腐蚀的本质是什么
 hfwiytg2022-10-04 11:39:543条回答
hfwiytg2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 xfdlhk 共回答了13个问题
xfdlhk 共回答了13个问题 |采纳率92.3%- 强酸都有夺氧性,会夺走有机物中的氧,使有机物被还原成碳
- 1年前
 70547165 共回答了34个问题
70547165 共回答了34个问题 |采纳率- 结晶状态的破坏
- 1年前
 lwg2381 共回答了4个问题
lwg2381 共回答了4个问题 |采纳率- 氧化还原反应
- 1年前
相关推荐
- 凝结水、给水系统主要有几种腐蚀形式?腐蚀部件各发生何处?
 冯何愁1年前1
冯何愁1年前1 -
 专打白狮子 共回答了15个问题
专打白狮子 共回答了15个问题 |采纳率93.3%溶解氧腐蚀:最容易发生的部位是给水管和省煤器.作为给水组成部分的补给水管道及疏水的贮存设备和输送管道都会发生氧腐蚀.二氧化碳腐蚀:最容易发生的部位为凝结水系统和疏水系统.1年前查看全部
- 铝合金7A09拿keller试剂腐蚀后出现一层黑色是什么
 稽山山下住1年前1
稽山山下住1年前1 -
 sxqlala 共回答了15个问题
sxqlala 共回答了15个问题 |采纳率100%首先 考虑是不是氧化铜,有些铝合金含铜,如果不是氧化铜,可能是非常细小的铝粉,一般非常细小的铝粉可能就像非常细小的银粉一样是黑色.1年前查看全部
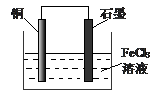
- (1)用FeCl 3 溶液腐蚀印刷电路铜板的化学方程式为:
(1)用FeCl 3 溶液腐蚀印刷电路铜板的化学方程式为: ;若将该反应设计成如图的原电池,请在图中完成标注。

(2)实验证明,能设计成原电池的反应通常是放热反应,现有下列反应:
①C(s)+H 2 O(g)=CO(g)+H 2 (g)△H>0;
②2H 2 (g)+O 2 (g)=2H 2 O(1) △H<0 ;
③NaOH(aq)+HC1(aq)=NaC1(aq)+H 2 O(1)△H<0 。
上述反应可以设计成原电池的是 (填序号),如若以KOH溶液为电解质溶液,依据所选反应设计的原电池其负极反应为 。 ll靈猎人1年前1
ll靈猎人1年前1 -
 第一次的问 共回答了20个问题
第一次的问 共回答了20个问题 |采纳率100%1年前查看全部
- 有A、B、C、D四块金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A和D分别投入等浓度盐酸中,D比A反应
有A、B、C、D四块金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A和D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是()
A.D >C >A >BB. D >A >B >C
C.D >B >A >CD.B >A >D >C tcpip70101年前1
tcpip70101年前1 -
 geeg 共回答了11个问题
geeg 共回答了11个问题 |采纳率81.8%B
1年前查看全部
- 下列说法中正确的是( )A.硫酸工业、合成氨工业、玻璃工业中都涉及氧化还原反应B.因氨水对许多金属有腐蚀作用,所以氨水
下列说法中正确的是( )
A.硫酸工业、合成氨工业、玻璃工业中都涉及氧化还原反应
B.因氨水对许多金属有腐蚀作用,所以氨水不能用金属容器盛装
C.一般合金的硬度比各成分金属要高,多数合金的熔点也比成分金属要高
D.在氧气参加的任何发光、发热的剧烈的化学反应才能称之为燃烧 韬武1年前1
韬武1年前1 -
 羔羊不迷途 共回答了20个问题
羔羊不迷途 共回答了20个问题 |采纳率90%解题思路:A.凡是有化合价升降的反应为氧化还原反应;
B.氨水腐蚀金属;
C.合金的硬度大熔点低;
D.燃烧是一种发光、发热的剧烈的化学反应.A.普通玻璃工业中不涉及氧化还原反应,故A错误;
B.氨能够与金属离子反应生成络合离子,从而腐蚀金属,故B正确;
C.合金的熔点比组成它的各成分的熔点都低,故C错误;
D.燃烧是一种发光、发热的剧烈的化学反应,不一定有氧气参与,故D错误.
故选B.点评:
本题考点: 金属与合金在性能上的主要差异;工业制取硫酸;工业合成氨;氨的化学性质.
考点点评: 本题考查氧化还原反应、金属腐蚀、合金和燃烧,题目难度不大,注意燃烧不一定有氧气参与.1年前查看全部
- 为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )
 为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是( )
A.正极的电极方程式为:O2+2H2O+4e-═4OH-
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快 亦优FISH1年前1
亦优FISH1年前1 -
 muroi 共回答了12个问题
muroi 共回答了12个问题 |采纳率100%解题思路:钢铁的吸氧腐蚀装置属于原电池,较活泼的金属是负极,较不活泼的金属或导电的非金属是正极,负极上失去电子发生氧化反应,正极上氧气得电子发生还原反应,水中加入电解质溶液会增大溶液的导电能力,从而促进铁的腐蚀,亚铁离子易被氧气氧化生成而促进铁锈的生成.A、钢铁的吸氧腐蚀中,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-═4OH-,故A正确;
B、将石墨换成镁,镁和铁构成的原电池中,镁作负极,容易失去电子被氧气,所以铁被保护而不易生锈,故B正确;
C、向自来水中加入少量氯化钠固体,溶液中自由移动离子增加,铁失电子能力增加,所以可以较快看到铁锈,故C正确;
D、钢铁的吸氧腐蚀中,铁失去电子生成亚铁离子,正极上氧气得电子生成氢氧根离子,溶液中亚铁离子向正极移动,亚铁离子和氢氧根离子反应生成氢氧化亚铁,所以向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得慢,故D错误.
故选D.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题以原电池原理为载体考查了金属的腐蚀与防护,注意酸性条件下,钢铁发生析氢腐蚀,中性或弱酸性条件下,钢铁发生吸氧腐蚀.1年前查看全部
- 硫酸在腐蚀作用中质量是否减轻?也就是说,再次反应中,硫酸充当催化剂呢?还是充当反应物呢?
 cherish19861年前2
cherish19861年前2 -
 zhangml 共回答了13个问题
zhangml 共回答了13个问题 |采纳率84.6%硫酸是作为反应物的,一般反应是因为硫酸的强酸性和强氧化性,1年前查看全部
- 盐酸腐蚀铝制品的化学方程式
 来世再爱你1年前1
来世再爱你1年前1 -
 cwjzcz 共回答了21个问题
cwjzcz 共回答了21个问题 |采纳率90.5%盐酸腐蚀过程分为两个部分
1)先与表面的氧化膜 (氧化铝)反应:Al2O3+6HCl=2AlCl3 +3H2O
2)后与内部的金属铝反应 :2Al+6HCl=22AlCl3 +3H21年前查看全部
- (2008•珠海一模)铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
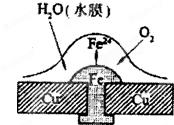 (2008•珠海一模)铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
(2008•珠海一模)铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
A.正极电极反应式为:2H++2e-→H2↑
B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜不被腐蚀
D.此过程中电子从Fe移向Cu yungaoqian1年前1
yungaoqian1年前1 -
 dcdbgsy 共回答了20个问题
dcdbgsy 共回答了20个问题 |采纳率80%解题思路:根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,原电池放电时,电子从负极流向正极.根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀.
A、正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故A错误;
B、负极上发生的电极反应式为:Fe-2e-=Fe2+,正极上的电极反应式为:O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故B正确;
C、该原电池中铜作正极,原电池放电时,负极失电子容易被腐蚀,正极被保护,所以铜不被腐蚀,故C正确;
D、该原电池放电时,外电路上电子从负极铁流向正极铜,故D正确;
故选A.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题以原电池原理为载体考查了金属的腐蚀,难度不大,明确钢铁发生析氢腐蚀和吸氧腐蚀的条件是解本题的关键,注意钢铁的吸氧腐蚀中还含有氢氧化亚铁生成氢氧化铁的反应.1年前查看全部
- 摩特 5.1 刹车油 腐蚀 橡胶
 huerladuoxx0001年前1
huerladuoxx0001年前1 -
 luloo_xue 共回答了19个问题
luloo_xue 共回答了19个问题 |采纳率78.9%你得知道刹车油的性质,刹车油的基础油一般分矿物油、合成油,矿物油配丁腈橡胶或氟橡胶密封件;合成油配三元乙丙橡胶密封件比较多,二者不能互换,不然对密封件损坏严重1年前查看全部
- 管道循环水处理的主要是什么成分是循环水的主要成分是什么,就是含什么离子,还有就是用浓水作循环水,会腐蚀管道嘛
 szmml1年前5
szmml1年前5 -
 apemendd 共回答了31个问题
apemendd 共回答了31个问题 |采纳率96.8%管道是指的热力管网的主管道吧,热力主管网用的药剂根据供热用的水质不同可分为耐高温的阻垢缓蚀剂和软化水缓蚀剂,主要起保护碳钢管道用的,普通的循环水药剂是不可以用的.而且热力主管网的阻垢缓蚀机理和普通循环水的完全是两码事.普通的药剂到80度后效果就不行了.1年前查看全部
- 70%硝酸对皮肤有腐蚀性吗,腐蚀到什么程度?
70%硝酸对皮肤有腐蚀性吗,腐蚀到什么程度?
30%的盐酸呢?30%的硫酸呢? gracefulni1年前4
gracefulni1年前4 -
 limi148 共回答了24个问题
limi148 共回答了24个问题 |采纳率95.8%是酸都有腐蚀性,70%HNO3绝对腐蚀皮肤,不过什么程度就不知道了,没人敢试.
30%HCL是算浓的了,所以也能伤害皮肤的
总而言之,上述所有都有腐蚀性,不用看了,随便哪个弄到都是烧伤1年前查看全部
- 非氧化性酸会不会腐蚀橡胶
 王洛衣1年前1
王洛衣1年前1 -
 小猪在hh 共回答了20个问题
小猪在hh 共回答了20个问题 |采纳率90%非氧化性酸不腐蚀橡胶1年前查看全部
- 碱性电解水和碱水有什么不同?PH值都是呈碱性为什么一个对人有腐蚀伤害,另一个却说没有.PH值是一样的呀
 了然无声1年前0
了然无声1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 我知道铜在空气中变成cu2(oh)2co3,那么铜棒和碳棒用导线连接放在氯化钠溶液中,就应该是吸氧腐蚀,要是把电解质溶液
我知道铜在空气中变成cu2(oh)2co3,那么铜棒和碳棒用导线连接放在氯化钠溶液中,就应该是吸氧腐蚀,要是把电解质溶液换成盐酸或氢氧化钠,那是什么腐蚀,两极电极反应式是啥,
我知道把电解质溶液换成盐酸或氢氧化钠,肯定还是吸氧腐蚀,因为要是析氢腐蚀,就是铜能和盐酸反应了。cu2(oh)2co3和盐酸反应是强酸制弱酸,但cu2(oh)2co3和氢氧化钠为什么不反应 coolma19841年前2
coolma19841年前2 -
 xqfed88gn18c6 共回答了20个问题
xqfed88gn18c6 共回答了20个问题 |采纳率90%答:是吸氧腐蚀.
正极反应:2(H2O)+O2+4e=4(OH-) (这好难表达化学式好,完全正确的写法写不出来)
负极反应:Cu+2(OH-)-2e=Cu(OH)2↓
假如Cu2(OH)2CO3能和NaOH反应,就会生成Cu(OH)2与Na2CO3
而Cu(OH)2在碱性环境下是沉淀的,它会在反应物表面形成一层阻碍反应进行的膜,只要反应还能进行,在能反应的地方膜就会加厚,直到膜把两反应物完全分开而停止反应.1年前查看全部
- 为什么钢铁在干燥的环境中不易腐蚀,在潮湿的环境中很容易腐蚀
 飞猫儿1年前2
飞猫儿1年前2 -
 不做木偶 共回答了13个问题
不做木偶 共回答了13个问题 |采纳率84.6%因为Fe只有在有O2和H2O的环境下才会腐蚀,如果只有O2,Fe是不会被腐蚀的,当然如果只有H2O,Fe也不会腐蚀.1年前查看全部
- 合金的化学性质和各组分金属相同吗,为什么.铝合金门能防氢氧化钠腐蚀?
 东耀1年前3
东耀1年前3 -
 梦中的阿尔卑 共回答了16个问题
梦中的阿尔卑 共回答了16个问题 |采纳率93.8%相同的,
不知一楼上哪找了些一元合金、二元合金什么的东东,
貌似没有看清楼主的问题...
一楼说的是物理性质,是的,合金的物理性质和各金属的物理性质差很多,
一般合金的熔点比各组分低,但硬度却更大,
但化学性质是不会改变的,
还记得吗,表现物质化学性质的最小颗粒是什么?是分子!
而合金的形成过程是不会破坏和改变各金属原有的原子结构的(这里就理解为金属构成为单原子分子),因此合金还具有原来各金属的化学性质.
至于楼主提出的实际问题,铝合金门能防氢氧化钠腐蚀,的确是这样,
但并不是说就不发生化学反应,楼主大概误以为没有化学反应了...
铝合金表面洒上氢氧化钠后用纸擦后应该会留下一层白色的东西,
并且很难去除,
这就是反应后的产物——氢氧化铝,附着性很强,
从而阻止腐蚀的进一步发生.
不过单从理论上讲,氢氧化铝也是可以溶于烧碱的,
只是在合金中,这种现象并不明显,
这要考虑铝合金中铝的含量还有反应环境,
毕竟不是在实验中的溶液里反映的,而只是滴上了少量低浓度的氢氧化钠,
总之是种种原因了,生活实例现象和严格的化学实验还是有一定差距的.1年前查看全部
- 氟化钠(牙膏中的)和牙齿中的矿物质反应是生成氢氧化钠吗、如果是、那氢氧化钠不会腐蚀口腔吗
 fjchengzy1年前1
fjchengzy1年前1 -
 杨晨100 共回答了15个问题
杨晨100 共回答了15个问题 |采纳率80%牙齿表面的釉质含Ca5(PO4)3(OH) Ca5(PO4)3(OH)+F-=Ca5(PO4)3F+OH- Ca5(PO4)3F比Ca5(PO4)3(OH)更难溶解和更硬,可以起到保护牙齿的作用.虽然会生成NaoH,但浓度很小.不会对口腔产生危害.况且我们漱口时,已经把那少量NaOH给洗掉了1年前查看全部
- 铁锈的生成过程主要是Fe—C原电池发生吸氧腐蚀的过程:
 失落上海1年前1
失落上海1年前1 -
 biaoge534 共回答了18个问题
biaoge534 共回答了18个问题 |采纳率77.8%钢材,生铁,熟铁都不是纯铁,是铁和碳的合金.在有水和空气的条件下,铁和碳形成原电池,铁充当负极,碳充当正极,吸收氧气,铁被氧化.原电池反应要比单纯的化学腐蚀快很多,所以铁锈的生成过程主要是Fe—C原电池发生吸氧腐蚀的过程.
负极 Fe-2e=Fe2+
正极 2H2O+O2+4e=4OH-1年前查看全部
- 硫酸能腐蚀橡胶么?为什么?
 ypp31年前1
ypp31年前1 -
 clppcb 共回答了22个问题
clppcb 共回答了22个问题 |采纳率95.5%浓硫酸能,因为浓硫酸具有强氧化性,而橡胶中有不饱和键,从而能和浓硫酸发生反应.1年前查看全部
- 铝腐蚀问题〔急〕用1060铝片在氢氧化钠中浸泡后放入0·5%的硫―盐酸混合水容液中60°浸泡两分钟◆拿出后表面出现不均匀
铝腐蚀问题〔急〕
用1060铝片在氢氧化钠中浸泡后放入0·5%的硫―盐酸混合水容液中60°浸泡两分钟◆拿出后表面出现不均匀的灰色孔点.请问如何让铝的腐蚀均匀.哪位老大教教我怎么做负极箔.我有硫酸.盐酸.硝酸.草酸.甘油.氢氧化钠. 沦落hhhh1年前1
沦落hhhh1年前1 -
 lxr000 共回答了16个问题
lxr000 共回答了16个问题 |采纳率81.3%最好不用盐酸,铝出现点蚀是因为盐酸中含有氯离子导致的1年前查看全部
- 钢铁的析氢腐蚀与吸氧腐蚀有哪些区别?3Q
 yaoyaoda1年前1
yaoyaoda1年前1 -
 黑马雷达 共回答了21个问题
黑马雷达 共回答了21个问题 |采纳率95.2%析氢腐蚀:要求水膜呈较强酸性,负极:Fe-2e-=Fe2+, 正极:2H++2e-=H2
吸氧腐蚀: 水膜呈极弱酸性、中性或碱性均可,负极:Fe-2e-=Fe2+, 正极:O2+2H2O+4e-=4OH-1年前查看全部
- 什麽化学液体抹在钢铁上可以使钢铁在几秒内变黑,且不会腐蚀成坑?
 穷人李富贵1年前2
穷人李富贵1年前2 -
 1987joecy 共回答了18个问题
1987joecy 共回答了18个问题 |采纳率83.3%浓硫酸有吨化作用,不知道是不是这个!1年前查看全部
- (2005•白山一模)用铝制饭盒盛放醋,一段时间后饭盒被腐蚀,该腐蚀属______腐蚀,相应的化学反应式为______;
(2005•白山一模)用铝制饭盒盛放醋,一段时间后饭盒被腐蚀,该腐蚀属______腐蚀,相应的化学反应式为______;
如盛放纯碱溶液而被腐蚀,有关离子反应式为______;
如盛放食盐(含少量MgCl2杂质)一段时间后变潮湿原因的是______,而且饭盒也会被腐蚀,发生______腐蚀,有关电极反应式______,______. nlink1年前1
nlink1年前1 -
 xinyi 共回答了22个问题
xinyi 共回答了22个问题 |采纳率100%解题思路:金属铝能和酸之间发生反应生成可溶性的铝盐和氢气,纯碱碳酸钠溶液水解显碱性,金属铝可以和碱之间发生反应生成偏铝酸盐和氢气,在中性环境下,金属铝发生吸氧腐蚀,在酸性环境下,金属铝发生析氢腐蚀,据此来回答.用铝制饭盒盛放醋,一段时间后饭盒被腐蚀,因为金属铝和醋酸之间发生2Al+6CH3COOH═2(CH3COOH)3Al+3H2↑,该腐蚀属于金属的化学腐蚀,
如果盛放纯碱溶液,由于碳酸钠水解而显碱性,金属铝可以和碱之间反应生成偏铝酸钠和氢气而被腐蚀,CO32-+H2O⇌HCO3-+OH-,2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑,氯化镁易吸水,导致氯化钠潮解,在中性环境下,金属铝会发生吸氧腐蚀,负极上是金属铝发生失电子的氧化反应,Al-3e-═Al3+,正极上是氧气发生得电子的还原反应,O2+2H2O+4e-═4OH-,
故答案为:化学;2Al+6CH3COOH═2(CH3COOH)3Al+3H2↑;CO32-+H2O⇌HCO3-+OH-,2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑;氯化镁具有较强的吸水性;吸氧;Al-3e-═Al3+;O2+2H2O+4e-═4OH-.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题考查学生金属铝的腐蚀情况知识,在中性环境下,金属发生析氢腐蚀,在碱性环境下,金属发生吸氧腐蚀.1年前查看全部
- 要推导均匀腐蚀条件下电流密度时间关系
要推导均匀腐蚀条件下电流密度时间关系
谁知道点,给个思路,帮朋友问的,急,分好说

 prayyou1年前1
prayyou1年前1 -
 送479个拥抱 共回答了30个问题
送479个拥抱 共回答了30个问题 |采纳率83.3%你的问题可以说的再清楚一点吗?看起来不是很明白.我理解的你是想弄清楚均匀腐蚀条件下以厚度表示的腐蚀速率(或者以mm/a、mpy)与腐蚀电流密度之间的换算关系.如果是这样的话我可以给你个解释.如果想知道电流密度与时间之间的关系,那就不好办了,因为腐蚀电流密度是衡量金属腐蚀的参数,与时间没有直接关系.
关于mm/a与腐蚀电流密度之间关系推导如下:
实验室中还常用腐蚀电流密度icorr(A*cm^-2)来表示腐蚀速度,它与v的换算关系为:
icorr={[v/(A/n)]*26.8/10^4}=v*(A/n)*1/373
其中,A为原子量;
v:以mm/a表征的腐蚀速率
n为离子电荷;
通常对于碳钢来说(假设密度为7.8,失2个电子,以Fe为主),
1mm/a≈85.232mA/cm^2
详细见图片推导过程:
希望我的回答对你能有帮助.我们可以继续讨论.
 1年前查看全部
1年前查看全部
- 能不能用冰醋酸腐蚀乐扣杯子的PP材质?
能不能用冰醋酸腐蚀乐扣杯子的PP材质?
如题,另外请问,如果杯子中倒入稀释后的冰醋酸,再倒入食用油,可以阻止它挥发吗? 笑影笑哈哈1年前1
笑影笑哈哈1年前1 -
 wjf7811 共回答了16个问题
wjf7811 共回答了16个问题 |采纳率87.5%PP材质耐化学腐蚀性较好,冰醋酸不会腐蚀PP材质;
食用油可以浮于上层,短时间内是可以阻止醋酸的挥发的.1年前查看全部
- 氢氟酸(HF)对玻璃有腐蚀作用,可用在玻璃上雕刻各种精美图案,也可用在玻璃仪器上标注刻度及文字.氢氟酸与玻璃发生的反应可
氢氟酸(HF)对玻璃有腐蚀作用,可用在玻璃上雕刻各种精美图案,也可用在玻璃仪器上标注刻度及文字.氢氟酸与玻璃发生的反应可以表示为:SiO2+4HF═X↑+2H2O,下列说法正确的是( )
A.该反应为置换反应
B.反应前后原子总数发生变化
C.X中一定含有硅元素、氟元素
D.硅是地壳中含量最高的元素 KGQ66961年前1
KGQ66961年前1 -
 slfslf8630 共回答了19个问题
slfslf8630 共回答了19个问题 |采纳率94.7%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式;氧化物是只含有两种元素且其中一种元素是氧元素的化合物;据此进行分析判断.根据反应的化学方程式SiO2+4HF=X↑+2H2O,反应物中硅、氧、氢、氟原子个数分别为1、2、4、4,反应后的生成物中硅、氧、氢、氟原子个数分别为0、2、4、0,根据反应前后原子种类、数目不变,则每个X分子由1个硅原子和4个氟原子构成,则物质X的化学式为SiF4.
A、置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,故选项说法错误.
B、根据质量守恒定律可知,反应前后原子总数不会发生变化,故选项错误.
C、物质X的化学式为SiF4,一定含有硅元素、氟元素,故选项说法正确.
D、地壳中含量最高的元素为氧元素,故选项说法错误.
故选:C.点评:
本题考点: 质量守恒定律及其应用;地壳中元素的分布与含量;置换反应及其应用.
考点点评: 本题难度不大,利用化学反应前后原子守恒来确定物质的化学式的方法是正确解题的关键.1年前查看全部
- 钢铁腐蚀 不是会生成FE(OH)3 那么腐蚀不是会停止么
 烹燃心动1年前1
烹燃心动1年前1 -
 zhenkeheni 共回答了8个问题
zhenkeheni 共回答了8个问题 |采纳率75%因为FE(OH)3是粉末状,铁总是有机会和氧气接触的,直到被完全腐蚀,它和氧化铝是不一样的,氧化铝是致密的氧化物保护膜1年前查看全部
- 用化学方程式解释其原理.1.为什么工业上利用氯化铁溶液腐蚀铜制印刷线路板.2.为什么在硫酸铁溶液中常常加入铁粉或铁钉.3
用化学方程式解释其原理.1.为什么工业上利用氯化铁溶液腐蚀铜制印刷线路板.2.为什么在硫酸铁溶液中常常加入铁粉或铁钉.3.工业制漂白粉的反应原理.4.钠与水反应原理.
 木瓜猪1年前1
木瓜猪1年前1 -
 爱上林妹妹 共回答了14个问题
爱上林妹妹 共回答了14个问题 |采纳率100%1, 2FeCl3+Cu=CuCl2+2FeCl2
2, 应该是在硫酸铁溶液中常常加入铁粉或铁钉.
Fe2(SO4)3+Fe=3FeSO4
3, 2Ca(OH)2+Cl2=2Ca(ClO)2+CaCl2+2H2O
4,2Na+2H2O=2NaOH+H2(气体)1年前查看全部
- 下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,完成(1)(2)两题。 (
下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,完成(1)(2)两题。 
(1)下列叙述正确的是 [ ]A.装置I在反应过程中自始至终只生成红棕色气体
B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀
C.装置Ⅱ在反应过程中能产生氢气
D.装置I在反应结束时溶液中的金属阳离子只有Cu 2+(2)下列与反应原理相关的叙述不正确的是 [ ]A.装置I中不可能发生如下反应:Fe+2Fe 3+ =3Fe 2+
B.装置Ⅱ在反应结束时溶液中存在Fe 2+
C.装置工的溶液若换为稀硝酸,则腐蚀过程与原装置不同
D.装置Ⅱ中的铁丝能发生电化学腐蚀 八步天龙20061年前1
八步天龙20061年前1 -
 hkPaul 共回答了16个问题
hkPaul 共回答了16个问题 |采纳率100%(1)C
(2)A1年前查看全部
- 不锈钢与锌接触腐蚀不锈钢与镀锌件接触置于空气中,是否存在阳极氧化,谁先被腐蚀?说明原因不懂的或初中文化水平的不要乱说
 枫叶_飘泪1年前2
枫叶_飘泪1年前2 -
 afmarrage 共回答了22个问题
afmarrage 共回答了22个问题 |采纳率90.9%不锈钢已经不是铁单质了.他的成分已经变了.所以楼上说的不对1年前查看全部
- 为什么金属在弱酸中就是化学腐蚀(如Al在醋酸中),而在强酸中就是电化学腐蚀?
为什么金属在弱酸中就是化学腐蚀(如Al在醋酸中),而在强酸中就是电化学腐蚀?
书上说在强酸里面是析氢反映 licanwei1年前4
licanwei1年前4 -
 qyg123 共回答了21个问题
qyg123 共回答了21个问题 |采纳率90.5%不是这样吧
都是化学腐蚀
在盐里一般是电化学
析氢只是说有氢气放出,化学和电化学腐蚀都可以有,吸氧是电化学专有的1年前查看全部
- 为什么铝制品很抗腐蚀
 hlpt20071年前5
hlpt20071年前5 -
 mumeikitty 共回答了14个问题
mumeikitty 共回答了14个问题 |采纳率92.9%因为铝的表面很容易和氧反应,生成致密的氧化膜,阻止了反应的进一步发生
保护了剩下了铝
因此铝制品很抗腐蚀1年前查看全部
- 小红同学为研究金属腐蚀的条件,用细尼龙线将三根大小相同的铁钉分别固定在如图所示的三个液面高度相同的相同装置中,放置一星期
小红同学为研究金属腐蚀的条件,用细尼龙线将三根大小相同的铁钉分别固定在如图所示的三个液面高度相同的相同装置中,放置一星期后观察现象。下列描述错误的是

A.装置Ⅰ的铁钉一侧的液面一定会上升 B.装置Ⅰ、Ⅱ中的铁钉都被腐蚀 C.装置Ⅲ中的铁钉几乎没被腐蚀 D.左边液面,装置Ⅱ比装置I的高  郁秋华1年前1
郁秋华1年前1 -
 yanzhi1982 共回答了23个问题
yanzhi1982 共回答了23个问题 |采纳率95.7%D
A、铁钉生锈能够耗氧气,从而使得气体的压强小于外界大气压,而使液面上升,故A描述正确;
B、在I和II中铁钉都与水和氧气接触,并且酸溶液能够加快铁的生锈速率,故B描述正确;
C、因为浓硫酸能够吸收水蒸气,使得铁不能与水充分接触,不容易生锈,故C描述正确;
D、考虑到浓盐酸挥发出来的氯化氢气体使得压强增大,所以比较铁钉这一侧的液面,装置Ⅱ比装置I的低,故D描述不正确.1年前查看全部
- 在钢铁腐蚀的过程中,下列可能发生的是
在钢铁腐蚀的过程中,下列可能发生的是
1.Fe2+转变为Fe3+
2.氧气被还原
3.产生氢气
4.Fe转变为Fe2+
5.Fe(OH)3失去水形成Fe2O3.H2O 月乌鸦1年前2
月乌鸦1年前2 -
 悠悠小番茄 共回答了22个问题
悠悠小番茄 共回答了22个问题 |采纳率86.4%1,FE(OH)2和水,氧气反映生成FE(OH)3
3,酸雨会与FE反应放出氢气,同时生成
Fe2+
41年前查看全部
- 怎么判断化学腐蚀还是电化学腐蚀
 jayjwcqt1年前2
jayjwcqt1年前2 -
 ss阳光 共回答了20个问题
ss阳光 共回答了20个问题 |采纳率90%根据腐蚀的作用原理,可分为化学腐蚀和电化学腐蚀.两者的区别是当电化学腐蚀发生时,金属表面存在隔离的阴极与阳极,有微小的电流存在于两极之间,单纯的化学腐蚀则不形成微电池.过去认为,高温气体腐蚀(如高温氧化)属于化学腐蚀,但近代概念指出在高温腐蚀中也存在隔离的阳极和阴极区,也有电子和离子的流动.据此,出现了另一种分类:干腐蚀和湿腐蚀.湿腐蚀是指金属在水溶液中的腐蚀,是典型的电化学腐蚀,干腐蚀则是指在干气体(通常是在高温)或非水溶液中的腐蚀.单纯的物理腐蚀,对于金属很少见,对于非金属,则多半产生单纯的化学或物理腐蚀,有时两种作用同时发生.
简单点说就是
电化学腐蚀之形成原电池的化学反应对金属等造成的腐蚀,而化学腐蚀则指直接反应造成的腐蚀1年前查看全部
- 有关电化学原理的推断正确的是 A.金属腐蚀就是金属原子失去电子被还原的过程 B.钢铁吸氧腐蚀时,负极反应式为:2H 2
有关电化学原理的推断正确的是
A.金属腐蚀就是金属原子失去电子被还原的过程 B.钢铁吸氧腐蚀时,负极反应式为:2H 2 O+O 2 +4e→4OH - C.氯碱工业中,阳极发生的反应为:2Cl - –2e→Cl 2 ↑ D.镀锌铁皮的镀层损坏后,铁更容易腐蚀  jimoivy1年前1
jimoivy1年前1 -
 明天就是艳阳天 共回答了30个问题
明天就是艳阳天 共回答了30个问题 |采纳率76.7%C
1年前查看全部
- 用铁桶装下列盐溶液,铁桶会被腐蚀 A 氯化锌溶液 B 硫酸铜溶液C 硫酸钠 D硝酸镁
 gracezhq1年前2
gracezhq1年前2 -
 tk007515 共回答了24个问题
tk007515 共回答了24个问题 |采纳率87.5%选B,B会发生反应Fe+CuSO4=FeSO4+Cu
ACD都不会与Fe反应.1年前查看全部
- 浓盐酸能腐蚀铁,不锈钢等金属吗?
 kevin22171年前1
kevin22171年前1 -
 流浪归家 共回答了29个问题
流浪归家 共回答了29个问题 |采纳率89.7%三氯化铁盐酸溶液就能进一步的腐蚀不锈钢了1年前查看全部
- (2005•桂林)(1)文物工作者发现,近二十年来,桂林的许多大理石石刻、雕塑等古迹的腐蚀程度加快.导致这些古文物腐蚀程
(2005•桂林)(1)文物工作者发现,近二十年来,桂林的许多大理石石刻、雕塑等古迹的腐蚀程度加快.导致这些古文物腐蚀程度加快的主要原因是______,为了减缓腐蚀,我们在日常生活和工业生产中可采取的措施(答出一各即可)______.
(2)用石灰石作原料可以实现下列转化:CaCO3→CaO→Ca(OH)2→NaOH,此转化过程所涉及的化学基本反应类型有______、______、______. bios7x1年前1
bios7x1年前1 -
 我是老威 共回答了14个问题
我是老威 共回答了14个问题 |采纳率78.6%解题思路:跟怒题干叙述结合物质的性质进行分析,化石燃料的使用,增加了空气中二氧化硫和氮氧化物的含量,易形成酸雨,能腐蚀大理石雕像,根据物质的转化即可得出反应的类型.(1)大理石雕塑腐蚀速度加快是因为受到了酸雨的腐蚀,减缓腐蚀就是减少空气中二氧化硫和氮氧化物的排放,可以减少化石燃料的使用或开发新能源等,故填:酸雨的腐蚀,减少或降低酸性气体的排放;
(2)碳酸钙高温能分解生成氧化钙,CaCO3
高温
.
CaO+CO2↑,属于分解反应,
氧化钙能与水化合生成氢氧化钙,CaO+H2O═Ca(OH)2,属于化合反应,,属于复分解反应,
故填:分解反应,化合反应,复分解反应.点评:
本题考点: 酸雨的产生、危害及防治;反应类型的判定.
考点点评: 本题考查了化学与环境的知识以及有关反应类型的判断,完成此题,可以依据已有的知识进行.1年前查看全部
- 铁碳合金看微观组织用什么腐蚀液腐蚀?
铁碳合金看微观组织用什么腐蚀液腐蚀?
Fe-1%C和Fe-%2.5C 游泳的小鱼儿991年前1
游泳的小鱼儿991年前1 -
 同生缘800920 共回答了15个问题
同生缘800920 共回答了15个问题 |采纳率93.3%浓硝酸或者浓硫酸1年前查看全部
- (9分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别
(9分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、 B的体积相同.已知:2NO2(g)N2O4(g) △H<0.
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A)___V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将_____(填“变大”、“变小”或“不变”,下同).
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将____;若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_______,B中NO2的转化率将_______.
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_______中的颜色较深.
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为________.

 sylas1年前3
sylas1年前3 -
 ab0932 共回答了32个问题
ab0932 共回答了32个问题 |采纳率87.5%(1)第二个小空、由于存在可逆反应2NO2(g)==N2O4(g),随反应进行B气体减少,体积减小,A气体减少,但体积不变,则A中压强1年前查看全部
- 这是什么石头能用naoh腐蚀吗还是用别的
 ttisno11年前1
ttisno11年前1 -
 heyann 共回答了19个问题
heyann 共回答了19个问题 |采纳率94.7%这石头成份是二氧化硅吧.只能用氢氟酸,没有别的办法!1年前查看全部
- 化学 金属的腐蚀和防护1,汽车,2,机器齿轮,3,门把手,4,锯条,5,铁洗脸盆,6,铁柜,7,铁轴,8,剪刀, 在这些
化学 金属的腐蚀和防护
1,汽车,2,机器齿轮,3,门把手,4,锯条,5,铁洗脸盆,6,铁柜,7,铁轴,8,剪刀, 在这些选项中, 在其表面刷一层油漆的是_____ 在表面涂上机油的是_____.在表面镀上其他金属的是_____,在表面烧制塘瓷的是______,是表面氧化成至密的氧化膜的是______ 老rr1年前3
老rr1年前3 -
 满陌千里红 共回答了20个问题
满陌千里红 共回答了20个问题 |采纳率90%1,汽车,2,机器齿轮,3,门把手,4,锯条,5,铁洗脸盆,6,铁柜,7,铁轴,8,剪刀,
在这些选项中, 在其表面刷一层油漆的是1.汽车 6.铁柜在表面涂上机油的是2机器齿轮.在表面镀上其他金属的是1.铁轴3.门把手4.剪刀,在表面烧制塘瓷的是5.铁洗脸盆,是表面氧化成至密的氧化膜的是4.锯条1年前查看全部
- 氢氧化钠能不能腐蚀托盘?托盘什么东西做的?看到很多答案都说能腐蚀托盘,原理是什么呢?
 宇宙仁1年前3
宇宙仁1年前3 -
 张秋水 共回答了17个问题
张秋水 共回答了17个问题 |采纳率100%烧碱能腐蚀托盘,托盘是塑料制品,易受到酸性或碱性物质的腐蚀,具体原因高中范围内不要求掌握.
中学课本上有关于氢氧化钠的称量方法:放在烧杯或表面皿等玻璃制品内称量,不能放在纸片上称量,因为氢氧化钠会潮解,形成氢氧化钠溶液,从而腐蚀托盘1年前查看全部
- 用fecl3溶液腐蚀印刷电路板有用的是哪一部分
用fecl3溶液腐蚀印刷电路板有用的是哪一部分
是那一条条划出来的线,还是没划出来的部分啊? 蚊-香1年前2
蚊-香1年前2 -
 sonnetxue 共回答了15个问题
sonnetxue 共回答了15个问题 |采纳率93.3%大约猜出了你的意思,你是说用三氯化铁制做PCB板时,哪部分不会被腐蚀掉是吗?是你用磁漆画出的线,会保留下来,然后你用砂纸或脱漆剂去除磁漆就可了.
另外你以看看热转印制板法和,光敏胶制板法.1年前查看全部
- 日常,电化学腐蚀和化学腐蚀哪种最常见?
 swing32371年前6
swing32371年前6 -
 200310211 共回答了16个问题
200310211 共回答了16个问题 |采纳率93.8%电化学腐蚀更常见,日常金属材料都是合金,而且潮湿环境也很易使金属腐蚀1年前查看全部
- 坩埚钳易不易被强碱腐蚀?易被热的强碱腐蚀( )
坩埚钳易不易被强碱腐蚀?易被热的强碱腐蚀( )
还有坩埚的主要用途及使用的注意事项 wyy8209281年前2
wyy8209281年前2 -
 好脾气不是没脾气 共回答了20个问题
好脾气不是没脾气 共回答了20个问题 |采纳率100%对
坩埚耐热耐酸,但是不能用于熔融碱的加热,因为坩埚中有SiO2等氧化物高温时与熔融碱反应
加热固体 分解或除水等1年前查看全部
- 请设计碳钢在自来水、除盐水中的腐蚀和防护综合实验 (碳钢+除盐水-低温停保、闭冷水系统腐蚀与防护)
请设计碳钢在自来水、除盐水中的腐蚀和防护综合实验 (碳钢+除盐水-低温停保、闭冷水系统腐蚀与防护)
请设计碳钢在自来水、除盐水中的腐蚀和防护综合实验
采用除氧法,一组不除氧,一组完全除氧,三组不同氧浓度,需要写出具体的实验仪器,如果分不够可以再加100分.
分已经最高了,就麻烦各位了,各位能帮忙找到一些有用的资料,我也会给分的 蓝天and大海1年前1
蓝天and大海1年前1 -
 朴纯灵心 共回答了18个问题
朴纯灵心 共回答了18个问题 |采纳率94.4%采用除氧法,一组不除氧,一组完全除氧,三组不同氧浓度,需要写出具体的实验仪器,详细的实验步骤,1年前查看全部
大家在问
- 1英语翻译我收到了你上周的来信,谢谢你寄的照片,我常常想起我们一起度过的时光,你还记得那个湖吗?我们还在那照过一张像呢.和
- 2为了使教室内的学生上课免受周围环境噪声干扰,采取下面哪个方法是有效、合理的 [
- 3(大学分析化学)用银量法测定下列试样(1)氯化钡 (2)氯化钾 (3)氯化氨(4)KSCN
- 4读下面一段文字,按要求答题。 人类的作品飞上了太空,打开了一个个微观的世界,于是人类 沾沾自喜 ,以为揭开了大自然的秘
- 5如何写英语作文中的主题句
- 6关尹子为什么不直截了当地把射中靶子的道理告诉列子?
- 7某烃 (29 19:32:51)
- 8不等式(x^2-1)(x^2-6x+8)>=0的解集是
- 9从中午12时到下午第一节课下课所经过的时间是下午第一节课下课到午夜12时所经过时间的1/3,请算出下午第一节课的时间.(
- 10三亚的年平均气温是多少?几月份最热?几月份最冷?
- 11有两个正方形,它们的周长相差12厘米,面积相差39平方厘米,其中小正方形的面积是都少?
- 12已知点A(1,2) 点B(3,2),则线段AB的垂直平分线的方程为?
- 13指出下列各题中的两项是不是同类项,不是同类项的请说出原因.
- 14王大妈要买一台电视机和两台电风扇,电视机每台2100,电风扇每台195.
- 15会的来,并说明解题思路1.重500N的王丽同学匀速向上爬杆时,杆对手的摩擦力是(),方向().2.质量为50kg的跳伞运