碘量法测溶解氧的困惑?在溶解氧的测定实验中,加入MnSO4和碱性KI后,如果有棕色沉淀,为什么要待沉淀降至瓶的一半深度时
 fxw1182022-10-04 11:39:544条回答
fxw1182022-10-04 11:39:544条回答
碘量法测溶解氧的困惑?
在溶解氧的测定实验中,加入MnSO4和碱性KI后,如果有棕色沉淀,为什么要待沉淀降至瓶的一半深度时,才加浓硫酸溶液?
在溶解氧的测定实验中,加入MnSO4和碱性KI后,如果有棕色沉淀,为什么要待沉淀降至瓶的一半深度时,才加浓硫酸溶液?

已提交,审核后显示!提交回复
共4条回复
 gybjcn 共回答了27个问题
gybjcn 共回答了27个问题 |采纳率85.2%- 应该是加入试剂之后,将碘量瓶反复摇动数次,静置,当沉淀物降至瓶高一半时,再颠倒摇动一次.继续静置,带沉淀物下降至瓶底后,轻启瓶塞,加入浓硫酸,盖好瓶塞,颠倒摇匀,若沉淀溶解不完全,则继续加入少量浓硫酸至溶液澄清且呈黄色或棕色,至于暗处5min.
- 1年前
 宸宸前程似锦 共回答了87个问题
宸宸前程似锦 共回答了87个问题 |采纳率- 应该是盖好瓶塞后待沉淀至一半深时,再颠倒一次,这时再使沉淀到瓶底,然后测定
目的是使沉淀完全 - 1年前
 婉秋02 共回答了12个问题
婉秋02 共回答了12个问题 |采纳率91.7%- 你猜
- 1年前
 phyning 共回答了6个问题
phyning 共回答了6个问题 |采纳率- 应该是加入试剂之后,将碘量瓶反复摇动数次,静置,当沉淀物降至瓶高一半时,再颠倒摇动一次。继续静置,带沉淀物下降至瓶底后,轻启瓶塞,加入浓硫酸,盖好瓶塞,颠倒摇匀,若沉淀溶解不完全,则继续加入少量浓硫酸至溶液澄清且呈黄色或棕色,至于暗处5min。
LZ应该是理解错了,不是降至一半加酸,而是降至一半继续颠倒摇匀,然后静置到完全沉降再加酸。
这样做的好处是使沉淀完全(用KI来固定DO,如... - 1年前
相关推荐
- 碘量法中,硫代硫酸钠溶液为何要标定
 yiyi991年前3
yiyi991年前3 -
 254141068 共回答了16个问题
254141068 共回答了16个问题 |采纳率87.5%碘量法中,使用的硫代硫酸钠标准溶液的浓度必须是已知的、准确可靠的,对它进行标定就是为了准确地测量其标准浓度值,
硫代硫酸钠是一种常见的还原剂,在空气中易受氧气氧化,且易受细菌的浸扰,所以无法通过直接称重配制准确浓度的标准溶液,需要在配制后,再对其浓度进行准确的标定以确定其准确可靠的浓度值1年前查看全部
- 用碘量法测定青霉素类药物的原理,需要做空白试验吗?如何做空白试验?
 薯Potato囝1年前1
薯Potato囝1年前1 -
 cuibuy 共回答了20个问题
cuibuy 共回答了20个问题 |采纳率100%是间接碘量法.青霉素类将碘滴定液部分还原成碘离子,再用硫代硫酸钠滴定至终点,需要空白.假设称取青霉素1g,加入0.1mol/L碘滴定液20mL.则空白试验为0.1mol/L碘滴定液20mL,用硫代硫酸钠滴定至终点,记录消耗体积1年前查看全部
- 怎么鉴别三氯异氰尿酸和次氯酸钙三氯异氰尿酸片里面有三氯,也有次氯酸钙,含量检测都是碘量法,我怎么知道这个氯的含量有多少是
怎么鉴别三氯异氰尿酸和次氯酸钙
三氯异氰尿酸片里面有三氯,也有次氯酸钙,含量检测都是碘量法,我怎么知道这个氯的含量有多少是三氯有多少事次氯酸钙,请高手支招·····感激·! mmmvfblp1年前1
mmmvfblp1年前1 -
 ramondl 共回答了18个问题
ramondl 共回答了18个问题 |采纳率83.3%您好,我们是次氯酸钙的工厂.次氯酸钙纳发生产最高含量只能是70%左右.而三氯异氰尿酸通常是90%左右.如果两种混到一起打片,那么有效氯含量肯定受到影响.如果您检测的有效氯含量为90%以上,那说明没有掺入次氯酸钙.如果您检测有效氯低于90%很多,即便是没有次氯酸钙也有其他产品加入.
在这里我要提醒的是,次氯酸钙是非常活泼的强氧化剂,需要远离酸碱等易燃易爆产品.如果把次氯酸钙掺入三氯中降低成本,是非常危险的事情.
希望我的回答对您有帮助.运输次氯酸钙一定要多注意!1年前查看全部
- 碘量法测定铜含量时,为什么需要KSCN溶液? 可否用NH4SCN代替KSCN溶液?
 dwhzw5211年前2
dwhzw5211年前2 -
 kuaihuolin1120 共回答了20个问题
kuaihuolin1120 共回答了20个问题 |采纳率95%近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,释放出被CuI吸附的I2,可以有效地避免结果偏低
应该不可以的 我感觉NH4+对PH有影响 滴定反应对PH要求很严格的1年前查看全部
- 氧化还原滴定的终点可用哪几类指示剂确定?对于碘量法中的淀粉指示剂使用时应注意哪些问题?
 第凡内早餐1年前2
第凡内早餐1年前2 -
 Roger_Jo 共回答了16个问题
Roger_Jo 共回答了16个问题 |采纳率100%碘量法是经典方法,许多化验手册上都有介绍.注意淀粉的加入不要过早,否则会吸附碘离子.滴定过程不能太慢,碘离子易被空气中的氧气氧化.1年前查看全部
- 用间接碘量法测胆矾中铜的含量时加入碘化钾有哪些作用
 二无将1年前2
二无将1年前2 -
 m8a03zc 共回答了18个问题
m8a03zc 共回答了18个问题 |采纳率100%可加快反应速率;
I-与I2形成I3-,增加了I2的溶解度,防止I2的挥发.1年前查看全部
- 为什么维生素C含量可以用碘量法测定?
 heiyahu1年前1
heiyahu1年前1 -
 冬儿67 共回答了22个问题
冬儿67 共回答了22个问题 |采纳率90.9%维生素c具有还原性,
碘有氧化性
用碘氧化维生素c
通过碘的用量可以知道维生素的含量1年前查看全部
- 关于一道大学无机及分析化学的题某年级学生用碘量法测定某铜合金中铜的质量分数,得到120个分析结果基本符合正态分布N(59
关于一道大学无机及分析化学的题
某年级学生用碘量法测定某铜合金中铜的质量分数,得到120个分析结果基本符合正态分布N(59.11,0.36)。求分析结果出现在区间(58.39,59.70)内的概率。求大神解答啊,刚开始学有点不明白
 shiyu19971年前1
shiyu19971年前1 -
 丽江女儿 共回答了15个问题
丽江女儿 共回答了15个问题 |采纳率73.3%总体平均值是59.11,总体标准偏差是0.36,然后根据边界值求u,再据u值去查概率积分表即可。1年前查看全部
- 求碘量法测双氧水浓度具体操作步骤?3Q
求碘量法测双氧水浓度具体操作步骤?3Q
碘量法测双氧水浓度具体操作步骤 试验急需用,最好是电子版的,不要太简单的.尽量详细的那种, jjz871年前1
jjz871年前1 -
 一缕秋天 共回答了16个问题
一缕秋天 共回答了16个问题 |采纳率75%参见2.2.2节:碘量法高锰酸钾法、碘量法和铈量法测定过氧化氢的比较 http://www.***.com/p-54767040.html 研究了用碘量滴定法测定过氧化氢浓度时,试剂的加入顺序和放置时间对测定结果的影响.结果表明,在用碘量滴定法测定过氧化氢浓度的过程中,酸化条件下,I-与H2O2反应的最佳时间为5~10min.与高锰酸钾氧化法相比,碘量法测定效果较好一些.来源:碘量滴定法测定过氧化氢溶液浓度的改进 http://d.wanfangdata.c ... 00307010.aspx 查看原帖1年前查看全部
- 直接碘量法反应只能在中性或什么性溶液中进行
 鸟托邦1年前1
鸟托邦1年前1 -
 景德镇 共回答了18个问题
景德镇 共回答了18个问题 |采纳率83.3%直接碘量法只能在酸性、中性或弱碱性溶液中进行,如果溶液pH>9,可发生副反应使测定结果不准确.1年前查看全部
- 简述剩余碘量法测定青霉素类药物的基本原理.反应的摩尔比是多少
 雎无瑕1年前1
雎无瑕1年前1 -
 回忆中的伤痛 共回答了15个问题
回忆中的伤痛 共回答了15个问题 |采纳率100%青霉素在碱性条件下水解产生的青霉噻唑酸能够与碘作用,根据消耗的碘量可以算出青霉素的含量.一般认为pH6左右的磷酸盐缓冲液溶解样品为好,而碘与青霉素作用时以pH4.5左右最好.
样品的测定过量的碘液用(0.01mol/L)Na2S2O3滴定得VS;空白试验过量的碘液用(0.01mol/L)Na2S2O3滴定得V0;
1摩尔青霉素消耗8摩尔碘.但碘的实际消耗量为8.02摩尔碘;青霉素钠分子量为356.36,则每1ml碘(0.1mol/L)与0.4443mg青霉素钠相当.1mg青霉素钠约等于1670青霉素单位,则每1ml碘(0.1mol/L)与742青霉素单位相当.
0.01mol/L×1ml=W/(356.36/8.02) W=0.4443mg
1mg样品中含青霉素的单位数=D(VS - V0)FT/S(mg)
式中:D为稀释倍数100/5;F为滴定液浓度校正系数;T为滴定度(742青霉素单位);S为供试品称重量.1年前查看全部
- 碘量法测铜的含量时为什么在近终点时才能加淀粉
 幼狮hh1年前1
幼狮hh1年前1 -
 淡品月光 共回答了21个问题
淡品月光 共回答了21个问题 |采纳率90.5%当I2浓度较高时,会与淀粉结合成比较稳定的加合物,难以分解,影响滴定的进行.1年前查看全部
- 碘量法滴定中,用硫代硫酸钠和溶液中的碘单质反应,为什么一开始会出现淡黄色?
 古道流云1年前2
古道流云1年前2 -
 21天ss中 共回答了16个问题
21天ss中 共回答了16个问题 |采纳率81.3%碘量法是利用I2的氧化性和I - 的还原性来进行滴定的方法.固体I2 在水中的溶解度很小(0.001 33 mol/ L) ,故通常将I2 溶解在KI 溶液中,此时I2 在溶液中以I3- 形式存在.
I2 属于较弱的氧化剂,能与许多电位较低的还原剂作用,发生氧化还原反应.硫化物测定中(S + 2H+ + 2e →H2S ,E0 = 0.141 V) ,S2 - 的电极电位明显低于I2 ,反应可以进行.
在酸性条件下,I2 能氧化S2 - (H2S + I2 →S +2I - + 2H+ ) ,剩余的I -3 则用Na2S2O3 滴定,间接求出硫化物的含量.
采用碘量法测定硫化物时,诸多干扰因素及测定过程中各种人为因素的影响都可造成不同的系统误差,为了获得准确的结果必须注意以下几点.
1 必须控制溶液的酸度
反应必须控制在弱酸性条件下进行(pH 5.7.0) .不能在碱性溶液中进行,否则部分S2 -可被氧化为SO42 - ,且I2 也会发生歧化反应.而S2O32 - 在碱性溶液中与I2 发生副反应(S2O32 - +4I2 + 10OH- →2SO42 - + 8I - + 5H2O) ;在强酸性溶液中,Na2S2O3 溶液会发生分解(S2O32 - + 2H+→SO2 + S + H2O) .这些均可给主反应( I2 +2S2O32 - →2I - + S4O62 - ) 造成一定的误差,所以控制溶液的酸度可减少测定误差.
2 防止I2 的挥发和空气中的O2 氧化I -防止I2 挥发的方法:1) 加入过量的KI(一般比理论值大2~3 倍) ,
由于生成了I3- ,可减少I2 的挥发.2) 反应时溶液的温度不能高,一般在室温下进行.3) 滴定时不要剧烈摇动溶液,最好使用碘量瓶.防止I - 被O2 氧化的方法:1) 溶液酸度不宜太高,因增高溶液酸度,会增加O2 氧化I - 的速度.2) 避免阳光直接照射,防止日光催化作用.3) 析出I2 后,不能让溶液放置过久.4) 滴定速度宜适当快些.
3 正确配制Na2S2O3 溶液
4 降低碘溶液与Na2S2O3 溶液浓度
5 选择合适的预处理方法
根据你的描述,你应该属于第一种情况,有淡黄色的硫单质析出.1年前查看全部
- 碘量法 方面的几个有关问题,碘量法中,淀粉指示剂都必须在近终点时加入.这种说法对吗,原因.尽可能简洁,清晰明快.
 jlm621年前1
jlm621年前1 -
 忍棠 共回答了23个问题
忍棠 共回答了23个问题 |采纳率87%对,因为提前加入的话,淀粉这种高分子很容易吸附溶液中的碘,而已经吸附的碘是不容易与硫代硫酸钠发生反应的,导致滴定终点不明显.1年前查看全部
- 碘量法测溶解氧 硫酸铜为什么有的朋友会在测溶解氧的时候加入硫酸铜?有什么作用,什么原理?
 信不信由你LT1年前1
信不信由你LT1年前1 -
 莫愁予 共回答了12个问题
莫愁予 共回答了12个问题 |采纳率91.7%我觉得他可能用的间接碘量法 有铜离子的事 但是为什么用间接碘量法 不用直接的 我不明白 你知道问题答案告诉我一声 谢谢!
(2)间接碘量法——滴定碘法
I-是中等强度的还原剂.主要用来测定: E0’( E0 )1年前查看全部
- 碘量法测铜如何发生氧化还原反应
 王辉学1年前1
王辉学1年前1 -
 djmac 共回答了23个问题
djmac 共回答了23个问题 |采纳率91.3%Cu^2+和过量KI生成I2 :2Cu^2+ + 4I^- = 2CuI + I2
生成的I2用硫代硫酸钠滴定:I2 + 2S2O3^2- = S4O6^2- + 2I^-1年前查看全部
- 碘量法测硫酸铜中铜离子含量时滴定至终点时加KSCN溶液的作用是什么若加KSCN过早有什么不好
碘量法测硫酸铜中铜离子含量时滴定至终点时加KSCN溶液的作用是什么若加KSCN过早有什么不好
我在学校做过可老师没让做这一部 shxzfwzm1年前1
shxzfwzm1年前1 -
 613sc_jyf 共回答了17个问题
613sc_jyf 共回答了17个问题 |采纳率76.5%由于CuI沉淀表面会吸附一些I2使滴定终点不明显,并影响准确度故在接近化学计量点时,加入少量KSCN,使CuI沉淀转变成CuSCN,因CuSCN的溶解度比CuI小得多(Ksp,CuI = 1.1×10-10, Ksp,CuSCN = 1.1×10-14)能使被吸附的I2从沉淀表面置换出来,
CuI+ SCN- == CuSCN +I-
使终点明显,提高测定结果的准确度.且此反应产生的I-离子可继续与Cu2 作用,节省了价格较贵的KI.1年前查看全部
- 碘量法测水中溶解氧是淀粉指示剂加过量会有什么影响
 hy7601251年前3
hy7601251年前3 -
 艾斯S 共回答了12个问题
艾斯S 共回答了12个问题 |采纳率91.7%淀粉指示剂加过量会多消耗碘,使测定值偏高.
楼上的纯属胡扯.
淀粉指示剂加过量对结果基本没有影响.1年前查看全部
- 碘量法为什么要作空白试验校正?
 小小小鱼1年前1
小小小鱼1年前1 -
 大木头11 共回答了18个问题
大木头11 共回答了18个问题 |采纳率100%因为所加的碘化钾(固体或溶液)有可能部分已变成了碘单质(微量),对下面的氧化还原滴定有影响.
还有在滴定时,空气中的氧气对滴定有影响.
所以要做空白.1年前查看全部
- 以 K2Cr2O7 为基准物,用碘量法标定 Na2S2O3 溶液的浓度时,滴定速度过快,并过早读出滴定管读数,会产生正偏
以 K2Cr2O7 为基准物,用碘量法标定 Na2S2O3 溶液的浓度时,滴定速度过快,并过早读出滴定管读数,会产生正偏差还是负偏差 ?为什么?
 carriezjy1年前1
carriezjy1年前1 -
 东方龙哥_xx 共回答了20个问题
东方龙哥_xx 共回答了20个问题 |采纳率100%C指硫代硫酸钠的浓度,m指重铬酸钾的质量,M指重铬酸钾的摩尔质量,V指滴定时消耗硫代硫酸钠的标准溶液体积ml,V0指的是空白试验消耗的硫代硫酸钠标准溶液的体积ml.C=6*1000*m/{(v-V0)*M}滴定度速度过快导致K2Cr2O7基准物与待测物质未反应完全,基准物还残留在待测物质中,在过早度数造成度数V偏大,从而计算的浓度偏小,产生负偏差.1年前查看全部
- 滴定终点的判定用碘量法测定时,为什么要在溶液变为淡黄色时加入淀粉,而不能在滴定一开始就加入?
 11onion1年前1
11onion1年前1 -
 哈哈吉 共回答了25个问题
哈哈吉 共回答了25个问题 |采纳率100%因为淀粉与碘单质显色的原理是淀粉与碘形成包合物,一开始就加入淀粉,与淀粉作用的碘单质比较多,反应时不容易从包合物中释放出来.在溶液变为淡黄色时加入淀粉,可以有效地减小误差.1年前查看全部
- 碘量法测水样硫化物如何防止碘挥发
 吟吟松风1年前2
吟吟松风1年前2 -
 herrydy 共回答了13个问题
herrydy 共回答了13个问题 |采纳率92.3%从原理上将,加入过量的碘化钾,使溶液中的碘都以I3-(碘三负离子)的形式存在
I2+I-=I3-
同时控制溶液中碘的浓度不要太高,就可以避免挥发.
另外,在实际的实验过程中,有一种专门做碘量法的碘量瓶,就是能在瓶塞周围加一些水的锥形瓶,它可以在反应(如I2氧化硫离子)的时候,在瓶口形成液封,使浓度高的I2不至于挥发,等到反应完成后,浓度低了,这时再快速滴定,挥发就会很少了.1年前查看全部
- 用碘量法滴定废水中的铜离子以淀粉为指示剂,硫代硫酸钠滴定碘,滴到蓝色褪去15秒不变色,就是到了滴定终点了吗.滴定好了的溶
用碘量法滴定废水中的铜离子
以淀粉为指示剂,硫代硫酸钠滴定碘,滴到蓝色褪去15秒不变色,就是到了滴定终点了吗.滴定好了的溶液放置一段时间后为什么还会重新变回蓝色,超过15秒的情况下 lxmwj751年前5
lxmwj751年前5 -
 woworini 共回答了18个问题
woworini 共回答了18个问题 |采纳率94.4%空气中的氧气可以氧化碘离子形成碘单质,一般碘化钾等等溶液也会部分被氧化,遇到淀粉变成蓝色.
4KI+O2+2H2O=4KOH+2I2
当然产生的氢氧化钾量非常少.
希望对你有帮助O(∩_∩)O~1年前查看全部
- 求解答!分析化学复习题!46、直接碘量法中加入淀粉指示剂的适宜时间是( )A.滴定开始时 B.滴定至近终点时 C.滴定至
求解答!分析化学复习题!
46、直接碘量法中加入淀粉指示剂的适宜时间是( )
A.滴定开始时 B.滴定至近终点时 C.滴定至溶液呈蓝色时 D.在标准溶液滴定了50%后
47、间接碘量法中加入淀粉指示剂的适宜时间是( )
A.滴定开始时 B.滴定至近终点时 C.滴定至溶液呈无色时 D.在标准溶液滴定了50%后
48、高锰酸钾法确定滴定终点时依靠( )
A.酸碱指示剂 B.吸附指示剂 C.金属指示剂 D.自身指示剂
49、高锰酸钾法滴定应在下列( )溶液中进行
A.强酸性 B. 弱酸性 C.中性 D.弱碱性
50、标定碘标准溶液常用的基准物质是( )
A.As2O3 B.KMnO4 C.Na2S2O3 D.K2Cr2O7
51、标定0.02mol/LKMnO4溶液反应由慢而快是由于( )
A.反应物浓度不断增加 B.反应温度降低 C.反应中有Mn2+生成 D.反应中有[H+]增加
52、测定维生素C含量所用的适宜方法是( )
A.高锰酸钾法 B. 直接碘量法 C. 亚硝酸钠法 D.重铬酸钾法
53、用配位滴定法测定金属离子含量时,滴定终点的颜色是( )的颜色.
A.EDTA B.In C.M-In D.M-EDTA E.M
54、在直接碘量法中,以淀粉为指示剂,其终点颜色变化是( )
A.蓝色至无色 B.无色至蓝色 C.红色至无色 D.无色至红色
55、 在间接碘量法中,以淀粉为指示剂,其终点颜色变化是( )
A.蓝色至无色 B. 无色至红色 C.红色至无色 D. 无色至蓝色
56、高锰酸钾法滴定中,其终点颜色变化是( )
A.蓝色至无色 B. 无色至红色 C.红色至无色 D. 无色至蓝色
57、可见光的波长的范围是( )
A.100~200nm B.200~400nm C.400~760nm D.760~1000nm
58、单色光是指( )
A.同种颜色的光 B.颜色单纯的光 C.单一波长的光 D.波长很短的光
59、光谱曲线上最大吸收峰所对应的波长称为( )
A.最小吸收波长 B.最大吸收波长 C.中等吸收波长 D.综合吸收波长
60、标准曲线法中的标准曲线是指( )
A.A—λ曲线 B. A—c曲线 C. pH—V曲线 D. E—V曲线
61、分光光度法中常用的空白溶液为( )
A.样品溶液 B.标准溶液 C.蒸馏水 D.显色剂
62、朗伯—比尔定律的数学表达式是( )
A.A=cL B.A=KcL C.A=KL D.A=cd
63、右图是高锰酸钾溶液的吸收光谱曲线,对高锰酸钾溶液进行
定量分析时,应选用哪个作为吸收波长( )
A.500nm B.525nm C.600nm D.700nm
64. 根据色谱过程的机制不同,纸色谱属于下列哪一类色谱( )
A.吸附色谱 B.分配色谱 C.离子交换色谱 D.凝胶色谱 E.液—固色谱
65. 碱性氧化铝为吸附剂时,适用于分离( )
A. 任何物质 B.酸性物质 C. 酸性或中性化合物 D.酸性或碱性化合物 E.碱性或中性化合物
66.已知三种氨基酸a、b、c,其中Rf值分别0.17、0.26、0.50,斑点在色谱纸上距原点由近到远的顺序是( )
A.a、b、c B.c、b、a C.a、c、b D.c、a、b E.b、c、a、
67.吸附柱色谱和分配柱色谱的根本区别是( )
A.所用的洗脱剂不同 B.溶剂不同 C.被分离的物质不同 D.色谱原理不同 E.操作方法大不相同
68、在薄层色谱法中,薄层分离中的各斑点的Rf值要求在( )范围内.
A.0.2~0.7 B. 0.3~0.7 C. 0.2~0.8 D.0.3~0.8 E.0.3~0.9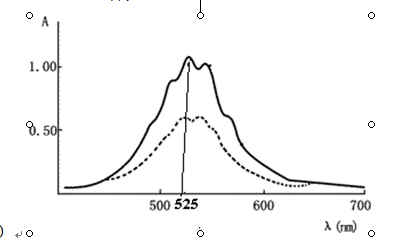
此为63题图
 LUOJIFENG051年前1
LUOJIFENG051年前1 -
 一毛五 共回答了23个问题
一毛五 共回答了23个问题 |采纳率95.7%46A 47B 48D 49A 50A 51C 52B 53B 54B 55A 56B 57C 58C 59B 60B 62B 63没看见图
64A 65E 66A 67D 681年前查看全部
- 为什么碘量法要在中性或弱碱性条件下进行
 sucharthu1年前1
sucharthu1年前1 -
 leilei100 共回答了22个问题
leilei100 共回答了22个问题 |采纳率90.9%间接碘量法的反应条件和滴定条件: 应在中性、弱酸性溶液中进行反应.
若在碱性溶液中:
S2O32-+ 4I2 + 10 OH-= 2SO42-+ 8I- + 5H2O 3I2 + 6OH-=IO3-+ 5I- + 3H2O
若在酸性溶液中:
S2O32-+ 2H+= SO2 + S + H2O 4I- + O2 (空气中) + 4H+= 2I2 + 2H2O1年前查看全部
- 溴化钾 碘量法测定苯酚的浓度了.
 6ds5h46v1年前1
6ds5h46v1年前1 -
 时间的赌徒 共回答了19个问题
时间的赌徒 共回答了19个问题 |采纳率94.7%如果我没记错的话,定量KBr与过量KBrO3反应,先生成过量Br2(相对苯酚来说).然后通过生成的溴单质与苯酚取代,然后,剩余的溴单质氧化KI,生成I2,再用硫代硫酸钠滴定I2,可知剩余的Br2.然后,通过KBr相当量关系,求出生成Br2的量,减去剩余的Br2,就是与苯酚反应的Br2.
现象是,
生成溴,就是水相变红色.
三溴苯酚沉淀,白色
剩余溴水与KI反应,水相紫色
用硫代硫酸钠滴定,至水相无色
然后通过,
5Br(-)—>3Br2—>苯酚
Br2—>I2—>2Na2S2O3
可求解两处分别的Br2,通过此,就可以求出苯酚的浓度1年前查看全部
- 碘量法中硫代硫酸钠的滴定速度有具体规定吗?
 肥嘟嘟左衛門1年前2
肥嘟嘟左衛門1年前2 -
 Iloveorchis 共回答了21个问题
Iloveorchis 共回答了21个问题 |采纳率90.5%碘量法是氧化还原滴定法中,应用比较广泛的一种方法.由于硫代硫酸钠与碘反映受温度,PH等的影响,在滴定的时候应注意观察滴定终点,当溶液刚刚由紫红色变黄的时候,加入1至2滴1%淀粉溶液,此时由于I2的存在,溶液变蓝,需要放慢滴定速度至0.5滴/秒,充分摇匀,至溶液由蓝变为无色(转变迅速,一定注意把握)
此时通过NASSO3的量可以计算到I2的量1年前查看全部
- 有一种混合物.含有三氧化二铁和二氧化锰.用什么方法测定二氧化锰含量?是否能用碘量法?
有一种混合物.含有三氧化二铁和二氧化锰.用什么方法测定二氧化锰含量?是否能用碘量法?
用碘法三价铁是否干扰. moraining1年前1
moraining1年前1 -
 libingxin620 共回答了15个问题
libingxin620 共回答了15个问题 |采纳率93.3%会影响,铁离子也可以氧化碘离子.
用硫酸溶解,氧化铁反应二氧化锰不变,然后用氟化钠(或者氢氟酸)中的氟离子掩蔽铁离子,去除铁离子干扰,
6F-+Fe3+=(FeF6)3-
二氧化锰还是没有反应,就可以开始碘量法滴定二氧化锰了.
多谢信任,希望能解决你的疑问.1年前查看全部
- 碘化亚铜颜色大家都知道碘化亚铜为白色粉末.可为啥我用碘量法测cu2+时终点的碘化亚铜是白色略带点红色?当时我以为没到终点
碘化亚铜颜色
大家都知道碘化亚铜为白色粉末.
可为啥我用碘量法测cu2+时终点的碘化亚铜是白色略带点红色?当时我以为没到终点,又加了好多硫代硫酸钠,可还是略带红色. yehuaming1年前2
yehuaming1年前2 -
 吉玲佩1 共回答了18个问题
吉玲佩1 共回答了18个问题 |采纳率83.3%其他的某些杂质吧~
铅高的时候终点还带有点黄色呢.
这个方法终点不是看什么颜色,是要看兰色完全消退.1年前查看全部
- 碘量法测铜有关反应方程!
 first98611年前1
first98611年前1 -
 我心伊然 共回答了21个问题
我心伊然 共回答了21个问题 |采纳率71.4%2Cu2+ +4I-=CuI+I2
I2+2S2O3 2-=2I- +2S4O6 2-1年前查看全部
- 间接碘量法测定苯酚含量实验中,配制溴酸钾-溴化钾标准溶液,称取溴化钾是否应过量,为什么?
 韻韻_o1年前1
韻韻_o1年前1 -
 julycom 共回答了16个问题
julycom 共回答了16个问题 |采纳率100%应该溴化钾过量.不然苯酚溴代之后产生HBr,又生成Br2.1年前查看全部
- 碘量法测铜为什么用盐酸分解铜合金
 χīлg1年前1
χīлg1年前1 -
 jerry988 共回答了12个问题
jerry988 共回答了12个问题 |采纳率75%是用的稀盐酸和过氧化氢,不是单独的盐酸1年前查看全部
- 为何在滴定近终点是加入?碘量法滴定时,加入淀粉的作用是什么?
 阿梦21121121年前1
阿梦21121121年前1 -
 aikk59168 共回答了13个问题
aikk59168 共回答了13个问题 |采纳率100%指示剂
怕I2被淀粉结合而影响反应1年前查看全部
- 碘量法测铜能否用硝酸分解?
 masami11041年前1
masami11041年前1 -
 宝宝的便便 共回答了14个问题
宝宝的便便 共回答了14个问题 |采纳率92.9%硝酸也能氧化碘离子,因此无法准确知道铜的含量.1年前查看全部
- 直接碘量法和间接碘量法的滴定剂各是什么?1
 lory20041年前1
lory20041年前1 -
 失恋女孩 共回答了28个问题
失恋女孩 共回答了28个问题 |采纳率92.9%以硫代硫酸钠为宜.1年前查看全部
- 三价铁离子是如何干扰碘量法测定溶解氧的
 飞儿咻咻1年前1
飞儿咻咻1年前1 -
 孤独的痕迹 共回答了17个问题
孤独的痕迹 共回答了17个问题 |采纳率82.4%三价铁离子也是氧化剂,
如果有存在的话,
会干扰试验,三价铁离子与碘反应,
使溶解氧的测量值偏低.1年前查看全部
- 胆矾中硫酸铜的含量测定,不用间接碘量法和加热分解法?
 xnclsc1年前1
xnclsc1年前1 -
 味道已注册 共回答了20个问题
味道已注册 共回答了20个问题 |采纳率85%先称量胆矾的质量,再把胆矾溶到水里,投入铁粉,(有铜析出),加入过量稀硫酸,待过量的铁粉全部溶解后过滤溶液,把过滤出的铜干燥,称量质量.最后用公式计算,妥了.1年前查看全部
- 用碘量法测定铜含量时加入硫氰化钾的目的何在?
 曦香1年前1
曦香1年前1 -
 huangqi203 共回答了14个问题
huangqi203 共回答了14个问题 |采纳率78.6%使碘化铜转化为溶解度更小的硫氰化铜,这样不但可以释放被吸附的I3-离子,而且反应时再生成的I-离子可以与未反应的Cu2+离子发生反应,这样,使用较少的KI,可以使反应更完全.1年前查看全部
- 淀粉指示剂在直接碘法和碘量法中指示滴定终点的原理
 hanxiaoerl1年前2
hanxiaoerl1年前2 -
 至将 共回答了22个问题
至将 共回答了22个问题 |采纳率95.5%前面那个是滴下去,滴定终点后,溶液变蓝色、后面那个是本来蓝色,终点时,I2被反应完,淀粉的蓝色效应消失.1年前查看全部
- 碘量法分析二氧化硫与其他方法相比有什么优点
 潇湘mm1年前1
潇湘mm1年前1 -
 一扬旋夏 共回答了19个问题
一扬旋夏 共回答了19个问题 |采纳率84.2%易于观察更精准1年前查看全部
- 在间接碘量法中,KI一般过量约4%的目的
 邂逅无语1年前1
邂逅无语1年前1 -
 xfcqu 共回答了22个问题
xfcqu 共回答了22个问题 |采纳率95.5%加入过量KI 与 I2 生成I3-,减少 I2挥发.1年前查看全部
- 间接碘量法测定时,须在( )溶液中进行.
间接碘量法测定时,须在( )溶液中进行.
A、强酸 B、强碱 C、弱酸或中性 D、弱碱或中性 lllou1年前2
lllou1年前2 -
 第5空间 共回答了16个问题
第5空间 共回答了16个问题 |采纳率93.8%选C
间接碘量法必须在中性或弱酸性介质中进行.
酸度过高,I-可被氧化:4I- + O2 + 4H+ = 2I2 + 2H2O
酸度过高也会促使硫代硫酸根分S2O32- + 2H+ = SO2 + S + H2O
碱度过高时,I2会发生歧化反应,并且S2O32- 与I2的反应会有副反应发生:
S2O32- + 4I2 +10OH- =2SO42- + 8I- + 5H2O1年前查看全部
- 间接碘量法时,所用淀粉指示剂应在何时加入?
 jinlulu19761年前1
jinlulu19761年前1 -
 淡雅馨香 共回答了11个问题
淡雅馨香 共回答了11个问题 |采纳率100%近终点时加入,否则淀粉颗粒包裹碘,使终点滞后,1年前查看全部
- 电厂化学脱硫化验中,皮带机石膏亚硫酸盐(碘量法)的测定?
电厂化学脱硫化验中,皮带机石膏亚硫酸盐(碘量法)的测定?
实验原理:
亚硫酸盐在酸性条件下与过量的0.05mol/L 的碘溶液反应,被氧化,然后,未反应的碘用0.1mol/L 的硫代硫酸钠标准液反滴定.其终点以电位法或指示剂法测定.
实验方法:
1.5g~2.0g石膏(已在40℃干燥) →放入250ml锥形瓶(或烧杯)→用150mlL除盐水稀释→加10ml 0.05mol/L 的碘溶液+大约10mL HCl(1:1)→摇动滴定瓶5 min,固体应溶解.当液体颜色变淡黄时加1%淀粉指示剂→用0.1mol/L Na2S2O3滴定→溶液蓝色消失时即为滴定终点→计消耗的0.1mol/L Na2S2O3 溶液体积(bmL).最后不加石膏样品按上述步骤作空白实验,记最后0.1mol/L Na2S2O3标准液消耗体积为a mL.
在这个实验中,前后所用的硫代硫酸钠起什么作用呀?
 云之言忍1年前1
云之言忍1年前1 -
 娃哈哈r8 共回答了20个问题
娃哈哈r8 共回答了20个问题 |采纳率90%第一部分的实验中,硫代硫酸钠是用来滴定被亚硫酸根还原后剩余的碘的量.空白实验是为了排除干扰因素,因为硫代硫酸钠易被空气中的氧气氧化.1年前查看全部
- 间接碘量法多在什么介质条件下进行?为什么?
 娘娘也oo1年前1
娘娘也oo1年前1 -
 独伴梨花 共回答了24个问题
独伴梨花 共回答了24个问题 |采纳率83.3%间接碘量法必须在中性或弱酸性介质中进行.
酸度过高,I-可被氧化:4I- + O2 + 4H+ = 2I2 + 2H2O
酸度过高也会促使硫代硫酸根分S2O32- + 2H+ = SO2 + S + H2O
碱度过高时,I2会发生歧化反应,并且S2O32- 与I2的反应会有副反应发生:
S2O32- + 4I2 +10OH- =2SO42- + 8I- + 5H2O1年前查看全部
- 溶液配制后为什么要标定例如配制硫代硫酸钠滴定液(0.1mol/L),然后需用置换碘量法进行标定,这样做的意义与作用是什么
溶液配制后为什么要标定
例如配制硫代硫酸钠滴定液(0.1mol/L),然后需用置换碘量法进行标定,这样做的意义与作用是什么.
(直接碘量法不可以吗?) dxp641年前2
dxp641年前2 -
 oooo 共回答了11个问题
oooo 共回答了11个问题 |采纳率100%你配制的.0.1mol/L一定不是0.1,所以必须用已知的或标定过的,对它标定后才能用你配制的进行其他实验1年前查看全部
- 碘量法测铜的时候,碘离子起到的作用是还原剂、配位剂和沉淀剂,碘离子是怎么起到配位剂的作用的
 shangyes1年前1
shangyes1年前1 -
 ab1243 共回答了14个问题
ab1243 共回答了14个问题 |采纳率78.6%生成I3-离子1年前查看全部
- 关于分析化学的一些问题6、间接碘量法应用过程中必须注意哪三个反应条件?7、简述受到不同形式沾污的沉淀应分别采取哪些措施进
关于分析化学的一些问题
6、间接碘量法应用过程中必须注意哪三个反应条件?
7、简述受到不同形式沾污的沉淀应分别采取哪些措施进行纯净?
8、试推导分析浓度为C,解离常数为Ka1、Ka2的二元弱酸H2A溶液中型体A2-的分布系数表达式δA2-(要有推导过程).
9、比较高锰钾法和重铬酸钾法各自的优缺点.
10、为什么莫尔法的酸度范围应控制在pH=6.10.
11、简述法扬司法中吸附指示剂HFI的变色原理.
只要有答案正确,就可以加满200分 liliang_xiaolei1年前2
liliang_xiaolei1年前2 -
 营销赢霄 共回答了13个问题
营销赢霄 共回答了13个问题 |采纳率92.3%6.向标定Na2S2O3溶液浓度;操作迅速防止I-和Na2S2O3被O2氧化;保证中性和弱酸性条件
7.共沉淀:采用分布沉淀方法
后沉淀:使用掩蔽剂
这两种玷污都可以用二次沉淀处理
8.δA2-=Ka1*Ka2/([H+]^2+Ka1[H+]+Ka1*Ka2)
推导:δA2-=[H2A]/c=[H2A]/([H2A]+[HA-]+[A2-]),同时除以[H2A]代入Ka1 Ka2就可以得到
9.KMnO4 氧化能力强,反应物很多,但是干扰比较严重.KMnO4杂质多,标准溶液不稳定
K2cr2O7 氧化性较强,反应物较少,但容易提纯,而且溶液稳定,但是有毒
10.指示剂CrO42-在这个pH,比较稳定.如果太酸CrO42- 转化为Cr2O7 2-,Ag2Cr2O7可溶于水.如果过碱,Ag+生成AgOH(很不稳定),最后生成Ag2O
11.胶体沉淀AgCl带有Ag+
AgCl·Ag+ +FI-==AgCl·(Ag+FI-)(一个化合物)
黄绿色 淡红色1年前查看全部
- 用间接碘量法测定BaCl2的纯度时,先将Ba2+沉淀为Ba(IO3)2,洗涤后溶解并酸化,加入过量的KI,然后用Na2S
用间接碘量法测定BaCl2的纯度时,先将Ba2+沉淀为Ba(IO3)2,洗涤后溶解并酸化,加入过量的KI,然后用Na2S2O3标准溶液滴定,则BaCl2与Na2S2O3的计量关系是( ).
 liouwevj1年前2
liouwevj1年前2 -
 cdsingaler 共回答了20个问题
cdsingaler 共回答了20个问题 |采纳率80%假设酸化用的是H2SO4
Ba(IO3)2+10KI+6H2SO4=BaSO4+6I2+5K2SO4+6H2O
2Na2S2O3+I2=Na2S4O6+2NaI
BaCl2与Na2S2O3的计量关系是
BaCl2---Ba(IO3)2-----6I2-----12Na2S2O31年前查看全部
大家在问
- 1Si h2sio3不能用si一步制h2sio3的原因是什么?对不起,偶打错了,是想问SiO2不能一步制h2sio3的原因
- 2根据句意及汉语提示完成句子1.Does he like _____(运动)?【sport要不要加s?什么情况下要加s?】
- 3He'll use what he has _____ her a new dress.
- 4P(2,-1)为圆(x-1)^2+y^2=25的弦AB的中点,则直线AB的方程是
- 5英语翻译I beg your pardon我 你 抱歉这差距太大了,搞不懂啊
- 6从C、H、O三种元素中,按要求选择适当的元素用化学语言填空.
- 7把2米长的绳子剪成相等的5段,每段长用小数表示是几米,用证书表示是几分米,每段绳子是全长的几.
- 8已知a向量=(cos(2x-π/3),sin(x-π/4),b向量=(1,2sin(x+π/4)),函数f(x)=a向量
- 91.A:It is Sunday tomorrow.What do you like doing?B:I like __
- 10利用均值不等式的一高中数学题一种设备的价值费为a元,设备维修和消耗费用第一年为b元,以后每年增加b元,若t表示设备使用年
- 11已知数列{an}的前n项和为Sn,满足条件lgSn+(n-1)lgb=lg(b∧n+1+n-2),其中b>0且b≠1,若
- 12按从大到小排列下列数字:2050米 2.5千米 2千米5米 2千米50厘米 2.005厘米 ______>_______
- 13下列各组物质的名称、俗名、化学式(主要成分)不能表示同一种物质的是( ) A.甲烷、甲醇、CH 4 B.二氧化碳、干冰
- 14完形填空Maybe you are more interested in history.You perhaps thi
- 15下列说法中正确的是( )A.15℃时,KNO3的溶解度是25g,15℃时饱和溶液的溶质质量分数为20%B.24%的Na
