(2014•晋中模拟)《环境研究通讯》刊文称:全世界每年因空气污染而死亡的人数约为210万.原因是大气中可吸入颗粒物(P
 jb72112022-10-04 11:39:541条回答
jb72112022-10-04 11:39:541条回答A.PM2.5是指大气中直径小于或等于2.5um(10-6m)的颗粒物,因此均能形成胶体
B.研制开发燃料电池汽车,降低机动车尾气排放,可以减少PM2.5污染
C.PM2.5专用口罩中使用了活性炭,是利用了活性炭的吸附性
D.工厂利用胶体电泳性质采用静电除尘工艺,可部分降低细颗粒物造成的污染

已提交,审核后显示!提交回复
共1条回复
 xlzxlt 共回答了14个问题
xlzxlt 共回答了14个问题 |采纳率85.7%- 解题思路:A.分散质粒子直径在10-9m~10-7m之间的分散系属于胶体;
B.减少机动车尾气排放能降低空气中PM2.5;
C.PM2.5专用口罩使用了活性炭,活性炭疏松多孔能把颗粒物吸附在表面;
D.胶粒在电场的作用下,做定向运动,这种现象称为电泳.A.PM2.5是指大气中直径小于或等于2.5um(10-6m)的颗粒物,粒子直径大于10-7m,不能形成胶体,故A错误;B.研制开发燃料电池汽车,降低机动车尾气排放,可以减少PM2.5污染,故B正确;C.PM2.5专用口罩中使用了活性...
点评:
本题考点: 常见的生活环境的污染及治理.
考点点评: 本题主要考查了PM2.5的性质,减少污染的方法与防治等知识,难度不大,注意胶体的胶粒直径在10-9m~10-7m之间. - 1年前
相关推荐
- (2011•晋中三模)有关命题的说法错误的是( )
(2011•晋中三模)有关命题的说法错误的是( )
A.若p∨q为假命题,则p、q均为假命题
B.“x=1”是“x2-3x+2=0”的充分不必要条件
C.命题“若x2-3x=2=0,则x=1”的逆否命题为:“若x≠1,则x2-3x=2≠0”
D.对于命题p:∃x≥0,2x=3,则¬P:∀x<0,2x≠3 3408237612011年前1
3408237612011年前1 -
 KLGDR 共回答了15个问题
KLGDR 共回答了15个问题 |采纳率93.3%解题思路:利用常用逻辑用语中四种命题之间的转化、充要条件的判断办法、复合命题真假的判断、含有量词的命题的否定等知识进行分析判断是解决这类问题的关键.在此基础上对四个选项分别加以判别,可得正确的选项.由复合命题真值表得:若p∨q为假命题,则p、q都为假命题即可.故A正确;
B中:x=1⇒x2-3x+2=0,而x2-3x+2=0不一定推出x=1,还可能x=2,
故“x=1”是“x2-3x+2=0”的充分不必要条件,B正确.
C中:逆否命题为是将原命题的条件和结论都否定,再交换条件结论
命题“若x2-3x=2=0,则x=1”和命题“若x≠1,则x2-3x=2≠0”,符合这个格式,故C是正确的;
D中:命题p:∃x≥0,2x=3是特称命题,否定写法应该是先改量词,但不否定条件,应该是¬P:∀x≥0,2x≠3.
D是错误的
故选D.点评:
本题考点: 特称命题;复合命题.
考点点评: 本题考查学生对逻辑知识的理解和把握,属于基础题型.只要把四种命题之间的转化关系,充要条件的判断要领,复合命题真假的判断,特称命题否定的叙述等知识掌握好是很容易做对这些题目的.1年前查看全部
- (2011•晋中三模)一个体积为163的正三棱柱的三视图如图所示,则这个三棱柱的左视图的面积为( )
(2011•晋中三模)一个体积为16
的正三棱柱的三视图如图所示,则这个三棱柱的左视图的面积为( )3 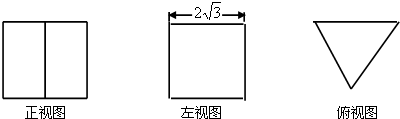
A.83
B.63
C.43
D.12 dede01021年前1
dede01021年前1 -
 rebecca_129 共回答了20个问题
rebecca_129 共回答了20个问题 |采纳率95%解题思路:几何体是一个正三棱柱,底面正三角形的高是 2
,由正三角形的性质可以求出其边长,由于本题中体积已知,故可设出棱柱的高,利用体积公式建立起关于高的方程求高,再由正方形的面积公式求侧视图的面积即可.3 设棱柱的高为h,
由左视图知,底面正三角形的高是 2
3,由正三角形的性质知,其边长是4,
故底面三角形的面积是
1
2×2
3×4=4
3
由于其体积为16
3,故有h×4
3=16
3,得h=4
由三视图的定义知,侧视图的宽即此三棱柱的高,故侧视图的宽是4,其面积为4×2
3=8
3
故选A点评:
本题考点: 由三视图求面积、体积.
考点点评: 本题考点是简单空间图形的三视图,考查根据作三视图的规则几何体的直观图的能力以及利用体积公式建立方程求参数的能力,三视图的投影规则是:“主视、俯视 长对正;主视、左视高平齐,左视、俯视 宽相等”.1年前查看全部
- (2011•晋中三模)若任意x∈A,则[1/x∈A,就称A是“和谐”集合,则在集合M={−1,0,13,12,1,2,3
(2011•晋中三模)若任意x∈A,则[1/x∈A
 Harvey_Lee1年前1
Harvey_Lee1年前1 -
 nmehuee 共回答了19个问题
nmehuee 共回答了19个问题 |采纳率94.7%解题思路:本题是一个新定义的题,可以先求出集合的所有子集的个数,再求出其中“和谐”集合的个数,从而解出“和谐”集合的概率,选出正确选项由题意知集合的非空子集有28-1=255个
由定义任意x∈A,则[1/x∈A,就称A是“和谐”集合,知此类集合中的元素两两成对,互为倒数,观察集合M,互为倒数的数有两对,包括两个倒数是自身的数1与-1
可将这些数看作是四个元素,由于包括四个元素的集合的非空子集是24-1=15
故“和谐”集合的概率是
15
255]=[1/17]
故选A点评:
本题考点: 等可能事件的概率.
考点点评: 本题考查等可能事件的概率,解题的关键是理解所给的定义及集合的子集的个数计算方法,求出集合的子集的个数与和谐集合的个数,由概率公式求出概率,本题考查了理解能力及推理判断的能力1年前查看全部
- (2011•晋中三模)去冬以来,我国北方持续干旱,为此,农业专家建议尽快发展高能抗旱保水剂.保水剂是一种强吸水树脂,能在
(2011•晋中三模)去冬以来,我国北方持续干旱,为此,农业专家建议尽快发展高能抗旱保水剂.保水剂是一种强吸水树脂,能在短时间内吸收自身重量几百倍至上千倍的水分.聚丙烯酸钠就是一种高吸水性树脂.下面是丙烯合成聚丙烯酸钠的化工流程:
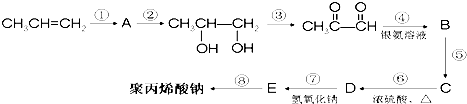
请回答下列问题:
(1)上述反应中属于加成反应的有______,反应⑧的反应类型为______;
(2)写出A的结构简式______,D中的官能团有______;
(3)F是D的同分异构体,F能发生银镜反应,且核磁共振氢谱上只有两种峰,强度比为1:1,写出F的结构简式______;
(4)写出下列反应的化学方程式:②CH3CHBrCH2Br+2NaOH
CH3CH(OH)CH2OH+2NaBr水 △ CH3CHBrCH2Br+2NaOH.⑧
CH3CH(OH)CH2OH+2NaBr水 △ nCH2=CHCOONa催化剂 △  nCH2=CHCOONa.
nCH2=CHCOONa.催化剂 △ 
 爱在爱自己1年前1
爱在爱自己1年前1 -
 hhc009 共回答了25个问题
hhc009 共回答了25个问题 |采纳率88%解题思路:由合成流程可知,反应①为丙烯发生加成反应生成A,若试剂为Br2,则A为CH3CHBrCH2Br,反应②为碱溶液中的水解反应,反应③为氧化反应,反应④发生银镜反应,-CHO被氧化为羧酸,则B为CH3COCOOH.反应⑧为E发生加聚反应生成聚丙烯酸钠,则E为CH2=CHCOONa,逆推可知反应⑦为中和反应,则D为CH2=CHCOOH,结合B→C→D转化,反应⑤为B与氢气的加成反应生成C,反应⑥为C发生消去反应生成D,则C为CH3C(HO)HCOOH,以此来解答.由合成流程可知,反应①为丙烯发生加成反应生成A,若试剂为Br2,则A为CH3CHBrCH2Br,反应②为碱溶液中的水解反应,反应③为氧化反应,反应④发生银镜反应,-CHO被氧化为羧酸,则B为CH3COCOOH.反应⑧为E发生加聚反应生成聚丙烯酸钠,则E为CH2=CHCOONa,逆推可知反应⑦为中和反应,则D为CH2=CHCOOH,结合B→C→D转化,反应⑤为B与氢气的加成反应生成C,反应⑥为C发生消去反应生成D,则C为CH3C(HO)HCOOH,
(1)由上述分析可知,反应①⑤为加成反应,反应⑧为加聚反应,
故答案为:①⑤;聚合反应;
(2)由上述分析可知,A为CH3CHBrCH2Br,D为CH2=CHCOOH,含有碳碳双键、羧基,
故答案为:CH3CHBrCH2Br;碳碳双键、羧基;
(3)D为CH2=CHCOOH,F是D的同分异构体,F能发生银镜反应,含有-CHO,且核磁共振氢谱上只有两种峰,强度比为1:1,F分子有两种H原子且各有2个,应含有2个-CHO,F的结构简式为:OHCCH2CHO,
故答案为:OHCCH2CHO;
(4)反应②是CH3CHBrCH2Br发生水解反应生成CH3CH(OH)CH2OH,反应方程式为:CH3CHBrCH2Br+2NaOH
水
△CH3CH(OH)CH2OH+2NaBr,
反应⑧的方程式为:nCH2=CHCOONa
催化剂
△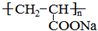 ,
,
故答案为:CH3CHBrCH2Br+2NaOH
水
△CH3CH(OH)CH2OH+2NaBr;nCH2=CHCOONa
催化剂
△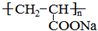 .
.点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的合成与推断,明确合成中反应的条件及官能团的变化即可解答,题目难度中等.1年前查看全部
- (2014•晋中模拟)向溴水中加入足量的乙醛溶液,可以看到溴水褪色.对产生该现象的原因有如下三种猜想;①溴水与乙醛发生取
(2014•晋中模拟)向溴水中加入足量的乙醛溶液,可以看到溴水褪色.对产生该现象的原因有如下三种猜想;①溴水与乙醛发生取代反应:②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸,为探究哪一种猜想正确.某研究性学习小组提出了如下两种实验方案:
实验方案一:检验褪色后溶液的酸碱性.
实验方案二:测定反应前后溴水中Br2的物质的量和反应后Br-的物质的是
(1)方案一是否可行?______,理由是______
(2)假设测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=______mol.说明溴水与乙醛发生取代反应;若测得反应后n(Br-)=______mol,说明溴水与乙醛发生加成反应;若测得反应后
n(Br-)=______mol,说明溴水将醛氧化为乙酸.
(3)按物质的量之比为1:5配制成1000mL KBrO3-KBr溶液,该溶液在酸性条件下完全反应可生成0.5mol Br2,取该溶液10mL,加入足量乙醛溶液使其褪色,然后将所得溶液稀释为100mL,准确取其中的10mL,加入过量AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188g.若已知COOAg易溶于水,试通过计算判断溴水与乙醛发生反应的类型为______(填序号)
①取代反应 ②加成反应 ③氧化反应
(4)写出上述测定过程中反应的离子方程式
①KBrO3与KBr在酸性条件下的反应______
②溴水与乙醛反应______
(5)根据上述信息,试推测向酸性KMnO4溶液中滴加乙醛可能出现的现象:______. 雪依小轩1年前1
雪依小轩1年前1 -
 dfn88_5buo3cae 共回答了23个问题
dfn88_5buo3cae 共回答了23个问题 |采纳率87%解题思路:(1)检验褪色后溶液的酸碱性不能确定是取代反应还是氧化反应;
(2)若发生取代反应,1molBr2可生成1molHBr;若发生加成反应,则无HBr生成;若发生氧化反应,1molBr2可被还原生成2molHBr;
(3)根据计算判断反应类型;
(4)根据氧化还原反应的规律进行书写;
(5)酸性KMnO4溶液具有强氧化性,乙醛具有还原性.(1)因溴水与乙醛发生取代反应有HBr生成;乙醛被氧化生成乙酸和HBr,溶液均呈酸性,故不能用测定溶液酸碱性的方法,方案一不可行,
故答案为:不可行;溴水与乙醛发生取代反应和乙醛被溴水氧化都有溴化氢生成,溶液均显酸性;
(2)若发生取代反应,1molBr2可生成1molHBr,故反应后n(Br-)=amol;若发生加成反应,则无HBr生成,故反应后n(Br-)=0;若发生氧化反应,1molBr2可被还原生成2molHBr,故反应后n(Br-)=2amol,
故答案为:a;0;2a;
(3)与乙醛反应的Br2为0.5×[10/1000]=0.005mol:n(AgBr)=[0.188g/188g/mol]=0.001mol,故Br2与乙醛反应生成的Br-为:0.001mol×[100/10]=0.01mol,故n(Br-):n(Br2)=0.01:0.005=2:1,故发生氧化反应,
故答案为:③;
(4)①KBrO3与KBr在酸性条件下发生氧化还原反应,生成单质溴,方程式为:BrO3-+5Br-+6H+=3Br2+3H2O,
故答案为:BrO3-+5Br-+6H+=3Br2+3H2O;
②溴水与乙醛发生氧化还原反应,方程式为:CH3CHO+Br2+H2O=CH3COOH+2H++2Br-,
故答案为:CH3CHO+Br2+H2O=CH3COOH+2H++2Br-;
(5)乙醛能与酸性KMnO4溶液发生氧化还原反应,从而使酸性KMnO4溶液褪色,
故答案为:溶液的紫色褪去.点评:
本题考点: 探究化学反应机理;乙醛的化学性质;探究对经典问题的质疑.
考点点评: 本题考查化学实验方案的评价,题目难度中等,注意根据反应的类型判断反应可能的产物,把握实验原理.1年前查看全部
- (2011•晋中三模)在等差数列{an}中,a1=-25,S3=S8,则前n项和sn的最小值为( )
(2011•晋中三模)在等差数列{an}中,a1=-25,S3=S8,则前n项和sn的最小值为( )
A.-80
B.-76
C.-75
D.-74 hxzrlove1年前0
hxzrlove1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2011•晋中三模)A.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
 (2011•晋中三模)A.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(2011•晋中三模)A.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(1)元素第一电离能:Al<<Mg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: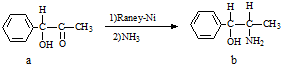
化合物b中进行sp3杂化的原子有:C、N、OC、N、O.
(3)一种铝镍合金的结构如图,与其结构相似的化合物是:bb(选填序号:a.氯化钠b.氯化铯c.石英d.金刚石).
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni在基态时,核外电子排布式为:1s22s22p63s23p63d84s21s22s22p63s23p63d84s2.
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4).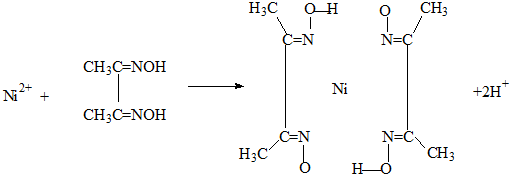
 山鬼的影子1年前1
山鬼的影子1年前1 -
 半杯苏打 共回答了11个问题
半杯苏打 共回答了11个问题 |采纳率100%(1)Mg元素原子的3s能级容纳2个电子,为全满稳定状态,能量降低,第一电离能高于同周期相邻的元素,故第一电离能Al<Mg,故答案为:<;
(2)苯环中存在大π键,碳原子杂化数为2,采取sp2杂化,侧链中C原子成4个单键,杂化轨道数为4,采取sp3杂化,O原子成2个单键,含有2对孤对电子,杂化轨道数为4,采取sp3杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化,故答案为:C、N、O;
(3)由图可知铝镍合金的晶胞结构中,Ni原子数目为1,Al原子数目为8×
1
8=1,为AlNi,每个Ni原子周围有8个Al原子,每个Al原子周围有8个Ni原子,
a.氯化钠中每个钠离子周围有6个氯离子,每个氯离子周围有6个钠离子,不符合;
b.氯化铯中每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,符合;
c.石英为空间立体网状结构,硅原子周围有4个氧原子,氧原子周围有2个硅原子,不符合;
d.金刚石为空间立体网状结构,每C原子周围有4个C原子,不符合;
故答案为:b;
(4)①Ni是28号元素,核外有28个电子,其原子核外电子排布为1s22s22p63s23p63d84s2,故答案为:1s22s22p63s23p63d84s2;
②Ni2+含有空轨道,N原子含有孤对电子对,N原子与Ni2+形成配位键,不同分子中氧原子与氢原子之间形成氢键,如图所示: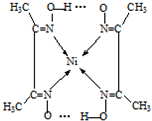 ,
,
故答案为: .
1年前查看全部
.
1年前查看全部
- (3c11•晋中三模)5ccmLKNO3和Cu(NO3)3的混合溶液中c(NO3-)=6.cmol/
(3c11•晋中三模)5ccmLKNO3和Cu(NO3)3的混合溶液中c(NO3-)=6.cmol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到33.4L气体(标准状况).下列说法正确的是( )
A.上述电解过程中共转移2 mol电子
B.原混合溶液中c(K+)为2 mol/L
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为4mol/L hyl1231年前1
hyl1231年前1 -
 天天洗澡D猪 共回答了18个问题
天天洗澡D猪 共回答了18个问题 |采纳率94.4%解题思路:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,
n(O2)=[22.4L/224L/mol]=1mol,结合电子守恒及物质的量浓度的计算来解答.石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(72)=[22.4L/224L/m7l]=1m7l,
阳极发生电极反应为:47H--4e-═72↑+2H27,
4m7l 4m7l 1m7l
阴极发生的电极反应为:Cu2++2e-═Cu、2H++2e-═H2↑
1m7l 2m7l 1m7l 2m7l 2m7l 1m7l
A.根据氧气计算转移电子的物质的量,转移电子的物质的量=1m7l×4=4m7l,故A错误;
B.c(Cu2+)=[1m7l/手.5L]=2m7l/L,由电荷守恒可知,原混合溶液中c(K+)为二m7l/L-2m7l/L×2=2m7l/L,故B正确;
C.电解得到的Cu的物质的量为1m7l,故C错误;
D.电解后溶液中c(H+)为[4m7l−2m7l/手.5L]=4m7l/L,故D正确;
故选BD.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,明确发生的电极反应及电子守恒是解答本题的关键,题目难度中等,难点是D,注意氢氧根离子与氢离子的关系即可解答.1年前查看全部
- (2011•晋中三模)某同学用如图所示的装置测定当地的重力加速度:
(2011•晋中三模)某同学用如图所示的装置测定当地的重力加速度:
(1)纸带上1至9各点为计时点,由纸带所示数据算出当地的重力加速度是______;
(2)若当地的重力加速度真实数值是9.8m/s2,请任意写出一个测量值与真实值有差异的原因______;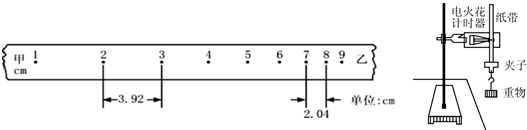
 一切随心能不neng1年前1
一切随心能不neng1年前1 -
 宇诚民本 共回答了17个问题
宇诚民本 共回答了17个问题 |采纳率88.2%解题思路:①纸带实验中,若纸带匀变速直线运动,测得纸带上的点间距,利用匀变速直线运动的推论即逐差法,可计算出打出某点时纸带运动的加速度.
②重物下落过程中不可避免的受到空气阻力或者纸带与限位空之间的摩擦力作用,因此会导致所测的重力加速度小于实际值.①根据运动学公式得:△x=at2,
g=
h7、8−h2、3
5T2=9.4m/s2
故答案为:9.4m/s2.
②重物下落过程中不可避免的受到空气阻力和纸带与限位空之间的摩擦力作用,因此会导致所测的重力加速度小于实际值.
故答案为:纸带受到摩擦阻力和空气阻力.点评:
本题考点: 验证机械能守恒定律.
考点点评: 解决实验问题首先要掌握该实验原理,了解实验的仪器、操作步骤和数据处理以及注意事项,计算过程中要注意单位的换算和有效数字的保留.1年前查看全部
- (2011•晋中三模)数列{xn}满足xn+1=xn+xn+2,已知x1=a,x2=b,则x2011的值为______.
 greatwh1年前1
greatwh1年前1 -
 村里俺最帅 共回答了17个问题
村里俺最帅 共回答了17个问题 |采纳率88.2%解题思路:根据题意可求得xn+3=xn+2-xn+1和xn+2=xn+1-xn的等式相加,求得xn+3=-xn,进而可推断出xn+6=-xn+3=xn.判断出数列是以6为周期的数列,进而根据x2011=x1求得答案.∵xn+1=xn+xn+2
∴xn+2=xn+1-xn①,
∴xn+3=xn+2-xn+1②.
式子②+式①,
得xn+3=-xn,
从而有xn+6=-xn+3=xn.
∴数列{xn}是以6为其周期.故x2011=x1=a.
故答案为:a.点评:
本题考点: 数列递推式.
考点点评: 本题主要考查了数列的递推式,考查了学生综合分析问题和解决问题的能力.1年前查看全部
- (2011•晋中三模)某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分).[已
(2011•晋中三模)某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分).[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]

(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是______;A处干燥管盛放的药品是______,其作用是______.
(2)指导老师在审阅设计方案后指出需要在E处进行改进,请你帮助该小组设计出改进方案:______.
(3)加热前需要进行的必要操作是______,其目的是______;对活塞的操作方法是:打开活塞______,关闭活塞______.
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,这是由于______.
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是______.
(6)实验测得数据如下:碱式碳酸镁样品22.6g;反应前C装置的质量为87.6g,反应后质量为89.4g;反应前D装置的质量为74.7g,反应后质量为83.5g.请计算推导该碱式碳酸镁的化学式______,该碱式碳酸镁受热分解的化学方程式为Mg3(OH)2(CO3)2
3MgO+2CO2↑+H2O△ .Mg3(OH)2(CO3)2.
3MgO+2CO2↑+H2O△ . hn7vv4241年前1
hn7vv4241年前1 -
 154088773 共回答了16个问题
154088773 共回答了16个问题 |采纳率93.8%解题思路:(1)由实验原理可知,实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,故应首先检验装置的气密性.
装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差,故A装置应吸收空气中的水蒸气和二氧化碳.
(2)D装置中盛放的碱石灰容易吸收空气中的水蒸气和二氧化碳,应在D装置之后添加一个盛有碱石灰(或氧化钙)的干燥管,防止空气中的水蒸气和二氧化碳进入D装置中,影响测量结果.
(3)装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,故实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差.活塞的操作方法是:打开活塞K1、K2,关闭活塞K3.
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,说明碱式碳酸镁分解完全,B装置内反应结束.
(5)B装置中的反应完全后,装置中的残留少量水蒸气和二氧化碳,为减少误差,应全部赶到装置C和D中.
(6)碱式碳酸镁样品22.6g,反应前C装置的质量为87.6g,反应后质量为89.4g,故生成水的质量为89.4g-87.6g=1.8g;反应前D装置的质量为74.7g,反应后质量为83.5g,生成二氧化碳的质量为83.5g-74.7g=8.8g,故氧化镁的质量为22.6g-1.8g-8.8g=12g,计算各物质的物质的量,利用元素守恒计算碱式碳酸镁中x、y、z,据此书写碱式碳酸镁化学式.
该碱式碳酸镁加热能分解生成氧化镁、水和二氧化碳的物质的量之比为3:1:2.(1)由实验原理可知,实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,故应首先检验装置的气密性.
装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差,故A装置应吸收空气中的水蒸气和二氧化碳,A装置内可以选用碱石灰(或氧化钙).
故答案为:检验装置的气密性;碱石灰(或氧化钙).
(2)D装置中盛放的碱石灰容易吸收空气中的水蒸气和二氧化碳,应在D装置之后添加一个盛有碱石灰(或氧化钙)的干燥管,防止空气中的水蒸气和二氧化碳进入D装置中,影响测量结果.
故答案为:添加一个盛有碱石灰(或氧化钙)的干燥管.
(3)装置内有空气,含有水蒸气和二氧化碳,影响水蒸气和二氧化碳质量的测定,故实验前要通入空气,赶走装置中含有水蒸气和二氧化碳,减少误差.
活塞的操作方法是:打开活塞K1、K2,关闭活塞K3.
故答案为:鼓入空气;赶走装置中含有水蒸气和二氧化碳;K1、K2,K3.
(4)关闭活塞K1、K2,打开K3,加热一段时间后,同学们发现C处洗气瓶中几乎没有气泡冒出,说明碱式碳酸镁分解完全,B装置内反应结束.
故答案为:B装置中的反应已完全.
(5)B装置中的反应完全后,装置中的残留少量水蒸气和二氧化碳,为减少误差,应全部赶到装置C和D中.
故答案为:将反应生成的残留在装置中的水蒸气和二氧化碳全部赶到装置C和D中.
(6)碱式碳酸镁样品22.6g,反应前C装置的质量为87.6g,反应后质量为89.4g,故生成水的质量为89.4g-87.6g=1.8g,物质的量为[1.8g/18g/mol]=0.1mol;反应前D装置的质量为74.7g,反应后质量为83.5g,生成二氧化碳的质量为83.5g-74.7g=8.8g,物质的量为[8.8g/44g/mol]=0.2mol,故氧化镁的质量为22.6g-1.8g-8.8g=12g,物质的量为[12g/40g/mol]=0.3mol,根据Mg、H、C元素守恒可知,x:y:z=0.3mol:0.1mol×2:0.2mol=3:2:2,故碱式碳酸镁的化学式为Mg3(OH)2(CO3)2;该碱式碳酸镁受热分解的化学方程式为Mg3(OH)2(CO3)2
△
.
3MgO+2CO2↑+H2O.
故答案为:Mg3(OH)2(CO3)2;Mg3(OH)2(CO3)2
△
.
3MgO+2CO2↑+H2O.点评:
本题考点: 探究物质的组成或测量物质的含量;镁、铝的重要化合物.
考点点评: 考查学生对实验原理理解、方案设计的评价、实验装置的理解、物质组成的测定等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.1年前查看全部
- (2011•晋中三模)下面为某报纸的一篇科技报道,请你通过必要的计算判断报道中存在的问题,并在下列选项中选出正确的答案本
(2011•晋中三模)下面为某报纸的一篇科技报道,请你通过必要的计算判断报道中存在的问题,并在下列选项中选出正确的答案本报讯:首个由***研制的目前世界上口径最大的、直径为1m的太空天文望远镜,被运载火箭送入距地面高735km、线速度约为5.0×l02 m/s的地球同步轨道上,它主要用于全面观察太阳活动、日地空间环境等.下面的数据在你需要时可选用:引力常量g=6.7×10-11n•m2/kg2;重力加速度g=10m/s2;地球半径r=6.4×106m;地球质量m=6.0×l024㎏;地球自转周期t=8.6×104s;地球公转周期t'=3.2×107s;π2=10;π=3;70~80的立方根约取4.2.( )
a.地球同步轨道上的线速度报道无误
b.能发射到距地面高2.96×104km的地球同步轨道上
c.地球同步轨道离地面高度报道无误
d.地球同步轨道高度和线速度大小报道都有误 兀那小厮1年前1
兀那小厮1年前1 -
 xiaozhenduo27 共回答了20个问题
xiaozhenduo27 共回答了20个问题 |采纳率90%解题思路:地球同步卫星相对地球表面静止,它绕地球做匀速圆周运动的周期等于地球自转周期,地球对它的万有引力提供它做圆周运动的向心力,由牛顿第二定律列方程,然后求出同步轨道的半径、同步卫星的线速度,最后分析答题.设同步卫星的质量是m,轨道半径是r;
(1)由牛顿第二定律可得:G[Mm
r2=m(
2π/T])2r,
r=
3
GMT2
4π2
=
3
6.7×10−11×6×1024×(8.6×104)2
4×10
≈4.2×107m,
同步轨道距地面的高度h=r-R=4.2×107m-6.4×106m=3.56×107m=3.56×104km,
故报道的轨道离地面的高度有误;
(2)同步卫星的周期等于地球自转周期,
同步卫星的线速度v=[2π/T]r=
2×3
8.6×104×3.56×107≈2.48×103m/s,
故报道的同步卫星线速度有误;
故ABC错误,D正确;
故选D.点评:
本题考点: 万有引力定律及其应用;人造卫星的加速度、周期和轨道的关系.
考点点评: 熟练应用万有引力公式、向心力公式及线速度与周期的关系,认真计算是正确解题的关键.1年前查看全部
- (2011•晋中三模)2011年3月,以法、美为首的多国部队空袭了利比亚.美国空军在往返利比亚的过程中,美军战机进行了空
 (2011•晋中三模)2011年3月,以法、美为首的多国部队空袭了利比亚.美国空军在往返利比亚的过程中,美军战机进行了空中加油.空中加油的过程大致如下;首先是加油机和受油机必须按照预定时间在预定地点会合,然后受油机和加油机实施对接,对接成功后,加油系统根据信号自动接通油路.加油完毕后,受油机根据加油机的指挥进行脱离,整个加油过程便完成了(如图所示).在加、受油机加油过程中,若加油机和受油机均保持匀速运动,且运动时所受阻力与重力成正比,则( )
(2011•晋中三模)2011年3月,以法、美为首的多国部队空袭了利比亚.美国空军在往返利比亚的过程中,美军战机进行了空中加油.空中加油的过程大致如下;首先是加油机和受油机必须按照预定时间在预定地点会合,然后受油机和加油机实施对接,对接成功后,加油系统根据信号自动接通油路.加油完毕后,受油机根据加油机的指挥进行脱离,整个加油过程便完成了(如图所示).在加、受油机加油过程中,若加油机和受油机均保持匀速运动,且运动时所受阻力与重力成正比,则( )
A.加油机和受油机不一定是相对静止的
B.加油机和受油机的速度可能不相等
C.加油机向受油机供油,受油机质量增大,必须减小发动机输出功率
D.加油机向受油机供油,加油机质量减小,必须减小发动机输出功率 yusihui1年前1
yusihui1年前1 -
 323313 共回答了21个问题
323313 共回答了21个问题 |采纳率95.2%解题思路:判断一个物体是运动个还是静止的关键是看被研究的物体与所选的标准,即参照物之间的相对位置是否发生了改变,如果发生改变,则物体是运动的;如果未发生变化,则物体是静止的.所受阻力与重力成正比,欲保持匀速运动,加油机应逐渐适当减小发动机输出功率,受油机则应逐渐适当增大发动机输出功率.A、在加、受油机加油过程中,若加油机和受油机均保持匀速运动,所以加油机和受油机必须相对静止,速度一定相等,故A、B错误.
C、加油机向受油机供油,受油机质量增大,运动时所受阻力F增大,由P=Fv可知,要保持匀速运动,必须增大发动机的输出功率P;加油机向受油机供油,加油机质量减小,运动时所受阻力F减小,由P=Fv可知,要保持匀速运动,必须减小发动机输出功率P.故C错误,D正确.
故选D.点评:
本题考点: 功率、平均功率和瞬时功率.
考点点评: 1、对参照物及其选择和运动与静止的相对性等知识点的理解和掌握,
2、掌握pP=Fv的应用.1年前查看全部
- (2014•晋中模拟)铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
(2014•晋中模拟)铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
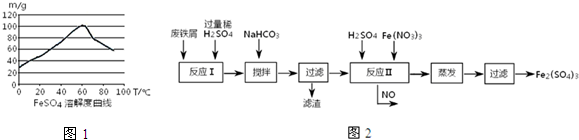
(1)用铁屑与稀硫酸反应制备FeSO4
①若要提高FeSO4生成速率,采取下列措施中正确的是______.
A.使用浓硫酸铁屑反应
B.使用磨细的铁粉反应
C.控制温度50-70℃
D.温度越高一定有利
②在上述述反应过程中,常会伴随发生
反应:4Fe2++O2+4H+═4Fe3++2H2O 若要
减少产品FeSO4中Fe2+的含量,采取下列措施中正确的是______
A.控制稀硫酸的浓度不能太高
B.用蒸馏水水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持
>1n(Fe) n(H2SO4)
D.反应中应经常添加Fe2(SO4)3搅拌.
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3其反应及操作流程如图:
①加入NaHCO3并搅拌,将混合溶液pH调至______范围内,使杂质沉淀过滤除去.
②反应Ⅱ中反应的离子方程式是:______沉淀物 Fe(OH)3 Fe(OH)2 Al(OH)3 Cu(OH)2 开始沉淀 2.3 7.5 3.4 4.7 完全沉淀 3.2 9.7 4.4 6.7
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是______,气体X与NO配比的比例是______.
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是______. 长袖飞花1年前1
长袖飞花1年前1 -
 guo185519160 共回答了18个问题
guo185519160 共回答了18个问题 |采纳率88.9%解题思路:(1)①一般增大接触面积、增大浓度、增大压强、升高温度,反应的反应速率增大,以此来解答;
②A.稀硫酸的浓度太高,4Fe2++O2+4H+⇌4Fe3++2H2O平衡向正反应方向移动;
B.浓硫酸配制反应所需的稀硫酸应该是浓硫酸注入水中;
C.反应中保持n(Fe)/n(H2SO4)>1,铁过量,铁和三价铁反应生成二价铁离子;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子;
(2)①用含有少量Cu、Al的废铁屑制备Fe2(SO4)3,用硫酸溶解后溶液中含有亚铁离子、铜离子和铝离子,加入NaHCO3并搅拌,将混合液pH调控至6.7~7.5,使铜离子和铝离子全部转化为沉淀,而亚铁离子未沉淀;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,根据得失电子守恒和原子守恒书写离子反应方程式;
③一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将反应Ⅱ产生的NO配比一种气体O2,混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染;
(3)三价铁离子具有强氧化性,硫离子具有还原性,发生氧化还原生成硫和硫化亚铁,据此解答;(1)①A.使用浓硫酸与铁屑反应,浓硫酸与铁屑发生钝化,反应停止,故A错误;
B.使用磨细的铁粉反应,增大了反应物的接触面积,反应速率加快,故B正确;
C.控制温度在50~70℃,温度较高,反应速率快,在该温度硫酸亚铁的溶解度最大,利于反应的进行,故C正确;
D.温度越高,硫酸亚铁的溶解度变小,不利于反应的进行,故D错误;
故选:BC;
②A.较浓的硫酸对于4Fe2++O2+4H+⇌4Fe3++2H2O等于增大反应物氢离子的浓度,平衡向生成三价铁离子的方向移动,所以需控制稀硫酸的浓度不能太高,故A正确;
B.浓硫酸的密度比水大,浓硫酸配制反应所需的稀硫酸,应该是浓硫酸注入去O2蒸馏水,否则水进入浓硫酸发生飞溅易发生事故,故B错误;
C.当反应中保持n(Fe)/n(H2SO4)>1时,铁过量,过量的铁和三价铁离子反应Fe+2Fe3+=3Fe2+,可减少产品FeSO4中Fe3+的含量,故C正确;
D.反应中应经常添加Fe2(SO4)3搅拌,引入三价铁离子,增加产品FeSO4中Fe3+的含量,故D错误;
故答案为:A、C;
(2)①用硫酸溶解含有少量Cu、Al的废铁屑,溶液中含有亚铁离子、铜离子和铝离子,根据沉淀与PH之间的关系表可知,当PH等于6.7时,铜离子全部转化为氢氧化铜沉淀,铝离子全部转化为氢氧化铝沉淀,此时亚铁离子为沉淀,当PH大于7.5时,亚铁离子开始沉淀,所以PH在6.7~7.5之间,
故答案为:6.7~7.5;
②氢离子和硝酸根在同一溶液,相当于稀硝酸,亚铁离子具有还原性,酸性溶液中硝酸根离子具有强氧化性,发生氧化还原反应,生成一氧化氮和三价铁离子,二价铁离子变为三价铁离子失去1个电子,硝酸根离子得到三个电子变成一氧化氮,所以亚铁离子和三价铁离子前的系数都为3,再根据原子守恒,该离子反应方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
③反应Ⅱ中需要强氧化性的酸将二价铁离子氧化,一氧化氮有毒,但一氧化氮易与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,总的反应为4NO+3O2+2H2O=4HNO3,将O2和反应Ⅱ产生的NO,按3:4配比混合后重新通入反应Ⅱ中,可节约Fe(NO3)3、防止NO污染,
故答案为:节约Fe(NO3)3、防止NO污染;3:4;
(3)根据信息用Fe2(SO4)3处理含S2-污水时,有淡黄色悬浮物产生的是硫,黑色沉淀是硫化亚铁,根据得失电子守恒,硫离子变为单质硫失去2个电子,三价铁离子变为二价铁,得到1个电子,所以三价铁离子和硫化亚铁前的系数都为2,根据原子守恒,该反应的离子反应方程式为2Fe3++3S2-=2FeS↓+S,
故答案为:2Fe3++3S2-=2FeS↓+S;点评:
本题考点: 硫酸亚铁的制备;化学反应速率的影响因素;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查铁屑与稀硫酸反应制备FeSO4,读懂工艺流程,熟练运用氧化还原反应原理、平衡移动原理是解答的关键,题目难度中等.1年前查看全部
- (2011•晋中三模)已知抛物线的顶点在原点,抛物线的焦点和双曲线x23−y2=1的右焦点重合,则抛物线的方程为____
(2011•晋中三模)已知抛物线的顶点在原点,抛物线的焦点和双曲线
−y2=1的右焦点重合,则抛物线的方程为______.x2 3  无敌床上飞1年前1
无敌床上飞1年前1 -
 贴过海报 共回答了26个问题
贴过海报 共回答了26个问题 |采纳率84.6%解题思路:由双曲线得右焦点坐标,从而可得抛物线的焦点坐标,进而写出抛物线方程.由题意,双曲线
x2
3−y2=1的右焦点为(2,0)
∴抛物线的焦点坐标为(2,0)
设抛物线的方程为:y2=2px(p>0)
∴[p/2]=2,∴p=4,
∴抛物线方程是 y2=8x.
故答案为:y2=8x.点评:
本题考点: 双曲线的简单性质;抛物线的标准方程.
考点点评: 本题考查双曲线的简单性质及抛物线的标准方程,解题的关键是由双曲线的焦点坐标得出抛物线的焦点坐标.属于基础题.1年前查看全部
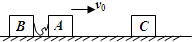
- (2011•晋中三模)质量为m=50kg的物体,在大小恒定水平向左的外力F的作用下,沿粗糙水平面从t=0时刻开始做直线运
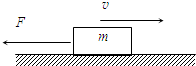 (2011•晋中三模)质量为m=50kg的物体,在大小恒定水平向左的外力F的作用下,沿粗糙水平面从t=0时刻开始做直线运动,如图所示.0时刻物体速度10m/s,方向水平向右,2s末物体速度为零,4s末物体速度2m/s,方向水平向左,g取10m/s2.求:
(2011•晋中三模)质量为m=50kg的物体,在大小恒定水平向左的外力F的作用下,沿粗糙水平面从t=0时刻开始做直线运动,如图所示.0时刻物体速度10m/s,方向水平向右,2s末物体速度为零,4s末物体速度2m/s,方向水平向左,g取10m/s2.求:
(1)物体与水平面间的动摩擦因数.
(2)恒定的水平外力F的大小. kljb1年前1
kljb1年前1 -
 零点感冒 共回答了23个问题
零点感冒 共回答了23个问题 |采纳率87%解题思路:在0~2s内物体向右做匀减速直线运动,在2~4s内物体向左做匀加速直线运动,根据运动学公式求出加速度的大小,根据牛顿第二定律求解物体与水平面间的动摩擦因数和水平外力F.(1)在0~2s内物体做匀减速直线运动,设加速度大小为a1,则有:
a1=
v-v0
t1=[10-0/2]=5m/s2
根据牛顿第二定律得:F+f=ma1
在2~4s内物体做匀加速直线运动,设加速度大小为a2,则有:
a2=
v-v0
t2=
2-0
2m/s2=1m/s2
由牛顿第二定律得:F-f=ma2
又f=μmg
得到 F+μmg=ma1①
F-μmg=ma2②
联立解得 μ=0.2
(2)由F-f=ma2 得
F=ma2+f=ma2+μmg=150N
答:
(1)物体与水平面间的动摩擦因数为0.2.
(2)恒定的水平外力F的大小为150N.点评:
本题考点: 牛顿第二定律;滑动摩擦力.
考点点评: 本题涉及两个运动过程,情景简单,采用程序法按时间顺序进行分析研究.比较容易.1年前查看全部
- (2014•晋中模拟)在电解炼铝过程中加入冰晶石(用“A”)代替,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2A
(2014•晋中模拟)在电解炼铝过程中加入冰晶石(用“A”)代替,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2A+3CO2↑+9H2O.根据题意完成下列填空:
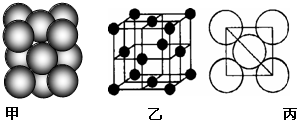
(1)冰晶石的化学式为______,含有离子键、______等化学键
(2)生成物中含有10个电子的分子空间构型为______,中心原子的杂化方式为______
(3)反应物中电负性最大的元素为______(填元素符号),写出其原子最外层的电子排布图______
(4)Al单质的晶体中原子堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置的平面图如图丙所示.若已知Al的原子半径为d,NA代表阿伏加德罗常数.Al的相对原子质量为M.则一个晶胞中Al的原子个数为______;Al晶体的密度为M 4
d3NA2 (用字母表示)M 4
d3NA2  爱犹添翼1年前1
爱犹添翼1年前1 -
 weitiger 共回答了16个问题
weitiger 共回答了16个问题 |采纳率93.8%解题思路:(1)冰晶石是六氟合铝酸钠,化学式Na3AlF6;六氟合铝(Ⅲ)酸根离子中含有配位键;
(2)根据方程式可知生成物10电子的物质是水,依据水分子的空间构型解答;
(3)元素非金属性越强电负性越大,依据F最外层电子排布可画出电子排布图;
(4)依据Al单质的晶体中原子堆积方式图解答.(1)冰晶石的化学式为Na3AlF6,Na+与AlF之间为离子键,而AlF是以配位键形成的;
故答案为:Na3AlF6;配位键;
(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子外含有两对孤对电子,故分子结构为V形;
故答案为:V形; sp3;
(3)F是电负性最大的元素,其最外层电子排布图为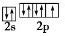 ;
;
故答案为:F; ;
;
(4)铝晶胞的原子处于晶胞顶点和面心,故一个晶胞含有的Al原子数目为6×[1/2]+8×[1/8]=4;设Al晶胞的边长为a,则有:2a2=(4d)2,a=2
2d,Al晶胞的体积为V=16
2d3 ,故Al晶体的密度为
M
4
2d3NA.
故答案为:4;
M
4
2d3NA.点评:
本题考点: 化学键;元素电离能、电负性的含义及应用;判断简单分子或离子的构型;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了化学键,电负性、分子的空间构型,原子轨道的杂化方式、晶胞的计算,题目综合性强,难度大,看清晶胞的示意图是晶胞计算的解题关键.1年前查看全部
- (2011•晋中三模)集合A={x|0<x≤2},B={x||x+1|≥2},则(CRA)∩B=( )
(2011•晋中三模)集合A={x|0<x≤2},B={x||x+1|≥2},则(CRA)∩B=( )
A.(-∞,0)∪(1,+∞)
B.(-∞,-3]∪(2,+∞)
C.(-∞,-3)∪[2,+∞)
D.(-∞,0]∪[1,+∞) 我来骝骝狗1年前1
我来骝骝狗1年前1 -
 可乐加益力多 共回答了18个问题
可乐加益力多 共回答了18个问题 |采纳率94.4%解题思路:利用集合的补集定义求出CRA,求出集合B,再利用两个集合的交集的定义 求出(CRA)∩B.集合A={x|0<x≤2},CRA={x|x≤0或x>2},B={x||x+1|≥2}={x|x≥1或x≤-3},
则(CRA)∩B={x|x≤0或x>2}∩{x|x≥1或x≤-3}={x|x>2或x≤-3},
故选B.点评:
本题考点: 交、并、补集的混合运算.
考点点评: 本题考查集合的表示方法、集合的补集,两个集合的交集的定义和求法,求出CRA是解题的关键.1年前查看全部
- 【古文翻译】义犬《搜神后记》晋中和中,广陵人杨生养一狗.
 旋转的木马05181年前1
旋转的木马05181年前1 -
 xsqlp 共回答了22个问题
xsqlp 共回答了22个问题 |采纳率95.5%晋太和中,广陵人杨生,养一狗,甚爱怜之,行止与俱.后,生饮酒醉,行大泽草中,眠不能动.时方冬月燎原,风势极盛.狗乃周章号唤,生醉不觉.前有一坑水,狗便走往水中,还,以身洒生左右草上.如此数次,周旋跬步,草皆沾湿,火至,免焚.生醒,方见之.尔后,生因暗行,堕于空井中.狗呻吟彻晓.有人经过,怪此狗向井号,往视,见生.生曰:“君可出我,当有厚报.”人曰:“以此狗见与,便当相出.”生曰:“此狗曾活我已死,不得相与.余即无惜.”人曰:“若尔,便不相出.”狗因下头目井.生知其意,乃语路人云,“以狗相与”.人即出之,系之而去.却后五日,狗夜走归.`
晋太和年间,广陵有个姓杨的人,养了一条狗.他特别爱这条狗,无论做什么事情都要带着这狗.一次,这个人喝醉酒后走到一个水洼附近的草地后,就倒地睡着了,无法赶路.当时正赶上冬天有人烧草燎原,当时风很大.与是狗反复不停的叫唤,这个姓杨的人仍旧大醉不醒.狗看到这个人前面有一坑水,于是走到坑里,用自己的身体沾了水后然后抖落在主人身边的草上.就这样反复来回了很多次,狗一点点一点点的移动步子把主人身边的草全都弄湿了.当火燃烧到的时候,因为草湿没有燃烧起来,主人躲过了被火烧的大难.后来姓杨的人醒来,才发现.
后来又有一次,这个人因为在天黑赶路,不小心掉到一空井里.狗叫了整整一个晚上.有人从这里过,很纳闷为什么狗冲着井号叫,过去一看,发现了这个姓杨的.杨生说,你救了我,我一定会好好报答你的.那个人说,如果你把你的狗送给我,我就救你出来.杨生说,这个狗救过我的命,不能赠给你啊.我死活不要紧.那个人说,既然这样,那我就不救你了.这时狗低头看着了看井里,杨生明白了狗的意思,于是给那个路人说,我愿意把狗送给你.那个人于是马上救出了杨生,把狗栓上带走了.过了五天,那只狗夜里逃跑回杨生家来了.1年前查看全部
- (2011•晋中三模)(1)下列关于热现象的说法,正确的是
 (2011•晋中三模)(1)下列关于热现象的说法,正确的是
(2011•晋中三模)(1)下列关于热现象的说法,正确的是
A.外界对物体做功,物体的内能一定增加
B.气体的温度升高,气体的压强一定增大
C.任何条件下,热量都不会由低温物体传递到高温物体
D.任何热机都不可能使燃料释放的热量完全转化为机械能
(2)如图所示,水平放置且内径均匀的两端封闭的细玻璃管内,有h0=6cm长的水银柱,水银柱左右两侧气柱A、B的长分别为20cm和40cm,温度均为27℃,压强均为1.0×105Pa.如果在水银柱中点处开一小孔,然后将两边气体同时加热至57℃,已知大气压强p0=1.0×105 Pa.则管内最后剩下的水银柱长度为多少?
某同学求解如下:
因内外压强相等,两侧气体均做等压变化.
对于A气体:
=LA1 T1
,LA2=LA2 T2
=LA1T2 T1
=22cm330×20 300
对于B气体:
=LB1 T1
,LB2=LB2 T2
=LB1T2 T1
=44cm330×40 300
则剩下水银柱长度L=(LA2+LB2)-(LA1+LB1)-h0.
问:你同意上述解法吗?若同意,求出最后水银的长度;若不同意,则说明理由并求出你认为正确的结果. lty22221年前1
lty22221年前1 -
 xhdada 共回答了19个问题
xhdada 共回答了19个问题 |采纳率94.7%解题思路:(1)解答本题应掌握:做功和热传递均可改变物体的内能;
热量可以自发地从高温物体传到低温物体,但不能自发地从低温物体传到高温物体而不引起其他变化;
气体压强取决于温度及体积.
(2)因内外压强相等,两侧气体均做等压变化,根据气体方程求出加热至57℃时的体积.
但是右端B气体在体积增大到43cm时就与外界连通了,右侧水银已全部溢出,不可能溢出4cm水银,而左侧3cm水银此时只溢出了2cm.(1)A、外界对气体做功,而气体可能同时对外放热,若放出的热量大于外界所做的功,则内能减小,故A错误;
B、气体的温度升高,若同时体积增大,气体的压强不一定增大,故B错误;
C、热量可以由低温物体传到高温物体,但会引起其他的变化,由空调制冷时可以将热量从低温物体传到高温物体,但要消耗电能,故C错误;
D、由热力学第二定律可得,任何热机都会有热量的耗散,即不可能将全部热量完全转化为机械能;故D正确;
(2)不同意
因内外压强相等,两侧气体均做等压变化.
对于A气体:
LA1
T1=
LA2
T2,LA2=
LA1T2
T1=
330×20
300=22cm
对于B气体:
LB1
T1=
LB2
T2,LB2=
LB1T2
T1=
330×40
300=44cm
因为右端B气体在体积增大到43cm时就与外界连通了,右侧水银已全部溢出,不可能溢出4cm水银,而左侧3cm水银此时只溢出了2cm.
所以剩下水银柱的长度△x=(
L′A2+LB2)-(LA1+LB1)-h0=1cm
故答案为:(1)D
(2)不同意,剩下水银柱的长度是1cm.点评:
本题考点: 理想气体的状态方程;热力学第一定律.
考点点评: 热力学第一定律及热力学第二定律为热学中的重点内空,要求能准确理解其内容;同时注意改变内能的方式有做功和热传递两种方式.
热学中很多知识点要需要记忆,注意平时的积累,在平时训练中加强练习.1年前查看全部
- (2011•晋中三模)下面说法正确的是( )
(2011•晋中三模)下面说法正确的是( )
A.命题“∃x∈R,使得x2+x+1≥0”的否定是“∀x∈R,使得x2+x+1≥0”
B.命题“若x2-3x+2=0则x=1”的逆否命题为假命题
C.设p、q为简单命题,若”p∨q”为假命题,则”¬p∧¬q”也为假命题
D.实数x>y是[1/x>
>1 y]成立的充要条件
>1 y],而x=-2,y=-1满足[1/x 1 y],但x>y不成立,从而可判断 A:根据特称命题的否定为全称命题可知,∃x∈R,使得x2+x+1≥0的否定是∀x∈R,使得x2+x+1<0,A错误
B:命题若x2-3x+2=0则x=1为假命题,且互为逆否命题的真假相同可知,逆否命题为假命题,B正确
C:若p∨q为假命题,则可知命题p,q都为假命题,从而¬p,¬q为真命题,¬p∧¬q真命题,C错误
D:x>y,例如x=1,y=-1,但是不满足[1/x>
1
y],而x=-2,y=-1满足[1/x>
1
y],但x>y不成立,即x>y是[1/x>
1
y]成立的既不充分也不必要条件,D错误
故选B点评:
本题考点: 复合命题的真假;四种命题的真假关系;命题的否定.
考点点评: 本题主要考查了充分必要条件的判断的应用,全称命题与特称命题的否定,互为逆否命题的真假关系的应用,复合命题的真假关系的应用.1年前
6可能相似的问题-
1年前1个回答
-
1年前1个回答
-
1年前1个回答
-
1年前1个回答
-
1年前1个回答
-
1年前1个回答
-
1年前1个回答
-
1年前1个回答
你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.057 s. - webmaster@yulucn.com taoooooo1年前0
taoooooo1年前0 -
-
 共回答了个问题
共回答了个问题 |采纳率
- (2011•晋中三模)如图,利用随机模拟的方法可以估计图中由曲线y=x22与两直线x=2及y=0所围成的阴影部分的面积S
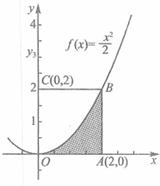 (2011•晋中三模)如图,利用随机模拟的方法可以估计图中由曲线y=
(2011•晋中三模)如图,利用随机模拟的方法可以估计图中由曲线y=
与两直线x=2及y=0所围成的阴影部分的面积S:x2 2
①先产生两组0~1的均匀随机数,a=rand ( ),b=rand ( );
②做变换,令x=2a,y=2b;(3)产生N个点(x,y),并统计满足条件y<
的点(x,y)的个数N1,已知某同学用计算器做模拟试验结果,当N=1000时,N1=332,则据此可估计S的值为______.x2 2  糖罐罐3231年前1
糖罐罐3231年前1 -
 放下_ 共回答了26个问题
放下_ 共回答了26个问题 |采纳率88.5%解题思路:先由计算器做模拟试验结果试验估计,满足条件y<
的点(x,y)的概率,再转化为几何概型的面积类型求解.x2 2 根据题意:满足条件y<
x2
2的点(x,y)的概率是 [332/1000]
矩形的面积为10,设阴影部分的面积为s
则有 [S/4=
332
1000]
∴s=1.328
故答案为:1.328点评:
本题考点: 模拟方法估计概率.
考点点评: 本题主要考查模拟方法估计概率以及几何概型中面积类型,将两者建立关系,引入方程思想.1年前查看全部
- (2011•晋中三模)(1)下列说法中正确的是:
 (2011•晋中三模)(1)下列说法中正确的是:
(2011•晋中三模)(1)下列说法中正确的是:
A.氢原子吸收一个光子跃迁到激发态后,在向低能级跃迁时放出光子的频率一定等于入射光子的频率
B.
Th(钍)核衰变为23490
Pa(镤)核时,衰变前Th核质量等于衰变后Pa核与β粒子的总质量23491
C.α粒子散射实验的结果证明原子核是质子和中子组成的
D.分别用X射线和绿光照射同一金属表面都能发生光电效应,则用X射线照射时光电子的最大初动能较大
(2)如图所示,A、B、C三物块质量均为m,静止于光滑水平台面上,A、B间用一不可伸长的轻短细线相连.初始时刻细线处于松弛状态,C位于A右侧较远处.现突然给A一瞬时冲量,使A以初速度v0沿A、C连线方向向C运动.A与C相碰后,粘合在一起.求:
①A与C粘合在一起时的速度;
②若将A、B、C看成一个系统,则从A开始运动到A与C刚好粘合完成的过程中系统损失的机械能. 卡卡茜1年前1
卡卡茜1年前1 -
 七合 共回答了21个问题
七合 共回答了21个问题 |采纳率90.5%解题思路:(1)正确解答该题需要掌握:明确氢原子放出光子种类和能级之间的关系,核反应过程伴随着质量亏损,亏损质量转化为能量,α粒子散射实验现象以及物理意义,根据光电效应方程讨论光子最大初动能和入射光频率之间的关系.
(2)碰撞过程中动量守恒,根据动量守恒和能量关系列方程可正确解答.(1)A、氢原子在像低能级跃迁过程中可能放出多种频率的光子,因此放出光子的频率不一定等于入射光子的频,故A错误;B、核反应过程中质量数守恒但是质量不守恒,伴随着质量亏损,故B错误;C、α粒子散射实验的结果证...
点评:
本题考点: 动量守恒定律;机械能守恒定律;氢原子的能级公式和跃迁.
考点点评: 选修的内容考查的知识点很广但不深,把课标上要求识记和理解的知识点记牢即可,应用也是最简单的应用.1年前查看全部
- (2011•晋中三模)去冬以来,我国北方持续干旱,为此,农业专家建议尽快发展高能抗旱保水剂.保水剂是一种强吸水树脂,能在
(2011•晋中三模)去冬以来,我国北方持续干旱,为此,农业专家建议尽快发展高能抗旱保水剂.保水剂是一种强吸水树脂,能在短时间内吸收自身重量几百倍至上千倍的水分.聚丙烯酸钠就是一种高吸水性树脂.下面是丙烯合成聚丙烯酸钠的化工流程:
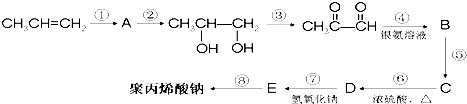
请回答下列问题:
(1)上述反应中属于加成反应的有①⑤①⑤,反应⑧的反应类型为聚合反应聚合反应;
(2)写出A的结构简式CH3CHBrCH2BrCH3CHBrCH2Br,D中的官能团有碳碳双键、羧基碳碳双键、羧基;
(3)F是D的同分异构体,F能发生银镜反应,且核磁共振氢谱上只有两种峰,强度比为1:1,写出F的结构简式OHCCH2CHOOHCCH2CHO;
(4)写出下列反应的化学方程式:②CH3CHBrCH2Br+2NaOH
CH3CH(OH)CH2OH+2NaBrCH3CHBrCH2Br+2NaOH水 △
CH3CH(OH)CH2OH+2NaBr.⑧nCH2=CHCOONa水 △ 催化剂 △ 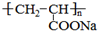 nCH2=CHCOONa
nCH2=CHCOONa催化剂 △ 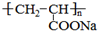 .
.  flutephemera1年前1
flutephemera1年前1 -
 s5484444 共回答了14个问题
s5484444 共回答了14个问题 |采纳率85.7%由合成流程可知,反应①为丙烯发生加成反应生成A,若试剂为Br2,则A为CH3CHBrCH2Br,反应②为碱溶液中的水解反应,反应③为氧化反应,反应④发生银镜反应,-CHO被氧化为羧酸,则B为CH3COCOOH.反应⑧为E发生加聚反应生成聚丙烯酸钠,则E为CH2=CHCOONa,逆推可知反应⑦为中和反应,则D为CH2=CHCOOH,结合B→C→D转化,反应⑤为B与氢气的加成反应生成C,反应⑥为C发生消去反应生成D,则C为CH3C(HO)HCOOH,
(1)由上述分析可知,反应①⑤为加成反应,反应⑧为加聚反应,
故答案为:①⑤;聚合反应;
(2)由上述分析可知,A为CH3CHBrCH2Br,D为CH2=CHCOOH,含有碳碳双键、羧基,
故答案为:CH3CHBrCH2Br;碳碳双键、羧基;
(3)D为CH2=CHCOOH,F是D的同分异构体,F能发生银镜反应,含有-CHO,且核磁共振氢谱上只有两种峰,强度比为1:1,F分子有两种H原子且各有2个,应含有2个-CHO,F的结构简式为:OHCCH2CHO,
故答案为:OHCCH2CHO;
(4)反应②是CH3CHBrCH2Br发生水解反应生成CH3CH(OH)CH2OH,反应方程式为:CH3CHBrCH2Br+2NaOH
水
△CH3CH(OH)CH2OH+2NaBr,
反应⑧的方程式为:nCH2=CHCOONa
催化剂
△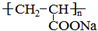 ,
,
故答案为:CH3CHBrCH2Br+2NaOH
水
△CH3CH(OH)CH2OH+2NaBr;nCH2=CHCOONa
催化剂
△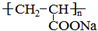 .
1年前查看全部
.
1年前查看全部
- (2014•晋中模拟)常温下,有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO
(2014•晋中模拟)常温下,有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
A.四种溶液的pH的大小顺序:①>④>③>②
B.将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3•H2O)
C.向溶液①、②中分别滴加25mL 0.1mol/L盐酸后,溶液中c(NH4+):①>②
D.将溶液③、④等体积混合所得溶液中:2 c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) 若隐的蓝1年前1
若隐的蓝1年前1 -
 单眼皮猪219129 共回答了23个问题
单眼皮猪219129 共回答了23个问题 |采纳率91.3%解题思路:A.碳酸根离子水解程度远远大于碳酸氢根离子,相同浓度的钠盐溶液,酸根离子水解程度越大,其盐溶液pH越大;
B.将溶液①、②等体积混合,二者恰好反应生成碳酸钠、碳酸铵,铵根离子水解程度较小;
C.向溶液①、②中分别滴加25mL 0.1mol/L盐酸后,①中的溶质是氯化铵、②中的溶质是HCl和氯化铵,氢离子抑制铵根离子水解;
D.将溶液③、④等体积混合所得溶液存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.A.相同浓度的钠盐溶液,酸根离子水解程度越大,其盐溶液pH越大,碳酸根离子水解程度远远大于碳酸氢根离子,所以pH④<③,故A错误;
B.将溶液①、②等体积混合,二者恰好反应生成碳酸钠、碳酸铵,铵根离子水解程度较小,所以溶液中存在c(NH4+)>c(NH3•H2O),故B错误;
C.向溶液①、②中分别滴加25mL 0.1mol/L盐酸后,①中的溶质是氯化铵、②中的溶质是HCl和氯化铵,氢离子抑制铵根离子水解,所以溶液中c(NH4+):①<②,故C错误;
D.将溶液③、④等体积混合所得溶液存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据物料守恒得2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-),所以得2 c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-),故D正确;
故选D.点评:
本题考点: 离子浓度大小的比较;盐类水解的应用.
考点点评: 本题考查了离子浓度大小比较,根据溶液中的溶质、溶液的酸碱性再结合电荷守恒、物料守恒来分析解答,易错选项是D,注意其物料守恒中钠离子和含有碳元素的微粒之间的比值,为易错点.1年前查看全部
- (2011•晋中三模)A~J是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉
(2011•晋中三模)A~J是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作杀菌消毒剂.
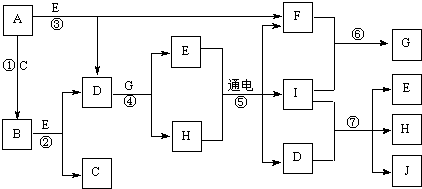
(1)写出B的电子式______.
(2)写出反应⑤的化学方程式:2NaCl+2H2O
2NaOH+Cl2↑+H2↑电解 .2NaCl+2H2O.
2NaOH+Cl2↑+H2↑电解 .
(3)写出反应⑦的离子方程式:______.
(4)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:______.
(5)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则______极(填“阴”或“阳”)附近溶液先由无色变为红色,请说明理由:______. 这个夏季真yy1年前1
这个夏季真yy1年前1 -
 找青天 共回答了20个问题
找青天 共回答了20个问题 |采纳率90%解题思路:常温下A为固体单质,B为淡黄色粉末,C是气体,A和C反应生成B,则B是过氧化钠,A是钠,C是氧气;E在常温下为液体,E是水,钠和水反应生成 氢氧化钠和氢气,过氧化钠和水反应生成氢氧化钠和氧气,C是氧气,D是氢氧化钠,F是氢气;
H的水溶液通电生成氢气、I气体和氢氧化钠,且J可作杀菌消毒剂,为次氯酸盐,所以I是氯气,电解饱和食盐水制取氯气,所以H是氯化钠,氢气和氯气反应生成G,所以G是氯化氢;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以J是次氯酸钠;
根据反应物和产物写出相应的化学方程式或离子方程式,溶液中氢氧根离子浓度大于氢离子浓度导致溶液呈碱性,酚酞遇碱性溶液变红色.常温下A为固体单质,B为淡黄色粉末,C是气体,A和C反应生成B,则B是过氧化钠,A是钠,C是氧气;E在常温下为液体,E是水,钠和水反应生成 氢氧化钠和氢气,过氧化钠和水反应生成氢氧化钠和氧气,C是氧气,D是氢氧化钠,F是氢气;H的水溶液通电生成氢气、I气体和氢氧化钠,且J可作杀菌消毒剂,为次氯酸盐,所以I是氯气,电解饱和食盐水制取氯气,所以H是氯化钠,氢气和氯气反应生成G,所以G是氯化氢;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以J是次氯酸钠.
(1)通过以上分析知,B是过氧化钠,电子式为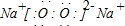 ,故答案为:
,故答案为: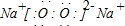 ;
;
(2)电解饱和氯化钠溶液生成氯气、氢气和氢氧化钠,电解方程式为:2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑;
(3)氯气和强碱反应生成氯化物、次氯酸盐和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)过氧化钠和水反应生成氢氧化钠和氧气,少量氢氧化钠和氯化铝反应生成氢氧化铝和氯化钠,反应方程式为:
6Na2O2+4AlCl3+6H2O=4Al(OH)3↓+12NaCl+3O2↑,故答案为:6Na2O2+4AlCl3+6H2O=4Al(OH)3↓+12NaCl+3O2↑;
(5)电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,在阴极氢离子不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中氢氧根离子浓度大于氢离子浓度,所以阴极附近溶液变红,
故答案为:阴;在阴极氢离子不断放电,破坏了水的电离平衡,促使水继续电离,导致溶液中氢氧根离子浓度大于氢离子浓度,所以阴极附近溶液变红.点评:
本题考点: 无机物的推断.
考点点评: 本题考查元素化合物的特性和反应,用框图设问可以考查学生正向思维、逆向思维、发散和收敛思维,能根据题眼正确判断化合物是解本题的关键,本题的题眼为“B为淡黄色粉末,E在常温下为液体”,据此.展开判断即可分析解答本题,难度较大1年前查看全部
- (2011•晋中三模)已知函数f(x)=|x-3|-2,g(x)=-|x+1|+4.
(2011•晋中三模)已知函数f(x)=|x-3|-2,g(x)=-|x+1|+4.
(1)若函数f(x)得值不大于1,求x得取值范围;
(2)若不等式f(x)-g(x)≥m+1的解集为R,求m的取值范围. 苤鲱1年前1
苤鲱1年前1 -
 niu666 共回答了16个问题
niu666 共回答了16个问题 |采纳率93.8%解题思路:(1)不等式先化为|x-3|≤3,再去掉绝对值化为-3≤x-3≤3,从而得到解集.
(2)由题意得 不等式|x-3|+|x+1|-6≥m+1恒成立,故左边的最小值大于或等于m+1,问题化为求左边
的最小值,利用绝对值不等式的性质可得左边的最小值.(1)由题意知,|x-3|-2≤1,即|x-3|≤3,-3≤x-3≤3,0≤x≤6,
∴x得取值范围是[0,6].
(2)由题意得 不等式f(x)-g(x)≥m+1恒成立,即|x-3|+|x+1|-6≥m+1 恒成立.
∵|x-3|+|x+1|-6≥|(x-3)-(x+1)|-6=-2,∴-2≥m+1,∴m≤-3,
故m的取值范围 (-∞,-3].点评:
本题考点: 绝对值不等式的解法.
考点点评: 本题考查绝对值不等式的解法,以及绝对值不等式的性质的应用,体现了转化的数学思想,属于中档题.1年前查看全部
- (2011•晋中三模)工业生产纯碱的工艺流程示意图如下:
(2011•晋中三模)工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)沉淀剂A来源于石灰窑厂,写出A、B的化学式.A______B______
(2)实验室提纯粗盐的实验操作依次为:取样、______、沉淀、______、______.
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象______.碳酸化时没有析出碳酸钠晶体,其原因是______.
(4)碳酸化后过滤,滤液D最主要的成分是______(填写化学式),检验这一成分的阴离子的具体方法:______.
(5)向滤液D中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有______(填a、b、c字母).这样做使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______ 的循环,这就是有名的侯氏制碱法.
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(6)产品纯碱中含有碳酸氢钠.如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
(m1为加热前纯碱的质量,m2为加热后的质量)84(m1−m2) 31m1 (注明你的表达式中所用的有关符号的含义)
(m1为加热前纯碱的质量,m2为加热后的质量)84(m1−m2) 31m1  章贝儿1年前1
章贝儿1年前1 -
 何伦广 共回答了16个问题
何伦广 共回答了16个问题 |采纳率93.8%解题思路:(1)加入试剂除去粗盐中的杂质;
(2)根据实验室提纯粗盐的整个操作过程来回答;
(3)根据碳酸氢钠的溶解度小于碳酸钠;
(4)根据题意知道通入二氧化碳后主要发生复分解反应结合质量守恒定律得知溶液中主要是NH4Cl来回答;根据氯离子的检验方法;
(5)滤液D最主要的成分是NH4Cl,通氨气,能促进晶体析出;
(6)根据碳酸氢钠受热易分解和碳酸钠受热稳定的性质来回答.(1)加入试剂除去粗盐中的杂质镁离子等,所以A、B的化学式为Ca(OH)2;Na2CO3;故答案为:Ca(OH)2;Na2CO3;
(2)实验室提纯粗盐的整个操作过程为:取样、溶解、沉淀、过滤、蒸发、冷却结晶、过滤、烘干几步,故答案为:溶解;过滤;蒸发结晶;
(3)纯碱生产中碳酸化时,会看到溶液中析出碳酸氢钠晶体,这是由于碳酸钠的溶解度大于碳酸氢钠,
故答案为:有晶体析出;碳酸钠溶解度比碳酸氢钠大;
(4)根据操作过程,氨化后通入二氧化碳的溶液发生复分解反应:H2O+CO2+NH3+NaCl=NaHCO3+NH4Cl,最终得到NH4Cl还有NaHCO3等,碳酸氢钠溶解度很小而结晶,故酸化后滤液的主要成分为:NH4Cl;检验其中的氯离子时,要经过取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子,
故答案为:NH4Cl;取少量滤液,先加硝酸酸化,再滴加硝酸银溶液,有白色沉淀,该阴离子是氯离子;
(5)滤液D最主要的成分是NH4Cl,通氨气,增大NH4+的浓度,使NH4Cl更多地析出,溶液中剩余的氯化钠重新利用;
故答案为:a;析出NH4Cl后的母液重新氨化;
(6)假设加热前纯碱的质量为m1,加热后的质量为m2,则加热损失的质量为:m1-m2,故纯碱中含有的碳酸氢钠的质量分数为
84(m1−m2)
31m1(m1为加热前纯碱的质量,m2为加热后的质量),故答案为:
84(m1−m2)
31m1(m1为加热前纯碱的质量,m2为加热后的质量).点评:
本题考点: 纯碱工业(侯氏制碱法);物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题以工业生产纯碱的工艺流程为背景,考查了物质的提纯、化学实验基本操作、实验结果的处理等知识,难度中等.1年前查看全部
- (2011•晋中三模)如图,已知直四棱柱ABCD-A1B1C1D1的底面是直角梯形,AB⊥BC,AB∥CD,E,F分别是
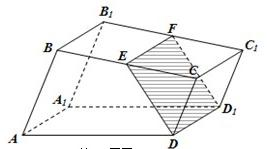 (2011•晋中三模)如图,已知直四棱柱ABCD-A1B1C1D1的底面是直角梯形,AB⊥BC,AB∥CD,E,F分别是棱BC,B1C1上的动点,且EF∥CC1,CD=DD1=1,AB=2,BC=3.
(2011•晋中三模)如图,已知直四棱柱ABCD-A1B1C1D1的底面是直角梯形,AB⊥BC,AB∥CD,E,F分别是棱BC,B1C1上的动点,且EF∥CC1,CD=DD1=1,AB=2,BC=3.
(Ⅰ)证明:无论点E怎样运动,四边形EFD1D都为矩形;
(Ⅱ)当EC=1时,求几何体A-EFD1D的体积. yvvone1年前0
yvvone1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列说法有误的一项是A《荷花淀》是孙犁短篇小说的代表作B孙犁的小说多描写晋中农村生活和斗争C孙犁的作品以明快流畅的笔调,
下列说法有误的一项是a《荷花淀》是孙犁短篇小说的代表作b孙犁的小说多描写晋中农村生活和斗争c孙犁的作品以明快流畅的笔调,优雅隽永的风格,在***现代文坛上独树一帜d孙犁是白洋淀派的***(d对了,
 愁容筋斗人1年前1
愁容筋斗人1年前1 -
 innocent2004 共回答了20个问题
innocent2004 共回答了20个问题 |采纳率85%B错,他写的是河北一块的农村斗争生活,1年前查看全部
- (2011•晋中三模)下列关于有机物的说法中,正确的一组是 ( )
(2011•晋中三模)下列关于有机物的说法中,正确的一组是 ( )
①淀粉、油脂、蛋白质在一定条件下都能发生水解反应
②“乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物
③除去乙酸乙酯中残留的乙酸,可加过量饱和Na2CO3溶液振荡后,静置分液
④石油的分馏、裂化和煤的干馏都是化学变化
⑤淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
⑥塑料、橡胶和纤维都是合成高分子材料.
A.①③⑤
B.②④⑥
C.①②⑤
D.③④⑥ 快速的脚1年前1
快速的脚1年前1 -
 宿命000 共回答了26个问题
宿命000 共回答了26个问题 |采纳率88.5%解题思路:①根据淀粉、油脂、蛋白质的性质分析;
②根据乙醇汽油的成分判断;
③根据乙酸乙酯和乙酸的性质分析;
④化学变化是有新物质生成;
⑤根据淀粉和葡萄糖的性质分析;
⑥天然高分子化合物有淀粉、纤维素和蛋白质.①淀粉、油脂、蛋白质都是有小分子物质经过化学反应形成的,所以能水解,故正确.
②乙醇汽油是一种由粮食及各种植物纤维加工成的燃料乙醇和普通汽油按一定比例混配形成的新型替代能源,所以是混合物,故错误.
③乙酸乙酯不溶于饱和碳酸钠,乙酸的酸性比碳酸强,能与碳酸钠反应生成二氧化碳而被吸收,然后分液可得到纯净的乙酸乙酯,故正确.
④石油的分馏没有新物质生成,属于物理变化,煤的干馏有新物质生成属于化学变化,故错误.
⑤碘遇淀粉变蓝色是碘的特性,葡萄糖含有醛基所以能和新制得的氢氧化铜反应生成醛,故正确.
⑥纤维素属于天然高分子化合物,故错误.
故选A.点评:
本题考点: 氨基酸、蛋白质的结构和性质特点;石油的分馏产品和用途;煤的干馏和综合利用;乙酸的化学性质;淀粉的性质和用途;合成材料.
考点点评: 本题考查了有机化合物的性质,难度不大,注意煤的干馏和石油的分馏的区别.1年前查看全部
- (2011•晋中三模)等差数列an中,若a1,a2011为方程x2-10x+16=0的两根,则a2+a1006+a201
(2011•晋中三模)等差数列an中,若a1,a2011为方程x2-10x+16=0的两根,则a2+a1006+a2010等于( )
A.10
B.15
C.20
D.40 dyppyd1年前1
dyppyd1年前1 -
 ee浩 共回答了15个问题
ee浩 共回答了15个问题 |采纳率100%解题思路:根据韦达定理可知a1+a2011的值,进而根据等差中项的性质可求得a2+a2010和a1006的值代入a2+a1006+a2010即可求得答案.∵a1,a2011为方程x2-10x+16=0的两根,
∴a1+a2011=10
∴a2+a1006+a2010=a1+a2011+
a1+a2011
2=15
故选B点评:
本题考点: 等差数列的性质;一元二次方程的根的分布与系数的关系.
考点点评: 本题主要考查了等差数列的性质和一元二次方程的根的分布与系数的关系.等差中项是等差数列中的重要性质,应作为重点掌握.1年前查看全部
大家在问
- 1一又二分之一*一又三分之一*一又四分之一*...*一又一百分之一
- 2(2011•岳池县模拟)某工厂计划为旅游区翠湖生产A、B两种型号的旅游船共150只,以解决1000人同时游玩的问题.现有
- 3根据所给单词写作文(注意情景和时态)
- 4(2014•句容市一模)如图,直角坐标系中,以点A(1,0)为圆心画圆,点M(4,4)在⊙A上,直线y=-[3/4]x+
- 5[x]为不超过实数x的最大整数,若数列an=3[[20144n]的前n项和为Sn,则S2014=( )
- 6英语翻译However,as winter holidays in the Alps became more and m
- 7体育课上在做迎体向上时,同学们用力向下拉单杠,为什么人体却向上运动呢?
- 8英文 肥皂剧令人厌烦soap operas () ()
- 9描写梅花的古诗表达了怎样的思想感情
- 10歇后语------- ㈠早开的红梅-------- ㈡王羲之写字-------- ㈢和尚打伞---------- ㈣画蛇
- 11什么是开仓、平仓?
- 12请问“梅花香自苦寒来”是出自哪一首诗的呢?
- 13如图是某物理兴趣小组的同学连接的家庭电路断开开关,灯不亮,用电压表测开关两端的电压为______V.若站在地上的人不小心
- 14已知函数f(x)=mx²+(m-3)x+1与x轴的交点至少有一个在原点的右侧,求实数m的取值范围
- 15杨志失陷生辰纲之后,路遇好汉_______,一同落草二龙山



