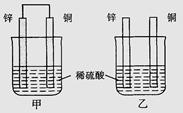
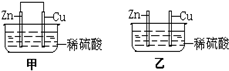
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
 B丢丢2022-10-04 11:39:541条回答
B丢丢2022-10-04 11:39:541条回答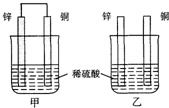 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )A.若要实现反应Cu+H2SO4→CuSO4+H2↑,则必须选用甲装置
B.甲中铜片是阳极,锌片是阴极
C.两烧杯中溶液的pH均增大
D.乙中产生气泡的物质表面与甲相同

已提交,审核后显示!提交回复
共1条回复
 lancel1982 共回答了15个问题
lancel1982 共回答了15个问题 |采纳率73.3%- 解题思路:A.铜和稀硫酸不反应,不能设计成原电池;
B.原电池中电极是正负极而不是阴阳极;
C.氢离子得电子生成氢气,导致溶液中氢离子浓度减小;
D.甲中铜片上氢离子得电子生成氢气,乙中锌片上氢离子得电子生成氢气.A.铜和稀硫酸不能自发的进行氧化还原反应,所以不能设计成原电池,可以设计成电解池,故A错误;
B.甲装置能将化学能转化为电能,属于原电池,锌易失电子作负极,铜作正极,故B错误;
C.甲、乙装置中氢离子都得电子生成氢气,所以溶液中氢离子浓度都减小,溶液的pH都增大,故C正确;
D.甲装置是原电池,锌作负极、铜作正极,正极铜上氢离子得电子生成氢气,乙中锌和氢离子直接发生氧化还原反应生成氢气,锌上有气泡生成,所以乙中产生气泡的物质表面与甲不同,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,根据原电池反应特点、电极名称、电极反应式来分析解答,注意:原电池反应必须是自发进行的放热的氧化还原反应,否则不能设计成原电池,易错选项是A,该反应不能自发进行,所以不能设计成原电池,为易错点. - 1年前
相关推荐
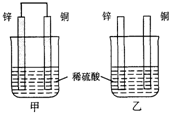
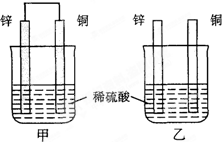
- 将纯锌片和纯铜片按下图所示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( ) A.两烧杯中铜片表面均无气泡产生
将纯锌片和纯铜片按下图所示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( ) A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极 C.两烧杯中溶液的pH均增大 D.产生气泡的速度甲比乙慢 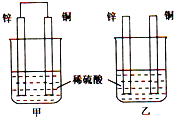
 lazyones1年前1
lazyones1年前1 -
 东坡豆腐 共回答了17个问题
东坡豆腐 共回答了17个问题 |采纳率88.2%A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H + 在铜极上得电子,生成H 2 ,所以甲中铜片表面有气泡产生,故A错误;
B、乙中不构成原电池,铜片不是电极,故B错误;
C、甲乙两烧杯反应的总方程式都为Zn+H 2 SO 4 =ZnSO 4 +H 2 ↑,溶液中硫酸的浓度降低,溶液的PH增大,故C正确;
D、原电池能加快反应速率,故产生气泡的速度甲比乙快,故D错误.
故选C.1年前查看全部
- 将纯锌片和纯铜片按图所示插入稀硫酸中,以下有关叙述中正确的是 [
将纯锌片和纯铜片按图所示插入稀硫酸中,以下有关叙述中正确的是 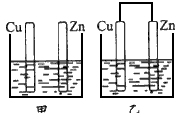 [ ]
[ ]A.两装置中铜片表面都有气泡产生
B.乙装置中化学能转化为电能,甲装置中没有能量转化
C.两装置中铜片附近SO 4 2- 浓度都增大
D.两装置中发生的总反应相同 狂狗1年前1
狂狗1年前1 -
 不惑之间 共回答了16个问题
不惑之间 共回答了16个问题 |采纳率81.3%D1年前查看全部
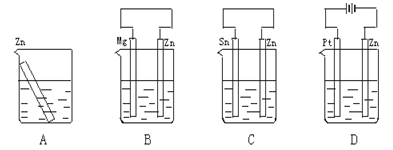
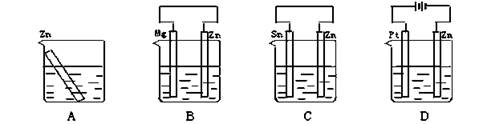
- 图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最快的是
 田达1年前1
田达1年前1 -
 gisele-peng 共回答了19个问题
gisele-peng 共回答了19个问题 |采纳率100%BD不腐蚀,A是与酸反应,C构成原电池,腐蚀最快1年前查看全部
- 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,下列说法正确的是( )
将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,下列说法正确的是( )
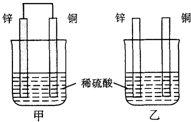
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上有气泡冒出
C.甲中铜片质量减少、乙中锌片质量减少
D.甲中电流由铜片沿导线流向锌片 聪聪猫1年前1
聪聪猫1年前1 -
 qiu1125 共回答了18个问题
qiu1125 共回答了18个问题 |采纳率88.9%解题思路:先判断甲、乙分别属于什么装置,然后再根据原电池的定义、工作原理判断.根据原电池的构成条件判断,甲是原电池,乙不是原电池.
A、甲是原电池,乙不是原电池,所以甲是把化学能转变为电能的装置,乙不是,故A错误.
B、乙中锌片上有气泡冒出,故B错误.
C、甲、乙中锌片质量都减少,故C 错误.
D、甲中电流由铜片沿导线流向锌片,电子由锌片沿导线流向铜片,故D正确.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 原电池的构成条件:
1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;
2、电极均需插入电解质溶液中;
3、两极相互连接(或接触);
4、能自发地发生氧化还原反应.1年前查看全部
- 将纯锌片和纯铜片按右图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
将纯锌片和纯铜片按右图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极 C.两烧杯中溶液的pH均增大 D.甲、乙溶液均变蓝  dsdaa1年前1
dsdaa1年前1 -
 rwwrw 共回答了22个问题
rwwrw 共回答了22个问题 |采纳率90.9%C
1年前查看全部
- 将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,电极反应:2H + +2e→H 2 ↑;乙中锌片是负极, 电极反应:Zn-2e→Zn 2+ C.两烧杯中的pH值均增大 D.产生的气泡速率甲比乙慢  琴LIU1年前1
琴LIU1年前1 -
 童祭 共回答了16个问题
童祭 共回答了16个问题 |采纳率93.8%C
1年前查看全部
- 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快 香山好1年前1
香山好1年前1 -
 ycgawj 共回答了17个问题
ycgawj 共回答了17个问题 |采纳率94.1%解题思路:甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.乙中不构成原电池,铜片不是电极,故B错误;
C.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,溶液的pH值都增大,故C错误;
D.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.1年前查看全部
- 分别放置在图4—10所示装置(都盛有0.1 mol·L - 1 的H 2 SO 4 溶液)中的四个相同的纯锌片,腐蚀最慢
分别放置在图4—10所示装置(都盛有0.1 mol·L - 1 的H 2 SO 4 溶液)中的四个相同的纯锌片,腐蚀最慢的是
 kosmic1年前1
kosmic1年前1 -
 翘翘睫毛 共回答了18个问题
翘翘睫毛 共回答了18个问题 |采纳率88.9%D
腐蚀的速率电解阳极>原电池负极>普通化学腐蚀>原电池正极>电解阴极;D中锌为阴极,腐蚀最慢。1年前查看全部
- (2010•乐山一模)将纯锌片和纯铜片按如图所示方式插入同浓度的稀H2SO4中一段时间,以下叙述正确的是( )
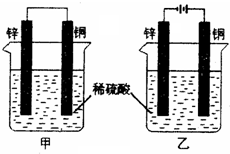 (2010•乐山一模)将纯锌片和纯铜片按如图所示方式插入同浓度的稀H2SO4中一段时间,以下叙述正确的是( )
(2010•乐山一模)将纯锌片和纯铜片按如图所示方式插入同浓度的稀H2SO4中一段时间,以下叙述正确的是( )
A.两烧杯中铜片均有气泡产生
B.两烧杯中溶液的pH均增大
C.甲中铜片是正极,乙中铜片是负极
D.甲中的锌比乙中的锌腐蚀慢 志村五郎1年前1
志村五郎1年前1 -
 新鲜的桔汁 共回答了19个问题
新鲜的桔汁 共回答了19个问题 |采纳率100%解题思路:由图可知,甲为原电池,Zn为负极,Cu为正极,负极上Zn失去电子,正极上氢离子得到电子生成氢气;乙为电解池,Cu为阳极,失去电子,Zn为阴极,氢离子得到电子生成氢气,以此来解答.由图可知,甲为原电池,Zn为负极,Cu为正极,负极上Zn失去电子,正极上氢离子得到电子生成氢气;
乙为电解池,Cu为阳极,失去电子,Zn为阴极,氢离子得到电子生成氢气,
A.甲中Cu片上有气泡,乙中Zn片有气泡,故A错误;
B.两烧杯中氢离子均得到电子生成氢气,氢氧根离子浓度变大,则两烧杯中溶液的pH均增大,故B正确;
C.甲中Cu为正极,乙中Cu为阳极,故C错误;
D.甲中Zn失去电子被腐蚀,乙中阴极被保护,则甲中的锌比乙中的锌腐蚀快,故D错误;
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池和电解池,把握原电池和电解池的工作原理为解答的关键,注意电极判断和发生的电极反应,题目难度不大.1年前查看全部
- 分别放置下图所示装置(都盛有0.1 mol·L -1 的H 2 SO 4 溶液)中的四个相同的纯锌片,腐蚀
分别放置下图所示装置(都盛有0.1 mol·L -1 的H 2 SO 4 溶液)中的四个相同的纯锌片,腐蚀最慢的是()
 HNQM3211年前1
HNQM3211年前1 -
 电风该 共回答了21个问题
电风该 共回答了21个问题 |采纳率95.2%C
1年前查看全部
- 将纯锌片和纯铜片按图示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按图示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )
 A. 两烧杯中铜片表面均无气泡产生
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 产生气泡的速度甲比乙慢 slk19841年前3
slk19841年前3 -
 ntlzs 共回答了25个问题
ntlzs 共回答了25个问题 |采纳率92%解题思路:甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑,原电池的构成加快了反应速率.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B、乙中不构成原电池,铜片不是电极,故B错误;
C、甲乙两烧杯反应的总方程式都为Zn+H2SO4=ZnSO4+H2↑,溶液中硫酸的浓度降低,溶液的PH增大,故C正确;
D、原电池能加快反应速率,故产生气泡的速度甲比乙快,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.1年前查看全部
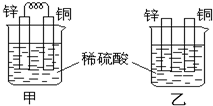
- 将纯锌片和纯铜片按如图方式插入100ml相同浓度的稀硫酸中一段时间,请回答下列问题:
 将纯锌片和纯铜片按如图方式插入100ml相同浓度的稀硫酸中一段时间,请回答下列问题:
将纯锌片和纯铜片按如图方式插入100ml相同浓度的稀硫酸中一段时间,请回答下列问题:
(1)下列说法正确的是______.
A、甲、乙均为化学能转变为电能的装置
B、乙中铜片上没有明显变化
C、甲中铜片质量减少、乙中锌片质量减少
D、两烧杯中溶液的pH均增大
(2)在相同时间内,两烧杯中产生气泡的速度:甲______乙(填“>”、“<“或“=”).
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子为______ mol.
(4)这时,甲中负极发生氧化反应,溶解了______ g. 我不懂也不羞1年前1
我不懂也不羞1年前1 -
 secondcoming 共回答了20个问题
secondcoming 共回答了20个问题 |采纳率90%解题思路:(1)甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
(2)作原电池负极的金属加速被腐蚀;
(3)根据氢气和转移电子之间的关系式计算;
(4)根据甲中氢气和锌之间的关系式计算.(1)A、甲符合原电池构成条件,所以属于原电池,乙不能构成闭合回路,所以不能构成原电池,故A错误;
B、乙不能构成原电池,氢离子在锌片上得电子发生还原反应,所以乙中铜片上没有明显变化,故B正确;
C、甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减少,故C错误;
D、两烧杯中锌和氢离子发生置换反应导致溶液中氢离子浓度减小,所以溶液的pH均增大,故D正确;
故选:BD;
(2)甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙,故答案为:>;
(3)甲中,铜电极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,根据电极反应式知,通过电子的物质的量=
1.12L
22.4L/mol×2=0.1mol,
故答案为:0.1;
(4)甲中负极锌上电极反应式为Zn-2e-=Zn2+,正极电极反应式为2H++2e-=H2↑,根据锌和氢气之间的关系式知,溶解锌的质量=
1.12L
22.4L/mol×2
2×65g/mol=3.25g,
故答案为:3.25.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,明确正负极上发生的电极反应是解本题关键,根据电极反应式来分析解答即可,难度不大.1年前查看全部
- 将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中一段时间,以下叙述正确的是( ) A.两烧杯中铜片表面均无气泡产生
将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中一段时间,以下叙述正确的是( ) A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极 C.两烧杯的溶液中H + 浓度均减小 D.乙装置中化学能转化为电能 
 devil1260071年前1
devil1260071年前1 -
 oxuf 共回答了14个问题
oxuf 共回答了14个问题 |采纳率100%A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H + 在铜极上得电子,生成H 2 ,所以甲中铜片表面有气泡产生,故A错误;
B、乙中不构成原电池,铜片不是电极,故B错误;
C、甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故C正确.
D、乙装置中没有形成闭合回路,不能构成原电池,所以乙装置中不是化学能转化为电能,故D错误.
故选C.1年前查看全部
- 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()
A.两烧杯中铜片表面均有气泡产生 B.甲烧杯中的电流与阳离子流向均为Zn→Cu C.两烧杯中溶液的pH均增大 D.两烧杯在相同时间内转移电子数相等  wanglei74951年前1
wanglei74951年前1 -
 jinqing 共回答了25个问题
jinqing 共回答了25个问题 |采纳率96%C
1年前查看全部
- 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是______.
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
(2)在相同时间内,两烧杯中产生气泡的速度:甲______乙(填“>”、“<“或“=”).
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为______.
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H + )=0.1mol•L -1 (设反应前后溶液体积不变).试确定原稀硫酸的物质的量浓度为______.
 gzxycxm1年前1
gzxycxm1年前1 -
 love512zm 共回答了13个问题
love512zm 共回答了13个问题 |采纳率84.6%(1)甲装置是原电池,发生电化学腐蚀,乙装置发生化学腐蚀.
A、甲是化学能转变为电能的装置,乙不是,故A错误.
B、乙装置中铜片不反应,也没构成原电池的正极,所以铜片上没有明显变化,故B正确.
C、甲、乙中锌片质量都减少,故C错误.
D、两个烧杯中都产生氢气,氢离子浓度都降低,所以溶液的pH均增大,故D正确.
故选BD.
(2)原电池原理引起的腐蚀速度大于化学腐蚀的速度,故答案为:>.
(3)Zn+H 2 SO 4 =ZnSO 4 +H 2 ↑ 转移电子
22.4L 2×6.02×10 23 个
1.12L 6.02×10 22 个
故答案为:6.02×10 22
(4)稀释后氢离子的物质的量为1L×0.1mol•L -1 =0.1mol,生成氢气的氢离子的物质的量为
1.12L
22.4L/mol ×2=0.1mol ,所以原溶液中氢离子的物质的量为0.2mol,原溶液中氢离子的浓度为
0.2mol
0.1L =2mol/L ;一个硫酸分子中含两个氢离子,所以原溶液中稀硫酸的浓度为1 mol•L -1 .
故答案为:1 mol•L -1
1年前
71年前查看全部
- 将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是( )
 将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是( )
将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是( )
A.甲装置中电能转化为化学能
B.乙装置中电能转化为化学能
C.甲装置中铜片表面有气泡产生
D.乙装置中铜片表面有气泡生成 wonterful1年前1
wonterful1年前1 -
 我被骗了吗 共回答了17个问题
我被骗了吗 共回答了17个问题 |采纳率88.2%解题思路:先判断甲、乙分别属于什么装置,然后再根据原电池的定义、工作原理判断.根据原电池的构成条件判断,甲是原电池,乙不是原电池.
A、甲是原电池,所以甲是把化学能转变为电能的装置,故A错误;
B、乙不是原电池,不是把化学能转变为电能的装置,故B错误;
C、甲中铜片是正极,该极上氢离子得电子析出氢气,故C正确;
D、乙中锌片可以和硫酸反应产生氢气,金属铜和硫酸不反应,铜片表面无气泡生成,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 原电池的构成条件:
1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;
2、电极均需插入电解质溶液中;
3、两极相互连接(或接触);
4、能自发地发生氧化还原反应.1年前查看全部
- 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是______.
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
(2)在相同时间内,两烧杯中产生气泡的速度:甲______乙(填“>”、“<“或“=”).
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为______.
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol•L-1(设反应前后溶液体积不变).试确定原稀硫酸的物质的量浓度为______. 真晕啊1年前1
真晕啊1年前1 -
 wwangluowuyu 共回答了19个问题
wwangluowuyu 共回答了19个问题 |采纳率84.2%解题思路:(1)先判断装置类型,再判断选项正误.
(2)根据装置判断;
(3)根据生成的气体与转移电子之间的关系式计算;
(4)先计算氢离子的物质的量再计算源稀硫酸的浓度;(1)甲装置是原电池,发生电化学腐蚀,乙装置发生化学腐蚀.
A、甲是化学能转变为电能的装置,乙不是,故A错误.
B、乙装置中铜片不反应,也没构成原电池的正极,所以铜片上没有明显变化,故B正确.
C、甲、乙中锌片质量都减少,故C错误.
D、两个烧杯中都产生氢气,氢离子浓度都降低,所以溶液的pH均增大,故D正确.
故选BD.
(2)原电池原理引起的腐蚀速度大于化学腐蚀的速度,故答案为:>.
(3)Zn+H2SO4=ZnSO4 +H2↑ 转移电子
22.4L 2×6.02×10 23个
1.12L 6.02×1022个
故答案为:6.02×1022
(4)稀释后氢离子的物质的量为1L×0.1mol•L-1=0.1mol,生成氢气的氢离子的物质的量为
1.12L
22.4L/mol×2=0.1mol,所以原溶液中氢离子的物质的量为0.2mol,原溶液中氢离子的浓度为
0.2mol
0.1L=2mol/L;一个硫酸分子中含两个氢离子,所以原溶液中稀硫酸的浓度为1 mol•L-1.
故答案为:1 mol•L-1
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 不同条件下金属腐蚀的快慢规律:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀1年前查看全部
- 分别放置在如图所示装置(都盛有0.1mol•L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是( )
分别放置在如图所示装置(都盛有0.1mol•L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是( )
A.
B.
C.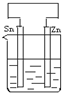
D.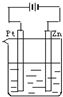
 tasstion1年前1
tasstion1年前1 -
 forst 共回答了20个问题
forst 共回答了20个问题 |采纳率95%解题思路:电化学腐蚀较化学腐蚀快,金属得到保护时,腐蚀较慢,作原电池正极和电解池阴极的金属被保护.A中发生化学腐蚀,B中锌作原电池正极,保护锌,C中锌作负极,发生电化学腐蚀,加快锌的腐蚀,D中锌作电解池阴极,不易被腐蚀,所以腐蚀速率由快到慢的顺序为CABD,
故选D.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题考查不同条件下金属腐蚀的快慢,明确腐蚀快慢为:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀即可解答,难度不大.1年前查看全部
- 分别放置在下图所示装置(都盛有0.1 mol·L -1 的H 2 SO 4 溶液)中的四个相同的纯锌片,腐蚀最慢的是
 jmjmzlt1年前1
jmjmzlt1年前1 -
 小小米lulu 共回答了21个问题
小小米lulu 共回答了21个问题 |采纳率81%D
1年前查看全部
- 分别放置在图所示装置(都盛有0.1 mol·L -1 的H 2 SO 4 溶液)中的四个相同的纯锌片,腐蚀最快的是 [&
分别放置在图所示装置(都盛有0.1 mol·L -1 的H 2 SO 4 溶液)中的四个相同的纯锌片,腐蚀最快的是 [ ]A. 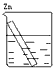
B.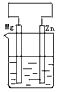
C.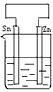
D.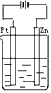
 个个都甘有型1年前1
个个都甘有型1年前1 -
 hui52 共回答了22个问题
hui52 共回答了22个问题 |采纳率72.7%C1年前查看全部
- 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法正确的是______.
a.甲、乙均为化学能转变为电能的装置
b.乙中铜片上没有明显变化
c.甲中铜片质量减少、乙中锌片质量减少
d.两烧杯中溶液的c(H+)均减小
(2)在相同时间内,两烧杯中产生气泡的速度:甲______乙(填“>”、“<“或“=”).
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为______.
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol•L-1(设反应前后溶液体积不变).试确定原稀硫酸的物质的量浓度为______ mol•L-1.
(5)甲中锌片上发生的电极反应:______;
(6)若甲中两电极的总质量为60g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47g,则氢气的体积(标准状况)为______ L. anson09241年前1
anson09241年前1 -
 minmin83327 共回答了21个问题
minmin83327 共回答了21个问题 |采纳率95.2%解题思路:(1)甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
(2)作原电池负极的金属加速被腐蚀;
(3)根据氢气和转移电子之间的关系式计算;
(4)先计算氢离子的物质的量再计算源稀硫酸的浓度;
(5)甲中锌失电子生成锌离子;
(6)负极上锌生成锌离子进入溶液而导致质量减少,正极上氢离子得电子生成氢气,所以正极质量不变,两个电极减少的质量是锌的质量,根据锌和氢气之间的关系式计算生成氢气的体积.(1)a、甲符合原电池构成条件,所以属于原电池,乙不能构成闭合回路,所以不能构成原电池,故a错误;
b、乙不能构成原电池,氢离子在锌片上得电子发生还原反应,所以乙中铜片上没有明显变化,故b正确;
c、甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减少,故c错误;
d、两烧杯中锌和氢离子发生置换反应导致溶液中氢离子浓度减小,则两烧杯中溶液的c(H+)均减小,故d正确;
故选:bd;
(2)甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙,故答案为:>;
(3)甲中,铜电极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,根据电极反应式知,通过电子的物质的量=[1.12L/22.4L/mol]=0.1mol,则通过导线的电子数目为0.1NA;
故答案为:0.1NA;
(4)稀释后氢离子的物质的量为1L×0.1mol•L-1=0.1mol,生成氢气的氢离子的物质的量为[1.12L/22.4L/mol]×2=0.1molmol,所以原溶液中氢离子的物质的量为0.2mol,原溶液中氢离子的浓度为[0.2mol/0.1L]=2mol/L,一个硫酸分子中含两个氢离子,所以原溶液中稀硫酸的浓度为1 mol•L-1;
故答案为:1;
(5)甲中锌失电子生成锌离子,则甲中负极锌上电极反应式为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(2)负极上锌生成锌离子进入溶液而导致质量减少,正极上氢离子得电子生成氢气,所以正极质量不变,两个电极减少的质量是锌的质量,锌和稀硫酸反应离子方程式为2H++Zn=Zn2++H2↑,根据锌和氢气之间的关系式得氢气的体积=
(60g−47g)
65g/mol×22.4L/mol=4.48L,
故答案为:4.48L.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题以原电池原理考查了氧化还原反应的有关计算,明确正负极上发生的反应是解本题关键,然后根据锌和氢气的关系式计算即可,难度不大.1年前查看全部
- (8338•德阳模拟)如图是将纯锌片和纯铜片插入同浓度的两杯稀硫酸中,多段时间后,她列有关叙述正确的是( )
 (8338•德阳模拟)如图是将纯锌片和纯铜片插入同浓度的两杯稀硫酸中,多段时间后,她列有关叙述正确的是( )
(8338•德阳模拟)如图是将纯锌片和纯铜片插入同浓度的两杯稀硫酸中,多段时间后,她列有关叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.产生气泡的速度甲比乙慢
D.两烧杯中溶液的pH均增大 lovexuan1年前1
lovexuan1年前1 -
 429259170 共回答了14个问题
429259170 共回答了14个问题 |采纳率78.6%解题思路:原电池的组成条件是活泼性不同的两个电极、电解质溶液、闭合回路、自发进行的氧化还原反应.装置甲是原电池,锌做负极,铜做正极,气体在铜片上产生,原电池由于在两个电极上发生氧化反应和还原反应,加快了反应速率.乙不是原电池,乙装置是锌与稀硫酸直接接触的反应,铜不与稀硫酸反应,气体在锌片上产生.甲和乙相比,相同点:发生的氧化还原反应原理相同,都消耗H+,反应后溶液pH都增大;不同点:①气体产生的位置不同,②反应速率不同,③能量转化不同.、甲是原电池,正极铜片个发生还原反应 2H++2e-═H2↑,乙装置中在锌片个发生反应 Zn+2H+═Zn2++H2↑,铜片个无气体产生,故r错误;
B、甲装置是原电池,铜片做正极,乙不是原电池,故B错误;
C、原电池反应加快反应速率,产生气泡的速度甲比乙快,故C错误;
1、两烧杯中的氢离子发生反应,浓度减少,溶液2H增大,故1正确;
故选:1.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池的工作原理,氧化还原反应的实质,装置分析相同点:发生的氧化还原反应原理相同,都消耗H+,反应后溶液pH都增大;不同点:①气体产生的位置不同,②反应速率不同,③能量转化不同,题目难度中等.1年前查看全部
- 将纯锌片和纯铜片按图示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按图示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )
 A. 两烧杯中铜片表面均无气泡产生
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大
D. 产生气泡的速度甲比乙慢 听见阳光1年前2
听见阳光1年前2 -
 songzangzhe6 共回答了12个问题
songzangzhe6 共回答了12个问题 |采纳率91.7%解题思路:甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑,原电池的构成加快了反应速率.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B、乙中不构成原电池,铜片不是电极,故B错误;
C、甲乙两烧杯反应的总方程式都为Zn+H2SO4=ZnSO4+H2↑,溶液中硫酸的浓度降低,溶液的PH增大,故C正确;
D、原电池能加快反应速率,故产生气泡的速度甲比乙快,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.1年前查看全部
- 分别放置在如图所示装置(都盛有0.1mol·L -1 的H 2 SO 4 溶液)中的四个相同的纯锌片,腐蚀最慢的是 [&
分别放置在如图所示装置(都盛有0.1mol·L -1 的H 2 SO 4 溶液)中的四个相同的纯锌片,腐蚀最慢的是 [ ]A. 
B.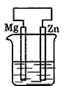
C.
D.
 美丽泡泡8881年前1
美丽泡泡8881年前1 -
 68593165 共回答了16个问题
68593165 共回答了16个问题 |采纳率81.3%D1年前查看全部
- 分别放置在如图所示装置(都盛有0.1 mol·L -1 的H 2 SO 4 溶液)中的四个相同的纯锌片,腐蚀最慢的是
 timonkk1年前1
timonkk1年前1 -
 黑白方格 共回答了21个问题
黑白方格 共回答了21个问题 |采纳率85.7%D
1年前查看全部
- 将纯锌片和纯铜片按如图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
 将纯锌片和纯铜片按如图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按如图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.甲中铜片是负极
B.两烧杯中铜片表面均无气泡产生
C.产生气泡的速度甲比乙快
D.两烧杯中溶液的pH均减小 cornstalkh1年前1
cornstalkh1年前1 -
 wenty0101 共回答了19个问题
wenty0101 共回答了19个问题 |采纳率84.2%解题思路:原电池的组成条件是活泼性不同的两个电极、电解质溶液、闭合回路、自发进行的氧化还原反应.装置甲是原电池,锌做负极,铜做正极,气体在铜片上产生,原电池由于在两个电极上发生氧化反应和还原反应,加快了反应速率.乙不是原电池,乙装置是锌与稀硫酸直接接触的反应,铜不与稀硫酸反应,气体在锌片上产生.甲和乙相比,相同点:发生的氧化还原反应原理相同,都消耗H+,反应后溶液PH都增大;不同点:一、气体产生的位置不同,二、反应速率不同,三、能量转化不同.A、甲装置是原电池,铜片做正极,乙不是原电池,故A错误;
B、甲是原电池,正极铜片上发生还原反应 2H++2e-=H2↑,铜片上有气生成,乙装置中在锌片上发生反应 Zn+2H+=Zn2++H2↑,铜片上无气体产生,故B错误;
C、原电池反应加快反应速率,故C正确;
D、两烧杯中的氢离子发生反应,浓度减少,溶液pH增大,故D错误;
故选:C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池的工作原理,氧化还原反应的实质,原电池反应的应用,题目难度中等.1年前查看全部
- 将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) A.两烧杯中铜片表面均无气泡产生 B.
将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极 C.两烧杯中溶液的酸性减小 D.甲、乙溶液均变蓝 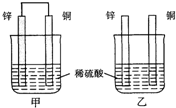
 抱抱团之小钟1年前1
抱抱团之小钟1年前1 -
 hlhdy 共回答了16个问题
hlhdy 共回答了16个问题 |采纳率93.8%A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H + 在铜极上得电子,生成H 2 ,所以甲中铜片表面有气泡产生,故A错误;
B、乙中不构成原电池,铜片不是电极,故B错误;
C、甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故C正确;
D、甲、乙装置中铜都不参加反应,所以甲、乙溶液都不变蓝,故D错误;
故选C.1年前查看全部
- (2008•乐山一模)将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
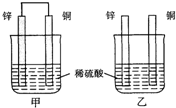 (2008•乐山一模)将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
(2008•乐山一模)将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性减小
D.甲、乙溶液均变蓝 afei81年前1
afei81年前1 -
 a1c2e3g4i 共回答了13个问题
a1c2e3g4i 共回答了13个问题 |采纳率92.3%解题思路:甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B、乙中不构成原电池,铜片不是电极,故B错误;
C、甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故C正确;
D、甲、乙装置中铜都不参加反应,所以甲、乙溶液都不变蓝,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.1年前查看全部
- 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
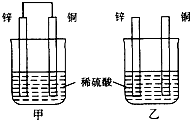 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙快 非特1年前1
非特1年前1 -
 xiashuxun646 共回答了25个问题
xiashuxun646 共回答了25个问题 |采纳率92%解题思路:原电池的组成条件是活泼性不同的两个电极、电解质溶液、闭合回路、自发进行的氧化还原反应.装置甲是原电池,锌做负极,铜做正极,气体在铜片上产生,原电池由于在两个电极上发生氧化反应和还原反应,加快了反应速率.乙不是原电池,乙装置是锌与稀硫酸直接接触的反应,铜不与稀硫酸反应,气体在锌片上产生.甲和乙相比,相同点:发生的氧化还原反应原理相同,都消耗H+,反应后溶液PH都增大;不同点:一、气体产生的位置不同,二、反应速率不同,三、能量转化不同.A、甲是原电池,正极铜片上发生还原反应 2H++2e-=H2↑,乙装置中在锌片上发生反应 Zn+2H+=Zn2++H2↑,铜片上无气体产生,故A错;
B、甲装置是原电池,铜片做正极,乙不是原电池,故B错;
C、两烧杯中的氢离子发生反应,浓度减少,溶液PH增大,故C正确;
D、原电池反应加快反应速率,故D正确;
故选:CD.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池的工作原理,氧化还原反应的实质.1年前查看全部
- (12分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
(12分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

(1)下列说法正确的是____________。
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化 C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的c(H + )均增小
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H + )=0.1 mol·L - 1 (设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________ mol·L - 1 。
(5) 甲中锌片上发生的电极反应: _________________________;
(6) 若甲中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g,则:氢气的体积(标准状况)为________L。 懒鱼一号1年前1
懒鱼一号1年前1 -
 任我吹 共回答了17个问题
任我吹 共回答了17个问题 |采纳率88.2%(1)BD(2)甲>乙(3)6.02×10 22 (0.1N A )
(4)1(5)Zn-2e - =Zn 2+ ; (6) 4.48
(1)根据装置特点可知,甲是原电池,锌比铜活泼,锌是负极,失去电子,铜是正极,溶液中的氢离子得到电子;乙不是原电池,锌能直接和稀硫酸发生置换反应,而铜不能和稀硫酸反应。所以正确的答案选BD。
(2)通过原电池反应进行的反应速率大于直接发生化学反应的反应速率。
(3)1.12L气体在标准状况下的物质的量是0.05mol,转移电子是0.05mol×2=0.1mol,数目是6.02×10 22 (0.1N A )。
(4)溶液中c(H + )=0.1 mol·L - 1 ,所以氢离子的物质的量是0.1mol,因此剩余硫酸是0.05mol。消耗硫酸是0.05mol,所以原硫酸的物质的量是0.1mol,其浓度是0.1mol÷0.1L=1.0mol/L。
(5) 甲中锌是负极,发生的电极反应为Zn-2e - =Zn 2+ 。
(6)电极减少的质量就是参加反应的锌的质量,即消耗锌是13g,物质的量是0.2mol,生成氢气是0.2mol,标准状况下的体积是4.48L。1年前查看全部
- (2008•石家庄模拟)将纯锌片和纯铜片按图示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )
 (2008•石家庄模拟)将纯锌片和纯铜片按图示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )
(2008•石家庄模拟)将纯锌片和纯铜片按图示方式插入同深度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢 硬吧1年前1
硬吧1年前1 -
 幽姬 共回答了19个问题
幽姬 共回答了19个问题 |采纳率84.2%解题思路:甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑,原电池的构成加快了反应速率.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B、乙中不构成原电池,铜片不是电极,故B错误;
C、甲乙两烧杯反应的总方程式都为Zn+H2SO4=ZnSO4+H2↑,溶液中硫酸的浓度降低,溶液的PH增大,故C正确;
D、原电池能加快反应速率,故产生气泡的速度甲比乙快,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.1年前查看全部
- 分别放置在如图所示装置(都盛有0.1mol•L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最快的是( )
分别放置在如图所示装置(都盛有0.1mol•L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最快的是( )
A.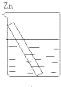
B.
C.
D.
 绅士不风度1年前1
绅士不风度1年前1 -
 yuanhua19820208 共回答了22个问题
yuanhua19820208 共回答了22个问题 |采纳率95.5%解题思路:电化学腐蚀较化学腐蚀快,金属得到保护时,腐蚀较慢,作原电池正极和电解池阴极的金属被保护,以此解答该题.A发生电化学腐蚀,B中锌为正极,被保护;C中锌为原电池负极,被氧化而腐蚀;D为电解池阴极,被保护,
则腐蚀速率由快到慢的顺序为CABD,腐蚀最快的是C.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查不同条件下金属腐蚀的快慢,明确腐蚀快慢为:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀即可解答.1年前查看全部
- 9将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()
 铁皮王老五1年前1
铁皮王老五1年前1 -
 -无双- 共回答了14个问题
-无双- 共回答了14个问题 |采纳率100%试题来源:2012年苏教版高中化学选修4 1.2化学能与电能的转化(带解析)
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生x05B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大x05D.产生气泡的速度甲比乙慢
答案:C
答案解析:试题分析:由题目所给图示可知,甲为原电池,铜作正极,发生反应:2H++2e-Zn2++H2↑,二者都消耗H+,故溶液的pH都增大,因此答案选C.
考点:考查原电池的有关判断和应用
点评:该题是基础性试题的考查,难度不大.该题的关键是明确原电池的工作原理,即原电池中较活泼的金属是负极,失去电子,发生氧化反应.电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应.1年前查看全部
- 将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

A.两烧杯中铜片表面均无气泡产生
B.甲中正极的电极反应式为Zn-2e-=Zn2+
C.两烧杯中氢离子浓度均减少
D.产生气泡的速度甲比乙慢 1985yy1年前1
1985yy1年前1 -
 3882533 共回答了16个问题
3882533 共回答了16个问题 |采纳率87.5%解题思路:甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B、甲中铜为正极,铜片上氢离子得电子生成氢气,正极的反应为:2H++2e-=H2↑,故B错误;
C、甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故C正确;
D、甲中形成铜锌原电池加快了反应速率,所以产生气泡的速度甲比乙快,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.1年前查看全部
大家在问
- 1完型填空SARS caused a lot of problems.Here,there are two ways we
- 2他的脸上看出喜悦的神情 修改病句
- 31.Bill came to China five years ago.(改为同义句)
- 4把长480米 宽360米的操场画在比例尺是1:12000的地图上请分别去长和宽
- 5“你为何不把会议推迟到下周?”用英语怎么翻译?
- 6试述同源三倍体高度不育的遗产机理
- 7平行四边形的周长为36cm,一组邻边之差为4cm,求平行四边形各边的长.
- 8梦想是芽坚持是肥 作文
- 9若双曲线的渐近线方程为y=正负3x,它的一个焦点是(根号10,0),求双曲线标准方程
- 10若关于x的不等式lg(10^x+10)-1>a的解集为R,则实数a的取值范围
- 11在测定空气中氧气含量的实验中,小强采用了右图所示装置:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃
- 12莉莉不想让妈妈失望,所以她每天早早地起来练习舞蹈用英语翻译
- 13用英语翻译我知道,我们不可能成为朋友,我对你的感情,不是感情,而是爱.我只能追求你,等你.对你,我不可能放弃.
- 14过氧化氢有腐蚀性吗请问在实验室做用过氧化氢制取氧气的实验后,衣服和手上会出现白色的斑点,这是由过氧化氢的强氧化性造成的吗
- 15甲、乙两人分别从A、B两地同时相向而行4小时相遇如果每人每小时少走1千米5小时相遇A、B两地相距多少千米?
