在10mL lmol/L的Al2(SO4)3溶液中,加入一定量6mol/L KOH 溶液后,再加入10mL31%的盐酸(
 沙漠一鸣2022-10-04 11:39:542条回答
沙漠一鸣2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 cyej 共回答了17个问题
cyej 共回答了17个问题 |采纳率94.1%- 其实这个题目思路很简单 加入入10mL31%盐酸恰好开始生成沉淀 发生的反应肯定是H+OH-=H2O (1) 刚好过量一点AlO2- + H+ + H2O=Al(OH)3生成沉淀是Al(OH)3沉淀 所以KOH肯定是过量的发生的反应为 Al3+ +4OH=AlO2-+2H2O ...
- 1年前
 kuangdevil 共回答了10个问题
kuangdevil 共回答了10个问题 |采纳率- 因为加入盐酸后恰好有沉淀,此时HCI与AI(OH)4一比一反应,且由计算可得盐酸的摩尔质量远远大于AI的,所以说明刚开始AI全部转化为偏铝酸根,且KOH是有多余的,
所以KOH的体积={(10*1.14/36.5)-0.01*2*1}/6
单位是毫升,若为升在除以1000 - 1年前
相关推荐
- AL2(SO4)3溶液和过量稀氨水反应的化学方程式
 出门就丢1年前3
出门就丢1年前3 -
 ss鸟人_329 共回答了16个问题
ss鸟人_329 共回答了16个问题 |采纳率81.3%Al2(SO4)3+6NH3+6H2O=2Al(OH)3↓+3(NH4)2SO41年前查看全部
- 某Na2SO4、MgCl2、Al2(SO4)3的混合溶液中,c(Na+)=0.2mol/L;c(Mg2+)=0.15mo
某Na2SO4、MgCl2、Al2(SO4)3的混合溶液中,c(Na+)=0.2mol/L;c(Mg2+)=0.15mol/L;c(Al3+)=0.2mol/L;c(Cl-)=0.3mol/L,则100mL此混合溶液中含有SO42-离子的物质的量为( )
A.0.4mol/L
B.0.4mol
C.0.04mol
D.0.02mol rongaie1年前1
rongaie1年前1 -
 xowr_2__62ho5922 共回答了19个问题
xowr_2__62ho5922 共回答了19个问题 |采纳率89.5%解题思路:根据溶液不显电性,则阳离子的电荷总数等于阴离子的电荷总数,以此来计算c(SO42-),再根据n=cV计算.根据溶液呈电中性,则c(Na+)+2c(Mg2+)+3c(Al3+)=c(Cl-)+2c(SO42-),
故0.2mol/L+2×0.15mol/L+3×0.2mol/L=0.3mol/L+2c(SO42-),
解得c(SO42-)=0.4mol/L,
故100mL此混合溶液中含有SO42-离子的物质的量为0.4mol/L×0.1L=0.04mol,
故选:C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查溶液物质的量浓度的计算,难度不大,注意根据溶液不显电性阳离子与阴离子所带电荷总数相等计算.1年前查看全部
- 若100mL 0.1mol/L的Al2(SO4)3溶液和NaOH溶液反应,得到1.17g Al(OH)3沉淀,
若100mL 0.1mol/L的Al2(SO4)3溶液和NaOH溶液反应,得到1.17g Al(OH)3沉淀,则需0.5mol/L NaOH溶液的体积为( )
A.130mL
B.100mL
C.65mL
D.50mL zhyzz1年前1
zhyzz1年前1 -
 心灵原唱 共回答了22个问题
心灵原唱 共回答了22个问题 |采纳率86.4%解题思路:根据Al2(SO4)3溶液与NaOH溶液的反应计算分析,100mL0.1mol/LAl2(SO4)3全转化为沉淀的质量为:0.1L×0.1mol/L×2×78g/mol=1.56g,
由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,可知NaOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此计算.在100ml 0.1mol/L的Al2(SO4)3溶液中加入0.5mol/L的NaOH溶液,如硫酸铝完全生成Al(OH)3,则沉淀的质量为:0.1L×0.1mol/L×2×78g/mol=1.56g,
而此时为1.17g,说明硫酸铝并没有完全转化为Al(OH)3,此时n(Al(OH)3)=[1.17g/78g/mol]=0.015mol,NaOH可能有两种情况,一是不足,二是使Al(OH)3部分溶解,
当NaOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 1mol
x 0.015mol
则x=0.045mol,
V1(NaOH溶液)=[0.045mol/0.5mol/L]=0.09L=90mL,
如使Al(OH)3部分溶解,则
①Al3++3OH-=Al(OH)3↓
0.02mol 0.06mol
②Al(OH)3+OH-=AlO2-+2H2O
1mol 1mol
(0.02-0.015)mol (0.02-0.015)mol=0.005mol
两步反应共需要0.06mol+0.005mol=0.065mol,
V2(NaOH溶液)=[0.065mol/0.5mol/L]=0.13L=130mL,
即所加的NaOH溶液体积是90毫升或130毫升,
故选A.点评:
本题考点: 镁、铝的重要化合物;化学方程式的有关计算.
考点点评: 本题考查化学方程式的相关计算,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意判断硫酸铝反应的程度,为解答本题的关键,用讨论法解答.1年前查看全部
- 泡沫灭火剂包括Al2(SO4)3溶液(约1mol/L)、NaHCO3溶液(约1mol/L)及发泡剂.使用时发生的化学反应
泡沫灭火剂包括Al2(SO4)3溶液(约1mol/L)、NaHCO3溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是______.Al2(SO4)3溶液和NaHCO3溶液的体积比约是______.若用等体积、等浓度(mol/L)的Na2CO3代替NaHCO3液,在使用时喷不出泡沫,这是因为______.泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢 钠溶液,不能把硫酸铝溶液盛在铁筒里的原因是______.
 xXxRockvanessxXX1年前1
xXxRockvanessxXX1年前1 -
 etd8a 共回答了22个问题
etd8a 共回答了22个问题 |采纳率86.4%解题思路:铝离子和碳酸氢根离子双水解会产生沉淀和气体,根据谁解原理方程式可以确定二者量的关系;碳酸根的水解是分步进行的,先水解得到碳酸氢根,进一步水解得到二氧化碳;硫酸铝中的铝离子水解得到的溶液显示酸性,能和金属铁发生反应.Al2(SO4)3溶液和NaHCO3溶液混合后会发生双水解反应,原理方程式为:Al2(SO4)3+6NaHCO3═2Al(OH)3↓+6CO2↑+3Na2SO4,Al2(SO4)3溶液和NaHCO3溶液的体积比约是1:6,由1mol的碳酸根离子转化为1molCO2需2molH+,H+由Al3+提供(水解),在Al3+量不变的情况下,碳酸根离子先水解得到碳酸氢根,只能生成HCO3-,没有CO2,喷不出泡沫,并且双水解时NaHCO3表面生成Al(OH)3后,会阻碍反应的进行,Al3+水解产生的H+会和金属铁反应,这样会腐蚀铁筒,所以不能把硫酸铝溶液盛在铁筒里.
故答案为:Al2(SO4)3+6NaHCO3═2Al(OH)3↓+6CO2↑+3Na2SO4;1:6;由1molCO32-转化为1molCO2需2molH+,H+由Al3+提供(水解),现因Al3+量不变,只能生成HCO3-,没有CO2,喷不出泡沫,另外,NaHCO3表面生成Al(OH)3后,阻碍反应的进行;Al3+水解产生的H+会腐蚀铁筒.点评:
本题考点: 盐类水解的应用.
考点点评: 本题考查学生盐的水解原理以及水解原理的应用知识,考查学生对教材知识的梳理情况,难度不大.1年前查看全部
- 300mL Al2(SO4)3溶液中,含Al3+为1.62g,该溶液中SO42-的物质的量浓度为( )
300mL Al2(SO4)3溶液中,含Al3+为1.62g,该溶液中SO42-的物质的量浓度为( )
A.0.4 mol•L-1
B.0.3 mol•L-1
C.0.2 mol•L-1
D.0.1 mol•L-1 期待者1年前1
期待者1年前1 -
 cuiguanghui 共回答了11个问题
cuiguanghui 共回答了11个问题 |采纳率90.9%解题思路:先根据C=[n/V]求出Al3+的物质的量浓度,然后根据C(Al3+):C(SO42-)=2:3来求出SO42-的物质的量浓度;溶液中Al3+为1.62g,物质的量为[1.62g/27g/mol]=0.06mol,则C(Al3+)=[0.06mol/0.3L]=0.2mol•L-1,又因为C(Al3+):C(SO42-)=2:3,所以C(SO42-)=0.3 mol•L-1,
故选:B;点评:
本题考点: 物质的量浓度.
考点点评: 本题考查物质的量浓度的有关计算,难度不大,需要注意的是溶液中离子浓度之比等于数目之比.1年前查看全部
- 100mL1mol•L-1Al2(SO4)3溶液中,含Al3+离子______mol,______个,含SO42-离子_
100mL1mol•L-1Al2(SO4)3溶液中,含Al3+离子______mol,______个,含SO42-离子______mol,______个.
 求索asd1年前1
求索asd1年前1 -
 幸福8不必勉强 共回答了15个问题
幸福8不必勉强 共回答了15个问题 |采纳率73.3%解题思路:1mol•L-1Al2(SO4)3溶液中,c(Al3+)=2mol/L,c(SO42-)=3mol/L,根据n=cV计算Al3+离子、SO42-离子的物质的量,再根据N=nNA计算离子数目.1mol•L-1Al2(SO4)3溶液中,c(Al3+)=2mol/L,c(SO42-)=3mol/L,则100mL该溶液中,n(Al3+)=0.1L×2mol/L=0.2mol,故Al3+离子数目=0.2mol×NAmol-1=0.2NA,溶液中n(SO42-)=0.1L×3mol/L=0.3mol,SO42-离子数...
点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度有关计算,比较基础,侧重对基础知识的巩固,注意理解电解质离子与电解质浓度关系.1年前查看全部
- 有2L K2SO4和Al2(SO4)3的混合液,已知其中Al3+的物质的量为0.8mol,而SO42-的物质的
有2L K2SO4和Al2(SO4)3的混合液,已知其中Al3+的物质的量为0.8mol,而SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为( )
A.0.1 mol/L
B.0.15 mol/L
C.0.2 mol/L
D.0.25 mol/L mimimimi88881年前1
mimimimi88881年前1 -
 秃尾猫 共回答了20个问题
秃尾猫 共回答了20个问题 |采纳率85%解题思路:根据溶液呈电中性,溶液中阴、阳离子所带电荷相等,则溶液中c(K+)+3c(Al3+)=2c(SO42-),据此计算.溶液中Al3+的物质的量为0.8mol,其物质的量浓度为[0.8mol/2L]=0.4mol/L,根据溶液呈电中性,则溶液中c(K+)+3c(Al3+)=2c(SO42-),所以c(K+)+3×0.4mol/L=2×0.7mol/L,解得c(K+)=0.2mol/L,故选C.
点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查混合溶液中离子物质的量浓度的计算,难度不大,理解溶液为电中性是解题关键,注意溶液中离子浓度计算中电荷守恒的运用.1年前查看全部
- 若Al2(SO4)3溶液中SO42-的质量为x g,则该溶液中Al3+的物质的量为______.
 SOSO看过来1年前1
SOSO看过来1年前1 -
 寒冬的腊梅 共回答了15个问题
寒冬的腊梅 共回答了15个问题 |采纳率80%解题思路:根据SO42-的质量为xg来计算硫酸根离子的物质的量,根据硫酸铝中的离子构成中铝离子和硫酸根离子量的关系来确定Al3+的物质的量即可.Al2(SO4)3溶液中SO42-的质量为x g,则SO42-的物质的量=[xg/96g/mol]=[x/96]mol,硫酸铝中铝离子和硫酸根离子物质的量之比是2:3,所以Al3+的物质的量=[x/96]mol×[2/3]=[x/144]mol,故答案为:[x/144]mol.
点评:
本题考点: 物质的量的相关计算.
考点点评: 本题考查学生公式m=nM的应用以及物质的微粒构成之间的关系,难度不大.1年前查看全部
- 只用胶头滴管和试管,不用其他试剂,就能区别下列溶液 CaCI2和Na2CO3.Al2(SO4)3和氨水.
只用胶头滴管和试管,不用其他试剂,就能区别下列溶液 CaCI2和Na2CO3.Al2(SO4)3和氨水.
Ba(OH)2和NaHCO3.NaAlO2和盐酸.答案是最后一个,求具体理由! yhh1231年前4
yhh1231年前4 -
 wangzhihao1984 共回答了15个问题
wangzhihao1984 共回答了15个问题 |采纳率86.7%NaAlO2滴入到HCl ,先无沉淀,后再产生沉淀
NaAlO2 + 4HCl 4Al(OH)3 + 3NaCl
盐酸滴入到NaAlO2,先产生沉淀,后沉淀溶解
HCl + NaAlO2 + H2O ===Al(OH)3 + NaCl
Al(OH)3 + 3HCl ===AlCl3 + 3H2O1年前查看全部
- 有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为( )
A. 0.1mol/L
B. 0.15mol/L
C. 0.2mol/L
D. 0.25mol/L dingding_mao1年前3
dingding_mao1年前3 -
 sinchenming 共回答了16个问题
sinchenming 共回答了16个问题 |采纳率87.5%解题思路:根据溶液呈电中性原则,溶液中应满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),以此解答该题.溶液呈电中性,则满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),
由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),
所以有3×0.4mol/L+c(K+)=2×0.7mol/L,
c(K+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L,
故选C.点评:
本题考点: 物质的量浓度的相关计算;电解质在水溶液中的电离.
考点点评: 本题考查溶液浓度的计算,题目难度不大,注意从溶液电中性的角度计算溶液离子浓度.1年前查看全部
- (1)只用一种试剂区别Na2SO4、MgCl2、FeCl3、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是_
 kal75861年前1
kal75861年前1 -
 bfsutian 共回答了18个问题
bfsutian 共回答了18个问题 |采纳率94.4%解题思路:(1)根据阳离子不同,可选碱来区别;
(2)利用质量之比等于个数之比及N=nNA,V=nVm计算;
(3)Al2(SO4)3溶液中含有Al3+为0.6mol,则n[Al2(SO4)3]=[0.6mol/2]=0.3mol,结合c=[n/V]及稀释时物质的量不变来计算;
(4)质子数=质量数-中子数,阳离子核外电子数=质子数-电荷数.(1)Na2SO4、MgCl2、FeCl3、Al2(SO4)3、(NH4)2SO4五种溶液加入NaOH溶液有不同的现象,分别为:无现象、白色沉淀、红褐色沉淀、先有白色沉淀后消失、刺激性气体,现象不同,可以区别,故答案为:NaOH溶液;
(2)a g某气体中含有的分子数为b,则c g 该气体的个数为
bc/a],其物质的量为[bc
aNA,所以在标准状况下的体积约是
22.4bc
aNAL,故答案为:
22.4bc
aNAL;
(3)Al2(SO4)3溶液中含有Al3+为0.6mol,则n[Al2(SO4)3]=
0.6mol/2]=0.3mol,c=[n/V]=[0.3mol/6L]=0.05mol/L,取上述溶液2ml加水稀释到10ml,则稀释后的浓度为[2×0.05/10]=0.01mol/L,SO42-的物质的量浓度为0.01,mol/L×3=0.03mol/L,故答案为:0.05;0.03;
(4)核内中子数为N的R2+,质量数为A,质子数为A-N,则该离子核外电子数为A-N-2,故答案为:A-N-2.点评:
本题考点: 物质的检验和鉴别的基本方法选择及应用;物质的量的相关计算;物质的量浓度的相关计算;质量数与质子数、中子数之间的相互关系.
考点点评: 本题考查较综合,注意物质的鉴别现象不同能鉴别,(1)中还可以选择Ba(OH)2溶液或KOH溶液,涉及鉴别、物质的量计算、原子构成等,综合性较强,注重基础知识的考查,题目难度不大.1年前查看全部
- 有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为( )
A. 0.1mol/L
B. 0.15mol/L
C. 0.2mol/L
D. 0.25mol/L 乌鸦2151年前2
乌鸦2151年前2 -
 windsong 共回答了15个问题
windsong 共回答了15个问题 |采纳率93.3%解题思路:根据溶液呈电中性原则,溶液中应满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),以此解答该题.溶液呈电中性,则满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),
由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),
所以有3×0.4mol/L+c(K+)=2×0.7mol/L,
c(K+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L,
故选C.点评:
本题考点: 物质的量浓度的相关计算;电解质在水溶液中的电离.
考点点评: 本题考查溶液浓度的计算,题目难度不大,注意从溶液电中性的角度计算溶液离子浓度.1年前查看全部
- 100ml 0.3mol/L Al2(SO4)3溶液混合后(忽略溶液体积变化),在相同温度下溶液中S04离子的物质的量浓
100ml 0.3mol/L Al2(SO4)3溶液混合后(忽略溶液体积变化),在相同温度下溶液中S04离子的物质的量浓度为
100ml 0.3mol/L Na2SO4溶液和50ml 0.20mol/L Al2(SO4)3溶液混合后(忽略溶液体积变化),在相同温度下溶液中S04离子的物质的量浓度为( ) 半山鸟1年前2
半山鸟1年前2 -
 xiang7188 共回答了21个问题
xiang7188 共回答了21个问题 |采纳率95.2%(100*0.3+50*0.2*3)/(100+50 )=0.4mol/L1年前查看全部
- 往100mL 1mol/L的Al2(SO4)3溶液中加入1mol/L的NaOH溶液.求:
往100mL 1mol/L的Al2(SO4)3溶液中加入1mol/L的NaOH溶液.求:
(1)当生成Al(OH)3沉淀最多时,加入的NaOH溶液的体积是多少?
(2)当产生的沉淀的质量为7.8g时,需要加入上述NaOH溶液的体积是多少? 早六点1年前1
早六点1年前1 -
 safcfu2md14la9d 共回答了20个问题
safcfu2md14la9d 共回答了20个问题 |采纳率85%提示一下:
(1)铝离子完全转化为沉淀时,生成的沉淀最多,按AI3+ + 3OH- = Al(OH)3 计算;
(2)当生成沉淀的质量为7.8克时,分两种情况:
一种是氢氧化钠少量,部分铝离子转化为沉淀,按AI3+ + 3OH- = Al(OH)3 计算;
第二种是氢氧化钠过量,铝离子全部转化为沉淀后,又有部分溶解在过量的氢氧化钠溶液中,剩余沉淀为7.8克,可以按下面两个方程式计算:
AI3+ + 3OH- = Al(OH)3
Al(OH)3 + OH- = AlO2- + 2H2O
自己试试看!1年前查看全部
- 从明矾中提取K2SO4和Al2(SO4)3的主要操作有下列四步,下面是对每步操作提出的问题,请完成填空:
从明矾中提取K2SO4和Al2(SO4)3的主要操作有下列四步,下面是对每步操作提出的问题,请完成填空:
(1)将固体明矾用水溶解,加入过量的氨水,并过滤、洗涤沉淀.加过量氨水的目的是___,洗涤沉淀的目的是___.
(2)取沉淀加___直到沉淀完全溶解,再蒸发、结晶得___.
(3)取(1)的滤液,加稍过量的___溶液并加热,其目的是___;再加入少量___中和多余的碱.
(4)对(3)所得的溶液加热、浓缩、结晶得___.
 leeapple1年前1
leeapple1年前1 -
 勤劳的懒驴 共回答了19个问题
勤劳的懒驴 共回答了19个问题 |采纳率94.7%解题思路:(1)铝离子与氨水反应生成氢氧化铝沉淀;洗涤沉淀除去附着在沉淀上的杂质离子;
(2)氢氧化铝溶于稀硫酸得到硫酸铝溶液,蒸发、结晶得硫酸铝;
(3)在(1)的滤液中含有K2SO4和硫酸铵;加强碱除去铵根离子,再除去多余的碱;
(4)根据从溶液中提取溶质的操作分析.(1)将固体明矾用水溶解,加入过量的氨水,铝离子与氨水反应生成氢氧化铝沉淀,则加过量氨水的目的是把铝离子全部转化为氢氧化铝沉淀;过滤得到氢氧化铝沉淀,沉淀上附着有硫酸根离子、钾离子等,洗涤沉淀是为了除去附着在沉淀上的杂质离子;
故答案为:把铝离子全部转化为氢氧化铝沉淀;除去附着在沉淀上的杂质离子;
(2)取沉淀加,加稀硫酸,氢氧化铝溶于稀硫酸得到硫酸铝溶液,蒸发浓缩硫酸铝溶液、结晶得Al2(SO4)3;
故答案为:稀H2SO4;Al2(SO4)3;
(3)在(1)的滤液中含有K2SO4和硫酸铵,加氢氧化钾溶液并加热除去铵根离子,再加稀硫酸除去多余的KOH;
故答案为:氢氧化钾;除去铵根离子;稀硫酸;
(4)(3)所得的溶液的溶质为K2SO4,则对(3)所得的溶液加热、浓缩、结晶得K2SO4;
故答案为:K2SO4.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用
考点点评: 本题考查学生对工艺流程的理解、物质的判断、实验操作等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.1年前查看全部
- 由K2SO4、Al2(SO4)3、H2SO4及KAl(SO4)2•12H2O组成的混合溶液,测得c(H+)=0.1
由K2SO4、Al2(SO4)3、H2SO4及KAl(SO4)2•12H2O组成的混合溶液,测得c(H+)=0.1mol•L-1,c(Al3+)=0.4mol•L-1,c(SO42-)=0.8mol•L-1,则c(K+)为( )
A.0.15 mol•L-1
B.0.2 mol•L-1
C.0.3 mol•L-1
D.0.4 mol•L-1 zslchensi1年前1
zslchensi1年前1 -
 etin 共回答了19个问题
etin 共回答了19个问题 |采纳率89.5%解题思路:c(H+)=0.1mol/L,因溶液不显电性,则利用阳离子电荷总数等于阴离子电荷总数计算.设K+的物质的浓度为x,
由溶液为电中性可知,c(H+)+c(K+)+3c(Al3+)=2c(SO42-),
则x+0.1mol/L+0.4mol/L×3=0.8mol/L×2,
解得x=0.3mol/L,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的计算,为高频考点,把握信息的处理及溶液为电中性为解答的关键,侧重分析能力、计算能力的考查,题目难度不大.1年前查看全部
- 下列试剂中,可以鉴别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、CuCl2五种溶液的是( )
下列试剂中,可以鉴别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、CuCl2五种溶液的是( )
A.HCl(aq)
B.H2SO4(aq)
C.NaOH(aq)
D.NaNO3(aq) 不是杰倫_ww1年前1
不是杰倫_ww1年前1 -
 yaoqiust 共回答了20个问题
yaoqiust 共回答了20个问题 |采纳率90%解题思路:五种盐溶液的阳离子各不相同,可从阳离子鉴别的角度分析,鉴别阳离子,可加入碱,结合沉淀的颜色等角度判断.A.Na2SO4、MgCl2、FeCl2、Al2(SO4)3、CuCl2与盐酸混合均不反应,所以不能鉴别,故A错误;
B.Na2SO4、MgCl2、FeCl2、Al2(SO4)3、CuCl2与H2SO4(aq)混合均不反应,所以不能鉴别,故B错误;
C.加入氢氧化钠,Na2SO4无现象,MgCl2生成白色沉淀,FeCl2生成白色沉淀然后迅速变成灰绿色,最后总变成红褐色,Al2(SO4)3先生成白色絮状沉淀,氢氧化钠过量时沉淀溶解,CuCl2生成蓝色沉淀,五种物质现象各不相同,可鉴别,故C正确;
D.Na2SO4、MgCl2、FeCl2、Al2(SO4)3、CuCl2与NaNO3(aq)混合均不反应,所以不能鉴别,故D错误.
故选C.点评:
本题考点: 物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查物质的检验和鉴别,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,难度不大.1年前查看全部
- 泡沫灭火剂包括Al2(SO4)3溶液(约1mol/L)、NaHCO3溶液(约1mol/L)及发泡剂.使用时发生的化学反应
泡沫灭火剂包括Al2(SO4)3溶液(约1mol/L)、NaHCO3溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是______.Al2(SO4)3溶液和NaHCO3溶液的体积比约是______.若用等体积、等浓度(mol/L)的Na2CO3代替NaHCO3液,在使用时喷不出泡沫,这是因为______.泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢 钠溶液,不能把硫酸铝溶液盛在铁筒里的原因是______.
 WHB19681年前2
WHB19681年前2 -
 litmermaid 共回答了27个问题
litmermaid 共回答了27个问题 |采纳率92.6%解题思路:铝离子和碳酸氢根离子双水解会产生沉淀和气体,根据谁解原理方程式可以确定二者量的关系;碳酸根的水解是分步进行的,先水解得到碳酸氢根,进一步水解得到二氧化碳;硫酸铝中的铝离子水解得到的溶液显示酸性,能和金属铁发生反应.Al2(SO4)3溶液和NaHCO3溶液混合后会发生双水解反应,原理方程式为:Al2(SO4)3+6NaHCO3═2Al(OH)3↓+6CO2↑+3Na2SO4,Al2(SO4)3溶液和NaHCO3溶液的体积比约是1:6,由1mol的碳酸根离子转化为1molCO2需2molH+,H+由Al3+提供(水解),在Al3+量不变的情况下,碳酸根离子先水解得到碳酸氢根,只能生成HCO3-,没有CO2,喷不出泡沫,并且双水解时NaHCO3表面生成Al(OH)3后,会阻碍反应的进行,Al3+水解产生的H+会和金属铁反应,这样会腐蚀铁筒,所以不能把硫酸铝溶液盛在铁筒里.
故答案为:Al2(SO4)3+6NaHCO3═2Al(OH)3↓+6CO2↑+3Na2SO4;1:6;由1molCO32-转化为1molCO2需2molH+,H+由Al3+提供(水解),现因Al3+量不变,只能生成HCO3-,没有CO2,喷不出泡沫,另外,NaHCO3表面生成Al(OH)3后,阻碍反应的进行;Al3+水解产生的H+会腐蚀铁筒.点评:
本题考点: 盐类水解的应用.
考点点评: 本题考查学生盐的水解原理以及水解原理的应用知识,考查学生对教材知识的梳理情况,难度不大.1年前查看全部
- Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度为0.8mol/L,当加入
Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度为0.8mol/L,当加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )
A. 0.2mol/L
B. 0.1mol/L
C. 0.45mol/L
D. 0.225mol/L 小小茉1年前1
小小茉1年前1 -
 蟑螂王 共回答了20个问题
蟑螂王 共回答了20个问题 |采纳率90%解题思路:当加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中n(Al3+)=[1/4]×2mol/L×0.1L=0.05mol,根据原溶液中电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),以此进行小计算原混合物中K+的物质的量浓度.加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,发生反应为:Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中铝离子的物质的量为:n(Al3+)=[1/4]×2mol/L×0.1L=0.05mol,
则原溶液中铝离子的浓度为:c(Al3+)=[0.05mol/0.1L]=0.5mol/L,
根据原溶液中电荷守恒可知:c(K+)+3c(Al3+)=2c(SO42-),
则c(K+)=2×0.8mol/L-0.5mol/L×3=0.1mol/L,
故选B.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查有关混合物的计算,为高频考点,题目难度中等,注意明确铝离子与氢氧根离子的物质的量关系及溶液中的电荷守恒为解题的关键.1年前查看全部
- 由K2SO4、Al2(SO4)3、H2SO4及KAl(SO4)2•12H2O组成的混合溶液,测得c(H+)=0.1
由K2SO4、Al2(SO4)3、H2SO4及KAl(SO4)2•12H2O组成的混合溶液,测得c(H+)=0.1mol•L-1,c(Al3+)=0.4mol•L-1,c(SO42-)=0.8mol•L-1,则c(K+)为( )
A. 0.15 mol•L-1
B. 0.2 mol•L-1
C. 0.3 mol•L-1
D. 0.4 mol•L-1 xrlhlp1年前1
xrlhlp1年前1 -
 txtwgr 共回答了22个问题
txtwgr 共回答了22个问题 |采纳率90.9%解题思路:c(H+)=0.1mol/L,因溶液不显电性,则利用阳离子电荷总数等于阴离子电荷总数计算.设K+的物质的浓度为x,
由溶液为电中性可知,c(H+)+c(K+)+3c(Al3+)=2c(SO42-),
则x+0.1mol/L+0.4mol/L×3=0.8mol/L×2,
解得x=0.3mol/L,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的计算,为高频考点,把握信息的处理及溶液为电中性为解答的关键,侧重分析能力、计算能力的考查,题目难度不大.1年前查看全部
- 只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、CuSO4五种溶液,这种试剂是( )
只用一种试剂可以区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、CuSO4五种溶液,这种试剂是( )
A. 盐酸
B. NaOH溶液
C. 硫酸
D. NaNO3溶液 susu29331年前2
susu29331年前2 -
 souhunzhe0 共回答了18个问题
souhunzhe0 共回答了18个问题 |采纳率100%解题思路:五种盐溶液的阳离子各不相同,可从阳离子鉴别的角度分析,鉴别阳离子,可加入碱,结合沉淀的颜色等角度判断.A.加入盐酸,与五种物质都不反应,不能鉴别,故A错误;
B.加入氢氧化钠,Na2SO4无现象,MgCl2生成白色沉淀,FeCl2生成白色沉淀,迅速变成灰绿色,最后总变成红褐色,Al2(SO4)3先生成白色絮状沉淀,氢氧化钠过量时沉淀溶解,CuSO4生成蓝色沉淀,五种物质现象各不相同,可鉴别,故B正确;
C.加入硫酸,都不反应,不能鉴别,故C错误;
D.加入硝酸钠,都不反应,不能鉴别,故D错误.
故选B.点评:
本题考点: 物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查物质的检验和鉴别,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,难度不大.1年前查看全部
- 向50 mL 1 mol·L-1的Al2(SO4)3溶液中加入100 mL KOH溶液,充分反应得到3.9 g 沉淀,
向50 mL 1 mol·L-1的Al2(SO4)3溶液中加入100 mL KOH溶液,充分反应得到3.9 g 沉淀,
则KOH溶液的物质的浓度可能是?
当KOH过量时,n(KOH)=4n(Al3+)-n〔Al(OH)3〕=0.4 mol-0.05 mol=0.35 mol,请问这一步怎么解释 liangxf1年前1
liangxf1年前1 -
 阿發 共回答了21个问题
阿發 共回答了21个问题 |采纳率81%当氢氧化钾少量时,设KOH的物质的量浓度为X
Al2(SO4)3+6KOH=2Al(OH)3↓+3K2SO4
6 156
0.1L*X 3.9g
X=1.5mol/L
当当氢氧化钾过量时,设硫酸铝完全反应需要KOH的物质的量为Y,反应生成Al(OH)3的质量为Z
Al2(SO4)3+6KOH=2Al(OH)3↓+3K2SO4
1 6 156
0.05L*1mol/L Y Z
Y=0.3mol
Z=7.8g
又与氢氧化钾反应氢氧化铝的质量为7.8g-3.9g=3.9g
设又与氢氧化铝反应需要氢氧化钾的物质的量为W
Al(OH)3+KOH=KAlO2+2H2O
78 1
3.9g W
W= 0.05mol
所以一共需要氢氧化铝的物质的量为0.3mol+0.05mol=0.35mol
KOH溶液的物质的浓度为0.35mol/0.1L=3.5mol/L
答:KOH溶液的物质的浓度可能是1.5mol/L或3.5mol/L
请问这一步怎么解释?
你根据上面的化学方程式就可以看出.如果不明白,再问.1年前查看全部
- Al2O3+3H2SO4= Al2(SO4)3+3H2O离子方程式
 瞵囵1年前1
瞵囵1年前1 -
 放了我 共回答了19个问题
放了我 共回答了19个问题 |采纳率89.5%Al2O3 +6H+ ===2Al+ +3H2O1年前查看全部
- 有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol•L-1,SO42-的浓度是0.7mol•L-
有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol•L-1,SO42-的浓度是0.7mol•L-1,则Al3+浓度最接近于( )
A.0.4mol•L-1
B.0.2mol•L-1
C.0.3mol•L-1
D.0.6mol•L-1 无穷的ll1年前1
无穷的ll1年前1 -
 飞天狮 共回答了16个问题
飞天狮 共回答了16个问题 |采纳率87.5%解题思路:电解质溶液呈电中性,所以溶液中阴阳离子所带电荷相等,根据电荷守恒确定铝离子浓度.电解质溶液呈电中性,则溶液中阴阳离子所带电荷相等,根据电荷守恒得c(K+)+3c(Al3+)=2c(SO42-),
所以c(Al3+)=
2c(SO42−)−c(K+)
3=[2×0.7mol/L−0.2mol/L/3]=0.4mol/L,
故选A.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了离子浓度的计算,根据电解质溶液呈电中性,再结合电荷守恒来分析解答即可,注意再这里不考虑铝离子水解,为易错点.1年前查看全部
- 已知Ba[Al(OH)4]可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的
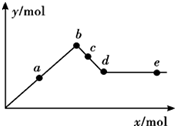 已知Ba[Al(OH)4]可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量(x)的关系.下列有关叙述正确的是( )
已知Ba[Al(OH)4]可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量(x)的关系.下列有关叙述正确的是( )
A.a~b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c~d时溶液中离子的物质的量:[Al(OH)4]-比Ba2+多
C.a~d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d~e时溶液中离子的物质的量:Ba2+一定等于OH- 诗家天子1年前1
诗家天子1年前1 -
 南无世尊 共回答了21个问题
南无世尊 共回答了21个问题 |采纳率90.5%解题思路:A、根据a-b是沉淀生成增大的过程,发生A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,b点沉淀的物质的量最大以及所发生的反应来回答;
B、c-d发生反应2Al(OH)3+Ba(OH)2=Ba[Al(OH)4]2,Ba[Al(OH)4]2电离出[Al(OH)4]-、Ba2+,据此判断;
C、a-b发生A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,b~d中Al(OH)3沉淀逐渐溶解转化为Ba[Al(OH)4]2,据此来分析;
D、d点时Al(OH)3沉淀恰好完全溶解,此时溶液中只存在Ba[Al(OH)4]2,当加入的Ba(OH)2的物质的量等于Ba[Al(OH)4]2的物质的量时,溶液中Ba2+与OH-的量相等.A、在a-b发生反应A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,由方程式可知,沉淀的物质的量:Al(OH)3<BaSO4,故A错误;
B、c-d发生反应2Al(OH)3+Ba(OH)2=Ba[Al(OH)4]2,1molBa[Al(OH)4]2电离出2mol[Al(OH)4]-、1molBa2+,故[Al(OH)4]-比Ba2+多,故B正确;
C、a-b发生A12(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,由方程式可知,沉淀的物质的量:Al(OH)3<BaSO4,b~d中Al(OH)3沉淀逐渐溶解转化为Ba[Al(OH)4]2,故a-d时沉淀的物质的量:BaSO4大于A1(OH)3,故C错误;
D、d点时Al(OH)3沉淀恰好完全溶解,此时溶液中只存在Ba[Al(OH)4]2,当加入的Ba(OH)2的物质的量等于Ba[Al(OH)4]2的物质的量时,溶液中Ba2+与OH-的量相等,故D错误;
故选B.点评:
本题考点: 离子方程式的有关计算.
考点点评: 结合图象知识来考查离子之间的反应,难度较大,熟悉每一段图中对应的化学反应是解答本题的关键.1年前查看全部
- 有一些元素上面还有数字什么意思呀 Al2(SO4)3 O上面有-2,是什么含义
有一些元素上面还有数字什么意思呀 Al2(SO4)3 O上面有-2,是什么含义
有一些元素上面还有数字什么意思呀 Al2(SO4)3 O上面有-2,是什么含义 mb2922d1年前1
mb2922d1年前1 -
 糖粒儿 共回答了18个问题
糖粒儿 共回答了18个问题 |采纳率72.2%2 2 21年前查看全部
- 在V mL Al2(SO4)3溶液中含有Al3+m g,取[V/4]mL该溶液用水稀释至4
在V mL Al2(SO4)3溶液中含有Al3+m g,取[V/4]mL该溶液用水稀释至4V mL,则SO42-物质的量浓度为( )
A.[125m/36V] mol/L
B.[125m/9V]mol/L
C.[125m/54V]mol/L
D.[125m/18V]mol/L qq里说ffqq1年前1
qq里说ffqq1年前1 -
 jinqw00 共回答了21个问题
jinqw00 共回答了21个问题 |采纳率100%解题思路:根据n=[m/M]计算mg Al3+的物质的量,进而计算[V/4]mL溶液中Al3+的物质的量,根据电荷守恒可知2n(SO42-)=3n(Al3+),据此计算[V/4]mL溶液中SO42-的物质的量,稀释为4VmL,溶液中SO42-的物质的量不变,再根据c=[n/V]计算稀释后溶液SO42-的物质的量浓度.mg Al3+的物质的量为[m g/27g/mol]=[m/27]mol,
故[V/4]mL溶液中Al3+的物质的量为[m/27]mol×[1/4]=[m/108]mol,
根据电荷守恒可知2n(SO42-)=3n(Al3+),故[V/4]mL溶液中SO42-的物质的量为[m/108]mol×[3/2]=[m/72]mol,
取[V/4]mL溶液稀释到4V mL,则稀释后溶液SO42-的物质的量浓度为
m
72mol
4V×10−3L=[125m/36V]mol/L,
故选A.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的有关计算,难度不大,属于字母型计算,容易计算出问题,注意对公式的理解与灵活运用.1年前查看全部
- (2011•信阳二模)固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3,某同学设计并进行实验对该
(2011•信阳二模)固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3,某同学设计并进行实验对该混合物进行分离,以得到纯净的AlCl3和FeCl3,图甲是该同学设计并进行的实验:
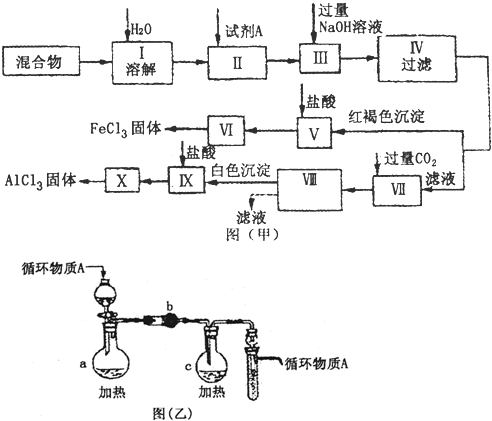
(1)实验操作Ⅱ需加入适宜的试剂,你认为最好选用的试剂是______.
A.KMnO4(H+)溶液B.硝酸C.H2O2 D.浓硫酸
(2)操作V的离子方程式为______;操作Ⅶ的离子方程式为______.
(3)图乙是操作Ⅵ、X制取无水FeCl3、AlCl3的部分装置(铁架台、加热装置等已略去).
①图乙中,装置a由______、圆底烧瓶、双孔塞和导管组成.
②循环物质A是______.
③装置b中填充的物质可以是______(填编号).
A.碱石灰B.无水氯化钙C.浓硫酸D.五氧化二磷
(4)你认为该同学的实验最后______(填“能”或“不能”)得到纯净的AlCl3和FeCl3.若不能,请你完善该同学的实验步骤设计(用文字叙述):______.(若能,此空不填) hellfire1681年前1
hellfire1681年前1 -
 灵色 共回答了24个问题
灵色 共回答了24个问题 |采纳率91.7%解题思路:由流程可知,混合物溶解后,加试剂A将亚铁离子氧化为铁离子,A为过氧化氢,然后加过量NaOH,过滤后得ⅤⅡ中含硫酸钠、偏铝酸钠,V为Fe(OH)3,Ⅵ为氯化铁溶液,Ⅶ中通入二氧化碳,得到的IX为Al(OH)3,X为氯化铝溶液,以此来解答.由流程可知,混合物溶解后,加试剂A将亚铁离子氧化为铁离子,A为过氧化氢,然后加过量NaOH,过滤后得ⅤⅡ中含硫酸钠、偏铝酸钠,V为Fe(OH)3,Ⅵ为氯化铁溶液,Ⅶ中通入二氧化碳,得到的IX为Al(OH)3,X为氯化铝溶液,
(1)由上述分析可知,氧化亚铁离子不能引入新杂质,只有C符合,故答案为:C;
(2)操作V中加盐酸,该离子方程式为3H++Fe(OH)3═Fe3+3H2O,操作Ⅶ通入二氧化碳,该离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:3H++Fe(OH)3═Fe3+3H2O;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)图乙是操作Ⅵ、X制取无水FeCl3、AlCl3的部分装置,
①由图可知,a为分液漏斗,故答案为:分液漏斗;
②因FeCl3、AlCl3水解生成盐酸易挥发,应在通HCl气流中蒸发,则循环物质为HCl,故答案为:HCl;
③为干燥管,起干燥作用,应为固体干燥剂,且不与HCl反应,只有B、D符合,故答案为:BD;
(4)由流程可知,生成的沉淀没有洗涤,可能混有其它离子,则应在溶解沉淀前洗涤沉淀,所以不能得到纯净的AlCl3和FeCl3,
故答案为:不能;在溶解沉淀前洗涤沉淀.点评:
本题考点: 物质的分离、提纯的基本方法选择与应用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查物质的分离、提纯,把握流程中各步发生的反应及操作为解答的关键,注意过滤后的沉淀可能不纯及盐类水解应用,题目难度不大.1年前查看全部
- 下列说法正确的是( )A.200ml 1 mol/L Al2(SO4)3溶液中,Al3+和SO42
下列说法正确的是( )
A.200ml 1 mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为6.02×1023
B.标准状况下11.2L氦气中含有的原子个数为1NA
C.46g NO2和N2O4的混合物含有的原子数为3NA
D.标准状况下,11.2L苯所含的分子数为0.5 NA 英雄没法不zz1年前1
英雄没法不zz1年前1 -
 fhxyroc 共回答了15个问题
fhxyroc 共回答了15个问题 |采纳率93.3%解题思路:A.硫酸铝溶液中,铝离子在溶液中部分水解,导致溶液中铝离子数目减少;
B.稀有气体为单原子分子,0.5mol氦气中含有0.5mol氦原子;
C.NO2和N2O4的最简式为NO2,根据最简式计算出混合物中含有原子总数;
D.标准状况下,苯的状态不是气体,不能使用标况下的气体摩尔体积减少其物质的量.A.200mL 1 mol/L Al2(SO4)3溶液中含有溶质硫酸铝0.2mol,含有0.6mol硫酸根离子,由于铝离子部分水解,则溶液中铝离子小于0.4mol,则Al3+和SO42-离子的总物质的量小于1mol,Al3+和SO42-离子总数小于6.02×1023,故A错误;
B.标准状况下,11.2L氦气的物质的量为0.5mol,0.5mol氦气中含有0.5mol氦原子,含有的原子个数为0.5NA,故B错误;
C.46g NO2和N2O4的混合物中含有1mol最简式NO2,含有2mol氧原子、1mol氮原子,总共含有3mol原子,含有的原子数为3NA,故C正确;
D.标况下,苯不是气体,不能使用标况下的气体摩尔体积计算11.2L苯的物质的量,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,选项B为易错点,注意稀有气体为单原子分子.1年前查看全部
- 只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
A.Ba(OH)2
B.H2SO4
C.NaOH
D.AgNO3 morpheus1001年前1
morpheus1001年前1 -
 aa89528390 共回答了25个问题
aa89528390 共回答了25个问题 |采纳率92%解题思路:五种盐溶液的阳离子各不相同,可从阳离子鉴别的角度分析,鉴别阳离子,可加入碱,结合沉淀的颜色、氢氧化铝的两性等角度判断.A.加入Ba(OH)2,Na2SO4和MgCl2都生成白色沉淀,不能鉴别,故A错误;
B.加入H2SO4,以上五种物质都不反应,不能鉴别,故B错误;
C.加入NaOH,Na2SO4无现象,MgCl2生成白色沉淀,FeCl2生成白色沉淀,迅速变成灰绿色,最后总变成红褐色,Al2(SO4)3生成白色沉淀,NaOH过量时,沉淀逐渐溶解,
(NH4)2SO4生成刺激性气体,五种物质现象各不相同,可鉴别,故C正确;
D.加入AgNO3,以上物质都生成白色沉淀,不能鉴别,故D错误.
故选C.点评:
本题考点: 物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查物质的检验和鉴别的基本方法,题目难度不大,本题注意把握五种物质的组成上的异同,从反应具有不同现象的角度考虑.1年前查看全部
- 配置Al2(SO4)3溶液时,防止发生水解可加入少量什么?
 feixueyuxiao1年前1
feixueyuxiao1年前1 -
 dunetycoon 共回答了23个问题
dunetycoon 共回答了23个问题 |采纳率91.3%加入少量硫酸可抑制水解1年前查看全部
- 含0.4molAI离子的AL2(SO4)3中所含的硫酸根离子的物质的量是?
 我轻舞肥羊1年前3
我轻舞肥羊1年前3 -
 Cady87 共回答了16个问题
Cady87 共回答了16个问题 |采纳率81.3%Al2(SO4)3——2Al——3SO4
2 3
0.4 x
2/0.4==3/x
x==0.6mol
所以含硫酸根离子的物质的量是0.6mol1年前查看全部
- 将KOH滴加到Al2(SO4)3中,先生成沉淀,后溶解,将Al2(SO4)3滴加到KOH中,先没有现象,后生成沉淀
将KOH滴加到Al2(SO4)3中,先生成沉淀,后溶解,将Al2(SO4)3滴加到KOH中,先没有现象,后生成沉淀
这是为什么? ljg919tt1年前1
ljg919tt1年前1 -
 荇菜A 共回答了17个问题
荇菜A 共回答了17个问题 |采纳率100%6KOH+AL2(SO4)3=2AL(OH)3+3K2SO4 6KOH+3AL(OH)3=3KALO2++6H2O随着氢氧化钾浓度升高氢氧化铝沉淀溶解为偏铝酸钾 第二部随着硫酸铝浓度增加氢氧化钾浓度降低生成氢氧化铝沉淀1年前查看全部
- 含0.4MOL铝离子的AL2(SO4)3中含硫酸根的物质的量是?
含0.4MOL铝离子的AL2(SO4)3中含硫酸根的物质的量是?
怎么算啊 roberto-baggio1年前1
roberto-baggio1年前1 -
 woiqiu 共回答了19个问题
woiqiu 共回答了19个问题 |采纳率100%(0.4/2)*3=0.6MOL1年前查看全部
- 实验室中要使Al2(SO4)3溶液中的Al3+全部沉淀出来,最适宜的试剂是( )
实验室中要使Al2(SO4)3溶液中的Al3+全部沉淀出来,最适宜的试剂是( )
A. NaOH溶液
B. 氨水
C. Ba(OH)2溶液
D. 盐酸 黑天六必治11年前1
黑天六必治11年前1 -
 电流cc 共回答了21个问题
电流cc 共回答了21个问题 |采纳率81%解题思路:根据题意,Al3+转化为不溶于水的物质是Al(OH)3,Al(OH)3具有两性,既能和酸反应又能和强碱反应,要使Al2(SO4)3溶液中的Al3+完全沉淀,选取试剂时就不能选强碱,只能是弱碱.Al3+转化为不溶于水的物质是Al(OH)3,Al(OH)3具有两性,既能和酸反应又能和强碱反应,要使Al2(SO4)3溶液中的Al3+完全沉淀,选取试剂时就不能选强碱,只能是弱碱.
A、C选项是强碱,所以不可;D选项是酸,与Al3+不反应,所以不可;B选项是弱碱,可以.
故选B点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题以选择沉淀剂为载体,考查铝的重要化合物的性质,难度不大,注意题目要求意在考查氢氧化铝的两性这一特性.1年前查看全部
- 帮我解下这道物质的量浓度的题100ml0.3mol/L的Na2so4溶液和50ml0.2mol/L的Al2(so4)3溶
帮我解下这道物质的量浓度的题
100ml0.3mol/L的Na2so4溶液和50ml0.2mol/L的Al2(so4)3溶液混合后,溶液中so4离子的物质的量浓度为多少? xcbcy1年前1
xcbcy1年前1 -
 gs441585 共回答了25个问题
gs441585 共回答了25个问题 |采纳率92%100ml0.3mol/L的Na2so4溶液的物质的量:0.3x0.1=0.03mol
所以SO4 2-的物质的量:0.03molx1=0.03mol
50ml0.2mol/L的Al2(so4)3溶液的物质的量:0.2x0.05=0.01mol
所以SO4 2-的物质的量:0.01molx3=0.03mol
那么总的SO4 2-的物质的量:0.03+0.03=0.06mol
所以so4离子的物质的量浓度:0.06mol/(0.1+0.05)=0.4mol/L1年前查看全部
- pH=5的Al2(SO4)3溶液中由水电离出来的氢离子的浓度是多少?为什么?
 太康公主11年前1
太康公主11年前1 -
 wubing508 共回答了17个问题
wubing508 共回答了17个问题 |采纳率94.1%10^-5 mol/L
溶液中的H+全部由水电离1年前查看全部
- 1、Al+Hcl——2、Al2O3电解3、Al+Fe2SO4——4、Al2O3+H2SO4——5、Al2(SO4)3+N
1、Al+Hcl——2、Al2O3电解3、Al+Fe2SO4——4、Al2O3+H2SO4——5、Al2(SO4)3+NH3.H2O——
 sjs198309291年前1
sjs198309291年前1 -
 shanghaixiaojie 共回答了19个问题
shanghaixiaojie 共回答了19个问题 |采纳率94.7%1、2Al+6Hcl——2AlCl3+3H2
2、2Al2O3电解4Al+3O2
3、2Al+3Fe2SO4——Al2(SO4)3+3Fe
4、Al2O3+3H2SO4——Al2(SO4)3+3H2
5、Al2(SO4)3+6NH3.H2O——2Al(OH)3+3(NH4)2SO41年前查看全部
- 氢氧化铝制备(离子方程式)化学方程式:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4变成
氢氧化铝制备(离子方程式)
化学方程式:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4变成离子方程式.顺便问一下,NH3·H2O离子方程式时能拆么?怎么拆? 2834199961年前1
2834199961年前1 -
 jskaaa 共回答了27个问题
jskaaa 共回答了27个问题 |采纳率85.2%2Al3+ + 6NH3·H2O = 2Al(OH)3↓ + 6NH4+
NH3·H2O离子方程式时不能拆1年前查看全部
- 2AL+3H2SO4=AL2(SO4)3+3H2气体溢出,这个方程用文字表达怎么说,把原子的个数也写明一下.谢天谢地
2AL+3H2SO4=AL2(SO4)3+3H2气体溢出,这个方程用文字表达怎么说,把原子的个数也写明一下.谢天谢地
2个铝原子和3个()反应生成。 qq登陆1年前3
qq登陆1年前3 -
 22703384 共回答了26个问题
22703384 共回答了26个问题 |采纳率76.9%两个铝原子与3个硫酸分子反应生成一个硫酸铝分子和3个氢气分子.
整个参与反应的原子个数为23个.1年前查看全部
- 2Al+3H2SO4=Al2(SO4)3+3H2
2Al+3H2SO4=Al2(SO4)3+3H2
2Al+2NaOH=2NaAlO2+2H2
由上,为什么相同质量的铝需要的稀硫酸和氢氧化钠的量为3:2 这里的“量”指的是什么? lengyuye21年前3
lengyuye21年前3 -
 canaes3816 共回答了20个问题
canaes3816 共回答了20个问题 |采纳率85%物质的量(计量数),质量
ps你的第二个方程式应该是
2Al+2NaOH+2H2O=2NaAlO2+3H21年前查看全部
- AL2(SO4)3溶液的物质量浓度为C,若已知溶液含硫酸根离子n(mol)时,体积为多少毫升?
 A任我行A1年前1
A任我行A1年前1 -
 农科园 共回答了22个问题
农科园 共回答了22个问题 |采纳率90.9%c=n/v
因为SO4 2- 的 n 为 AL2(SO4)3的3倍
所以AL2(SO4)3的 N 为 1/3n
所以V=n/3c1年前查看全部
- 向盛有2-3ml 0.5mol/L Al2(SO4)3溶液的试管中,滴加氨水 然后将此试管里的物质分别装到两支试管中(同
向盛有2-3ml 0.5mol/L Al2(SO4)3溶液的试管中,滴加氨水 然后将此试管里的物质分别装到两支试管中(同下
一支试管滴入2mol/LHCL溶液,另一支试管滴入2mol/LNaoh溶液,震荡,观察现象
①描述整个实验过程中发生的现象
②写出整个实验中发生反应的化学方程式 人人为我066681年前1
人人为我066681年前1 -
 bestking 共回答了17个问题
bestking 共回答了17个问题 |采纳率100%加入氨水后形成白色胶状沉淀,加盐酸和氢氧化钠后都是沉淀慢慢溶解,最后形成无色透明溶液
Al2(SO4)3 +6NH3.H2O ===2Al(OH)3 +3(NH4)2SO4 +6H2O
Al(OH)3 +3HCl ==AlCl3 +3H2O
Al(OH)3 +NaOH ==NaAlO2 +2H2O1年前查看全部
- 在常温下的Al2(SO4)3、K2SO4和H2SO4的混和溶液中,若pH=1,c(SO42-)=0.8mol/L,c(A
在常温下的Al2(SO4)3、K2SO4和H2SO4的混和溶液中,若pH=1,c(SO42-)=0.8mol/L,c(Al3+)=0.4mol/L,则K+的物质的浓度为( )
A.0.1 mol/L
B.0.2 mol/L
C.0.3 mol/L
D.0.4 mol/L 同切而战1年前1
同切而战1年前1 -
 araina 共回答了15个问题
araina 共回答了15个问题 |采纳率80%解题思路:pH=1,则c(H+)=0.1mol/L,因溶液不显电性,则利用阳离子电荷总数等于阴离子电荷总数计算.pH=1,则c(H+)=0.1mol/L,设K+的物质的浓度为x,
由溶液为电中性可知,
x+0.1mol/L+0.4mol/L×3=0.8mol/L×2,
解得x=0.3mol/L,
故选C.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的计算,为高频考点,把握信息的处理及溶液为电中性为解答的关键,侧重分析能力、计算能力的考查,题目难度不大.1年前查看全部
- 下列说法正确的是( )A.不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4B
下列说法正确的是( )
A.不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4
B.可以用分液漏斗分离下列三组液态混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇
C.在由水电离出的c(H+)=1×10-14 mol/L的溶液中可以大量存在Na+、K+、NO3-、HCO3-
D.实验室保存少量液溴和白磷常用水封 天上闲人1年前1
天上闲人1年前1 -
 LL_ASDF 共回答了17个问题
LL_ASDF 共回答了17个问题 |采纳率100%解题思路:A、根据物质和其他物质反应的实验现象的不同来检验物质;
B、互不相容的两层液体的分离可以采用分液的方法来分离;
C、由水电离出的c ( H+ )=1×10-14 mol/L的溶液可以是强酸性溶液还可以是强碱性的溶液;
D、溴极易挥发,白磷的着火点很低.A、Na2CO3和Al2(SO4)3反应生成沉淀和气体,和NaHSO4反应会产生气泡,不和氯化钠反应,反应的现象不一样,可以鉴别,故A错误;
B、硝基苯和水互不相溶,可以分液法分离、但是油酸和水、乙酸乙酯和乙醇均是相互溶解的,不能采用分液的方法分离,故B错误;
C、由水电离出的c ( H+ )=1×10-14 mol/L的溶液可以是强酸性溶液还可以是强碱性的溶液,HCO3-在强酸性和强碱性环境中均不能存在,故C错误;
D、溴极易挥发,加水液封防挥发,白磷不溶于水,且比水的密度大,可以将少量的白磷放入盛有冷水的广口试剂瓶中,并经常注意保持足够的水量.通过水的覆盖,既可以隔绝空气,又能防止白磷蒸气的逸出,同时还能保持白磷处于燃点之下,实验室保存少量液溴和白磷常用水封,故D正确.
故选D.点评:
本题考点: 物质的检验和鉴别的实验方案设计;离子共存问题;化学试剂的存放;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题是一道关于物质的分离、检验和鉴别、离子共存以及试剂存放知识的综合考查题,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- 有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为( )
A. 0.1mol/L
B. 0.15mol/L
C. 0.2mol/L
D. 0.25mol/L bga4caux41年前1
bga4caux41年前1 -
 真心缘 共回答了18个问题
真心缘 共回答了18个问题 |采纳率100%解题思路:根据溶液呈电中性原则,溶液中应满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),以此解答该题.溶液呈电中性,则满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),
由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),
所以有3×0.4mol/L+c(K+)=2×0.7mol/L,
c(K+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L,
故选C.点评:
本题考点: 物质的量浓度的相关计算;电解质在水溶液中的电离.
考点点评: 本题考查溶液浓度的计算,题目难度不大,注意从溶液电中性的角度计算溶液离子浓度.1年前查看全部
- 用一种试剂鉴别MgSO4、Al2(SO4)3、FeSO4、Fe2(SO4)3四种失去标签的稀溶液
用一种试剂鉴别MgSO4、Al2(SO4)3、FeSO4、Fe2(SO4)3四种失去标签的稀溶液
要现象、反应离子方程式 冰玉寒1年前6
冰玉寒1年前6 -
 matao111 共回答了22个问题
matao111 共回答了22个问题 |采纳率77.3%先观察颜色,淡绿色是FeSO4,黄色是Fe2(SO4)3,再用NaOH溶液,出现沉淀且不消失的是MgSO4,出现沉淀后又消失的是Al2(SO4)3
离子方程式:(1) Mg2+ +2OH-=Mg(OH)2(沉淀箭头)
(2)Al3+ +2OH-=Al(OH)3(沉淀箭头)
Al(OH)3+OH-=AlO2-+2H2O1年前查看全部
- 用化学方法区别MgSO4、Al2(SO4)3和Fe2(SO4)3三种溶液时,最好选择下列试剂中的( )
用化学方法区别MgSO4、Al2(SO4)3和Fe2(SO4)3三种溶液时,最好选择下列试剂中的( )
A.NaOH溶液
B.KSCN溶液
C.氨水
D.石蕊试液 一顶再顶1年前1
一顶再顶1年前1 -
 _依一_ 共回答了12个问题
_依一_ 共回答了12个问题 |采纳率100%解题思路:MgSO4溶液、Al2(SO4)3和Fe2(SO4)3分别与NaOH溶液的现象为:白色沉淀、先生成白色沉淀后沉淀溶解、红褐色沉淀,以此来解答.A.分别与NaOH溶液的现象为:白色沉淀、先生成白色沉淀后沉淀溶解、红褐色沉淀,现象不同,可鉴别,故A正确;
B.不能鉴别MgSO4、Al2(SO4)3,故B错误;
C.不能鉴别MgSO4、Al2(SO4)3,均生成白色沉淀,故C错误;
D.MgSO4、Al2(SO4)3和Fe2(SO4)3三种溶液均显酸性,加石蕊均变红,现象相同,不能鉴别,故D错误;
故选A.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质的鉴别和检验,为高频考点,把握常见离子的检验及物质之间的反应为解答的关键,注意氢氧化铝的两性,题目难度不大.1年前查看全部
- 在配置AL2(SO4)3溶液时,为了防止发生水解,可以加入少量什么?为什么要加入?
 爱17BT1年前2
爱17BT1年前2 -
 hnnynys 共回答了14个问题
hnnynys 共回答了14个问题 |采纳率78.6%你看 水解是生成H+ 所以加酸使水解平衡向左动(抑制水解)
又因为是硫酸铝 所以为了避免引入杂质离子 就要加稀硫酸1年前查看全部
大家在问
- 1某种白色粉末可能由氯化钾、氯化钡、亚硫酸钠、硫酸钠和硫酸铜中的一种或几种组成.往无色溶液中加硝酸银和稀硝酸,产生大量白色
- 2已知函数fx=2cosx(sinx-√3cosx)+√3,x属于R 求最小正周期和单调
- 3已知数列an的前n项和为Sn,a1=1,Sn=2an+1,则Sn=?
- 4左边一个绕丝旁,右边一个是字,是什么字
- 5已知正数x,y,z满足x∧2+y∧2+z∧2=6,求
- 6如何不画图求解不等式|x − 1| > 5 − 2x.
- 7(怪题)更改过的某种白色粉末可能由氯化钾、氯化钡、亚硫酸钠、硫酸钠和硫酸铜中的一种或几种组成.将少量粉末溶于水,产生白色
- 8美国宇航员大卫·斯科特在登上月球后,从同一高度同时释放锤子和羽毛,看到它们同时落到月球表面,如图2-29所示.某同学在电
- 9在月球上把羽毛和锤子同时扔下谁先落地
- 10在10千克浓度为20%的糖水中加入5%的糖水和白开水若干千克,其中加入的糖水
- 11美国宇航员大卫斯科特在登上月球后,从同一高度同时释放锤子和羽毛,看到它们同时落到月球表面.
- 12水的流速 进水量 水管直径
- 13一水池有甲乙两个水管,甲注水量是乙的1.5倍
- 14祝青奥会成功用英语怎么说
- 15与青奥共成长用英语怎么说

