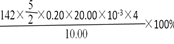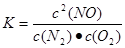NO是大气污染物之一,但少量的NO在人体内却有扩张血管、增强记忆力的功能。已知NO不溶于水且不与水反应,密度比空气大,易
 野渡无人舟子恒2022-10-04 11:39:541条回答
野渡无人舟子恒2022-10-04 11:39:541条回答| NO是大气污染物之一,但少量的NO在人体内却有扩张血管、增强记忆力的功能。已知NO不溶于水且不与水反应,密度比空气大,易与O 2 反应生成NO 2 。那么该气体用什么方法收集 ①向上排空气法②向下排气法③排水法
|

已提交,审核后显示!提交回复
共1条回复
 magiclcl 共回答了17个问题
magiclcl 共回答了17个问题 |采纳率70.6%- C
A、NO易与O 2 反应生成NO 2 ,因此不用向上排空气法,故选项错误;
B、密度比空气大,因此不用向下排空气法,故选项错误;
C、NO不溶于水且不与水反应,因此可以用排水法收集,故选项正确;
D、NO不溶于水且不与水反应,密度比空气大,易与O 2 反应生成NO 2 ,那么该气体只能用排水法收集,故选项错误;
故选C - 1年前
相关推荐
- 下列现象的产生与人为排放大气污染物氮氧化物无关的是( )
下列现象的产生与人为排放大气污染物氮氧化物无关的是( )
A. 闪电
B. 光化学烟雾
C. 酸雨
D. 臭氧层空洞 iameoo1年前1
iameoo1年前1 -
 沈天陌25 共回答了12个问题
沈天陌25 共回答了12个问题 |采纳率91.7%解题思路:酸雨与大量排放SO2及氮氧化物有关;光化学烟雾是大量汽车尾气排放的碳氢化合物(CxHy)、CO和氮氧化物在强光下引起的一系列光化学反应所致;臭氧空洞的形成与氟氯烃或氮氧化物在大气中泄漏与臭氧(O3)发生一系列连锁反应有关;温室效应则是大气中CO2含量(CH4含量)偏高所致.A.闪电属于自然现象,与人为排放大气污染物氮氧化物无关,故A选;
B.光化学烟雾是大量汽车尾气排放的碳氢化合物(CxHy)、CO和氮氧化物在强光下引起的一系列光化学反应所致,故B不选;
C.酸雨与大量排放SO2及氮氧化物有关,故C不选.
D.臭氧空洞的形成与氟氯烃或氮氧化物在大气中泄漏与臭氧(O3)发生一系列连锁反应有关,故D不选;
故选A.点评:
本题考点: 常见的生活环境的污染及治理.
考点点评: 本题考查环境污染问题,题目难度不大,注意人为造成的环境污染与自然现象的区别.1年前查看全部
- 主要的大气污染物有哪些?
 xiaoxiao777731年前1
xiaoxiao777731年前1 -
 五zz出狗狗 共回答了11个问题
五zz出狗狗 共回答了11个问题 |采纳率90.9%大气污染物种类很多,据不完全统计目前全世界每年排入大气的污染物有六亿多吨,已经造成危害或已受到人们注意的约有100多种,其中影响范围广,对人类环境威胁大的有:烟尘、二氧化硫(SO2)、一氧化碳(CO)、碳氢化合物(HC)、二氧化氮(NO2).烟尘和二氧化硫是产生硫酸烟雾的原料和触媒剂.NO2、CO、HC在阳光作用下形成光学烟雾,这些次级污染物有腐蚀性和刺激性,HC中还含有致癌物质.1年前查看全部
- 读图回答1—2题。 1、上述气温的垂直变化示意图中,对流运动旺盛有利于大气污染物扩散的是 [
读图回答1—2题。
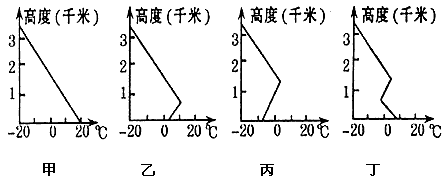
1、上述气温的垂直变化示意图中,对流运动旺盛有利于大气污染物扩散的是 [ ]A、甲图
B、乙图
C、丙图
D、丁图2、该地气温垂直变化由甲依次演变到丁,可推知该地 [ ]A、大气污染减轻
B、大气污染加重
C、大气污染状况没有改变
D、大气污染彻底消除 koerner1年前1
koerner1年前1 -
 47585638 共回答了19个问题
47585638 共回答了19个问题 |采纳率94.7%1、A
2、B1年前查看全部
- NO是汽车为其中的一种大气污染物,它是一种无色气体,难溶于水,密度比空气略大,在空气中能与氧气迅速反
 jakelili1年前1
jakelili1年前1 -
 liujie5552 共回答了14个问题
liujie5552 共回答了14个问题 |采纳率85.7%得到NO21年前查看全部
- 我国城市环境中的大气污染物主要是( )
我国城市环境中的大气污染物主要是( )
A.CO2、Cl2、N2、酸雨
B.SO2、CO、NO2、烟尘
C.NH3、CO2、NO、雾
D.HCl、SO2、N2、粉尘 危乐1年前1
危乐1年前1 -
 谁挽起弓箭 共回答了13个问题
谁挽起弓箭 共回答了13个问题 |采纳率84.6%解题思路:城市大气污染物主要是有害气体和可吸入粉尘,以此解答.A.CO2不是污染物,故A错误;
B.SO2、CO、NO2都是有害气体,烟尘为可吸入粉尘,对人体有害,为污染物,故B正确;
C.CO2、雾不是污染物,故C错误;
D.N2不是污染物,HCl不是主要污染物,故D错误.
故选B.点评:
本题考点: 常见的生活环境的污染及治理.
考点点评: 本题考查常见环境污染问题,题目难度不大,注意物质的性质,特别是对环境的污染和人体的危害.1年前查看全部
- 活性炭可处理大气污染物NO.T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量
活性炭可处理大气污染物NO.T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
(1)2分钟内,用NO表示该反应的平均速率v(NO)=______mol•L-1•min-1.活性炭/mol NO/mol A/mol B/mol 起始状态 2.030 0.100 0 0 2min时 2.000 0.040 0.030 0.030
(2)该反应的化学方程式是______;T℃时,它的平衡常数K=9/16,则2min时反应______(填“是”或“不是”)平衡状态;已知升高温度时,K增大,则该反应为______(填“吸热”或“放热”)反应.
(3)为了提高反应速率和NO的转化率,可采取的措施是______. 芦洲1年前1
芦洲1年前1 -
 sbsujap 共回答了14个问题
sbsujap 共回答了14个问题 |采纳率92.9%解题思路:(1)根据反应速率表达式v=△c△t及表中数据计算出2分钟内,用NO表示该反应的平均速率v(NO);(2)根据表中数据可知,C、NO、A、B化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;根据该温度下的浓度商判断此时是否达到平衡状态;温度升高,平衡向着吸热反应方向移动,据此判断反应放热还是吸热;(3)该反应为体积不变的吸热反应,升高温度可以增大反应速率和一氧化氮的转化率.(1)2min时一氧化氮物质的量变化为:0.100mol-0.040mol=0.060mol,2分钟内,用NO表示该反应的平均速率v(NO)=0.060mol1L2min=0.03mol•L-1•min-1,故答案为:0.03;(2)由表中数据可知,C、NO、E、F的化学计量数...
点评:
本题考点: 化学平衡的影响因素;反应速率的定量表示方法;化学平衡常数的含义.
考点点评: 本题考查化学反应速率计算与影响因素、影响化学平衡的因素、化学平衡常数等等,难度中等,确定发生的反应是解题的关键,注意理解外界条件对平衡的影响.1年前查看全部
- 一氧化氮(NO)是汽车尾气中的大气污染物之一,但是少量的一氧化氮(NO)在人体内能起到扩张血管,增强记忆力的作用.它是一
一氧化氮(NO)是汽车尾气中的大气污染物之一,但是少量的一氧化氮(NO)在人体内能起到扩张血管,增强记忆力的作用.它是一种无色气体,难溶于水,密度比空气略大,在空气中能与氧气反应迅速生成红棕色的二氧化氮气体(NO2).在实验室中用来一氧化氮(NO)收集的方法是( )
A.排水法
B.向上排空法
C.向下排空法
D.排水法或向上排空法 dosjdos1年前1
dosjdos1年前1 -
 月儿挂天上 共回答了20个问题
月儿挂天上 共回答了20个问题 |采纳率85%A、由于一氧化氮难溶于水,所以可以用排水法收集,由于一氧化氮密度比空气略大,在空气中能与氧气反应,迅速生成红棕色的二氧化氮气体(NO2),所以不能用排空气法收集,故A正确;
B、由于一氧化氮密度比空气略大,在空气中能与氧气反应,迅速生成红棕色的二氧化氮气体(NO2),所以不能用排空气法收集,否则会由于变质而收集不到一氧化氮气体,故B错;
C、由于一氧化氮能与空气中氧气反应,所以不能用排空气法收集,故C错;
D、一氧化氮难溶于水,所以可以用排水法收集,一氧化氮能与空气中氧气反应,所以不能用排空气法收集,故D错.
故选A.1年前查看全部
- 蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H 2 S ),H 2 S 气体是一种大气污染物,它在空气完全燃烧时,
蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H 2 S ),H 2 S 气体是一种大气污染物,它在空气完全燃烧时,生成了二氧化硫和水。把H 2 S 气体通入浓H 2 SO 4 中,发生的反应为:H 2 S + H 2 SO 4 ( 浓)==SO 2 + X ↓+ 2H 2 O
(1 )上述内容中,属于H 2 S 的物理性质是_______________________________________ ;
(2 )写出H 2 S 在空气中完全燃烧的化学方程式: ________________________________ ;
(3 )H 2 S 气体通入浓H 2 SO 4 中反应时,生成物中X 的化学式为________________ ;
(4 )若尾气中含有H 2 S ,用浓硫酸来吸收行吗?为什么? _____________________________ ;若你来建议,你认为使用何种试剂能达到吸收的效果?请写出相应的化学方程式________________________ 。 ss凯1234561年前1
ss凯1234561年前1 -
 盐煮咖啡 共回答了24个问题
盐煮咖啡 共回答了24个问题 |采纳率95.8%(1 )无色、有臭鸡蛋气味的气体;
(2 )2H 2 S + 3O 2 === 2SO 2 + 2H 2 O ;
(3 )S
(4 )不行,产生的SO 2 气体仍然是污染性气体; 用氢氧化钠溶液 H 2 S + 2NaOH == Na 2 S + 2H 2 O1年前查看全部
- (2013•普陀区二模)研究NO2、SO2、CO等大气污染物的处理具有重要意义.NO2可用下列反应来处理:6NO2(g)
(2013•普陀区二模)研究NO2、SO2、CO等大气污染物的处理具有重要意义.NO2可用下列反应来处理:6NO2(g)+8NH3(g)⇌7N2(g)+12H2O(g)+Q(Q>0).
完成下列填空:
(1)反应的平衡常数大,处理NO2的效率高.增大该反应平衡常数的措施有______.
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是______.
a.c(NO2):c(NH3)=3:4b.6v(NO2)=7v(N2)
c.容器内气体总压强不再变化d.容器内气体密度不再变化
(3)若平衡时NO2和N2的浓度之比为m/n,保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比______m/n(填“>”、“=”或“<”).
(4)某温度下,在一个容积为2升的反应容器内,上述反应2分钟后达到平衡,测得刚好有3mol电子发生转移,则在2分钟内NH3的平均反应速率为:v(NH3)=______. 宝马Z411年前1
宝马Z411年前1 -
 yyww100 共回答了17个问题
yyww100 共回答了17个问题 |采纳率88.2%解题思路:(1)化学平衡常数只受温度影响,根据温度对平衡移动的影响判断;
(2)a.NO2、NH3的平衡浓度与起始浓度及转化率有关;
b.未指明正、逆速率,且速率之比不等于化学计量数之比,反应未到达平衡;
c.随反应进行气体的物质的量增大,压强增大,压强不变说明到达平衡;
d.混合气体的密度始终不变;
(3)缩小反应容器的体积,压强增大,平衡向逆反应移动,达到新的平衡后n(NO2)增大、n(N2)减小,据此判断;
(4)根据电子转移守恒计算参加反应的n(NH3),再根据v=
计算v(NH3).△n V △t (1)化学平衡常数只受温度影响,使平衡常数增大应改变温度平衡向正反应移动,该反应正反应为放热反应,故应降低温度,
故答案为:降低温度;
(2)a.NO2、NH3的平衡浓度与起始浓度及转化率有关,平衡时二者浓度不一定是3:4,若二者起始浓度为3:4,任意时刻都为3:4,也不能说明到达平衡,故a错误;
b.未指明正、逆速率,且速率之比不等于化学计量数之比,反应未到达平衡,故b错误;
c.随反应进行气体的物质的量增大,压强增大,压强不变说明反应混合物的总物质的量不变,到达平衡状态,故c正确;
d.混合气体的密度始终不变,密度不变不能说明到达平衡,故d错误;
故答案为:c;
(3)缩小反应容器的体积,压强增大,平衡向逆反应移动,达到新的平衡后n(NO2)增大、n(N2)减小,故此时NO2和N2的浓度之比大于[m/n],
故答案为:>;
(4)有3mol电子发生转移,则参加反应的n(NH3)=[3mol/3]=1mol,故v(NH3)=
1mol
2L
2min=0.25 mol/(L•min),
故答案为:0.25 mol/(L•min).点评:
本题考点: 化学平衡常数的含义;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题考查化学平衡常数、平衡状态判断、化学平衡影响因素、化学反应速率计算等,难度中等,注意对基础知识的理解掌握.1年前查看全部
- NO是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能。NO密度比空气大,难溶于水,通常条件下极易与氧气反
NO是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能。NO密度比空气大,难溶于水,通常条件下极易与氧气反应。实验室收集NO的装置是
A.只能用排水法 B.既能用排水法又能用向上排空法 C.只能用向上排空法 D.既能用排水法又能用向下排空法  经验61年前1
经验61年前1 -
 竹根先生 共回答了18个问题
竹根先生 共回答了18个问题 |采纳率94.4%A
1年前查看全部
- (2003•徐州)NO是大气污染物,但少量NO在人体内具有扩张血管,增强记忆功能.NO难溶于水,通常条件下极易与O2反应
(2003•徐州)NO是大气污染物,但少量NO在人体内具有扩张血管,增强记忆功能.NO难溶于水,通常条件下极易与O2反应.则实验室收集NO的方法为( )
A.向下排空气法
B.向上排空气法
C.排水集气法
D.以上方法都可以 紫烟20071年前1
紫烟20071年前1 -
 水木白 共回答了17个问题
水木白 共回答了17个问题 |采纳率100%解题思路:收集气体时不但要考虑气体的密度、水溶性和是否与空气中的成分发生反应,还要考虑气体是否有毒,若有毒则不能用排空气法来收集.N0是大气污染物之一,有毒,且通常条件下极易与氧气反应,因此不能用排空气法收集,从而排除ACD,难溶于水,可以用排水法收集;
故选C.点评:
本题考点: 常用气体的收集方法.
考点点评: 本题考查了一氧化氮的收集方法,分析气体的收集方法时,要注意:有毒气体不能用排空气法来收集.1年前查看全部
- NO是大气污染物,但少量NO在人体内具有扩张血管增强记忆的功能。实验室收集NO只能用排水集气法,对NO的猜想或评价正确的
NO是大气污染物,但少量NO在人体内具有扩张血管增强记忆的功能。实验室收集NO只能用排水集气法,对NO的猜想或评价正确的是 [ ]
A.易溶于水
B.可能极易与氧气反应
C.易和水反应
D.有害无利 shouren1101年前1
shouren1101年前1 -
 majun123721 共回答了21个问题
majun123721 共回答了21个问题 |采纳率95.2%B1年前查看全部
- 目前,燃烧矿物燃料排放出大量的大气污染物,如SO 2 、NO 2 、CO等.必须改变燃料结构,才能降低由燃料引起的大气污
目前,燃烧矿物燃料排放出大量的大气污染物,如SO 2 、NO 2 、CO等.必须改变燃料结构,才能降低由燃料引起的大气污染.在①可燃冰、②氢能、③风能、④太阳能、⑤煤、⑥天然气、⑦石油等能源中,一般不会造成大气污染的是( ) A.①②③④⑥ B.②③④⑥⑦ C.①③④⑤⑥ D.①②③④⑤  憨憨21年前1
憨憨21年前1 -
 qinhua0898 共回答了16个问题
qinhua0898 共回答了16个问题 |采纳率81.3%在提供的燃料中煤、石油的燃烧会生成SO 2 、NO 2 、CO等空气污染物,而可燃冰(甲烷的固态)、氢能、风能、天然气均属清洁能源,使用时不会产生大气污染物;
故选A1年前查看全部
- 某兴趣小组欲在绿色环保的条件下探究大气污染物SO 2 的性质,设计如下图实验装置。请回答:
某兴趣小组欲在绿色环保的条件下探究大气污染物SO 2 的性质,设计如下图实验装置。请回答:

(1)B、C、D分别用于检验SO 2 的漂白性、还原性和氧化性,则B中所盛试剂为 ; C中反应的离子方程式为
(2)为了实现绿色环保的目标,某同学设计了上图A 2 的制取装置来代替A 1 装置,与A 1 装置相比,A 2 装置的优点是
(3)试验中发现Na 2 SO 3 可能部分被氧化,现需测定Na 2 SO 3 的纯度:称取10.00g产品,配成100ml溶液,移取25.00ml溶液,用0.20mol/L酸性KMnO 4 溶液进行滴定,消耗KMnO 4 溶液20.00mL,产品中Na 2 SO 3 质量分数的计算表达式为 ,计算结果为 。(保留两位小数) 饭团子磊1年前1
饭团子磊1年前1 -
 qinjian861121 共回答了18个问题
qinjian861121 共回答了18个问题 |采纳率66.7%1年前查看全部
- (1)二氧化氮是大气污染物之一.通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的______性质(填
(1)二氧化氮是大气污染物之一.通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的______性质(填“物理”或“化学”).
(2)新闻报道《小雨引“燃”一车电石》很好地说明水可“引火”.该报道称:5月9日傍晚,一辆储运电石的汽车因未做好防水工作,行驶过程中天降小雨,引发车厢着火…已知:电石(CaC2)不可燃,与水接触剧烈反应产生乙炔(C2H2).
①根据上述信息,请从物质组成和化学性质的角度,说说你对乙炔气体的认识(各一条).
组成:______;化学性质:______.
②根据上述信息,你认为应该如何保存电石?答______. 群带1年前1
群带1年前1 -
 ken8181 共回答了14个问题
ken8181 共回答了14个问题 |采纳率78.6%解题思路:(1)物质的物理性质是指不需要通过化学变化表现出来的性质;(2)根据物质的化学式可以判断物质的元素组成;根据物质的性质可以判断保存物质的方法.(1)二氧化氮的颜色、状态、气味等方面的性质不需要通过化学变化表现出来,属于物理性质.故填:物理.
(2)①由乙炔的化学式可知,乙炔是由碳元素和氢元素组成的.故填:乙炔是由碳元素和氢元素组成的.
乙炔能够燃烧需要通过化学变化表现出来,属于化学性质.故填:乙炔可以燃烧.
②乙炔能够和水发生化学反应,所以应该防水、密封保存.故填:防水、密封保存.点评:
本题考点: 化学性质与物理性质的差别及应用;分子、原子、离子、元素与物质之间的关系.
考点点评: 解答本题要分析物质的性质是否需要通过化学变化表现出来,如果需要通过化学变化表现出来就属于物质的化学性质.如果不需要通过化学变化表现出来就属于物质的物理性质.1年前查看全部
- NO是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能.NO密度比空气略大、难溶于水的气体,通常条件下极易
NO是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能.NO密度比空气略大、难溶于水的气体,通常条件下极易与氧气反应.实验室收集NO的装置应选用( ) A.向上排空气法 B.向下排空气法 C.向上排空气法或排水集气法 D.排水集气法  精神好差1年前1
精神好差1年前1 -
 tuyuk 共回答了16个问题
tuyuk 共回答了16个问题 |采纳率93.8%A、NO极易与氧气反应,所以不能用排空气法,所以A不正确;
B、NO密度比空气略大,通常条件下极易与氧气反应,不能用排空气法,所以B不正确;
C、NO极易与氧气反应,不能用排空气法,NO难溶于水,可用排水法,所以C不正;
D、因为NO难溶于水,可以用排水法收集,所以D正确.
故选D.1年前查看全部
- 一氧化氮(NO)是汽车尾气中的一种大气污染物,但少量NO在人体内具有扩张血管、增加记忆的功能.它是无色的气体,难溶于水,
一氧化氮(NO)是汽车尾气中的一种大气污染物,但少量NO在人体内具有扩张血管、增加记忆的功能.它是无色的气体,难溶于水,密度比空气略大,通常情况下极易与氧气反应,生成红棕色的二氧化氮.实验室收集NO的方法是( )
A.向上排空气集气法
B.向下排空气集气法
C.排水集气法
D.无法确定 我没有飞翔的因子1年前1
我没有飞翔的因子1年前1 -
 ccwsh 共回答了18个问题
ccwsh 共回答了18个问题 |采纳率94.4%解题思路:气体不溶于水,且不能与水发生反应,可用排水法收集;气体密度大于空气,且不与氧气发生反应的无毒气体,可用向上排空气法收集;气体密度小于空气,且不与氧气发生反应的无毒气体,可用向下排空气法收集.一氧化氮,虽然密度比空气略大,但由于极易与氧气反应且是大气污染物,不宜用排空气法进行收集;一氧化氮难溶于水,可用排水法进行收集;
故选C点评:
本题考点: 常用气体的收集方法.
考点点评: 排水法收集的气体较为纯净,是最理想的收集方法.1年前查看全部
- (2014?番禺区一模)对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:(1)为减少SO2的
(2014?番禺区一模)对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:(1)为减少SO2的
 (2014?番禺区一模)对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
(2014?番禺区一模)对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料.
已知:H2(g)+[1/2O2 ssj03241年前1
ssj03241年前1 -
 不醉不归的我 共回答了12个问题
不醉不归的我 共回答了12个问题 |采纳率91.7%(1)①H2(g)+
1
2O2(g)=H2O(g)△H=-241.8kJ?mol-1
②C(s)+
1
2O2(g)=CO(g)△H=-110.5kJ?mol-1
依据盖斯定律计算②-①得到C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ?mol-1;
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ?mol-1;
(2)①在1.0L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4mol,5s内该反应的平均速率ν(NO)=
8×10-4mol
1.0L
5s]=1.6×10-4 mol/(L?s),依据化学方程式写出反应的平衡常数为:
c2(NO)
c(N2)c(O2);
故答案为:1.6×10-4 mol/(L?s),
c2(NO)
c(N2)c(O2);
②气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移,
故答案为:温度升高,反应速率加快,平衡右移;
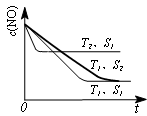
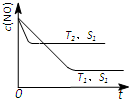
(3)①、温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②、催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为: ,故答案为:
,故答案为: .
1年前查看全部
.
1年前查看全部
- 常见的大气污染物分为一次污染物和二次污染物。二次污染物是排入环境中的一次污染物在物理化学因素或微生物作用下发生变化所生成
常见的大气污染物分为一次污染物和二次污染物。二次污染物是排入环境中的一次污染物在物理化学因素或微生物作用下发生变化所生成的新污染物,如2NO+O 2 ====2NO 2 ,则NO 2 就是二次污染物。下列四种气体中能导致二次污染的是()
①SO 2 ②NO ③NO 2 ④Cl 2A.①②③④ B.①②④ C.②④ D.②
 China加油1年前1
China加油1年前1 -
 示申anson言舌 共回答了20个问题
示申anson言舌 共回答了20个问题 |采纳率95%A
①③④还都能与水作用,生成二次污染物1年前查看全部
- 在催化剂的条件下,什么物质可还原汽车尾气中的大气污染物No2
 lipengju1年前1
lipengju1年前1 -
 黛缘青果 共回答了10个问题
黛缘青果 共回答了10个问题 |采纳率80%理论上来说只要还原性大于N2的就可以,实际上是用CO还原的.这是汽车尾气中含有CO和NO2,只要有适当的催化剂就可以除去NO2,所以用不着特意加还原剂的.1年前查看全部
- 对大气污染物SO 2 、NO x 进行研究具有重要环保意义。请回答下列问题:
对大气污染物SO 2 、NO x 进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO 2 的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:① H 2 (g)+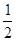 O 2 (g)=H 2 O(g)△H=-241.8kJ·mol -1
O 2 (g)=H 2 O(g)△H=-241.8kJ·mol -1
②C(s)+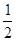 O 2 (g)=CO(g)△H=-110.5kJ·mol -1
O 2 (g)=CO(g)△H=-110.5kJ·mol -1
写出焦炭与水蒸气反应的热化学方程式: 。
(2)已知汽车汽缸中生成NO的反应为:N 2 (g)+O 2 (g) 2NO(g) △H
2NO(g) △H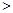 0,若1.0 mol空气含0.80 mol N 2 和0.20 mol O 2 ,1300 o C时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10 -3 mol。
0,若1.0 mol空气含0.80 mol N 2 和0.20 mol O 2 ,1300 o C时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10 -3 mol。
①在1300 o C 时,该反应的平衡常数表达式K= 。5s内该反应的平均速率ν(N 2 ) = (保留2位有效数字);
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
(3)汽车尾气中NO和CO的转化。当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g)+2CO(g) 2CO 2 (g)+N 2 (g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO 2 (g)+N 2 (g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的△H 0 (填“>”或“<”)。
②若催化剂的表面积S 1 >S 2 ,在右图中画出c(NO) 在T 1 、S 2 条件下达到平衡过程中的变化曲线(并作相应标注)。 江晚1年前1
江晚1年前1 -
 噻ztului 共回答了21个问题
噻ztului 共回答了21个问题 |采纳率81%1年前查看全部
- 下列现象的产生与人为排放大气污染物氮氧化物无关的是( )
下列现象的产生与人为排放大气污染物氮氧化物无关的是( )
A. 闪电
B. 光化学烟雾
C. 酸雨
D. 臭氧层空洞 joy小虾1年前1
joy小虾1年前1 -
 晓帝 共回答了20个问题
晓帝 共回答了20个问题 |采纳率90%解题思路:酸雨与大量排放SO2及氮氧化物有关;光化学烟雾是大量汽车尾气排放的碳氢化合物(CxHy)、CO和氮氧化物在强光下引起的一系列光化学反应所致;臭氧空洞的形成与氟氯烃或氮氧化物在大气中泄漏与臭氧(O3)发生一系列连锁反应有关;温室效应则是大气中CO2含量(CH4含量)偏高所致.A.闪电属于自然现象,与人为排放大气污染物氮氧化物无关,故A选;
B.光化学烟雾是大量汽车尾气排放的碳氢化合物(CxHy)、CO和氮氧化物在强光下引起的一系列光化学反应所致,故B不选;
C.酸雨与大量排放SO2及氮氧化物有关,故C不选.
D.臭氧空洞的形成与氟氯烃或氮氧化物在大气中泄漏与臭氧(O3)发生一系列连锁反应有关,故D不选;
故选A.点评:
本题考点: 常见的生活环境的污染及治理.
考点点评: 本题考查环境污染问题,题目难度不大,注意人为造成的环境污染与自然现象的区别.1年前查看全部
- 工业排烟中去除二氧化硫气体的技术主要包括什么?大气污染物的一次污染物是哪些?造成全球气候变暖的温...
工业排烟中去除二氧化硫气体的技术主要包括什么?大气污染物的一次污染物是哪些?造成全球气候变暖的温...
工业排烟中去除二氧化硫气体的技术主要包括什么?大气污染物的一次污染物是哪些?造成全球气候变暖的温室气体是哪些? ef10391年前1
ef10391年前1 -
 天一剑 共回答了16个问题
天一剑 共回答了16个问题 |采纳率100%石灰石/石灰法湿法烟气脱硫技术、喷雾干燥法烟气脱硫技术、氧化镁湿法烟气脱硫技术、海水烟气脱硫技术、湿式氨法烟气脱硫技术、干法烟气脱硫技术等;
一次污染物:烟尘、硫氧化物、氮氧化物、碳氧化物、有机化合物等;
温室气体:H2O(g)、CO2、CH4、N2O、氟化物等1年前查看全部
- (2005•宣武区二模)NO2是一种大气污染物,它是一种红棕色,比空气重的气体,溶水后能与水迅速反应.在实验室中,收集N
(2005•宣武区二模)NO2是一种大气污染物,它是一种红棕色,比空气重的气体,溶水后能与水迅速反应.在实验室中,收集NO2时可选用的集气方法是( )
A.排水集气法
B.向上排空气集气法
C.向下排空气集气法
D.排水集气法或向上排空气集气法 a283701年前1
a283701年前1 -
 秋波滚滚 共回答了19个问题
秋波滚滚 共回答了19个问题 |采纳率89.5%解题思路:收集方法的选择是根据:难溶于水或不易溶于水用排水法收集,密度比空气大且不与空气中成分反应,用向上排空气法收集,密度比空气小且不与空气中成分反应,用向下排空气法收集.因为NO2是一种比空气重的气体,因此可以采用向上排空气法收集;
又因为NO2溶水后能与水迅速反应,因此不能采用排水法收集;
故选项为:B.点评:
本题考点: 常用气体的收集方法.
考点点评: 本题根据题目的信息考查了气体的收集方法,明确收集方法的选择要根据气体的密度和溶解性是解题的关键.1年前查看全部
- 臭氧属于什么A 氧气 B大气污染物 C有机物 D稀有气体
 h2000hyy1年前11
h2000hyy1年前11 -
 lvdepin 共回答了18个问题
lvdepin 共回答了18个问题 |采纳率88.9%1年前查看全部
- 火箭推进剂主要是偏二甲肼(C2H8N2) 它在空气中燃烧时会产生大气污染物,该污染物是什么?
 事实证明俞1年前1
事实证明俞1年前1 -
 yaxiange 共回答了26个问题
yaxiange 共回答了26个问题 |采纳率92.3%碳及一氧化碳1年前查看全部
- 下列化学性质……这个东东是大气污染物之一,能使高锰酸钾溶液褪色,请写出它的化学式,并写明为什么.谢谢
 ynp6b1年前4
ynp6b1年前4 -
 我是廉价品 共回答了18个问题
我是廉价品 共回答了18个问题 |采纳率88.9%二氧化硫,二氧化硫有还原性,高锰酸钾有强氧化性
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO41年前查看全部
- 硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还
硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还
硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理.其主要反应原理如下:
4NO + 4NH3 + O2 4N2 + 6H2O 6NO2 + 8NH3 7N2 + 12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
57.尾气中氮氧化合物的平均相对分子质量为 .
58.尾气中NO的含量为 mg/m3.
59要处理5m3的尾气,需要氨氧混合气的体积为 L.
60.另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O.现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收.
(1)NaOH溶液的物质的量浓度为 mol/L,体积为 mL. lxch991年前1
lxch991年前1 -
 118yyy118 共回答了15个问题
118yyy118 共回答了15个问题 |采纳率93.3%解析:
因为:尾气中氮氧化物与氨氧混合气恰好完全反应
所以根据反应方程式:
4NO + 4NH3 + O2 ―(一定条件)→ 4N2 + 6H2O
6NO2 + 8NH3 ―(一定条件)→ 7N2 + 12H2O
以及NO与NO2物质的量比为4∶1
可推算:
和NO反应的NH3 与 NO的物质的量之比 = 1:1
和NO2反应的NH3 与 NO2的物质的量之比 = 4:3
则可知物质的量之比NO:NO2:NH3(总):O2 = 12:3:16:3
(57)所以 尾气中氮氧化合物的平均相对分子质量为 【(30 * 4/5)+(46 * 1/5) = 33.2】
(58)尾气中NO的含量为 【 2490 * 4/5 = 1992 】mg/m3.
(59)要处理5m3的尾气,需要氨氧混合气的体积为 【 5000 * 19/15 = 6333.333 】L.
(60)另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O.现有含0.5mol氮氧化物的尾气,恰好被一定体积的25% NaOH溶液(密度1.28g/cm3)完全吸收.
相关反应方程式:
2NO + 2NO2 + 4NaOH + O2 ―→ 2NaNO2 + 2NaNO3 + 2H2O
即物质的量NOx :NaOH = 1:1
所以NaOH物质的量= 0.5 mol,其质量 = 40 g/mol * 0.5 mol = 20 g
所以NaOH溶液质量 = 20 g / 25% = 80 g
NaOH溶液体积 = 80g / 1.28 g/cm3 = 62.5 ml1年前查看全部
- 鸡蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H2S),硫化氢气体是一种大气污染物,吸入量过多会使人中毒身亡,它在
鸡蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H2S),硫化氢气体是一种大气污染物,吸入量过多会使人中毒身亡,它在空气中点燃完全燃烧时,生成二氧化碳和水,把硫化氢气体通入浓硫酸中,发生的反应为H2S+H2SO4(浓)═SO2+X↓+2H2O根据以上信息回答问题:
(1)硫化氢的物理性质有______
(2)硫化氢的化学性质有______.
(3)硫化氢与浓硫酸反应时,生成物中X的化学式是______
(4)若尾气中含有硫化氢气体,用浓硫酸来吸收行吗?为什么?
答:______. jiakechong1231年前1
jiakechong1231年前1 -
 十丈红尘 共回答了23个问题
十丈红尘 共回答了23个问题 |采纳率91.3%解题思路:根据题干提供的信息进行分析即可得出硫化氢的物理性质和化学性质,判断物质的化学式可以依据质量守恒定律,化学反应前后元素的种类和原子的个数不变进行.(1)根据题干叙述可知,硫化氢是无色、有臭鸡蛋气味的气体,故填:无色、有臭鸡蛋气味的气体;
(2)根据题干叙述可知,硫化氢是有毒、能燃烧、能和浓硫酸反应的气体,故填:毒性、可燃性、能与浓硫酸反应;
(3)根据质量守恒定律,化学反应前后元素的种类和原子的个数不变,反应前含有4个H原子,2个S原子和4个O原子,反应后已有1个S原子,4个H原子和4个O原子,故X为S,故填:S;
(4)硫化氢能和浓硫酸反应生成二氧化硫气体,所以不能用浓硫酸干燥硫化氢气体,故填:不可以,因为硫化氢与浓硫酸反应后生成二氧化硫污染空气.点评:
本题考点: 化学性质与物理性质的差别及应用;空气的污染及其危害;有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查了物质的物理性质和化学性质、根据质量守恒定律推断物质的化学式等,完成此题,可以依据题干的叙述,从中抽取有用的信息.1年前查看全部
- (2004•南京)一氧化氮(NO)是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能.NO难溶于水,密度比
(2004•南京)一氧化氮(NO)是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能.NO难溶于水,密度比空气略大,通常条件下极易与氧气反应.实验室收集NO的装置是( )
A.
B.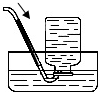
C.
D.
 笛子9261年前1
笛子9261年前1 -
 千颗珠1234 共回答了24个问题
千颗珠1234 共回答了24个问题 |采纳率95.8%解题思路:收集气体有两种方法:排水法和排空气法,排水法适合于难溶于水且不和水反应的气体;排空气法有向上排空气法和向下排空气法两种,向上排空气法适合于密度比空气大而且不与空气成分发生反应的气体,向下排空气法适合于密度比空气小而且不与空气成分发生反应的气体.NO难溶于水,可用排水法收集;密度比空气的略大且极易和空气中的氧气反应,故不能用排空气法收集;
故选B.点评:
本题考点: 常用气体的收集方法.
考点点评: 排水法收集的气体较为纯净,是较为理想的收集方法.(一般有毒气体不适合用排空气的方法)1年前查看全部
- 高空大气中 O 2 的吸收紫外线后可变成臭氧O 3 ,O 3 可分解:O 3 → O 2 + O,O 3 又和大气污染物
高空大气中 O 2 的吸收紫外线后可变成臭氧O 3 ,O 3 可分解:O 3 → O 2 + O,O 3 又和大气污染物如超音速飞机排放的NO发生反应:NO +O 3 →NO 2 + O 2 ,NO 2 + O→ NO + O 2 ,从反应的全过程判断NO的作用是
A.中间产物 B.氧化剂 C.最终产物 D.催化剂  玩短线的穷人1年前1
玩短线的穷人1年前1 -
 二郎神nn地 共回答了18个问题
二郎神nn地 共回答了18个问题 |采纳率83.3%D
从反应的全过程判断NO的作用是催化剂,因为开始NO参与反应,经过反应之后又生成了NO,且反应前后化学性质不变,符合催化剂定义,故选D。1年前查看全部
- NO是大气污染物之一,但少量的NO在人体内却有扩张血管、增强记忆力的功能.已知NO不溶于水且不与水反应,密度比空气大,易
NO是大气污染物之一,但少量的NO在人体内却有扩张血管、增强记忆力的功能.已知NO不溶于水且不与水反应,密度比空气大,易与O2反应生成NO2.那么该气体用什么方法收集( )
①向上排空气法②向下排气法③排水法.
A.①
B.②
C.③
D.①②③均可 浑身洁白1年前1
浑身洁白1年前1 -
 asdgkhwakjrgth 共回答了15个问题
asdgkhwakjrgth 共回答了15个问题 |采纳率93.3%解题思路:气体的收集方法包括排水法和排空气法,排水法适用于不易溶于水或难溶于水的气体.排空气法分为向上排空气法和向下排空气法,气体的密度比空气的密度大就用向上排空气法,气体的密度比空气的密度小就用向下排空气法.A、NO易与O2反应生成NO2,因此不用向上排空气法,故选项错误;
B、密度比空气大,因此不用向下排空气法,故选项错误;
C、NO不溶于水且不与水反应,因此可以用排水法收集,故选项正确;
D、NO不溶于水且不与水反应,密度比空气大,易与O2反应生成NO2,那么该气体只能用排水法收集,故选项错误;
故选C点评:
本题考点: 常用气体的收集方法.
考点点评: 本考点考查了常见气体的收集方法,气体的收集方法与气体的密度和溶解性有关,有时还要考虑气体是否与水或与空气中的成分反应.还要记忆气体的三种收集方法,本考点主要出现在选择题和填空题中.1年前查看全部
- 大气污染物按其物理状态,可分为?等类型.
 yizh-19881年前3
yizh-19881年前3 -
 馥惠 共回答了21个问题
馥惠 共回答了21个问题 |采纳率90.5%固体,液体和气体.1年前查看全部
- 为什么逆温现象,不利于大气污染物扩散
 年少轻狂者1年前1
年少轻狂者1年前1 -
 shaorendong 共回答了18个问题
shaorendong 共回答了18个问题 |采纳率94.4%正常情况下,对流层大气的气温是近地面气温高,高空气温低,近地面空气上升,高空空气下沉,形成对流运动,对流会使空气中的污染物扩散开.
但是当对流层中出现近地面的气温低,高空的气温高,或大气温度的递减率低于垂直递减率(垂直方向上海拔每升高100m,气温下降0.6℃)时就形成逆温现象,此时大气层结稳定,空气对流运动减弱或停滞,所以不利于大气污染物扩散.1年前查看全部
- NO2与SO2都是大气污染物,并且它们都是形成酸雨的主要物质.有等质量的MO2、SO2
NO2与SO2都是大气污染物,并且它们都是形成酸雨的主要物质.有等质量的MO2、SO2
所含氧原子的物质的量
分子个数之比
氧原子的物质的量之比
质子数之比
是多少,怎么求 lizhideai1年前2
lizhideai1年前2 -
 hdlzcfeels 共回答了22个问题
hdlzcfeels 共回答了22个问题 |采纳率81.8%NO2的相对分子质量 14+16*2 = 46
SO2的相对分子质量 32+16*2 = 64
所以32 个NO2分子 与 23个SO2分子的质量相同.即分子数之比 NO2:SO2 = 32:23
1、所含氧原子的物质的量无法计算.因为不知道确切的质量,只知道比例
2、分子个数 之比 = 32:23
3、氧原子的物质的量 之比 = (32*2) :(23*2) = 32:23
4、质子数之比 = (32*23):(23*32) = 1:11年前查看全部
- 鸡蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H 2 S),硫化氢气体是一种大气污染物,吸入量过多会使人中毒身亡,
鸡蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H 2 S),硫化氢气体是一种大气污染物,吸入量过多会使人中毒身亡,它在空气中点燃完全燃烧时,生成二氧化碳和水,把硫化氢气体通入浓硫酸中,发生的反应为H 2 S+H 2 SO 4 (浓)═SO 2 +X↓+2H 2 O根据以上信息回答问题:
(1)硫化氢的物理性质有______
(2)硫化氢的化学性质有______.
(3)硫化氢与浓硫酸反应时,生成物中X的化学式是______
(4)若尾气中含有硫化氢气体,用浓硫酸来吸收行吗?为什么?
答:______. pagon1年前1
pagon1年前1 -
 stgeorge 共回答了17个问题
stgeorge 共回答了17个问题 |采纳率82.4%(1)根据题干叙述可知,硫化氢是无色、有臭鸡蛋气味的气体,故填:无色、有臭鸡蛋气味的气体;
(2)根据题干叙述可知,硫化氢是有毒、能燃烧、能和浓硫酸反应的气体,故填:毒性、可燃性、能与浓硫酸反应;
(3)根据质量守恒定律,化学反应前后元素的种类和原子的个数不变,反应前含有4个H原子,2个S原子和4个O原子,反应后已有1个S原子,4个H原子和4个O原子,故X为S,故填:S;
(4)硫化氢能和浓硫酸反应生成二氧化硫气体,所以不能用浓硫酸干燥硫化氢气体,故填:不可以,因为硫化氢与浓硫酸反应后生成二氧化硫污染空气.1年前查看全部
- NO是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能.NO难溶于水,通常条件下极易与氧气反应.实验室收集
NO是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能.NO难溶于水,通常条件下极易与氧气反应.实验室收集NO的装置是 ( )
第9题 liqingwu1年前1
liqingwu1年前1 -
 敬自己一杯白开水 共回答了18个问题
敬自己一杯白开水 共回答了18个问题 |采纳率77.8%选B
因为NO在通常条件下极易与氧气反应,所以不能采用排空气法,而且NO难溶于水,所以应该选排水法.1年前查看全部
- 地形逆温的特点,产生原因及其对大气污染物扩散的影响
 璇玑-薇1年前1
璇玑-薇1年前1 -
 老虎的牙 共回答了15个问题
老虎的牙 共回答了15个问题 |采纳率100%地形逆温是常发生在山地,盆地和谷地中,由于山坡散热快,山坡上的冷空气沿山坡下沉到谷底,谷底原来较暖的空气被冷空气抬挤上升,从而出现温度的倒置现象.并称低气温的空气层为逆温层.
在逆温层中,较暖而轻的空气位于较冷而重的空气上面,形成一种极其稳定的空气层,就象一个锅盖一样,笼罩在近地层的上空,严重地阻碍着空气的对流运动,由于这种原因,近地层空气中的水汽、烟尘以及各种有害气体,上天无路,入地无门,只有飘浮在逆温层下面的空气层中,有利于云雾的形成,而降低了能见度,给交通运输带来麻烦,更严重的是,使空气中的污染物不能及时扩散开去,加重大气污染,给人们的生命财产带来危害.近代世界上所发生的重大公害事件中,就有一半以上与逆温层的影响有关.
其实地形性逆温只是成因有所不同,与其他的逆温现象的危害基本是相同的1年前查看全部
- (1)二氧化氮是大气污染物之一.通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的______性质(填
(1)二氧化氮是大气污染物之一.通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的______性质(填“物理”或“化学”).
(2)新闻报道《小雨引“燃”一车电石》很好地说明水可“引火”.该报道称:5月9日傍晚,一辆储运电石的汽车因未做好防水工作,行驶过程中天降小雨,引发车厢着火…已知:电石(CaC 2 )不可燃,与水接触剧烈反应产生乙炔(C 2 H 2 ).
①根据上述信息,请从物质组成和化学性质的角度,说说你对乙炔气体的认识(各一条).
组成:______;化学性质:______.
②根据上述信息,你认为应该如何保存电石?答______. jude7621年前1
jude7621年前1 -
 junjie1103 共回答了15个问题
junjie1103 共回答了15个问题 |采纳率86.7%(1)二氧化氮的颜色、状态、气味等方面的性质不需要通过化学变化表现出来,属于物理性质.故填:物理.
(2)①由乙炔的化学式可知,乙炔是由碳元素和氢元素组成的.故填:乙炔是由碳元素和氢元素组成的.
乙炔能够燃烧需要通过化学变化表现出来,属于化学性质.故填:乙炔可以燃烧.
②乙炔能够和水发生化学反应,所以应该防水、密封保存.故填:防水、密封保存.1年前查看全部
- 环境部门监测的大气污染物有哪些是 二氧化氮 二氧化硫 可吸入颗粒还是 一氧化碳 二氧化硫 可吸入颗粒或者是一氧化碳 二氧
环境部门监测的大气污染物有哪些
是 二氧化氮 二氧化硫 可吸入颗粒
还是 一氧化碳 二氧化硫 可吸入颗粒
或者是一氧化碳 二氧化氮 二氧化硫 可吸入颗粒 hcl14411年前1
hcl14411年前1 -
 lynnxu0203 共回答了17个问题
lynnxu0203 共回答了17个问题 |采纳率82.4%二氧化硫、 氮氧化物、总悬浮颗粒物(TSP)或飘尘(PM10)1年前查看全部
- 油漆挥发后造成大气污染物类型和浓度该是什么呢?
 欧阳静菇1年前1
欧阳静菇1年前1 -
 善良石头心 共回答了23个问题
善良石头心 共回答了23个问题 |采纳率91.3%油漆分油性和水性的.如果是油性的话,主要是油漆生产过程中添加的有机溶剂,如苯类、酯类、酮类等等,以及在使用过程中添加的稀释剂.溶剂和稀释剂都是最终会挥发的气态污染物.如果是水性的话,即是环保漆,基本不产生有毒有害气体1年前查看全部
- 两种大气污染物NO2和SO2在一定条件下可以发生如下反应:NO2+SO2=NO+SO3,在体积为V L的密闭容
两种大气污染物NO2和SO2在一定条件下可以发生如下反应:NO2+SO2=NO+SO3,在体积为V L的密闭容器中通入a molNO2和bmolSO2,反应后容器内硫原子和氧原子个数比为( )
A. [3b/a]
B. [b2(a+b)  guhai4171年前1
guhai4171年前1 -
 manto_nl 共回答了25个问题
manto_nl 共回答了25个问题 |采纳率84%解题思路:由元素守恒可知反应后容器内硫原子的物质的量n(S)=n(SO2)、氧原子的物质的量n(O)=2n(NO2)+2n(SO2),原子个数之比等于物质的量之比.反应后容器内硫原子的物质的量n(S)=n(SO2)=bmol,氧原子的物质的量n(O)=2n(NO2)+2n(SO2)=2amol+2bmol,
原子个数之比等于物质的量之比,故反应后容器内硫原子和氧原子个数比为
bmol
2(a+b)mol=
b
2(a+b),
故选B.点评:
本题考点: 阿伏加德罗定律及推论.
考点点评: 本题考查原子守恒的计算,难度不大,注意守恒思想在计算中的运用.1年前查看全部
- 二氧化氮是大气污染物之一.通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的______性质(填“物理
二氧化氮是大气污染物之一.通常状况下,它是一种有刺激性气味的红棕色气体,这里描述的是二氧化氮的______性质(填“物理”或“化学”).在催化剂作用下,汽车尾气中的一氧化碳(C0)可以和二氧化氮反应生成氮气和二氧化碳,该反应的化学方程式是2NO2+4CO
N2+4CO2催化剂 .2NO2+4CO.
N2+4CO2催化剂 . 灵儿13145201年前1
灵儿13145201年前1 -
 longtao08 共回答了18个问题
longtao08 共回答了18个问题 |采纳率94.4%解题思路:根据物质的颜色、状态、气味、熔点、沸点、硬度、密度等性质,不需要发生化学变化就表现出来,因此,都属于物理性质;根据方程式的书写考虑本题.二氧化氮通常状况下,它是一种有刺激性气味的红棕色气体属于颜色、状态、气味,属于物理性质;反应物是一氧化碳(C0)和二氧化氮写在等号的左边,生成物是氮气和二氧化碳,写在等号的右边,用观察法配平,反应条件是催化剂写在等号的上边,所以方程式是:2NO2+4CO
催化剂
.
N2+4CO2.
故答案为:物理;2NO2+4CO
催化剂
.
N2+4CO2.点评:
本题考点: 化学性质与物理性质的差别及应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 物理性质、化学性质是一对与物理变化、化学变化有密切关系的概念,联系物理变化、化学变化来理解物理性质和化学性质,则掌握起来并不困难.熟记方程式的书写注意事项.1年前查看全部
- 用fluent模拟大气污染物扩散 是稳态还是非稳态过程
用fluent模拟大气污染物扩散 是稳态还是非稳态过程
如题 qutcindy1年前2
qutcindy1年前2 -
 mkiju8900098 共回答了24个问题
mkiju8900098 共回答了24个问题 |采纳率91.7%首先说明,任何物理过程都是非稳态过程,不存在绝对稳态过程.稳态问题仅仅是我们不打算考虑某个物理过程与时间的关系而已.比如,我们只需要知道泄漏时各点污染物浓度基本上不再随时间变化(实际上不可能)时污染物分布情况,就可以不考虑扩散过程,即视为稳态问题;如果我们关系泄漏过程任何时刻各点污染物浓度,我们就需要非稳态求解.
其次,是否收敛与稳态/非稳态不存在半毛钱关系.换句话说,如果你设置有误或模型有误,无论稳态还是非稳态,都不会得到满意的收敛结果.
简单地说,FLUENT计算的非稳态本质就是稳态问题,不同之处在于非稳态问题是把稳态求解的迭代过程分段标明了时间.1年前查看全部
- 某氮的氧化物是大气污染物之一,在一定温度何有催化剂的条件下,可和氨气反应,生成氮气和水,氮气和水的
某氮的氧化物是大气污染物之一,在一定温度何有催化剂的条件下,可和氨气反应,生成氮气和水,氮气和水的
5:6,则氮的氧化物为
A.NO
B.N₂O₃
C.NO₂
D.N₂O5 khd51241年前1
khd51241年前1 -
 甜娜娜 共回答了18个问题
甜娜娜 共回答了18个问题 |采纳率94.4%A.
6NOx+4NH3=5N2+6H2O
x=11年前查看全部
- 在通常情况下,二硫化碳(CS2)是一种无色有刺激性气味的液体.在空气中完全燃烧生成一种大气污染物和一种能产生温室效应的气
在通常情况下,二硫化碳(CS2)是一种无色有刺激性气味的液体.在空气中完全燃烧生成一种大气污染物和一种能产生温室效应的气体.请根据以上信息回答:
(1)二硫化碳的物理性质有______;
(2)发生反应的化学方程式为______,
(3)反应前后硫元素的化合价分别是______(CS2中碳元素的化合价为+4价). 挨淋1年前1
挨淋1年前1 -
 小猪笨笨快快跑啊 共回答了15个问题
小猪笨笨快快跑啊 共回答了15个问题 |采纳率80%解题思路:物质的物理性质主要有:颜色、状态、气味、密度、硬度、熔点、沸点等.根据反应物和生成物可以书写化学方程式.根据化合物中元素的化合价代数和为零的原则可以求元素的化合价.(1)无色、有刺激性气味、液体都是二硫化碳的物理性质.
故填:(通常情况下)无色、刺激性气味、液体.
(2)反应物是二硫化碳和氧气,生成物是二氧化硫和二氧化碳.化学方程式为:CS2+3O2
点燃
.
CO2+2SO2
二硫化碳中硫元素的化合价是-2价,二氧化硫中硫元素的化合价是+4价.故填:-2价和+4价.点评:
本题考点: 化学性质与物理性质的差别及应用;有关元素化合价的计算;化学方程式的概念、读法和含义.
考点点评: 本题主要考查了物质的物理性质、化学方程式、化合价等方面的内容.1年前查看全部
- (2005•安丘市)二氧化硫是大气污染物之一.我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二
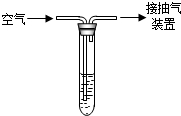 (2005•安丘市)二氧化硫是大气污染物之一.我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如表所示:
(2005•安丘市)二氧化硫是大气污染物之一.我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如表所示:
为测定某地空气中二氧化硫的含量,某中学环保小组按如图所示的实验装置进行如下实验:向试管中加入一定量的含碘(I.)1.27mg的碘水,再加入2~3滴淀粉溶液(淀粉遇I2变蓝色),通过抽气装置抽气,使空气由导气管进入试管与碘水充分接触,当溶液由蓝色变为无色时,恰好完全反应.反应的化学方程式是:S02+I2+2H20═H2SO4+2HI.实验过程中进入试管内的空气的总体积为1 000L.请通过计算说明该法测定的此空气中二氧化硫的浓度级别.浓度限值(mg/m3) 一级标准 二级标准 三级标准
0.15 0.50 0.70 卡每1年前1
卡每1年前1 -
 独舞在天台 共回答了16个问题
独舞在天台 共回答了16个问题 |采纳率81.3%解题思路:根据反应的化学方程式,由恰好完全反应消耗碘的质量计算出1000L空气中所含二氧化硫的质量,转化为标准表示法mg/m3,与级别标准对比,判断出空气中二氧化硫的浓度级别.1000L=1m3
设1m3空气中含SO2质量为x
S02+I2+2H20═H2SO4+2HI
64 254
x 1.27mg
[64/254=
x
1.27mg] x=0.32mg
空气中SO2浓度=0.32mg÷1m3=0.32mg/m3
由于0.15mg/m3<0.32mg/m3<0.5mg/m3,说明此空气中二氧化硫的浓度为二级
答:此空气中二氧化硫的浓度为二级.点评:
本题考点: 化学在环境监测与环境保护中的重要作用;根据化学反应方程式的计算.
考点点评: 本题为根据化学方程式的基本计算,在最后与级别标准对比时要注意:根据化学方程式计算所得值为空气中二氧化硫的质量,还需要转换成标准值.1年前查看全部
- 蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H2S).硫化氢气体是一种大气污染物,它在空气中点燃时,生成二氧化硫和
蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H2S).硫化氢气体是一种大气污染物,它在空气中点燃时,生成二氧化硫和水,把硫化氢气体通人浓硫酸中,发生的反应为:H2S+H2SO4(浓)=SO2+X↓+2H2O.
(1)上述内容中,属于硫化氢物理性质的是______.
(2)硫化氢在空气中完全燃烧的化学方程式是:2H2S+3O2
2SO2+2H2O点燃 .2H2S+3O2.其中硫化氢是______(填“‘氧化剂”或“还原剂”).
2SO2+2H2O点燃 .
(3)硫化氢与浓硫酸反应时,生成物中X的化学式是______. 冬无名1年前1
冬无名1年前1 -
 飞言海声 共回答了27个问题
飞言海声 共回答了27个问题 |采纳率88.9%解题思路:(1)不需要通过化学变化表现出来的性质属于物质的物理性质;
(2)根据质量守恒定律可以书写反应的化学方程式;反应中得氧的物质是还原剂;
(3)根据质量守恒定律可以判断物质的化学式.(1)硫化氢的颜色、气味等方面的性质不需要通过化学变化表现出来,属于物理性质.
故答案为:无色、有臭鸡蛋气味的气体;
(2)硫化氢在空气中完全燃烧的化学方程式为:2H2S+3O2
点燃
.
2SO2+2H2O;该反应中硫化氢得氧,是还原剂;
故答案为:2H2S+3O2
点燃
.
2SO2+2H2O;还原剂;
(3)由H2S+H2SO4(浓)═SO2+X↓+2H2O可知,反应物中有4个氢原子、2个硫原子、4个氧原子,生成物除X外,有4个氢原子、1个硫原子、4个氧原子,根据质量守恒定律,每个X中含有1个硫原子,是硫,化学式是S.
故答案为:S.点评:
本题考点: 化学性质与物理性质的差别及应用;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查物质的性质和化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.1年前查看全部
- (2014•番禺区一模)对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
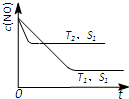 (2014•番禺区一模)对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
(2014•番禺区一模)对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料.
已知:H2(g)+[1/2O2 田中春雨1年前1
田中春雨1年前1 -
 明月清泉cmz 共回答了21个问题
明月清泉cmz 共回答了21个问题 |采纳率95.2%解题思路:(1)依据热化学方程式和盖斯定律计算得到所需让化学方程式;
(2)①计算出平衡时各种物质的物质的量,结合反应速率计算方法和平衡常数的表达式完成;
②汽缸温度越高,单位时间内NO排放量越大,说明平衡正向进行,温度越高速率越快;
(3)①根据到达平衡的时间,判断温度高低,再根据不同温度下到达平衡时NO的浓度高低,判断温度对平衡的影响,据此判断反应热效应;
②催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,据此作图.(1)①H2(g)+[1/2O2(g)=H2O(g)△H=-241.8kJ•mol-1
②C(s)+
1
2O2(g)=CO(g)△H=-110.5kJ•mol-1
依据盖斯定律计算②-①得到C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1;
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1;
(2)①在1.0L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4mol,5s内该反应的平均速率ν(NO)=
8×10-4mol
1.0L
5s]=1.6×10-4 mol/(L•s),依据化学方程式写出反应的平衡常数为:
c2(NO)
c(N2)c(O2);
故答案为:1.6×10-4 mol/(L•s),
c2(NO)
c(N2)c(O2);
②气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移,
故答案为:温度升高,反应速率加快,平衡右移;
(3)①、温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②、催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为: ,故答案为:
,故答案为: .
.点评:
本题考点: 化学平衡常数的含义;热化学方程式;化学反应速率的影响因素.
考点点评: 本题主要考查热化学方程式书写,化学反应速率、影响化学平衡的因素、化学平衡图象以及热化学方程式的书写等,难度不大,(3)中注意根据“先拐先平数值大”原则判断温度高低是关键,作图时注意到达平衡的时间与平衡时NO的浓度.1年前查看全部
大家在问
- 1高中除杂问题!急!除去甲烷中的乙烯.选用试剂.分离装置名称.是要分开的。。。。。。。还有分离装置的名称。。不要太长。是填
- 2下面的短文中共有10处语言错误,请你在错误的地方增加、删除或个性某个单词。
- 3在下面每个等式的横线里分别填上合适的相同的分数.
- 4已知关于x的方程3x+2a=x+7,小刚在解这个方程时,把方程右端的+7抄成了-7,解得的结果为x=2,求原方程的解
- 5一个2/27分子分母加上一个相同的数约分等于1/5
- 6已知一次函数y=kx+b(k,b是常数,且k≠0),x与y的部分对应值如下表所示,
- 7我是不是该用个八卦镜呢?办公室,我的座位正右方是窗户,窗户外面就是冲着我的墙壁,(因为我们办公室比别的凸出来一块),现在
- 8如果四个人平均年龄是30岁,且在四人中没有小于21岁的,那么年龄最大的人可能是几岁?
- 9请问混凝剂投加量最近在做化学除磷,混凝剂PAC投加量60mg/L时,才对TP有1mg/L的处理量.按照规范,投加量在8.
- 10钟面上现在是三点整,再过______分钟,时针和分针正好重叠在一条直线上.
- 11有关保持身体健康的作文
- 12为什么地图上查无福建漳平地区的湖尾、溪平、太湖
- 13(2014•芜湖模拟)等差数列{an}中,d<0,若|a3|=|a9|,则数列{an}的前n项和取最大值时,n的值为__
- 14一道初二数学题(梯形的)用一块800平方厘米的等腰梯形,为牢固起见,用竹条做对角线,切刚好垂直,合计至少需要___cm.
- 15下列关于唐朝诗歌的说法,错误的是( ) A.岑参的诗体现了宁静平和的自然之趣 B.李白的诗体现了盛唐蓬勃向上的时代精