杂化轨道理论中孤对电子对空间结构的影响
 mynameisjelly132022-10-04 11:39:541条回答
mynameisjelly132022-10-04 11:39:541条回答
杂化轨道理论中孤对电子对空间结构的影响
请填完下列表格孤对电子数 0 1 2 3杂化类型SP 直线 --------- --------- ---------SP2 平面正三角形 -------- --------- ---------SP3 正四面体 三角锥 折线型 直线型SP3D 三角双锥 -------- -------- --------SP3D2 正八面体 -------- -------- --------
请填完下列表格孤对电子数 0 1 2 3杂化类型SP 直线 --------- --------- ---------SP2 平面正三角形 -------- --------- ---------SP3 正四面体 三角锥 折线型 直线型SP3D 三角双锥 -------- -------- --------SP3D2 正八面体 -------- -------- --------

已提交,审核后显示!提交回复
共1条回复
 mingc 共回答了23个问题
mingc 共回答了23个问题 |采纳率87%- sp 不存在 不存在 不存在Sp2 V型 不存在 不存在sp3sp3d 变形四面体 平面三角形 直线型 sp3d2 变形三角双锥或四棱锥 平面四边形 没听说过有研究这种情况的注:“不存在”是指该...
- 1年前
相关推荐
- 用Pauling的杂化轨道理论解释甲烷分子的正四面体形结构,下列说法中不正确的是 [
用Pauling的杂化轨道理论解释甲烷分子的正四面体形结构,下列说法中不正确的是 [ ]A.C原子的四个杂化轨道的能量一样
B.C原子的sp 3 杂化轨道之间夹角一样
C.C原子的4个价电子分别占据4个sp 3 杂化轨道
D.C原子有1个sp 3 杂化轨道由孤对电子占据 王世庆1年前1
王世庆1年前1 -
 guoguo506 共回答了17个问题
guoguo506 共回答了17个问题 |采纳率94.1%D1年前查看全部
- 根据杂化轨道理论,指出下列分子中心原子采取的杂化轨道类型及空间构型.
根据杂化轨道理论,指出下列分子中心原子采取的杂化轨道类型及空间构型.
分子杂化轨道类型空间构型
①CH4______、______;
②C2H4______、______;
③C2H2______、______,其中σ键与π键数之比为______. 北青萝萝1年前1
北青萝萝1年前1 -
 peakyl 共回答了19个问题
peakyl 共回答了19个问题 |采纳率89.5%解题思路:根据价层电子对互斥理论确定分子的空间构型及原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.①CH4中价层电子对个数=4+
1
2×(4-4×1)=4且不含孤电子对,所以C原子采用sp3杂化,其空间构型为正四面体结构,故答案为:sp3;正四面体;
②C2H4中每个碳原子价层电子对个数为3且不含孤电子对,所以C原子采用sp2杂化,且平面结构,故答案为:sp2;平面形;
③乙炔的结构式为H-C≡C-H,每个碳原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化,为直线形结构,该反应中σ键与π键个数=3:2,故答案为:sp;直线形;3:2.点评:
本题考点: 原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查了原子杂化方式的判断,根据价层电子对互斥理论解答即可,注意孤电子对个数的计算方法,知道其表达式中各个字母的含义,题目难度不大.1年前查看全部
- 如何用杂化轨道理论解释键级
 波兹逗逗1年前2
波兹逗逗1年前2 -
 动物学aa 共回答了16个问题
动物学aa 共回答了16个问题 |采纳率93.8%杂化轨道理论 在形成分子的过程中,由于原子间的相互影响,若干类型不同而能量相近的原子轨道相互混杂,重新组合成一组能量相等,成分相同的新轨道,这一过程称为杂化.经过杂化而形成的新轨道叫做杂化轨道,杂化轨道与其他原子轨道重叠时形成σ共价键.原子在形成分子的过程中,为了使所成化学键强度更大,更有利于体系能量的降低,总趋向于将原来的原子轨道进一步线性组合,以形成新的原子轨道.
3.杂化轨道之间力图在空间取最大夹角分布,使相互间的排斥能最小,故形成的键较稳定.不同类型的杂化轨道之间的夹角不同,成键后所形成的分子就具有不同的空间构型.
按参加杂化的原子轨道种类,轨道的杂化有sp和spd两种主要类型.按杂化后形成的几个杂化轨道的能量是否相同,轨道的杂化可分为等性杂化和不等性杂化.
sp型和spd型杂化
能量相近的ns轨道和np轨道之间的杂化称为sp型杂化.按参加杂化的s轨道、p轨道数目的不同,sp型杂化又可分为sp、sp2 、sp3 三种杂化.由1个s轨道和1个p轨道组合成2个sp杂化轨道的过程称为sp杂化,所形成的轨道称为sp杂化轨道.每个sp杂化轨道均含有1电子的s轨道成分和1电子的p轨道成分.为使相互间的排斥能最小,轨道间的夹角为180° .当2个sp杂化轨道与其他原子轨道重叠成键后就形成直线型分子.
由1个s轨道与2个p轨道组合成3个sp2 杂化轨道的过程称为sp2 杂化.每个sp2 杂化轨道含有1电子的s轨道成分和2电子的p轨道成分,为使轨道间的排斥能最小,3个sp2杂化轨道呈正三角形分布,夹角为120°.当3个sp2杂化轨道分别与其他3个相同原子的轨道重叠成键后,就形成正三角形构型的分子.
sp3杂化轨道是由1个s轨道和3个 p轨道组合成4个sp3杂化轨道的过程称为sp3 杂化.每个sp3杂化轨道含有1电子的s 轨道成分和3电子的p轨道成分.为使轨道间的排斥能最小,4个顶角的sp3杂化轨道间的夹角均为109°28’.当它们分别与其他4个相同原子的轨道重叠成键后,就形成正四面体构型的分子.1年前查看全部
- XeO4的空间构型,用杂化轨道理论解释其成键情况
 wockadengol1年前1
wockadengol1年前1 -
 wdqok 共回答了21个问题
wdqok 共回答了21个问题 |采纳率90.5%Xe原子采用sp3杂化
4个Xe-O σ键
正四面体结构,Xe在中心1年前查看全部
- 杂化轨道理论中形成分子时怎样的原子可以使另一个原子的电子激发
杂化轨道理论中形成分子时怎样的原子可以使另一个原子的电子激发
杂化轨道理论中杂化前都要激发吗 funny_wang1年前2
funny_wang1年前2 -
 没3 共回答了8个问题
没3 共回答了8个问题 |采纳率100%杂化轨道就是中心原子为了成建现将自己的能量非常接近的sp等轨道进行混杂----在与配位原子成建---这样的好处是稳定的对称几何分子构型----能量最低原理啊!一般而言,杂化在一下情况会出现:1、多个原子形成的分子(配...1年前查看全部
- 求杂化轨道理论和价层电子对互斥理论的详解
求杂化轨道理论和价层电子对互斥理论的详解
这里一点也不明白 、 求详解 百事不留1年前1
百事不留1年前1 -
 我先劫个社 共回答了14个问题
我先劫个社 共回答了14个问题 |采纳率100%1 杂化轨道:
在形成分子的过程中,由于原子间的相互影响,若干类型不同而能量相近的原子轨道相互混杂,
重新组合成一组能量相等,成分相同的新轨道,这一过程称为杂化.经过杂化而形成的新轨道叫做杂化轨道,杂化轨道与其他原子轨道重叠时形成σ共价键.原子在形成分子的过程中,为了使所成化学键强度更大,更有利于体系能量的降低,总趋向于将原来的原子轨道进一步线性组合,以形成新的原子轨道.
价键理论的论证
价键理论对共价键的本质和特点做了有力的论证,但它把讨论的基础放在共用一对电子形成一个共价键上,在解释许多分子、原子的价键数目及分子空间结构时却遇到了困难.例如C原子的价电子是2s22p2,按电子排布规律,2个s电子是已配对的,只有2个p电子未成对,而许多含碳化合物中C都呈4价而不是2价,可以设想有1个s电子激发到p轨道去了.那么1个s轨道和3个p轨道都有不成对电子,可以形成4个共价键,但s和p的成键方向和能量应该是不同的.而实验证明:CH4分子中,4个 C-H共价键是完全等同的,键长为114pm,键角为109°28'.BCl3,BeCl2,PCl3等许多分子也都有类似的情况.为了解释这些矛盾,1928年鲍林(Pauling)提出了杂化轨道概念[1],丰富和发展了的价键理论.他根据量子力学的观点提出:在同一个原子中,能量相近的不同类型的几个原子轨道在成键时,可以互相叠加重组,成为相同数目、能量相等的新轨道,这种新轨道叫杂化轨道.C原子中 1个2s电子激发到2p后,1个2s轨道和3个2p轨道重新组合成4个sp3杂化轨道,它们再和4个H原子形成4个相同的C-H键,C位于正四面体中心,4个H位于四个顶角.
相关种类
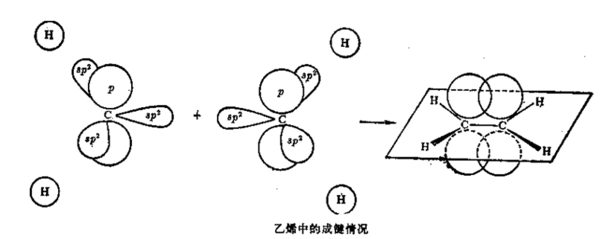
杂化轨道种类很多,如三氯化硼(BCl3)分子中B有sp2杂化轨道,即由1个s轨道和2个p轨道组合成3个sp2杂化轨道,在氯化铍(BeCl2)中有sp杂化轨道,在过渡金属化合物中还有d轨道参与的sp3d和 sp3d2杂化轨道等.以上几例都是阐明了共价单键的性质,至于乙烯和乙炔分子中的双键和三键的形成,又提出了σ键和π键的概念.如把两个成键原子核间联线叫键轴,把原子轨道沿键轴方向“头碰头”的方式重叠成键,称为σ键.把原子轨道沿键轴方向“肩并肩”的方式重叠,称为π键.例如在乙烯(CH2= CH2)分子中有碳碳双键(C=C),碳原子的激发态中2px,2py和2s形成sp2杂化轨道,这3个轨道能量相等,位于同一平面并互成120℃夹角,另外一个pz轨道未参与杂化,位于与平面垂直的方向上.碳碳双键中的sp2杂化如下所示.
这3个sp2杂化轨道中有2个轨道分别与2个H原子形成σ单键,还有1个sp2轨道则与另一个 C的sp2轨道形成头对头的σ键,同时位于垂直方向的pz轨道则以肩并肩的方式形成了π键.也就是说碳碳双键是由一个σ键和一个π键组成,即双键中两个键是不等同的.π键原子轨道的重叠程度小于σ键,π键不稳定,容易断裂,所以含有双键的烯烃很容易发生加成反应,如乙烯(H2C=CH2)和氯 (Cl2)反应生成氯乙烯(Cl—CH2—CH2—Cl).
乙炔分子(C2H2)中有碳碳叁键 (HC≡CH),激发态的C原子中2s和2px轨道形成sp杂化轨道.这两个能量相等的sp杂化轨道在同一直线上,其中之一与H原子形成σ单键,另外一个 sp杂化轨道形成C原子之间的σ键,而未参与杂化的py与pz则垂直于x轴并互相垂直,它们以肩并肩的方式与另一个C的py,pz形成π键.即碳碳三键是由一个σ键和两个π键组成.这两个π键不同于σ键,轨道重叠也较少并不稳定,因而容易断开,所以含三键的炔烃也容易发生加成反应.
杂化轨道限于最外层电子,而在第一层的两个电子不参与反应,而在其他层上有许多的轨道,电子会从能量低的层“跃迁”到能量高的层,而原来能量低的层是因为电子的运动方向相反,而跃迁以后电子就只向一种方向运动,所以能量会高.并且反应以后组成的能量介于原来的S轨道和P轨道能量之间.
几种杂化轨道之后的分子空间形态
sp杂化:直线型
sp2杂化:平面三角形(等性杂化为平面正三角形)
sp3杂化:空间四面体(等性杂化为正四面体)
2 价电子对互斥理论
一个分子的中心原子究竟采取哪种类型的轨道杂化,直接可以预测整个分子的空间构型. 杂化轨道理论成功地解释了部分共价分子杂化与空间构型关系,但是,仅用杂化轨道理论预测有时是难以确定的.1940年美国的Sidgwick NV等人相继提出了价层电子对互斥理论(valence shell electron pair repulsion theory),简 称VSEPR法,该法适用于主族元素间形成的ABn型分子或离子.该理论认为,一个共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要决定于中心原子的价电子层中各电子对间的相互排斥作用.这些电子对在中心原子周围按尽可能互相远离的位置排布,以使彼此间的排斥能最小.所谓价层电子对,指的是形成σ键的电子对和孤对电子.孤对电子的存在,增加了电子对间的排斥力,影响了分子中的键角,会改变分子构型的基本类型.根据此理论,只要知道分子或离子中的中心原子上的价层电子对数,就能比较容易而准确地判断 ABn 型共价分子或离子的空间构型.
空间构型步骤
价层电子对理论预测分子空间构型步骤为:
1.确定中心原子中价层电子对数
中心原子的价层电子数和配体所提供的共用电子数的总和除以2,即为中心原子的价层电子对数. 规定:(1)作为配体,卤素原子和H 原子提供1个电子,氧族元素的原子不提供电子;(2)作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算;(3)对于复杂离子,在计算价层电子对数时,还应加上负离子的电荷数或减去正离子的电荷数;(4)计算电子对数时,若剩余1个电子,亦当作 1对电子处理.(5) 双键、叁键等多重键作为1对电子看待.
2.判断分子的空间构型
根据中心原子的价层电子对数,从表9-4中找出相应的价层电子对构型后,再根据价层电子对中的孤对电子数,确定电子对的排布方式和分子的空间构型.
实例分析:试判断PCl5 离子的空间构型.
P离子的正电荷数为5,中心原子P有5个价电子,Cl原子各提供1个电子,所以P原子的价层电子对数为(5+5)/2 = 5,其排布方式为三角双锥.因价层电子对中无孤对电子,所以PCl5 为三角双锥构型.
实例分析:试判断H2O分子的空间构型.
解 :O是H2O分子的中心原子,它有 6个价电子,与O化合的2个H原子各提供1个电子,所以O原子价层电子对数为(6+2)/2 = 4,其排布方式为 四面体,因价层电子对中有2对孤对电子,所以H2O分子的空间构型为V形.
表9-5 理想的价层电子对构型和分子构型
实例分析
判断HCHO分子和HCN分子的空间构型
解分子中有1个C=O双键,看作1对成键电子,2个C-H单键为2对成键电子,C原子的价层电子对数为3,且无孤对电子,所以HCHO分子的空间构型为平面三角形.
HCN分子的结构式为H—C≡N∶,含有1个C≡N叁键,看作1对成键电子,1个 CH单键为1对成键电子,故C原子的价层电子对数为2,且无孤对电子,所以HCN分子的空间构型为直线.1年前查看全部
- 乙烯中的碳为sp2杂化,构成三个相同的sp2杂化轨道,还有一个空的p轨道,谁能用杂化轨道理论
乙烯中的碳为sp2杂化,构成三个相同的sp2杂化轨道,还有一个空的p轨道,谁能用杂化轨道理论
阐述一下怎么形成了一个sigema键和一个π键,说的好,我去吃饭了 qcl19921年前1
qcl19921年前1 -
 shelflaura 共回答了20个问题
shelflaura 共回答了20个问题 |采纳率95%1年前查看全部
- 分别用MO与VB方法分析CO,BN,NO的化学键.试用杂化轨道理论说明NO,NO2,N2O的化学键.
 mgume1年前1
mgume1年前1 -
 风云2 共回答了17个问题
风云2 共回答了17个问题 |采纳率82.4%杂化:NO没有杂化,N跟O形成1个σ2个π,其中一个π含有3电子.
NO2的N采取sp2杂化,2个sp2轨道跟2O形成σ键,另一个sp2上含有成单电子.垂直於sp2的p轨道上面有N的2e-.2个O各1个e-,总共4e-形成π43
N2O的其中一个N是中心原子,另一个N和O是配位原子.中心N采取sp杂化,跟N和O形成2σ和2个π43.配位原子N在2π中都提供1个e-,而中心N在px上提供2e-,py上提供e-.O在px提供e-.在py上提供2e.
分子:CO KK(σ2s)2(σ*2s)2(σ2px2)(π2py2)(π2pz2)
BN KK(σ2s)2(σ*2s)2(σ2px2)(2py)(2pz)
NO KK(σ2s)2(σ*2s)2(σ2px2)(π2py2)(π2pz2)(π*2py)1年前查看全部
- 在线求指导:试用杂化轨道理论说明
在线求指导:试用杂化轨道理论说明
试用杂化轨道理论说明下列分子或离子的几何构型.
(1)CO 2 (直线形)_______________
(2)SiF 4 (正四面体形)________________
(3)H 2 O(V形)________________
(4)NO 2 - (V形)________________ yuankhan1年前1
yuankhan1年前1 -
 咖啡也ww 共回答了15个问题
咖啡也ww 共回答了15个问题 |采纳率86.7%(1)CO 2 中C采取sp杂化,两个sp杂化轨道分别与两个O的2p原子轨道形成两个σ键.C上另两个未杂化的
p轨道分别与两个O上的p轨道形成π键,分子构型为直线形.
(2)SiF 4 中Si采取sp杂化,四个sp 3 杂化轨道分别与四个F原子的2p原子轨道形成σ键,分子构型为正四面体形.
(3)H 2 O中O采取sp 3 杂化,四个sp 3 杂化轨道其中有两个被O原子的两对孤电子对占据,其余的两个sp 3 杂化轨道分别与两个H原子的s原子轨道形成σ键,分子构型为V形.
(4)NO 2 - 中N采取sp 2 杂化,其中两个杂化轨道分别与两个O的2p原子轨道形成σ键,另一个杂化轨道被一对孤电子对占据,未杂化的p轨道与两个O原子上的p轨道形成了π 键,形成V形分子结构.1年前查看全部
- 试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
 jxjlwy1年前1
jxjlwy1年前1 -
 tuchuyang 共回答了17个问题
tuchuyang 共回答了17个问题 |采纳率88.2%解题思路:根据价电子对数判断其杂化类型,根据形成的杂化轨道判断其空间构型,BF3中B的价电子结构为2s22p1,形成分子时,进行sp2杂化,三个sp2杂化轨道分别与三个F原子的p轨道成键,故BF3分子为平面三角形;NF3中的N价电子结构为2s22p3,形成分子时,进行sp3不等性杂化,其中一个sp3杂化轨道为孤对电子占有,另三个电子分别与F成键,故分子结构为三角锥型.BF3中B的价电子结构为2s22p1,价电子对数为:3+32=3,形成了三条杂化轨道,即B的杂化类型为sp2,形成3个共用电子对,无孤对电子,三个sp2杂化轨道分别与三个F原子的p轨道成键,为平面三角形;NF3中N价电子结构为2s22...
点评:
本题考点: 判断简单分子或离子的构型.
考点点评: 本题考查分子构型的判断,根据价电子对数=孤电子对数+共价键数判断,题目难度不大.1年前查看全部
- 杂化轨道理论sp杂化后 剩余两个p轨道 怎么形成两个π键?例如乙炔 有1个σ键和两个π键s-p形成的一定是σ键吧
 然羽_诺1年前0
然羽_诺1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 试用杂化轨道理论说明CH4是正四面体,H2O是角形
 huzhy8171年前1
huzhy8171年前1 -
 淡色星晴 共回答了23个问题
淡色星晴 共回答了23个问题 |采纳率82.6%CH4中是等性杂化;(4个sp3杂化轨道都参加成键)
H2O是不等性杂化.(4个sp3杂化轨道只有2个参与成键)1年前查看全部
- 给环丙丁戊己烷稳定性排序.并根据杂化轨道理论说明原因.一定要用杂化轨道理论 求完整
给环丙丁戊己烷稳定性排序.并根据杂化轨道理论说明原因.一定要用杂化轨道理论 求完整
给环丙丁戊己烷稳定性排序.并根据杂化轨道理论说明原因.一定要用杂化轨道理论
求完整答案. 水美日月1年前1
水美日月1年前1 -
 BBff鬼 共回答了21个问题
BBff鬼 共回答了21个问题 |采纳率95.2%环烷皆以sp3杂化轨道成键,正常键角109°28'.环丙烷难以形成此键角,甚至弯曲成键,故张力大,很不稳定;环丁烷相对好些,但环张力也较大;环戊烷和环己烷则是非平面无张力环,半椅型和椅型分别为其稳定构象.1年前查看全部
- 用杂化轨道理论描述丙二烯分子的成键 为什么三个C是一条直线?为什么两个CH2基的平面互相垂直?
 shy691年前2
shy691年前2 -
 萝卜00 共回答了20个问题
萝卜00 共回答了20个问题 |采纳率100%丙二烯中间的碳是sp杂化(还剩两个p轨道未参与杂化,且这两个p轨道互相垂直),所以三个碳在一条直线上,两边碳是sp2杂化,它们的p轨道分别与中间碳原子两个互相垂直的p轨道重叠,形成两个互相垂直的π键,所以两个CH2基的平面互相垂直.1年前查看全部
- no2用杂化轨道理论说明其成键特点
 纶裸天崖1年前3
纶裸天崖1年前3 -
 怀念老朝晖 共回答了26个问题
怀念老朝晖 共回答了26个问题 |采纳率80.8%楼上看清楚
是NO2
中间的N是sp2杂化
氧也是sp2杂化
对于N有2种说法
第1种是N的1个单电子占据1个sp2杂化轨道,然后另外2个单电子和氧成键,剩下的2个p轨道电子和氧的p轨道上的电子形成3c-4e∏键
第2种是N的一对电子占据1个sp2杂化轨道,p轨道上是1个电子和氧的p轨道的电子形成3c-3e∏键
目前第1种较多人认可1年前查看全部
- 用杂化轨道理论详细解释乙烯和CO12几何构型!(类似这样 ,但我的画法不正确)
 kojit1年前1
kojit1年前1 -
 翠被生寒 共回答了26个问题
翠被生寒 共回答了26个问题 |采纳率80.8%(1) C 1S2 2S2 2P2
(2)SP2 杂化 形成三个等价的杂化轨道
(3)四个价电子有三个占据三个等价的杂化轨道;还有一个占据未杂化的P轨道
(4)C2H4成键时,每个碳原子用一个杂化轨道和另一个碳,以及两个氢形成西格玛键;键角120度
(5)两个碳院子的未杂化的P轨道形成派件!...1年前查看全部
- 用杂化轨道理论描述甲烷成键过程
 lzek1年前0
lzek1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 杂化轨道理论是用来解释还是推测分子空间构型,如果不是推测的话,怎么去推测分子空间构型?
杂化轨道理论是用来解释还是推测分子空间构型,如果不是推测的话,怎么去推测分子空间构型?
大一无机化学! sdlr1231年前2
sdlr1231年前2 -
 cccc的女孩 共回答了14个问题
cccc的女孩 共回答了14个问题 |采纳率92.9%主要是用来解释空间构型,推测的话对于主族元素用VESPR理论,副族元素用晶体场理论更合适1年前查看全部
- 共价键测知CS2的电偶极矩为零,试用杂化轨道理论简要说明CS2分子内共价键的形成情况,有几个σ键,几个Π键能有图追分
 thinker8301年前1
thinker8301年前1 -
 363158715 共回答了11个问题
363158715 共回答了11个问题 |采纳率90.9%sp
2
21年前查看全部
- 试用杂化轨道理论解释HOCl分子如何成键及键角为什么是103° 速求!
 behip2q1年前2
behip2q1年前2 -
 aihezi 共回答了18个问题
aihezi 共回答了18个问题 |采纳率77.8%根据价层电子对互斥理论,杂化轨道数=与中心原子成键的电子数+(中心原子价电子数-配位原子未成对电子数之和)/2
这样,O原子为中心原子成键电子数为2个,价电子数为6,配位原子(H,Cl)未成对电子数之和为6.最终杂化轨道数为2.
所以,杂化为SP杂化.在该杂化轨道中,有氧的两个电子和H,Cl的两个电子.未参与杂化的氧的电子成为孤对电子,共有四对价电子,为不对称四面锥形,(若为对称,比如甲烷键角107.9度)其中H--O,Cl--O夹角因被孤对电子排斥而小于107.9,约为103度.1年前查看全部
- 杂化轨道理论的缺陷性?
 柠檬草cassie1年前1
柠檬草cassie1年前1 -
 chenshuaiyong 共回答了16个问题
chenshuaiyong 共回答了16个问题 |采纳率87.5%本介绍 在形成分子的过程中,由于原子间的相互影响,若干类型不同而能量相近的原子轨道相互混杂,sp3杂化重新组合成一组能量相等,成分相同的新轨道,这一过程称为杂化.经过杂化而形成的新轨道叫做杂化轨道,杂化轨道与其...1年前查看全部
- 1.简述什么是盖斯定律?2.简述杂化轨道理论要点?3.简述什么是元素电势图?4.如何鉴别NaNO2和NaNO3?
 decrilend1年前1
decrilend1年前1 -
 dine 共回答了18个问题
dine 共回答了18个问题 |采纳率100%1定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等).即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
2在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道.
3许多元素具有多种氧化值,不同氧化值的物种可以组成电对.将某种元素不同氧化值的物种从左到右按氧化值由高到低的顺序排成一行,每两个物种间用直线连接表示一个电对,并在直线上标明此电对的标准电极电势的数值.这种图称为元素电势图.
4加入硝酸银有白色沉淀的是亚硝酸钠,是溶液的是硝酸钠1年前查看全部
- 1.用杂化轨道理论说明配合物的磁性和稳定性
1.用杂化轨道理论说明配合物的磁性和稳定性
2.用八面体配合物的晶体场理论说明Ti(OH)6 3+的颜色
3.软硬酸碱的基本理论和重要的软碱软酸和硬酸硬碱
.......
没书.......
你们帮我抄书拉
我帮你们加多50分.......
OK? 蓝色秋天charlie1年前4
蓝色秋天charlie1年前4 -
 汽轮机 共回答了19个问题
汽轮机 共回答了19个问题 |采纳率94.7%好先来回答第一个问题
请楼主注意配合物的磁性是指在外加磁场的影响下,物质所表现出的性质,即顺磁性或反磁性(抗磁性).而物质的磁性主要与物质中电子自旋运动有关.如果配合物中的中心原子的电子都已成对,电子自旋所产生的磁效应相互抵消,则表现出反磁性;如果配合物的中心原子有成单电子,总磁效应不能相互抵消,则为顺磁性.
配合物的磁性强弱可用磁矩(μ)来衡量.对于配合物的中心原子,可以忽略轨道角动量,只考虑电子自旋角动量对磁矩的贡献.
通常是利用测定配合物的磁矩来确定内轨型配合物和外轨型配合物.假定配体和外界离子的电子都已配对,则配合物的单电子数就是中心原子的单电子数.将测得的磁矩与理论值对比,确定出中心原子的单电子数n,再与成键前中心原子的单电子数比较,可判断配合物中成键轨道的杂化类型和空间构型.由此可确定配合物是内轨型还是外轨型.
中心原子采用外层的ns、np、nd轨道进行杂化与配体成键,所形成的配合物称为外轨型配合物.这类配合物,中心原子的价电子构型在成键前后未发生变化.
例如,形成[FeF6]3-配离子时,中心原子Fe3+在成键时,采用能量相近的外层空的4s、4p、4d轨道进行sp3d2杂化,形成6个能量相等且在空间呈正八面体分布的杂化轨道.然后,6个F-的被孤对电子占据的2p轨道沿着正八面体的6个顶点与6个sp3d2杂化轨道重叠成键(形成σ配键).
凡是中心原子采用sp、sp2、sp3、sp3d2杂化方式成键的配合物都属于外轨型配合物.如[Ag(NH3)2]+、[CuCl3]2-、[NiCl4]3+、[Fe(H2O)6]3+ 都是外轨型配合物.
中心原子采用内层(n-1)d轨道和外层ns、np轨道进行杂化与配体成键,所形成的配合物称为内轨型配合物.这类配合物,中心原子在与配体成键时,往往伴随着电子发生重排.
例如,形成[Fe(CN)6]3-配离子时,由于配体CN-对中心原子Fe3+有较强烈的影响,所以当CN-接近 Fe3+时,Fe3+的价层电子发生重排,5个3d 电子重排到3个3d轨道上.然后,Fe3+的2个空的3d轨道、1个4s轨道、和3个4p轨道进行d2sp3杂化与CN-成键,故[Fe(CN)6]3-为内轨型配合物,其空间构型为正八面体.
凡是中心原子采用dsp2、dsp3、d2sp3杂化方式与配体成键,所形成的配合物都属于内轨型配合物.如[PtCl4]2-、[Fe(CO)5]、[Fe(CN)6]4-都是内轨型配合物.1年前查看全部
- 根据杂化轨道理论和VSERP理论判断NF3空间构型
 云中的猪1年前2
云中的猪1年前2 -
 klk555 共回答了20个问题
klk555 共回答了20个问题 |采纳率85%N原子不等性sp3杂化,3个F原子的2p轨道与N原子的sp3杂化轨道形成σ键
分子成三角锥型1年前查看全部
- 杂化轨道理论解释SIF4sif4分子几何构型是正四面体,键角为109°28‘
 timmy1976d1年前1
timmy1976d1年前1 -
 zyl230966663 共回答了18个问题
zyl230966663 共回答了18个问题 |采纳率88.9%Si:sp3杂化.1年前查看全部
- 试用杂化轨道理论说明下列分子或离子的几何构型。
试用杂化轨道理论说明下列分子或离子的几何构型。
(1)CO 2 ______ (2)SiF 4 ______(3)BCl 3 ______ (4)NF 3 ______(5)NO 2 - ______ alvin9211年前1
alvin9211年前1 -
 小月0341 共回答了14个问题
小月0341 共回答了14个问题 |采纳率85.7%(1)直线形;(2)正四面体;(3)平面三角形;(4)三角锥形;(5)V形1年前查看全部
- 怎样用杂化轨道理论解释I3负离子?
怎样用杂化轨道理论解释I3负离子?
碘三的负一价离子是什么杂化类型? Aillen31年前4
Aillen31年前4 -
 huchaowu 共回答了12个问题
huchaowu 共回答了12个问题 |采纳率91.7%是sp3吧.空间构型是T型.将一个碘看做主体,其他的看做配体1年前查看全部
- 应用杂化轨道理论说明NF3的分子结构,指出中心原子的杂化类型,价键结构和分子的空间结构,
 小小仙女31年前3
小小仙女31年前3 -
 ccvol 共回答了18个问题
ccvol 共回答了18个问题 |采纳率88.9%5-3*1=2 3+2/2=4 所以N是以sp3不等性杂化,三个与F形成σ键,还有一对电子在一个sp3轨道上,空间构型是三棱锥形1年前查看全部
- BF3是平面三角形,NF3是三角锥形,用杂化轨道理论解释.我想请问的是,N原子价电子排布为2s^2 2p^3,原来有五个
BF3是平面三角形,NF3是三角锥形,用杂化轨道理论解释.我想请问的是,N原子价电子排布为2s^2 2p^3,原来有五个电子五条轨道,为什么会出现一个sp^3杂化,只有四条轨道?
好吧、五个电子四条轨道。我知道了。 skidrow1年前1
skidrow1年前1 -
 cxp495 共回答了20个问题
cxp495 共回答了20个问题 |采纳率80%NF3分子中的N原子使用了比较特殊的不等性sp3杂化,
其中3个杂化轨道分别与3个F原子形成N-F单键,
另一个杂化轨道为孤对电子所占据,所以NF3分子呈三角锥形
2个s电子占据一个轨道,三个p电子各占据一个轨道,所以也就是4个轨道
并不是你所认为的一个电子一个轨道1年前查看全部
- 用杂化轨道理论说明CO2、PCl3、CCl4的几何构型
 sukermonkey1年前2
sukermonkey1年前2 -
 亭亭映江月 共回答了13个问题
亭亭映江月 共回答了13个问题 |采纳率100%丢了很多年了,仅供参考:CO2中的C是sp杂化,键角180度,当然是线性结构了PCl3毫无疑问是sp2杂化,键角小于60度,成四面体结构CCl4是最典型的sp3杂化.正四面体结构.1年前查看全部
- 用杂化轨道理论说明三氟化硼是平面三角形,而三氟化氮却是三角锥形?
 jszxbgs1年前1
jszxbgs1年前1 -
 苹果太郎 共回答了19个问题
苹果太郎 共回答了19个问题 |采纳率100%B的最外层一共有三个电子,所以BF3中,B采取sp2杂化,三个轨道都参与成键,所以为了使排斥力最小,成平面三角形,而N原子最外层有五个电子,所以NF3中,N原子采取不等性的sp3杂化,所形成的四个杂化轨道参与F成键,而剩余的一...1年前查看全部
- 杂化轨道理论中的等性杂化和不等性杂化实例分析?
 xcw19861年前2
xcw19861年前2 -
 northforrest 共回答了16个问题
northforrest 共回答了16个问题 |采纳率81.3%等性杂化是指各个杂化轨道的性质一样,例如甲烷CH4 中的四个 C-H 键,均为碳原子 SP3杂化轨道与H 原子的S 轨道成键形成的.
不等性杂化是指各个杂化轨道的性质不一样.1年前查看全部
- 试用杂化轨道理论分析为什么BF 3 的空间构型是平面三角形,而NF 3 是三角锥形的?
试用杂化轨道理论分析为什么BF 3 的空间构型是平面三角形,而NF 3 是三角锥形的?
_________________________________________ 猪仔慧1年前1
猪仔慧1年前1 -
 阿呆爱静静 共回答了14个问题
阿呆爱静静 共回答了14个问题 |采纳率85.7%BF 3 中B的价电子结构为2s 2 2p 1 ,形成分子时,进行sp 2 杂化,三个sp 2 杂化轨道分别与三个F原子的p轨道成键,故BF 3 分子为平面三角形;NF 3 中的N价电子结构为2s 2 2p 3 ,形成分子时,进行sp 3 不等性杂化,其中一个sp 3 杂化轨道为孤对电子占有,另三个电子分别与F成键,故分子结构为三角锥型。1年前查看全部
- 用杂化轨道理论解释为何三氯化磷是三角锥形,且键角为101°,而三氯化硼却是平面三角形的几何构型.
 xunzhaoqiji1年前1
xunzhaoqiji1年前1 -
 hkyxhy 共回答了8个问题
hkyxhy 共回答了8个问题 |采纳率87.5%磷有五个电子,棚只有三个1年前查看全部
- 试用杂化轨道理论分析为什么BF 3 的空间构型是平面三角形,而NF 3 是三角锥形的?_________________
试用杂化轨道理论分析为什么BF 3 的空间构型是平面三角形,而NF 3 是三角锥形的?_____________________________________________________________________________________________________  paparobin1年前1
paparobin1年前1 -
 起床扫地 共回答了17个问题
起床扫地 共回答了17个问题 |采纳率94.1%BF 3 中B的价电子结构为2s 2 2p 1 ,形成分子时,进行sp 2 杂化,三个sp 2 杂化轨道分别与三个F原子的p轨道成键,故BF 3 分子为平面三角形;NF 3 中的N价电子结构为2s 2 2p 3 ,形成分子时,进行sp 3 不等性杂化,其中一个sp 3 杂化轨道为孤对电子占有,另三个电子分别与F成键,故分子结构为三角锥型。1年前查看全部
- 根据下列分子或离子的几何构型,试用杂化轨道理论加以说明
根据下列分子或离子的几何构型,试用杂化轨道理论加以说明
1、HgCl2(直线型) 2、SiF4(正四面体) 3、BCl(平面三角形) 4、NF3(三角锥形,102°) 5、NO2-(V形,115.4°) 6、SiF6 2- (八面体) pgycs1年前1
pgycs1年前1 -
 小嘴乱撅 共回答了20个问题
小嘴乱撅 共回答了20个问题 |采纳率100%1是SP杂化,2 中硅SP3杂化,故为正四面体 3 中应该是BCL3吧,其中的中心原子BSP2杂化,排斥为平面三角型.4 同2,不过N有孤对电子,所以除去此对电子后是三角锥形.
5也同上,但有俩对孤对电子,除去后是V型,像H2O一样.
6中硅元素是SP3d2杂化,6对电子互斥成空间八面体.
如果有不懂欢迎追问.1年前查看全部
- 一、 简答题 1、试用杂化轨道理论,说明H2O的形成过程.2、试用杂化轨道理论,说明氨分子的形成过程.二、计算:1、将2
一、 简答题
1、试用杂化轨道理论,说明H2O的形成过程.
2、试用杂化轨道理论,说明氨分子的形成过程.
二、计算:
1、将2.45g固体NaCN配置成500cm3的水溶液,计算此溶液的酸度是多少?
已知HCN的Ka = 4.93×10-10
2、如何配置1000ml、PH=5.0,具有中等缓冲能力的缓冲溶液?
已知 HCOOH HCOO- :Pka =3.75; HAC AC-:Pka = 4.75
H2PO4- HPO42-:PKa = 7.21
3、反应:CO + H2O(g)≈CO2+H2,已知某温度下Kc=1.0,若CO的起始浓度为2mol/L,水蒸汽的起始浓度为3mol/L.
求平衡建立后各物质的浓度及CO的转化率. T麦克格雷迪1年前1
T麦克格雷迪1年前1 -
 五行涵 共回答了12个问题
五行涵 共回答了12个问题 |采纳率75%一、简答题1、H2O分子中心原子是O,O的价电子构型为2s(2)2p(4),采用不等性sp3杂化,生成4个sp3杂化轨道,其中两个轨道各填充1个电子,然后分别和一个氢原子的1s轨道重合形成∑键,另外两个杂化轨道填充两对孤对电子.所以...1年前查看全部
- 如何用杂化轨道理论解释分子构型
 迷ss影1年前1
迷ss影1年前1 -
 yfyang 共回答了13个问题
yfyang 共回答了13个问题 |采纳率92.3%“BF3分子具有平面三角形的构型”(对的) 却是三角锥(谁说的?) BF3为平面三角,不是锥形,它是sp2杂化,夹角120度,中心原子层电子对数(三对)全是1年前查看全部
- 用杂化轨道理论推测分子构型:GeH4,H2Te,SbH3
 31555305201年前1
31555305201年前1 -
 钟汀 共回答了20个问题
钟汀 共回答了20个问题 |采纳率95%第一个化合物是正四面体结构,第二个化合物是V字型结构,第三个是三角锥结构.Ge外围有四个单电子,与碳元素是同一主族的,四个单电子能够结合四个氢原子的单电子,并进行配对,通过杂化理论可知都是sp3杂化,而且由于没有单...1年前查看全部
- 杂化轨道理论举个例子:BCL3怎么判断他是SP^2杂化
 tp08ma1年前2
tp08ma1年前2 -
 沙漠楼兰_索菲娅 共回答了15个问题
沙漠楼兰_索菲娅 共回答了15个问题 |采纳率86.7%B最外层有3个电子
3个Cl各提供1个电子
就是3对电子
占据3个轨道
所以sp2杂化的三个轨道呀1年前查看全部
- BF3是平面三角形,但NF3却是三角锥形,试用杂化轨道理论加以说明
 qing3161年前2
qing3161年前2 -
 l780925 共回答了22个问题
l780925 共回答了22个问题 |采纳率86.4%B的p轨道只有三个电子,而N的p轨道有五个电子,NF3也是sp2杂化,三个杂化轨道分别和f城建,但N上还有一对孤对电子,把sp2的平面压下去了,所以成了三角锥型.孤对电子的斥力要比键大.1年前查看全部
- 利用杂化轨道理论解释乙烷,乙烯,乙炔和苯分子的空间构型
 kwb19791年前1
kwb19791年前1 -
 鲁灏 共回答了21个问题
鲁灏 共回答了21个问题 |采纳率95.2%乙烷,两个C都是sp3杂化,四面体形.分子:双四面体共顶点
乙烯,两个C都是sp2杂化,平面三角形.分子:平面
乙炔,两个C都是sp杂化,直线形.分子:直线形
苯,6个C都是sp2杂化,平面三角形.分子:正六边形1年前查看全部
- 甲烷用杂化轨道理论解释为何是sp3
甲烷用杂化轨道理论解释为何是sp3
sp3杂化是一个s轨道和三个p轨道进行杂化 而C的价层电子是 2s2 2p2 s轨道有两个电子,p轨道一个电子,难道是s轨道电子跃迁?对这点我非常困惑 hapy223boy1年前5
hapy223boy1年前5 -
 我相信佛祖 共回答了11个问题
我相信佛祖 共回答了11个问题 |采纳率90.9%其实是有电子跃迁的,因为2s轨域和2p轨域之间的能量缺口很小,因此碳只需投入很少的能量便可将2s轨域上的一个电子跃迁到空2p轨域上,这样做的好处是,碳可以形成4个共价键.成键时额外形成的2个共价键所释放出的能量将超过碳开始时的投入(使电子跃迁的能量).然后可以看做四个轨道揉来揉去,形成四个相同的sp3轨道~1年前查看全部
- 能否用价键理论和杂化轨道理论解释BrF5的空间构型?
 寒笑天下5201年前1
寒笑天下5201年前1 -
 大漠之北 共回答了14个问题
大漠之北 共回答了14个问题 |采纳率78.6%可以,按如下流程:
1、确定中心原子的价电子结构,Br的价电子构型为4s2 4p5 4d0;
2、使中心原子的成单电子数与成键数相等;Br只有1个成单电子,而BrF5中要形成5个共价键,因此必须有5个成单电子,所以Br将通过激发并拆分最高能量轨道(4p)上的电子,并使形成有5个成单电子,即形成4s2 4p3 4d2,此时有5个成单电子;
3、确定杂化方式,根据杂化轨道理论,同一能级组或同一电子层轨道在成键前必须杂化,以提高成键能力,此时杂化方式就是sp3d2,杂化轨道结构是正八面体;
4、确定分子结构,BrF5中会形成5个Br-F键和1对孤电子,分子结构是四方锥.1年前查看全部
- 请问SP3在杂化轨道理论怎么理解简单些?
 rocolashcaty1年前2
rocolashcaty1年前2 -
 潜水高手 共回答了16个问题
潜水高手 共回答了16个问题 |采纳率93.8%sp3杂化即一个s轨道与3个p轨道杂化.注意杂化前后轨道的总数不变.所以形成4个sp3杂化轨道,这四个轨道夹角109度28分,形成正四面体结构.例如甲烷中的碳就是sp3杂化.1年前查看全部
- 怎样用杂化轨道理论理解乙烯分子中的双键是不容旋转的,因而四个氢原子是在一个平
 你是我今生的Love1年前2
你是我今生的Love1年前2 -
 snailpancake 共回答了20个问题
snailpancake 共回答了20个问题 |采纳率90%碳原子轨道是sp2杂化,即以1个2S轨道与2个2P轨道进行杂化,组成3个能量完全相等、性质相同的SP2杂化轨道.
在形成乙烯分子时,每个碳原子各以2个SP2杂化轨道形成2个碳氢σ键,再以1个 SP2杂化轨道形成碳碳σ键.5个σ键都在同一个平面上,2个碳原子未参加杂化的2P轨道,垂直于5个σ键所在的平面而互相平行.这两个平行的P轨道,侧面重叠,形成一个π键.
π键受到限制,不能自由旋转.1年前查看全部
- 用分子轨道法分析乙烯结构是否需要用到杂化轨道理论
 海天归一1年前2
海天归一1年前2 -
 heweifeng11010 共回答了23个问题
heweifeng11010 共回答了23个问题 |采纳率87%要用的.
分子轨道可以通过相应的原子轨道线性组合而成.有几个原子轨道相组合,就形成几个分子轨道.在组合产生的分子轨道中,能量低于原子轨道的称为成键轨道;高于原子轨道的称为反键轨道;无对应的(能量相近,对称性匹配)的原子轨道直接生成的称为非键轨道.
如有不懂,可以hi我交流.我教有机.1年前查看全部
- 试用杂化轨道理论说明硫酸根离子的空间构型.硫酸盐的结晶水数目经常是5或7,其中4或6被认为是阳离子结晶水,它们以配位键与
试用杂化轨道理论说明硫酸根离子的空间构型.硫酸盐的结晶水数目经常是5或7,其中4或6被认为是阳离子结晶水,它们以配位键与阳离子结合,另外一个结晶水被认为是阴离子结晶水,它与硫酸根离子以氢键相结合.试画出阴离子结晶水与硫酸根离子结合的示意图.
 稻草茂1年前1
稻草茂1年前1 -
 王金宝 共回答了23个问题
王金宝 共回答了23个问题 |采纳率91.3%SO42-的中心原子S外层有6个电子,4个O按照VSEPR理论是不提供电子的,因此共有(6+2)/2=4个电子对,为sp3杂化,正四面体构型.
O^^^O…H
^^/^^^^
^^S^^^^^^O
^/^^^^^/
O^^^O…H1年前查看全部
- 三氯化磷,三氯化硼用杂化轨道理论解释其空间构型.
 吃葡萄吐西瓜皮1年前1
吃葡萄吐西瓜皮1年前1 -
 hh人观hh事 共回答了15个问题
hh人观hh事 共回答了15个问题 |采纳率86.7%三氯化磷,价层对数为4,有一对孤对电子,不等性sp3杂化,四面体结构,和氨分子类似.
三氯化硼,价层对数为3,没有孤对电子,平面三角结构,sp2杂化1年前查看全部
大家在问
- 1一道物理题,关于浮力的质量相等的甲,乙,丙三个实心小球,放入水中后,甲球漂浮,乙球悬浮,丙球下沉,则A三个小球所受的浮力
- 2塞翁失马说明《老子》中的“()()”两句话,阐述了祸与福的对立统一关系.成语“()()”就来自这个故事.
- 3化工中的有机酸都有那些?要具体点的,复制粘贴一边去别烦我.我只要名称,请不要一一介绍功能及其化学特性.
- 4a^2(a^2+4a)^2-a^(a^2+4a)-20a^2 因式分解
- 50.85×14=列竖式计算
- 6(2011•温州模拟)如图所示,实线为不知方向的三条电场线,虚线1和2为等势线,从电场中M点以相切于等势线1的相同速度飞
- 7(sina+cosa)^2=2^x+(1/2)^x,a属于(0,pai/2),求tana.
- 8对y''和y'求导的结果分别是什么?
- 9①下列情况物体运动状态可能发生改变的是 ______
- 1095%的乙醇与无水乙醇的区别
- 11速度单位有哪些?他们与公里/小时是怎么换算的?
- 12cos(a-35°)cos(a+25°)+sin(a-35°)sin(65°-a)=?
- 13已知函数f(x)=x2+(2-n)x-2n的图象与x轴正半轴的交点为A(an,0),n=1,2,3,….
- 14在一个半径为4厘米的圆内的所有线段中,最长的一条是( )厘米.
- 151000-999-998+997+996-995-994+993+.+104-103-102+101 等于好多?