NH3易融于水,PH3难融于水.请问这能表示N元素比P元素的非金属性强吗
 bbb432022-10-04 11:39:541条回答
bbb432022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 whbest17 共回答了19个问题
whbest17 共回答了19个问题 |采纳率94.7%- 不能,NH3易溶于水,是因为他和水形成分子间氢键!不能说明非金属性问题!
- 1年前
相关推荐
- 请问为什么氯仿不溶于水我想氯仿不是羟基比较多那不是更容易使氢电离吗那不是应当酸性更强,那不是更易溶于水
 5487321年前5
5487321年前5 -
 whmbn 共回答了22个问题
whmbn 共回答了22个问题 |采纳率90.9%氯仿是三氯甲烷,不含羟基的,楼主可能弄错了.此外,楼上说有机物不溶于无机物,根本就没有这一说.乙醇、甘油、蔗糖……都是是有机物,然而都是可溶于水的.
像含有羟基、羧基、氨基等极性基团的小分子有机物都有一定的水溶性,有些甚至可与水任意比互溶(如乙醇),这是由于这些基团可与水形成氢键,故而水溶性较好.
楼下的注意,氯仿是极性的.1年前查看全部
- 明矾溶于水生成胶体的过程是从12水合硫酸铝钾变成硫酸铝钾再变成氢氧化铝胶体的吗
 clr51年前1
clr51年前1 -
 yxzlxx 共回答了20个问题
yxzlxx 共回答了20个问题 |采纳率95%从12水合硫酸铝钾变成硫酸铝钾溶液,然后水解得到
kAl(SO4)2 ===K+ + Al3+ + 2SO42-
Al3+ +3H2O === Al(OH)3胶体 + 3H+1年前查看全部
- chemkin能模拟氨气溶解于水么.
 英皇绝色男人1年前1
英皇绝色男人1年前1 -
 carolfeifei 共回答了15个问题
carolfeifei 共回答了15个问题 |采纳率86.7%就否定父老敬老反思;lk1年前查看全部
- 已知石灰石所含的杂质不溶于水和盐酸.为测定石灰石的纯度,取4 g样品于烧杯,将50 g稀盐酸分为5次
已知石灰石所含的杂质不溶于水和盐酸.为测定石灰石的纯度,取4 g样品于烧杯,将50 g稀盐酸分为5次依次加入烧杯,每次充分反应后,过滤、干燥、称量剩余固体的质量,再将剩余物放回烧杯,继续进行实验.实验结果如下表(假设过滤、干燥等操作过程,固体质量没有损耗):
请列式计算:(1)该石灰石样品的纯度是多少?实验次数 第1次 第2次 第3次 第4次 第5次 加入稀盐酸的质量 10g 10g 10g 10g 10g 剩余固体的质量 3.0g 2.0g 1.0g 0.4g 0.4g
(2)煅烧该种石灰石100t,得到含杂质的生石灰多少吨? 刘翼6612031年前1
刘翼6612031年前1 -
 suresweet 共回答了11个问题
suresweet 共回答了11个问题 |采纳率90.9%解题思路:根据表中数据可以看出每加10 g酸固体溶解1.0 g,最后不溶固体为0.4 g,从而得到石灰石的纯度,然后利用石灰石高温分解的化学方程式来解答生石灰的质量.(1)因每加10 g酸固体溶解1.0 g,第4次和第5次加酸,固体质量不变,则不溶固体为0.4 g,石灰石样品的纯度为:
(4−0.4)g
4g×100%═90%,
答:石灰石样品的纯度为90%.
(2)该种石灰石100t,其中碳酸钙为100t×90%═90t,杂质为100t-90t═10t,设碳酸钙高温分解生成的生石灰为X,则
CaCO3
高温
.
CaO+CO2↑
100 56
90t X
[100/90t=
56
X],
解得X═50.4t
则得到含杂质的生石灰为50.4t+10t═60.4t
答:得到含杂质的生石灰为60.4t.点评:
本题考点: 含杂质物质的化学反应的有关计算;物质组成的综合计算;质量守恒定律及其应用.
考点点评: 本题考查了学生对表格中数据的分析和应用,准确判断杂质的质量是关键,还要注意计算格式要规范.1年前查看全部
- 现有10.6g大理石(大理石中的杂质不溶于水,也不与酸反应)与100g稀盐酸恰好完全反应,生成4.4gCO2,求
现有10.6g大理石(大理石中的杂质不溶于水,也不与酸反应)与100g稀盐酸恰好完全反应,生成4.4gCO2,求
(1)反应后所得溶液中溶剂的质量.
(2)反应后所得溶液的质量. zj594551年前3
zj594551年前3 -
 夏出清 共回答了18个问题
夏出清 共回答了18个问题 |采纳率100%CaCO3+2HCl=CaCl2+CO2+H2O
100 111 44
10g 11.1g 4.4g
可以知道:碳酸钙的质量为10g,杂质为0.6g,氯化钙为11.1g,
则溶剂为10+100-11.1-4.4=94.5g
溶液质量为10.6+100-4.4-0.6=105.6g1年前查看全部
- 乙酸铵溶于水是什么 怎么用乙酸铵生成乙酸?
 zsz198810161年前1
zsz198810161年前1 -
 flygirl618 共回答了11个问题
flygirl618 共回答了11个问题 |采纳率90.9%醋酸铵溶於水还是醋酸铵啊,可以加入比醋酸强的酸例如硫酸,盐酸等,可以生成乙酸.1年前查看全部
- 叶绿素是否不溶于水为什么不溶于水?
 痞子老cc1年前3
痞子老cc1年前3 -
 zjlwb 共回答了22个问题
zjlwb 共回答了22个问题 |采纳率90.9%叶绿素是有机物,大多数有机物都不易溶于水,但叶绿素可以溶于丙酮1年前查看全部
- 红磷为何既不溶于水又不溶于cs2
红磷为何既不溶于水又不溶于cs2
红磷为何既不溶于水又不溶于cs2?红磷应该是非极性分子吧,为什么不溶于cs2呢,若是极性分子的话应该溶于水的吧,纠结中... rongliangwan1年前1
rongliangwan1年前1 -
 劳动o 共回答了14个问题
劳动o 共回答了14个问题 |采纳率92.9%红磷是链状、网状、层片状等复杂形式的P单质 共价键分布广泛、交叉连接,原子之间结合紧密 整一小片/块红磷就是一个或几个分子(类似于金刚石、单晶硅颗粒一样) 而非极性溶剂CS2只能通过分散作用溶解溶质,不能极化P-...1年前查看全部
- 硫酸钾溶于水呈中性,化学式是——
硫酸钾溶于水呈中性,化学式是——
是反应的化学方程式! 綄鎂ヾ冰之剑ヾ帅1年前4
綄鎂ヾ冰之剑ヾ帅1年前4 -
 bride99 共回答了22个问题
bride99 共回答了22个问题 |采纳率81.8%K2SO41年前查看全部
- 含杂质(杂质不溶于水)的硫酸钠15.5克与35.8克水配制成溶液.过滤后去滤液10克,加入20%的氯化钡溶液20.8克
含杂质(杂质不溶于水)的硫酸钠15.5克与35.8克水配制成溶液.过滤后去滤液10克,加入20%的氯化钡溶液20.8克
含杂质(杂质不溶于水)的硫酸钠15.5克与35.8克水配制成溶液.过滤后去滤液10克,加入20%的氯化钡溶液20.8克恰好完全反应.计算:(1)滤液的质量分数.(2)硫酸钠的纯度.
不要用摩尔,用初三水平做 夜叶1年前1
夜叶1年前1 -
 sleeplesser 共回答了15个问题
sleeplesser 共回答了15个问题 |采纳率100%Na2SO4+BaCl2===BaSO4↓+2NaCl
142 208
x 20.8g*20%
142/x=208/4.16g
x=2.84g
(1)滤液的质量分数2.84g/10g*100%=28.4%.
(2)硫酸钠的纯度.
15.5克样品中硫酸钠的质量为 35.8g*2.84g/(10g-2.84g)=14.2g
纯度 14.2g/15.5g*100%=91.6%1年前查看全部
- 如何判断一个物质溶不溶于水能不能从理论上去判断物质溶不溶于水,比如Cl2,ClCrO2(OH)
 蓝马蹄铁1年前2
蓝马蹄铁1年前2 -
 zhangzuola880819 共回答了22个问题
zhangzuola880819 共回答了22个问题 |采纳率95.5%不能有一个确定的规则吧我觉得,只能根据“相似相溶”原理来大概判定,就是说,像非极性物质会溶于非极性物质中,极性物质会溶于极性物质中.(以下那段是百度)
具体可以这样理
1.极性溶剂(如水)易溶解极性物质(离子晶体、分子晶体中的极性物质如强酸等);
2.非极性溶剂(如苯、汽油、四氯化碳等)能溶解非极性物质(大多数有机物、Br2、I2等)
3.含有相同官能团的物质互溶,如水中含羟基(—OH)能溶解含有羟基的醇、酚、羧酸.
4、一般情况,可简记极性相似,便可相溶.
此原理只能做一般推论,不能做定性的推导理由.1年前查看全部
- 劝学 青,取之于蓝;冰,水为之,而寒于水.这句话你是怎样理解的?它说明了一个什么道理?
 望9991年前1
望9991年前1 -
 栎灵 共回答了15个问题
栎灵 共回答了15个问题 |采纳率86.7%它说明世间万物都是在不断发展的和不断进步的.先辈们留下了宝贵经验和资源,后来者们应当好好利用这份财富,努力提高自我突破成就,以达到青出于蓝胜于蓝,长江后浪推前浪的目标.(绝对原创)1年前查看全部
- 苯甲酸能否使溴水褪色?“ 百科上说是甲苯酸微溶于水,那在做题时是把他当做溶于水处理还是不溶于水处理
 Askey5211年前2
Askey5211年前2 -
 geng_ting 共回答了12个问题
geng_ting 共回答了12个问题 |采纳率100%一半亲水,一半疏水,表面活性类物质.
严格讲按照不溶于水处理.
但是你不能按照百科知识判断,具体的根据课本知识,因为很多超纲知识会颠覆高中课本,会诱导你做错题目的.
所以我只能说如果按照可溶,不能褪色,按照难溶,可以萃取褪色.
.1年前查看全部
- 初三化学计算题一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸。高温时也部发生反应。为了测定该石灰石的纯度,某研究所
初三化学计算题
一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸。高温时也部发生反应。为了测定该石灰石的纯度,某研究所学习小组取用4g这种石灰石样品。用实验室现有的稀盐酸40g分4次加入。每次充分反应后,经过滤、干燥等操作后称量剩余固体物质的质量。每次稀盐酸的用量见下表。(假如过滤、干燥等操作过程。固体物质不受损耗)
稀盐酸的用量 剩余固体的质量
第一次加入10g 3.0g
第二次加入10g 2.0g
第三次加入10g 1.0g
第四次加入10g 0.4g
1.该石灰石样品的纯度是多少?
2.如果煅烧上述石灰石原料生产出含有杂质的生石灰质量为100t,需要上述石灰石原料多少吨?(精确到0.1)
过程!!1 dushishen1年前3
dushishen1年前3 -
 fccool 共回答了10个问题
fccool 共回答了10个问题 |采纳率70%观察可知 前三次反应 盐酸均消耗完 碳酸钙过量
则最后剩余的不反应的即为杂质 杂质质量 0.4g
1.该石灰石样品的纯度是多少?
(4-0.4)/4*100% = 90%
2.如果煅烧上述石灰石原料生产出含有杂质的生石灰质量为100t,需要上述石灰石原料多少吨?(精确到0.1)
设需要上述石灰石原料质量为x
CaCO3 =高温= CaO + CO...1年前查看全部
- 为什么氨气溶于水显碱性
 我们1111年前4
我们1111年前4 -
 飞云乱渡 共回答了23个问题
飞云乱渡 共回答了23个问题 |采纳率100%氨气溶于水会跟水结合成氨水,氨水发生部分水解,电离出按根离子和氢氧根离子,所以氨气溶于水后溶液显碱性
NH3+H2O=(可逆)=NH3·H2O NH3·H2O=(可逆)=NH4+ + OH-1年前查看全部
- 下列说法正确的是( ) A.HR溶液导电性较弱,HR属于弱酸 B.某化合物溶解于水导电,则该化合物为电解质 C.根据电解
下列说法正确的是( )
A.HR溶液导电性较弱,HR属于弱酸 B.某化合物溶解于水导电,则该化合物为电解质 C.根据电解质在其水溶液中能否完全电离,将电解质分成强电解质与弱电解质 D.食盐是电解质,食盐的水溶液也是电解质  liberty_shi1年前1
liberty_shi1年前1 -
 bovey2005 共回答了15个问题
bovey2005 共回答了15个问题 |采纳率93.3%C
1年前查看全部
- 除去二氧化碳中的气体用饱和碳酸氢钠溶液,是要抑制二氧化碳气体的溶解.二氧化碳溶不溶于水是碳酸氢钠决定的吗?那有没有一种情
除去二氧化碳中的气体用饱和碳酸氢钠溶液,是要抑制二氧化碳气体的溶解.二氧化碳溶不溶于水是碳酸氢钠决定的吗?那有没有一种情况是碳酸氢钠溶液饱和了而二氧化碳也溶于水了只是不反应而已?我觉得碳酸氢钠饱和了只能说明碳酸氢根满了,可是二氧化碳溶于水后生成的碳酸是碳酸根和碳酸氢跟有什么冲突啊.还有能不能用饱和碳酸钠溶液除二氧化碳里的气体?
 yutiandewoniu1年前4
yutiandewoniu1年前4 -
 dxg539 共回答了9个问题
dxg539 共回答了9个问题 |采纳率88.9%1:除去二氧化碳中的气体用饱和碳酸氢钠溶液这个命题本身就有漏洞,要是杂质气体像氧气氮气甲烷也不溶于溶液怎么办?这说的气体是氯化氢之类的吧2不是说CO2不溶于水,是CO2溶于水的过程收到了碳酸氢根的抑制,导致溶于水的量很小,所以那句二氧化碳不溶于水是碳酸氢钠决定的吗,差不多是对的3碳酸氢钠饱和的情况下,二氧化碳是不溶于水的(严谨滴说,是溶解量少),也可以这样说CO2+H2O=H2CO3,然后碳酸电离出一个氢离子,变成碳酸氢根,那个氢离子与其他碳酸氢根结合又生成了碳酸(如果碳酸氢根离子不饱和,那个氢离子就会到处跑不那么容易撞到碳酸氢根),而碳酸不稳定最终分解了,形成二氧化碳和水,实际上就等于CO2没溶水4二氧化碳溶于水生成的碳酸不是碳酸根,当然会碳酸氢根冲突的啊5不能,二氧化碳会跟碳酸钠反应的1年前查看全部
- 将2.5gNaCO3,NaHCO3,NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸
将2.5gNaCO3,NaHCO3,NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体

积与产生CO2的体积关系如下图所示,计算原混合物中NaOH的质量及碳酸钠的质量分数 海师爱心aa1年前1
海师爱心aa1年前1 -
 程育宣 共回答了23个问题
程育宣 共回答了23个问题 |采纳率91.3%Na2CO3 xmol;NaHCO3 ymol;NaOH zmol;
106x+84y+40z=2.5
x+y=1(0.045-0.025)=0.020
y-z=1*(0.025-0.020)=0.0051年前查看全部
- 硝酸钾溶于水是放热还是吸热?
 Paris曦曦1年前2
Paris曦曦1年前2 -
 泳装ss 共回答了11个问题
泳装ss 共回答了11个问题 |采纳率100%属于吸热反应,将装有少量硝酸钾的瓶放置代水的盘中,过一会儿会出现结冻现象,并有凉冰丝产生!1年前查看全部
- 医学本科有机化学推理题,急1、某化合物A(C5H10O2)不溶于水,A能和氨反应生成B和C(C3H7ON).B能够发生碘
医学本科有机化学推理题,急
1、某化合物A(C5H10O2)不溶于水,A能和氨反应生成B和C(C3H7ON).B能够发生碘仿反应,B不能够与氢氰酸发生加成反应,但能够被酸性高锰酸钾彻底氧化生成D,B和D都能和水以任意比混溶.C为一近中性化合物,C可以和亚硝酸反应放N2,并且生成化合物E.D和E都可以与碳酸氢钠溶液反应放出二氧化碳,B和E反应可以生成A.试写出A、B、C、D、E的结构.(给出推断依据)
2、某化合物的分子式是C6H10O3,其1H NMR谱为: 2.2(单峰,3H), 3.5( 单峰,2H),4.1(四重峰,2H),1.2(三重峰,3H);IR谱图:1700cm-1有吸收峰,但无2820 cm-1、2720 cm-1的吸收峰;该化合物可与氢氰酸发生加成反应,也能和金属钠作用放出氢气.试推断该化合物的分子结构式.(给出推断依据)
2、某化合物分子式为C9H10O,其1H NMR谱为:2.02(单峰,3H), 3.71(单峰,2H),7.25(多重峰,5H);IR谱:1720cm-1有强吸收峰,但无2820 cm-1、2720 cm-1的吸收峰;该化合物能发生碘仿反应,不与Tollens试剂发生反应.试推断该化合物的分子结构式.(给出推断依据) 雪落枫1年前1
雪落枫1年前1 -
 太叔鹕 共回答了17个问题
太叔鹕 共回答了17个问题 |采纳率94.1%A.CH3CH2COOCH2CH3 B.C2H5OH
C.CH3CH2CONH2 D.CH3COOH E.CH3CH2COOH1年前查看全部
- 上善若水和.天下柔者莫过于水,而能攻坚者又莫胜于水. 这这是同种意思吗 有什么区别
 rikusuki1年前1
rikusuki1年前1 -
 shelly625 共回答了9个问题
shelly625 共回答了9个问题 |采纳率77.8%不是一个意思,上善若水是指最好的品格就像水一样,而第二句的意思是水虽柔,却能以柔克刚1年前查看全部
- 下列关于油脂的论述错误的是( ) A.油脂的密度都比水轻,不溶于水,易溶于乙醇、乙醚、苯、氯仿等有机溶剂 B.油脂
下列关于油脂的论述错误的是( )
A.油脂的密度都比水轻,不溶于水,易溶于乙醇、乙醚、苯、氯仿等有机溶剂 B.油脂的相对分子质量很大,属于高分子化合物 C.油的化学稳定性不如脂,容易被氧化,也容易发生加成反应 D.所有的常温下是液态的植物油都可以催化加氢转变成固态的脂,即人造脂肪  当上631年前1
当上631年前1 -
 zhuxiaoshuai 共回答了23个问题
zhuxiaoshuai 共回答了23个问题 |采纳率91.3%B
油脂有具体分子式,不属于高分子化合物,油的烃基不饱和,易被氧化。1年前查看全部
- A、B、C、D、B、F是初中化学中常见的物质,其中A为黑色固体,D为难溶于水的蓝色固体,F为不溶于水也不溶于稀硝酸的白色
A、B、C、D、B、F是初中化学中常见的物质,其中A为黑色固体,D为难溶于水的蓝色固体,F为不溶于水也不溶于稀硝酸的白色固体,其余均为溶液,它们之间存在如下转化关系:

根据上述转化关系回答问题:
(1)写出物质的化学式:D______;E______.
(2)写出上述关系中D转化成C的化学方程式:______其基本反应类型为______.
(3)A与B反应的化学方程式:______. lyqzg1年前1
lyqzg1年前1 -
 lb196411 共回答了19个问题
lb196411 共回答了19个问题 |采纳率89.5%解题思路:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,根据叙述的关键,以及物质的性质和物质之间的反应,做出判断,D为难溶于水的蓝色固体,则D为氢氧化铜,F由E和氯化钡反应生成,F为不溶于水也不溶于稀硝酸的白色固体,则F为硫酸钡,E为硫酸钾,A为黑色同体,能与B反应生成C和水,则C可能为硫酸铜,A可能为氧化铜,B可能为硫酸,代入框图,推断合理.D为难溶于水的蓝色固体,则D为氢氧化铜,F由E和氯化钡反应生成,F为不溶于水也不溶于稀硝酸的白色固体,则F为硫酸钡,E为硫酸钾,A为黑色同体,能与B反应生成C和水,则C可能为硫酸铜,A可能为氧化铜,B可能为硫酸,因此:
(1)D为氢氧化铜,E为硫酸钾,化学式分别为:Cu(OH)2,K2SO4;
(2)根据推断,D为氢氧化铜,B为硫酸,生成的C为硫酸铜,此反应是两种化合物相互交换成分得到的两种新的化合物的反应,属于复分解反应,氢氧化铜和硫酸反应的方程式为:Cu(OH)2+H2SO4═CuSO4+2H2O;
(3)A未氧化铜,B为硫酸,反应的方程式为:CuO+H2SO4=CuSO4+H2O;
故答案为:(1)DCu(OH)2;EK2SO4.
(2)Cu(OH)2+H2SO4=CuSO4+2H2O; 复分解反应.
(3)CuO+H2SO4=CuSO4+H2O.点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.1年前查看全部
- 既不溶于水也不溶于酸的白色沉淀除了氯化银硫酸钡还有什么
 煮妇啦啦啦1年前1
煮妇啦啦啦1年前1 -
 荡阳 共回答了24个问题
荡阳 共回答了24个问题 |采纳率95.8%硫酸锶,氯化亚汞1年前查看全部
- 现有35g含杂质的锌跟200g24 .5%的硫酸溶液恰好反应杂质不溶于水也不与硫酸反应
现有35g含杂质的锌跟200g24 .5%的硫酸溶液恰好反应杂质不溶于水也不与硫酸反应
1求生成氢气的质量2最终锁所得溶液中溶质的质量分数 ingramping1年前1
ingramping1年前1 -
 WKQ7654321 共回答了21个问题
WKQ7654321 共回答了21个问题 |采纳率81%Zn和硫酸反应如下:
因为是恰好反应,所以根据H2SO4的质量进行计算即可.
Zn + H2SO4====ZnSO4 + H2(气体) 设,反应消耗Zn X克,生成ZnSO4 Y克,生成H2 Z克
65 98 161 2
X 49 Y Z
===> x=32.5 Y=80.5 Z=1
所以:
1、生成H2 1g
2、反应后,溶液总质量为 32.5 +200-1=231.5g
(因为杂质不溶、且不反应,所以不算在溶液体系内)
所以,ZnSO4质量分数=80.5÷231.5×100%=34.77%1年前查看全部
- 某学校的研究性学习小组在实践活动中了解到,某石材厂有一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸。为了测定该石灰
某学校的研究性学习小组在实践活动中了解到,某石材厂有一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸。为了测定该石灰石的纯度,该研究性学习小组取用4g这种石灰石样品,用实验室现有稀盐酸40g分4次加入。每次充分反应后,经过滤、干燥等操作。操作后称量固体物质的质量。每次稀盐酸的用量及剩余固体的质量见下表。(假设过滤、干燥等操作过程,固体物质不受损耗) 稀盐酸的用量剩余固体的质量第一次加入10g3.0g第二次加入10g2.0g第三次加入10g1.0g第四次加入10g0.4g计算:
(1)该石灰石样品的纯度是多少?
(2)三、四次产生的二氧化碳的质量共为多少? 酷酷的男孩1年前1
酷酷的男孩1年前1 -
 baoguobin815 共回答了18个问题
baoguobin815 共回答了18个问题 |采纳率83.3%90%;0.704g1年前查看全部
- 天然蛋白质R的水解产物是一直链氨基酸,该氨基酸分子中只有一个氮原子,0.159g 该氨基酸溶于水需用20.25mL0.1
天然蛋白质R的水解产物是一直链氨基酸,该氨基酸分子中只有一个氮原子,0.159g 该氨基酸溶于水需用20.25mL0.107mol/LKOH溶液中和.若取2.94g该氨基酸用一定的化学方法处理,将全部的氮原子全转化为NH3,其体积在标准状况下为448mL.
1)求该氨基酸的相对分子质量
2)推断该氨基酸的分子式和结构简式 HL000081年前1
HL000081年前1 -
 找不到用户 共回答了19个问题
找不到用户 共回答了19个问题 |采纳率89.5%该氨基酸分子中只有一个氮原子也就是说只有一个氨基.
取2.94g该氨基酸用一定的化学方法处理,将全部的氮原子全转化为NH3,其体积在标准状况下为448mL,物质的量为0.02mol,也就是说氨基为0.02mol.
根据上面所述知道氨基酸分子为0.02mol,其摩尔质量为2.94g÷0.02mol=147g/mol.
0.159g 该氨基酸物质的量为1.08×10^(-3)mol,溶于水需用20.25mL0.107mol/LKOH溶液(所含KOH物质的量为2.16×10^(-3)mol)中和,说明该氨基酸分子含有2个-COOH羧基.
-COOH式量为45,-NH2式量为16,所以氨基酸分子除去氨基和羧基后剩余烃基部分:
147-2×45-16=41,经推算为C3H5.
该氨基酸是天然氨基酸,属于α-氨基酸,根据上述情况推测为谷氨酸,即2-氨基戊二酸.1年前查看全部
- 氢氧化铜不溶于水怎么还是碱?如题,赐教
 googrsj1年前3
googrsj1年前3 -
 PTPT 共回答了28个问题
PTPT 共回答了28个问题 |采纳率82.1%电离出的阴离子全为OH-的就叫碱.
看定义即可.1年前查看全部
- 标况下氢气氯气的混合气体为47.04L完全反应后产生氯化氢气体全溶于水得到20%的盐酸365g求氢气和氯气的质量
标况下氢气氯气的混合气体为47.04L完全反应后产生氯化氢气体全溶于水得到20%的盐酸365g求氢气和氯气的质量
帮帮忙啊 lazybone241年前1
lazybone241年前1 -
 明天会更好888 共回答了20个问题
明天会更好888 共回答了20个问题 |采纳率85%分析:20%的盐酸365克中含有HCl 73克,为2mol,所以根据方程式:
H2+Cl2 2HCl 反应掉的氢气和氯气各 1mol,体积为44.8升,剩余气体2.24升,可能为H2,也可能为Cl2,如果余气是H2,则共有H2 1.1mol,2.2g,如果余气是Cl2,则有H2 1mol,2g.1年前查看全部
- (2011•道里区一模)小明同学为了测定含有小苏打的胃药中小苏打的含量,(该胃药中其他成分不溶于水,也不与酸反应)取20
(2011•道里区一模)小明同学为了测定含有小苏打的胃药中小苏打的含量,(该胃药中其他成分不溶于水,也不与酸反应)取20g该胃药于烧杯中,向其中加入100g稀盐酸,恰好完全反应后,烧杯中剩余物质的质量为111.2g,请根据要求回答问题:
(1)发生反应的化学方程式______
(2)根据已知条件列出稀盐酸中溶质质量(x)的比例式[36.5/x]=[44/8.8g][36.5/x]=[44/8.8g]
(3)该胃药中小苏打的含量为______
(4)若小亮另取一种含小苏打的胃药(其他成分不溶于水也不与酸反应)做类似的测定.同样取20g药品,100g另一种未知浓度的盐酸,恰好完全反应后,若烧杯中剩余溶液为106g,则所用盐酸的溶质质量分数为______ (取整数) 杳阳1年前1
杳阳1年前1 -
 nimadawa 共回答了23个问题
nimadawa 共回答了23个问题 |采纳率91.3%解题思路:(1)根据小苏打的性质,写出小苏打与盐酸发生反应的化学方程式;
(2)根据质量守恒定律,计算出恰好完全反应所放出二氧化碳的质量,利用二氧化碳与盐酸在反应中的质量关系,列出稀盐酸中溶质质量(x)的比例式;
(3)该胃药中小苏打的含量=[小苏打的质量/样品质量20g]×100%,其中小苏打的质量可根据反应的化学方程式,由二氧化碳质量计算出来;
(4)根据反应的化学方程式,由加入碳酸氢钠的质量与放出二氧化碳的质量关系,判断完全反应时溶液质量的差量,由溶液质量差与盐酸的反应关系,利用测定实验中溶液前后质量差计算所消耗稀盐酸的质量分数.(1)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)根据质量守恒定律,反应放出二氧化碳的质量=20g+100g-111.2g=8.8g
NaHCO3+HCl═NaCl+H2O+CO2↑
84 36.5 44
x 8.8g
[36.5/x]=[44/8.8g]
(3)设小苏打的质量为y
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
y 8.8g
[84/y]=[44/8.8g] y=16.8g
该胃药中小苏打的含量=[16.8g/20g]×100%=84%
(4)根据质量守恒定律,反应放出二氧化碳后溶液质量增加=106g-100g=6g
设所用盐酸的溶质质量分数为z
NaHCO3+HCl═NaCl+H2O+CO2↑ 溶液增重
8436.5 44 84-44=40
100g×z 6g
[36.5/100g×z]=[40/6g] z=5%
故答案为:
(1)NaHCO3+HCl═NaCl+H2O+CO2↑;
(2)[36.5/x]=[44/8.8g];
(3)84%;
(4)5%.点评:
本题考点: 根据化学反应方程式的计算;实验探究物质的组成成分以及含量.
考点点评: 利用溶液的差量法解答本问题:根据反应的化学方程式,利用反应前后所得溶液的质量差计算反应所消耗盐酸的溶质质量分数,可以使计算过程简明许多.1年前查看全部
- 物质溶解于水,本以分子构成的物质现以离子形式进入溶液,为什么还能够保持物质的化学性质呢?
 xcvjasidfui1年前1
xcvjasidfui1年前1 -
 飞鸟与鱼lxj 共回答了29个问题
飞鸟与鱼lxj 共回答了29个问题 |采纳率86.2%粒子的化学性质是由粒子的核外电子决定的,分子以离子形态进入溶液,其核外电子并未发生变化,故其化学性质仍是那样1年前查看全部
- 二氧化碳溶于水产生碳酸,溶液中存在的阳离子是什么
 cxuhua1年前4
cxuhua1年前4 -
 水她她 共回答了21个问题
水她她 共回答了21个问题 |采纳率100%二氧化碳溶于水产生碳酸,碳酸是弱酸,会电离出部分氢离子(即溶液中存在的阳离子)1年前查看全部
- 文化经典阅读(6分)阅读下面《孟子》选段,回答问题。(6分)徐子曰:“仲尼亟 ① 称于水,曰‘水哉,水哉!’何取于水也?
文化经典阅读(6分)
阅读下面《孟子》选段,回答问题。(6分)
徐子曰:“仲尼亟 ① 称于水,曰‘水哉,水哉!’何取于水也?”
孟子曰:“源泉混混 ② ,不舍昼夜,盈科而后进 ③ ,放乎四海。有本者如是,是之取尔 ④ 。苟为无本,七八月之间雨集,沟浍 ⑤ 皆盈,其涸也,可立而待也。故声闻过情⑥,君子耻之。”(《孟子·离娄下》)
[注]①亟:屡次。②混混:水不断涌出的样子。③盈科而后进:注满洼坑后继续前进。④是之取尔: “取是尔”的倒装句,“取这个罢了。”⑤浍:田间水道。⑥声闻过情:声望名誉超过了实际情况(实际的学养)。
(1)请简要概括“有本之水”和“无本之水”的特点。(2分)
(2)请简要分析孟子以水为喻所阐述的观点。(4分) cugych1年前1
cugych1年前1 -
 chentwo211 共回答了18个问题
chentwo211 共回答了18个问题 |采纳率83.3%(1)有本之水:源源不断,奔流不息。无本之水:来得快,来得大,易于涸。(2分。意思对即可)
(2)答案示例:以“源泉”和“雨集”喻指两种相反的为学态度和方法,强调为学要务本求实,不要追求虚名;要不断进取,循序渐进,不要急于求成。(4分)
略
[参考译文]
徐子说:“孔子多次称赞水,说道‘水啊,水啊!’对于水,孔予取它哪一点呢?”
孟子说:“源头里的泉水滚滚涌出,日夜不停,注满洼坑后继续前进,最后流入大海。有本源的事物都是这样,孔子就取它这一点罢了。如果没有本源,像七八月间的暴雨那样,下得很集中,虽然也可以一下子灌满大小沟渠,但也会一下予就干涸枯竭。所以,声望名誉超过了实际情况(实际的学养),君子就会感到羞耻。”1年前查看全部
- 有一种石灰石样品,其中含有既不溶于水也不与盐酸反应的杂质二氧化硅.某同学为了测定该样品的纯度,他取了2g石灰石样品,将2
有一种石灰石样品,其中含有既不溶于水也不与盐酸反应的杂质二氧化硅.某同学为了测定该样品的纯度,他取了2g石灰石样品,将20g稀盐酸分四次加入,实验中得到的数据记录如下:
(1)该石灰石样品的纯度为多少?稀盐酸用量 剩余固体质量 第一次加入5g 1.315g 第二次加入5g 0.63g 第三次加入5g 0.3g 第四次加入5g 0.3g
(2)20kg这种石灰石与足量的盐酸反应,可以生产多少千克CO2? 小涟漪1年前1
小涟漪1年前1 -
 jjkan 共回答了29个问题
jjkan 共回答了29个问题 |采纳率86.2%解题思路:(1)由于样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水,因此由表中每次加入5g稀盐酸固体减少的质量关系可判断:每加入5g稀盐酸固体应减少0.685g;据此规律,由第四次加入盐酸后固体质量的减少值小于0.685g可判断此次反应后碳酸钙已完全反应;利用样品杂质的质量,由此求出石灰石样品中碳酸钙的质量分数;
(2)根据化学方程式计算,根据碳酸钙的质量就可求出生成的二氧化碳的质量.(1)根据表中的实验数据可得,每加入5g稀盐酸,固体质量减少0.685g,第三次加入稀盐酸后,固体减少的质量=0.63g-0.3g=0.33g,小于0.685g,即此时碳酸钙已完全反应;所以剩余的0.3g固体即为杂质的质量,石灰石样品中碳酸钙的质量分数=[2g−0.3g/2g]×100%=85%
(2)设20Kg石灰石样品与足量稀盐酸反应生成CO2的质量为x,碳酸钙的质量为20Kg×85%=17Kg
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
17Kgx
[100/44=
17Kg
x]
x=7.48Kg
答案:
(1)该石灰石样品的纯度为85%
(2)可以生产7.48千克CO2点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据图表中剩余固体的质量,分析每次加入相同稀盐酸所减少的质量即样品中被反应掉碳酸钙的质量,判断出第四次加稀盐酸后碳酸钙完全反应,此为本题的突破口.1年前查看全部
- 为测定石灰石中碳酸钙的纯度,取一定质量的石灰石(杂质不溶于水,也不与酸反应)高温煅烧一段时间后得78g固体向其中加入40
为测定石灰石中碳酸钙的纯度,取一定质量的石灰石(杂质不溶于水,也不与酸反应)高温煅烧一段时间后得78g固体向其中加入400g质量分数为14.6%的稀盐酸充分反应后发现固体质量不再减少,过滤得一定质量的中性溶液和20g不溶物(滤渣),则原石灰石样品中碳酸钙的纯度为( )
A. 50%
B. 75%
C. 80%
D. 90% 闹静静1年前1
闹静静1年前1 -
 生命痕迹 共回答了14个问题
生命痕迹 共回答了14个问题 |采纳率100%解题思路:石灰石高温锻烧,碳酸钙分解生成氧化钙和二氧化碳,锻烧后固体与盐酸反应,碳酸钙与盐酸反应生成氯化钙、水、二氧化碳而氧化钙与盐酸生成氯化钙和水,且反应后溶液呈中性,说明恰好完全反应,因此,反应后所得溶液一定是氯化钙,其中钙元素质量即石灰石中碳酸钙中钙元素的质量、氯元素质量即所加盐酸中氯元素质量;利用氯化钙中氯元素与钙元素质量关系,可由盐酸中所含氯元素质量求得碳酸钙中钙元素质量,进而计算出碳酸钙的质量,最终根据题意完成原石灰石样品中碳酸钙的纯度的计算.400g质量分数为14.6%的稀盐酸中所含氯元素质量=400g×14.6%×[35.5/36.5]×100%=56.8g
氯化钙中钙元素与氯元素质量比=40:(35.5×2)=40:71,则氯化钙中氯元素质量为56.8g时钙元素质量=[56.8g/71×40=32g
石灰石中碳酸钙的质量=32g÷
40
100]×100%=80g
原石灰石样品中碳酸钙的纯度=[80g/80g+20g]×100%=80%
故选C.点评:
本题考点: 根据化学反应方程式的计算;含杂质物质的化学反应的有关计算.
考点点评: 根据化学变化前后元素质量不变,通过氯化钙中氯元素与钙元素质量关系,建立盐酸与碳酸钙的质量关系,这是解答本题的技巧所在.1年前查看全部
- (2014•江宁区二模)为了测定某样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不溶于水和酸),某兴趣小组的同
(2014•江宁区二模)为了测定某样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不溶于水和酸),某兴趣小组的同学进行了如下的实验,请你参与过程分析.
【查阅资料】
1草酸(H2C2O4)在浓硫酸作用下受热分解,化学方程式为H2C2O4
CO2↑+CO↑+H2O浓硫酸 .△
2碱石灰能吸收二氧化碳和水蒸气
【实验设计及操作】用如图所示装置进行实验:
【问题讨论】
(1)装药品前应先______,实验中观察到E中现象是:固体颜色______;
(2)进入E中的气体是纯净、干燥的CO,则B、C、D中依次是______(填序号).
①浓硫酸、石灰水、氢氧化钠溶液 ②石灰水、氢氧化钠溶液、浓硫酸
③氢氧化钠溶液、石灰水、浓硫酸
(3)G的作用是______;E中反应的化学方程式是3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3;
2Fe+3CO2高温 .
(4)当E中固体完全反应后,先熄灭______灯(A、E);
(5)实验装置有一明显缺陷是:______.
【数据处理】称取样品8.0g,用上述装置进行实验,充分反应后称量F装置增重4.4g.则样品中氧化铁质量分数为______.
【实验反思】当观察到E中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数______(填“偏大”,“偏小”,“无影响”). 神奇之神1年前1
神奇之神1年前1 -
 鹿惊 共回答了22个问题
鹿惊 共回答了22个问题 |采纳率100%解题思路:【问题讨论】
(1)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
氧化铁是红色的,和一氧化碳反应能生成黑色的铁粉和二氧化碳;
(2)氢氧化钠溶液能够吸收二氧化碳气体,二氧化碳能使澄清石灰水变浑浊,浓硫酸具有吸水性,可以用来干燥一氧化碳;
(3)G的作用是防止空气中的二氧化碳和水蒸气干扰实验;
一氧化碳和氧化铁在高温条件下反应能生成铁和二氧化碳;
(4)当E中固体完全反应后,为了防止液体倒吸入A装置,应该先熄灭E处的酒精灯;
(5)一氧化碳有毒,扩散到空气中会污染环境;
【数据处理】
F装置增重的部分即为生成二氧化碳的质量,根据二氧化碳的质量可以计算氧化铁的质量,进一步可以计算样品中氧化铁的质量分数;
【实验反思】
当观察到E中固体全部变黑后,若立即停止通CO,则反应生成的二氧化碳不能被F装置完全吸收.【问题讨论】
(1)装药品前应先检查装置气密性,实验中观察到E中现象是:固体颜色由红色变成黑色.
故填:检查装置气密性;由红色变成黑色.
(2)进入E中的气体是纯净、干燥的CO,则B、C、D中依次是氢氧化钠溶液、石灰水、浓硫酸.
故填:③.
(3)G的作用是防止空气中的二氧化碳和水蒸气进入F;E中反应的化学方程式是3CO+Fe2O3
高温
.
2Fe+3CO2.
故填:防止空气中的二氧化碳和水蒸气进入F;3CO+Fe2O3
高温
.
2Fe+3CO2.
(4)当E中固体完全反应后,先熄灭E处的酒精灯.
故填:E.
(5)实验装置明显缺陷是没有处理尾气.
故填:没有处理尾气.
【数据处理】
设氧化铁的质量为x,
3CO+Fe2O3
高温
.
2Fe+3CO2,
160 132
x 4.4g
[160/x]=[132/4.4g],
x=5.3g,
则样品中氧化铁质量分数为:[5.3g/8.0g]×100%=66.7%,
故填:66.7%.
【实验反思】
当观察到E中固体全部变黑后,若立即停止通CO,会导致生成的二氧化碳不能被F装置完全吸收,则测得的样品中氧化铁的质量分数会偏小.
故填:偏小.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;一氧化碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.1年前查看全部
- 一道令人发疯的化学题某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与盐酸反应)进行分析.甲乙丙三位同学分别进行
一道令人发疯的化学题
某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与盐酸反应)进行分析.甲乙丙三位同学分别进行试验,其中只有一位同学所取用的稀硫酸与铁样品恰好反应.实验数据如下(烧杯的质量为25.4g).
甲 乙 丙
烧杯+稀硫酸 200g 150g 150g
加入的铁样品 9g 9g 14g
充分反映后,烧杯+剩余物 208.7g 158.7g 163.7g
1、那位同学所取用的稀硫酸与铁样品恰好完全反应
2、计算样品中铁的质量分数
3、计算恰好完全反应后所得溶液中溶质的质量分数
先谢谢答题的哥哥姐姐了!
还请来点步骤 歪歪大虾1年前1
歪歪大虾1年前1 -
 honje2000 共回答了13个问题
honje2000 共回答了13个问题 |采纳率92.3%(1)乙同学
(2)设铁的质量分数为x,FeSO4质量为y
Fe + H2SO4 = FeSO4 + H2↑
56 154 2
9×x y 150+9-158.7
x=93.3%
y=23.1
铁中的杂质为:9×(1-93.3%)=0.603g
所以恰好完全反应后所得溶液中溶质的质量分数为:
23.1÷(158.7-25.4-0.603)=17.4%1年前查看全部
- 硫化氢(H2S)是一种有毒气体,密度比空气大,且能溶于水形成氢硫酸.实验室常用块状固体硫化亚铁(FeS)与稀H2SO4混
硫化氢(H2S)是一种有毒气体,密度比空气大,且能溶于水形成氢硫酸.实验室常用块状固体硫化亚铁(FeS)与稀H2SO4混合,在常温下反应制得硫化氢气体,同时生成硫酸亚铁.试回答:
(1)实验室制取硫化氢气体的化学方程式为:______;
(2)根据装置图回答下列问题: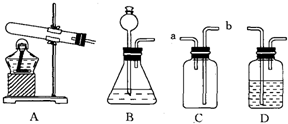
①制取硫化氢气体的发生装置可选用(填序号)______;
②若用C装置收集硫化氢气体,H2S气体应从(填“a”或“b”)______进入,原因是______;
③为验证硫化氢气体的水溶液呈酸性,可将该气体通入装置D中.D中所盛试剂应该是______,现象是______;
④制取H2S气体实验中,多余的气体能否直接排放到空气中?为什么?应怎样处理?______. zings1231年前1
zings1231年前1 -
 sl3397837 共回答了14个问题
sl3397837 共回答了14个问题 |采纳率92.9%(1)实验室制取硫化氢气体的化学方程式为:FeS+H2SO4═FeSO4+H2S↑.
故填:FeS+H2SO4═FeSO4+H2S↑.
(2)①硫化亚铁和稀硫酸反应不需要加热,应该用B装置作为发生装置.
故填:B.
②因为硫化氢气体的密度比空气大,所以H2S气体应从b导管进入.
故填:b;硫化氢气体的密度比空气大.
③为验证硫化氢气体的水溶液呈酸性,可将该气体通入装置D中,D中所盛试剂应该是紫色石蕊试液,现象是溶液由紫色变成红色.
故填:紫色石蕊试液;溶液由紫色变成红色.
④因为硫化氢气体有毒,排放到空气中会污染环境,所以不能把硫化氢排放到空气中;
处理方法:将尾气用氢氧化钠等碱溶液吸收,这是因为氢氧化钠溶液能和硫化氢反应生成硫化钠和水.
故填:不能;因为H2S气体有毒,会污染空气;处理方法:将尾气用氢氧化钠等碱溶液吸收.1年前查看全部
- 配位化合物 中如 {cu(NH3)4}CL2 它溶于水是怎么电离的 会出现 NH4+吗
 qjsj67671年前3
qjsj67671年前3 -
 冥鱼 共回答了17个问题
冥鱼 共回答了17个问题 |采纳率100%因为{cu(NH3)4}这是一个整体的 由配位键连接,配位键相当于共价键,相当牢固.配位体和氯离子形成的是离子键,这个就比较容易断裂了,所以呢 溶液中会存在{cu(NH3)4}阳离子和氯离子1年前查看全部
- 暗绿色固体A不溶于水,将A与NaOH固体共熔得易溶于水的化合物B.将B溶于水后加入H2O2得黄色溶液C.向C中加入稀硫酸
暗绿色固体A不溶于水,将A与NaOH固体共熔得易溶于水的化合物B.将B溶于水后加入H2O2得黄色溶液C.向C中加入稀硫酸至酸性后转化为橙色溶液D.向酸化的D溶液中滴加Na2SO4溶液得绿色溶液E.向E中加入氨水得灰蓝色沉淀F,再加入氯化铵并微热则F溶解得紫红色溶液G.请给出字母所代表的物质并写出相关的反应方程式.
 yuhuat1年前2
yuhuat1年前2 -
 guiwawa0428 共回答了15个问题
guiwawa0428 共回答了15个问题 |采纳率93.3%A:Cr2O3
B:NaCrO2
C:Na2CrO4
D:Na2Cr2O7
E:Cr2(SO4)3
F:Cr(OH)3
G:[Cr(NH3)2(H2O)4]3+1年前查看全部
- 书上写 “硝酸铵溶于水吸热 降温”“硝酸铵的溶解度随温度的升高而升高”
书上写 “硝酸铵溶于水吸热 降温”“硝酸铵的溶解度随温度的升高而升高”
如果在100g水中溶20g硝酸铵 达到饱和 硝酸铵溶水吸热 溶液降温 ;则降温后溶解度也随之降低 会有硝酸铵固体析出 ——这种猜想对吗 我有点饿1年前2
我有点饿1年前2 -
 grace00 共回答了31个问题
grace00 共回答了31个问题 |采纳率90.3%降温速度要快于溶解速度.假如温度t时,100g水溶解20g硝铵达到饱和,那么将20g硝铵投入100g水中,它会边降温边溶解.由于降温速度快于溶解速度,所以,达到某一平衡点后,总有部分硝铵无法溶解,直至外界温度使溶液温度又逐渐升高,它才会继续溶解剩余部分.当回升至t时,全部溶解.
所以,溶解过程中,会发现是逐渐溶解掉的,而不是溶解后又析出.1年前查看全部
- 某石材厂购进一批石灰石原料,其所含杂质既不溶于水,也不溶于盐酸,高温时也不发生反应.
某石材厂购进一批石灰石原料,其所含杂质既不溶于水,也不溶于盐酸,高温时也不发生反应.
甲乙丙丁四位同学分别取某石灰石样品,并取稀盐酸200g平均分成四份,进行试验,结果如下试验x05
甲 乙 丙x05 丁
加入样品的质量x055x0510x0515x0520
生成CO2的质量x051.76x053.52x054.40x05m
求m的数值 石灰石样品中CaCO3的质量分数 稀盐酸中溶质的质量分数 lipansl1年前1
lipansl1年前1 -
 majic321 共回答了15个问题
majic321 共回答了15个问题 |采纳率93.3%m的数值 4.40
甲乙都是盐酸过量,乙丙是石灰石过量
CaCO3+2HCl=CaCl2+H2O+CO2
100 44
x 3.52g
100/x=44/3.52g
x=8g
石灰石样品中CaCO3的质量分数 8g/10g*100%=80%
CaCO3+2HCl=CaCl2+H2O+CO2
73 44
y 4.4g
73/y=44/4.4g
y=7.3g
稀盐酸中溶质的质量分数 7.3g/50g*100%=14.6%1年前查看全部
- 为什么碳酸钠 碳酸氢钠溶于水放热
 毛毛绒球1年前4
毛毛绒球1年前4 -
 ellenawy 共回答了22个问题
ellenawy 共回答了22个问题 |采纳率90.9%物质溶于水中发生2个过程,一是水破坏原来物质的化学键(比如碳酸钠溶于水,原来碳酸钠之间的离子键被水破坏),这需要吸收能量.另一个过程是形成的离子与水结合形成水合离子,这个过程会释放出能量.
物质溶于水最终的热效应是这两个过程综合结果,如果前一个过程吸收的能量小于形成水合离子放出的能量,则溶解过程是放热过程,如碳酸钠、NaOH、硫酸等属于这种情况.反之则是吸热过程,比如硝酸铵的溶解就是吸热过程.当两个过程能量差不多,则表现为基本上即不吸热也不放热,比如NaCl的溶解等.1年前查看全部
- 氮气不能燃烧,不能支持燃烧,且不溶于水对吗
 flylong20081年前4
flylong20081年前4 -
 朱男 共回答了23个问题
朱男 共回答了23个问题 |采纳率87%Mg是可以在氮气中燃烧的1年前查看全部
- 下列物质中,属于烷烃特征的是? A完全燃烧产物只有二氧化碳和水B它们几乎不溶于水
下列物质中,属于烷烃特征的是? A完全燃烧产物只有二氧化碳和水B它们几乎不溶于水
C分子通式为CnH2n+2,与氯气发生取代反应D它们是非电解质 yeeming1年前2
yeeming1年前2 -
 树杈上的小巫婆 共回答了14个问题
树杈上的小巫婆 共回答了14个问题 |采纳率78.6%C分子通式为CnH2n+2,与氯气发生取代反应
ABD是有机物通有的性质1年前查看全部
- CuSO4溶于水时的水溶液为蓝色,那么CuSO4在常温下溶于水是不是不会与水发生反应?
 黄帝1年前1
黄帝1年前1 -
 笑霸天_心问佛 共回答了19个问题
笑霸天_心问佛 共回答了19个问题 |采纳率94.7%先CuSO4在水中全部电离,很少一部分与水发生水解反应,
化学方程式:CuSO4 + 2H2O(可逆) Cu(OH)2 + H2SO4
离子方程式:Cu2+ 2H2O(可逆) Cu(OH)2 +2H+
大部分CuSO4溶于水电离生成Cu2+离子和SO42-离子,所以溶液呈蓝色(即Cu2+颜色)..
只有加CuSO4固体过多,溶液成饱和溶液后,有蓝色晶体析出.
CuSO4+ 5H2O = CuSO4.5H2O1年前查看全部
- 沉淀溶水与溶酸的问题哪些沉淀不溶于水但是溶于酸?哪些既不溶于水也不溶于酸?
 朵拉A梦1年前1
朵拉A梦1年前1 -
 百代1985 共回答了23个问题
百代1985 共回答了23个问题 |采纳率82.6%硫酸钡 氯化银(较常见的)既不溶于水也不溶于酸
碳酸钙 碳酸钡等等很多的都是不溶于水但是溶于酸的啊,大多都是碳酸盐1年前查看全部
- 氨盐溶于水易分解的离子方程式
 邓钦1年前2
邓钦1年前2 -
 Nickili 共回答了16个问题
Nickili 共回答了16个问题 |采纳率81.3%直接拆开就行啊.如果你想到了铵根和水的反应,那这个反应是水解,不是电离
NH4R=NH4+ + R-(R为酸根)1年前查看全部
- 用分子角度解释为什么植物油不溶于水 而是浮在水的上层
 williamstan1年前2
williamstan1年前2 -
 八戒爱嫦娥JL 共回答了15个问题
八戒爱嫦娥JL 共回答了15个问题 |采纳率80%水是极性分子,油是非极性分子,根据相似相溶原理(极性相近的易互溶)水油不溶.植物油密度比水小,浮在水上1年前查看全部
大家在问
- 1一种物品的重量不超过16千克时,需付基础费30元和保险费a元:为限制过重物品的托运,一件物品超过
- 2中二英语语法1.the+序数词的用法规则,什么时候不加the?2.日,月,年和月,日,年的读法.如:2009年5月26号
- 3路由器上col是什么意思
- 4请使用春天 夏天 秋天和冬天四个词语 运用一定的修辞手发写一段表达人生感悟的文字
- 5As you worked late yesterday,you ___ have come this morning.
- 6操场上有一400米长的跑道(如图),已知操场的宽度为50米,跑道的宽度为1米,那么这个4×100接力赛起点的间隔应是__
- 7用什么词语形容心情好好
- 8作文分几大类
- 9运放同相端和反相端对地的直流电阻怎么计算
- 10名词做动词的直接宾语Frank sent an urgent telex from cairo this morning
- 11当水笔的笔尖朝上书写了一会儿后,笔尖无法写出字,这是为什么?
- 12含有辅基FAD或NAD的酶有哪些?胃蛋白酶的辅基是什么?
- 13对偶,要反义词路不拾遗()花似海()水滴石穿()五讲()
- 14favourite subject of conversation 这个句子中为什么subject后面用了of?favo
- 15盘子里有16个苹果,拿到走6个,使剩下苹果每行每列的数目都是偶数,问该如何取,有多少种取法?
