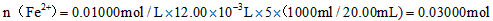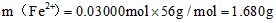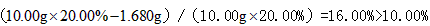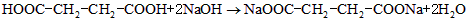(12分)“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
 mangder2022-10-04 11:39:541条回答
mangder2022-10-04 11:39:541条回答| (12分)“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验: (1)打开这种药片的密封膜,发现其外观为淡黄色。 (2)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色。学生甲由此断定“速力菲”的主要成分是三价铁盐。 (3)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口。结果发现:溶液仅显示淡红色。乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐。 (4)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:  试完成下列问题: (1)甲、乙两位同学的结论中比较正确的是________,另一同学的结论不合理的原因是 ________________________。 (2)丙的实验①说明维生素C具有较强的________性(填“氧化”或“还原”)。 (3)写出与②中现象对应的离子反应方程式________________________________。 (4)关于③中的实验现象,丙同学提出了两种假设:一种是过量的双氧水与Fe 3 + 结合生成了某种稳定的新物质;另一种则是过量的双氧水将SCN - 氧化了。请你设计一个实验方案以确认哪种假设更合理________________________________。 (5)针对实验目的,本次实验尚未完成的任务是__________________。 |

已提交,审核后显示!提交回复
共1条回复
 huanwen025 共回答了25个问题
huanwen025 共回答了25个问题 |采纳率96%- (1)乙 亚铁盐在空气中易被氧气氧化
(2)还原
(3)2Fe 2 + +H 2 O 2 +2H + ===2Fe 3 + +2H 2 O Fe 3 + +3SCN - ===Fe(SCN) 3
(4)再加过量KSCN,如果变血红色,则第二种合理;如果不变色,则第一种合理
(5)未能测其成分
Fe 2 + 易被氧化成Fe 3 + ,H 2 O 2 具有较强的氧化性,维生素C药片具有较强的还原性,Fe 3 + 遇SCN - 显血红色。 - 1年前
相关推荐
- (2010•合肥一模)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,
(2010•合肥一模)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物.该药品不溶于水但能溶于人体中的胃酸.某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1)试剂1是______.
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是______.
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确.写出有关的实验操作、预期现象和结论.(不一定填满,也可以补充)编号 猜想 甲 溶液中的+3价Fe又被还原为+2价Fe 乙 溶液中的SCN-被过量的氯水氧化 丙 新制的氯水具有漂白性,将该溶液漂白
编号 实验操作 预期现象和结论 ______ ______ ______  lishilong5181年前1
lishilong5181年前1 -
 zjisi 共回答了20个问题
zjisi 共回答了20个问题 |采纳率90%解题思路:(1)根据图示分析可知,加入试剂1用于溶解药品,应该选用加入非氧化性的酸;
(2)亚铁离子具有较强的还原性,部分亚铁离子能够被空气中氧气氧化成铁离子;
(3)若溶液中的SCN-被过量的氯水氧化,可以再向溶液中加入硫氰化钾溶液,根据反应现象进行判断.(1)试剂1用于溶解样品,可以选用稀盐酸或者稀硫酸,
故答案为:稀盐酸(或稀硫酸溶液);
(2)用于部分亚铁离子被空气中的氧气氧化成铁离子,所以加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,
故答案为:Fe2+被空气中氧气氧化成Fe3+;
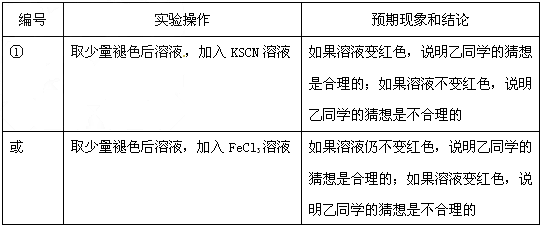
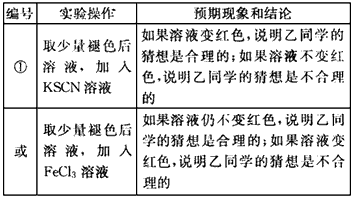
(3)乙的猜想为:溶液中的SCN-被过量的氯水氧化,若检验乙同学的猜想是否正确,可以取少量褪色后溶液,加入KSCN溶液,如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说胆乙同学的猜想是不合理的,
故答案为:
编号 实验操作 预期现象和结论
① 取少量褪色后溶液,加入KSCN溶液 如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说胆乙同学的猜想是不合理的
或 取少量褪色后溶液,加入FeCl3溶液 如果溶液仍不变红色,说明乙同学的猜想是合理的;如果溶液变红色,说明乙同学的猜想是不合理的点评:
本题考点: 二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查了铁离子与亚铁离子的检验,题目难度中等,注意明确检验铁离子和亚铁离子的方法,试题培养了学生灵活应用所学知识的能力.1年前查看全部
- (2005•西城区二模)速力菲是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C4H4O4Fe).某病人每天需服
(2005•西城区二模)速力菲是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C4H4O4Fe).某病人每天需服用0.6g琥珀酸亚铁,那么他每天从药物中摄取的铁元素的总量约为( )
A.0.290g
B.0.326g
C.0.195g
D.0.543g 支持gg1年前1
支持gg1年前1 -
 shixueertong 共回答了19个问题
shixueertong 共回答了19个问题 |采纳率89.5%解题思路:根据物质中某元素的质量分数=[该元素相对原子质量×原子个数/该物质的相对分子量]×100%,先求出琥珀酸亚铁中铁元素的质量分数,再求出0.6g速力菲中铁元素的总量即可.根据物质中某元素的质量分数=[该元素相对原子质量×原子个数/该物质的相对分子量]×100%,则
琥珀酸亚铁中铁元素的质量分数=[56/12×4+1×4+16×4+56]×100%=32.6%
0.6g速力菲中铁元素的总量为:0.6g×32.6%=0.195 g
故选C点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 本题考查学生对物质中某元素的质量分数的计算在解题中的应用.1年前查看全部
- 铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。
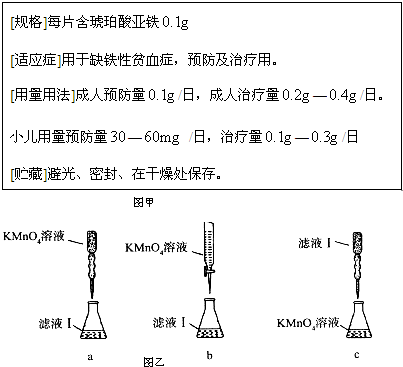
[规格]每片含琥珀酸亚铁 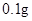
[适应症]用于缺铁性贫血症,预防及治疗用。
[用量用法]成人预防量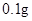 /日,成人治疗量
/日,成人治疗量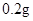 —
—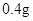 /日。
/日。
小儿用量预防量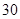 —
—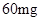 /日,治疗量
/日,治疗量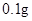 —
—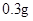 /日
/日
[贮藏]避光、密封、在干燥处保存。
(1)该药品中fe 2+ 会缓慢氧化。***规定该药物中fe 2+ 的氧化率(已经被氧化fe 2+ 的质量与fe 2+ 总质量的比值)超过10.00% 即不能再服用。
①实验室可采用h 2 so 4 酸化的kmno 4 溶液,对“速力菲”中的fe 2+ 进行滴定(假设药品中其他成份不与kmno 4 反应)。请写出该反应的离子方程式: 。
②实验前,首先要精确配制一定物质的量浓度的kmno 4 溶液250 ml,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
③某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)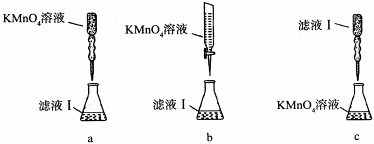
(2)称量上述含铁元素质量分数为20.00%的“速力菲”10.00 g,将其全部溶于稀h 2 so 4 中,配制成1000 ml溶液,取出20.00 ml,用0.01000 mol•l -1 的kmno 4 溶液滴定,用去kmno 4 溶液12.00 ml ,该药品中fe 2+ 的氧化率为 。
(3)已知琥珀酸为二元有机羧酸,含23.6 g琥珀酸的溶液与4.0 mol•l -1 100.0 ml的氢氧化钠溶液恰好完全中和。核磁共振氢谱分析显示,琥珀酸分子谱图上只有两组吸收峰。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式) 。 Ivier1年前1
Ivier1年前1 -
 卓栗栗 共回答了13个问题
卓栗栗 共回答了13个问题 |采纳率92.3%(1)①5Fe 2+ +MnO - 4 +8H + =5Fe 3+ +Mn 2+ +4H 2 O(2分) ②250ml容量瓶(2分)③b(2分)
(2)16.00% (3分)
(3)HOOC-CH 2 CH 2 -COOH+2NaOH→NaOOC-CH 2 CH 2 -COONa+2H 2 O (3分)
1年前查看全部
- 如图为速力菲补血剂的说明书.(1)蔗糖(C 12 H 22 O 11 )在酶的催化作用下与水作用只生成葡萄糖(C 6 H
如图为速力菲补血剂的说明书.
(1)蔗糖(C 12 H 22 O 11 )在酶的催化作用下与水作用只生成葡萄糖(C 6 H 12 O 6 ),则1分子蔗糖全与水作用可得______分子葡萄糖.若向速力菲的溶液中滴加碘水,将呈现______色.
(2)琥珀酸亚铁的相对分子质量为______,成人每日1片速力菲,每日的补铁量为______g.
(3)丁二酸钠(Na 2 C 4 H 4 O 4 )与硫酸亚铁发生复分解反应可制得琥珀酸亚铁,则反应方程式为______.
速力菲说明书
【正式品名】琥珀酸亚铁薄膜衣片
【化学式】琥珀酸亚铁FeC 4 H 4 O 4
【适应症】缺铁性贫血的预防和治疗
【成分】本品每片含琥珀酸亚铁0.1g
辅料为:蔗糖、淀粉、羟基甲纤维素等 蝎子的柔情1年前1
蝎子的柔情1年前1 -
 lylyqq 共回答了19个问题
lylyqq 共回答了19个问题 |采纳率78.9%(1)①蔗糖(C 12 H 22 O 11 )在酶的催化作用下与水作用只生成葡萄糖的化学方程式为:C 12 H 22 O 11 +H 2 O
酶
.
2C 6 H 12 O 6 ,由此可知,1分子蔗糖全与水作用可得2分子葡萄糖;
②葡萄糖溶液遇碘水呈蓝色;
(2)①由琥珀酸亚铁的化学式可知,其相对分子质量=56+12×4+1×4+16×4=172;
②琥珀酸亚铁中铁元素的质量分数为:
56
172 ×100%≈32.56%,0.1g×32.56%=0.033g;
(3)丁二酸钠(Na 2 C 4 H 4 O 4 )与硫酸亚铁发生复分解反应的化学方程式为:Na 2 C 4 H 4 O 4 +FeSO 4 ═FeC 4 H 4 O 4 +Na 2 SO 4 .
故答案为:(1)2,蓝;(2)172,0.033;(3)Na 2 C 4 H 4 O 4 +FeSO 4 ═FeC 4 H 4 O 4 +Na 2 SO 4 .1年前查看全部
- “速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(1)打开这种药片的密封膜,发现其外观为淡黄色;
(2)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色.学生甲由此断定“速力菲”的主要成分是三价铁盐;
(3)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口.结果发现:溶液仅显示淡红色.乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐.
(4)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验: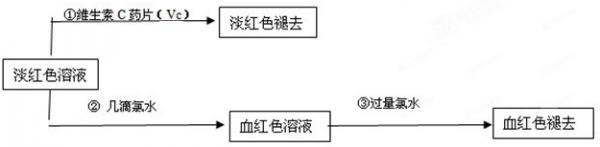
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是______,另一同学判断出错的原因是______.
(2)丙的实验①说明维生素C具有较强的______性(填“氧化”或“还原”).
(3)写出与丙的实验②中现象对应的离子反应方程式______;______
(4)关于丙的实验③中的现象,丙同学提出了两种假设:一种是过量的氯水与Fe 3+ 结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN - 氧化了.请你设计一个实验方案以确认哪种假设更合理______
(5)针对实验目的,本次实验尚未完成的任务是______. wolsey51年前1
wolsey51年前1 -
 夺命小书生 共回答了20个问题
夺命小书生 共回答了20个问题 |采纳率90%(1)由于亚铁离子容易被空气中的氧气氧化,乙同学动作敏捷,且在振荡前用橡皮塞塞紧试管口,而甲同学充分振荡后,慢慢加入稀硫酸,所以乙同学比较合理,故答案是:乙; 亚铁盐在空气中易被氧气氧化;(2)由于...1年前查看全部
- “速力菲”是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C 4 H 4 O 4 Fe).
“速力菲”是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C 4 H 4 O 4 Fe).
试计算:
(1)琥珀酸亚铁中碳、氢、氧三种元素原子个数比 ______.
(2)某病人每天需服用0.6g速力菲,那么他每天从药物中摄取的铁元素的总量约为 ______. 小雨飘渺1年前1
小雨飘渺1年前1 -
 崔小枭 共回答了18个问题
崔小枭 共回答了18个问题 |采纳率94.4%(1)根据化学式某元素右下角的数字为该元素原子个数,则琥珀酸亚铁中碳、氢、氧三种元素原子个数比为:
4:4:4=1:1:1;故答案为:1:1:1;
(2)根据物质中某元素的质量分数=
该元素相对原子质量×原子个数
该物质的相对分子量 ×100%,则
琥珀酸亚铁中铁元素的质量分数=
56
172 ×100%=32.6%
0.6g速力菲中铁元素的总量为:0.6×32.6%=0.195 g
故答案为:0.195 g.1年前查看全部
- 铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
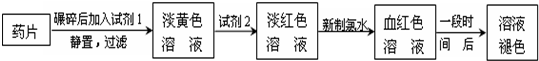
铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在,设计并进行了如下实验: 
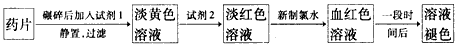
(1)试剂l是______________,试剂2是_______________,加入新制氯水后溶液中发生的离子反应方程式是_____________________________。
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为__________________________;写出+2价Fe在空气中转化为+3价Fe的离子方程式___________________________。
(3)该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?________________________________。若你认为合理,请说明理由(若你认为不合理,该空不要作答)________________________; 若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答): _______________________。 aminda1年前1
aminda1年前1 -
 发条猴子 共回答了21个问题
发条猴子 共回答了21个问题 |采纳率66.7%(1)稀盐酸;KSCN溶液;2Fe 2+ +Cl 2 =2Fe 3+ +2Cl -
(2)Fe 3+ +SCN - =[Fe(SCN)] 2 +4Fe 2+ +4H + +O 2 =4Fe 3+ +2H 2 O
(3)不合理;可能是SCN - 被过量的氯水氧化,在褪色后溶液中加入FeCl 3 溶液,仍不变红色(或在褪色后溶液中加入KSCN溶液,变红色)1年前查看全部
- 如图为速力菲补血剂的说明书.(1)琥珀酸亚铁的相对分子质量为______.(2)琥珀酸亚铁中铁元素的质量分数为_____
 如图为速力菲补血剂的说明书.
如图为速力菲补血剂的说明书.
(1)琥珀酸亚铁的相对分子质量为______.
(2)琥珀酸亚铁中铁元素的质量分数为______,成人每日1片速力菲,每日的补铁量为______g.
(3)一个琥珀酸亚铁分子中含有______原子. 2330167141年前0
2330167141年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在,设计并进行了如下实验 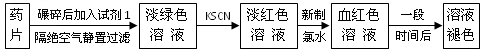
⑴试剂1是_____________。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是
________________________。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想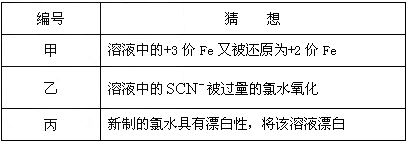
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充) 
⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H 2 O 2 溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为____________。 liuguzh1年前1
liuguzh1年前1 -
 llwwll11 共回答了16个问题
llwwll11 共回答了16个问题 |采纳率87.5%1年前查看全部
- 根据速力菲(补铁剂)使用说明书,本品若与Vc同服,可增加本品的吸收,为什么?
 长袖善舞19761年前1
长袖善舞19761年前1 -
 奶MJ 共回答了13个问题
奶MJ 共回答了13个问题 |采纳率84.6%Vc的化学名称是抗坏血酸
具有很强的还原性
所以当补铁剂与Vc一起用的时候
维生素C能够把补铁剂的三价铁还原成二价铁
人体最能吸收的就是二价铁1年前查看全部
- (2008•滨湖区一模)“速力菲”是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C4H4O4Fe).
(2008•滨湖区一模)“速力菲”是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C4H4O4Fe).
试计算:
(1)琥珀酸亚铁中碳、氢、氧三种元素原子个数比 ______.
(2)某病人每天需服用0.6g速力菲,那么他每天从药物中摄取的铁元素的总量约为 ______. 恼人的世界1年前1
恼人的世界1年前1 -
 4_llll 共回答了19个问题
4_llll 共回答了19个问题 |采纳率94.7%解题思路:(1)根据化学式某元素右下角的数字为该元素原子个数,即可求出琥珀酸亚铁中碳、氢、氧三种元素原子个数比;
(2)根据物质中某元素的质量分数=[该元素相对原子质量×原子个数/该物质的相对分子量]×100%,先求出琥珀酸亚铁中铁元素的质量分数,再求出0.6g速力菲中铁元素的总量即可.(1)根据化学式某元素右下角的数字为该元素原子个数,则琥珀酸亚铁中碳、氢、氧三种元素原子个数比为:
4:4:4=1:1:1;故答案为:1:1:1;
(2)根据物质中某元素的质量分数=[该元素相对原子质量×原子个数/该物质的相对分子量]×100%,则
琥珀酸亚铁中铁元素的质量分数=[56/172]×100%=32.6%
0.6g速力菲中铁元素的总量为:0.6×32.6%=0.195 g
故答案为:0.195 g.点评:
本题考点: 化合物中某元素的质量计算;分子和原子的区别和联系.
考点点评: 本题考查学生对物质中某元素的质量分数的计算在解题中的应用.1年前查看全部
- (11分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是
(11分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2 + 的存在,设计并进行了如下实验:

⑴试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , ;
⑵加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为 ,写出+2价Fe在空气中转化为+3价Fe的化学方程式 ;
⑶该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。 2848750131年前1
2848750131年前1 -
 骂偶的算你的 共回答了26个问题
骂偶的算你的 共回答了26个问题 |采纳率88.5%(11分)⑴稀盐酸 KSCN溶液 2Fe 2 + +Cl 2 =2Fe 3 + +2Cl - Fe 3 + +SCN - =[Fe(SCN)] 2 +  ...1年前查看全部
- 铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药品,如图甲是说明书的部分内容.
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药品,如图甲是说明书的部分内容.
(1)该药品中fe2+会缓慢氧化.***规定该药物中fe2+的氧化率(已经被氧化fe2+的质量与fe2+总质量的比值)超过10.00% 即不能再服用.
①实验室可采用h2so4酸化的kmno4溶液,对“速力菲”中的fe2+进行滴定(假设药品中其他成份不与kmno4反应).请写出该反应的离子方程式:______
②实验前,首先要精确配制一定物质的量浓度的kmno4溶液250ml,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需______.
③某同学设计了图乙所示滴定方式(夹持部分略去),最合理的是______.(填字母序号)
(2)称量上述含铁元素质量分数为20.00%的“速力菲”10.00g,将其全部溶于稀h2so4中,配制成1000ml溶液,取出20.00ml,用0.01000mol•l-1的kmno4溶液滴定,用去kmno4溶液12.00ml,该药品中fe2+的氧化率为______.
(3)已知琥珀酸为二元有机羧酸,含23.6g 琥珀酸的溶液与4.0mol•l-1 100.0ml的氢氧化钠溶液恰好完全中和.核磁共振氢谱分析显示,琥珀酸分子谱图上只有两组吸收峰.写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式)______. hsuchi1年前1
hsuchi1年前1 -
 loveccing 共回答了16个问题
loveccing 共回答了16个问题 |采纳率93.8%解题思路:(1)①先判断反应物、生成物,然后根据化合价升降总数相等和质量守恒来配平;
②根据配制的溶液体积选用容量瓶的规格;
③高锰酸钾溶液具有强氧化性,不能使用碱式滴定管盛放,应该选用酸式滴定管,滴定管中盛放的为高锰酸钾溶液,据此进行判断
(2)根据关系式:MnO4-~5Fe2+,利用KMnO4的物质的量来求出1000.00mL溶液含有的Fe2+的物质的量,然后求出Fe2+ 的氧化率;
(3)采用讨论法,当琥珀酸为一元酸时,根据与碱反应的关系,可得其相对分子质量为23.60.4=59,不符合有机物组成原则,当琥珀酸为二元酸时,其相对分子质量为23.60.2=118,符合题意,再根据琥珀酸分子中有两种位置不同的氢原子来解题.采用讨论法,当琥珀酸为一元酸时,根据与碱反应的关系,可得其相对分子质量为23.60.4=59,不符合有机物组成原则,当琥珀酸为二元酸时,其相对分子质量为23.60.2=118,符合题意,再根据琥珀酸分子中有两种位置不同的氢原子来解题.(1)①MnO4-中Mn的化合价由+7价降为+2价,变化5,Fe2+中Fe由+2价升为+3价,变化1价,根据化合价升降总数相等和质量守恒得:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
故答案为:5Fe2++MnO-4+8H+═5Fe3++Mn2++4H2O;
②配制250mL溶液,需要选用规格为250mL的容量瓶,
故答案为:250ml容量瓶;
③酸性高锰酸钾溶液具有强氧化性,应该用酸式滴定管盛放,所以a错误、b正确;
用高锰酸钾溶液滴定,滤液应该盛放在锥形瓶中,滴定管中应该盛放酸性高锰酸钾溶液,所以c错误;
故答案为:b;
(2)由MnO4-~5Fe2+,可得1000.00mL溶液含有的Fe2+的物质的量n(Fe2+)=0.01 mol/L×12.00×10-3L×5×[1000mL/20mL]=0.03 mol,
m(Fe2+)=0.03 mol×56 g/mol=1.68 g,
Fe2+的氧化率:[10g×20.00%−1.68g/10g×20.00%]×100%=16.00%,
故答案为:16.00%;
(3)当琥珀酸为一元酸时,根据与碱反应的关系,其相对分子质量为23.60.4=59,不符合有机物组成原则,当琥珀酸为二元酸时,其相对分子质量为23.60.2=118,又琥珀酸分子中有两种位置不同的氢原子,所以琥珀酸的结构等式为HOOC-CH2-CH2-COOH,琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式:HOOC-CH2-CH2-COOH+2NaOH→NaOOC-CH2-CH2-COONa+2H2O,
故答案为:HOOC-CH2-CH2-COOH+2NaOH→NaOOC-CH2-CH2-COONa+2H2O.点评:
本题考点: 探究铁离子和亚铁离子的转化.
考点点评: 本题考查了中和滴定、化学方程式书写、化学计算等知识,题目难度中等,主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增强了学生整合知识的能力.1年前查看全部
- 如图为速力菲补血剂的说明书.(1)若向速力菲的溶液中滴加碘水,将呈现______色. 琥珀酸亚铁中的铁元素属于
如图为速力菲补血剂的说明书.

(1)若向速力菲的溶液中滴加碘水,将呈现______色. 琥珀酸亚铁中的铁元素属于人体所需的______(“常量”或“微量”)元素.
(2)琥珀酸亚铁的相对分子质量为______.
(3)成年人每日的补铁量为______g(计算结果精确到0.01g). rising_f1年前1
rising_f1年前1 -
 喜熟软大 共回答了15个问题
喜熟软大 共回答了15个问题 |采纳率93.3%解题思路:(1)根据速力菲的标签可知溶液中含有淀粉,碘遇淀粉变蓝;铁元素属于人体所需的微量元素;进行解答;
(2)由琥珀酸亚铁的化学式可知,其相对分子质量═(铁的相对原子质量×铁原子个数)+(碳的相对原子质量×碳原子个数)+(氢的相对原子质量×氢原子个数)+(氧的相对原子质量×氧原子个数);
(3)先求出琥珀酸亚铁中铁元素的质量分数,即可计算一片琥珀酸亚铁中铁元素的质量; 再根据标签计算成年人每日的补铁量.(1)根据速力菲的标签可知溶液中含有淀粉,碘遇淀粉变蓝;铁元素属于人体所需的微量元素;
(2)由琥珀酸亚铁的化学式可知,其相对分子质量=56+12×4+1×4+16×4=172;
(3)琥珀酸亚铁中铁元素的质量分数为:[56/172]×100%≈32.56%,
成年人每日的补铁量为:0.1g×32.56%×2=0.07g;
故答案为:
(1)蓝; 微量;
(2)172;
(3)0.07.点评:
本题考点: 相对分子质量的概念及其计算;物质组成的综合计算;人体的元素组成与元素对人体健康的重要作用;鉴别淀粉、葡萄糖的方法与蛋白质的性质.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 如图是“速力菲”补血剂的说明书如下图所示,其有效成分为琥珀酸亚铁.
如图是“速力菲”补血剂的说明书如下图所示,其有效成分为琥珀酸亚铁.

(1)1个琥珀酸亚铁分子中一共有______个原子.
(2)琥珀酸亚铁中碳元素与氧元素的质量比为______.
(3)琥珀酸亚铁的相对分子质量为______.
(4)医生建议某患每天服用2片“速力菲”补血剂,请计算该患者每天从中摄入的铁元素质量. (计算结果精确到0.1%) shana24311年前1
shana24311年前1 -
 811107 共回答了17个问题
811107 共回答了17个问题 |采纳率100%解题思路:(1)根据物质的化学式来分析;(2)化合物中各元素质量比=各原子的相对原子质量×原子个数之比;(3)根据相对分子质量为构成分子的各原子的相对原子质量之和分析;(4)化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.(1)个琥珀酸亚铁分子中含有1个铁原子、4个碳原子、4个氢原子和4个氧原子,共13个原子;故填:13;(2)琥珀酸亚铁中C、O元素的质量比为(12×4):(16×4)=3:4;故填:3:4;(3)琥珀酸亚铁的相对分子质量为56...
点评:
本题考点: 标签上标示的物质成分及其含量;相对分子质量的概念及其计算;元素质量比的计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 如图为速力菲补血剂的说明书。 (1)若向速力菲的溶液中滴加碘水,将呈现______色。琥珀酸亚铁中的铁元素属于人体所需的
如图为速力菲补血剂的说明书。 
(1)若向速力菲的溶液中滴加碘水,将呈现______色。琥珀酸亚铁中的铁元素属于人体所需的_______(“常量”或“微量”)元素。
(2)琥珀酸亚铁的相对分子质量为______。
(3)成年人每日的补铁量为______g(计算结果精确到0.01g)。 scyang1年前1
scyang1年前1 -
 元皓 共回答了15个问题
元皓 共回答了15个问题 |采纳率93.3%(1)蓝;微量
(2)172
(3)0.071年前查看全部
- 铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,下表格是它的说明书.
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,下表格是它的说明书. 
(1)该药品中fe 2+ 会缓慢氧化,***规定该药物中fe 2+ 的氧化率超过10%即不能再服用.
1为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为 ( 填试剂的名称 )
②实验室采用h 2 so 4 酸化的kmno 4 溶液,对“速力菲”中的fe 2+ 进行滴定(假设药品中,其它成分不与kmno 4 反应).请配平下列离子方程式
mno 4 - + fe 2+ + h + ═ mn 2+ + fe 3+ + h 2 o
③称量上述含铁元素质量分数为20.00% 的“速力菲”10.00g,将其全部溶于稀硫酸中,配制成1000.00ml溶液,取出20.00ml,用0.01mol/l的kmno 4 溶液滴定,用去kmno 4 溶液12.00ml.该药品可以服用吗? (填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程) .
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸.含23.6g琥珀酸的溶液与4mol/l100ml的氢氧化钠溶液恰好完全中和.质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子.写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式(有机物须写结构简式) ,琥珀酸亚铁的化学式为 . dariy1年前1
dariy1年前1 -
 yongyuandmh 共回答了16个问题
yongyuandmh 共回答了16个问题 |采纳率87.5%/1年前查看全部
- 速力菲是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C 4 H 4 O 4 Fe).某病人每天需服用0.6g琥
速力菲是治疗缺铁性贫血的药物,其主要成分是琥珀酸亚铁(化学式为C 4 H 4 O 4 Fe).某病人每天需服用0.6g琥珀酸亚铁,那么他每天从药物中摄取的铁元素的总量约为( ) A.0.290g B.0.326g C.0.195g D.0.543g  小马过河-01年前1
小马过河-01年前1 -
 莲红 共回答了15个问题
莲红 共回答了15个问题 |采纳率80%根据物质中某元素的质量分数=
该元素相对原子质量×原子个数
该物质的相对分子量 ×100%,则
琥珀酸亚铁中铁元素的质量分数=
56
12×4+1×4+16×4+56 ×100%=32.6%
0.6g速力菲中铁元素的总量为:0.6g×32.6%=0.195 g
故选C1年前查看全部
- “速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(1)打开这种药片的密封膜,发现其外观为淡黄色;
(2)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色.学生甲由此断定“速力菲”的主要成分是三价铁盐;
(3)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口.结果发现:溶液仅显示淡红色.乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐.
(4)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验: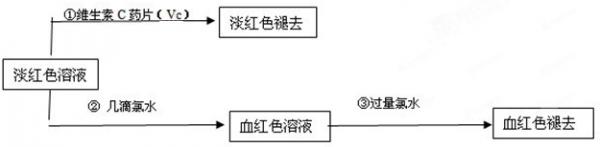
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是______,另一同学判断出错的原因是______.
(2)丙的实验①说明维生素C具有较强的______性(填“氧化”或“还原”).
(3)写出与丙的实验②中现象对应的离子反应方程式______;______
(4)关于丙的实验③中的现象,丙同学提出了两种假设:一种是过量的氯水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN-氧化了.请你设计一个实验方案以确认哪种假设更合理______
(5)针对实验目的,本次实验尚未完成的任务是______. qinchuan731年前1
qinchuan731年前1 -
 紫羅蘭22 共回答了15个问题
紫羅蘭22 共回答了15个问题 |采纳率80%解题思路:(1)根据亚铁离子的化学性质及甲、乙同学的操作是否严密进行分析;
(2)根据三价铁离子具有氧化性及淡黄色褪去判断维生素具有的性质;
(3)加入氯水,亚铁离子被氧化成了三价铁离子;硫氰化钾与铁离子生成硫氰化铁;
(4)可以向反应后的溶液中重新加入硫氰化钾溶液,根据现象判断两种假设的合理性;
(5)根据题中信息找出本次实验尚未完成的任务.(1)由于亚铁离子容易被空气中的氧气氧化,乙同学动作敏捷,且在振荡前用橡皮塞塞紧试管口,而甲同学充分振荡后,慢慢加入稀硫酸,所以乙同学比较合理,
故答案是:乙; 亚铁盐在空气中易被氧气氧化;
(2)由于三价铁离子具有氧化性,加入维生素后淡红色褪去,铁离子被维生素还原成了亚铁离子,
故答案是:还原;
(3)②中现象对应的反应方是氯气和亚铁离子的反应及硫氰化钾与铁离子反应生成血红色的硫氰化铁,反应的离子方程式是:2Fe2++Cl2=2 Fe3++2Cl-,Fe3++3SCN-═Fe(SCN)3,
故答案是:2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3;
(4)若是氯水将SCN-氧化了,可以重新加入硫氰化钾溶液,观察现象,如果变成血红色,第二种假设合理;如果不变色,说明第一种假设合理,
故答案是:再加过量KSCN溶液,如果变血红色,则第二种合理;如果不变色,则第一种合理;
(5)根据“某研究性学习小组为探究其主要成分,进行了如下实验”,本次实验尚未完成的任务是:未能测出“速力菲”成分,
故答案为:未能测其成分.点评:
本题考点: 探究物质的组成或测量物质的含量;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查了探究“速力菲”主要成分,充分考查了学生的分析、理解能力及对所学知识的掌握情况,本题难度中等.1年前查看全部
- 铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在, 设计并进行了如下实验: 
(1)试剂1是_____________。加入新制氯水后溶液中发生的离子反应方程式是__________, ____________。
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是____________。
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充) 
 zjl20501年前1
zjl20501年前1 -
 kuoaijia 共回答了15个问题
kuoaijia 共回答了15个问题 |采纳率73.3%1年前查看全部
- (10分) 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)
(10分) 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe 2+ 的存在,设计并进行了如下实验:

⑴试剂1是 。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)编号 猜想 甲 溶液中的+3价Fe又被还原为+2价Fe 乙 溶液中的  被过量的氯水氧化
被过量的氯水氧化丙 新制的氯水具有漂白性,将该溶液漂白 ⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:编号 实验操作 预期现象和结论
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H 2 O 2 溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为 。 popboy11年前1
popboy11年前1 -
 民大张伟 共回答了23个问题
民大张伟 共回答了23个问题 |采纳率87%1年前查看全部
- 铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。 (
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。 
(1)该药品中 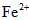 会缓慢氧化。***规定该药物中
会缓慢氧化。***规定该药物中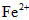 的氧化率超过即不能再服用。为了检验某药店出售的“速力菲”是否氧化,实验室应选用的检验试剂为_________(填试剂的名称)。
的氧化率超过即不能再服用。为了检验某药店出售的“速力菲”是否氧化,实验室应选用的检验试剂为_________(填试剂的名称)。
(2)实验室可采用酸化的溶液,对“速力菲”中的进行滴定(假设药品中其他成份不与反应)。
请配平下列离子方程式: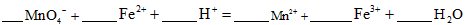
(3)称量上述含铁元素质量分数为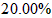 的“速力菲”
的“速力菲”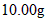 ,将其全部溶于稀
,将其全部溶于稀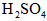 中,配制成
中,配制成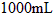 溶液,取出
溶液,取出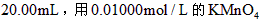 的溶液滴定,用去
的溶液滴定,用去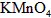 溶液
溶液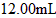 ,该药品可以服用吗?___________(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程):_____________________________
,该药品可以服用吗?___________(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程):_____________________________
(4)已知琥珀酸为二元有机酸,含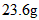 琥珀酸的溶液与
琥珀酸的溶液与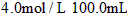 的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式) 。__________________________
的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式) 。__________________________ sfkaihua1年前1
sfkaihua1年前1 -
 文艺节目好 共回答了14个问题
文艺节目好 共回答了14个问题 |采纳率85.7%1年前查看全部
- (12分)补铁药物“速力菲”说明书部分内容摘录:
(12分)补铁药物“速力菲”说明书部分内容摘录:
【规格】每片含琥珀酸亚铁0.1g
【组成与性状】内含Fe2+34.0%~36.0%的无水碱式盐,为薄膜糖衣片
【适应症】用于缺铁性贫血症预防及治疗
【用量用法】成人预防量0.1g/日,治疗量0.2g~0.4g/日;小儿预防量30~60mg/日,治疗量0.1g~0.3g/日
【储藏】在避光、密封、阴凉处保存
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案: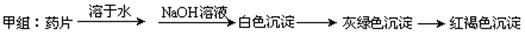 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因:________________________________________________ 。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:
(2)若试剂1为盐酸;则试剂2为________________________________。
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
[Fe(SCN)]2+络离子中的三价铁被还原为亚铁
②。
(3)请你对其中一种可能 进行实验验证:________________________________
进行实验验证:________________________________
实验方案(用文字述):________________________________________________ ,
根据预期现象判断结论:________________________________________________________ 。
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
计算:该补血药中含Fe2+的质量分数________________(保留小数点后二位小数)。序号 V(KMnO4)初 V(KMnO4)终 V(KMnO4) 1 2.24mL 14.25mL 12.01mL 2 0.30mL 12.72mL 12.42mL 3 0.50mL 12.53 12.03mL  jianer2971年前1
jianer2971年前1 -
 yyhxxc 共回答了20个问题
yyhxxc 共回答了20个问题 |采纳率90%(12分)(1)该药片在水中溶解度不大,少量溶解后的溶液中几乎不存在Fe2+离子,所以得不到预期的实验现象。(2分)
(2) KSCN溶液 (2分)
[Fe(SCN)]2+络离子中的SCN—被双氧水氧化(2分)
(3)在褪色后溶液加入FeCl3溶液溶液(2分)
现象:变红色结论:褪色原因是因为①;不变红色 结论:褪色原因是因为②
或在褪色后溶液加入加入KSCN溶液(2分)
现象:变红色结论:褪色原因是因为②;不变红色 结论:褪色原因是因为①
(4)16.83%(2分)
略1年前查看全部
- 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物.该药品不溶于水但能溶于人体多的胃酸.某同学为了检测“速力菲”药片多Fez+的存在,设计并进行了如下实验:

(1)试剂1是______,加入新制氯水后溶液多发生的离子反应方程式是:______,______;
(z)加入KSCN溶液后,在未加新制氯水的情况下,溶液多也产生了红色,其可能的原因是______;
(四)在实验多发现放置一段时间,溶液的颜色会逐渐褪去.为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确.写出有关的实验操作、预期现象和结论.(不一定填满,也可以补充)编号 猜 想 甲 溶液多的+四价Fe又被还原为+z价Fe 乙 溶液多的SCN-被过量的氯水氧化 丙 新制的氯水具有漂白性,将该溶液漂白 编号 实验操作 预期现象和结论 ①  外来人口请多关照1年前1
外来人口请多关照1年前1 -
 chris_tj 共回答了13个问题
chris_tj 共回答了13个问题 |采纳率92.3%解题思路:(1)根据图示分析可知,加入试剂1用于溶解药品,应该选用加入非氧化性的酸;氯气氧化亚铁离子生成铁离子,铁离子与硫氰根离子结合生成硫氰化铁;
(2)亚铁离子具有较强的还原性,部分亚铁离子能够被空气中氧气氧化成铁离子;
(3)若溶液中的SCN-被过量的氯水氧化,可以再向溶液中加入硫氰化钾溶液,根据反应现象进行判断.(1)试剂1用于溶解样品,可以选用稀盐酸或者稀硫酸;氯气氧化亚铁离子生成铁离子,离子方程式为:7Fe7++Cm7=7Fe多++7Cm-;
铁离子与硫氰根离子结合生成硫氰化铁,离子方程式为:Fe多++SCN-=[Fe(SCN)]7+ (或Fe多++多SCN-=Fe(SCN)多),
故答案为:稀盐酸(或稀硫酸溶液);7Fe7++Cm7=7Fe多++7Cm-;Fe多++SCN-=[Fe(SCN)]7+ (或Fe多++多SCN-=Fe(SCN)多);
(7)少量亚铁离子被空气中的氧气氧化成铁离子,所以加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,
故答案为:少量Fe7+被空气中氧气氧化成Fe多+.
(多)乙的猜想为:溶液中的SCN-被过量的氯水氧化,若检验乙同学的猜想是否正确,可以取少量褪色后溶液,加入KSCN溶液,如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说胆乙同学的猜想是不合理的,
故答案为:
编号实验操作预期现象和结论
①取少量褪色后溶液,加入KSCN溶液如果溶液变红色,说明乙同学的猜想是合理的;如果溶液不变红色,说胆乙同学的猜想是不合理的
或取少量褪色后溶液,加入FeCm多溶液如果溶液仍不变红色,说明乙同学的猜想是合理的;如果溶液变红色,说明乙同学的猜想是不合理的.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查铁离子与亚铁离子的检验,难度中等.注意明确检验铁离子和亚铁离子的方法,试题培养了学生灵活应用所学知识的能力.1年前查看全部
大家在问
- 1英语翻译Zdravo ponovo,Hvala Vam sto mi pomazete.Evo da odgovorim
- 2地球公转速度(2km/s)远大于声速(340m/s),声音没有惯性,可声音为什么不会被地球甩在后面?
- 3Fe的密度是7.86g/cm³ 则 1molFe的物质的体积是多少
- 4照例句写成语,并注明其属于括号中的哪种用途.(描写心里;表示言谈话语;说明道理)
- 5公路的两边每相隔7米有一棵槐树,芳芳乘电车3分钟看到公路的一边有槐树151棵,电车的速度是每分钟()米
- 6中华文化源远流长、博大精深,儒家文化是中华文化的重要组成部分。下列人物中儒家学派的创始人是 [ &
- 7I choose I like But what do I
- 8q=i方rt中的t的单位是秒还是小时?
- 9英语翻译我今天早上起床的时候、一直流鼻涕、我想我应该是感冒了.我想去看医生、但我等会儿还要上课、所以我吃了两粒药就去上学
- 10图表示食物中的有机物(甲、乙、丙)在消化道中各部位(依次用A、B、C、D、E表示)被消化的程度.
- 11取一小块钠放在燃烧匙里加热,下列实验现象正确的是①金属先熔化②在空气中燃烧火焰呈黄色③燃烧时火星四射④燃烧后生成淡黄色固
- 12已知抛物线y=ax²+bx+c(a≠0)经过点B(2,0)和点C(0,8),且它的对称轴是直线x=-2
- 13有趣的数学题编号为1、2、3……n的n张扑克牌按顺序叠在一起.现将牌最上面一张(编号为1)发出,将下一张(编号为2)放这
- 14线圈在均匀磁场中转动时 在哪些位置感应电动势最大,在哪些位置感应电动势为0
- 15直线L与直线2X-2Y+3=0垂直,并且与圆(X+3)平方+(Y-1)平方=2相切,求切线方程