二氧化硫和氧气反应吸热还是放热
 friday_zhou2022-10-04 11:39:542条回答
friday_zhou2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 雪天下雪 共回答了23个问题
雪天下雪 共回答了23个问题 |采纳率95.7%- 放热的.
吸热且气体分子数减少的反应是不会自发进行的,热力学可以证明.SO2+1/2O2=SO3,气体明显减少. - 1年前
 shirthing 共回答了9个问题
shirthing 共回答了9个问题 |采纳率- 就只有这个反应时放热的...
- 1年前
相关推荐
- 煤是重要的化工原料,用煤做燃料,不仅是极大的浪费,而且因煤中含有硫,燃烧后生成的二氧化硫会造成空气污染.某工厂用煤做燃料
煤是重要的化工原料,用煤做燃料,不仅是极大的浪费,而且因煤中含有硫,燃烧后生成的二氧化硫会造成空气污染.某工厂用煤做燃料,每天燃烧含硫2%的煤4800kg
该厂废气中二氧化硫的含量可根据下列反应测定:so2+2h2o=h2so4+2hi.现取该厂废气样品500ml,用含碘2x10-6次方即(0.0000002%)的碘溶液200g与废气中二氧化硫恰好完全反应,试计算该厂排放的废气是否符符合***规定的工业废气排放标准(废气中二氧化硫的含量不得超过0.15mg/m3)
用煤做燃料,你认为有什么方法可以减少so2对空气的污染?
不要到网上复制啊 这道题与网上的不同,)
会的帮我答一下
so2+2h2o+i2=h2so4+2hi
是这样的 lounge_lu1年前1
lounge_lu1年前1 -
 liuyu683 共回答了24个问题
liuyu683 共回答了24个问题 |采纳率91.7%SO2+2H2O+I2=H2SO4+2HI
64g 254g
x 2x10-6*200
x=1x10-4 g=0.1mg
含量=0.1mg/500ml(即0.5x10-3m3)=200mg/m3
超标
可以将尾气通过碱液后排放1年前查看全部
- 三氧化硫和二氧化硫两物质的质量比为3:2,则两物质中硫元素的质量比,氧原子的个数比
 zcq100011年前2
zcq100011年前2 -
 niudawan 共回答了21个问题
niudawan 共回答了21个问题 |采纳率90.5%两物质中硫元素的质量比=3/80:2/64=6:5,所以两物质的物质的量比为6:5,
所以氧原子的个数比=6*3:5*2=9:51年前查看全部
- 次氯酸钙和二氧化碳的反应 二氧化硫和氧化钙的反应 氯化铵和氢氧化钙的反应 一氧化
次氯酸钙和二氧化碳的反应 二氧化硫和氧化钙的反应 氯化铵和氢氧化钙的反应 一氧化
二氧化氮和氨气反应 硝酸钠和浓硫酸反应 碳酸钙和氢氧化钙反应 碳酸钠和二氧化硅反应 硅酸钠和盐酸反应 硅酸钠和二氧化碳反应 的化学方程式 如果有原因的话下解释一 rswto生活频道1年前1
rswto生活频道1年前1 -
 路人love 共回答了19个问题
路人love 共回答了19个问题 |采纳率78.9%次氯酸钙在有水条件下与二氧化碳反应,因为碳酸的酸性强于次氯酸:Ca(ClO)2+H2O+CO2=CaCO3+2HClO
氧化钙与二氧化硫,酸性氧化物和碱性氧化物反应产生盐CaO+SO2=CaSO3
氯化铵和氢氧化钙,铵盐与强碱反应产生氨气2NH4Cl+Ca(OH)2=CaCl2+2NH3+2H2O
氨气与二氧化氮发生归中反应产生氮气8NH3 + 6NO2 = 7N2 + 12H2O
硝酸钠和浓硫酸,加热反应,由高沸点酸制低沸点酸得到硝酸,但硝酸容易受热分解,因此得到的硝酸不会很纯净2NaNO3+H2SO4=2HNO3+Na2SO4
碳酸钙和氢氧化钙不会反应,碳酸钠与氢氧化钙反应产生氢氧化钠,因为有碳酸钙沉淀生成Na2CO3+Ca(OH)2=2NaOH+CaCO3
碳酸钠和二氧化硅在高温下反应产生硅酸钠,因为另一产物二氧化碳是挥发性的Na2CO3+SiO2=Na2SiO3+CO2
硅酸钠和盐酸,强酸制弱酸得到原硅酸沉淀Na2SiO3+2HCl+H2O=H4SiO4+2NaCl
硅酸钠和二氧化碳在溶液中反应,碳酸酸性强于硅酸,因此产生原硅酸沉淀Na2SiO3+2H2O+CO2=Na2CO3+H4SiO41年前查看全部
- 有人认为浓硫酸具有强氧化性,不能用来干燥二氧化硫气体,为什么?
 chent1631年前4
chent1631年前4 -
 dyuhai 共回答了12个问题
dyuhai 共回答了12个问题 |采纳率66.7%不对!
同种元素相邻价态间不能发生氧化还原反应.
浓硫酸中S为+6价,SO2中S为+4价,S的+6、+4间没有中间价,所以浓硫酸不能氧化SO2.1年前查看全部
- 二氧化硫通入硫化钡和硝酸的混合溶液,生成白色沉淀和无色气体一氧化氮的化学方程式?
二氧化硫通入硫化钡和硝酸的混合溶液,生成白色沉淀和无色气体一氧化氮的化学方程式?
有关反应的离子方程式. xuxin6061年前1
xuxin6061年前1 -
 情有獨中 共回答了21个问题
情有獨中 共回答了21个问题 |采纳率90.5%是氯化钡吧.
3SO2 + 3Ba2+ + 2NO3^- + 2H2O = 3BaSO4 + 2NO + 4H+1年前查看全部
- 除去二氧化硫中的三氧化硫求用浓硫酸 的化学方程式
 hjuikol1年前3
hjuikol1年前3 -
 向往边城 共回答了16个问题
向往边城 共回答了16个问题 |采纳率75%H2SO4+SO3=H2S2O7(发烟硫酸) 事实上 第一个方程式也是工业制硫酸的最后一步反应,防止三氧化硫遇水生成硫酸时大量的热引起事故,在吸收三氧化硫生成发烟硫酸后,浓度可以超过百分之百,用时再加入水中稀释1年前查看全部
- 近年来有人提出了利用海水(含氯化钠)处理含二氧化硫的废气,该方法的流程如下:
近年来有人提出了利用海水(含氯化钠)处理含二氧化硫的废气,该方法的流程如下: 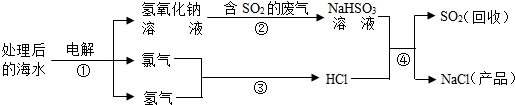
(1)上图中从海水最终得到“NaCl(产品)”的过程属于______(填“物理变化”或“化学变化”).
(2)图中反应①、③、④属于化合反应的是______ (填序号).
(3)①中的反应物是氯化钠和______,该反应的化学方程式为______.
(4)反应④的化学方程式为______. hermitwing1年前1
hermitwing1年前1 -
 阿飞甲 共回答了21个问题
阿飞甲 共回答了21个问题 |采纳率90.5%(1)从海水最终得到“NaCl(产品)”是反应生成的氯化钠,该变化属于化学变化.故答案为:化学变化.
(2)氯气和氢气反应生成氯化氢的反应属于化合反应.故答案为:③
(3)①中的反应物是氯化钠和水.故答案为:水.反应的化学方程式为:2NaCl+2H 2 O
通电
.
2NaOH+H 2 ↑+Cl 2 ↑
(4)反应④的化学方程式为:NaHSO 3 +HCl═NaCl+H 2 O+SO 2 ↑1年前查看全部
- 帮忙写下化学反应离子方程式1.氯化铁溶液中通入硫化氢气体.2.向次氯酸钙溶液中通入二氧化硫.3.硫酸铁的酸性溶液中通入足
帮忙写下化学反应离子方程式
1.氯化铁溶液中通入硫化氢气体.
2.向次氯酸钙溶液中通入二氧化硫.
3.硫酸铁的酸性溶液中通入足量硫化氢.
4.氯化铝溶液中加入过量氨水.
5.碳酸钠溶液中加入过量苯酚.
6.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液. wdy442791年前1
wdy442791年前1 -
 lina138 共回答了21个问题
lina138 共回答了21个问题 |采纳率66.7%晕,不会打小加号和小数字,怎么办
算了,应该看得明白吧.
2Fe3+ + H2S ==2H+ + S↓+ 2Fe
2ClO- + Ca2+ +2H2O+2SO2==2Cl- +CaSO4↓+4H+ + SO4 2-
Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4
Al3+ +3NH3.H2O=Al(OH)3↓+3NH4+
AlCl3+3NH4.H2O==3NH4Cl+Al(OH)3 ↓
Ca2+ +HCO3- +OH-==CaCO3↓+H2O
打到手累1年前查看全部
- (10分)下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物。填写下列空白。(已知二氧化硫能和
(10分)下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物。填写下列空白。(已知二氧化硫能和酸性高锰酸钾溶液发生氧化还原反应。)
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式 。
(2)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,不能检出的物质是____ _ 。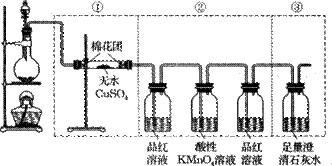
(3)如果将仪器的连接顺序变为①、③、②,则不能检出的物质是 _ _ _ 和 ,。
(4)如果将第②部分仪器中连接在酸性KMnO 4 溶液后的装有品红溶液的洗气瓶去掉,则对所作出的结论会有什么影响?
请说明具体原因 。 睛一one1年前1
睛一one1年前1 -
 dengzelong 共回答了14个问题
dengzelong 共回答了14个问题 |采纳率85.7%1年前查看全部
- 酸雨也称“空中死神”,主要是含硫的煤燃烧时,排放到空气中的二氧化硫随雨水落下而形成的,请回答:
酸雨也称“空中死神”,主要是含硫的煤燃烧时,排放到空气中的二氧化硫随雨水落下而形成的,请回答:
(1)写出硫燃烧时生成二氧化硫的化学方程式______;
(2)若用氢氧化钠溶液吸收二氧化硫,反应的化学方程式为______;
(3)近年来为防治酸雨,工业上常采用“钙基固硫法”,即将生石灰与含硫的煤混合后燃烧,使生石灰、硫、氧气在高温下共同反应生成硫酸钙,写出该反应的化学方程式:______. 项峰1年前1
项峰1年前1 -
 肾亏胆小心衰 共回答了13个问题
肾亏胆小心衰 共回答了13个问题 |采纳率100%(1)硫与氧气在点燃的条件下燃烧时生成二氧化硫的化学方程式为:S+O 2
点燃
.
SO 2 ;
(2)氢氧化钠与二氧化硫反应会生成亚硫酸钠和水,反应的化学方程式为:SO 2 +2NaOH═Na 2 SO 3 +H 2 O;
(3)从题干的叙述可知该反应的反应物为生石灰、硫、氧气条件是高温生成物是硫酸钙,该反应的化学方程式:2CaO+2S+3O 2
高温
.
2CaSO 4 ;
故答案为:(1)S+O 2
点燃
.
SO 2 ;(2)SO 2 +2NaOH═Na 2 SO 3 +H 2 O;(3)2CaO+2S+3O 2
高温
.
2CaSO 4 ;1年前查看全部
- 导致酸雨的主要原因是空气中含有大量的( ) A.由工业燃烧排放的二氧化碳 B.由工业燃烧排放的二氧化硫 C.由人类活动
导致酸雨的主要原因是空气中含有大量的( ) A.由工业燃烧排放的二氧化碳 B.由工业燃烧排放的二氧化硫 C.由人类活动引起的臭氧增加 D.由人类活动排放的含氮物质  l7non1年前1
l7non1年前1 -
 fdsdsaff 共回答了25个问题
fdsdsaff 共回答了25个问题 |采纳率88%酸雨是由于人类大量使用含硫量高的煤、石油、天然气等燃料,燃烧后产生的含有二氧化硫等的气体,在大气中经过复杂的化学反应后,形成硫酸或亚硫酸气溶胶,或为云、雨、雪、雾捕捉吸收,降到地面成为酸雨.
故选:B1年前查看全部
- (1)常温下向20l真空容器中通入amol硫化氢和bmol二氧化硫(a,b都是正整数,且a
 潮汐乘风1年前2
潮汐乘风1年前2 -
 朴原1 共回答了22个问题
朴原1 共回答了22个问题 |采纳率90.9%(1)容器中发生的反应为:2H2S+SO2=3S↓+2H2O,
欲使容器内气的密度(ρ=m÷V,容器的体积一定)最大,则要让容器中的气体质量最大(质量与物质的量成正比,即物质的量最大).
两种气体反应,最后剩余的气体为过量的气体,所以只要让剩余的气体的质量(物质的量)最大,容器内气体的密度最大.要让剩余气体的物质的量最大,则让硫化氢气体和二氧化硫气体的物质的量差值最大即可;
所以欲使容器中气体密度最大,则b取最大值5,a取最大值1即可;
此时硫化氢完全反应,剩余的SO2的物质的量为5-0.5=4.5mol(通过方程式计算可知);
所以容器中气体的质量为m=n×M=4.5mol×64g/mol=288g;
所以此时容器中的气体的密度为:ρ=m÷V=288g÷20L=14.4g/L;
综上所述,容器内气体可能达到的最大密度约是14.4g/mol.
(楼上错误的原因是a取了0,0不是正整数)
(2)根据气体状态方程PV=nRT可知:同问同体积时,压强和物质的量成正比,即P1/P2=n1/n2;所以反应前后容器中气体的总物质的量之比为P1/P2=2:1;
根据反应方程式可知若恰好完全反应则无气体剩余,所以剩余的气体为过量的气体;
设反应前H2S的物质的量为x,SO2的物质的量为y.
①若H2S过量;则有:
(x-2y)/(x+y)=1/2,所以x:y=5:1;
②若SO2过量,则有:
(y-0.5x)/(x+y)=1/2,所以x:y=1:2;
综上所述:反应前H2S和SO2的体积比是5:1或1:2.1年前查看全部
- 二氧化硫与硫酸钡溶液反应生成啥
 sunman9101年前3
sunman9101年前3 -
 newer999 共回答了14个问题
newer999 共回答了14个问题 |采纳率100%硫酸钡是固体沉淀,不是溶液1年前查看全部
- 二氧化硫与氢氧化钠的化学反应方程式是什么?
 fieldfieldfield1年前1
fieldfieldfield1年前1 -
 zzl214 共回答了29个问题
zzl214 共回答了29个问题 |采纳率93.1%SO2+2NaOH=NaSO3+H2O1年前查看全部
- 二氧化硫通入酸化硝酸钡有现象么
 不做老大很久了1年前6
不做老大很久了1年前6 -
 venleno 共回答了31个问题
venleno 共回答了31个问题 |采纳率87.1%现象是:生成白色沉淀.
因为酸性的Ba(NO3)2溶液相当于汉语HNO3,HNO3能将SO2氧化为SO4^2-,SO4^2-与Ba2+反应生成难溶于HNO3的BaSO4白色沉淀.1年前查看全部
- 证明一氧化氮还原性强于二氧化硫还原性的方程式是什么
 qz55951年前4
qz55951年前4 -
 sophialam 共回答了14个问题
sophialam 共回答了14个问题 |采纳率92.9%一氧化氮与氧气 常温直接反应
二氧化硫与氧气 加热可逆反应1年前查看全部
- 下列叙述正确的是()A绿化难溶液在电流作用下电离成钠离子和氯离子所以能导电B二氧化硫的水溶液能导电,所以二氧化硫式电解质
下列叙述正确的是()
A绿化难溶液在电流作用下电离成钠离子和氯离子所以能导电
B二氧化硫的水溶液能导电,所以二氧化硫式电解质
C硫酸钡难容于水,但硫酸钡属于强电解质‘
D固体氯化钠不到点,所以氯化钠是非电解质
下列各组物质的分类正确的是()
A纯净物 :蒸馏水 盐酸 只含氧元素的固体
B非电解质 :CL2 NH3 C2H5OH
C胶体分散系:淀粉溶液 Fe(OH)3胶体 泥沙水
D酸性氧化物:CO2 SO2 SO3
在某些无色同名的酸性溶液中,能共存的例子是()
A Na+ K+ So42- CO32- B Cu2+ K+ So42- No3-
C Na+ K+ Cl- No3- D Ba2+ K+ So42- Cl-
能用H++OH-==H20表示的是()
A氢氧化钡和稀硫酸 B氢氧化铜和稀硝酸
C醋酸和氢氧化钾 D氢氧化钠和硫酸 sqsq5204431年前1
sqsq5204431年前1 -
 液体蜘蛛 共回答了18个问题
液体蜘蛛 共回答了18个问题 |采纳率94.4%1.C
A选项中,氯化钠并非在电流作用下电离,而是在水中解离,形成水和钠离子与水和氯离子;B中二氧化硫溶于水形成亚硫酸,亚硫酸是电解质;C中硫酸钡不溶于水,但也有一小部分溶于水,且完全电离,故是强电解质;固体氯化钠熔融可以导电,是电解质.
2.D
A选项中盐酸和只含氧元素的固体不是纯净物;氯气是纯净物,不符合非电解质是化合物的条件;泥沙水是悬浊液;D中非金属氧化物都是酸性氧化物.
3.C
碳酸根离子和氢离子会生成气体,不能共存;铜离子在水中呈蓝色,不符合;D中钡离子和硫酸根例子生成不溶于水的固体,不符合.
4.D
A中氢氧化钡和硫酸不仅生成水,还生成硫酸钡,不可省去;B中氢氧化铜不可分;醋酸是弱酸,不完全电离,不可分;D中离子前面的计量数可以略去,符合.1年前查看全部
- 下列叙述正确的是( )A.将二氧化硫气体通入浅黄色的溴水中使其颜色褪去,说明二氧化硫具有漂白性B.SiO2为酸性氧化物
下列叙述正确的是( )
A.将二氧化硫气体通入浅黄色的溴水中使其颜色褪去,说明二氧化硫具有漂白性
B.SiO2为酸性氧化物,故不能与任何酸发生化学反应
C.用砂纸打磨过的铝箔放在酒精灯焰上不燃烧,说明铝不易与O2反应
D.FeCl2、SO2、NO、Fe(OH)3四种物质都可以直接通过化合反应制取 深圳孤独男孩1年前1
深圳孤独男孩1年前1 -
 回首一片风雨飘摇 共回答了21个问题
回首一片风雨飘摇 共回答了21个问题 |采纳率85.7%解题思路:A、二氧化硫和溴单质发生氧化还原反应,二氧化硫的漂白作用具有选择性;
B、二氧化硅和氢氟酸反应;
C、依据金属的活泼性分析判断,铝易于氧气发生反应;
D、依据在性质和特征反应分析判断.A、二氧化硫和溴单质发生氧化还原反应,二氧化硫的漂白作用具有选择性;将二氧化硫气体通入浅黄色的溴水中使其颜色褪去,说明二氧化硫具有还原性,故A错误;B、SiO2为酸性氧化物,和氢氟酸酸发生化学反应,SiO2+4HF=...
点评:
本题考点: 二氧化硫的化学性质;硅和二氧化硅;铝的化学性质.
考点点评: 本题是一道有关物质性质的综合题,考查角度广,难度不大,要求学生熟悉教材知识,学以致用.1年前查看全部
- 二氧化硫可以漂白品红溶液是有强氧化性但它应该是有弱氧化性啊
 一面湖水8881年前2
一面湖水8881年前2 -
 风飞飘 共回答了15个问题
风飞飘 共回答了15个问题 |采纳率100%SO2的漂白性,不是因为它有氧化性,而是能与“某些”有色物质化合,生成“不稳定”的无色物质,所以褪色.
也因为无色物质不稳定,加热或者时间长了还会分解,恢复原来的颜色.1年前查看全部
- 有色金属冶炼行业 硫化锌精矿焙烧后,二氧化硫烟气制硫酸,请问从投矿量算产酸量的公式 理论值
有色金属冶炼行业 硫化锌精矿焙烧后,二氧化硫烟气制硫酸,请问从投矿量算产酸量的公式 理论值
矿S含量32% 水分9% 转化率99.6% 吸收率99.5% 酸浓93% evening_mist1年前1
evening_mist1年前1 -
 tense 共回答了20个问题
tense 共回答了20个问题 |采纳率90%工业硫酸的计算一般以干基计算.你的矿含硫32%,可能指干基含硫.吸收率99.5%不能达标排放,一般吸收率很容易达到99.95%.计算产量,一般按标酸(浓度100%,不是含量100%)计算.还需要焙烧的烧出率,净化的收得率的值.一般硫的总收得率在95%~96%之间.硫的总收得率取96%,一吨含硫32%(干基)矿可生产940kg标酸.1年前查看全部
- 含硫煤燃烧排放到空气中的有毒气体主要是二氧化硫,它遇雨形成酸雨降落到地面会带来很大的危害
含硫煤燃烧排放到空气中的有毒气体主要是二氧化硫,它遇雨形成酸雨降落到地面会带来很大的危害
(1)请举出两个方面有危害的实例(2)为减少环境污染,对工厂排放的废气可用烧碱溶液吸收处理,其反应化学方程式为 AtlanticBlue1年前1
AtlanticBlue1年前1 -
 xhn001 共回答了20个问题
xhn001 共回答了20个问题 |采纳率75%1.酸雨降下来腐蚀大理石雕塑
酸雨腐蚀树木
2.2NaOH+SO2=Na2SO3+H2O
如果SO2再多一点
Na2SO3+SO2+H2O=2NaHSO31年前查看全部
- 急求化学方程式1.照相底片成像原理2.二氧化硫和(少量、过量)碱石灰反应3.磷酸二氢根离子和磷酸根离子4.氯化铝与(少量
急求化学方程式
1.照相底片成像原理
2.二氧化硫和(少量、过量)碱石灰反应
3.磷酸二氢根离子和磷酸根离子
4.氯化铝与(少量、过量)氢氧化钠(请把分步的反应写清楚)
5.偏铝酸钠与(少量、过量)盐酸(要求同上)
6.硫酸亚铁与氨水
谢谢!~~ sunnyxiaoyezi1年前5
sunnyxiaoyezi1年前5 -
 lidonghai123 共回答了17个问题
lidonghai123 共回答了17个问题 |采纳率82.4%1.照相底片成像原理:2AgBr = 2Ag + Br2(可逆)
2.二氧化硫和少量碱石灰反应:2SO2 + Ca(OH)2 = Ca(HSO3)2
二氧化硫和过量碱石灰反应:SO2 + Ca(OH)2 = CaSO3 + H2O
3.磷酸二氢根离子和磷酸根离子:H2PO4- + PO43- = 2HPO42-
4.氯化铝与少量氢氧化钠反应:AlCl3 + 3NaOH = Al(OH)3↓+ 3NaCl
氯化铝与过量氢氧化钠反应:(1)AlCl3 + 3NaOH = Al(OH)3↓+ 3NaCl
(2) Al(OH)3 + NaOH = NaAlO2 + 2H2O
5.偏铝酸钠与少量盐酸反应:NaAlO2 + HCl + H2O = NaCl + Al(OH)3↓
偏铝酸钠与过量盐酸反应:(1)NaAlO2 + HCl + H2O = NaCl + Al(OH)3↓
(2)Al(OH)3 + 3HCl = AlCl3 + 3H2O
6.硫酸亚铁与氨水反应:(1)FeSO4 + 2NH3.H2O = Fe(OH)2↓+ (NH4)2SO4
Fe(OH)2在空气中继续被氧化(2)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)31年前查看全部
- 下列过程不会造成空气污染的是( ) A.石油化工厂排放出的废气 B.氢气燃烧生成水 C.煤燃烧生成二氧化碳、二氧化硫等
下列过程不会造成空气污染的是( ) A.石油化工厂排放出的废气 B.氢气燃烧生成水 C.煤燃烧生成二氧化碳、二氧化硫等 D.汽车排出的尾气  CHEN888HONG1年前1
CHEN888HONG1年前1 -
 markto 共回答了11个问题
markto 共回答了11个问题 |采纳率90.9%A、石油化工厂排放出的废气中含有二氧化硫、二氧化氮、一氧化碳等空气污染物,会造成空气污染,故A不符合题意;
B、氢气燃烧生成水,水不会造成空气污染,故B符合题意;
C、煤燃烧产生的烟雾中含有二氧化硫、二氧化氮、一氧化碳等空气污染物,会造成空气污染,故C不符合题意;
D、汽车排放的废气是城市空气污染的主要途径,会产生大量的CO、氮氧化合物、碳氢化合物,严重时会造成光化学烟雾;会造成空气污染,故D不符合题意.
故选:B.1年前查看全部
- 二氧化硫和硫化氢反应生成琉和水的反应条件?
二氧化硫和硫化氢反应生成琉和水的反应条件?
他们是常温下在空气中就可以反应吗?还是在什么条件下? 876428291年前1
876428291年前1 -
 ljj5399 共回答了13个问题
ljj5399 共回答了13个问题 |采纳率76.9%相遇即反应1年前查看全部
- 用氢氧化钙吸收二氧化硫后的副产品硫酸钙有什么用
 兰色维他命1年前4
兰色维他命1年前4 -
 野豌豆和小虫 共回答了18个问题
野豌豆和小虫 共回答了18个问题 |采纳率88.9%可制作各种模型,医疗上用作石膏绷带.此外,还可用于调节水泥的凝结时间,作油漆用的白色颜料、纸张的填料和抛光粉,也是一种常用的干燥剂.也用于冶金和农业等方面. 也有用作面包改良剂.1年前查看全部
- 一定物质的量的二氧化硫与氢氧化钠反应,所得溶液中含亚硫酸钠和亚硫酸氢钠,若两者物质的量之比为3:5,则参加反应的二氧化硫
一定物质的量的二氧化硫与氢氧化钠反应,所得溶液中含亚硫酸钠和亚硫酸氢钠,若两者物质的量之比为3:5,则参加反应的二氧化硫和氢氧化钠的物质的量之比为?
 helloyifeng1年前1
helloyifeng1年前1 -
 郑小妮 共回答了22个问题
郑小妮 共回答了22个问题 |采纳率95.5%设Na2SO3为3xmol,NaHSO3为5x,则根据Na元素守恒:n(NaOH)= 2*3x+5x=11x 根据S元素守恒:n(SO2)=3x+5x=8x,(SO2):n(NaOH)=8:111年前查看全部
- (2012•武汉模拟)二氧化硫是一种无色、有刺激性气味的有毒气体,易溶于水,密度比空气大.实验室常用亚硫酸钠(Na2SO
(2012•武汉模拟)二氧化硫是一种无色、有刺激性气味的有毒气体,易溶于水,密度比空气大.实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸在常温下反应制取二氧化硫.现有如下装置:若在实验室中用上述装置制备并收集一瓶二氧化硫气体,且符合“绿色化学”理念,所选装置的连接顺序(按气体从左到右的方向)是( )

A.①接③
B.①接⑥,⑦接⑤
C.②接⑨,⑧接⑥
D.②接④ maria1969091年前1
maria1969091年前1 -
 静思俊 共回答了15个问题
静思俊 共回答了15个问题 |采纳率80%解题思路:制取装置包括加热和不需加热两种,实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸在常温下反应制取二氧化硫,因此不需要加热;二氧化硫能溶于水,密度比空气的密度大,因此只能用向上排空气法;为了环保,用最后一个装置,二氧化硫的密度比空气的密度大,因此应该从长管进入.二氧化硫污染空气,因此可以用氢氧化钠溶液吸收.A、实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸在常温下反应制取二氧化硫,因此不需要加热;故选项错误;
B、不需要加热,不能用排水法收集,故选项错误;
C、不需要加热,为了环保,用最后一个装置,二氧化硫的密度比空气的密度大,因此应该从长管进入;二氧化硫污染空气,因此可以用氢氧化钠溶液吸收.故选项正确;
D、如果用向上排空气法收集,容易造成污染,故选项错误;
故选C点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常见气体的检验与除杂方法;绿色化学.
考点点评: 本考点主要考查气体的制取装置和收集装置的选择,同时也考查了气体的收集和吸收.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- 强酸和弱酸的问题Br2+SO2+2H2O=2HBr+H2SO4 二氧化硫和水是亚硫酸,但是这里亚硫酸制成了硫酸,怎么变成
强酸和弱酸的问题
Br2+SO2+2H2O=2HBr+H2SO4
二氧化硫和水是亚硫酸,但是这里亚硫酸制成了硫酸,怎么变成了弱酸制强酸? 伪装的潇洒1年前6
伪装的潇洒1年前6 -
 juanjuanlove 共回答了20个问题
juanjuanlove 共回答了20个问题 |采纳率90%这里发生的是氧化还原反应和强酸弱酸没有关系!Br2的氧化性比较强而SO2的还原性比较强,因此反映一般情况下能发生!1年前查看全部
- 用化学用语表示:(1)磷元素______;(2)锰元素______;(3)2个二氧化硫分子______;(4)5个氮分子
用化学用语表示:
(1)磷元素______;
(2)锰元素______;
(3)2个二氧化硫分子______;
(4)5个氮分子______;
(5)水分子______;
(6)干冰的化学式______;
(7)空气中供人呼吸的气体______;
(8)过氧化氢的化学式______;
(9)2个氮原子______;
(10)2个铁原子______;
(11)3个氢氧根离子______;
(12)3个钙离子______;
(13)镁离子______;
(14)铁离子______;
(15)氢氧化铝中铝显+3价
(OH)3+3 Al .
(OH)3+3 Al  gutano1年前1
gutano1年前1 -
 zsrld 共回答了13个问题
zsrld 共回答了13个问题 |采纳率92.3%解题思路:本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.(1)元素符号只有一个字母的要大写,有两个字母的第一个大写,第二个小写,磷元素符号为 P;
(2)锰元素符号为 Mn;
(3)分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,因此2个二氧化硫分子表示为 2SO2;
(4)5个氮分子表示为 5N2;
(5)水分子符号为 H2O;
(6)干冰为固态二氧化碳,化学式为 CO2;
(7)空气中供人呼吸的气体是氧气,化学式为 O2;
(8)过氧化氢的化学式 H2O2;
(9)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个氮原子,就可表示为 2N;
(10)2个铁原子表示为 2Fe;
(11)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.表示多个离子在离子符号前面加数字,故3个氢氧根离子符号为:3OH-;
(12)3个钙离子符号为 3Ca2+;
(13)镁离子符号为 Mg2+;
(14)铁离子符号为 Fe3+;
(15)元素的化合价的正确标法是在元素符号或原子团符号的正上方标明化合价的种类和价目,氢氧化铝中铝元素的化合价为+3价,符号为
+3
Al(OH)3
故答案为:
(1)P;(2)Mn;(3)2SO2;(4)5N2;(5)H2O;(6)CO2;
(7)O2;(8)H2O2;(9)2N;(10)2Fe;(11)3OH-;(12)3Ca2+;
(13)Mg2+; (14)Fe3+;(15)
+3
Al(OH)3点评:
本题考点: 化学符号及其周围数字的意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.1年前查看全部
- 分子数相同的二氧化硫和三氧化硫含氧元素的质量比是多少?
 yangmin8881年前1
yangmin8881年前1 -
 yin_666 共回答了24个问题
yin_666 共回答了24个问题 |采纳率87.5%解题思路:1个二氧化硫分子中含有1个氧原子,1个三氧化硫分子中含有3个氧原子,分子数相同的二氧化硫和三氧化硫中所含的氧原子个数比为2:3,据此进行分析判断.1个二氧化硫分子中含有1个氧原子,1个三氧化硫分子中含有3个氧原子,分子数相同的二氧化硫和三氧化硫中所含的氧原子个数比为2:3,则分子数相同的二氧化硫和三氧化硫含氧元素的质量比是2:3.
答:分子数相同的二氧化硫和三氧化硫含氧元素的质量比是2:3.点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 本题难度不大,掌握化学式的有关计算并能灵活运用是正确解答本题的关键.1年前查看全部
- “节能减排、低碳出行”是我们倡导的生活方式.这里所谓的“减排”不涉及下列哪种气体的排放( ) A.二氧化硫 B.一氧化
“节能减排、低碳出行”是我们倡导的生活方式.这里所谓的“减排”不涉及下列哪种气体的排放( ) A.二氧化硫 B.一氧化碳 C.水蒸气 D.二氧化碳  阿明11年前1
阿明11年前1 -
 看轻风吹过 共回答了12个问题
看轻风吹过 共回答了12个问题 |采纳率100%A、二氧化硫能造成酸雨,会污染空气,应减少气体的排放,故A正确;
B、一氧化碳有毒,会污染空气,应减少气体的排放,故B正确;
C、水蒸气无污染,所以与减排无关,故C错误;
D、二氧化碳气体的增加造成全球变暖,造成温室效应,所以应减少气体的排放,故D正确.
故选:C.1年前查看全部
- 下列有关说法,错误的是( ) A.氮氧化物、二氧化硫都是形成酸雨的主要物质 B.工业合成氨及用NH 3 制化肥(NH
下列有关说法,错误的是()
A.氮氧化物、二氧化硫都是形成酸雨的主要物质 B.工业合成氨及用NH 3 制化肥(NH 4 ) 2 SO 4 都属于氮的固定 C.一定条件下,镁能与一些非金属氧化物反应,铝能与一些金属氧化物反应 D.玻璃中含有硅酸钠和二氧化硅  阳光喜悦1年前1
阳光喜悦1年前1 -
 iudanshaner 共回答了21个问题
iudanshaner 共回答了21个问题 |采纳率100%B
氮的单质生成氮的化合物的反应,才是氮的固定,用NH 3 制化肥(NH 4 ) 2 SO 4 不属于氮的固定。1年前查看全部
- 下列漂白原理相同的是A氯水A氯水B二氧化硫C过氧化钠D活性炭为什么?
 jiangxiqusi1年前1
jiangxiqusi1年前1 -
 94ai 共回答了14个问题
94ai 共回答了14个问题 |采纳率85.7%氯水和过氧化钠都是通过氧化还原反应达到漂白作用 ,而二氧化硫则是和有机物质生成不稳定物质,但并没有发生氧化还原反应,活性炭则是简单的通过结构上的物理吸附达到的,所以A和C相同1年前查看全部
- 为了减少酸雨的形成,必须减少二氧化硫的排放量,对废气中的氮的氧化物用什么吸收
 喜欢绿豆沙1年前2
喜欢绿豆沙1年前2 -
 lion13815 共回答了20个问题
lion13815 共回答了20个问题 |采纳率90%氮氧化物用氢氧化钠吸收1年前查看全部
- 有关二氧化硫氧化性的问题.二氧化硫可以氧化醇吗?产物是什么?
 想做螃蟹1年前1
想做螃蟹1年前1 -
 zise32 共回答了28个问题
zise32 共回答了28个问题 |采纳率89.3%二氧化硫既有氧化性又有还原性,但以还原性为主,二氧化硫不能氧化醇1年前查看全部
- 67毫克每立方米的二氧化硫处于什么污染水平及其危害性
 搜狐倒了1年前1
搜狐倒了1年前1 -
 请为晨晨好 共回答了18个问题
请为晨晨好 共回答了18个问题 |采纳率94.4%答:二氧化硫的含量:67mg/m3(毫克每立方米),大大超过GB18883-2002 的标准值0.15 mg/m3,属于严重污染水平.1年前查看全部
- 判断氧化剂与还原剂?氯化铁中有+3价的铁元素,所以氯化铁是氧化剂.那为什么二氧化硫中有+4价的硫元素却即可以做氧化剂又可
判断氧化剂与还原剂?
氯化铁中有+3价的铁元素,所以氯化铁是氧化剂.那为什么二氧化硫中有+4价的硫元素却即可以做氧化剂又可以做还原剂? onlyhanyan1年前5
onlyhanyan1年前5 -
 雪rr嫩 共回答了14个问题
雪rr嫩 共回答了14个问题 |采纳率85.7%氧化剂和还原剂的判断一般是在具体的化学反应中来说的,在化学反应中,只要有升价此物质即为还原剂,有降价即为氧化剂.(如H2+O2).
如果单从物质判断,那么就要判断此元素是否还可以升价(还原性)或降价(氧化性)
如Cl元素,最高价为+7 ,最低位-1价,当Cl处于+1,+3,+5价时(2价Fe也是),均具有氧化性和还原性,因为均可再升或再降.当元素处于最低或最高价时,没有氧化性(不能再降)和还原性(不能再升).1年前查看全部
- 二氧化硫使酸性高锰酸钾溶液褪色为什么生成的是硫酸根而不是三氧化硫,都是+6的硫啊
二氧化硫使酸性高锰酸钾溶液褪色为什么生成的是硫酸根而不是三氧化硫,都是+6的硫啊
还有反应式:5SO2+2MnO4-+2H2O=5SO4 2-+2Mn2+ +4H+为什么酸化的高锰酸钾,但前面加的不是氢离子而是水 dddkof1年前6
dddkof1年前6 -
 天津李锤 共回答了17个问题
天津李锤 共回答了17个问题 |采纳率94.1%很简单.这个反应是溶液状态下进行的.
所以你可以理解为生成的SO3溶于水成为了H2SO4
另外,我可能理解你的感受了,SO3是固体,、不是气体,所以它不可能以气体的方式飞出来.
基本就这样了,如果还有疑问请追问、回答满意请采纳哦!~
酸化也可以的:
5SO2+2MnO4-+6H+=5SO3 +2Mn2+ +3H2O
然后: 5SO3 + 5H2O ====5H2SO4
这两个方程式合并:
5SO2+2MnO4-+6H++5H2O=5H2SO4 + 2Mn2+ + 3H2O
然后消去相同部分:
5SO2 + 2MnO4 + 2H2O===5SO42- + 2Mn2+ + 4H+
还是那句话,因为SO3迅速溶于水,所以不会生成SO3,而是SO42-1年前查看全部
- 二氧化硫硫是正四价是不是意味着共用电子对偏向氧可硫的质子不是多于氧么为什么共用电子对不偏向硫
二氧化硫硫是正四价是不是意味着共用电子对偏向氧可硫的质子不是多于氧么为什么共用电子对不偏向硫
从而使硫变成负四价呢? 贝以蒙1年前2
贝以蒙1年前2 -
 youranzi 共回答了18个问题
youranzi 共回答了18个问题 |采纳率88.9%你不能就考虑质子数的.
硫原子和氧原子相比:
1、原子核质子数增加,原子核所带正电荷总数增加,有对核外电子引力增强从而使原子半径减小的趋势;
2、核外电子总数和电子层数也增加,电子和电子相互排斥,内层电子会将外层电子往外推,有对最外层电子引力减小从而使原子半径增大的趋势.
两种因素中后者占主导因素.所以硫原子核对最外层电子引力要比氧原子核对最外层电子引力小,得电子能力弱,共用电子对时电子对偏离硫原子,偏向氧原子.1年前查看全部
- 二氧化硫与次氯酸钠反应铁二价与次氯酸根离子反应
 寒沙空独1年前1
寒沙空独1年前1 -
 feiyang19731 共回答了27个问题
feiyang19731 共回答了27个问题 |采纳率88.9%NaClO+SO2 H2O=H2SO4 NaCl 酸性条件下2Fe2+ + HClO + H+= 2Fe3+ + H2O + Cl-碱性条件下2Fe(OH)2 + ClO- + H2O = 2F e(OH)3 + Cl-1年前查看全部
- 将二氧化硫通到显红色的酚酞试液中,发现红色消失,主要是因为二氧化硫有
将二氧化硫通到显红色的酚酞试液中,发现红色消失,主要是因为二氧化硫有
酸性氧化物.为什么 byxok1年前3
byxok1年前3 -
 zhumin388813 共回答了21个问题
zhumin388813 共回答了21个问题 |采纳率90.5%因为二氧化硫显酸性,会与使酚酞溶液变红的碱性物质发生化学反应.从而,酚酞褪色.1年前查看全部
- 对国标法 大气中二氧化硫的测定--甲醛吸收法的质疑 我严谨的按照国标做了标准曲线,但是斜率为0.032
对国标法 大气中二氧化硫的测定--甲醛吸收法的质疑 我严谨的按照国标做了标准曲线,但是斜率为0.032
根本达不到标准上的0.044,查了相关文献,发现很多同行也是面临这些问题.如果这个稳定性这么差,条件如此苛刻,是不是没有当做国家标准的必要. 守望vv1年前1
守望vv1年前1 -
 7668375 共回答了13个问题
7668375 共回答了13个问题 |采纳率92.3%不太懂你的专业领域,但看起来你做的是标准曲线内插法测浓度.吸收曲线的影响因素太多了,原来我们做过别的标准曲线,试剂的某微量元素居然会影响曲线.既然目前是国标,那么确实也会有它的合理性.如果因为条件苛刻,那么唯一能做的就是等着它修订.现在质疑它也没什么用.还是再仔细看看有哪些微小的细节没有注意吧.1年前查看全部
- 用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫烧到损失混入炉渣.二氧化硫转化为三氧化硫的转化率97%,求一吨黄
用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫烧到损失混入炉渣.二氧化硫转化为三氧化硫的转化率97%,求一吨黄铁矿可产生98%硫酸多少吨?
 心跳乱了节奏1年前4
心跳乱了节奏1年前4 -
 skchenglong 共回答了20个问题
skchenglong 共回答了20个问题 |采纳率95%就是计算最后进入硫酸的硫的重量,进而换算成硫酸就可以了,因为硫元素是守恒的.
1t FeS2含有FeS2 720kg,FeS2中硫元素的质量分数是64/(64+56)=0.5333,所以S元素的质量就是384kg ,损失1.5%那么还剩下384×0.985=378.24kg,在转换三氧化硫的时候转化率是97%,所以这时候能转化成SO3的S的重量就是378.24×0.97=367kg,好了,现在知道变成硫酸的硫元素的质量,进而计算三氧化硫转化的纯硫酸质量:(367/32)×98=1123kg,因为硫酸是98%,所以再除以0.98,得到硫酸重量是1146.54kg
实际上运用守恒是很简单的,我写得很复杂,因为要介绍思想,如果你很熟悉,可以一步写齐所有算式,这样其中数字运算的约分等等能让计算更加简单,元素守恒、质量守恒、电荷守恒、能量守恒等等的应用有时候会让人视野更加开阔,看问题更宏观全面,简化思考和计算过程,十分有用.无论是做题还是研究,这都是很重要的思想和思考方法.1年前查看全部
- 燃煤烟尘排放量计算项目用煤量600t/a,燃煤含硫量为0.51%.计算二氧化硫的排放量?
 komilll1年前1
komilll1年前1 -
 小蝙蝠 共回答了20个问题
小蝙蝠 共回答了20个问题 |采纳率85%每年600吨煤,含硫量大约600x0.51% = 3.06吨.因为在二氧化硫 SO2中,硫的分子量只占有其一半的量(分子量分别为S = 32;O = 16).所以,二氧化硫的排放量就应该是 3.06吨 x 2 = 6.12 吨.
即,项目每年的二氧化硫排放量,大约是 6.12吨.1年前查看全部
- 在一密闭的2L容器中装有4mol二氧化硫,和2mol氧气,在一定条件下开始反应,2min末测得容器中有3.6mol二氧化
在一密闭的2L容器中装有4mol二氧化硫,和2mol氧气,在一定条件下开始反应,2min末测得容器中有3.6mol二氧化硫
请计算
1) min末三氧化硫的浓度.
2)2min内二氧化硫的平均反应速率.
3)氧气的转化率. v15sc1年前3
v15sc1年前3 -
 草衣青牛 共回答了19个问题
草衣青牛 共回答了19个问题 |采纳率89.5%2SO2 + O2 =(可逆)= 2SO3
始 4mol 2mol 0mol
平 3.6mol 1.8mol 0.4mol
转 0.4mol 0.2mol 0.4mol
c(SO3)=n(SO3)/V=0.4/2 mol/L = 0.2mol/L
v(SO2)=(0.4/2)/2 mol/(L*min)=0.1mol/(L*min)
a(O2)%=0.2/2 *100%=10%1年前查看全部
- 归纳中学常见物质的键角度数大小还能再多整理点吗?如氨气,二氧化硫,二氧化硅等
 guozhen83851年前1
guozhen83851年前1 -
 XINXIN380 共回答了15个问题
XINXIN380 共回答了15个问题 |采纳率100%根据物质空间构型确定.直线形为180度,V形为105度,平面三角形为120度,三角锥为107度,正四面体为109度28分 .NH3空间构型为三角锥,所以是107度,SO2为V形,所以为105度,SiO2为直线形,故180度1年前查看全部
- 高锰酸钾溶液与二氧化硫气体反应为什么要在酸性的条件下
高锰酸钾溶液与二氧化硫气体反应为什么要在酸性的条件下
二氧化硫溶于水形成亚硫酸不就是满足酸性条件了吗?为什么还要特意强调是在酸性条件下? nanhangwqx1年前4
nanhangwqx1年前4 -
 飘远不在人间 共回答了11个问题
飘远不在人间 共回答了11个问题 |采纳率90.9%高锰酸钾酸性条件下氧化性最强,生成二价锰离子Mn2+;
中性条件下生成四价的MnO2,氧化性较弱;
碱性条件下则最弱,生成六价锰酸钾K2MnO4.
所以一般使用酸性高锰酸钾作为氧化剂!
数理化梦之队为您答题,1年前查看全部
- 环保部门对某地区空气污染程度的检测报告主要有①总悬浮颗粒物②二氧化硫③氮的氧化物三项量化指标.下列情况中,能直接引起①和
环保部门对某地区空气污染程度的检测报告主要有①总悬浮颗粒物②二氧化硫③氮的氧化物三项量化指标.下列情况中,能直接引起①和②两项指标增大的是( )
A. 随意丢弃难以分解的塑料垃圾
B. 用煤炭用燃料放出的大量烟气
C. 工业废水直接排入河中
D. 农业上滥用化肥和农药 常盘晓晓1年前1
常盘晓晓1年前1 -
 garry20 共回答了24个问题
garry20 共回答了24个问题 |采纳率91.7%解题思路:根据污染物造成的影响进行分析解答本题.
A、随意扔弃难以分解的塑料垃圾,造成白色污染;
B、煤炭燃烧放出的烟中含很多悬浮颗粒物,煤中含硫燃烧产生二氧化硫,能直接引起总悬浮颗粒物、二氧化硫两项指标变化;
C、工业废水直接排入河中,造成污染水源;
D、农业上滥用化肥和农药,造成污染水源.A、随意扔弃难以分解的塑料垃圾,造成白色污染,故A错误;
B、煤炭燃烧放出的烟中含很多悬浮颗粒物,煤中含硫燃烧产生二氧化硫,能直接引起总悬浮颗粒物、二氧化硫两项指标变化,故B正确;
C、工业废水直接排入河中,造成污染水源,故C错误;
D、农业上滥用化肥和农药,造成污染水源,故D错误.
故选B.点评:
本题考点: 空气的污染及其危害.
考点点评: 本题考查学生根据污染物造成的影响进行分析解题,并加强环境保护意识,保护环境.1年前查看全部
- 水吸收二氧化硫还是二氧化硫溶解于水?
 wds99991年前2
wds99991年前2 -
 ff快枪 共回答了14个问题
ff快枪 共回答了14个问题 |采纳率78.6%它俩是一回事.只是说法不一样而已1年前查看全部
大家在问
- 1物体的体积一般大于它的容积.
- 2纯牛奶煮熟冷却后,出现白块状的东西,很想猪油,这样的牛奶是不是掺东西了?
- 3以下问题全部要方程.方程只能有一边有未知数的,两边都有没学过
- 4英语试卷题目 快点( ) 1. I get up about seven fifty-five. A. in B. on
- 5为什么氢氧化钠易溶于水、乙醇以及甘油?
- 6下列词语中加点的字,读音有误的一组是( ) A.花钿(diàn)炮烙(páo)果脯(fǔ)杳无音信(yǎo)
- 7与直线x+2y+3=0垂直的抛物线y=x2的切线方程是______.
- 8(2011•桂平市三模)以下是实验室常见的实验装置,请回答下列问题.
- 9此时,想起你,愿一切安好 作文
- 10(2013•海南)如图,光滑水平面上有三个物块A、B和C,它们具有相同的质量,且位于同一直线上.开始时,三个物块均静止,
- 11双星问题计算神奇的 黑洞时近代引力理论所预言的一种特殊天体,探寻黑洞的方案之一观测双星系统的运动规律,天文学家观测河外星
- 12free和tired的比较级、最高级、副词?
- 13沸腾时汽泡越往上越大 沸腾前汽泡越往上越小 为什么?
- 14储存甘薯、白菜最适宜的环境是( )
- 15将甲烷与氧气按体积1:2混合后点燃,充分反应后得到气体(120°c,101千帕)的平均相对分子质量?