Cr2O72- 变成Cr3+需要加入氧化剂才能实现吗?
 fkk382022-10-04 11:39:541条回答
fkk382022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 kellgs 共回答了25个问题
kellgs 共回答了25个问题 |采纳率100%- Cr2O72- 变成Cr3+
降价
只有被还原才变成Cr3+
加入Fe2+等还原剂就行 - 1年前
相关推荐
- (2014•浙江模拟)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O7
 (2014•浙江模拟)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
(2014•浙江模拟)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
A.阳极反应为Fe-2e-═Fe2+
B.在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑
C.在阳极室,PH增大会有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被氧化 robert_li9851年前1
robert_li9851年前1 -
 唉唷乖乖滴 共回答了18个问题
唉唷乖乖滴 共回答了18个问题 |采纳率83.3%解题思路:A.Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成亚铁离子;
B.电解氢氧化钾溶液,阴极生成氢气;
C.由反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,生成Fe3+,消耗了大量H+,有利于沉淀的生成;
D.根据反应式Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O判断.A.阳-氧-失,活泼电极失电子,Fe-2e-=Fe2+,故A正确;B.在阴极,发生还原反应,溶液中的氢离子得到电子减少,同时生成氢氧根,故B正确;C.在阳极发生反应:Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O,消耗了大量H+,使...
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查电解原理、氧化还原反应等,清楚发生的电极反应是解题的关键,是对学生综合能力的考查,难度中等.1年前查看全部
- 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.
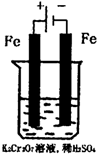
方法1:还原沉淀法该法的工艺流程为:CrO42-
Cr2O72-H+ ①转化
Cr3+Fe2+ ②还原
Cr(OH)3↓其中第①步存在平衡:2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2OOH− ③沉淀
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是______.
a.Cr2O72-和CrO42-的浓度相同b.2v(Cr2O72-)=v(CrO42-)c.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要______mol的FeSO4•7H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法,该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为______.
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)______,溶液中同时生成的沉淀还有______. 妍19841年前1
妍19841年前1 -
 yt_lavey 共回答了22个问题
yt_lavey 共回答了22个问题 |采纳率95.5%解题思路:(1)根据外界条件对平衡的影响来考虑平衡移动方向,从而确定离子浓度大小,进而确定颜色变化;
(2)判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变,即能变的量保持不变则说明已达平衡;
(3)根据得失电子守恒来计算;
(4)根据溶度积常数进行计算;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;
(6)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.(1)c(H+)增大,平衡2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O右移,溶液呈橙色;
(2)平衡时各物质的浓度不再改变,即溶液的颜色不再改变;
(3)根据电子得失守恒可知,还原1molCr2O72-离子得到Cr3+,得电子:2×(6-3)=6mol,需要FeSO4•7H2O的物质的量为:6÷(3-2)=6;
(4)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=
3
10−32
10−5
=10−9mol/L,c(H+)═
10−14
10−9,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+;
(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2的同时,大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀.
故答案为:(1)橙;(2)c;(3)6;(4)5;(5)阳极反应为Fe-2e-═Fe2+,提供还原剂Fe2+;(6)2H++2e-═H2↑;Fe(OH)3.点评:
本题考点: 化学平衡移动原理;氧化还原反应的电子转移数目计算;原电池和电解池的工作原理;化学平衡状态的判断;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题综合考查了化学平衡原理、氧化还原反应、沉淀溶解平衡和电化学知识等内容.分析时要根据题给信息,结合相关原理进行解答.1年前查看全部
- Cr2O72- + I- + H+ = H2O + I2 + Cr3+
Cr2O72- + I- + H+ = H2O + I2 + Cr3+
在 100ml C(H+)=1mol/L 的溶液中
有以下反应 Cr2O72- + I- + H+ = H2O + I2 + Cr3+
已知电子转移1.806*10^22
求反应后C(H+)
以下为个人看法:我觉得这裏的电子转移和H+没关系,因为H+由始至终都没有变价
所以我认为H+反应后全部变成了H2O,就代表了反应后的H+浓度[H+]=[OH-]=1×10^(-7)mol/L
所以答案是1*10^-7 可是很多同学都说用h+和电子之间的关系计到了0.03mol/L
是我对题目的理解有错? 猫咪和鸭子1年前1
猫咪和鸭子1年前1 -
 燕晚 共回答了17个问题
燕晚 共回答了17个问题 |采纳率94.1%有错.
首先将反应方程式配平:
Cr2O72- + 6I- + 14H+ = 7H2O + 3I2 + 2Cr3+
虽然H+没有发生电子的转移,但是I-、Cr2O72-发生电子转移的时候H+是参与了反应的,并且满足一定的关系,如上式显示,6I- --- 3I2 转移6个电子,而同时有14个H+参与反应.转移电子数与参与反应的H+数之比是6:14,现电子转移0.03mol,所以参与反应的H+就是0.042mol,所以剩余H+就是0.1*1-0.042=0.058mol
因此反应后H+浓度是0.58mol/L1年前查看全部
- 怎么根据化合价升降法配平_H+ +_Cr2O72-+_Fe3O4--_Fe3++ Cr3++_H2O
 szgr_wjs1年前3
szgr_wjs1年前3 -
 最恨下雨的日子 共回答了19个问题
最恨下雨的日子 共回答了19个问题 |采纳率78.9%劝你用离子电子法来配吧,氧化数因为Fe出现了分数所以...
Cr2O72-+14H++6e-=2Cr3++7H2O
Fe3O4+8H+-e-=3Fe3++4H2O ×6相加
6Fe3O4+Cr2O72-+62H+=2Cr3++18Fe3++31H2O
这个方法好处在於不需要找化合价,只用元素守恒,电荷守恒就可以配平.缺点是非溶液中不适用.1年前查看全部
- 工业上常用Fe做电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去.某科研小组用该原理处
工业上常用Fe做电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去.某科研小组用该原理处理污水,设计装置如图所示.下列说法不正确的是( )
 A. 燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96L
A. 燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96L
B. 实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4
C. 该燃料电池正极的电极反应式为:O2+4e-+2CO2=2CO32-
D. 甲中阳极附近溶液中的离子反应方程式是:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 逍遥天帝1年前1
逍遥天帝1年前1 -
 惑虫 共回答了19个问题
惑虫 共回答了19个问题 |采纳率78.9%解题思路:A.甲中C电极发生2H2O=H2↑+2OH-,利用CH4~8e-~4H2↑来计算;
B.离子浓度越大,导电性越强;
C.电解质为碳酸盐,燃料电池的正极上氧气得到电子;
D.亚铁离子具有还原性,Cr2O72-具有氧化性,发生氧化还原反应.A.甲中C电极发生2H2O=H2↑+2OH-,由CH4~8e-~4H2↑可知,1.6gCH4参加反应,则甲中C电极理论上生成气体体积为[1.6g/16g/mol]×4×22.4L/mol=8.96L,故A正确;
B.离子浓度越大,导电性越强,则若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4来增强导电性,故B正确;
C.电解质为碳酸盐,燃料电池的正极上氧气得到电子,正极反应为O2+4e-+2CO2=2CO32-,故C正确;
D.亚铁离子具有还原性,Cr2O72-具有氧化性,发生氧化还原反应,甲中阳极附近溶液中的离子反应方程式为Cr2O72-+6Fe2++7H2O+10OH-=2Cr(OH)3↓+6Fe(OH)3↓,故D错误;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池、电解池及氧化还原反应,明确发生的电极反应是解答本题的关键,注意选项D中阳极上生成沉淀来处理污水,注重学生获取信息和应用信息的能力,题目难度中等.1年前查看全部
- 在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则1mol Cr3+反应所需PbO2的物
在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则1mol Cr3+反应所需PbO2的物质的量是( )
A. 3.0mol
B. 1.5mol
C. 1.0mol
D. 0.75 mol ╰殇ァ1年前1
╰殇ァ1年前1 -
 藏化冥主 共回答了24个问题
藏化冥主 共回答了24个问题 |采纳率87.5%解题思路:反应中PbO2→Pb2+,Pb元素的化合价由+4价降低为+2,Cr3+→Cr2O72-,Cr元素的化合价由+3价升高为+6价,根据电子转移守恒计算1mol Cr3+反应所需PbO2的物质的量.反应中PbO2→Pb2+,Pb元素的化合价由+4价降低为+2,Cr3+→Cr2O72-,Cr元素的化合价由+3价升高为+6价,
令1mol Cr3+反应所需PbO2的物质的量为n,根据电子转移守恒,则:
1mol×(6-3)=n×(4-2)
解得:n=1.5mol
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的有关计算,难度不大,注意氧化还原反应计算中守恒思想的运用.1年前查看全部
- 在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则1mol Cr3+反应所需PbO2的物
在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则1mol Cr3+反应所需PbO2的物质的量是( )
A. 3.0mol
B. 1.5mol
C. 1.0mol
D. 0.75 mol 戒爱蝴蝶1年前1
戒爱蝴蝶1年前1 -
 redcafe 共回答了23个问题
redcafe 共回答了23个问题 |采纳率95.7%解题思路:反应中PbO2→Pb2+,Pb元素的化合价由+4价降低为+2,Cr3+→Cr2O72-,Cr元素的化合价由+3价升高为+6价,根据电子转移守恒计算1mol Cr3+反应所需PbO2的物质的量.反应中PbO2→Pb2+,Pb元素的化合价由+4价降低为+2,Cr3+→Cr2O72-,Cr元素的化合价由+3价升高为+6价,
令1mol Cr3+反应所需PbO2的物质的量为n,根据电子转移守恒,则:
1mol×(6-3)=n×(4-2)
解得:n=1.5mol
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的有关计算,难度不大,注意氧化还原反应计算中守恒思想的运用.1年前查看全部
- 工业上处理含Cr2O72-的酸性工业废水常用以下方法:
工业上处理含Cr2O72-的酸性工业废水常用以下方法:
①往工业废水里加入适量的NaCl,搅拌均匀;
②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;
③过滤回收沉淀,废水达到排放标准.
试回答:
(1)电解时的电极反应:阳极______,阴极______.
(2)Cr2O72-转变成Cr3+的离子反应方程式:______.
(3)电解过程Cr(OH)3、Fe(OH)3沉淀是怎么产生的?______.
(4)能否用Cu电极来代替Fe电极?______(填“能”或“不能”),简述理由______. 那一夜的月亮1年前1
那一夜的月亮1年前1 -
 eluardt 共回答了17个问题
eluardt 共回答了17个问题 |采纳率94.1%解题思路:(1)在电解池中,如果阳极是活泼电极,则电极本身发生失电子的氧化反应,阴极上是阳离子发生得电子的还原反应,据此书写电极反应;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,据此书写方程式;
(3)Fe3+、Cr3+在水溶液中会发生水解反应,当溶液的碱性达到一定程度就会生成氢氧化物沉淀;
(4)铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应.(1)用Fe为电极进行电解,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上是阳离子发生得电子的还原反应,即2H++2e-═H2↑,故答案为:Fe-2e-═Fe2+;2H++2e-═H2↑;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,;
(3)在电解池的阴极发生反应2H++2e-═H2↑,Cr2O72-与Fe2+反应的过程中,都将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+水解并最终转化为Fe(OH)3、Cr(OH)3沉淀,
故答案为:在阴极反应及Cr2O72-与Fe2+反应的过程中,将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+水解并最终转化为Fe(OH)3、Cr(OH)3沉淀;
(4)若用Cu电极来代替Fe电极,在阳极上铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应,
故答案为:不能;因为阳极产生的Cu2+不能使Cr2O72-还原到低价.点评:
本题考点: 电解原理.
考点点评: 本题考查学生电解池的工作原理以及氧化还原反应型离子方程式的书写方法等知识,难度不大.1年前查看全部
- (2012•洛阳一模)环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
 (2012•洛阳一模)环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
(2012•洛阳一模)环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
离子,常用的方法有两种.2−4
方法1:还原沉淀法
该法的工艺流程为: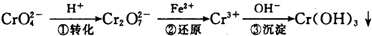
其中第①步存在平衡:2CrO
(黄色)+2H+⇌Cr2O2−4
(橙色)+H2O2−7
(1)写出第①步反应的平衡常数表达式K=
)c( Cr2 O 2−7
) • c 2 ( H+ )c 2 ( CrO 2−4K=.
)c( Cr2 O 2−7
) • c 2 ( H+ )c 2 ( CrO 2−4
(2)关于第①步反应,下列说法正确的是______.
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1mol Cr2O
离子,需要______mol的FeSO4•7H2O.2−3
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为______.在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)⇌Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积K sp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)______.
方法2:电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O
的废水,电解时阳极反应式为______,阴极区反应式为______,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是______.2−3 dakongyiheihei1年前1
dakongyiheihei1年前1 -
 仙玉立 共回答了18个问题
仙玉立 共回答了18个问题 |采纳率72.2%解题思路:(1)根据化学平衡常数表达式的概念解决;
(2)根据平衡装状态判断标准;氧化还原反应的概念;化学平衡的移动,结合题意解决;
(3)根据氧化还原反应的计算解决;
(4)根据化学反应过程的分析判断离子种类,得出产物;根据溶度积常数计算,确定溶液中离子是否沉淀完全;
(5)根据电解池阴、阳两极微粒的放电顺序解决;结合阴阳两极的放电引起的溶液中离子变化解决.(1)根据平衡常数表达式的概念,结合方程式2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O可知,K=
c( Cr2 O2−7 )
c 2 ( CrO2−4 ) • c 2 ( H+ ),
故答案为:K=
c(Cr2O2−7)
c2 ( CrO2−4) • c2 ( H+);
(2)A• 根据化学平衡状态的判断标准,结合可逆反应方程式2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O,随着反应的进行,溶液中c(H+)逐渐减小,当溶液中c(H+)保持不变时,即到达平衡状态,此时,溶液的pH不变,故A正确;
B• 根据氧化反应的概念,一个反应中有元素化合价升降的,就为氧化还原反应,而此选项中,只有化合价的升高,没有化合价降低的元素,因此次变化是一个氧化还原反应中氧化过程,不是一个完整的氧化还原反应,故B错误;
C• 根据影响化学平衡移动的条件,结合题意,强酸环境下,相当于增加了c(H+)的浓度,反应2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O向正向移动,即溶液颜色为橙色.故C正确,
故答案为:AC;
(3)根据氧化还原反应的计算,氧化剂得到的电子总数与还原剂失去电子总数相等.根据Cr2O72-→2Cr3+,1molCr2O72-被还原得到6mol电子,现在有0.1molCr2O72-被还原被还原,需得到0.6mol电子,0.6mol电子将有Fe2+失去变成Fe3+,1molFe2+变成Fe3+,将失去1mol电子,现在失去0.6mol电子,需要0.6mol FeSO4•7H2O,
故答案为:0.6;
(4)根据分析(3)当Cr2O
2−7→2Cr3+变化时,溶液中产生了Cr3+的同时,又发生了Fe2+→Fe3+的过程 溶液中又产生了Fe3+,因此加入OH-又有Fe(OH)3生成.故答案为Fe(OH)3;根据溶度积常数的计算,结合Cr(OH)3(s)⇌Cr3+(aq)+3OH(aq),当溶液的pH值调至4时,c(OH-)=1×10-10,常温下,Cr(OH)3的溶度积K sp=10-32,Ksp(Cr(OH)3)=c3(OH)•c(Cr3+),c(Cr3+)=
Ksp(Cr(OH)3)
c3(OH−)=
10−32
103×−10=10-2mol/L>10-5 mol/L,
故答案为:若pH值调整至4时已形成部分沉淀;
(5)根据电解池阴阳两极的放电顺序,金属单质做阳极时,金属优先失电子,次电解池阳极是铁,故阳极反应为:Fe-2e-=Fe2+;阴极的放电顺序与金属活动性顺序相反,在K2Cr2O7、H2SO4的溶液中,含有的阳离子有:K+、H+,H+的放电能力比K+的强,因此阴极上是H+离子放电,H+浓度减小促进了水的电离平衡,使水向电离的方向移动,OH-离子的浓度增大,碱性增强,使得到的金属阳离子在阴极区可沉淀完全,
故答案为:2H++2e-=H2↑;由于阴极发生2H++2e-=H2↑;阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,是溶液中OH-的浓度增大,溶液逐渐呈碱性.点评:
本题考点: 化学平衡常数的含义;化学平衡状态的判断;难溶电解质的溶解平衡及沉淀转化的本质;电解原理.
考点点评: 本题是一道综合题,集中考查了难溶物的溶解平衡、利用溶度积常数的计算、溶解平衡的移动、电解原理等知识点,综合性较强,很容易出错,特别是简答题,如何将学到的知识组织成答案是关键.1年前查看全部
- 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.某工厂使用还原
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.某工厂使用还原沉淀法处理,该法的工艺流程为:

其中第①步存在平衡:2CrO42-(黄色)+2H+═Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显______色.
(2)能说明第①步反应达平衡状态的是______.
a.Cr2O72-的浓度不变b.Cr2O72-和CrO42-的浓度相同
c.2v(Cr2O72-)=v(CrO42-) d.溶液的颜色不变
(3)第②步反应中,还原剂为______,该还原剂反应后生成______.
(4)电镀废液中Cr2O72-还可通过下列反应转化:
Cr2O72-(aq)+2Pb2+(aq)+H2O(l)═2PbCrO4(s)+2H+(aq)△H<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是______
 龙一龙1年前1
龙一龙1年前1 -
 峡犷 共回答了21个问题
峡犷 共回答了21个问题 |采纳率81%解题思路:(1)若平衡体系的pH=12,2CrO42-(黄色)+2H+═Cr2O72-(橙色)+H2O逆向移动,以此分析;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡;
(3)根据氧化还原反应中元素的化合价变化分析;
(4)根据升高温度反应速率加快,平衡逆向移动,pH越大,平衡正向移动,Pb2+的浓度越大,平衡正向移动,结合图象分析.(1)若平衡体系的pH=12,2CrO42-(黄色)+2H+═Cr2O72-(橙色)+H2O逆向移动,则溶液为黄色,故答案为:黄;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,
a.Cr2O72-的浓度不变,为特征定,能判断平衡,故a正确;
b.Cr2O72-和CrO42-的浓度相同取决于起始浓度和转化,不能判断平衡,故b错误;
c.2v(Cr2O72-)=v(CrO42-),不能判断正逆反应速率关系,不能判断平衡,故c错误;
d.溶液的颜色不变,为特征定,能判断平衡,故d正确;
故答案为:ad;
(3)第②步反应中,Cr元素的化合价降低,则Fe元素的化合价升高,所以为Fe2+,被氧化为Fe3+,故答案为:Fe2+;Fe3+;
(4)A.升高温度平衡逆向移动,化学平衡常数减小,与图象一致,故A正确;
B.pH越大,平衡正向移动的趋势越大,Cr2O72-转化率增大,与图象不符,故B错误;
C.升高温度,反应速率增大,与图象不符,故C错误;
D.Pb2+的浓度越大,平衡正向移动,Cr2O72-的物质的量越小,与图象不符,故D错误;
故答案为:A.点评:
本题考点: 影响盐类水解程度的主要因素;化学平衡建立的过程.
考点点评: 本题主要考查了化学平衡移动原理、氧化还原反应等,注意结合信息来分析解答,侧重反应原理和学生能力的考查,题目难度中等.1年前查看全部
- 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O中,Fe2O3的基本单元为什么是1/2
 bluesource1年前1
bluesource1年前1 -
 呐呐大人 共回答了18个问题
呐呐大人 共回答了18个问题 |采纳率77.8%因为该方程式的基本单元是Fe,所以有2个Fe的Fe2O3的基本单元是1/2
1/2个Fe2O3里有1个Fe1年前查看全部
- 配平Cr2O72- +H2S+ H +→ Cr3++ S+ H2O
 linger451年前1
linger451年前1 -
 loll0094 共回答了21个问题
loll0094 共回答了21个问题 |采纳率90.5%配平方程式如下
Cr2O72- + H2S + 8 H+ == 2 Cr3+ + 3 S+ 7 H2O1年前查看全部
- 某含Cr2O72-废水用硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该
某含Cr2O72-废水用硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到n mol FeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述正确的是( )
A.反应中转移的电子总数为3nx mol
B.Cr2O72-转化为沉淀时被氧化
C.消耗硫酸亚铁铵的物质的量为n(2-x)mol
D.在FeO•FeyCrxO3中3y=x 杀了张小珏喂猪1年前1
杀了张小珏喂猪1年前1 -
 隔离线sun 共回答了10个问题
隔离线sun 共回答了10个问题 |采纳率60%解题思路:含Cr2O72-废水用硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]处理,Cr元素的化合价由+6价降低为+3价,Fe元素的化合价由+2价升高为+3价,以此来解答.A.由Cr元素的化合价变化可知,最终得到nxmolCr时,转移电子为nxmol×(6-3)=3nxmol,故A正确;
B.Cr元素的化合价降低,则Cr2O72-转化为沉淀时被还原,故B错误;
C.由电子守恒可知,发生氧化还原反应消耗硫酸亚铁铵为
3nxmol
(3−2)mol,共消耗(3nx+n)mol,故C错误;
D.由化合物中正负化合价的代数和为0可知,3y+3x=6,则x=2-y,由得失电子守恒知y=3x,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意电子守恒及原子守恒的应用,题目难度不大.1年前查看全部
- (2012•邯郸二模)工业上常用Fe做电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去
 (2012•邯郸二模)工业上常用Fe做电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去.某科研小组用该原理处理污水,设计装置如图所示.下列说法不正确的是( )
(2012•邯郸二模)工业上常用Fe做电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去.某科研小组用该原理处理污水,设计装置如图所示.下列说法不正确的是( )
A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96L
B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2CO32-
D.甲中阳极附近溶液中的离子反应方程式是:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 白墨汁1年前1
白墨汁1年前1 -
 farytale 共回答了16个问题
farytale 共回答了16个问题 |采纳率93.8%解题思路:A.甲中C电极发生2H2O=H2↑+2OH-,利用CH4~8e-~4H2↑来计算;
B.离子浓度越大,导电性越强;
C.电解质为碳酸盐,燃料电池的正极上氧气得到电子;
D.亚铁离子具有还原性,Cr2O72-具有氧化性,发生氧化还原反应.A.甲中C电极发生2H2O=H2↑+2OH-,由CH4~8e-~4H2↑可知,1.6gCH4参加反应,则甲中C电极理论上生成气体体积为[1.6g/16g/mol]×4×22.4L/mol=8.96L,故A正确;
B.离子浓度越大,导电性越强,则若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4来增强导电性,故B正确;
C.电解质为碳酸盐,燃料电池的正极上氧气得到电子,正极反应为O2+4e-+2CO2=2CO32-,故C正确;
D.亚铁离子具有还原性,Cr2O72-具有氧化性,发生氧化还原反应,甲中阳极附近溶液中的离子反应方程式为Cr2O72-+6Fe2++7H2O+10OH-=2Cr(OH)3↓+6Fe(OH)3↓,故D错误;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池、电解池及氧化还原反应,明确发生的电极反应是解答本题的关键,注意选项D中阳极上生成沉淀来处理污水,注重学生获取信息和应用信息的能力,题目难度中等.1年前查看全部
- 简单的化学基础问题S2O32-怎么读?还有Cr2O72-是重铬酸根读CHONG还是ZHONG 谢谢
 LOVE8161年前4
LOVE8161年前4 -
 wawzm9999 共回答了16个问题
wawzm9999 共回答了16个问题 |采纳率93.8%S2O32-硫代硫酸根
Cr2O72-重铬酸根(chong)1年前查看全部
- 化学反应方程式配平1、 BiCl3 + H2O —2、 Pb2+ + Cr2O72- + H2O —3、 NO2- +
化学反应方程式配平
1、 BiCl3 + H2O —
2、 Pb2+ + Cr2O72- + H2O —
3、 NO2- + MnO4- + H+ —
4、 AgNO3(S)
5、 H2O2 + MnO4- + H+
6、 PCl5 + H2O
7、 Fe3+ + Sn2+
8、 Al(OH)3 + OH-
9、 NaHCO3
10、 KNO3(S)
11、 SbCl3 + H2O —
12、 Fe3+ + SCN- —
13、 MnO4-+ SO32-+ OH- —
14、 Cr2O72-+ Fe2++ H+ —
15、 Pb(NO3) 2
16、 SnCl2 + H2O —
17、 CrO2 + H2O2 + OH- — WO天天郁闷1年前2
WO天天郁闷1年前2 -
 砸谈发烧友 共回答了11个问题
砸谈发烧友 共回答了11个问题 |采纳率100%1、 BiCL3+H2O=BiOCL↓+2HCl
2、 2Pb2++(Cr2O7)2-+H2O=2PbCrO4(s)+2H+
3、 5 NO2- + 2 MnO4- + 6 H+ = 2 Mn2+【Mn的2价正离子】+ 5 NO3- + 3 H2O
4、 2AgNO3=2Ag+2NO2+O2↑
5、 2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5O2↑+ 8H2O
6、 PCl5+3H2O=HPO3+5HCl
7、 2Fe3+ + Sn2+ =2Fe2+ + Sn4+
8、 Al(OH)3 + OH- =(AlO2)- +2H2O
9、 2 NaHCO3(加热)=Na2CO3 +CO2↑+H2O
10、 2KNO3 == 2KNO2 + O2↑
11、 SdCl3+ H2O == SdOCl(碱式盐) + 2HCl
12、 Fe3+ +3SCN-=Fe(SCN)3
13、 2(MnO4)-+(SO3)2-+2OH-=2(MnO4)2-+(SO4)2-+H2O
14、 6Fe2+ + Cr2O72- +14H+ =6Fe3+ + 2Cr3+ 7H2O
15、 2Pb(NO3)2=2PbO+4NO2↑+O2↑
16、 SnCl2+H2O=Sn(OH)Cl+HCl
17、 CrO2+H2O2+2OH-=(CrO4)2-+2H2O1年前查看全部
- Ⅰ.在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O⇌2CrO42-+2H+,
Ⅰ.在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O⇌2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色.
(1)向上述溶液中加入NaOH溶液,溶液呈______色,因为______.
(2)上述反应平衡常数表达式K=c2(Cr
)•c2(H+)O 2−4c(Cr2
)O 2−7c2(Cr
)•c2(H+)O 2−4c(Cr2
)O 2−7
Ⅱ.将CoCl2溶解于盐酸中可以形成CoCl42-,在溶液中存在下面的化学平衡:Co(H2O)62+[粉红色]+4Cl-⇌6H2O+CoCl42-[蓝色]△H>0.取一支试管,向其中加入少量氯化钴晶体,再逐滴加入浓盐酸至晶体完全溶解,然后滴加水至溶液呈紫色为止.将所得溶液分装于二支试管中,
(1)其一将所得溶液置于热水中,观察到的实验现象是______,因为______.
(2)其二将所得溶液加水稀释[稀释过程的变化相当于化学平衡移动原理中改变压强的变化],稀释一倍后,重新达到平衡时,
______(填“增大”、“减小”或“不变”).c(Co(H2O
)) 2+6c(CoC
)l 2−4
(3)该反应的升高温度,K值将______(填“增大”、“减小”或“不变”). 边缘碎花1年前1
边缘碎花1年前1 -
 best3664 共回答了14个问题
best3664 共回答了14个问题 |采纳率92.9%解题思路:Ⅰ.(1)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,水不需要写出,据此书写;
Ⅱ.(1)正反应是吸热反应,则上述平衡正向移动;
(2)加水稀释促进水解,平衡逆向移动;
(3)正反应是吸热反应,温度升高K值变大.Ⅰ.(1)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液呈黄色,故答案为:黄;加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动;
(2)根据化学平衡常数的定义,可知Cr2O72-(aq)+H2O(l)⇌2CrO42-(aq)+2H+(aq)的平衡常数K=
c2(Cr
O2−4)•c2(H+)
c(Cr2
O2−7),故答案为:
c2(Cr
O2−4)•c2(H+)
c(Cr2
O2−7);
Ⅱ.(1)正反应是吸热反应,则上述平衡正向移动,溶液由粉红色逐渐变蓝色,故答案为:粉红色逐渐变蓝色;正反应是吸热反应,则上述平衡正向移动;
(2)加水稀释促进水解,平衡逆向移动,所以
c(Co(H2O
)2+6)
c(CoC
l2−4) 增大,故答案为:增大;
(3)正反应是吸热反应,温度升高K值变大,故答案为:增大.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡常数及平衡移动,明确温度、稀释及浓度对化学平衡的影响即可解答,注重基础知识的考查,题目难度不大.1年前查看全部
- 急【工厂为了除含Cr2O72-离子的酸性废水,采用以下处理方法:以铁作为电极进行电解 鼓入空气,经过一】 [ 标签:离子
急【工厂为了除含Cr2O72-离子的酸性废水,采用以下处理方法:以铁作为电极进行电解 鼓入空气,经过一】 [ 标签:离子酸性,废水,电极 ] 工厂为了除含Cr2O72-离子的酸性废水,采用以下处理方法:以铁作为电极进行电解 鼓入空气,经过一段时间后,使废水中的含铬(有毒)量降到可排放的标准,其原理是:①将Cr2O72-离子还原为可溶性三价铬离子.②电解除铬过程中,使溶液的PH不断升高,使工业废水由酸性变为碱性,再把三价铬离子变成不溶性氢氧化物除去.根据上述内容回答下列问题:(1)用铁作电极电解时,电极反应式为:阳极 ,阴极 .(2)在水溶液中将Cr2O72-离子还原成Cr3+的还原剂是溶液中的 离子,此氧化还原反应的离子方程式是 .(3)在处理废水中使溶液的PH不断升高,由酸性转变碱性是通过 和 途径来实现的.(4)将Cr3+转变成不溶性氢氧化物的离子反应式为 ,同时还有 生成 第二行 鼓入空气 阳极:Fe-2e---->Fe2+ ; 阴极:Cr2O7(2-) + 14H+ + 6e ----> 2Cr3+ + 7H2O .Fe2+ ; Cr2O7(2-) + 14H+ + 6Fe2+ ----> 2Cr3+ + 7H2O + 6Fe3+ .通电和O2.Cr3+ 3OH- ----> Cr(OH)3 ; Fe(OH)3 .为什么 氧气 不反应 那鼓入空气还有什么用
 品客薯片1年前1
品客薯片1年前1 -
 依风季节 共回答了21个问题
依风季节 共回答了21个问题 |采纳率90.5%加入O2!1年前查看全部
- (2014•浙江模拟)工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
(2014•浙江模拟)工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
已知:CrO2−4
Cr2OH+ ①转化 2−7
Cr3+Fe2+ ②还原
Cr(OH)3↓OH− ③沉淀
(1)步骤①中存在平衡:2CrO42-(黄色)+2H+⇌Cr2O42-(橙色)+H2O
(2)步骤③生成的Cr(OH)3,在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5mol•L-1 时可视作该离子不存下列有关说法中,正确的是( )
A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大
B.步骤①中当2v(CrO42-)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O达到平衡状态
C.步骤②中,若要还原1mol Cr2O72-离子,需要12mol (NH4)2Fe(SO4)2•6H2O
D.步骤③中,当将溶液的pH调节至6 时,则可认为废水中的铬已除尽 VGTFDRE1年前1
VGTFDRE1年前1 -
 green2010 共回答了10个问题
green2010 共回答了10个问题 |采纳率100%解题思路:A.步骤①中加酸,氢离子浓度增大,平衡正向移动;
B.2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,结合Ksp计算.A.步骤①中加酸,氢离子浓度增大,平衡正向移动,则CrO42-离子浓度减小,故A错误;
B.当2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等,则该反应不能达到平衡,故B错误;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3,则由电子守恒可知需要6 mol(NH4)2Fe(SO4)2•6H2O,故C错误;
D.步骤③中,当将溶液的pH 调节至6 时,c(OH-)=10-8mol/L,由Ksp可知,c(Cr3+)=
10−32
(10−8)3=10-8mol/L,则可认为废水中的铬元素已经除尽,故D正确;
故选D.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查化学平衡的影响因素,涉及反应速率、平衡移动、转移电子计算、溶解度计算等,注重学生知识迁移应用能力的考查,题目难度中等.1年前查看全部
- 处理含Cr2O72-的废水的原理如下:向含Cr2O72-的酸性废水中加入FeSO4·7H2O,将Cr2O72-还原
处理含Cr2O72-的废水的原理如下:向含Cr2O72-的酸性废水中加入FeSO4·7H2O,将Cr2O72-还原
Cr3+,使铁、铬元素转化为组成相当于FeII [FeIIIx·CrIII2-x]O4 (铁氧磁体、罗马数字表示元素的价态)的沉淀.处理含1 mol Cr2O72-的废水至少需要加入a mol FeSO4·7H2O.下列结论正确的是 A.x=0.5,a=8 B.x=1.5,a=10 viennaGIRL1年前3
viennaGIRL1年前3 -
 liumengyin 共回答了13个问题
liumengyin 共回答了13个问题 |采纳率84.6%为了便于叙述,把FeII [FeIIIx·CrIII2-x]O4 简化叫混合物.
设最终生成了y mol混合物;
寻找关系:
1、Cr元素量不变,则有:(2-x)y=2
2、Fe元素量不变,则有:(1+x)y=a
3、Fe失去的电子量=Cr得到的电子量,则有:xy=2*(6-3)=6
解这三个方程式可得:X=1.5,y=4,a=10.1年前查看全部
- 化学Cr(Ⅵ)主要以CrO42-和Cr2O72-形态存在, 在酸性条件下具有很强的氧化性,它们 在溶液中之间存在如下转
化学Cr(Ⅵ)主要以CrO42-和Cr2O72-形态存在, 在酸性条件下具有很强的氧化性,它们 在溶液中之间存在如下转
Cr(Ⅵ)主要以CrO42-和Cr2O72-形态存在,
在酸性条件下具有很强的氧化性,它们
在溶液中之间存在如下转化:
CrO42-(黄色) +2H+—— Cr2O72-(橙色)+水 ;
K=4.2×1014.若若要使溶液由黄色变橙色,则应采取的措施是 ▲ .
A.加NaOH B.加盐酸 C.加硫酸 D.加AgNO3
答案是C 请问为什么不能加盐酸 jfei081年前1
jfei081年前1 -
 厦大混混 共回答了21个问题
厦大混混 共回答了21个问题 |采纳率95.2%Cr2O72-在酸性条件下具有很强的氧化性,会把氯离子氧化为氯气.1年前查看全部
- 一道化学配平.请速度做答Cr2o72- + Fe3o4+ H+ === Cr3+ + Fe3+ + H2o第一个7在下面
一道化学配平.请速度做答
Cr2o72- + Fe3o4+ H+ === Cr3+ + Fe3+ + H2o
第一个7在下面.2在右上角.是个离子化学式 fangli02031年前4
fangli02031年前4 -
 bleachsong 共回答了16个问题
bleachsong 共回答了16个问题 |采纳率93.8%Cr2O7(2-) +6 Fe3o4+ 62H+ → 2Cr3+ + 18Fe3+ + 31H2o1年前查看全部
- Cr2O72-(aq)+2Pb2+(aq)+H2O(l)=2PbCrO4(s)+2H+(aq)平衡后加水向哪个方向移动
Cr2O72-(aq)+2Pb2+(aq)+H2O(l)=2PbCrO4(s)+2H+(aq)平衡后加水向哪个方向移动
我认为是不移动.可是错了 为什么 Samantha_Leo1年前3
Samantha_Leo1年前3 -
 杉子来迟 共回答了9个问题
杉子来迟 共回答了9个问题 |采纳率100%加水稀释后所有粒子浓度降低,根据平衡移动规则,此时化学平衡将向粒子数增加的方向移动
反应物粒子数=3,H2O不计
生成物粒子数=2,PbCrO4不计
所以平衡向反应物方向移动,或者说平衡逆向移动1年前查看全部
- 工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
工业上常用还原沉淀法处理含铬废水(Cr2O72-和CrO42-),其流程为:
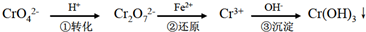
已知:
(1)步骤①中存在平衡:2Cr O42-(黄色)+2H+⇌Cr2O42-(橙色)+H2O
(2)步骤③生成的Cr(OH)3 在溶液中存在沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol•L-1 时可视作该离子不存在.
下列有关说法中,正确的是( )
A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大
B.步骤①中当溶液呈现深黄色,且2v(CrO42-)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+⇌Cr2O72-(橙色)+H2O 达到平衡状态
C.步骤②中,若要还原1 mol Cr2O72-离子,需要6 mol(NH4)2Fe(SO4)2•6H2O
D.步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 xx民间xx会1年前1
xx民间xx会1年前1 -
 youmingwu 共回答了16个问题
youmingwu 共回答了16个问题 |采纳率93.8%解题思路:A.步骤①中加酸,氢离子浓度增大,平衡正向移动;
B.2v(CrO42一)=v(Cr2O72-)时,正逆反应速率不等;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,结合Ksp计算.A.步骤①中加酸,氢离子浓度增大,平衡正向移动,则CrO42-离子浓度减小,故A错误;
B.2v(CrO42-)=v(Cr2O72-)时,正逆反应速率不等,则该反应不能达到平衡,故B错误;
C.还原1 mol Cr2O72-离子,转移电子为1mol×2×(6-3)=6mol,Fe元素的化合价由+2升高为+3,则由电子守恒可知需要6 mol(NH4)2Fe(SO4)2•6H2O,故C正确;
D.步骤③中,当将溶液的pH 调节至4 时,c(OH-)=10-10mol/L,由Ksp可知,c(Cr3+)=
10−32
(10−10)3=10-2mol/L,废水中的铬元素没有除尽,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查化学平衡的影响因素,涉及反应速率、平衡移动、转移电子计算、溶解度计算等,注重学生知识迁移应用能力的考查,题目难度中等.1年前查看全部
- 怎么用离子电子法配平Cr3+ + PbO2 → Cr2O72- + Pb2+
怎么用离子电子法配平Cr3+ + PbO2 → Cr2O72- + Pb2+
用离子——电子法配平下列反应
(1)As2S3 + HNO3(稀) → HAsO3 + NO + S
(2)Cr3+ + PbO2 → Cr2O72- + Pb2+
(3)H2O2 + Cr3+ + OH- → CrO42- + H2O
(4)Cr3+ + S2O82- + H2O → Cr2O72- + SO42- + H+
(5)Mn2+ + HBiO3 → Bi3+ + MnO4-
(6)Cr2O72- + H2S + H2SO4(稀) → Cr3+ + S
(7)Cl2 + OH- → ClO- + Cl-
(8)MnO4- + AsO3- → Mn2+ + AsO43- 屠园1年前1
屠园1年前1 -
 ww3304 共回答了24个问题
ww3304 共回答了24个问题 |采纳率91.7%我以上面的一条有代表性的题教你算了.
(2)Cr3+ + PbO2 → Cr2O72- + Pb2+
先把两边的元素的比例配好,而且得先考虑是化合物形态的离子先配,符合条件的是PbO和Cr2O72-,先配O,左边2个O,右边7个O,所以左边的O前得加7,右边加2,变成:
Cr3+ + 7PbO2 → 2Cr2O72- + Pb2+
剩下的就把单个离子Cr3+ ,Pb2+按照元素守恒原则配.例如左边现在1个Cr,右边有4个Cr,所以得在左边的Cr3+前加上4
.最终配好的就是这样
4Cr3+ + 7PbO2 → 2Cr2O72- + 7Pb2+
算左右两边的电荷数,左边12+,右边14+ + 2- =12+.离子式配好.
其它的也可以按照这种思路来做.这是最简单的离子配平,还有很多方法,例如电荷守恒
方法都是靠作题做出来的.其它题自己做.慢慢摸索.总有天你就会变牛B的1年前查看全部
- 关于结晶水,判断结晶水的个数.题文:六价铬对人体有毒,含铬废水要经过化学处理后才能排放.工业上为处理含有Cr2O72-的
关于结晶水,判断结晶水的个数.
题文:六价铬对人体有毒,含铬废水要经过化学处理后才能排放.工业上为处理含有cr2o72-的酸性废水采用如下方法:在工业废水中加入适量nacl,然后以铁为电极电解,鼓入空气,最后将cr2o72-以cr(oh)3形式沉淀下来而除去,且还生成fe(oh)3沉淀,这种处理方法可使工业废水中的cr2o72-含量达到***规定的排放标准.
试回答:
(1)在工业废水中加入nacl的作用是____.
(2)有关的电极反应式是____.
(3)由cr2o72-转化为cr3+的离子方程式是___.
(4)电解过程中工业废水由酸性变碱性的原因是___.
(5)另一种处理含铬废水的方法是用绿矾 [feso4·7h2o]把废水中的六价铬还原成铬离子,再加入过量石灰水,使铬离子转为氢氧化铬[cr(oh)3]沉淀,其主要反应的化学方程式如下:
h2cr2o7+6feso4+6h2so4=3fe2(so4)3+ cr2 (so4)3+7h2o
现用上法处理1×104 l含铬(+6价)78 mg·l-1 的废水(cr的相对原子质量为52),
试回答:
①处理后沉淀除cr(oh)3外,还有__ (用化学式来表示).
②需用绿矾多少千克?____.
(1)增强废水的导电能力
(2)阳极:fe-2e-=fe2+
阴极:2h++2e-=h2↑
(3) cr2o72- +6fe2+ +14h+=2cr3+ +7h2o +6 fe3+
(4)电解过程中,由于h+放电,因而破坏了水的电离平衡,导致溶液中c( oh-)>c(h+),因而废水 由酸性变为碱性
(5)①fe(oh)3和caso4·2h2o
②12.51 kg
看第五问,得出了硫酸钙沉淀是很明显,但是如何判断结晶水的个数.是根据硫酸钙常有的特性(即是不是硫酸钙的结晶水一般是两个),还是具体的计算?
题目较长较多,希望回答者耐心回答, S雨华茶1年前1
S雨华茶1年前1 -
 ee456 共回答了18个问题
ee456 共回答了18个问题 |采纳率83.3%考试时,有时间计算,没时间直接写.因为硫酸钙一般有两个结晶水,可以查阅参考书.平时做题还是算算比较好.1年前查看全部
- 为了治理废水中Cr2O72-的污染,常先加入试剂使之变为Cr3+,该试剂为( )
为了治理废水中Cr2O72-的污染,常先加入试剂使之变为Cr3+,该试剂为( )
A. NaOH溶液
B. FeCl3溶液
C. Al2(SO4)3溶液
D. Na2SO3和H2SO4 幽-火1年前1
幽-火1年前1 -
 熙薇 共回答了14个问题
熙薇 共回答了14个问题 |采纳率92.9%解题思路:Cr2O72-中Cr元素化合价为+6价,加入试剂使之变为Cr3+,则Cr元素化合价降低,应加入还原剂,以此解答该题.Cr2O72-中Cr元素化合价为+6价,加入试剂使之变为Cr3+,则Cr元素化合价降低,应加入还原剂,题中只有Na2SO3具有还原性,加入硫酸,Cr2O72-可在酸性条件下与Na2SO3发生氧化还原反应,
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,侧重于基础知识和分析能力的考查,本题可从元素化合价的角度认识氧化还原反应的相关概念和物质的性质.1年前查看全部
- 在K2CrO4的溶液中存在着如下的平衡:2CrO42-+2H+?Cr2O72-+H2O,K=1×1014.若用0.05m
在K2CrO4的溶液中存在着如下的平衡:2CrO42-+2H+?Cr2O72-+H2O,K=1×1014.若用0.05mol K2Cr2O7配制成1L
在K2CrO4的溶液中存在着如下的平衡:2CrO42-+2H+?Cr2O72-+H2O,K=1×1014.若用0.05mol K2Cr2O7配制成1L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH( )
A.>7
B.<7
C.=7
D.无法确定
 limgk1年前1
limgk1年前1 -
 天才北斗 共回答了19个问题
天才北斗 共回答了19个问题 |采纳率84.2%若用0.05mol K2Cr2O7配制成1L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,平衡状态生成CrO42-浓度=0.05mol/L-10-5mol/L,
结合反应平衡常数计算式计算得到:
10?5
(0.05?10?5)2×c2(H+)=1×1014,c(H+)≈2×10-10mol/L,溶液pH>7,
故选A.1年前查看全部
- Cr2O72-在酸性溶液中与二价铁离子反应么?
Cr2O72-在酸性溶液中与二价铁离子反应么?
Cr2O72-是读作铬酸根还是重铬酸根呢? befk1年前1
befk1年前1 -
 zlf781123 共回答了16个问题
zlf781123 共回答了16个问题 |采纳率87.5%重铬酸根
与Fe2+反应,酸性条件下Cr2O72-是一种较强的氧化剂1年前查看全部
- 请问Cr(III)和Cr(VI)在水中溶解度为多少呢?(包括Cr2O72-和CrO42-)
请问Cr(III)和Cr(VI)在水中溶解度为多少呢?(包括Cr2O72-和CrO42-)
追问一个细节,溶解度最高的是什么化学式呢?例如,是不是K2Cr2O7,那它的溶解度是多少呢 珍珠泪滴1年前1
珍珠泪滴1年前1 -
 鱼是hh滴 共回答了18个问题
鱼是hh滴 共回答了18个问题 |采纳率94.4%单纯的离子是没办法说溶解度的.他必须与其他离子共同存在,而其他离子的存在会影响整体的溶解度.例如CrCl3 与 CrF3的溶解度就不一样.1年前查看全部
- 工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解
工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准.请回答下列问题.
(1)两极发生的电极反应式:阳极:______,阴极:______.
(2)写出Cr2O72-变为Cr3+的离子方程______.
(3)工业废水由酸性变为碱性的原因______.
(4)______(填“能”或“不能”)改用石墨电极. fschgj1年前1
fschgj1年前1 -
 冬泳者 共回答了24个问题
冬泳者 共回答了24个问题 |采纳率91.7%解题思路:(1)Fe为电极进行电解时,阳极上铁失电子发生氧化反应,阴极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成;
(2)酸性条件下,Cr2O72-和亚铁离子发生氧化还原反应,生成铁离子和铬离子;
(3)阴极上及发生氧化还原都消耗氢离子;
(4)如果改用石墨作电极,则阳极不能生成亚铁离子,导致无法生成铬离子.(1)Fe为电极进行电解时,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上氢离子得电子发生还原反应,即2H++2e-═H2↑,故答案为:Fe-2e-═Fe2+;2H++2e-═H2↑;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)阴极反应消耗H+,溶液中的氧化还原反应也消耗H+,导致溶液中氢离子浓度降低,从而使溶液pH升高,
故答案为:阴极反应消耗H+,溶液中的氧化还原反应也消耗H+,使溶液pH升高;
(4)若用石墨做电极,则无法产生还原剂Fe2+,从而使Cr2O72-无法还原为Cr3+变成沉淀除去,所以不能用石墨作电极,故答案为:不能.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解池原理的应用,还涉及氧化还原反应等知识点,明确各个电极上发生的反应是解本题关键,注意:活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子失电子,为易错点,题目难度中等.1年前查看全部
- (2014•汕头二模)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.三种金属离子生成沉
 (2014•汕头二模)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.三种金属离子生成沉淀的pH如表.
(2014•汕头二模)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.三种金属离子生成沉淀的pH如表.
(1)某含铬废水处理的主要流程如图所示:开始沉淀的pH 完全沉淀的pH Fe(OH)2 7.0 9.0 Fe(OH)3 1.9 3.2 Cr(OH)3 6.0 8.0 
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______.
②请补充并配平以下反应池中发生主要反应的离子方程式:
______Cr2O72-+______HSO3-+______═______Cr3++______SO42-+______H2O.
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和______.证明Cr3+沉淀完全的方法是______.
(2)工业可用电解法来处理含Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑.
①Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是______,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因______.
③若溶液中含有0.01mol Cr2O72-,则阳离子全部生成沉淀的物质的量是______mol. lonelylovers1年前1
lonelylovers1年前1 -
 会人伯 共回答了19个问题
会人伯 共回答了19个问题 |采纳率94.7%解题思路:(1)含Cr2O72-废水中加入明矾,铝离子水解生成具有吸附性的氢氧化铝,可除去水的悬浮物杂质,然后加入硫酸和亚硫酸钠,在酸性条件下发生 Cr2O72-+3 HSO3-+5H+=2 Cr3++3 SO42-+4 H2O,充分反应后,加入氢氧化钠溶液可生成Cr(OH)3沉淀,分离后可达到排放的目的;
(2)Fe2+离子与Cr2O72-离子发生氧化还原反应生成Fe3+离子和Cr3+离子;随着电解进行,溶液中c(H+) 逐渐减少,c(OH-)浓度增大;
根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓进行计算.(1)①K2SO4﹒Al2(SO4)3﹒24H2O为强电解质,在溶液中完全电离,生成Al3+和SO42-、K+,Al3+能水解生成氢氧化铝胶体:Al3++3H2O=Al(OH)3(胶体)+3H+或Al3++3H2O⇌Al(OH)3+3H+,氢氧化铝胶体具有吸附性,能吸附水中的悬浮物,所以能作净水剂,
故答案为:Al3++3H2O⇌Al(OH)3+3H+;
②反应中,Cr2O72-中铬元素化合价变化为:+6→+3,化合价降低了3价,Cr2O72-中含有两个铬原子,至少降低6价;
HSO3-中硫元素化合价变化为:+4→+6,化合价升高了(6-4)=2价,化合价变化的最小公倍数为6,所以Cr2O72-的化学计量数为1,亚硫酸氢根离子计量数为3,铬离子计量数为2,硫酸根离子计量数为3,再根据电荷守恒,氢离子计量数为5,最后根据质量守恒判断,未知物为水,计量数为4,配平后的方程式为:Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O,
故答案为:1;3;5;2;3;4;
③向转化后的废水中加入NaOH溶液,NaOH会和H+发生反应H++OH-═H2O,Cr3+与NaOH发生反应Cr3++3OH-═Cr(OH)3↓,根据表中数据可知,Cr(OH)3沉淀完全时,溶液的pH为8,所以测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全,
故答案为:Cr3++3OH-=Cr(OH)3↓;取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全;
(2)①亚铁离子与Cr2O72-发生氧化还原反应,Cr2O72-被还原为Cr3+,然后Cr3+生成Cr(OH)3沉淀,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,反应的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②随着电解进行,溶液中c(H+) 逐渐减少,打破了水的电离平衡,促进了水的电离,使溶液中OH-浓度增大,溶液的碱性增强,生成Fe(OH)3和Cr(OH)3沉淀,金属阳离子在阴极区可沉淀完全,
故答案为:水中的H+在阴极区放电,H+浓度减小促使水的电离平衡H2O⇌H++OH-向右移动,阴极区OH-浓度增大与金属阳离子在阴极区结合而沉淀完全;
③根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓知0.01mol Cr2O72-,可生成0.02molCr(OH)3,0.06molFe(OH)3,共0.08mol,
故答案为:0.08.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;氧化还原反应方程式的配平;难溶电解质的溶解平衡及沉淀转化的本质;电解原理.
考点点评: 本题考查了探究物质的组成、电解原理等知识,题目难度较大,试题综合性较强,涉及了电解原理、氧化还原反应配平、化学方程式的计算等问题,培养了学生的分析、理解能力及灵活应用所学知识解决问题的能力,有利于提高学生的实验设计能力和应试能力,提升学生的学科素养.1年前查看全部
- 在重铬酸钾(K2 Cr2O7)水溶液中橙红色的Cr2O72-与黄色的CrO42-有以下平衡关系:
在重铬酸钾(K2 Cr2O7)水溶液中橙红色的Cr2O72-与黄色的CrO42-有以下平衡关系:
Cr2O72-(aq)+H2O(l)⇌2CrO42-(aq)+2H+(aq)
(1)写出上述反应的平衡常数表达式:K=c2(CrO42−)•c2(H+) c(Cr2O72−) c2(CrO42−)•c2(H+) c(Cr2O72−)
(2)向重铬酸钾中加入少量NaOH固体,溶液呈______色.
(3)向(2)所得的溶液中加入过量的稀硫酸,则溶液呈______色,因为______
(4)向原溶液中加入Ba(NO3)2溶液(Ba CrO4为难溶性黄色沉淀),则平衡______(填“正向移动”、“逆向移动”或“不移动”),溶液颜色将______. AD18811年前1
AD18811年前1 -
 neouu 共回答了24个问题
neouu 共回答了24个问题 |采纳率83.3%解题思路:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,水不需要写出,据此书写;
(2)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动;
(3)加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大;
(4)向原溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,结合平衡移动原理解答.(1)根据化学平衡常数的定义,可知Cr2O72-(aq)+H2O(l)⇌2CrO42-(aq)+2H+(aq)的平衡常数K=
c2(CrO42−)•c2(H+)
c(Cr2O72−),故答案为:
c2(CrO42−)•c2(H+)
c(Cr2O72−);
(2)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液呈黄色,故答案为:黄;
(3)加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色,
故答案为:橙红色;加入酸,H+浓度增大,平衡左移,Cr2O72-浓度增大,溶液呈橙红色;
(4)向原溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,平衡正向移动,溶液的颜色变浅,
故答案为:正向移动;变浅.点评:
本题考点: 化学平衡的影响因素;用化学平衡常数进行计算.
考点点评: 本题考查化学平衡的影响因素,比较基础,注意对化学平衡移动原理的理解.1年前查看全部
- 某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为
某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀经干燥后得到n mol FeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(y+1)mol
B.处理废水中Cr2O72-的物质的量为nx mol或ny/3 mol
C.反应中发生转移的电子数为ny mol
D.在FeO•FeyCrxO3中,若x=0.5,则y=1.5 wangzhuoer20011年前1
wangzhuoer20011年前1 -
 123764749 共回答了15个问题
123764749 共回答了15个问题 |采纳率80%解题思路:A.由铁元素守恒,求出消耗硫酸亚铁的物质的量,结合电子转移守恒或FeO•FeyCrxO3电中性找出x与y,代入硫酸亚铁的物质的量计算;
B.反应的铬元素完全转化为沉淀,根据铬原子守恒计算;
C.Cr2O72-中Cr为+6价,被还原为+3价Cr,每个Cr原子得3个电子,计算出Cr原子物质的量,转移电子为Cr原子物质的量3倍;
D.根据失电子守恒计算.A.由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),故A正确;
B.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为[nx/2]mol,故B错误;
C.得到nmolFeO•FeyCrxO3,则一共有nymolFe被氧化,化合价由+2价升高为+3价,则转移的电子数为nymol,故C正确;
D、FeO•FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,若x=0.5,则y=1.5,故D正确.
故选:B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高考高频考点,题目难度中等,注意原子守恒、电子守恒在计算中的应用,使计算简单化.1年前查看全部
- 在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则1mol Cr3+反应所需PbO2的物
在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则1mol Cr3+反应所需PbO2的物质的量是( )
A. 3.0mol
B. 1.5mol
C. 1.0mol
D. 0.75 mol 小楼ing1年前1
小楼ing1年前1 -
 雪蝴蝶1982 共回答了19个问题
雪蝴蝶1982 共回答了19个问题 |采纳率89.5%解题思路:反应中PbO2→Pb2+,Pb元素的化合价由+4价降低为+2,Cr3+→Cr2O72-,Cr元素的化合价由+3价升高为+6价,根据电子转移守恒计算1mol Cr3+反应所需PbO2的物质的量.反应中PbO2→Pb2+,Pb元素的化合价由+4价降低为+2,Cr3+→Cr2O72-,Cr元素的化合价由+3价升高为+6价,
令1mol Cr3+反应所需PbO2的物质的量为n,根据电子转移守恒,则:
1mol×(6-3)=n×(4-2)
解得:n=1.5mol
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的有关计算,难度不大,注意氧化还原反应计算中守恒思想的运用.1年前查看全部
- 能说明反应达平衡状态的是.2v(Cr2O72-)=v(CrO42-)
能说明反应达平衡状态的是.2v(Cr2O72-)=v(CrO42-)
能说明反应2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
达平衡状态的是.2v(Cr2O72-)=v(CrO42-)不对吗? yw55351年前2
yw55351年前2 -
 啥名都被抢了 共回答了16个问题
啥名都被抢了 共回答了16个问题 |采纳率100%严谨的说 速率有正逆之分,若上式2v(Cr2O72-)为正反应 v(CrO42-)为正反应则含义相同 若是二者一正一逆,则含义不相同,对
楼下理论对,但你变一下位置v(CrO42-)/v(Cr2O72-)=2:1,不对吗?1年前查看全部
- 求pH=1,其它离子浓度为1 mol•L-1时,电池反应6Fe2++Cr2O72-+14H+== 6Fe3+
求pH=1,其它离子浓度为1 mol•L-1时,电池反应6Fe2++Cr2O72-+14H+== 6Fe3++2Cr3++ 7H2O
求pH=1,其它离子浓度为1 mol·L-1时,电池反应6Fe2++Cr2O72-+14H+== 6Fe3++2Cr3++ 7H2O 的电动势和平衡常数各是多少?(已知 (Cr2O72-/Cr3+)=1.33V,(Fe3+/Fe2+=0.77V) 粉红色郎1年前1
粉红色郎1年前1 -
 宇喜多秀次 共回答了23个问题
宇喜多秀次 共回答了23个问题 |采纳率95.7%标准状态下(都是1mol/L)直接E=E(+)-E(-)=1.33-0.77=0.56V即为电动势.平衡常数的公式是lgK=6*0.56除以0.0591=4.84*10^51年前查看全部
- Cr2O72-与FeSO4反应的化学方程式
 264173521年前3
264173521年前3 -
 开尽梨花春又来2 共回答了22个问题
开尽梨花春又来2 共回答了22个问题 |采纳率90.9%重铬酸根具有氧化性,亚铁离子具有还原性,他们会在酸性条件下反应.
方程式是:
Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H20.
希望对你有所帮助!1年前查看全部
- 工业上常用Fe做电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去.某科研小组用该原理处
工业上常用Fe做电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去.某科研小组用该原理处理污水,设计装置如图所示.下列说法不正确的是( )
 A. 燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96L
A. 燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96L
B. 实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4
C. 该燃料电池正极的电极反应式为:O2+4e-+2CO2=2CO32-
D. 甲中阳极附近溶液中的离子反应方程式是:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O q7yq1年前1
q7yq1年前1 -
 浪竟_天崖 共回答了24个问题
浪竟_天崖 共回答了24个问题 |采纳率87.5%解题思路:A.甲中C电极发生2H2O=H2↑+2OH-,利用CH4~8e-~4H2↑来计算;
B.离子浓度越大,导电性越强;
C.电解质为碳酸盐,燃料电池的正极上氧气得到电子;
D.亚铁离子具有还原性,Cr2O72-具有氧化性,发生氧化还原反应.A.甲中C电极发生2H2O=H2↑+2OH-,由CH4~8e-~4H2↑可知,1.6gCH4参加反应,则甲中C电极理论上生成气体体积为[1.6g/16g/mol]×4×22.4L/mol=8.96L,故A正确;
B.离子浓度越大,导电性越强,则若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4来增强导电性,故B正确;
C.电解质为碳酸盐,燃料电池的正极上氧气得到电子,正极反应为O2+4e-+2CO2=2CO32-,故C正确;
D.亚铁离子具有还原性,Cr2O72-具有氧化性,发生氧化还原反应,甲中阳极附近溶液中的离子反应方程式为Cr2O72-+6Fe2++7H2O+10OH-=2Cr(OH)3↓+6Fe(OH)3↓,故D错误;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池、电解池及氧化还原反应,明确发生的电极反应是解答本题的关键,注意选项D中阳极上生成沉淀来处理污水,注重学生获取信息和应用信息的能力,题目难度中等.1年前查看全部
- 工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解
工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准.请回答下列问题.
(1)两极发生的电极反应式:阳极:______,阴极:______.
(2)写出Cr2O72-变为Cr3+的离子方程______.
(3)工业废水由酸性变为碱性的原因______.
(4)______(填“能”或“不能”)改用石墨电极. 热-HOT1年前1
热-HOT1年前1 -
 得成_gg 共回答了15个问题
得成_gg 共回答了15个问题 |采纳率93.3%解题思路:(1)Fe为电极进行电解时,阳极上铁失电子发生氧化反应,阴极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成;
(2)酸性条件下,Cr2O72-和亚铁离子发生氧化还原反应,生成铁离子和铬离子;
(3)阴极上及发生氧化还原都消耗氢离子;
(4)如果改用石墨作电极,则阳极不能生成亚铁离子,导致无法生成铬离子.(1)Fe为电极进行电解时,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上氢离子得电子发生还原反应,即2H++2e-═H2↑,故答案为:Fe-2e-═Fe2+;2H++2e-═H2↑;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)阴极反应消耗H+,溶液中的氧化还原反应也消耗H+,导致溶液中氢离子浓度降低,从而使溶液pH升高,
故答案为:阴极反应消耗H+,溶液中的氧化还原反应也消耗H+,使溶液pH升高;
(4)若用石墨做电极,则无法产生还原剂Fe2+,从而使Cr2O72-无法还原为Cr3+变成沉淀除去,所以不能用石墨作电极,故答案为:不能.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解池原理的应用,还涉及氧化还原反应等知识点,明确各个电极上发生的反应是解本题关键,注意:活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子失电子,为易错点,题目难度中等.1年前查看全部
- Cr2O72- + Fe2+ + H+ = Cr3+ + Fe3+ + H2O 配平
 houtianlun1年前4
houtianlun1年前4 -
 ufoufo 共回答了16个问题
ufoufo 共回答了16个问题 |采纳率87.5%Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O1年前查看全部
- 已知重铬酸根(Cr2O72-)和铬酸根(CrO42-)离子间存在如下平衡:Cr2O72-(橙色)+H2O⇌2CrO42-
已知重铬酸根(Cr2O72-)和铬酸根(CrO42-)离子间存在如下平衡:Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+△H<0
向试管中加入4mL 0.1mol/L K2Cr2O7溶液,溶液为橙色,下列措施会使溶液变为黄色的是
①滴加1mL1mol/L K2Cr2O7溶液
②滴加数滴1mol/L NaOH溶液
③滴加数滴1mol/L HNO3溶液
④加热
⑤加催化剂.
A.①②
B.①②④
C.③④⑤
D.② 周佳卉1年前1
周佳卉1年前1 -
 朱朱七七 共回答了17个问题
朱朱七七 共回答了17个问题 |采纳率100%解题思路:重铬酸根(Cr2O72-)和铬酸根(CrO42-)离子间存在如下平衡:Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+△H<0,要使得溶液变为黄色,则是化学平衡正向移动的条件都是可以的,然后根据外界条件对化学平衡的影响据此分析解答.①滴加1mL1mol/L K2Cr2O7溶液,会使平衡正向移动,但是重铬酸根离子浓度增大,溶液显示橙色加深,故错误;
②滴加数滴1mol/L NaOH溶液,会消耗氢离子,使得平衡正向移动,使溶液变为黄色,故正确;
③滴加数滴1mol/L HNO3溶液,使得氢离子浓度增大,所以平衡逆向移动,使溶液变为橙色,故错误;
④加热会使化学平衡逆向移动,使溶液变为橙色,故错误;
⑤加催化剂不会改变化学平衡的移动,溶液颜色不变,故错误.
故选D.点评:
本题考点: 影响盐类水解程度的主要因素.
考点点评: 本题考查化学平衡移动的影响,易错选项是A,注意Cr2O72-能氧化氯离子,为易错点.1年前查看全部
- 工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.废水pH与Cr2O72-转化为C
工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.废水pH与Cr2O72-转化为Cr3+的关系如图1,实验室模拟工业电解法处理含铬废水的装置如图2:
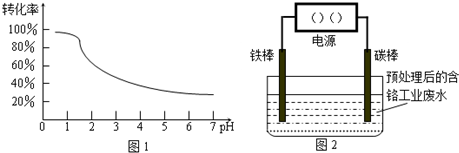
请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是______.
(2)在图2中连接铁棒的一极是电源的______极.
(3)实验中除能观察到废水颜色发生变化外,还能观察到的现象是______.
表一:
(4)当废水颜色不再发生明显变化时,切断电源,取出电极,再调节电解液的pH至8左右.调节pH的目的是______.沉淀物 Fe(OH)3 Fe(OH)2 Cr(OH)3 Al(OH)3 开始沉淀 2.7 7.5 4.3 3.4 完全沉淀 4.1 9.7 5.6 5.2
(5)含铬废水国家排放标准为
含量≤0.1000mg/L.取上述电解后的废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL.已知酸性条件下,I-被Cr2O72-氧化的产物为I2.用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准______.+6 Cr  free_cheng1年前1
free_cheng1年前1 -
 sxxylrq 共回答了23个问题
sxxylrq 共回答了23个问题 |采纳率100%解题思路:(1)根据废水pH与Cr2O72-转化为Cr3+的关系图1分析;
(2)在电解池中,阳极是活泼金属电极时,则电极本身失去电子,以此来解答;
(3)阴极上是电解质中阳离子得电子的反应,重铬酸根离子具有强氧化性,亚铁离子具有还原性,生成Fe3+,Cr3+,Fe3+、Cr3+转化为氢氧化物沉淀;
(4)根据Cr(OH)3、Fe(OH)3沉淀的PH值进行解答;
(5)根据Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O计算;(1)根据废水pH与Cr2O72-转化为Cr3+的关系图1可知:当pH为1时,Cr2O72-转化为Cr3+的转化率接近100%,
故答案为:调节pH为1左右;
(2)亚铁离子与Cr2O72-发生氧化还原反应被还原为Cr3+,在电解池中,阳极是活泼金属电极时,则电极本身失去电子,所以须用Fe做电极进行电解,阳极发生Fe-2e-=Fe2+,与电源正极相连的为阳极,
故答案为:正;
(3)在电解池中,阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,阴极,根据放电顺序阴极上是电解质中氢离子得电子的反应,即2H++2e=H2↑,所以阴极区产生沉淀,Fe3++3OH-═Fe(OH)3↓,Cr3++3OH-═Cr(OH)3↓,
故答案为:阴极区产生沉淀;
(4)由氢氧化铁和氢氧化铬沉淀的pH表可知,氢氧化铁完全沉淀pH应控制在4.1,氢氧化铬完全沉淀pH应控制在5.6,调节电解液的pH至8左右,目的使溶液中的Fe3+、Cr3+全部转化为氢氧化物沉淀,
故答案为:使溶液中的Fe3+、Cr3+全部转化为氢氧化物沉淀;
(5)废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL,Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,
1 6
n(Cr2O72-)9×10-3L×0.0001mol/L n(Cr2O72-)=1.5×10-7mol,废水1L中n(Cr2O72-)=7.5×10-7mol,废水1L中n(
+6
Cr)=1.5×10-6mol,电解后的废水中
+6
Cr含量=1.5×10-6mol×52g/mol=0.0780 mg/L,符合国家排放标准为
+6
Cr含量≤0.1000mg/L,
故答案为:符合;点评:
本题考点: 金属的回收与环境、资源保护;难溶电解质的溶解平衡及沉淀转化的本质;电解原理.
考点点评: 本题考查较为综合,涉及氧化还原反应、电解、化学计算等,需要学生具备扎实的基础知识,平时注意培养分析和解决问题的能力,题目难度中等.1年前查看全部
- 已知下列物质都能氧化H2S,它们氧化H2S时自身分别发生下列变化:Fe3+→Fe2+,Cr2O72-→2Cr3+,Br2
已知下列物质都能氧化H2S,它们氧化H2S时自身分别发生下列变化:Fe3+→Fe2+,Cr2O72-→2Cr3+,Br2→2Br-,HNO3→NO.如要氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最小的是
A.Fe3+ B.Br2 C.Cr2O72- D.HNO3
这个根据什么啊 查考勤1年前3
查考勤1年前3 -
 布谷蛇 共回答了16个问题
布谷蛇 共回答了16个问题 |采纳率100%选C,这个主要看得电子数目的多少,得电子越多,需要物质的物质的量最小.
A.Fe3+→Fe2+ 1
B.Br2→2Br- 2
C.Cr2O72-→2Cr3+ 6
D.HNO3→NO 5
所以选C.1年前查看全部
- 工业上处理含Cr2O72-的酸性工业废水用以下方法:
工业上处理含Cr2O72-的酸性工业废水用以下方法:
①往工业废水中加入适量的NaCl,搅拌均匀;
②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,
③过滤回收沉淀,废水达排放标准.试回答:
(1)写出Cr2O72-转变成Cr3+的离子反应______
(2)能否将Fe电极改成石墨电极?为什么?______
(3)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板.有关反应为:2FeCl3+Cu═2FeCl2+CuCl2.现将一块敷有铜箔的绝缘板浸入8.00×102mL某FeCl3溶液A中,一段时间后,将该线路板取出,向所得的溶液B中加入铁粉100.0g,充分反应后剩余固体质量为96.8g,把固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol•L-1 AgNO3溶液60.00mL时,溶液中的Cl-恰好完全沉淀.
计算:溶液A中FeCl3的物质的量浓度为______.溶液B中FeCl2的物质的量浓度为______.(要有计算过程,注意有效数字) hjxyz881年前1
hjxyz881年前1 -
 月之zz 共回答了21个问题
月之zz 共回答了21个问题 |采纳率90.5%解题思路:用Fe为电极进行电解,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上是阳离子发生得电子的还原反应,即2H++2e-═H2↑.
(1)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为Cr3+,据此书写方程式;
(2)铁失去电子得到的阳离子是亚铁离子,该离子具有还原性,能和重铬酸根之间发生反应,改用石墨不能生成还原性离子;
(3)依据反应过程分析,最后溶液中加入硝酸银溶液生成氯化银沉淀,氯元素守恒可以直接计算原溶液A中氯化铁的浓度,氯化铁溶解铜生成氯化亚铁和氯化铜,加入铁粉发生的反应为①2Fe3++Fe=3Fe2+,②Fe+Cu2+=Fe2++Cu,引起质量变化的原因是反应①固体质量减小,反应②固体质量增加,结合质量变化和化学方程式列式计算.(1)Cr2O72-转变成Cr3+的离子反应是被阳极生成的亚铁离子在酸性溶液中还原,Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为Cr3+,反应的离子方程式为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(2)因为Fe电极在电解过程中产生还原性的Fe2+,将溶液中Cr2O72-还原为Cr3+而除去,若用石墨电极来代替Fe电极,在阳极上失去电子的是氯离子,不能生成还原性离子,不能和重铬酸根之间发生反应,
故答案为:不能,因为Fe电极在电解过程中产生还原性的Fe2+,将溶液中Cr2O72-还原为Cr3+而除去,若改用石墨电极,不能产生还原性微粒;
(3)从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol•L-1 AgNO3溶液60.00mL时,溶液中的Cl-恰好完全沉淀,依据氯元素守恒20ml溶液中氯离子物质的量n(Cl-)=n(Ag+)=3.00mol/L×0.060L=0.18mol,所以原溶液800ml中含有氯离子物质的量为0.18mol×[800/20]=7.2mol,n(FeCl3)=[1/3]n(Cl-)=2.4mol
溶液A中FeCl3的物质的量浓度=[2.4mol/0.8L]=3mol/L,加入铁粉发生的反应为①2Fe3++Fe=3Fe2+,②Fe+Cu2+=Fe2++Cu,引起质量变化的原因是反应①固体质量减小,反应②固体质量增加,设B溶液中亚铁离子物质的量为x,则溶解的铜物质的量为0.5x,
①2Fe3++Fe=3Fe2+,固体质量减少
2 56g
2.4mol-x 28(2.4-x)g
②Fe+Cu2+=Fe2++Cu,固体质量增加
1( 64-56)g
0.5x 0.5x(64-56)
则 28(2.4-x)g-0.5x(64-56)=100g-96.8g=3.2g
x=2mol
溶液B中c(FeCl2)=[2mol/0.8L]=2.5mol/L;
故答案为:3.00mol•L-1; 2.50 mol•L-1.点评:
本题考点: 离子方程式的书写;化学方程式的有关计算;电解原理.
考点点评: 本题考查学生电解池的工作原理以及氧化还原反应型离子方程式的书写方法等知识,氧化还原反应过程中化学方程式的计算应用是本题难点,题目难度中等.1年前查看全部
- 某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应后铁元素和铬元素完全转化为
某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应后铁元素和铬元素完全转化为沉淀.该沉淀经干燥后得到n mol FeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁的物质的量为n(2-x)mol
B. 处理废水中的Cr2O72-的物质的量为[nx/2]mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO•FeyCrxO3中,3x=y 山下1年前1
山下1年前1 -
 有的枫叶 共回答了22个问题
有的枫叶 共回答了22个问题 |采纳率100%解题思路:A、由铁元素守恒,求出消耗硫酸亚铁的物质的量,结合电子转移守恒或FeO•FeyCrxO3电中性找出x与y,代入硫酸亚铁的物质的量计算;
B、反应的铬元素完全转化为沉淀,根据铬原子守恒计算;
C、Cr2O72-中Cr为+6价,被还原为+3价Cr,每个Cr原子得3个电子,计算出Cr原子物质的量,转移电子为Cr原子物质的量3倍;
D、根据失电子守恒计算.A、由铁元素守恒,消耗硫酸亚铁的物质的量为n(y+1),又由FeO•FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,故A错误;
B、根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为[nx/2],故B正确;
C、得到nmolFeO•FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,故C正确;
D、FeO•FeyCrxO3中,Cr为正三价,由得失电子守恒知3x-y=0,即3x=y,故D正确.
故选A.点评:
本题考点: 电解原理.
考点点评: 考查原子守恒、电子守恒,难度较大,注意在计算中守恒思想的应用,使计算简单化.1年前查看全部
- 当用电解法除去溶液中的Cr2O72-时,因其具有强氧化性易得电子,故可在阴极 放电生成Cr3+,最后生成Cr(OH)3沉
当用电解法除去溶液中的Cr2O72-时,因其具有强氧化性易得电子,故可在阴极 放电生成Cr3+,最后生成Cr(OH)3沉淀除去.
为什么错! 063007001491年前1
063007001491年前1 -
 半夜加水 共回答了14个问题
半夜加水 共回答了14个问题 |采纳率100%请注意Cr2O72-是带负电的,所以只要通电就会向正极移动,没有机会接触到阴极.不能在阴极得电子1年前查看全部
- 在下列平衡2CrO42-(黄色)+2H+⇌Cr2O72-(橙红色)+H2O中,溶液介于黄和橙红色之间,今欲增加溶液的橙红
在下列平衡2CrO42-(黄色)+2H+⇌Cr2O72-(橙红色)+H2O中,溶液介于黄和橙红色之间,今欲增加溶液的橙红色,则要在溶液中加入( )
A. H+
B. OH-
C. K+
D. H2O 0kyb65c21年前1
0kyb65c21年前1 -
 联通994 共回答了19个问题
联通994 共回答了19个问题 |采纳率94.7%解题思路:欲增加溶液的橙红色,则平衡应该向正反应方向移动,可以采用增大反应物浓度的方法.A.向溶液中加入氢离子,氢离子浓度增大,平衡向正反应方向移动导致溶液橙红色加深,故A正确;
B.向溶液中加入氢氧根离子,氢氧根离子和氢离子反应导致氢离子浓度降低,平衡向逆反应方向移动,则溶液橙红色变浅,故B错误;
C.向溶液中加入钾离子,钾离子不参加反应,所以对平衡无影响,故C错误;
D.向溶液中加入水,导致Cr2O72-浓度降低,则溶液橙红色变浅,故D错误;
故选A.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了外界条件对化学反应平衡的影响,难度不大,根据勒夏特里原理来分析解答即可.1年前查看全部
- 已知在K2Cr2O7的溶液中存在着如下平衡:Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+,加入下列物质
已知在K2Cr2O7的溶液中存在着如下平衡:Cr2O72-(橙色)+H2O⇌2CrO42-(黄色)+2H+,加入下列物质能使溶液变为橙色的是( )
A.氨水
B.硫酸
C.NaOH
D.水 kktt军1881年前1
kktt军1881年前1 -
 是光一定会灿烂 共回答了21个问题
是光一定会灿烂 共回答了21个问题 |采纳率81%解题思路:根据反应方程式知,若要使溶液变为橙色,则加入的物质能使平衡向逆反应方向移动,据此分析解答.A.加入氨水,氨水和氢离子反应使平衡向正反应方向移动,溶液变为黄色,故A错误;
B.加入硫酸,硫酸根离子和Cr2O72-不反应,氢离子浓度增大,平衡向逆反应方向移动,溶液变为橙色,故B正确;
C.加入NaOH,NaOH和氢离子反应使平衡向正反应方向移动,溶液变为黄色,故C错误;
D.加水稀释溶液,促进Cr2O72-水解,所以平衡向正反应方向移动,橙色变浅,故D错误;
故选B.点评:
本题考点: 影响盐类水解程度的主要因素.
考点点评: 本题考查了影响化学平衡移动的因素,注意根据题意分析平衡的移动方向,题目难度不大.1年前查看全部
大家在问
- 11、求极限lim[(根号下n^2-1)-n]/[n-(根号下n^2+1)]的值
- 2根据句意填词.1 根据句意填词. 1.Who do you want to go _______ to Yunnan?2
- 3四年级上册第四单元日积月累成语意思
- 4爱的表达 作文从小到大,我们沐浴过多少爱呢?数不清.你对一直疼爱,呵护你的爸爸妈妈表达过爱吗?今天回家做一件事,想一想爸
- 5据此回答下列问题。(8分)2009年10月1日,天安门广场上首次参加国庆游行的“宝岛台湾彩车”吸引了观众的眼球,彩车上代
- 6制折线统计图的步骤与条形统计图基本相同( )
- 7(2004•北京)如图中的实验表明:在通电导线周围存在着______.
- 8她星期二有什么课?哦,她有数学和英语。(英语翻译)
- 9含鸟名的诗句
- 10求过直线l1:x-2y+3=0与直线l2:2x+3y-8=0的交点,且到点P(0,4)的距离为1的直线l的方程
- 11单元内容填空。 1.本组课文为我们展示了一幅幅多姿多彩的异国风情画卷:有________的德国人;有把小艇当作
- 12试说明:无论x,y为何值时,多项式x(2)+y(2)-2x+6y+10的值恒为非负数 括号内的数是平方
- 13生物入侵者第三段在材料安排有什么不同
- 14drive的完成时是什么
- 15“Goldilocks”中文意思是什么?在一个句子里可以直接用这个英文吗?
