鸡蛋壳与硫酸发生的化学反应方程式怎么写?
 LEO冷寒2022-10-04 11:39:541条回答
LEO冷寒2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 白丁 共回答了14个问题
白丁 共回答了14个问题 |采纳率85.7%- H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
- 1年前
相关推荐
- 鸡蛋壳的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的含量,小丽称取30g干燥的碎鸡蛋壳放入烧杯中,并向其中加入了80g稀盐
鸡蛋壳的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的含量,小丽称取30g干燥的碎鸡蛋壳放入烧杯中,并向其中加入了80g稀盐酸恰好完全反应(假设鸡蛋壳中除碳酸钙外的其他成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量为101.2g.我能完成下列计算:
(1)生成CO2的质量______;
(2)碳酸钙的质量分数______;
(3)当碳酸钙恰好完全反应时所得溶液中溶质的质量分数.(结果保留一位小数) yaoyao324_01年前1
yaoyao324_01年前1 -
 捣蛋王31 共回答了21个问题
捣蛋王31 共回答了21个问题 |采纳率90.5%解题思路:(1)碳酸钙与盐酸反应放出二氧化碳而使反应后质量减小,利用质量守恒定律可计算放出二氧化碳的质量;
(2)根据反应的化学方程式,由放出二氧化碳的质量计算蛋壳中所含碳酸钙的质量.
(3)根据反应的化学方程式,由放出二氧化碳的质量计算蛋壳中所含氯化钙的质量.然后利用物质的总质量减去杂质的质量求出溶液的质量,从而求出所得溶液中溶质的质量分数.(1)根据质量守恒定律,生成二氧化碳的质量为80g+30g-101.2g=8.8g
设30g鸡蛋壳中碳酸钙的质量为x,生成氯化钙的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
10011144
x y 8.8g
[100/x=
44
8.8g] x=20g
[111/y=
44
8.8g] y=22.2g
(2)碳酸钙的质量分数
20g
30g×100%≈66.7%
(3)所得溶液中溶质的质量分数=
22.2g
101.2g−(30g−20g)×100%≈24.3%
答案:
(1)8.8g
(2)66.7%
(3)所得溶液中溶质的质量分数为24.3%点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 利用质量守恒定律求出反应放出二氧化碳的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.1年前查看全部
- 下列离子方程式正确的是( )A.鸡蛋壳浸泡在盐酸中产生气泡:CO32-+2H+=CO2↑+H2OB.小苏打与氢氧化钠溶
下列离子方程式正确的是( )
A.鸡蛋壳浸泡在盐酸中产生气泡:CO32-+2H+=CO2↑+H2O
B.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
C.碘化亚铁溶液中通入少量Cl2:Cl2+2I-=2Cl-+I2
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O 静动风虎1年前1
静动风虎1年前1 -
 两条小河 共回答了14个问题
两条小河 共回答了14个问题 |采纳率100%解题思路:A、鸡蛋壳中的碳酸钙是难溶物质;
B、小苏打与氢氧化钠反应生成碳酸根离子;
C、亚铁离子的还原性小于碘离子,所以通入少量Cl2,先与碘离子反应;
D、KMnO4能氧化HCl,所以不能用HCl酸化KMnO4.A、鸡蛋壳中的碳酸钙是难溶物质,所以鸡蛋壳浸泡在盐酸中产生气泡:CaCO3+2H+=CO2↑+H2O+Ca2+,故A错误;
B、小苏打与氢氧化钠反应生成碳酸根离子,其离子方程式:HCO3-+OH-=CO32-+H2O,故B错误;
C、亚铁离子的还原性小于碘离子,所以通入少量Cl2,先与碘离子反应,所以碘化亚铁溶液中通入少量Cl2:Cl2+2I-=2Cl-+I2,故C正确;
D、KMnO4能氧化HCl生成Cl2,所以不能用HCl酸化KMnO4,应该用硫酸酸化,故D错误;
故选C.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子方程式的书写方法和注意问题,注意难溶物质的判断,以及氧化还原反应中离子反应的先后顺序,题目难度中等.1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15 g鸡蛋壳,捣碎,放在烧杯中,
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15 g鸡蛋壳,捣碎,放在烧杯中,
求反应后滤去不溶物所得溶液中溶质的质量分数.
然后向其加入80 g某浓度的稀盐酸,使之充分反应后,(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发)(A.95g B.90.6)其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半.试计算(计算结果保留1位小数) 无奈人生DDNN1年前1
无奈人生DDNN1年前1 -
 我不懂也不羞 共回答了17个问题
我不懂也不羞 共回答了17个问题 |采纳率100%B.时生成二氧化碳的质量为15g+80g-90.6g=4.4g
CaCO3+2HCl=CaCl2+H2O+CO2
100 73 111 44
x y z 4.4g
100/x=73/y=111/z=44/4.4g
x=10g y=7.3g z=11.1g
所用盐酸刚好消耗了加入量的一半.
所用盐酸的溶质质量分数为 7.3g/(80g/2)*100%=18.25%
看不见图 其它的无法计算1年前查看全部
- 实验 醋浸鸡蛋1.一开始鸡蛋是漂浮在醋上、悬浮在醋中、还是沉入瓶底?2.是否发现鸡蛋壳上有气泡冒出?3.是否发现鸡蛋壳慢
实验 醋浸鸡蛋
1.一开始鸡蛋是漂浮在醋上、悬浮在醋中、还是沉入瓶底?
2.是否发现鸡蛋壳上有气泡冒出?
3.是否发现鸡蛋壳慢慢变薄,最后消失?
4.当鸡蛋壳消失后,鸡蛋是漂浮在醋上、悬浮在醋中、还是沉入瓶底?
5.一开始,鸡蛋( ),随后看到鸡蛋外壳上( )产生,且随着时间的推移,鸡蛋慢慢( ).最后还发现,当鸡蛋消失后,鸡蛋( ).
6.鸡蛋壳内层的蛋膜是否也消失了? flyless1年前1
flyless1年前1 -
 LT_long 共回答了20个问题
LT_long 共回答了20个问题 |采纳率90%1.下沉
2.有气泡
3.是
4.悬浮
5.下沉 气泡 上浮 悬浮
6.1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好完全反应.试计算(计算结果保留1位小数):
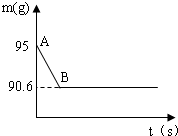
(1)产生CO2的质量为______ g;
(2)该鸡蛋壳中CaCO3的质量分数.
(3)反应后滤去不溶物所得溶液中溶质的质量分数. 六十年代的男人1年前1
六十年代的男人1年前1 -
 just114 共回答了23个问题
just114 共回答了23个问题 |采纳率95.7%解题思路:(1)分析题中反发生的变化可知,由于二氧化碳气体的放出变化后烧杯中的反应剩余物的质量减小,减小的质量即放出二氧化碳气体的质量;
(2)根据反应的化学方程式,由生成二氧化碳的质量计算参加反应的碳酸钙的质量,使用质量分数计算公式求出鸡蛋壳中CaCO3的质量分数;
(3)恰好完全反应后过滤,所得滤液为氯化钙溶液,由反应生成二氧化碳的质量计算同时生成氯化钙的质量、利用剩余质量减去沉淀计算出滤液的质量,利用溶液的溶质质量分数计算公式,求出反应后滤去不溶物所得溶液中溶质的质量分数.(1)根据质量守恒定律,生成二氧化碳的质量=95g-90.6g=4.4g
故答案为:4.4;
(2)设该鸡蛋壳中CaCO3的质量为x,生成的氯化钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
10011144
x y 4.4g
[100/x=
44
4.4g] x=10g
该鸡蛋壳中CaCO3的质量分数=[10g/15g]×100%≈66.7%
[111/y=
44
4.4g] y=11.1g
反应后滤去不溶物所得溶液中溶质的质量分数=
11.1g
90.6g−(15g−10g)×100%≈13.0%
答:(2)该鸡蛋壳中CaCO3的质量分数约为66.7%;(3)反应后滤去不溶物所得溶液中溶质的质量分数约为13.0%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;质量守恒定律及其应用.
考点点评: 进行变化的曲线分析时,曲线的折点表示反应此时恰好完全反应.1年前查看全部
- (2012•奉贤区一模)鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,取12.5g鸡蛋壳,放在烧
(2012•奉贤区一模)鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,取12.5g鸡蛋壳,放在烧杯中,然后向其中加入足量稀盐酸,使之充分反应(鸡蛋壳中其他成分都不溶于水,且不与稀盐酸反应),测得反应中产生气体的质量为4.4g.试计算:
(1)产生CO2的物质的量为0.10.1mol.
(2)该鸡蛋壳中CaCO3的质量分数(写出计算过程). cdxueying1年前1
cdxueying1年前1 -
 jingzying 共回答了23个问题
jingzying 共回答了23个问题 |采纳率100%(1)二氧化碳的物质的量是:4.4/44=0.1mol;
故答案为:0.1;
(2)设:鸡蛋壳中有碳酸钙X mol
CaCO3+2HCl═CaCl2+H2O+CO2↑
1 1
Xmol 0.1mol
1/X=1/0.1
X=0.1 mol
CaCO3的质量分数=(0.1×100/12.5)×100%=80%
答:该鸡蛋壳中CaCO3的质量分数为80%.1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的质量分数,某同学捣碎鸡蛋壳称取10g放入烧杯中,再加入足量的90g的稀
鸡蛋壳的主要成分是碳酸钙,为了测定鸡蛋壳中碳酸钙的质量分数,某同学捣碎鸡蛋壳称取10g放入烧杯中,再加入足量的90g的稀盐酸,充分反应后,称得反应物余物为97.14g.(假设鸡蛋壳中其他成分不与盐酸反应)
求:
(1)标准情况下,产生二氧化碳气体多少g.
(2)计算该鸡蛋壳中碳酸钙的质量分数. 旗指风云11年前1
旗指风云11年前1 -
 shikitou 共回答了10个问题
shikitou 共回答了10个问题 |采纳率100%产生二氧化碳气体:10g+90g-97.14g=2.86g
CaCO3+2HCl=CaCl2+H2O+CO2
100 44
x 2.86g
100/x=44/2.86g
x=6.5g
6.5g/10g*100%=65%1年前查看全部
- (2007•岳阳)为了验证鸡蛋壳的主要成分是CaCO3,盛莉同学进行了以下实验探究:
 (2007•岳阳)为了验证鸡蛋壳的主要成分是CaCO3,盛莉同学进行了以下实验探究:
(2007•岳阳)为了验证鸡蛋壳的主要成分是CaCO3,盛莉同学进行了以下实验探究:
(1)实验桌上已准备好的试剂:NaOH溶液、澄清石灰水、NaCl溶液、Na2CO3溶液、稀盐酸
(2)实验装置如图.
(3)实验方案见下表,请你帮助她将表中的内容填写完整.
B试管中化学反应的化学方程式是:______.实验序号 实验目的 实验操作 实验现象
I验证碳酸
根离子①向装有鸡蛋
壳的A试管中
加入______②B试管中应
加入的试剂是
______A试管中______
B试管中溶液变浑
浊
Ⅱ
验证钙离子向实验皈应后的A试管中滴加
Na2C03溶液A试管中溶液变浑
浊
(4)反思与评价:
①鸡蛋壳完全反应消失后,向实验I反应后的A试管中滴加几滴Na2CO3溶液,若发现溶液中有气泡产生,且溶液未变浑浊.则造成这一现象的原因是:______
②常温下有许多含有碳酸根离子的盐不溶于水.请你评价:盛莉同学的实验方案,能否证明鸡蛋壳里一定含有钙离子?______(填“能“或“不能”) liliepingli1年前1
liliepingli1年前1 -
 zzzzzzzn 共回答了14个问题
zzzzzzzn 共回答了14个问题 |采纳率92.9%解题思路:(3)证明碳酸盐的检验方法是,使用稀盐酸和澄清的石灰水来检验;二氧化碳能使澄清的石灰水变浑浊,据此分析解答;
(4)加入碳酸钠有气泡产生,且溶液未变浑浊,说明加入的盐酸过量且浓度较大;
常温下有许多含有碳酸根离子的盐不溶于水,如碳酸钡,滴加稀盐酸也会生成二氧化碳,生成的氯化钡在滴加碳酸钠溶液同样会出现浑浊现象,故盛莉同学的实验方案,不能证明鸡蛋壳里一定含有钙离子.(3)证明碳酸盐的检验方法是,先取少量的待检物于试管中,再向其中滴加少量的稀盐酸,若有气泡生成,将气体通入澄清的石灰水,若澄清的石灰水变浑浊,则说明该物质中含有碳酸根离子;二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,方程式是:Ca(OH)2+CO2═CaCO3↓+H2O;
(4)①鸡蛋壳完全反应消失后,向实验I反应后的A试管中滴加几滴Na2CO3溶液,若发现溶液中有气泡产生,说明盐酸过量,且溶液未变浑浊,说明盐酸浓度较大,挥发出氯化氢气体溶于水与石灰水反应,从而不变浑浊;
②常温下有许多含有碳酸根离子的盐不溶于水,如碳酸钡,滴加稀盐酸也会生成二氧化碳,生成的氯化钡在滴加碳酸钠溶液同样会出现浑浊现象,故盛莉同学的实验方案,不能证明鸡蛋壳里一定含有钙离子;
故答案为:(3)稀盐酸;澄清石灰水;鸡蛋壳表面有气泡产生;
(4)①加入的盐酸过量且浓度较大;
②不能.点评:
本题考点: 证明碳酸盐.
考点点评: 了解检验碳酸盐所用试剂:稀盐酸、澄清石灰水,明确物质的性质才能正确分析和解答问题.1年前查看全部
- (6分)鸡蛋壳的主要成分是碳酸钙。为了测定鸡蛋壳中钙元素的质量分数,小华同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,
(6分)鸡蛋壳的主要成分是碳酸钙。为了测定鸡蛋壳中钙元素的质量分数,小华同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎后,称取10g放在烧杯里,然后往烧杯中滴加足量的稀盐酸,加入稀盐酸的量与生成气体的量如图所示。试求该鸡蛋壳中钙元素的质量分数。(假设鸡蛋壳中其他物质不与盐酸反应)

 ljffjl20041年前1
ljffjl20041年前1 -
 malarunfa 共回答了20个问题
malarunfa 共回答了20个问题 |采纳率95%20%
1年前查看全部
- 薄薄的鸡蛋壳之所以能承受这么大的压力是因为它能够把受到的压力均匀地分散到各个部分.
薄薄的鸡蛋壳之所以能承受这么大的压力是因为它能够把受到的压力均匀地分散到各个部分.
换一种方法说出来.意思不能变 zy16301年前1
zy16301年前1 -
 lks707 共回答了10个问题
lks707 共回答了10个问题 |采纳率100%因为鸡蛋壳能够把受到的压力均匀地分散到各个部分,所以薄薄的鸡蛋壳能承受这么大的压力.1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半.试计算(计算结果保留1位小数):

(1)产生CO2的质量为______ g;
(2)该鸡蛋壳中CaCO3的质量分数.
(3)所用稀盐酸中溶质的质量分数. sfhhsf1年前1
sfhhsf1年前1 -
 dj7686 共回答了27个问题
dj7686 共回答了27个问题 |采纳率92.6%解题思路:(1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,生成的二氧化碳扩散到空气中,烧杯中前后减少的质量即为二氧化碳的质量.
(2)根据二氧化碳的质量求出碳酸钙的质量,再根据[碳酸钙的质量/鸡蛋壳的质量]×100%求出鸡蛋壳中碳酸钙的质量分数.
(3)根据二氧化碳的质量求出一半稀盐酸中溶质的质量,再根据[一半稀盐酸中溶质的质量/一半稀盐酸的质量]×100%求出稀盐酸中溶质的质量分数.(1)产生CO2的质量为:95g-90.6g=4.4g 故答案为:4.4g
(2)设鸡蛋壳中碳酸钙的质量为x,一半稀盐酸中溶质的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
10073 44
x y4.4g
[100/44=
x
4.4g],x=10g
[73/44=
y
4.4g],y=7.3g
[10g/15g]×100%=66.7% 答:鸡蛋壳中碳酸钙的质量分数为66.7%.
(3)稀盐酸中溶质的质量分数=[7.3g/40g]×100%≈18.3% 答:稀盐酸中溶质的质量分数为18.3%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;质量守恒定律及其应用.
考点点评: 石灰石与稀盐酸反应,反应前后减少的质量为二氧化碳的质量,固体在反应前后减少的质量为参加反应的碳酸钙的质量,要将两者区分清.1年前查看全部
- 请用化学用语填空(1)两个亚铁离子______(2)鸡蛋壳的主要成分______(3)标出氯化铵中氮元素的化合价____
请用化学用语填空
(1)两个亚铁离子______(2)鸡蛋壳的主要成分______
(3)标出氯化铵中氮元素的化合价______
(4)铝在空气中能形成一层致密的保护膜,化学方程式______. 追上你啦抱抱1年前1
追上你啦抱抱1年前1 -
 贫者立命 共回答了20个问题
贫者立命 共回答了20个问题 |采纳率95%(1)根据离子的表示方法表示为为2Fe 2+ ;
(2)鸡蛋壳主要成分为碳酸钙,化学式为CaCO 3 ;
(3)根据化合价的表示方法表示为
-3
NH 4 Cl
(4)Al在常温下可以和空气中的氧气反应生成一层致密的氧化物薄膜三氧化二铝,方程式为4Al+3O 2 ═2Al 2 O 3 ;
故答案为:(1)2Fe 2+ ;(2)CaCO 3 ;(3)
-3
NH 4 Cl ;(4)4Al+3O 2 ═2Al 2 O 31年前
21年前查看全部
- (2014•哈尔滨)鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应).化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,
(2014•哈尔滨)鸡蛋壳的主要成分是碳酸钙(其它成分不溶于水也不与酸反应).化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做如下实验:

反应①结束后,所加盐酸刚好反应了一半,反应②恰好完全反应.请回答下列问题:
(1)反应①的化学方程式为______;
(2)根据已知条件列出求解碳酸钙质量(X)的比例式[100/44]=[x/4.4g][100/44]=[x/4.4g];
(3)该鸡蛋壳中碳酸钙的质量分数为______;
(4)所加氢氧化钙的质量为______;
(5)溶液b中溶质的质量分数为______;
(6)用36.5%的浓盐酸配制80g上述稀盐酸需加水的质量为______. hty7311年前1
hty7311年前1 -
 hl35wt 共回答了20个问题
hl35wt 共回答了20个问题 |采纳率90%解题思路:(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
(2)反应前后的质量差即为生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钙的质量;
(3)根据碳酸钙的质量可以计算该鸡蛋壳中碳酸钙的质量分数;
(4)根据氯化氢的质量可以计算氢氧化钙的质量;
根据氯化钙的质量、溶液的质量可以计算溶液b中溶质的质量分数;
(6)溶液稀释前后,溶质质量不变.(1)反应①的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.
故填:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)设碳酸钙的质量为x,反应的氯化氢的质量为y,生成氯化钙的质量为z,
反应生成二氧化碳的质量为:12.5g+80g-88.1g=4.4g,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 7311144
xyz 4.4g
[100/x]=[73/y]=[111/z]=[44/4.4g],
x=10g,y=7.3g,z=11.1g,
故填:[100/x]=[44/4.4g],
(3)该鸡蛋壳中碳酸钙的质量分数为:[10g/12.5g]×100%=80%,
故填:80%.
(4)设所加氢氧化钙的质量为m,生成氯化钙的质量为n,
Ca(OH)2+2HCl═CaCl2+2H2O,
7473111
m7.3g n
[74/m]=[73/7.3g]=[111/n],
m=7.4g,n=11.1g,
故填:7.4g.
(5)溶液b的质量为:10g+80g+107g+7.4g-4.4g=200g,
溶液b中溶质的质量分数为:[11.1g+11.1g/200g]×100%=11.1%,
故填:11.1%.
(6)设需要36.5%的浓盐酸的质量为w,
则w×36.5%=7.3g+7.3g,
w=40g,
用36.5%的浓盐酸配制80g上述稀盐酸需加水的质量为:80g-40g=40g,
故填:40g.点评:
本题考点: 根据化学反应方程式的计算;用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.1年前查看全部
- 为什么把熟鸡蛋放在醋裏,过几天鸡蛋壳会软掉?
为什么把熟鸡蛋放在醋裏,过几天鸡蛋壳会软掉?
主要说说科学之类的,语言不要太复杂. 燕焉1年前5
燕焉1年前5 -
 dieya 共回答了20个问题
dieya 共回答了20个问题 |采纳率95%鸡蛋壳本身含有很多碳酸钙,醋是一种弱酸,而碳酸钙在有水的条件下会生成氢氧化钙逐渐和醋中和反应,故使得鸡蛋壳碳酸钙中的含量变少,就软掉了.1年前查看全部
- 含碳酸钙的物质有什么鸡蛋壳,贝壳的主要成分是碳酸钙.请问还有哪些含有碳酸钙的物质?
 wangjun80291年前1
wangjun80291年前1 -
 天空中的小猪 共回答了18个问题
天空中的小猪 共回答了18个问题 |采纳率94.4%1、牙膏里面也含有少量的碳酸钙
2、珊瑚石
3、石灰石
4、大理石
5、水壶和锅炉中的水垢
6、汉白玉
7、1年前查看全部
- 怎样用化学实验的方法证明鸡蛋壳的主要成分是碳酸钙拜托了各位
 落叶潇萧1年前1
落叶潇萧1年前1 -
 gaoxiao00006 共回答了18个问题
gaoxiao00006 共回答了18个问题 |采纳率88.9%向鸡蛋壳滴加稀盐酸,无色气体通过澄清的石灰水,若有沉淀就证明是碳酸钙1年前查看全部
- 为什么我的鸡蛋壳和稀盐酸反应不生成CO2
 宝贝的宝宝19791年前1
宝贝的宝宝19791年前1 -
 465826172 共回答了14个问题
465826172 共回答了14个问题 |采纳率92.9%盐酸不纯呗.蛋壳和盐酸反应肯定生成二氧化碳!是不是生成的二氧化碳太少啦?检验不出来?1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15克鸡蛋
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15克鸡蛋
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定某鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯里,然后向其加入80 g某浓度的稀盐酸,使之充分反应后,(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发)(A.95g B.90.6)其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半.试计算(计算结果保留1位小数)
(1)产生CO2的质量为_______________g.
(2)计算该鸡蛋壳中CaCO3的质量分数 .
(3)所用稀盐酸中溶质的质量分数 娃哈哈uuhx1年前1
娃哈哈uuhx1年前1 -
 赫子 共回答了14个问题
赫子 共回答了14个问题 |采纳率64.3%前后失去的质量为二氧化碳的质量即4.4g;算出CaCO3的质量为4.4/44*100=10g,即鸡蛋壳中CaCO3的质量分数为10/15*100%=66.7%;所用稀盐酸中溶质的质量分数为3.65*2/80*100%=1年前查看全部
- 先用食醋,再同石灰水来检验鸡蛋壳的主要成分 的原理是什么.
 孤挑白云1年前1
孤挑白云1年前1 -
 wsh1966ww 共回答了20个问题
wsh1966ww 共回答了20个问题 |采纳率85%食醋里面含有醋酸,鸡蛋壳的主要成分是碳酸钙,把鸡蛋壳泡在食醋里就会发生化学反应,生成醋酸钙和二氧化碳.二氧化碳在充到石灰水里,使石灰水变浑浊,主要是二氧化碳和石灰水里的氢氧化钙发生反应,生成碳酸钙,碳酸钙不溶于水,所以才浑浊的.1年前查看全部
- 碳酸 稀盐酸 反应烧杯底部是一些碎鸡蛋壳,瓶内有少量水,在瓶中插入一支点燃的蜡烛,向瓶内倒入稀盐酸会有什么现象,得出CO
碳酸 稀盐酸 反应
烧杯底部是一些碎鸡蛋壳,瓶内有少量水,在瓶中插入一支点燃的蜡烛,向瓶内倒入稀盐酸会有什么现象,得出CO2的什么性质.
根据这一性质有何用途 陆文婷1年前4
陆文婷1年前4 -
 有经验 共回答了18个问题
有经验 共回答了18个问题 |采纳率77.8%蛋壳溶解,产生大量无色气泡,蜡烛熄灭
说明CO2不能燃烧,也不能助燃1年前查看全部
- 鸡蛋应选择哪种保存方式?鸡蛋壳的主要成份是碳酸钙,其表面有极细小的空隙,使氧分子能进入蛋白,从而缩短了鸡蛋的保鲜期,为了
鸡蛋应选择哪种保存方式?
鸡蛋壳的主要成份是碳酸钙,其表面有极细小的空隙,使氧分子能进入蛋白,从而缩短了鸡蛋的保鲜期,为了延长保鲜期,人们把鸡蛋作如下之一处理:
A.食盐水中 B.冰箱中 C.石灰水中 D.煮熟后存放
请回答应选择哪种保存方式,使鸡蛋的保鲜期延长,简述理由. lxl0609071年前1
lxl0609071年前1 -
 zj_yellow 共回答了24个问题
zj_yellow 共回答了24个问题 |采纳率100%选C
题目的意思是防止氧气通过表面空隙进入
那么B冰箱里面还是有氧气
D煮熟后表面还是CACO3
AC之间选
那么C更好
石灰水
CO2+Ca(OH)2==CaCO3沉淀
这样形成沉淀覆盖在即蛋表面 抑制它呼吸作用分解有机质1年前查看全部
- 关于鸡蛋壳的化学题鸡蛋壳中的主要成分是碳酸钙.为了测定某鸡蛋壳中碳酸钙的质量分数,小群同学进行了如下实验:将鸡蛋壳洗净、
关于鸡蛋壳的化学题
鸡蛋壳中的主要成分是碳酸钙.为了测定某鸡蛋壳中碳酸钙的质量分数,小群同学进行了如下实验:将鸡蛋壳洗净、干燥并捣碎,称取10G放在烧杯里,然后往烧杯中加入足量的稀盐酸90G,充分反映后,称的反映剩余物为97.14G.
计算该鸡蛋壳中碳酸钙的质量分数. ayanlian1年前1
ayanlian1年前1 -
 夏雅雯 共回答了16个问题
夏雅雯 共回答了16个问题 |采纳率93.8%2HCl+CaCO3====CaCl2+H2O+CO2↑ △m
100 44
x 10g+90g-97.14g
x=2.86g×100÷44=6.5g
故ω(CaCO3)=6.5g÷10g×100%=65%
答:鸡蛋壳中碳酸钙的质量分数为65%.1年前查看全部
- 鸡蛋壳和白醋反映的现象和方程式
 四一居士1年前1
四一居士1年前1 -
 宏西 共回答了20个问题
宏西 共回答了20个问题 |采纳率95%鸡蛋壳的主要成分是碳酸钙,与醋酸反应生成二氧化碳
方程式:2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑
鸡蛋放在白醋里的话.
一会儿可能不会
久了可能就会变酸
蛋壳也会变软.1年前查看全部
- 请求翻译:本文利用鸡蛋壳制取乳酸钙,采用高温煅烧法.
 xue83091年前3
xue83091年前3 -
 laoqiu321 共回答了12个问题
laoqiu321 共回答了12个问题 |采纳率75%Preparation of this paper,egg shells,calcium lactate,high-temperature calcination.1年前查看全部
- 能腐蚀鸡蛋壳,并在上面刻字的化学式
 ltli1年前3
ltli1年前3 -
 szyp65 共回答了16个问题
szyp65 共回答了16个问题 |采纳率81.3%CaCO3+2HCl=CaCl2+H2O+CO2↑1年前查看全部
- 帮我解决一个化学题一个化学实验"以鸡蛋壳和稀盐酸为原料制取二氧化碳",若要验证鸡蛋壳的主要成分碳酸钙中的钙离子,只要在反
帮我解决一个化学题
一个化学实验"以鸡蛋壳和稀盐酸为原料制取二氧化碳",若要验证鸡蛋壳的主要成分碳酸钙中的钙离子,只要在反应后的溶液中滴加_____溶液,观察到_____现象即可(鸡蛋壳中的杂质不干扰反应现象).若所加试剂正确,但实验刚开始阶段却观察不到应有现象,则原因是______. xiayuziyang1年前5
xiayuziyang1年前5 -
 鱼嘻水 共回答了21个问题
鱼嘻水 共回答了21个问题 |采纳率100%1.Na2CO3
2.白色沉淀
3.盐酸过量,Na2CO3与反应1年前查看全部
- 向玻璃杯中逐渐加入浓盐酸,鸡蛋壳表面会有什么现象
 xhnh5001年前1
xhnh5001年前1 -
 此球必进 共回答了15个问题
此球必进 共回答了15个问题 |采纳率93.3%分解,有气体产生1年前查看全部
- 【化学】用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐?
 colorseven1年前3
colorseven1年前3 -
 01534 共回答了20个问题
01534 共回答了20个问题 |采纳率85%透析的原理,用鸡蛋壳膜装淀粉胶体后置于蒸馏水中,由于鸡蛋壳膜的半透膜性质,食盐分子能溶于水并能通过鸡蛋壳膜转移到蒸馏水中,而淀粉胶体分子不能穿过鸡蛋壳膜,这样就实现了除去食盐的目的.1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙,讲一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,
鸡蛋壳的主要成分是碳酸钙,讲一个新鲜的鸡蛋放在盛有足量稀盐酸的玻璃杯中,
可观察到鸡蛋一边冒气泡一边沉到杯底,一会又慢慢上浮,到接近液面时又下沉.请解释这一现象. 碧情1年前1
碧情1年前1 -
 138257675 共回答了14个问题
138257675 共回答了14个问题 |采纳率85.7%鸡蛋壳表面附有CO2气体,有浮力的作用上浮,接近液面时气体溢出去,鸡蛋壳的密度大于盐酸的密度,又沉下去了.我是这么理解的,也不知道对不对1年前查看全部
- 鸡蛋壳压碎后加入白醋会发生什么现象
 ll的云1年前1
ll的云1年前1 -
 5713486 共回答了19个问题
5713486 共回答了19个问题 |采纳率94.7%因为鸡蛋壳的成分为碳酸钙,而白醋为醋酸,所以两者相遇后会发生反应
CaCO3+CH3COOH-->CH3COOCa+H2O+Co2生成可融物,而生成co2为二氧化碳气体,所以同时有气体附在鸡蛋壳上1年前查看全部
- 鸡蛋壳(主要成分是CaCO3)放入盛有盐酸的试管中,现象是
 sam1012241年前2
sam1012241年前2 -
 garyxzf 共回答了25个问题
garyxzf 共回答了25个问题 |采纳率88%有气泡产生1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定某鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯里,然后向其加入
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定某鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯里,然后向其加入80 g某浓度的稀盐酸,使之充分反应后,(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发)(A.95g B.90.6)其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半.试计算(计算结果保留1位小数)
(1)产生CO2的质量为_______________g.
(2)计算该鸡蛋壳中CaCO3的质量分数 .
(3)所用稀盐酸中溶质的质量分数 知了CARMAN1年前1
知了CARMAN1年前1 -
 LAN-YU 共回答了17个问题
LAN-YU 共回答了17个问题 |采纳率76.5%B点时少去的质量即为CO2的质量=80+15-90.6=4.4克
设B点时参与反应的盐酸质量为x克
2HCl+CaCO3=CaCl2+H2O+CO2
73 44
x 4.4
73/x=44/4.4
x=7.3
盐酸溶液中的HCl的质量=7.3*2=14.6克
所用稀盐酸的溶质质量分数=14.6/80*100%=18.25%1年前查看全部
- A是鸡蛋壳、贝壳、石灰石的主要成分,B、F是元素组成相同的气体,E、G是黑色固体,根据下列关系(部分产物略去),完成下列
A是鸡蛋壳、贝壳、石灰石的主要成分,B、F是元素组成相同的气体,E、G是黑色固体,根据下列关系(部分产物略去),完成下列各题
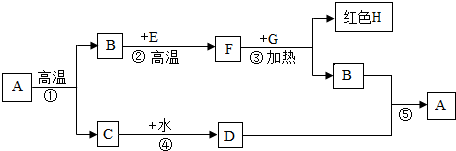
(1)C的俗名是______,E的化学式______;
(2)③的化学方程式是CO+CuO
Cu+CO2高温 .CO+CuO,利用F这一性质可______,在做此实验时,除检查装置气密性外,加热前应______,目的是______;
Cu+CO2高温 .
(3)④的化学方程式,反应的基本类型是______,该反应是______ (填“吸热”或“放热”)反应. 会跑的猪猪1年前1
会跑的猪猪1年前1 -
 woomimi 共回答了25个问题
woomimi 共回答了25个问题 |采纳率92%解题思路:本题为框图式物质推断题,本题的解题突破口是A是鸡蛋壳、贝壳、石灰石的主要成分,故A是碳酸钙;高温分解产生二氧化碳和氧化钙,B、F是元素组成相同的气体,E是黑色固体,因此B是二氧化碳,E是碳,F是一氧化碳;G是黑色固体,和一氧化碳反应产生红色H,因此G是氧化铜,H是铜;则C是氧化钙,氧化钙和水反应产生氢氧化钙,D是氢氧化钙,氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水,带入验证符合题意.A是鸡蛋壳、贝壳、石灰石的主要成分,故A是碳酸钙;高温分解产生二氧化碳和氧化钙,B、F是元素组成相同的气体,E是黑色固体,因此B是二氧化碳,E是碳,F是一氧化碳;G是黑色固体,和一氧化碳反应产生红色H,因此G是氧化铜,H是铜;则C是氧化钙,氧化钙和水反应产生氢氧化钙,D是氢氧化钙,氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水,因此:
(1)C是氧化钙,俗称生石灰;E是碳,化学式为:C;
(2)③的化学方程式是一氧化碳和氧化铜反应产生铜和二氧化碳,反应的方程式为:CO+CuO
高温
.
Cu+CO2;利用一氧化碳的还原性可以冶炼金属;在做此实验时,除检查装置气密性外,加热前应先通入一段时间CO,目的是赶走装置中的空气,避免CO不纯而爆炸;
(3)反应④的化学方程式是氧化钙和水反应产生氢氧化钙,同时放出大量的热;该反应是两种物质生成了一种物质,属于化合反应;
故答案为:(1)生石灰;C;
(2)CO+CuO
高温
.
Cu+CO2;可冶炼金属;先通入一段时间CO;赶走装置中的空气,避免CO不纯而爆炸;
(3)CaO+H2O=Ca(OH)2;化合反应;放热.点评:
本题考点: 物质的鉴别、推断;化学式的书写及意义;物质发生化学变化时的能量变化;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题为框图式物质推断题,完成此题,关键是根据题干叙述,找准解题突破口,直接得出有关物质的化学式,然后根据题干叙述结合框图,推断得出其他物质的化学式.1年前查看全部
- 鸡蛋壳的主要化学成分和石灰石相同,这种化学成分及证明它是碳酸盐的理想方法是?
 随风流1年前1
随风流1年前1 -
 avv1 共回答了23个问题
avv1 共回答了23个问题 |采纳率100%化学成分是碳酸钙CaCO3
证明它是碳酸盐的理想方法是:
加入稀盐酸,将生成的气体通入澄清的石灰水中,若澄清的石灰水变浑浊,则可证明它是碳酸盐.
因为碳酸盐都可与酸反应生成二氧化碳(CO2),CO2可使澄清的石灰水变浑浊
CO32- +2H+ ==H2O+CO2↑1年前查看全部
- 鸡蛋壳主要成分是碳酸钙,为测定鸡蛋壳中碳酸钙的含量,张利称取30g干燥碎鸡蛋壳放入烧杯,向其中加入80g稀盐酸恰好完全反
鸡蛋壳主要成分是碳酸钙,为测定鸡蛋壳中碳酸钙的含量,张利称取30g干燥碎鸡蛋壳放入烧杯,向其中加入80g稀盐酸恰好完全反应,反应后烧杯中物质总质量101.2g求碳酸钙的质量?当碳酸钙恰好完全反应时所得溶液中溶质的质量分数?学霸学霸召唤
 五饼贰鱼1年前1
五饼贰鱼1年前1 -
 acleverbird 共回答了18个问题
acleverbird 共回答了18个问题 |采纳率83.3%1co2质量30+80-101.2=8.8g
2.设碳酸钙质量为X,氯化钙质量为Y
CaCO3+Hcl=CaCl+CO2
100 111 44
x Y 8.8
x=20g
Y=22.2克
22.2克/(101.2-10)=24.3%1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙.为了测定某鸡蛋中碳酸钙的质量分数,小群同学进行了如下实验:
鸡蛋壳的主要成分是碳酸钙.为了测定某鸡蛋中碳酸钙的质量分数,小群同学进行了如下实验:
将鸡蛋清洗干净.干燥并捣碎后,称取10g放在烧杯里,然后往烧杯里加入足量的稀盐酸90g,充分反应后,称得反应剩余物为97.14g(假设其他物质不与盐酸反应)
(1)产生CO2多少克
(2)计算鸡蛋壳中碳酸钙的质量分数
(3)计算该蛋壳中碳酸钙的质量分数
(4)计算稀盐酸溶质的质量分数
 ilovesmart1年前1
ilovesmart1年前1 -
 秋独残 共回答了14个问题
秋独残 共回答了14个问题 |采纳率92.9%(1)由题目可知反应物总重量为10+90=100克,反应剩余物为97.14克,
由质量守恒定律,可知产生CO2气体为100-97.14=2.86克
(2)由反应方程式CaCO3+2HCl=CaCl2+H2O+CO2
· 100 71 44
· x y 2.86 g
100/44 = x/2.86,解得CaCO3质量x = 6.5 g
可知鸡蛋中CaCO3的质量分数为6.5/10*100=65%
(3)71/44 = y/ 2.86 ,所以y = 4.615 g
盐酸质量分数 = 4.615 / 90 ×100%= 5.13%1年前查看全部
- 鸡蛋壳与醋酸的反应可以应用在哪些地方
 hy00661年前2
hy00661年前2 -
 吃斋的狼 共回答了13个问题
吃斋的狼 共回答了13个问题 |采纳率100%其实就是碳酸钙与酸的反应,在去除暖水壶底层水垢时可用1年前查看全部
- 为什么鸡蛋壳和盐酸反应生成的二氧化碳能证明鸡蛋壳中的主要成分是碳酸钙吗?
 控诉爱情1年前3
控诉爱情1年前3 -
 shyground 共回答了15个问题
shyground 共回答了15个问题 |采纳率86.7%因为CaCO3+2HCl=CaCl2+H2O+CO2↑ ,而其他碳酸盐大多溶于水,不是较为坚硬的固体.1年前查看全部
- 鸡蛋壳怎么会不见了呢?
 zwhdf1年前1
zwhdf1年前1 -
 负犁挑担过小溪 共回答了13个问题
负犁挑担过小溪 共回答了13个问题 |采纳率84.6%浏阳市嗣同路小学李非易
我越着急,爷爷越是卖关子,很神秘地说:“你做做实验,你再观察观察吧,这可是一种治疗高血压有一定疗效的祖传秘方哦.”
“祖传秘方?有这么神奇吗?”我好奇地想着,学着爷爷,先拿一个生鸡蛋,洗干净之后,把它放进玻璃杯里.再向杯子里倒入足够的醋,原来那浸泡鸡蛋的液体是醋,醋要完全淹过鸡蛋.爷爷告诉我要浸泡几天,观察几天.于是我将浸泡着鸡蛋的杯子放在我的书桌上,每天在家我就看上它几次,过了两天,我发现鸡蛋身上吸附着许许多多的气泡,气泡越来越多,又过了两天,我发现鸡蛋的壳不见了,它变成了透明的.
这是什么原因呢?为什么鸡蛋壳不见了呢?我又缠着爷爷:“醋浸泡鸡蛋为什么有气泡呢?您喝醋浸鸡蛋干嘛呢?”即使我一副“打破沙罐问到底”的态度,爷爷却还在跟我“捉迷藏”似的,说:“你自己想办法找答案吧!”于是我上网“求救”,原来在《本草纲目》中记载:鸡子一枚,醋三四两调匀,暖过顿服,可治心气作痛,具体做法是:
您只要把一枚鸡蛋放到容器中,然后每次倒上150毫升~170毫升的米醋.一瓶醋是500毫升,也就是说一次倒1/3多一点就可以了.这样至少浸泡48个小时以上,主要是让鸡蛋壳完全软化就行了.鸡蛋壳是碳酸钙,经过醋一泡就变成了醋酸钙.醋酸钙非常有利于人体吸收,而且醋长时间浸泡鸡蛋,就把鸡蛋中的蛋白质分解成了氨基酸.氨基酸对人体也是非常有益的东西.这样,等鸡蛋壳完全软化之后,您就找一双筷子,把鸡蛋壳、鸡蛋清和鸡蛋黄,连同醋一搅和,搅匀之后呢,连鸡蛋壳一起一口气全喝下去.每天喝上一碗,连续喝10天就能收到非常好的疗效了.但是,这个醋泡蛋呢,有些人一定要慎用,比如说,容易过敏的人、有胃病的人、血压偏低的人,以防病情加重.
通过这个实验和查证,让我知道了:醋中的酸慢慢分解了鸡蛋壳,几天之后鸡蛋变成了透明的.你能清楚地看到蛋壳中的粘膜.“剥壳”过程中的一些小气泡可能也引起了你的注意.蛋壳中含有碳酸钙,它与醋(一种醋)发生反应,生成醋酸钙和二氧化碳(就是你看到的气泡)以及水.1年前查看全部
- 鸡蛋壳的主要成分是碳酸钙,某化学兴趣小组为了测定鸡蛋壳中碳酸钙的质量分数,称取50g样品,磨成粉末后,放在电炉上高温煅烧
鸡蛋壳的主要成分是碳酸钙,某化学兴趣小组为了测定鸡蛋壳中碳酸钙的质量分数,称取50g样品,磨成粉末后,放在电炉上高温煅烧至质量不再发生变化,称量剩余物质量为30.2g.(有关反应的化学方程式为CaCO3
CaO+CO2↑假设鸡蛋壳样品中杂质不参加反应)据此计算:高温 .
(1)生成二氧化碳气体的质量;
(2)此鸡蛋壳样品中碳酸钙的质量分数. 我是分清1年前1
我是分清1年前1 -
 我找不到你了 共回答了19个问题
我找不到你了 共回答了19个问题 |采纳率89.5%解题思路:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.注意事项有:设未知数不带单位,计算过程中要带单位,结果要带单位.在本题中,分析题目信息和数据可知,减少的质量是二氧化碳的质量,根据二氧化碳的质量可以求出碳酸钙的质量,然后再求碳酸钙的质量分数.(1)生成CO2的质量:50g-30.2g=19.8g
答:生成二氧化碳气体的质量为19.8g.
(2)设50g样品中含CaC03的质量为x
CaCO3
高温
.
CaO+CO2↑
100 44
x19.8g
[100/x=
44
19.8g]
x=45g
[45g/50g]×100%=90%
答:鸡蛋壳样品中碳酸钙的质量分数90%点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本考点考查了根据化学方程式的计算和物质的质量分数,是根据质量守恒定律求气体,记住遇到固体的差求气体.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律在计算题中的应用,本考点主要出现在计算题中.1年前查看全部
- 鸡蛋壳中钙含量的测定公式
 setjkrkt1年前1
setjkrkt1年前1 -
 bilder 共回答了15个问题
bilder 共回答了15个问题 |采纳率100%鸡蛋壳中钙含量的测定 EDTA滴定法和原子吸收分光光度法 一、 实验目的:1、了解从鸡弹壳中得到Ca 2+ 的方法. 2、掌握EDTA溶液的标定方法和操作条件及其滴定Ca2+的原理及方法. 3、学会原子吸收分光光度计的使用. 二、实验原理:1、(1)EDTA标定原理:以氧化锌为基准物标定EDTA的条件是用二甲酚橙作指示剂,在pH=5~6的六次甲基四胺为缓冲溶液中进行. 在此条件下,二甲酚橙程黄色,它与Zn2+络合物呈紫红色因为EDTA与锌离子形成的络合物更稳定,当用EDTA标准溶液滴定锌离子达到sp时,二甲酚橙被置换出,溶液由紫色变为黄色,即为终点. EDTA滴定原理:在pH>12.5时,Mg2+生成Mg(OH)2 沉淀,在用沉淀掩蔽镁离子后,用EDTA单独滴定钙离子.钙指示剂与钙离子显红色,灵敏度高,在pH=12~13滴定钙离子,终点呈指示剂自身的蓝色.终点时反应为: CaIn— +H2Y2— =CaY2— + HIn2— + H+ (2)原子吸收分光光度法测定钙离子原理:原子吸收分光光度法是由待测元素空心阴极灯发射出一定强度和一定波长的特征谱线的光.当它通过含有待测元素基态原子蒸汽的火焰时,部分特征谱线的光被吸收,而未被吸收的光经单色器,照射至光电检测器上,通过检测得到特征谱线光强被吸收的大小,即可得到试样中待测元素的含量. 特征谱线被吸收的程度是可以用朗伯——比尔定律表示:A=K`c 式中,K`在一定条件下是一常数即吸光度(A)浓度(c)成正比. 标准曲线法是原子吸收分光光度分析中一种常用的定量方法,首先配置一系列标准溶液用原子吸收分光光度计测定各标准溶液的吸光度(A),得到A~ c的标准曲线,然后测定试液的吸光度,通过A~c 曲线得到待测组分的含量. 三、实验仪器及试剂:小烧杯、玻璃棒、碱式滴定管、滴管、250ml容量瓶二个、250ml锥形瓶6个、25ml容量瓶6个、原子吸收分光光度计、钙空心阴极灯、10ml量筒一个、100ml量筒一个、洗瓶、25ml移液管、10ml吸量管、洗耳球、pH试纸、表面皿、400、250、100ml烧杯各一个、电子天平、滤纸若干,酒精灯,石棉网,试剂瓶;试剂有:6mol/LHCl、一只生鸡蛋、分析纯EDTA二钠盐、0.5%二甲酚橙、20%六亚甲基四胺、分析纯氧化锌固体、钙指示剂、NaOH、铬黑T、钙标准使用液(100ug/ml) 四、实验步骤、 方法一.EDTA滴定法 1、鸡蛋壳的溶解: 取一只鸡蛋壳洗净取出内膜,烘干,研碎称量其质量,然后将其放入小烧杯中,加入10ml6mol/L的HCl,微火加热将其溶解, 然后将小烧杯中的溶液转移到250ml容量瓶中,定容摇匀. 2、(1)EDTA标准溶液的标定:a.浓度为0.1mol/L的EDTA标准溶液的配置:称取EDTA二钠盐1.9克,溶解于150~200ml温热的去离子水中,冷却后加入到试剂瓶中,稀释到500ml,摇匀. b.锌标准溶液的配置:准确称取0.2克的分析纯ZnO固体试剂,置于100ml小烧杯中,先用少量去离子水润湿,然后加2ml 6mol/L的HCl溶液,用玻璃棒轻轻搅拌使其溶解.将溶液定量转移到250ml容量瓶中,用去离子水稀释到刻线,摇匀.根据称取的ZnO质量计算出锌离子标准溶液的浓度. c.EDTA标准溶液的标定:用移液管吸取25.00ml锌离子标准溶液,于250ml小烧杯中,加入1~2滴0.5%的二甲酚橙指示剂,滴加20%六亚甲基四胺溶液至溶液呈稳定的紫红色后再加2ml;然后用c(EDTA)= 0.01mol/LEDTA标准溶液滴定至溶液由紫红色变为亮黄色即为终点,并记录所消耗的EDTA溶液体积. 按照以上方法重复滴定3次,要求极差小于0.05ml,根据标定时消耗的EDTA溶液的体积计算它的准确浓度. (2)Ca2+ 的滴定:用移液管移取25.00ml待测溶液于锥形瓶中,调节溶液pH>12.5,充分摇匀,加入5滴钙指示剂,用EDTA标准溶液滴定至溶液由酒红色变为纯蓝色为终点,重复滴定3次,记录消耗EDTA溶液的体积. 方法二 原子吸收分光光度法测定钙含量: a.配置钙标准溶液系列 准确移取2.00、4.00、6.00、8.00、10.0ml钙标准使用掖,分别置于25ml容量瓶中,用去离子水稀释到刻线,摇匀备用. b.配置试样溶液 准确移取5.00ml250ml容量瓶中的钙离子溶液于25ml容量瓶中,用水稀释至刻度摇匀备用. c.用原子吸收分光光度计测量 通过钙标准工作曲线求得试样中钙 .
【初高中阶段:
已知蛋壳中主要含CaCO3和少量的MgCO3
1) 取蛋壳0.30g,加水煮沸约5min,置于蒸发皿中用小火烤干,研细;
2) 将上述固体置于锥形瓶中,逐滴加入质量分数为0.73%的盐酸30.00g;
3) 待反应完全后,向锥形瓶加____________;
4) 将质量分数为0.20%的NaOH溶液逐滴滴入锥形瓶中;
5) 待_______时,记录消耗NaOH溶液的质量为24.00g.
3)紫色石蕊试液
5)溶液刚好变为紫色时
这个其实就是滴定没有反应完的盐酸,得出与蛋壳反应的盐酸的量
绝对不能加酚酞,加酚酞,溶液变红的话,说明氢氧化钠已经过量,而这种滴定实验,氢氧化钠绝对不能过量
滴定用的氢氧化钠的质量=24g*0.2%=0.048g
滴定用的氢氧化钠的物质的量=0.048g/(40g/mol)=0.0012mol
没有与鸡蛋壳反应的盐酸的物质的量=0.0012mol
盐酸的总质量=30g*0.73%=0.219g
盐酸的总物质的量=0.219g/(36.5g/mol)=0.006mol
与鸡蛋壳反应的盐酸的物质的量=0.0048mol
CaCO3+2HCl==CaCl2+CO2↑+H2O
两mol盐酸反应掉一mol碳酸钙
所以鸡蛋壳中碳酸钙的物质的量=0.0048mol*0.5=0.0024mol
鸡蛋壳中钙元素的物质的量=0.0024mol
钙元素的质量=0.0024mol*40g/mol=0.096g
钙元素的百分含量=0.096/0.3*100%=32%
蛋壳样品中含钙量为___32%_____. 】1年前查看全部
- 鸡蛋煮熟以后拿起来放在碗里,鸡蛋壳上还有一些水,此时用手触摸并不觉得很烫手.但是当鸡蛋壳上的水消失以后,用手触摸会感到很
鸡蛋煮熟以后拿起来放在碗里,鸡蛋壳上还有一些水,此时用手触摸并不觉得很烫手.但是当鸡蛋壳上的水消失以后,用手触摸会感到很烫手.这里面有什么科学道理?
 不是男人1年前3
不是男人1年前3 -
 披着虎皮的蚂蚁 共回答了27个问题
披着虎皮的蚂蚁 共回答了27个问题 |采纳率88.9%当熟鸡蛋壳上还有一些水时,水蒸发吸热,导致鸡蛋壳的温度下降,此时用手触摸就不觉得烫手;但是当鸡蛋壳上的水消失后,由于刚煮熟的鸡蛋温度很高,里面的热量很快就会传出来,不一会儿,就会使外面的温度跟里面一样高,这时再用手去触摸就会感到很烫手了.就是这个道理.1年前查看全部
- 碳酸钙和稀盐酸鸡蛋壳主要的成分是碳酸钙.为了测定某鸡蛋壳中碳酸钙的质量分数,小红进行了如下实验:将鸡蛋壳洗净·干燥并捣碎
碳酸钙和稀盐酸
鸡蛋壳主要的成分是碳酸钙.为了测定某鸡蛋壳中碳酸钙的质量分数,小红进行了如下实验:将鸡蛋壳洗净·干燥并捣碎后,称得10克放在烧杯中,然后往烧杯中加入足量的稀盐酸90克,充分反应后,称得反应剩余物为97·14克.(假设其他物质不和稀盐酸反应)
(1)·产生二氧化碳气体 克
(2)·计算该鸡蛋壳中碳酸钙的质量分数. liuafei1年前1
liuafei1年前1 -
 琪琪儿 共回答了22个问题
琪琪儿 共回答了22个问题 |采纳率95.5%1.m(CO2)=90g+10g-97.14g=2.86g(质量守恒)
2.CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
100g 44g
m(CaCO3) 2.86g
用比例解得m(CaCO3) =6.5g
w(CaCO3) =6.5g/10g*100%=65%1年前查看全部
- 利用鸡蛋壳与草酸中和制备草酸钙,如何检验生成物是草酸钙
 我要开始行动1年前1
我要开始行动1年前1 -
 他猪 共回答了21个问题
他猪 共回答了21个问题 |采纳率100%检验是否有草酸钙可以向溶液中加入高锰酸钾溶液 看是否褪色
还有一个方法我觉得应该可以
灼烧草酸钙固体后会生成碳酸钙,加入盐酸若有令澄清石灰水变浑浊的气体即CO2产生可验证存在
第一个方法应该可以,草酸根可以被氧化1年前查看全部
- (2008•邵阳)鸡蛋壳的主要成分是碳酸钙,某化学兴趣小组为了测定鸡蛋壳中碳酸钙的质量分数,称取50g样品,磨成粉末后,
(2008•邵阳)鸡蛋壳的主要成分是碳酸钙,某化学兴趣小组为了测定鸡蛋壳中碳酸钙的质量分数,称取50g样品,磨成粉末后,放在电炉上高温煅烧至质量不再发生变化,称量剩余物质量为30.2g.(有关反应的化学方程式为CaCO3
CaO+CO2↑假设鸡蛋壳样品中杂质不参加反应)据此计算:高温 .
(1)生成二氧化碳气体的质量;
(2)此鸡蛋壳样品中碳酸钙的质量分数. JKLMKLL1年前1
JKLMKLL1年前1 -
 偶不甘心 共回答了28个问题
偶不甘心 共回答了28个问题 |采纳率85.7%解题思路:根据化学方程式计算的步骤有:一设、二写、三找、四列、五答、六查.注意事项有:设未知数不带单位,计算过程中要带单位,结果要带单位.在本题中,分析题目信息和数据可知,减少的质量是二氧化碳的质量,根据二氧化碳的质量可以求出碳酸钙的质量,然后再求碳酸钙的质量分数.(1)生成CO2的质量:50g-30.2g=19.8g 答:生成二氧化碳气体的质量为19.8g.(2)设50g样品中含CaC03的质量为x CaCO3 高温 . CaO+CO2↑ 100&...
点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本考点考查了根据化学方程式的计算和物质的质量分数,是根据质量守恒定律求气体,记住遇到固体的差求气体.做题时要注意:化学方程式要写正确,始终不要忘记质量守恒定律在计算题中的应用,本考点主要出现在计算题中.1年前查看全部
- 鸡蛋壳主要成分caco3,小丽称取15g碎鸡蛋壳放入烧杯,向其中加入40g稀hcl溶液,恰好完全反应,反应后烧杯总质量为
鸡蛋壳主要成分caco3,小丽称取15g碎鸡蛋壳放入烧杯,向其中加入40g稀hcl溶液,恰好完全反应,反应后烧杯总质量为50.6
1.使用的稀hcl中hcl的质量分数
2.反应后得到的溶液中溶质的质量分数(结果保留一位小数) karry_jin1年前1
karry_jin1年前1 -
 lujia_1218 共回答了20个问题
lujia_1218 共回答了20个问题 |采纳率90%反应前总质量为40+15=55,反应后总质量为50.6
说明反应生成CO2的质量为55-50.6=4.4g
(因为CO2是气体,生成后飞升了.所以质量减少的部分就是生成CO2的质量)
列出反应方程式:
CaCO3 + 2HCl ====CaCl2 + H2O + CO2(气体) 设消耗HCl X克、CaCO3 Y克,生成CaCl2 Z克
10 73 111 44
Y X Z 4.4
X=7.3 Y=10 Z=11.1
所以:
(1)稀盐酸的质量分数为 7.3÷40×100%=18.25%=18.3%
(2)所得溶液质量分数为11.1÷(10+40-4.4)×100%=24.3%
p.s.因为鸡蛋壳中并不是全部成分都是CaCO3,按照题意、其他部分应该不和盐酸反应,所以这部分物质不算在溶液的体系内,所以是10+40而不是15+401年前查看全部
- 急寻:鸡蛋壳遇到食醋冒气泡鸡蛋壳遇到食醋冒气泡的现象并解释、
 沧海一栗20051年前9
沧海一栗20051年前9 -
 兰色小子 共回答了16个问题
兰色小子 共回答了16个问题 |采纳率81.3%因为鸡蛋壳的成分主要为CaCO3,而食醋是酸,所以当鸡蛋壳遇到食醋时,就发生了CaCO3与酸的反应,产生的气泡为CO21年前查看全部
- 用鸡蛋壳与稀盐酸反应制取和收集二氧化碳气体,其反应的化学方程式是:
 查明猫猫1年前3
查明猫猫1年前3 -
 琉璃风信子 共回答了21个问题
琉璃风信子 共回答了21个问题 |采纳率95.2%CaCO3+2HCl=CaCl2+H2O+CO2.1年前查看全部
- 向鸡蛋壳、草木灰、石灰石、纯碱等物质中滴加稀盐酸,都能产生CO2,其原因是( )
向鸡蛋壳、草木灰、石灰石、纯碱等物质中滴加稀盐酸,都能产生CO2,其原因是( )
A. 这些物质都是固体
B. 这些物质中都含有碳元素
C. 这些物质中都含有碳酸盐
D. 这些物质中都含有二氧化碳 谁是燕七1年前3
谁是燕七1年前3 -
 点击我的xx 共回答了19个问题
点击我的xx 共回答了19个问题 |采纳率89.5%解题思路:碳酸盐遇酸能反应生成二氧化碳.鸡蛋壳、草木灰、石灰石、纯碱等物质中都含有碳酸根,遇酸能反应生成二氧化碳气体,观察选项,故选C.
点评:
本题考点: 证明碳酸盐.
考点点评: 本题考查了碳酸盐的检验,完成此题,可以依据碳酸盐的检验方法进行,及采用加酸化气的方法.1年前查看全部
大家在问
- 1“我站在这里将豪无意义”英语怎么说
- 2把干燥的种子放在试管内,用酒精灯均匀烘烤,用此实验来测定种子中的含水量时,试管口应()
- 3除非你没有什么兴趣否则你将有机会看看电视节目是怎样录制的用英语怎么翻译
- 4除夕英语作文60词带翻译
- 5求老师解答:某班同学在军训队列表
- 6如图所示是古人搬运巨石的情境,针对图中的场景,下列说法中错误的是( )
- 7科学改变人类生活的100个瞬间读后感
- 844,某升降机电机的额定功率为3.0×104W,其中15%用来克服摩擦阻力,升降机可移动部分总重6.0×103N,设每位
- 9谁会这道题:—Is Nancy knocking
- 10请知道地下人行道的英语怎么说?要口语化的!
- 11经过两点可以画出几条直线?
- 12下列各句中没有语病的一句是 ( ) A.人生的价值和意义,其
- 13照料的近义词3Q了!
- 14求讲解 第一第二道题放在一起讲D1 Is it in that factory__"Red Flag" cars are
- 15列车以七十二千米每小时的速度向站在路旁的一人驶去,在列车行驶过程中鸣笛2秒,前方的人能听见几秒的笛声
