粉末状试样A是由等物质的量的MgO和Fe 2 O 3 组成的混合物,现进行如下实验:
 lgvc2022-10-04 11:39:541条回答
lgvc2022-10-04 11:39:541条回答| 粉末状试样A是由等物质的量的MgO和Fe 2 O 3 组成的混合物,现进行如下实验: ①取适量A进行铝热反应,产物中有单质B生成; ②另取20 g A全部溶于0.2 L 6.0 mol / L的盐酸中,得溶液C; ③将①中得到的单质B和溶液C反应,放出标准状况下4.48L的气体,生成溶液D,同时还有残留的单质B。请你填写下列空白: (1)①中铝热反应的化学方程式是_____________,产物中单质B的化学式是___________。 (2)③中反应的离子方程式是____________、____________。 (3)20g A中n(Fe 2 O 3 )=_________;若溶液D的体积仍视为0.2L ,则该溶液中c(Mg 2+ )=_______,c(Fe 2+ )=_______。 |

已提交,审核后显示!提交回复
共1条回复
相关推荐
- 淡黄色粉末状固体是什么
 zf8174131年前2
zf8174131年前2 -
 king730826 共回答了21个问题
king730826 共回答了21个问题 |采纳率95.2%中学化学淡黄色固体,Na2O2 淡黄色 粉末
硫,黄色晶体
FeS2 黄色晶体.1年前查看全部
- 硫酸钙和什么物质发生反应成水或粉末状啊?急!急!急!
硫酸钙和什么物质发生反应成水或粉末状啊?急!急!急!
请速回答答案!
 headhunting1年前1
headhunting1年前1 -
 lk_7 共回答了17个问题
lk_7 共回答了17个问题 |采纳率82.4%硫酸钙和什么物质发生反应都不会生成水的!但可以生成粉末状物质,那就是生成比硫酸钙(微溶)更难溶的物质,如硫酸钙和可溶性的钡盐或氢氧化钡反应都可以的.1年前查看全部
- 加热胶体溶液,会有沉淀产生.请问沉淀物以什么形式存在?(晶体,凝胶还是混合物或是粉末状的纯净物固体?)
加热胶体溶液,会有沉淀产生.请问沉淀物以什么形式存在?(晶体,凝胶还是混合物或是粉末状的纯净物固体?)
为什么? ztailiu1年前1
ztailiu1年前1 -
 space19811 共回答了23个问题
space19811 共回答了23个问题 |采纳率95.7%粉末状的纯净物固体,和直接生成的沉淀一样1年前查看全部
- 粉末状的碘化汞钾如何配置成碱性碘化汞钾?
 随风笑沧海1年前1
随风笑沧海1年前1 -
 fangwei82720 共回答了19个问题
fangwei82720 共回答了19个问题 |采纳率94.7%取碘化钾 10 g,加水10ml,溶解后,缓缓加入二氯化汞的饱和水溶液,随加随搅拌,至生成的红色沉淀不再溶解,加氢氧化钾 30 g,溶解后,再加二氯化汞的饱和水溶液 1 ml 或 1 ml 以上,并用适量的水稀释使成 200 ml,静置,使沉淀,即得.
用时倾取上层的澄明液应用.1年前查看全部
- 在一定温度下把粉末状硫酸铜晶体加入到盛有100ml水的烧杯中直至不能继续溶解为止把粉末状硫酸铜
在一定温度下把粉末状硫酸铜晶体加入到盛有100ml水的烧杯中直至不能继续溶解为止把粉末状硫酸铜
把粉末状硫酸铜晶体加入到盛有100ml的热水的烧杯中,直至不能继续溶解为止.再将一小块形状不规则的硫酸铜系在玻璃棒的中间.把玻璃棒放在烧杯上,将硫酸铜晶体尽到溶液中.静置一段时间,观察晶体形状和大小的变化.问题1、硫酸铜的大小和形状发生变化了吗?2、溶液中的硫酸铜发生了怎样的变化?3、该实验中设计到什么化学知识?(海水中的化学一章)
各位敬爱的哥哥姐姐们 这是我们今晚的作业 我不太会 不然我明天说不定就要挨揍了啊~
不是热水就是水 刚刚弄错了 呵呵 82922831年前1
82922831年前1 -
 ccg4444 共回答了16个问题
ccg4444 共回答了16个问题 |采纳率93.8%如果是热水,那么硫酸铜晶体会变大并且出现固定的形状(硫酸铜晶体),溶液中的硫酸铜会减少,溶液变浅,涉及的知识.不会是“结晶”吧1年前查看全部
- 某元素在室温下其单质成粉末状固体,加热易熔化.该单质在空气中燃烧发出蓝紫色火焰.
某元素在室温下其单质成粉末状固体,加热易熔化.该单质在空气中燃烧发出蓝紫色火焰.
为什么不可以是磷?,鬼火的颜色不就是蓝紫色吗? 卧室tt1年前1
卧室tt1年前1 -
 天使在地狱999 共回答了22个问题
天使在地狱999 共回答了22个问题 |采纳率77.3%这是硫!鬼火是磷化氢自燃而不是磷!1年前查看全部
- 初中化学中所有物质的颜色及状态如:CuSO4白色粉末状固体,溶于水后溶液呈蓝色
 qing01301年前1
qing01301年前1 -
 WQLSY 共回答了18个问题
WQLSY 共回答了18个问题 |采纳率88.9%Fe(OH)3红褐色沉淀 Fe2O3红(棕)色 Fe2(SO4)3、FeCl3 、Fe(NO3)3溶液(即Fe3+的溶液)黄色FeSO4 、FeCl2 、Fe(NO3)2、(即Fe2+)浅绿色 Fe块状是白色的,粉末状是黑色,不纯的是黑色
Cu(OH)2蓝色沉淀 CuO黑色 CuCl2、 Cu(NO3)2、 CuSO4溶液(即Cu2+的溶液)蓝色无水CuSO4是白色 CuSO4•5H2O是蓝色 Cu(紫)红色
BaSO4、AgCl是不溶于 HNO3的白色沉淀
CaCO3 BaCO3是溶于HNO3 的白色沉淀
KClO3白色 KCl白色 KMnO4紫黑色 MnO2黑色 Cu2(OH)2CO3绿色1年前查看全部
- 加热蒸发氯化铝溶液之后,有粉末状或者晶体状的物质析出,怎样分辨物质是氢氧化铝、氧化铝还是六水氯化铝
 温柔地笑1年前2
温柔地笑1年前2 -
 pgx0001000 共回答了18个问题
pgx0001000 共回答了18个问题 |采纳率88.9%答案:取一个烧杯,装入50毫升的蒸馏水,再取少量析出的物质,放入烧杯中.1、如果该物质不溶解,就再取该析出物质进行灼烧,由于氢氧化铝灼烧时会生成氧化铝和水蒸气,所以在上方罩一个干而冷的烧杯,如果烧杯内壁有水珠生成,则说明该物质是氢氧化铝;如果没有,则说明该物质是氧化铝:2、如果该物质溶解,再滴加少量氢氧化钠溶液,有白色沉淀生成,则说明该物质是六水氯化铝 .1年前查看全部
- 向试管中装粉末状药品时先使试管倾斜,盛药品的药匙送入试管底部后使试管直立,这样做的目的是
 sjcxch1231年前1
sjcxch1231年前1 -
 batiley 共回答了25个问题
batiley 共回答了25个问题 |采纳率80%这样做的目的是:防止药品沾在试管口和试管壁上.
化学实验时,取用粉末状固体药品的操作标准:一斜、二送、三直立.1年前查看全部
- 1.为了测定某粉末状黄铜(铜,锌的合金)样品中的铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40克稀盐酸分
1.为了测定某粉末状黄铜(铜,锌的合金)样品中的铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40克稀盐酸分四次加入烧杯中,均充分反应,实验数据如下
第一次 第二次 第三次 第四次
加入稀盐酸 10 10 10 10
质量
剩余固体 9.10 8.45 7.80 7.80
质量
(1)上述反应的化学方程式为 (2)根据锌的质量列出求解第二次生成氢气质量(x)的比例式 (3)所用稀盐酸的溶质的质量分数为 (4)用36.5%的浓盐酸配置40克上述稀盐酸,需要浓盐酸的质量为 (5)黄铜样品中铜的质量分数为
2.某同学欲测定草木灰中碳酸钾的含量,称取69克式样于烧杯中,加入29.2克稀盐酸恰好完全反应,充分反应后,称得混合物的总质量为93.8克(忽略二氧化碳的溶解对混合物质量的影响 求
(1)反应过程中产生的二氧化碳质量为
(2)该草木灰式样中碳酸钾的质量分数(这题要步骤,上面的都不用) qianjianren1年前1
qianjianren1年前1 -
 kbszhm 共回答了20个问题
kbszhm 共回答了20个问题 |采纳率95%1、答案:
(1)Zn+2HCl==H2↑+ZnCl2
(2)因为从第一次到第二次可以看出,10g稀盐酸可反应掉9.1-8.45=0.65gZn,故可知原样品质量为0.65+9.1=9.75g.第二次到第三次固体质量减少8.45-7.8=0.65g,在方程式可推算产生氢气质量x的比例式为x/2=0.65/65
(3)由第一次加入的稀盐酸充分反映可求知,10g稀盐酸中HCl的含量为2x(0.65/65)x36.5=0.73g,故其质量分数为0.73/10=0.073=7.3%
(4)用36.5%的浓盐酸配置40克上述稀盐酸,HCl质量守恒,40g上述稀盐酸含HCl质量为2.92g,对应36.5%的浓盐酸质量为2.92/36.5%=8g
(5)黄铜样品质量在(2)中已算出为9.75,第四次后剩余固体全为铜,故其质量分数为7.8/9.75=80%
2、答案:
(1)根据质量守恒,CO2的质量为29.2+69-93.8=4.4g
(忽略二氧化碳的溶解对混合物质量的影响)
(2)反应式K2CO3+2HCl==2KCl+H2O+CO2↑
生成4.4gCO2对应所需的碳酸钾质量为(4.4/44)x(39x2+12+48)=13.8g即69g样品中含碳酸钾13.8g,其质量分数为13.8/69=0.2=20%1年前查看全部
- 一种白色粉末状样品是有NA2SIO3和NA2SO3组成的,请你设计实验,在一次证实该样品的组成
 uneo1年前1
uneo1年前1 -
 小勇子哥哥 共回答了22个问题
小勇子哥哥 共回答了22个问题 |采纳率95.5%加入HCL
有白色晶状沉淀,证明有SIO32-
有刺激性气体生成,通入澄清石灰水变浑浊,证明有SO32-
再用焰色反应,点燃固体,火焰为黄色,证明有NA
参考Z1年前查看全部
- 为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,阳阳同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入
为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,阳阳同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
第一次 第二次 第三次 第四次
加入稀盐酸质量(g) 10 10 10 10
剩余固体的质量(g) 9.10 8.45 7.80 7.80 (1)金属----------(填化学式)不与稀盐酸反应,原因是-------------------------(2)求参加反应的HCL的质量 3dnvcimce1年前1
3dnvcimce1年前1 -
 新恐龙化石 共回答了15个问题
新恐龙化石 共回答了15个问题 |采纳率86.7%初中的题吧,很高兴为你
1,Cu 铜在金属活动顺序表中排在氢的后面,不与盐酸反应
2,参加反应的HCl :设第三份盐酸反应的质量为x,则有
10/(9.10-8.45)=x/(8.45-7.80) 得 x=10
所以参加反应的盐酸为前三份:30克 原样品应该是9.10+0.65=9.75克
设参加反应的HCl 为y克
由Zn+2HCl=ZnCl2+H2
65 73
9.75-7.8 y
65/(9.75-7.8)=73/y 解得:y=2.19g
答,参加反应的HCl 的质量为2.19g
另外3,铜的质量分数为7.8/9.75=80%1年前查看全部
- 现有四种白色粉末状物质:1.消石灰粉2.生石灰粉3.熟石膏粉4.生石膏粉.在无其他任何仪器试剂的
现有四种白色粉末状物质:1.消石灰粉2.生石灰粉3.熟石膏粉4.生石膏粉.在无其他任何仪器试剂的
现有四种白色粉末状物质:1.消石灰粉2.生石灰粉3.熟石膏粉4.生石膏粉.
在无其他任何仪器试剂的情况下,仅可用加水搅拌法,问如何区分? 雪蓝蓝蓝1年前1
雪蓝蓝蓝1年前1 -
 阿默斯特的女尼 共回答了14个问题
阿默斯特的女尼 共回答了14个问题 |采纳率85.7%加水搅拌 放热使水升温的是生石灰和熟石膏 反应完成后悬浊液的是生石灰 糊状的是熟石膏
与水混合无 明显放热的是消石灰和生石膏 悬浊液的是消石灰 糊状的是生石膏1年前查看全部
- 将装有粉末状海波的试管放在烧杯中,
将装有粉末状海波的试管放在烧杯中,
1,逐渐补充温度较高的开水,一会儿发现()
1粉末状固体越来越少,温度及示数越来越高
2粉末.少,有流动性的液体出现,温度计示数不再上升
3粉末.少,有乳白色烟雾出现,温度计示数继续上升
4粉末状固体越来越多,温度计示数不再上升
2,停止加入热水一会儿后,在温度计示数保持不变的情况下()
1粉末状固体变成硬块状固体
2试管内的海波慢慢恢复到固态
3试管内的物质没有再发生明显的物态变化
4从试管液体内部冒出很多气泡
3如果使用石蜡代替海波做实验,则温度随时间变化的曲线应该是什么样
4请你描述石蜡溶化曲线上稍平坦一段表示的物理意义
还有为什么? 漠北风缘1年前1
漠北风缘1年前1 -
 jfjf31 共回答了22个问题
jfjf31 共回答了22个问题 |采纳率86.4%第一题,选2,因为海波是晶体,熔解时温度不上升.第二题选用2,因为是凝固过程.第三题,温度随时间而增高,没有平坦的线,第四题,它表示石蜡熔化时,吸的热不是全部用来升温,即熔化要吸热1年前查看全部
- 常温下为淡黄色粉末状固体有?
 king07461年前1
king07461年前1 -
 rehearse 共回答了14个问题
rehearse 共回答了14个问题 |采纳率100%S,过氧化钠1年前查看全部
- 粉末状物质压实后密度测定方法,我们的具体情况是:用碾压机对飞灰样品进行多次碾压以期望增大飞灰的压实程度,从而减少它的填埋
粉末状物质压实后密度测定方法,
我们的具体情况是:用碾压机对飞灰样品进行多次碾压以期望增大飞灰的压实程度,从而减少它的填埋体积.现在想测定碾压后的飞灰的密度.具体的取样及测定方法还请详细说明, andy_wang8005181年前1
andy_wang8005181年前1 -
 ★妖☆帅★ 共回答了23个问题
★妖☆帅★ 共回答了23个问题 |采纳率78.3%取扁平柱状的培养皿,称重m1
培养皿作为碾压容器,装入飞灰碾平压实后称重m2
洗干净培养皿,装满水称重m3
飞灰密度就是(m2-m1)/(m3-m1)1年前查看全部
- 粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物,引起铝热反应的实验操作是?
 jhtu5eytresh1年前1
jhtu5eytresh1年前1 -
 Sakura小樱 共回答了17个问题
Sakura小樱 共回答了17个问题 |采纳率94.1%点燃镁条1年前查看全部
- 由铁和氧化铁组成的粉末状混合物19.2 g,向其中加入250 mL未知浓度的稀硫酸,当固体全部溶解时,放出3.36
由铁和氧化铁组成的粉末状混合物19.2 g,向其中加入250 mL未知浓度的稀硫酸,当固体全部溶解时,放出3.36
氢气(标准状况).经测定,溶液中c(H+)为1.6 mol·L-1,且反应后的溶液中不含三价铁离子,求:
(1)混合物中铁和氧化铁的质量各为多少?
(2)所加稀硫酸的物质的量浓度是多少? chycmm1年前2
chycmm1年前2 -
 laseax 共回答了26个问题
laseax 共回答了26个问题 |采纳率80.8%铁:xmol ; 三氧化二铁:ymol
56x+160y=19.2 ; x=0.2 ; m(Fe)=11.2g
x-y=3.36/22.4=0.15 ; y=0.05 ; m(Fe2O3)=8g
c(FeSO4)=(0.2+0.05*2)/0.25=1.2mol/L
c(H2SO4)=1.2+1.6/2=2.0mol/L
设铁为xmol,氧化铁ymol
Fe——H2
0.15.0.15
Fe2O3——2Fe3+——Fe——3Fe2+
.x.x.x
根据题意,铁质量为19.2=56*(x+0.15)+160*x
得x=0.05mol
故原混合物中Fe质量为56*(0.05+0.15)=11.2g
Fe2O3质量为160*0.05=8g
根据守恒,铁元素最后变为FeSO4,物质的量为0.05*2+0.05+0.15=0.3mol,故反应掉H2SO4物质的量为0.3mol
题中“经测定,硫酸实际消耗了三分之五”为“五分之三”吧
若为3/5,则,硫酸总物质的量为0.5mol,物质的量浓度为0.5/0.25=2mol/L
我也在做这题.
Fe + H2SO4 = FeSO4 + H2↑
1 1 1 22.4L
0.15mol 0.15mol 3.36L
mFe=8.4g
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe+Fe2(SO4)3=
由上两个得
Fe+Fe2O3+3H2SO4=3FeSO4+3H2O
因为反应后无Fe3+离子,所以Fe和Fe2O3恰好完全反应
Fe+Fe2O3+3H2SO4=3FeSO4+3H2O
56 160 3
x x y
有56x+160x=10.8 x=0.05mol y=0.15mol
总的n(Fe)=0.15mol+0.05mol=0.2mol m(Fe)=11.2g
n(Fe2O3)=0.05mol m(Fe2O3)=8g
已反应的H2SO4物质的量为0.15mol+0.15mol=0.3mol
溶液中c(H+) 为1.6mol*L^(-1),所以有H2SO4物质的量1.6mol/L*0.25L*1/2=0.2mol
总的H2SO4物质的量为0.3mol+0.2mol=0.5mol
物质的量的浓度为0.5mol/0.25L=2mol/L1年前查看全部
- 高中化学哪些物质是黄色粉末状的?
 loyalhuazy1年前1
loyalhuazy1年前1 -
 yy90号 共回答了12个问题
yy90号 共回答了12个问题 |采纳率91.7%过氧化钠,硫(不是粉末),AgBr(不是粉末),有点想不起来,但如果做推断题,绝对少不了它们.1年前查看全部
- 室温下单质呈粉末状固体,加热易熔化.单质A是短周期的一个元素,
室温下单质呈粉末状固体,加热易熔化.单质A是短周期的一个元素,
A是短周期的一个元素,且A在室温下单质呈粉末状固体,加热易熔化.A单质在氧气中燃烧,发出明亮的蓝紫色火焰.问,A是什么东西?
请说明原因。 gtrfgtfrfgrfgf1年前4
gtrfgtfrfgrfgf1年前4 -
 liuhui10001 共回答了17个问题
liuhui10001 共回答了17个问题 |采纳率94.1%是硫单质 S.硫单质是一种淡黄色的粉末状固体,熔点低,能在氧气中燃烧产生蓝紫色火焰,根据火焰颜色是蓝紫色可以判断,且硫粉受热易融化 .1年前查看全部
- 粉末状固体,用量不大,一般采用()取用,用量大,用()
 ˊ風吹過﹎1年前1
ˊ風吹過﹎1年前1 -
 宜韩 共回答了11个问题
宜韩 共回答了11个问题 |采纳率90.9%药匙1年前查看全部
- 蜡烛燃烧实验:用白瓷板压在火焰上,在白瓷板上可以观察到黑色的粉末状物质,说明蜡烛中含有什么元素?
 fionayf1年前3
fionayf1年前3 -
 巴托姆 共回答了15个问题
巴托姆 共回答了15个问题 |采纳率73.3%碳元素1年前查看全部
- 关于蜡烛的化学实验点燃后在火焰上方放一白瓷板会发现有黑色的粉末状物体,说明什么从火焰中,可以引出白烟,说明什么吹灭蜡烛后
关于蜡烛的化学实验
点燃后在火焰上方放一白瓷板会发现有黑色的粉末状物体,说明什么
从火焰中,可以引出白烟,说明什么
吹灭蜡烛后的瞬间看到什么,说明什么
怎样来说明蜡烛点燃后在空气中和氧气反应可以生成二氧化碳和水
还有为什么有的时候是黑烟的也有白烟的,这是为什么啊
没办法,刚刚入门呢,还望耐心回答 andyjjp1111年前3
andyjjp1111年前3 -
 顶帖支持18 共回答了25个问题
顶帖支持18 共回答了25个问题 |采纳率92%白瓷板有黑色粉末说明蜡烛由碳元素组成
引出白烟说明有石蜡燃烧后又液化的小颗粒
蜡烛和氧气反应后所收集到气体会使石灰水变浑浊说明有CO2、而在蜡烛燃烧时在上方放一个干燥的烧杯、以后会发现干燥的烧杯壁上有小水滴、说明蜡烛燃烧生成水
黑烟是碳的小颗粒、白烟是石蜡的小颗粒(都是固体)
应该就是这些了吧、、、唉、、、我差点都记不清了1年前查看全部
- 在试管中加入粉末状固体时,用长柄钥匙或纸槽伸到试管底部的原因是什么
 3933974591年前1
3933974591年前1 -
 L筱 共回答了23个问题
L筱 共回答了23个问题 |采纳率87%防止粉末粘到试管壁或试管口1年前查看全部
- 向试管中加入粉末状固体时,用长柄药匙或纸槽伸到试管底部的原因
向试管中加入粉末状固体时,用长柄药匙或纸槽伸到试管底部的原因
向试管中加入粉末状固体时,用长柄药匙或纸槽伸到试管底部,原因是 guojianbin1年前1
guojianbin1年前1 -
 wwj3168 共回答了17个问题
wwj3168 共回答了17个问题 |采纳率94.1%防止固体药品沾到试管壁上.1年前查看全部
- 如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案的编号填入在表内相应的空格内(如果不需要外
如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案的编号填入在表内相应的空格内(如果不需要外加试剂,则对应答案栏可空着)。
1.可供选择的试剂:
Ⅰ.可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳 
 路边的骨头1年前1
路边的骨头1年前1 -
 魔法之屋 共回答了16个问题
魔法之屋 共回答了16个问题 |采纳率87.5%(1)B,④ (2)D,④,⑤ (3)A,④ (4)A,④ (5)③ (6)②
可根据二氧化硅是不溶于水的酸性氧化物;它可跟强碱反应,不跟酸(氢氟酸除外)反应;它受热不分解等性质。而三氧化二铁,碳酸钙跟盐酸反应;硅酸、氯化铵能受热分解。通过一定操作,除去杂质。除杂过程中所发生的化学方程式如下:
(1)SiO 2 +2NaOH==Na 2 SiO 3 +H 2 O
(3)Fe 2 O 3 +6HCl==2FeCl 3 +3H 2 O
(4)CaCO 3 +2HCl==CaCl 2 +CO 2 ↑+H 2 O
(5)H 2 SiO 3 SiO 2 +H 2 O
SiO 2 +H 2 O
(6)NH 4 Cl NH 3 ↑+HCl↑
1年前查看全部
NH 3 ↑+HCl↑
1年前查看全部
- 在实验室取用块状固体应用______;取粉末状的固体时应用______,加热物质一般用______做热源,给试管中的液体
在实验室取用块状固体应用______;取粉末状的固体时应用______,加热物质一般用______做热源,给试管中的液体加热时,要用______夹持,而且液体不能超过试管容积的[1/3][1/3],试管口不能______.
 wangdtjs1年前1
wangdtjs1年前1 -
 liubuzhu 共回答了19个问题
liubuzhu 共回答了19个问题 |采纳率100%解题思路:根据实验室常用仪器的名称与用途、给试管中的液体与固体加热的方法、注意事项等进行分析解答.在实验室取用块状固体应用镊子;取用粉末状药品要用药匙或纸槽;酒精灯是常用的给物质加热的仪器;给试管中的液体加热时,试管内液体不可超过试管容积的三分之一;要用试管夹夹持,而且试管口倾斜与桌面约成45度角;为防止液体沸腾时喷出伤人,试管口不能朝向自己或别人.
故答案为:镊子; 药匙;酒精灯;试管夹; 1/3;对着自己或他人.点评:
本题考点: 固体药品的取用;给试管里的液体加热.
考点点评: 化学是一门以实验为基础的学科,化学实验是考查的重点、难点和热点,特别是基本操作,了解仪器的名称、用途、使用方法和注意事项,是解题的前提.1年前查看全部
- 雅安地震后,救援的医护人员需将每瓶含0.5g粉末状抗生素配成质量分数为20%的溶液用于消毒,则每瓶配制需加入蒸馏水(
雅安地震后,救援的医护人员需将每瓶含0.5g粉末状抗生素配成质量分数为20%的溶液用于消毒,则每瓶配制需加入蒸馏水( )
A. 1.5mL
B. 2mL
C. 3mL
D. 4mL didiking1年前1
didiking1年前1 -
 nhguohuan 共回答了15个问题
nhguohuan 共回答了15个问题 |采纳率93.3%解题思路:根据溶质质量分数=
×100%,结合题意进行分解答即可.溶质质量 溶液质量 解;每瓶含0.5g粉末状抗生素能配成质量分数为20%的溶液的质量为0.5g÷20%=2.5g,则每瓶配制需加入蒸馏水的质量为2.5g-0.5g=2g(合2mL).
故选:B.点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 本题难度不大,掌握溶质质量分数的有关计算并能灵活运用是正确解答本题的关键.1年前查看全部
- 为了探究物质的升华与凝华,小明设计了下面的实验:在一个烧瓶中装入少量碾成粉末状的萘,并在烧瓶中悬挂
为了探究物质的升华与凝华,小明设计了下面的实验:在一个烧瓶中装入少量碾成粉末状的萘,并在烧瓶中悬挂
小树枝,然后用酒精灯加热烧瓶底部 (1):用酒精灯加热烧瓶底部,可以看到烧瓶底部的萘粉末 (变多 不变 变少),仔细观察(有 没有)液态物质生成,这说明萘发生了(物态变化名称)现象.(2)熄灭酒精灯,冷却后,将烧瓶内的树枝取出,会看到树枝上挂上了洁白的雪,没有液态物质出现,这说明萘是由 态直接变成了 态,发生了(物态变化名称)现象.(3)如果不给萘加热,或一直给萘加热,会不会发生上面所说的现象?说出你的猜想,并说明 猜想的依据 tianshimeihuo281年前1
tianshimeihuo281年前1 -
 fofpeng 共回答了17个问题
fofpeng 共回答了17个问题 |采纳率94.1%答题:
1、变少、没有、升华
2、气、固、凝华
3、不会,因为升华过程要吸收热量,凝华过程要放出热量.1年前查看全部
- 溶解食盐的实验中我们用()来取粉末状固体
 小莲1年前4
小莲1年前4 -
 ppvvokok 共回答了19个问题
ppvvokok 共回答了19个问题 |采纳率84.2%溶解食盐的实验中我们用(药匙)来取粉末状固体1年前查看全部
- 跪求一种导热系数低的原料!急寻一种导热系数较低的材料,具保温隔热性,粉末状(对人无害),能与硅酸盐参和.我方要求粉末能到
跪求一种导热系数低的原料!
急寻一种导热系数较低的材料,具保温隔热性,粉末状(对人无害),能与硅酸盐参和.
我方要求粉末能到达几百目以上的细度 旧新花样1年前3
旧新花样1年前3 -
 lchjgzh 共回答了20个问题
lchjgzh 共回答了20个问题 |采纳率95%sio2二氧化硅1年前查看全部
- 请问加入高锰酸钾在水里面之后,水是变成红色还是紫红色?水的温度会变高吗?最好是粉末状的化学药品
 yglxd661年前1
yglxd661年前1 -
 SHAKE007 共回答了15个问题
SHAKE007 共回答了15个问题 |采纳率73.3%紫红~ 不会变温度~1年前查看全部
- 这两种物质是什么?绿色结晶粉末状物质加入无色液体后,形成无色溶液,请问这两种物质分别是什么
 popart1年前1
popart1年前1 -
 斋藤卓也 共回答了23个问题
斋藤卓也 共回答了23个问题 |采纳率82.6%FECL2+2NAOH=FE(OH)2+2NACL1年前查看全部
- 食品包装盒中常放一小袋粉末状物质,该物质对食品同时具有防潮和防氧化作用.某同学从超市购买的食品包装盒中取出装有粉末状物质
食品包装盒中常放一小袋粉末状物质,该物质对食品同时具有防潮和防氧化作用.某同学从超市购买的食品包装盒中取出装有粉末状物质的小袋,撕开发现袋里有板结的铁锈.试推测粉末状物质是什么?其作用原理是什么?
 粤想粤好1年前3
粤想粤好1年前3 -
 cys_hff8183 共回答了19个问题
cys_hff8183 共回答了19个问题 |采纳率94.7%解题思路:铁能与氧气和水反应生成铁锈,从而对食品起到保护作用.粉末状物质是铁粉;铁粉能与水、氧气反应生成铁锈,既吸水又消耗了能促使食品变质的氧气,从而延长了食品的保质期.
点评:
本题考点: 食品干燥剂、保鲜剂和真空包装的成分探究;金属锈蚀的条件及其防护.
考点点评: 解答本题的关键是要掌握铁的性质,只有掌握了铁的性质才能确定铁的用途.1年前查看全部
- 用小刀将数十只萤火虫的发光器割下,干燥后形成粉末状,取两等份分别装入两只小玻璃管中,各加入少量的水,使之混合,可见到玻璃
用小刀将数十只萤火虫的发光器割下,干燥后形成粉末状,取两等份分别装入两只小玻璃管中,各加入少量的水,使之混合,可见到玻璃管中发出淡黄色萤光,约过15分钟萤光消失.这时,再将ATP溶液加入其中一只玻璃管中,将葡萄糖溶液加入另一只玻璃管中,发现加ATP溶液的玻璃管中发出萤光,而加葡萄糖溶液的管中不发萤光.

(1)向A,B两管加水后,两管均发光,这说明水对生物正常的生命活动有何重要意义?___
(2)发光器发出萤光说明了研磨成的粉末中含有哪种物质?___
(3)以上现象说明了什么问题;
①萤火虫发光是将___能转变成___能的过程;
②这一过程所需的能量由___提供;
③___不是生命活动的直接能源.
(4)若向刚切下的萤火虫的发光器上滴加葡萄糖溶液,你认为会发萤光吗?___,为什么?___.
 带露的洁西1年前1
带露的洁西1年前1 -
 漂漾叶子 共回答了18个问题
漂漾叶子 共回答了18个问题 |采纳率72.2%解题思路:ATP是一种含有高能磷酸键的有机化合物,它的大量化学能就储存在高能磷酸键中.ATP水解释放能量断裂的是末端的那个高能磷酸键.ATP是生命活动能量的直接来源,但本身在体内含量并不高.ATP来源于光合作用和呼吸作用,场所是细胞质基质、叶绿体和线粒体.解(1)向A,B两管加水后,两管均发光,这说明生物体内许多重要的生化反应均要在水中才能进行.(2)发光器发出萤光说明了研磨成的粉末中含有少量的ATP.(3)以上现象说明:①萤火虫发光是将化学能转变成光能的过程...
点评:
本题考点: ATP在能量代谢中的作用的综合
考点点评: 本题考查了ATP在生命活动中的作用,意在考查考生的分析理解能力和应用能力,能理解所学知识的要点,把握知识间的内在联系的能力,解答本题的关键是掌握ATP的结构及作用特点.1年前查看全部
- 比较粉末状,粒状,柱状活性炭对苯酚的吸附能力,并且解释下原因.
比较粉末状,粒状,柱状活性炭对苯酚的吸附能力,并且解释下原因.
是不是吸附剂被磨细了之后,其吸附能力就加大了呢? liuyjnx1年前1
liuyjnx1年前1 -
 我得上网 共回答了23个问题
我得上网 共回答了23个问题 |采纳率87%如果是相同材料,材料相对表面积越大,吸附能力越强1年前查看全部
- 由一种黑色单质和一种黑色氧化物、按一定的量组成的粉末状混合物、高温后黑色粉末状转变成光良的红色金属、同时产生一种能使澄清
由一种黑色单质和一种黑色氧化物、按一定的量组成的粉末状混合物、高温后黑色粉末状转变成光良的红色金属、同时产生一种能使澄清石灰水变浑浊的无色气体则这种黑色粉末的成分可能是(填化学式)、上述变化的有关化学反应方程式为
 小吉祥11191年前2
小吉祥11191年前2 -
 lucchini 共回答了22个问题
lucchini 共回答了22个问题 |采纳率90.9%C+2CuO=CO2+2Cu
CO2+Ca(OH)2=CaCO3(沉淀)+H2O1年前查看全部
- 取用粉末状固体和液体的注意事项取用固体粉末若不指定用量,一般只需要___即可不定量取用液体,若不指定用量,一般只取___
取用粉末状固体和液体的注意事项
取用固体粉末若不指定用量,一般只需要___即可
不定量取用液体,若不指定用量,一般只取________即可
还有
给试管里的液体加热,让试管倾斜,跟桌面成_______度角 走过就是了1年前1
走过就是了1年前1 -
 timoboll1981 共回答了20个问题
timoboll1981 共回答了20个问题 |采纳率90%固体只要盖满试管的底部
液体1ml~2ml
约45°1年前查看全部
- 请问nicl3(三氯化镍)都有哪些性质,在常温下能以粉末状稳定存在么,熔点和沸点怎样,稳定性随温度如何变
请问nicl3(三氯化镍)都有哪些性质,在常温下能以粉末状稳定存在么,熔点和沸点怎样,稳定性随温度如何变
能查到的化学课讲义上说ni的三价离子不稳定,还说不存在ni的三价盐,是真的么,比较困惑,分数一定会给,混分的不必浪费时间了,我会看清楚, 丛西二小1年前1
丛西二小1年前1 -
 楚程阳 共回答了18个问题
楚程阳 共回答了18个问题 |采纳率83.3%不存在NiCl3,1年前查看全部
- 用王水溶粗金,后用铁丝在里面搅,直接就出来粉末状的固体,是金子 但是溶液仍然是强酸性,为什么?
用王水溶粗金,后用铁丝在里面搅,直接就出来粉末状的固体,是金子 但是溶液仍然是强酸性,为什么?
王水是现配的,大概20ml,放入粗金后,放置了大约2个半小时,铁丝放进去是一直冒泡并同时析出固体的 zhaoyufeng_19811年前2
zhaoyufeng_19811年前2 -
 寂静岭上的流浪狗 共回答了29个问题
寂静岭上的流浪狗 共回答了29个问题 |采纳率96.6%王水对于金属的强烈腐蚀性表现在配比物生成的强氧化性(硝酸的腐蚀体现在硝酸根上而非氢离子)与氯离子络合物与金属形成配离子以降低金属离子的氧化性从而达到溶解黄金的目的.但因为王水会发生自反应(氯离子遭到硝酸的氧化生成氯气以及各种各样的东西),一旦王水过期后,即使液体仍表现酸性但其开始阶段的氧化性减弱,至铁加入后进一步降低氧化性并夺取配离子中氯离子的位置,从而体现出金离子的氧化性从而制得提纯的化学金.1年前查看全部
- 如何取用密度较大的块状固体药品?如何取用粉末状固体药品?没有说明用量一般取多少?
 VcB2_20001年前5
VcB2_20001年前5 -
 yitian8479 共回答了16个问题
yitian8479 共回答了16个问题 |采纳率93.8%将一试管横放,用镊子夹取块状固体,放在试管口,慢慢倾斜使固体药品缓缓滑到试管底部.
将一试管横放,装有药品的药匙或纸槽缓慢地伸入试管底部,迅速地将试管竖立起来,使药品全部落到试管底部.
如果没有说明药品用量,一般按最小量取用:液体药品1~2毫升;固体药品只需盖满试管底部.1年前查看全部
- 做干燥剂的生石灰块状变成粉末状为什么属于化学变化?
做干燥剂的生石灰块状变成粉末状为什么属于化学变化?
?为什么?
 我要去个地方1年前1
我要去个地方1年前1 -
 橡胶人体50 共回答了15个问题
橡胶人体50 共回答了15个问题 |采纳率93.3%生石灰变成熟石灰了
CaO+H2O=Ca(OH)21年前查看全部
- 都来猜猜看:这是什么物质?一种白色粉末状固体和一种颗粒状固体(透明),在一起时不发生反应,加水时发生反应,放出气体(好像
都来猜猜看:这是什么物质?
一种白色粉末状固体和一种颗粒状固体(透明),在一起时不发生反应,加水时发生反应,放出气体(好像不支持燃烧,***).这两种物质都是易取得且价格便宜的. wtoscn1年前2
wtoscn1年前2 -
 kubghbyuil 共回答了20个问题
kubghbyuil 共回答了20个问题 |采纳率95%白色粉末状固体:NaHCO3
颗粒状固体:NaHSO4
固体时不反应,加水后生成CO2:
NaHCO3+NaHSO4=Na2SO4+CO2↑+H2O1年前查看全部
- (2008•遵义)近几年木糖醇作为新型甜味剂正在悄悄地代替蔗糖进入生活.木糖醇(化学式C5H12O5)是白色粉末状固体.
(2008•遵义)近几年木糖醇作为新型甜味剂正在悄悄地代替蔗糖进入生活.木糖醇(化学式C5H12O5)是白色粉末状固体.木糖醇与蔗糖的溶解度曲线如图I所示(图中a<b<c),在口腔中细菌的作用下pH变化如图Ⅱ所示.试回答:
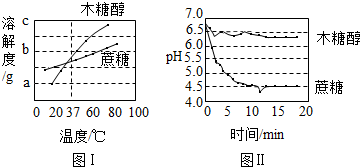
(1)在37℃时木糖醇的溶解度______.
(填“大于”或“小于”)蔗糖的溶解度,将60℃等质量的该两种物质的饱和溶液分别降到18℃,析出晶体后,此时所得溶液溶质质量分数较大的是______(填“蔗糖”或“木糖醇”).
(2)人们使用含糖较高的物质在口腔中细菌的作用下能产生酸性物质、腐蚀牙齿,形成龋齿,则食用______(填“蔗糖”或“木糖醇”)能有效的防止龋齿.
(3)蔗糖在一定条件下发生水解反应:
C12H22O11(蔗糖)+H2O═C6H12O6(葡萄糖)+X(果糖)
则X的化学式为______.
(4)木糖醇具有可燃性,它在足量的氧气中燃烧的化学方程式是2C5H12O5+11O2
10CO2+12H2O点燃 .2C5H12O5+11O2.
10CO2+12H2O点燃 . boke5211年前1
boke5211年前1 -
 海角大虾 共回答了13个问题
海角大虾 共回答了13个问题 |采纳率100%解题思路:(1)解读溶解度曲线可以看出在木糖醇和蔗糖的溶解度变化关系
(2)信息中酸性环境造成龋齿,且酸性越强,月容易形成龋齿,结合图II可以分析出,在口腔内木糖醇和蔗糖引起的酸碱性变化情况.
(3)根据质量守恒定律可以得出葡萄糖的化学式
(4)根据反应物和生成物写出化学方程式.(1)从图中可以看出,在37℃时木糖醇的溶解度大于蔗糖的溶解度.将60℃等质量的该两种物质的饱和溶液分别降到18℃,析出晶体后,得到饱和溶液,18℃时,蔗糖的溶解度大于木糖醇,因此蔗糖的溶质质量分数大.
(2)根据“人们食用含糖较多的物质在口腔中细菌的作用下产生酸性物质,腐蚀蛀坏牙齿,形成龋齿”,可知,酸性物质容易造成龋齿,且酸性越强,越容易造成龋齿.根据图II可以看出,木糖醇在口腔内造成酸性增强,但是蔗糖的酸性更强.所以食用 木糖醇能有效防止龋齿.
(3)蔗糖在一定条件下发生水解反应:C12H22O11(蔗糖)+H2O→X(葡萄糖)+C6H12O6(果糖),通过观察,一个X分子中含有6个碳原子、12个氢原子和6个氧原子,所以X的化学式C6H12O6.
(4)木糖醇燃烧的化学方程式为:2C5H12O5+11O2
点燃
.
10CO2+12H2O
故答案为:(1)大于.蔗糖(2)木糖醇(3)C6H12O6.
(4)2C5H12O5+11O2
点燃
.
10CO2+12H2O.点评:
本题考点: 固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 对于多问,且设计内容较多的,要注意审题时避免彼此之间的干扰,冷静答题,沉着思考.1年前查看全部
- 氧化亚铜(Cu 2 O)是鲜红色粉末状固体,可用作杀菌剂、陶瓷和搪瓷的着色剂、红色玻璃染色剂等。现将 Cu 2 O 和
氧化亚铜(Cu 2 O)是鲜红色粉末状固体,可用作杀菌剂、陶瓷和搪瓷的着色剂、红色玻璃染色剂等。现将 Cu 2 O 和 Cu 的固体混合物 6.8g 放入烧杯中,加入足量的稀硫酸,充分反应后,过滤、洗涤、干燥,得到 4.8g 固体。(已知Cu 2 O+H 2 SO 4 =CuSO 4 +Cu+H 2 O)。则原混合物中的 Cu 2 O 和 Cu 质量比为
A.9∶8 B.17∶12 C.1∶1 D.9∶4  lemore1年前1
lemore1年前1 -
 梨花院里叩重门 共回答了24个问题
梨花院里叩重门 共回答了24个问题 |采纳率87.5%A
1年前查看全部
- 1.铁 镁 铜 铝等金属的颜色 粉末状时的颜色
1.铁 镁 铜 铝等金属的颜色 粉末状时的颜色
2.什么什么亚什么 的“亚”的含义 氧化铁和氧化亚铁的化学式和不同点
3.气割气焊分别利用了氧气的化学物理什么性质
4.什么酸可溶(或不可溶) 什么碱可溶(或不可溶) 什么盐可溶(或不可溶)
5.氧 氢 二氧化碳 氮等气体是可溶?易溶还是?密度和空气相比大还是小
6.铁镁铜铝等金属在水中形成溶液的颜色
6.洗涤剂 和汽油洗油污区别是
半个小时内给我啊谢谢~ 猪在七楼半1年前3
猪在七楼半1年前3 -
 飞天06 共回答了15个问题
飞天06 共回答了15个问题 |采纳率93.3%在学初三化学中,许多同学面对繁多的方程式、极易混淆的概念、定义及灵活多变的选择题、推断题时,常常觉得无从下手.事实上,只要掌握一定的学习方法和技巧,化学学习也可以得心应手!
首先,大家要学会利用笔记.所谓记笔记是“记住笔记”,大家不能一味的追求笔记内容的全面而忽略了记笔记的原始目的.每天做作业前,浏览笔记,争取对当天所学的内容有个整体的印象;在对某一个章节进行一段时间的学习后,把典型例题或自己易忽略的小经验、小窍门等,用不同的颜色将他们圈圆圈出来,分别列出那些是重点,那些是次重点,考试前则要对重点及易错点着重复习.
由于化学考试以实验出题居多,所以做好每一次实验就显得非常重要.对vcm仿真实验里的演示实验,课前,教师应演练几遍,以便课堂上操作干净利落,效果明显.教学时可采取先让学生猜结果,然后边做边让学生观察有什么现象发生,再解开这些谜,使学生体验到学习物理知识是有趣的.
化学学科概念多、方程式多、易混淆.因此,初三学生别忘了每隔一段时间,把学过的内容复习一遍,在复习的过程中,要注意查漏补缺,对自己不完全理解的内容要及时向老师提问.每一次复习,就是对自己所学内容的一次升级,最终目的是不让自己在这一部分知识中留有死角.
基本概念:
1、化学变化:生成了其它物质的变化
2、物理变化:没有生成其它物质的变化
3、物理性质:不需要发生化学变化就表现出来的性质
(如:颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等)
4、化学性质:物质在化学变化中表现出来的性质
(如:可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等)
5、纯净物:由一种物质组成
6、混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质
7、元素:具有相同核电荷数(即质子数)的一类原子的总称
8、原子:是在化学变化中的最小粒子,在化学变化中不可再分
9、分子:是保持物质化学性质的最小粒子,在化学变化中可以再分
10、单质:由同种元素组成的纯净物
11、化合物:由不同种元素组成的纯净物
12、氧化物:由两种元素组成的化合物中,其中有一种元素是氧元素
13、化学式:用元素符号来表示物质组成的式子
14、相对原子质量:以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的值
某原子的相对原子质量=
相对原子质量 ≈ 质子数 + 中子数 (因为原子的质量主要集中在原子核)
15、相对分子质量:化学式中各原子的相对原子质量的总和
16、离子:带有电荷的原子或原子团
化学知识点的归纳总结.
一、初中化学常见物质的颜色
(一)、固体的颜色
1、红色固体:铜,氧化铁
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾
5、淡黄色固体:硫磺
6、无色固体:冰,干冰,金刚石
7、银白色固体:银,铁,镁,铝,汞等金属
8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
(二)、液体的颜色
11、无色液体:水,双氧水
12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液
16、紫色溶液:石蕊溶液
(三)、气体的颜色
17、红棕色气体:二氧化氮
18、黄绿色气体:氯气
19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体.
二、初中化学之三
1、我国古代三大化学工艺:造纸,制火药,烧瓷器.
2、氧化反应的三种类型:爆炸,燃烧,缓慢氧化.
3、构成物质的三种微粒:分子,原子,离子.
4、不带电的三种微粒:分子,原子,中子.
5、物质组成与构成的三种说法:
(1)、二氧化碳是由碳元素和氧元素组成的;
(2)、二氧化碳是由二氧化碳分子构成的;
(3)、一个二氧化碳分子是由 一个碳原子和一个氧原子构成的.
6、构成原子的三种微粒:质子,中子,电子.
7、造成水污染的三种原因:
(1)工业“三废”任意排放,
(2)生活污水任意排放
(3)农药化肥任意施放
8、收集方法的三种方法:排水法(不容于水的气体),向上排空气法(密度比空气大的气体),向下排空气法(密度比空气小的气体).
9、质量守恒定律的三个不改变:原子种类不变,原子数目不变,原子质量不变.
10、不饱和溶液变成饱和溶液的三种方法:增加溶质,减少溶剂,改变温度(升高或降低).
11、复分解反应能否发生的三个条件:生成水、气体或者沉淀
12、三大化学肥料:N、P、K
13、排放到空气中的三种气体污染物:一氧化碳、氮的氧化物,硫的氧化物.
14、燃烧发白光的物质:镁条,木炭,蜡烛.
15、具有可燃性,还原性的物质:氢气,一氧化碳,单质碳.
16、具有可燃性的三种气体是:氢气(理想),一氧化碳(有毒),甲烷(常用).
17、CO的三种化学性质:可燃性,还原性,毒性.
18、三大矿物燃料:煤,石油,天然气.(全为混合物)
19、三种黑色金属:铁,锰,铬.
20、铁的三种氧化物:氧化亚铁,三氧化二铁,四氧化三铁.
21、炼铁的三种氧化物:铁矿石,焦炭,石灰石.
22、常见的三种强酸:盐酸,硫酸,硝酸.
23、浓硫酸的三个特性:吸水性,脱水性,强氧化性.
24、氢氧化钠的三个俗称:火碱,烧碱,苛性钠.
25、碱式碳酸铜受热分解生成的三种氧化物:氧化铜,水(氧化氢),二氧化碳.
26、实验室制取CO2不能用的三种物质:硝酸,浓硫酸,碳酸钠.
27、酒精灯的三个火焰:内焰,外焰,焰心.
28、使用酒精灯有三禁:禁止向燃着的灯里添加酒精,禁止用酒精灯去引燃另一只酒精灯,禁止用嘴吹灭酒精灯.
29、玻璃棒在粗盐提纯中的三个作用:搅拌、引流、转移
30、液体过滤操作中的三靠:(1)倾倒滤液时烧杯口紧靠玻璃棒,(2)玻璃棒轻靠在三层滤纸的一端,(3)漏斗下端管口紧靠烧杯内壁.
31、固体配溶液的三个步骤:计算,称量,溶解.
32、浓配稀的三个步骤:计算,量取,溶解.
33、浓配稀的三个仪器:烧杯,量筒,玻璃棒.
34、三种遇水放热的物质:浓硫酸,氢氧化钠,生石灰.
35、过滤两次滤液仍浑浊的原因:滤纸破损,仪器不干净,液面高于滤纸边缘.
36、药品取用的三不原则:不能用手接触药品,不要把鼻孔凑到容器口闻药品的气味,不得尝任何药品的味道.
37、金属活动顺序的三含义:(1)金属的位置越靠前,它在水溶液中越容易失去电子变成离子,它的活动性就越强;(2)排在氢前面的金属能置换出酸里的氢,排在氢后面的金属不能置换出酸里的氢;(3)排在前面的金属能把排在后面的金属从它们的盐溶液中置换出来.
38、温度对固体溶解度的影响:(1)大多数固体物质的溶解度随着温度的升高而增大,(2)少数固体物质的溶解度受温度影响变化不大(3)极少数固体物质的溶解度随着温度的升高而减小.
39、影响溶解速度的因素:(1)温度,(2)是否搅拌(3)固体颗粒的大小
40、使铁生锈的三种物质:铁,水,氧气.
41、溶质的三种状态:固态,液态,气态.
42、影响溶解度的三个因素:溶质的性质,溶剂的性质,温度.
三、初中化学常见混合物的重要成分
1、空气:氮气(N2)和氧气(O2)
2、水煤气:一氧化碳(CO)和氢气(H2)
3、煤气:一氧化碳(CO)
4、天然气:甲烷(CH4)
5、石灰石/大理石:(CaCO3)
6、生铁/钢:(Fe)
7、木炭/焦炭/炭黑/活性炭:(C)
8、铁锈:(Fe2O3)
四、初中化学常见物质俗称
1、氯化钠 (NaCl) : 食盐
2、碳酸钠(Na2CO3) : 纯碱,苏打,口碱
3、氢氧化钠(NaOH):火碱,烧碱,苛性钠
4、氧化钙(CaO):生石灰
5、氢氧化钙(Ca(OH)2):熟石灰,消石灰
6、二氧化碳固体(CO2):干冰
7、氢氯酸(HCl):盐酸
8、碱式碳酸铜(Cu2(OH)2CO3):铜绿
9、硫酸铜晶体(CuSO4 .5H2O):蓝矾,胆矾
10、甲烷 (CH4):沼气
11、乙醇(C2H5OH):酒精
12、乙酸(CH3COOH):醋酸
13、过氧化氢(H2O2):双氧水
14、汞(Hg):水银
15、碳酸氢钠(NaHCO3):小苏打
四、初中化学溶液的酸碱性
1、显酸性的溶液:酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)
2、显碱性的溶液:碱溶液和某些盐溶液(碳酸钠、碳酸氢钠等)
3、显中性的溶液:水和大多数的盐溶液
五、初中化学敞口置于空气中质量改变的
(一)质量增加的
1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;
2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜
3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;
(二)质量减少的
1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;
2、由于风化而减少的:碳酸钠晶体.
六、初中化学物质的检验
(一) 、气体的检验
1、氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.
2、氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.
3、二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.
4、氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.
5、水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.
(二)、离子的检验.
6、氢离子:滴加紫色石蕊试液/加入锌粒
7、氢氧根离子:酚酞试液/硫酸铜溶液
8、碳酸根离子:稀盐酸和澄清的石灰水
9、氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子
10、硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡
11、铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口
12、铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子
13、铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子
(三)、相关例题
14、如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质
15、检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石
16、检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl.
17、检验三瓶试液分别是稀HNO3,稀HCl,稀H2SO4?
向三只试管中分别滴加Ba(NO3)2溶液,若产生白色沉淀,则是稀H2SO4;再分别滴加AgNO3溶液,若产生白色沉淀则是稀HCl,剩下的是稀HNO3
18、淀粉:加入碘溶液,若变蓝则含淀粉.
19、葡萄糖:加入新制的氢氧化铜,若生成砖红色的氧化亚铜沉淀,就含葡萄糖.
七、物质的除杂
1、CO2(CO):把气体通过灼热的氧化铜
2、CO(CO2):通过足量的氢氧化钠溶液
3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体
4、CuO(Cu):在空气中(在氧气流中)灼烧混合物
5、Cu(Fe) :加入足量的稀硫酸
6、Cu(CuO):加入足量的稀硫酸
7、FeSO4(CuSO4): 加 入足量的铁粉
8、NaCl(Na2CO3):加 入足量的盐酸
9、NaCl(Na2SO4):加入足量的氯化钡溶液
10、NaCl(NaOH):加入足量的盐酸
11、NaOH(Na2CO3):加入足量的氢氧化钙溶液
12、NaCl(CuSO4):加入足量的氢氧化钡溶液
13、NaNO3(NaCl):加入足量的硝酸银溶液
14、NaCl(KNO3):蒸发溶剂
15、KNO3(NaCl):冷却热饱和溶液.
16、CO2(水蒸气):通过浓硫酸.
八、化学之最
1、未来最理想的燃料是H2 .
2、最简单的有机物是CH4 .
3、密度最小的气体是H2 .
4、相对分子质量最小的物质是H2 .
5、相对分子质量最小的氧化物是H2O .
6、化学变化中最小的粒子是 原子 .
7、PH=0时,酸性最强,碱性最弱 .
PH=14时,碱性最强 ,酸性最弱 .
8、土壤里最缺乏的是N,K,P三种元素,肥效最高的氮肥是 尿素 .
9、天然存在最硬的物质是 金刚石 .
10、最早利用天然气的国家是 中国 .
11、地壳中含量最多的元素是 氧 .
12、地壳中含量最多的金属元素是 铝 .
13、空气里含量最多的气体是 氮气 .
14、空气里含量最多的元素是 氮 .
15、当今世界上最重要的三大化石燃料是 煤,石油,天然气.
16、形成化合物种类最多的元素:碳
九、有关不同
1、金刚石和石墨的物理性质不同:是因为 碳原子排列不同.
2、生铁和钢的性能不同:是因为 含碳量不同.
3、一氧化碳和二氧化碳的化学性质不同:是因为 分子构成不同.
(氧气和臭氧的化学性质不同是因为分子构成不同;水和双氧水的化学性质不同是因为分子构成不同.)
4、元素种类不同:是因为质子数不同.
5、元素化合价不同:是因为最外层电子数不同.
6、钠原子和钠离子的化学性质不同:是因为最外层电子数不同
十、有毒的物质
1、 有毒的固体:亚硝酸钠(NaNO2),乙酸铅等;
2、 有毒的液体:汞,硫酸铜溶液,甲醇,含Ba2+的溶液(除BaSO4);
3、 有毒的气体:CO,氮的氧化物,硫的氧化物
化学方程式:
一. 物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
二.几个分解反应:
13. 水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑
15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑
16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17. 碳酸不稳定而分H2CO3 === H2O + CO2↑
18. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑
三.几个氧化还原反应:
19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑
23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
24. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑
31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑
32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑
33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑
(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg
(3)碱性氧化物 +酸 -------- 盐 + 水
37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O 41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水
43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O
(5)酸 + 碱 -------- 盐 + 水
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O
51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O
57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
(6)酸 + 盐 -------- 另一种酸 + 另一种盐
59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl
(7)碱 + 盐 -------- 另一种碱 + 另一种盐
65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4
66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl
67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl
68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl
69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH
(8)盐 + 盐 ----- 两种新盐
70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3
71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
五.其它反应:
72.二氧化碳溶解于水:CO2 + H2O === H2CO3
73.生石灰溶于水:CaO + H2O === Ca(OH)2
74.氧化钠溶于水:Na2O + H2O ==== 2NaOH
75.三氧化硫溶于水:SO3 + H2O ==== H2SO4
76.硫酸铜晶体受热分CuSO4?5H2O 加热 CuSO4 + 5H2O
77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2
应该就这麽多了
望采纳.1年前查看全部
- 一物质熔点214-217摄氏度,易溶于热水、乙醇、乙酸乙酯,微溶于冷水,不易溶于己烷,固态呈白色粉末状.能不能告诉我这种
一物质熔点214-217摄氏度,易溶于热水、乙醇、乙酸乙酯,微溶于冷水,不易溶于己烷,固态呈白色粉末状.能不能告诉我这种物质的名字(可能的)?谢谢!
更正一下:是“不易溶于环己烷” 飘荡者1101年前1
飘荡者1101年前1 -
 1237488 共回答了17个问题
1237488 共回答了17个问题 |采纳率100%氢氧化钙1年前查看全部
- 除去下列各粉末状混合物中的杂质(括号内物质为杂质),请按下列提供的试剂和操作,将序号填在下表内.
除去下列各粉末状混合物中的杂质(括号内物质为杂质),请按下列提供的试剂和操作,将序号填在下表内.
试剂:A.盐酸;B.烧碱溶液;C.氧气;D.水;E.二氧化碳;F.不需要其他试剂.
操作:①加热;②过滤;③蒸发;④蒸馏;⑤结晶;⑥萃取
混合物 试剂 操作 Fe2O3(SiO2) NaCl(SiO2) SiO2(CaCO3) SiO2(H2SiO3)  乞美的丐人1年前1
乞美的丐人1年前1 -
 lxg1203 共回答了14个问题
lxg1203 共回答了14个问题 |采纳率92.9%解题思路:SiO2与NaOH溶液反应,而氧化铁不能;NaCl溶于水,而SiO2不能;CaCO3能溶于盐酸,SiO2不能;H2SiO3受热分解生成SiO2和水,以此来解答.SiO2与NaOH溶液反应,而氧化铁不能,则将混合物溶于过量NaOH溶液中,然后过滤可实现分离;
NaCl溶于水,而SiO2不能,则将混合物溶于水,然后过滤,对滤液蒸发可得到NaCl;
CaCO3能溶于盐酸,SiO2不能,则将混合物溶于盐酸,过滤即可除杂;
H2SiO3受热分解生成SiO2和水,则不需要其他试剂,直接加热即可实现除杂,
故答案为:
混合物 试剂 操作
Fe2O3(SiO2) B ②
NaCl(SiO2) D ②③
SiO2(CaCO3) A ②
SiO2(H2SiO3) F ①点评:
本题考点: 物质分离、提纯的实验方案设计.
考点点评: 本题考查物质分离、提纯实验方案的设计,侧重元素化合物性质的考查,把握二氧化硅的性质为解答的关键,注意除杂时不能将原物质反应掉,题目难度不大.1年前查看全部
大家在问
- 1读“黄河水系示意图”回答下列问题.
- 2as a 再给我造个句子…
- 3most of us后加单数还是复数形式
- 4修改病句:1.小丽在上学的路上,一个人向学校走去.2.这个老人的头发已经花白,大约有六七十岁.
- 5花型的戊醇 C(CH3)3CH2-OH 为什么不能氧化生成醛
- 6一辆汽车沿平直公路行驶,先以v1通过前[1/3] 的位移,再以速度v2=50km/h通过其余[2/3]的位移.若整个位移
- 7谁会这道题:阅读理解.根据短文内
- 8He didn't buy anything yesterday 变为被动语态
- 9人教版语文课时精练六年级下册第二单元综合练习的答案
- 10I,who am your friend,will help you.这句话的语法问题
- 1123个不同的正整数的和是4845,问这23个数的最大公约数可能达到的最大值是多少?
- 12在50个连续的奇数1,3,5,…,99中选取k个数,使得它们的和为1949,那么k的最大值是多少?
- 13英语选择more and more young people are trying to dosomething ___
- 14一个梯形的面积是54平方分米,他的下底长10分米,高6分米,这个梯形上底的长度是多少分米
- 15为了节省石油资源和有效地减少汽车尾气对环境的污染,我国正在逐步推广使用在汽油中加入适量乙醇作为汽车燃料(车用乙醇汽油).