高纯铝会被氧化吗?什么原因?高纯铝会被氧化吗?在什么情况下可能会被氧化?
 stingdandan2022-10-04 11:39:541条回答
stingdandan2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 白米爱黑米 共回答了19个问题
白米爱黑米 共回答了19个问题 |采纳率89.5%- 是铝就会氧化 跟空气接触就会产生氧化层 而氧化层就相当于一个保护膜 让内部的铝不被氧化
- 1年前
相关推荐
- 高纯的纯度是多少,99.9%?我想知道高纯的四硼酸锂的纯度是多少,谢谢刚才两位的回答
 fengyinger1年前1
fengyinger1年前1 -
 xt102vsjd102 共回答了17个问题
xt102vsjd102 共回答了17个问题 |采纳率88.2%不同物质的高纯标准不同.
容易分离、提纯的物质,高纯的要求高.
不易分离、提纯的物质,高纯的要求低.
高纯四硼酸锂的纯度为99.99%
试剂瓶的标签上打印的含量就是纯度标准.1年前查看全部
- 高纯二氧化钛制备中的四氯化钛精制的目的是什么?
 zhanghuijie11201年前1
zhanghuijie11201年前1 -
 ciscosun 共回答了22个问题
ciscosun 共回答了22个问题 |采纳率90.9%你要制备高纯二氧化钛,当然就要再把四氯化钛提纯了,减少杂质参加反应1年前查看全部
- 太阳能光伏发电是2010年上海世博会的“亮点”.太阳能光伏发电最关键的材料是高纯硅.三氯甲硅烷(SiHCl3,常温下是液
太阳能光伏发电是2010年上海世博会的“亮点”.太阳能光伏发电最关键的材料是高纯硅.三氯甲硅烷(SiHCl3,常温下是液体)还原法是当前制备高纯硅的主要方法,生产流程示意图如下:
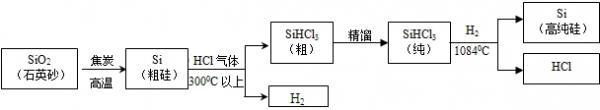
(1)由石英沙转变成粗硅的过程中利用了焦炭的______(填一化学性质).
(2)“精馏”也是蒸馏的一种形式.通过蒸馏可把液体混合物分离开,原理是利用混合物各成分的______(填“熔点”或“沸点”)不同.
(3)写出从Si(粗硅)到SiHCl3(粗)的化学方程式Si+3HCl
SiHCl3+H2;300℃以上 .Si+3HCl.
SiHCl3+H2;300℃以上 .
(4)为了达到绿色化学和资源综合利用的目的,上述生产流程中有两种物质在循环使用,它们的化学式为______和______. 殷少庭1年前1
殷少庭1年前1 -
 柔晴如风 共回答了20个问题
柔晴如风 共回答了20个问题 |采纳率90%解题思路:(1)把物质从其氧化物中还原出来体现了炭的还原性;
(2)用蒸馏法分离液态混合物,要求各组份的沸点不相同.
(3)从图中流程可以发现,由粗硅到三氯甲硅烷和由三氯甲硅烷到高纯硅是两个相反的过程,在写化学方程式时,要根据质量守恒定律增加某些反应物或生成物.
(4)从两个转化方程式可以看出,H2,HCl都可以循环利用.(1)由石英沙转变成粗硅的过程中利用了焦炭的还原性;
(2)蒸馏可把液体混合物分离,原理是利用混合物各成分的沸点不同;
(3)粗硅和HCl反应,生成SiHCl3,同时还生成H2,反应的方程式为:Si+3HCl
300℃以上
.
SiHCl3+H2;
(4)上述生产流程中由粗硅到三氯甲硅烷和由三氯甲硅烷到高纯硅是两个相反的过程,因此,这些过程中,H2、HCl可以循环使用;
故答案是:(1)3;
(2)沸点;
(3)Si+3HCl
300℃以上
.
SiHCl3+H2;
(4)H2、HCl;点评:
本题考点: 物质除杂或净化的探究.
考点点评: 以流程图呈现实验过程的探究性考题,是近几年中考探究题命题特点之一.读懂实验流程图,明确实验步骤和原理,是正确解答此类问题的前提.注意信息的提炼和应用.1年前查看全部
- (2012•昌平区二模)高纯的单晶硅是重要的半导体材料.制备高纯硅的化学方程式为:SiCl4+2H2 高温
(2012•昌平区二模)高纯的单晶硅是重要的半导体材料.制备高纯硅的化学方程式为:SiCl4+2H2
Si+4HCl.请计算要获得14g硅(Si),至少需要氢气多少克?高温 .  qqpasser1年前1
qqpasser1年前1 -
 飚滴 共回答了24个问题
飚滴 共回答了24个问题 |采纳率91.7%解题思路:利用化学方程式和要获得14g硅,列出比例式,就可计算出至少需要氢气的质量.设至少需要氢气的质量为x,
SiCl4+2H2
高温
.
Si+4HCl
428
x 14g
∴
4
28=
x
14g
∴x=
14g×4
28=2g.
答:至少需要氢气的质量为2g.点评:
本题考点: 根据化学反应方程式的计算.1年前查看全部
- 下列说法错误的是( )A.钢板镀锌可以防止锈蚀B.高纯石英玻璃可用来制造光导纤维C.羊毛、蚕丝、棉花的主要成分都是纤维
下列说法错误的是( )
A.钢板镀锌可以防止锈蚀
B.高纯石英玻璃可用来制造光导纤维
C.羊毛、蚕丝、棉花的主要成分都是纤维素
D.生铁和普通钢都是铁碳合金 球球心情1年前1
球球心情1年前1 -
 415069650 共回答了17个问题
415069650 共回答了17个问题 |采纳率94.1%解题思路:A、根据金属电化学腐蚀的原理来回答;
B、根据高纯石英玻璃成分和用途分析;
C、羊毛、蚕丝的成分是蛋白质;
D、生铁和普通钢都含有少量碳元素.A、钢板和锌形成原电池时,Zn作负极被腐蚀,钢板作正极被保护,故A正确;
B、高纯石英玻璃成分是二氧化硅,有导光性,能用来制造光导纤维,故B正确;
C、羊毛、蚕丝的成分是蛋白质,棉花的主要成分是纤维素,故C错误;
D、生铁和普通钢都含有少量碳元素,都是铁碳合金,故D正确;
故选C.点评:
本题考点: 金属的电化学腐蚀与防护;硅和二氧化硅;金属与合金在性能上的主要差异;纤维素的性质和用途;氨基酸、蛋白质的结构和性质特点.
考点点评: 本题主要考查了生活中的化学相关知识,掌握相关物质的化学性质是解答的关键,题目难度不大.1年前查看全部
- 锶(Sr)为第五周期ⅡA族元素.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水
锶(Sr)为第五周期ⅡA族元素.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水.用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如图1:
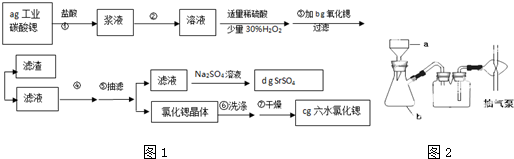
请回答:
(1)加入少量30%H2O2的作用______(用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是______,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是______;
(3)步骤⑥中,洗涤氯化锶晶体最好选用______;
A.水B.硫酸C.氢氧化钠溶液D.氯化锶饱和溶液
(4)指出如图2中仪器b 的名称______,在抽滤时使滤纸紧贴布氏漏斗瓷板的操作是______,抽气使滤纸紧贴在漏斗瓷板上. 无痕世界1年前1
无痕世界1年前1 -
 华族dd 共回答了23个问题
华族dd 共回答了23个问题 |采纳率82.6%解题思路:碳酸锶粉末用盐酸溶解,因为铁与盐酸反应生成二价铁,所以所得溶液中含有二价铁,加入少量30%H2O2将亚铁离子氧化亚铁离子为铁离子,再加氧化锶粉末调节溶液PH使Fe3+沉淀,过滤除去铁离子,所得溶液主要含有氯化锶,抽滤得到氯化锶晶体,为了减少氯化锶溶解,所以用氯化锶饱和溶液洗涤晶体,再干燥得到六水氯化锶晶体,以此分析解答;
(1)过氧化氢具有氧化性氧化亚铁离子为铁离子;
(2)调节pH除去Fe3+等,不能引入杂质,由题中信息可知热风吹干六水氯化锶时温度不能太高,当高于61℃时晶体会失去结晶水;
(3)从防止氯化锶的溶解的角度分析选择洗涤氯化锶晶体的试剂;
(4)依据装置图分析装置名称,滤纸的使用方法设计在抽滤时使滤纸紧贴布氏漏斗瓷板的操作.碳酸锶粉末用盐酸溶解,因为铁与盐酸反应生成二价铁,所以所得溶液中含有二价铁,加入少量30%H2O2将亚铁离子氧化亚铁离子为铁离子,再加氧化锶粉末调节溶液PH使Fe3+沉淀,过滤除去铁离子,所得溶液主要含有氯化锶,抽滤得到氯化锶晶体,为了减少氯化锶溶解,所以用氯化锶饱和溶液洗涤晶体,再干燥得到六水氯化锶晶体;
(1)加入少量30%H2O2的作用,过氧化氢具有氧化性氧化亚铁离子为铁离子.反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++H2O;
故答案为:H2O2+2Fe2++2H+=2Fe3++H2O;
(2)调节pH除去Fe3+等,要不能引入杂质,最好选用氢氧化锶粉末或氧化锶粉末;由题中信息可知热风吹干六水氯化锶时温度不能太高,当高于61℃时晶体会失去结晶水;故答案为:调节溶液PH使Fe3+沉淀;温度高有利于除去晶体表面附着的水,但温度高于61℃时晶体会失去结晶水;
(3)步骤⑥中,洗涤氯化锶晶体,为了减少氯化锶溶解,所以用氯化锶饱和溶液洗涤晶体;
A.水会溶解晶体,故A不符合;
B.硫酸洗涤会引入杂质,故B不符合;
C.氢氧化钠溶液一如新得到杂质,故C不符合;
D.氯化锶饱和溶液能减少氯化锶溶解,可以用来洗涤晶体,故D符合;
故答案为:D;
(4)装置图分析可知是吸滤瓶装置,在抽滤时使滤纸紧贴布氏漏斗瓷板的操作是用蒸馏水湿润滤纸,打开水龙头,抽气使滤纸紧贴在漏斗瓷板上;
故答案为:吸滤瓶;用蒸馏水湿润滤纸,打开水龙头.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了实验探究物质组成和物质性质的分析判断,实验基本操作的熟练掌握是解题关键,题目难度中等.1年前查看全部
- 磁控溅射靶材是铟、起辉气体是氩气(高纯),反应气体是氧(高纯),在基片上需要生成三氧化二铟
磁控溅射靶材是铟、起辉气体是氩气(高纯),反应气体是氧(高纯),在基片上需要生成三氧化二铟
工作环境为2.8*10-3mbar真空度,1.5厘米间距阻值要200欧姆左右.影响最终在基片上生成为三氧化二铟的因素有哪些方面. hueiyanshizhu1年前1
hueiyanshizhu1年前1 -
 向往美好生活 共回答了14个问题
向往美好生活 共回答了14个问题 |采纳率85.7%氧流量,控制靶中毒.
沉积膜时的时间,
基材的清洁问题,1年前查看全部
- 从沙子(二氧化硅)中制取高纯硅的化学反应方程式是:
从沙子(二氧化硅)中制取高纯硅的化学反应方程式是:
1.SiO2+2C==Si+2CO
2.Si+2Cl2==SiCl4
3.SiCl4+2H2==Si+4HCl
第一步就已经制得硅,为何还要2.3步? 王水20021年前4
王水20021年前4 -
 海阔 共回答了13个问题
海阔 共回答了13个问题 |采纳率92.3%第一步 是粗硅 含有未反应完全的杂质碳
第二步 转化为SiCl4 沸点较低 50多度 容易转化为气体 从而起到和杂质碳分离的目的,
第三步 用还原剂把硅从化合态还原为纯净单质硅1年前查看全部
- 求供应氩气、氢气、氩氢气在合肥市的供应厂家,我们要的是 科研用的高纯气体,
求供应氩气、氢气、氩氢气在合肥市的供应厂家,我们要的是 科研用的高纯气体,
氩氢气为5%氢,95%氩 boost_6661年前1
boost_6661年前1 -
 njmml 共回答了10个问题
njmml 共回答了10个问题 |采纳率100%百度搜索 纽瑞德气体 .学校、科研用的高纯气体都有.1年前查看全部
- 颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”.实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和F
 颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”.实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”和氯化氢气体.请回答以下问题:
颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”.实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”和氯化氢气体.请回答以下问题:
(1)写出生成“纳米铁”的化学方程式FeCl2+H2
Fe+2HCl高温 .FeCl2+H2.
Fe+2HCl高温 .
(2)反应中需要保护气的原因是______.
(3)阅读材料,回答问题:
【材料1】氯元素(Cl)是一种重要的非金属元素,氯气是双原子分子,在通常情况下为黄绿色气体.
【材料2】氯原子的结构示意图如图,在化学反应中易得到1个电子,达到8电子的稳定结构,氯气化学性质很活泼,具有较强的氧化性,能与多种金属和非金属直接化合,还能与水、碱等化合物反应.
【材料3】燃烧不一定要有氧气参加,任何发光、发热的剧烈的化学反应,都可以叫做燃烧,氢气可以在氯气中燃烧生成氯化氢(HCl).
(1)氯气的化学式为______.
(2)请总结氯气的有关性质:①物理性质______;②化学性质______.
(3)写出材料3中的化学方程式Cl2+H2
2HCl点燃 .Cl2+H2.
2HCl点燃 . Rhh08061年前1
Rhh08061年前1 -
 lg_han 共回答了24个问题
lg_han 共回答了24个问题 |采纳率91.7%解题思路:(1)根据反应物生成物进行书写解决,注意条件.
(2)铁在热的时候活动性很强,故应使用保护气.
(3)物质的物理性质是指不需要通过化学变化表现出来的性质.例如,颜色、状态、气味、密度、熔点、沸点等.物质的化学性质是指通过化学变化表现出来的性质.例如,稳定性、氧化性、还原性、毒性、可燃性等.(1)由题中信息在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”.可知反应物为氢气和氯化亚铁,生成物为铁,根据反应前后元素种类不变可知另一生成物为氯化氢,化学方程式为FeCl2+H2
高温
.
Fe+2HCl
(2)铁在热的时候活动性很强,故应使用保护气防止它在和其他物质发生反应.
(3)氯气的化学式为:Cl2.
物理性质有:黄绿色气体.化学性质有:具有较强的氧化性、能与多种金属和非金属直接化合,还能与水、碱等化合物反应.
(3)氢气在氯气中燃烧生成氯化氢(HCl),反应的方程式是Cl2+H2
点燃
.
2HCl.
故答案为:(1)FeCl2+H2
高温
.
Fe+2HCl;
(2)防止铁在高温下与氧气反应;
(3)Cl2;黄绿色气体;具有较强的氧化性、能与多种金属和非金属直接化合,还能与水、碱等化合物反应;Cl2+H2
点燃
.
2HCl.点评:
本题考点: 金属的化学性质;原子结构示意图与离子结构示意图;化学式的书写及意义;化学性质与物理性质的差别及应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题考查了金属铁的活动性、置换反应以及化学方程式的书写等,题目不难.1年前查看全部
- (2010•益阳)芯片是计算机的核心部件,它是由高纯硅制成的,下面是生产单质硅过程中的主要反应:
(2010•益阳)芯片是计算机的核心部件,它是由高纯硅制成的,下面是生产单质硅过程中的主要反应:
①SiO2+2c
Si+2CO↑②Si+2Cl2高温 .
SiCl4③siCl4+2H2点燃 .
Si+4HCl△ .
上述反应③的基本反应类型是( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应 yuli1234567891年前1
yuli1234567891年前1 -
 gf63373034 共回答了18个问题
gf63373034 共回答了18个问题 |采纳率83.3%解题思路:认真分析各反应物与生成物的特点与数量,来确定反应的类型:化合反应的特点为“多变一”,分解反应的特点为“一变多”,置换反应的特点为“单质+化合物═单质+化合物”,复分解反应的特点为“化合物+化合物═化合物+化合物,且两种反应物相互交换成分”.然后根据具体的化学方程式进行分析、判断,从而得出正确的结论.由化学方程式可知,①③反应中的反应物和生成物都是一种单质和一种化合物,属于置换反应;②中的反应物是两种,生成物是一种,属于化合反应.
故选C.点评:
本题考点: 反应类型的判定.
考点点评: 解答本题要掌握反应类型的判断方法,只有这样才能对各种反应类型做出正确的判断.1年前查看全部
- 电子技术离不开高纯硅,硅广泛应用于电子工业,工业上制硅的基本原理是:SiO2+2C 高温 .
电子技术离不开高纯硅,硅广泛应用于电子工业,工业上制硅的基本原理是:SiO2+2C
Si+2CO↑,该反应中还原剂是______,该反应中氧化剂是______.高温 . ayan352251年前1
ayan352251年前1 -
 纳可鲁鲁 共回答了21个问题
纳可鲁鲁 共回答了21个问题 |采纳率95.2%解题思路:根据氧化反应中得氧的物质为还原剂,失氧的物质为氧化剂进行解答.在SiO2+2C
高温
.
Si+2CO↑,碳在该反应中得到氧,是还原剂,二氧化硅在该反应中失去氧,是氧化剂.
故答案为:C;SiO2.点评:
本题考点: 还原反应;氧化反应.
考点点评: 解答本题要充分理解氧化还原反应的含义,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 下列关于物质的用途叙述不正确的是 A.过氧化钠可用作供氧剂 B.高纯硅用来制造光导纤维 C.镁铝合金可用作制造飞机的材料
下列关于物质的用途叙述不正确的是
A.过氧化钠可用作供氧剂 B.高纯硅用来制造光导纤维 C.镁铝合金可用作制造飞机的材料 D.Cl 2 可与石灰乳反应制取漂白粉  hurry6241年前1
hurry6241年前1 -
 永和的杯子 共回答了17个问题
永和的杯子 共回答了17个问题 |采纳率82.4%B
1年前查看全部
- 下列关于硅的叙述错误的是( ) A.硅广泛存在于自然界中,天然单质硅叫硅石 B.高纯硅及其氧化物在太阳能电池及信息高速
下列关于硅的叙述错误的是( ) A.硅广泛存在于自然界中,天然单质硅叫硅石 B.高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用 C.常温下硅很稳定,不能跟强酸反应 D.二氧化硅可制玻璃、单质硅、光导纤维  孤鸿茗1年前1
孤鸿茗1年前1 -
 风行者_3053 共回答了23个问题
风行者_3053 共回答了23个问题 |采纳率95.7%A.硅元素以化合态广泛存在于自然界中,无天然硅的单质,故A错误;
B.高纯硅可做半导体,二氧化硅可做光导纤维的材料,故B正确;
C.硅性质较为稳定,在常温下与强酸不反应,但和HF酸、强碱等物质反应,故C正确;
D.二氧化硅是制备玻璃的主要原料,可被还原制备单质硅,是光导纤维的材料,故D正确.
故选A.1年前查看全部
- 氢气由于制取半导体材料高纯硅,以及焊接工艺中为防止金属在高温下氧化氧化等,都是利用了氢气的_________
氢气由于制取半导体材料高纯硅,以及焊接工艺中为防止金属在高温下氧化氧化等,都是利用了氢气的_________
A)可燃性 B)还原性 C)密度小 D)难溶于水 joko19791年前1
joko19791年前1 -
 xlows 共回答了16个问题
xlows 共回答了16个问题 |采纳率93.8%B
题目中防止金属在高温下氧化 是比较明显的判断依据1年前查看全部
- 粗硅经系列反应可生成硅烷(siH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因 ,si元素
粗硅经系列反应可生成硅烷(siH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因 ,si元素的非金属性弱于c元素,硅烷的热稳定性弱于甲烷.
 qcbyg1年前1
qcbyg1年前1 -
 wamger_2008 共回答了19个问题
wamger_2008 共回答了19个问题 |采纳率89.5%硅是原子晶体,熔沸点高,硅烷中Si--H键能要比甲烷中C--H键能要小,键能越小越不稳定,稳定性涉及化学性质,所以稳定性差1年前查看全部
- (2012•徐州模拟)利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯
(2012•徐州模拟)利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯氧化铁(α-Fe2O3)的工艺流程如下:
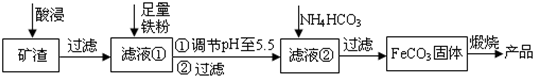
(1)“酸浸”过程中Fe3O4发生反应的离子方程式为______.为提高“酸浸”中铁元素的浸出率,除了采用合适的液固比和循环浸取外,适宜的条件还有______、______.(任举两例)
(2)调节pH至5.5的目的是______.
(3)滤液②中加入NH4HCO3时需要控制反应温度不能过高,原因是______.(答一点即可)
(4)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为4FeCO3+O2
2Fe2O3+4CO2高温 .4FeCO3+O2.
2Fe2O3+4CO2高温 . az5281年前1
az5281年前1 -
 曼珠沙华_林 共回答了12个问题
曼珠沙华_林 共回答了12个问题 |采纳率83.3%解题思路:(1)酸浸过程中四氧化三铁和酸反应生成亚铁离子、铁离子和水;延长反应时间,搅拌加速反应,合适的酸度等可以提高酸浸率;
(2)依据流程分析生产目的是得到氧化铁,根据矿渣成分可知调节PH是为了除去铝离子,所以加入足量铁是把铁离子还原为亚铁离子防止调节PH沉淀;
(3)分析过程加入碳酸氢铵是为了沉淀亚铁离子,温度过高会促进亚铁离子水解或加入的碳酸氢铵分解;
(4)空气中碳酸亚铁和氧气反应生成氧化铁和二氧化碳;(1)酸浸过程中四氧化三铁和酸反应生成亚铁离子、铁离子和水,“酸浸”过程中Fe3O4发生反应的离子方程式为,Fe3O4+8H+=Fe2++2Fe3++4H2O;为提高“酸浸”中铁元素的浸出率,除了采用合适的液固比和循环浸取外,适宜的条件还有合适的酸浓度、连续搅拌、延长酸浸时间等;
故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;合适的酸浓度、连续搅拌、延长酸浸时间等;
(2)分析流程可知生产目的是为了制取氧化铁,所以流程中加入过量铁会把铁离子还原为亚铁离子,调节溶液PH5.5铝离子沉淀,亚铁离子不沉淀达到分离的目的;
故答案为:除去滤液①中的Al3+;
(3)滤液②中加入NH4HCO3时需要控制反应温度不能过高,温度过高会促进亚铁离子水解或加入的碳酸氢铵分解;
故答案为:防止NH4HCO3受热分解或防止Fe2+水解程度增大;
(4)空气中碳酸亚铁和氧气反应生成氧化铁和二氧化碳,反应的化学方程式为:4FeCO3+O2
高温
.
2Fe2O3+4CO2;
故答案为:4FeCO3+O2
高温
.
2Fe2O3+4CO2;点评:
本题考点: 铁的氧化物和氢氧化物;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了工业生产流程的分析判断,铁及其化合物性质的分析应用,掌握流程分析方法和题干信息的理解应用是解题关键,题目难度中等.1年前查看全部
- 工业上冶炼高纯硅有以下几个过程:1、S i O2+2C=高温=S i+2CO向上箭头 2、S i +2Cl2=加热=S
工业上冶炼高纯硅有以下几个过程:1、S i O2+2C=高温=S i+2CO向上箭头 2、S i +2Cl2=加热=S i Cl4 3、S i C l4+2H2=高温=S i+4HCl 回答下列几个问题:
1、反应1中的氧化剂和还原剂分别是( )和( ).
2、反应2中Cl2的作用是( ),此反应中S i为什么还要再次生成化合态的硅?
3、每产生14kg高纯硅,理论上消耗焦炭和Cl2的质量分别为( g)和( g).
(重点讲解一下第三题,1、2题可不解, 小怪yy1年前1
小怪yy1年前1 -
 空心人儿 共回答了31个问题
空心人儿 共回答了31个问题 |采纳率90.3%1、反应1中的氧化剂和还原剂分别是( SiO2 )和( C ).
2、反应2中Cl2的作用是( 氧化剂 ),此反应中S i为什么还要再次生成化合态的硅?
为了方便气化提纯.
3、每产生14kg高纯硅,理论上消耗焦炭和Cl2的质量分别为( 12000g)和( 71000 g).
根据反应物质的量关系
Si~2C~2Cl2
14000gSi~500mol~1000molC~1000molCl2
所以需要Cl2质量1000*71=71000克
C质量1000*12=12000克
希望对你有帮助O(∩_∩)O~1年前查看全部
- (2014•荆州模拟)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
(2014•荆州模拟)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
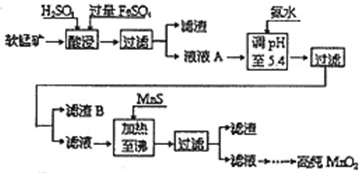
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
回答下列问题:沉淀物 Al(OH)3 Fe(OH)3
Fe(OH)2Mn(OH)2 CuS ZnS MnS FeS pH 5.2 3.2 9.7 10.4 ≥-0.42 ≥2.5 ≥7 ≥7
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为______.
(2)调节pH时不用氢氧化钠原因是:______,理论上,调节pH的最小值为______,滤渣B的主要成分是______.
(3)加入MnS的目的是除去______杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为______.回收废旧碱性锰电池中的锰,可向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O,该方法的优点是______. 雨惊鸿1年前1
雨惊鸿1年前1 -
 baobeiyuer 共回答了16个问题
baobeiyuer 共回答了16个问题 |采纳率87.5%解题思路:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,则Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成;
(2)由题目信息可知,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH进行判断;
(3)加入MnS后,因为酸性条件下CuS、ZnS更难溶所以会转化为CuS、ZnS沉淀而除去Cu2+、Zn2+;
(4)由碱性锌锰干电池的电池反应式可知,Zn作负极,MnO2得电子作正极,生成MnOOH,由电荷守恒可知还生成OH-,由元素守恒可知,还有水参与反应,据此写出MnO2参与的电极反应方程式为;从工艺流程是否简单、反应产物是否产生污染物等方面进行分析.(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为:2Fe2++MnO2+4H+=Mn2++2Fe3++2H2O,故答案为:2Fe2++MnO2+4H+=Mn2++2Fe3++2H2...
点评:
本题考点: 硫酸亚铁的制备;难溶电解质的溶解平衡及沉淀转化的本质;金属的回收与环境、资源保护.
考点点评: 本题考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.1年前查看全部
- 由二氧化硅制高纯硅的流程如图,下列判断中错误的是( )
由二氧化硅制高纯硅的流程如图,下列判断中错误的是( )
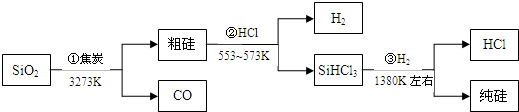
A.①②③均属于氧化还原反应
B.H2和HCl均可循环利用
C.SiO2是一种坚硬难熔的固体
D.SiHCl3摩尔质量为135.5g himalayas_aus1年前1
himalayas_aus1年前1 -
 4722668 共回答了16个问题
4722668 共回答了16个问题 |采纳率100%解题思路:A.根据反应前后元素的化合价发生变化的是氧化还原反应;
B.根据生产高纯硅的流程示意图可知,H2和HCl既是反应物,又是生成物进行解答;
C.根据SiO2是原子晶体;
D.根据摩尔质量的单位为g/mol.A.反应①为SiO2+2C
高温
.
Si+2CO↑,反应②Si(粗)+3HCl
553K−573K
.
SiHCl3+H2,反应③SiHCl3+H2
1380K
.
Si(粗)+3HCl,三个方程式中元素的化合价均发生变化,均属于氧化还原反应,故A正确;
B.生产高纯硅的流程示意图可知,H2和HCl既是反应物,又是生成物,所以可重复利用的物质是H2和HCl,故B正确;
C.SiO2是原子晶体,硬度大、熔点高,故C正确;
D.SiHCl3摩尔质量为135.5g/mol,故D错误;
故选D.点评:
本题考点: 硅和二氧化硅.
考点点评: 本题主要考查了氧化还原反应的判断、原子晶体的性质,摩尔质量的单位,难度不大,根据所学知识即可完成.1年前查看全部
- 计算机芯片和太阳能光伏发电最关键的材料是高纯硅(Si)。在高温条件下,硅可以通过如下反应制备: ,若要得到112Kg的硅
计算机芯片和太阳能光伏发电最关键的材料是高纯硅(Si)。在高温条件下,硅可以通过如下反应制备:  ,若要得到112Kg的硅,则需要参加反应的四氯化硅(SiCl 4 )的质量是多少千克?
,若要得到112Kg的硅,则需要参加反应的四氯化硅(SiCl 4 )的质量是多少千克? 海子水1年前1
海子水1年前1 -
 孙建彬 共回答了23个问题
孙建彬 共回答了23个问题 |采纳率100%1年前查看全部
- (2014•四川模拟)工业上制备高纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)═Si(s)+4HCl(g)
(2014•四川模拟)工业上制备高纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)═Si(s)+4HCl(g)△H=+Q kJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述中正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L•min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应 qazxsw23edc1年前1
qazxsw23edc1年前1 -
 坐看云开 共回答了11个问题
坐看云开 共回答了11个问题 |采纳率100%解题思路:A、从压强对平衡移动的影响分析;
B、注意反应的可逆性;
C、根据反应速率之比等于化学计量数之比分析;
D、根据方程式计算生成HCl的物质的量.A、从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故A错误;
B、该反应为可逆反应,1molSiCl4不能完全转化,达平衡时,吸收热量小于QkJ,故B错误;
C、反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)=[0.12mol/L/4min]=0.03mol/(L•min),根据反应速率之比等于化学计量数之比,则v(H2)=[1/2]×v(HCl)=[1/2]×0.03mol/(L•min)=0.015mol/(L•min),故C错误;
D、由方程式可知,当反应吸收热量为0.025QkJ时,生成HCl的物质的量为[0.025QkJ/QkJ/mol]×4=0.1mol,100mL1mol/L的NaOH的物质的量为0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故D正确;
故选D.点评:
本题考点: 化学平衡的影响因素;化学平衡建立的过程.
考点点评: 本题考查较为综合,涉及反应热的计算、化学反应速率、化学平衡等问题,题目难度中等,注意反应的可逆性,选项B是解答中的易错点.1年前查看全部
- 制造高纯氧气99.999.需要那些设备,.
 8002291年前2
8002291年前2 -
 jtijjpl 共回答了19个问题
jtijjpl 共回答了19个问题 |采纳率100%制取高纯氧99.999%必须要深冷设备,也就是温度要达到零下196以上的空气分离设备,现在有常温制氧设备比如变压吸附设备,但无法达到高纯氧级别.1年前查看全部
- 生产、生活离不开化学。下列说法中不正确的是() A.高纯硅是工业上制造光导纤维的主要原料 B.开发和推广新能源汽车是实现
生产、生活离不开化学。下列说法中不正确的是()
A.高纯硅是工业上制造光导纤维的主要原料 B.开发和推广新能源汽车是实现低碳生活的途径之一 C.寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 D.不需要通过化学反应就能从海水中获得淡水  我真的不懂啊1年前1
我真的不懂啊1年前1 -
 zhangyi1001 共回答了26个问题
zhangyi1001 共回答了26个问题 |采纳率88.5%A
考查化学与生活、生产及环境保护等。二氧化硅是工业上制造光导纤维的主要原料,而高纯硅是半导体的主要原料,即选项A不正确,其余选项都是正确的,答案选A。1年前查看全部
- SIO2制备高纯硅
 qgnru1年前3
qgnru1年前3 -
 gzhong 共回答了15个问题
gzhong 共回答了15个问题 |采纳率80%在高温下,二氧化硅能被碳、镁、铝还原:
SiO₂+2C=(高温)Si+2CO↑
若c过量,则发生反应:
Si+C=高温=SiC(金刚砂)1年前查看全部
- 高纯氩气的操作使用过程中有哪些危险性
 inspirationzz1年前1
inspirationzz1年前1 -
 7578637 共回答了16个问题
7578637 共回答了16个问题 |采纳率93.8%氩气是惰性气体,是最安全的气体之一,它极难与其他气体发生反应,因此是非常安全的,只要气瓶内气体的压力不超出标准,且气瓶没有泄露或破损,基本没有危险.1年前查看全部
- 我买的高纯磷酸二氢钾说明是喷施:稀释500~1000倍这个500-1000是什么意思,我看不懂说明.有知道的吗
 一剑你好快1年前5
一剑你好快1年前5 -
 cherish_rain 共回答了18个问题
cherish_rain 共回答了18个问题 |采纳率94.4%是和水的比例,比如1g磷酸二氢钾兑500g水或者1g兑1000g水,500g水和1000g水就是500ml和1000ml水1年前查看全部
- 下列说法不正确的是( )A.陶瓷是以黏土和石灰石为原料,经高温烧结而成的B.高纯单质硅可以制成光电池,将光能直接转换为
下列说法不正确的是( )
A.陶瓷是以黏土和石灰石为原料,经高温烧结而成的
B.高纯单质硅可以制成光电池,将光能直接转换为电能
C.水玻璃可作木材的防火剂
D.向饱和Na2SiO3溶液中通入足量CO2,然后蒸发结晶,最后灼烧,得到Na2CO3、SiO2 多多8881年前1
多多8881年前1 -
 lqtkgg123 共回答了18个问题
lqtkgg123 共回答了18个问题 |采纳率100%解题思路:A.黏土经过高温烧结可以获得陶瓷;
B.单质硅导电性介于导体与绝缘体之间;
C.硅酸钠耐高温;
D.硅酸的酸性弱于碳酸,碳酸钠与二氧化硅 高温条件反应生成硅酸钠.A.陶瓷黏土经过高温烧结而成,故A错误;
B.单质硅导电性介于导体与绝缘体之间,是良好的半导体,可以制成光电池,将光能直接转换为电能,故B正确;
C.水玻璃的主要成分为硅酸钠,硅酸钠耐高温,不易燃烧,故C正确;
D.向饱和Na2SiO3溶液中通入足量CO2,然后蒸发结晶,最后灼烧,得到硅酸钠,故D错误;
故选:AD.点评:
本题考点: 硅和二氧化硅.
考点点评: 本题考查了硅及其化合物的性质和用途,性质决定用途,明确硅及其化合物性质是解题关键,注意相关知识的积累.1年前查看全部
- 计算机芯片和太阳能光伏发电最关键的材料是高纯硅(Si).在高温条件下,硅可以通过如下反映制备:SiCl 4 +2H 2
计算机芯片和太阳能光伏发电最关键的材料是高纯硅(Si).在高温条件下,硅可以通过如下反映制备:SiCl 4 +2H 2
Si+4HCl,若要得到112Kg的硅,则需要参加反应的四氯化硅(SiCl 4 )的质量是多少千克?高温 .  k259580251年前1
k259580251年前1 -
 blw913 共回答了16个问题
blw913 共回答了16个问题 |采纳率93.8%设需要参加反应的四氯化硅的质量为x
SiCl 4 +2H 2
高温
.
Si+4HCl
17028
x112kg
170
28 =
x
112kg
解得 x=680kg
答:需要参加反应的四氯化硅的质量为680kg.
故答案为:680kg.1年前查看全部
- 二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下 某软锰矿的主要成分为M
二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下 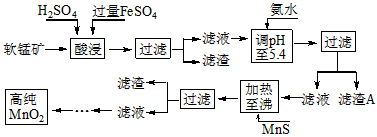
某软锰矿的主要成分为MnO 2 ,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题 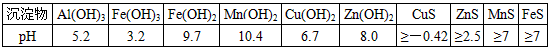
(1)硫酸亚铁在酸性条件下将MnO 2 还原为MnSO 4 ,酸浸时发生的主要反应的化学方程式为
_________________________。
(2)滤渣A的主要成分是_____________________________。
(3)加入MnS的目的是除去______________________杂质。
(4)碱性锌锰电池中,MnO 2 参与的电极反应方程式为___________________________。
(5)从废旧碱性锌锰电池中可以回收利用的物质有____________________________(写两种)。 goodleon1年前1
goodleon1年前1 -
 lbmfff 共回答了18个问题
lbmfff 共回答了18个问题 |采纳率88.9%(1)MnO 2 +2FeSO 4 +2H 2 SO 4 =MnSO 4 +Fe 2 (SO 4 ) 3 +2H 2 O
(2)Fe(OH) 3 、Al(OH) 3
(3)Cu 2+ 、Zn 2+
(4)MnO 2 +H 2 O+e - =MnO(OH)+OH - (或2MnO 2 +H 2 O+2e - =Mn 2 O 3 +2OH - )
(5)锌、二氧化锰1年前查看全部
- 从石英砂制取并获得高纯硅的主要化学反应如下:
从石英砂制取并获得高纯硅的主要化学反应如下:
①SiO2+2C
Si(粗)+2CO高温 .
②Si(粗)+2Cl2
SiCl4加热 .
③SiCl4+2H2
Si(纯)+4HCl高温 .
关于上述反应的分析不正确的是( )
A. ①、③是置换反应,②是化合反应
B. 高温下,焦炭与氢气的还原性均强于硅
C. 任一反应中,每消耗或生成28g硅,均转移4mol电子
D. 高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅 longmenlang1年前1
longmenlang1年前1 -
 xiao_tianshu 共回答了22个问题
xiao_tianshu 共回答了22个问题 |采纳率90.9%解题思路:A.根据置换反应、化合反应的特征判断反应类型;
B.氧化还原反应中还原剂的还原性大于还原产物的还原性;
C.Si原子核外最外层有4个电子,一般表现为+4价;
D.将四种物质混合物得到粗硅和HCl.A.①、③时一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,②是化合反应,故A正确;
B.氧化还原反应中,还原剂的还原性大于还原产物的还原性,①、③反应可说明焦炭与氢气的还原性均强于硅,故B正确;
C.Si原子核外最外层有4个电子,一般表现为+4价,所以任一反应中,每消耗或生成28g硅,均转移4mol电子,故C正确;
D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合,石英砂、焦炭反应生成粗硅,氯气、氢气反应生成HCl,故D错误.
故选D.点评:
本题考点: 硅和二氧化硅;氧化还原反应.
考点点评: 本题考查硅的制备,题目难度不大,注意化学反应原理和反应类型的判断.1年前查看全部
- (7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
(7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
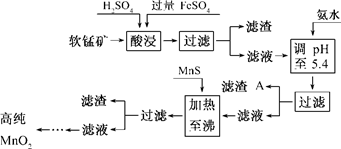
某软锰矿的主要成分为MnO 2 ,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO 2 还原为MnSO 4 ,酸浸时发生的主要反应的化学方程式为______________________________.沉淀物 pH Al(OH) 3 5.2 Fe(OH) 3 3.2 Fe(OH) 2 9.7 Mn(OH) 2 10.4 Cu(OH) 2 6.7 Zn(OH) 2 8.0 CuS ≥-0.42 ZnS ≥2.5 MnS ≥7 FeS ≥7
(2)滤渣A的主要成分为________.
(3)加入MnS的目的是除去________杂质.
(4)碱性锌锰干电池中,MnO 2 参与的电极反应方程式为__________________________.
(5)从废旧碱性锌锰干电池中可以回收利用的物质有________(写出两种). maxinyan1年前1
maxinyan1年前1 -
 kky0 共回答了17个问题
kky0 共回答了17个问题 |采纳率94.1%(1)MnO 2 +2FeSO 4 +2H 2 SO 4 ===MnSO 4 +Fe 2 (SO 4 ) 3 +2H 2 O
(2)Fe(OH) 3 、Al(OH) 3 (3)Cu 2 + 、Zn 2 +
(4)MnO 2 +H 2 O+e - ===MnOOH+OH - (5)Zn、MnO 2
(1)根据FeSO 4 在反应条件下将MnO 2 还原为MnSO 4 ,Fe 2 + 被氧化为Fe 3 + ,可以写其反应方程式2FeSO 4 +MnO 2 +2H 2 SO 4 ===MnSO 4 +Fe 2 (SO 4 ) 3 +2H 2 O。
(2)根据反应后滤液(Mn 2 + 、Fe 3 + 、Al 3 + 、Cu 2 + 、Zn 2 + 、Fe 2 + )加氨水调pH至5.4,结合题表可知滤渣A的主要成分为Fe(OH) 3 和Al(OH) 3 。
(3)根据题表可知加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu 2 + 、Zn 2 + .
(4)碱性锌锰干电池中Zn作负极,则MnO 2 作正极得电子.其电极反应式应为 MnO 2 +H 2 O+e - ===MnOOH+OH - 。
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO 2 。1年前查看全部
- 高纯硅生产流程如图:(1)由SiO2制粗硅的化学方程式是SiO2+2C 高温 . Si+2
高纯硅生产流程如图:
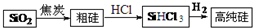
(1)由SiO2制粗硅的化学方程式是SiO2+2C
Si+2CO高温 .SiO2+2C,该反应不能说明碳的非金属性强于硅,原因是______,请写出一个能说明碳的非金属性强于硅的化学方程式______.
Si+2CO高温 .
(2)900℃以上,H2与SiHCl3发生反应:SiHCl3(g)+H2(g)⇌Si(s)+3HCl(g)△H>0.将一定量的反应物通入固定容积的密闭容器中进行反应.下列说法正确的是______(填字母).
a.在恒温条件下,若容器内压强不变,则该反应一定达到化学平衡状态
b.增大SiHCl3的用量,可提高SiHCl3的平衡转化率
c.升高温度可加快反应速率,且提高硅的产率
(3)该流程中可以循环使用的物质是______. DuoDuo05171年前1
DuoDuo05171年前1 -
 雨霄 共回答了20个问题
雨霄 共回答了20个问题 |采纳率85%解题思路:(1)碳与二氧化硅反应生成硅单质和一氧化碳,只能说明碳的还原性比硅强,强酸反应制取弱酸;
(2)a.反应前后有气体物质的量的变化;
b.增大SiHCl3的用量,可提高H2的平衡转化率;
c.正反应是吸热反应;
(3)根据化学根据反应物中和生成物中都有的物质考虑.(1)碳与二氧化硅反应生成硅单质和一氧化碳:SiO2+2C 高温 . Si+2CO,只能说明碳的还原性比硅强,非金属性是指非金属元素的单质在化学反应中得到电子的能力,不能说明碳的非金属性比硅强;非金属性...
点评:
本题考点: 硅和二氧化硅;化学平衡的影响因素.
考点点评: 本题涉及关硅和二氧化硅性质的综合题,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度较大,注意相关知识的积累.1年前查看全部
- (2014•大庆)太阳能光伏发电最关键的材料是高纯硅.硅原子结构示意图为.高纯硅可以通过以下过程制取:
(2014•大庆)太阳能光伏发电最关键的材料是高纯硅.硅原子结构示意图为
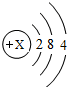 .高纯硅可以通过以下过程制取:
.高纯硅可以通过以下过程制取:
制粗硅:①SiO2+2C
Si(粗硅)+2CO↑高温 .
制纯硅:②Si(粗硅)+2Cl2
SiCl4高温 .
③SiCl4+2H2
Si(纯硅)+4HCl高温 .
石英砂、水晶、玛瑙的主要成份均是SiO2,SiO2的化学性质与CO2有些类似.
(1)x的值为______.
(2)请写出SiO2与NaOH溶液反应的化学方程式:______.
(3)在反应①②③中,②属于______反应类型,属于置换反应的是(填序号)______.
(4)有元素的化合价改变的反应是______(填序号). 毛毛熊881年前1
毛毛熊881年前1 -
 社车别 共回答了20个问题
社车别 共回答了20个问题 |采纳率90%解题思路:(1)在原子中核内质子数等于核外电子数;
(2)根据SiO2与NaOH溶液的反应,写出反应的化学方程式;
(3)根据反应的特点分析判断;
(4)根据元素化合价的变化分析回答.(1)在原子中核内质子数等于核外电子数,所以,X=2+8+4=14;
(2)SiO2与NaOH溶液反应生成了硅酸钠和水,反应的化学方程式是:SiO2+2NaOH=Na2SiO3+H2O;
(3)在反应②中,由两种物质生成了一种物质,属于化合反应;在反应①③,都是由一种单质与一种化合物反应,生成了另一种单质和另一种化合物,属于置换反应;
(4)在反应①②③中,都有单质参加或单质生成,一定有元素化合价的变化.
故答为:(1)14;(2)SiO2+2NaOH=Na2SiO3+H2O;(3)化合反应,①③;(4)①②③.点评:
本题考点: 原子结构示意图与离子结构示意图;有关元素化合价的计算;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了化学用语和反应类型的判断,属于课本的基础知识,难度不大,根据已有的知识即可解答.1年前查看全部
- (1)生产电脑芯片的材料主要是高纯硅.工业生产硅的原理为:2C+SiO2=Si+2CO↑,在反应中SiO2发生了____
(1)生产电脑芯片的材料主要是高纯硅.工业生产硅的原理为:2C+SiO2=Si+2CO↑,在反应中SiO2发生了______(填“氧化“或“还原“)反应.
(2)天原化工厂通过电解饱和食盐水获得的氢气可用于生产高纯硅.已知电解饱和食盐水生成氢气、氯气(Cl2)和烧碱,反应的化学方程式为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑通电 .2NaCl+2H2O,产生的H2若在潮湿的Cl2中燃烧,会产生大量的“白雾“,“白雾“是______.
2NaOH+Cl2↑+H2↑通电 . kent1976121年前1
kent1976121年前1 -
 wongwong01 共回答了15个问题
wongwong01 共回答了15个问题 |采纳率86.7%解题思路:(1)根据物质在反应中得失氧的情况,判断物质所发生的反应,得氧的发生氧化反应失氧的发生还原反应;
(2)根据对所发生反应的描述,确定反应的反应物、生成物,完成反应化学方程式的书写;根据HCl能与空气中形成盐酸的小液滴,解释“白雾”的原因.(1)在反应2C+SiO2
高温
.
Si+2CO↑中,SiO2失去氧而生成单质Si,发生失氧的还原反应;
(2)根据电解饱和食盐水生成氢气、氯气(Cl2)和烧碱,可知反应为通电条件下,氯化钠和水反应生成氢气、氯气(Cl2)和氢氧化钠三种物质,该反应的化学方程式为2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑;氢气在氯气中燃烧生成的氯化氢气体极易溶于水,与空气中的水蒸气结合成盐酸的小液滴而形成“白雾”;
故答案为:(1)还原;(2)2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑;盐酸液滴.点评:
本题考点: 还原反应;酸的物理性质及用途;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是对氧化还原反应以及对化学方程式书写的考查,解题的关键是掌握氧化还原反应的特征和利用信息书写化学方程式,属基础性知识考查题.1年前查看全部
- 什么是高纯气,高纯氢气,高纯氮气?
 心的季节1年前1
心的季节1年前1 -
 YM李贤宇 共回答了13个问题
YM李贤宇 共回答了13个问题 |采纳率92.3%高纯气体(High Purity Gases)气体工业名词,通常指利用现代提纯技术能达到的某个等级纯度的气体.对于不同类别的气体,纯度指标不同,例如对于氮,氢,氩,氦而言,通常指纯度等于或高于99.999%的为高纯气体;而对于氧气,纯度为99.199%即可称高纯氧;对于碳氢化合物,纯度为99199%的即可认为是高纯气体.高纯气体应用领域极宽,在半导体工业,高纯氮,氢,氩,氦可作为运载气,保护气和配制混合气的底气. 高纯气体根据分子结构的不同可以分为有机高纯气体,和无机高纯气体.
高纯氢气和高纯氮气都是无极高纯气体.1年前查看全部
- 高纯氮气国家标准关于GB/T8980-1996或更新标准的
 adanyFM1年前3
adanyFM1年前3 -
 ghost331 共回答了21个问题
ghost331 共回答了21个问题 |采纳率81%纯度是氮气的一个重要技术参数,按国标氮气的纯度分为工业用氮气、纯氮和高纯氮三级,它们的纯度分别为99.5%(O2≤0.5%),99.99%(O2≤0.01%)和99.999%(O2≤0.001%).1年前查看全部
- 高温CO还原MgSO4制备高纯MgO.750℃测得含等物质量的SO2和SO3,此时反应的化学方程式是
 水缸放zz1年前1
水缸放zz1年前1 -
 alostman 共回答了21个问题
alostman 共回答了21个问题 |采纳率95.2%2MgSO4 + CO =(750℃) 2MgO + CO2 + SO2 + SO31年前查看全部
- 天原化工厂通过电解饱和食盐水获得的氢气可用于生产高纯硅.已知电解饱和食盐水生成氢气、氯气(Cl2)和烧碱,反应的化学方程
天原化工厂通过电解饱和食盐水获得的氢气可用于生产高纯硅.已知电解饱和食盐水生成氢气、氯气(Cl2)和烧碱,反应的化学方程式为:
 云鹤九霄1年前1
云鹤九霄1年前1 -
 spfly911 共回答了19个问题
spfly911 共回答了19个问题 |采纳率89.5%2NaCl+2H2O= 通电= 2NaOH+H2↑+ Cl2 ↑1年前查看全部
- 关于次氯酸的实验室制取.【次氯酸实验室制取:由次氯酸钙与二氧化碳或草酸作用后过滤可得高纯滤液.】——百度百科请问,如此方
关于次氯酸的实验室制取.
【次氯酸实验室制取:由次氯酸钙与二氧化碳或草酸作用后过滤可得高纯滤液.】——百度百科
请问,如此方法,制取的次氯酸的浓度和以及杂质是什么样程度?另外制取过程中有什么需要注意的?主要问题:草酸与次氯酸钙发生反应的化学方程式?另外,类似强酸制弱酸,还有成品的杂质更方便去除的制取方法吗?
 我是大力1年前1
我是大力1年前1 -
 海浪大哥 共回答了15个问题
海浪大哥 共回答了15个问题 |采纳率80%CA(CLO)2+2HCL=2HCLO+CACL21年前查看全部
- (14分)高纯硅是当今科技的核心材料。工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl 4 (g)+2H 2 (g)
(14分)高纯硅是当今科技的核心材料。工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl 4 (g)+2H 2 (g)
 Si(s)+4HCl(g)。已知SiCl 4 可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl 4 (g)和H 2 (g),分别在T 1 和T 2 温度时进行反应。SiCl 4 的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g)。已知SiCl 4 可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl 4 (g)和H 2 (g),分别在T 1 和T 2 温度时进行反应。SiCl 4 的物质的量随时间变化情况如下表所示: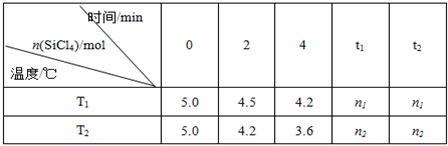
(1)T 1 时,反应开始的2 min内,用HCl表示的反应速率为 。
(2)该反应的平衡常数表达式为:K= 。
(3)保持其他条件不变,下列措施可提高SiCl 4 转化率的是 。
a.充入更多的SiCl 4 (g)
b.充入更多的H 2 (g)
c.及时分离出Si(s)
d.使用催化剂
e.将容器的体积扩大一倍
(4)据上表中的数据分析:T 1 T 2 (填“>”或“<”,下同),理由是 。已知n 1 >n 2 ,ΔH 0。
(5)有同学认为,采用水淋法来吸收生成的HCl,可以提高SiCl 4 的转化率。该认识 (填“合理”或“不合理”),理由是 。
(6)将平衡后的混合气体溶于水,取少量上层清液,向其中滴加足量的AgNO3溶液,反应后过滤,取沉淀向其中加入Na 2 S溶液,可观察到 。 我的英雄PBJ1年前1
我的英雄PBJ1年前1 -
 syslcy 共回答了14个问题
syslcy 共回答了14个问题 |采纳率92.9%(14分)
(1)1.0 mol/(L • min)(2分) (2)(2分)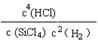
(3)be (2分)
(4)< (1分) T 2 时反应速率快(2分)> (1分)
(5)不合理(1分) SiCl 4 遇水完全水解生成硅酸和盐酸(2分)
(6)白色沉淀转化为黑色沉淀(1分)
(1)在T 1 时,反应开始的2 min内消耗的SiCl 4 的量是0.5mol,所以生成的HCl的量是2.0mol。因此用HCl表示的反应速率为1.0 mol/(L • min)。
(2)平衡常数是指在一定条件下,可逆反应达到平衡是生成物浓度的幂之积和反应物浓度的幂之积的比值。根据方程式可写出该反应的平衡常数表达式,需要注意的是在表达式中不能出现固体或纯液体的。
(3)因为这是一个体积增大的可逆反应,因此将容器的体积扩大一倍,平衡向正反应方向移动,增大反应物的转化率,e正确。充入更多的SiCl 4 (g),平衡虽然向正反应方向移动,但会降低自身的转化率,而提高氢气的转化率,所以a不正确,b正确。Si(s)是固体不影响平衡,c不正确。催化剂能同等程度改变正逆反应速率,但不会影响平衡,但不正确。故正确的答案是be。
(4)根据表中数据可知在相同时间内温度为T 2 反应速率快,因为温度越高,速率越快,故T 2 大于T 1 。n 1 >n 2 说明前者的转化率低于后者,即温度越高反应物的转化率越大,所以正反应是吸热反应。即ΔH大于0。
(5)由于SiCl 4 遇水完全水解生成硅酸和盐酸,所以采用水淋法来吸收生成的HCl是错误的。
(6)平衡后的混合气体溶于水,所得溶液中含有盐酸,滴加AgNO 3 溶液将生成AgCl沉淀,过滤后向沉淀中加入Na 2 S溶液,则沉淀颜色将由白色转化为黑色,这是因为Ag 2 S比AgCl更难溶,沉淀将向生成更难溶的物质转化。1年前查看全部
- 计算机工业所用的单晶硅要求达到99,99%以上的纯度在制造过程中利用四氯化硅和和氢气在高温下反应制取高纯硅,同时生成氯化
计算机工业所用的单晶硅要求达到99,99%以上的纯度在制造过程中利用四氯化硅和和氢气在高温下反应制取高纯硅,同时生成氯化氢 写出其化学方程式
 寒风扫落叶1年前1
寒风扫落叶1年前1 -
 jiangxu1986 共回答了15个问题
jiangxu1986 共回答了15个问题 |采纳率86.7%Si(粗硅)十2Cl2=加热=SiCl4
SiCl4十2H2=加热=Si(纯硅)十4HCl1年前查看全部
- 99.99%高纯二氧化碳最高压力多少啊
 磕碜Dê爷们1年前1
磕碜Dê爷们1年前1 -
 清歌妙舞落花前 共回答了23个问题
清歌妙舞落花前 共回答了23个问题 |采纳率95.7%你是想问CO2的液化点是吧,给你张表想要那个温度压力点的就自己查吧.这可是我精心收集的数据哦.
Temperature (℃) → Pressure (MPa)
-56 → 0.53065
-55 → 0.55397
-54 → 0.57805
-53 → 0.60291
-52 → 0.62857
-51 → 0.65504
-50 → 0.68234
-49 → 0.71049
-48 → 0.73949
-47 → 0.76937
-46 → 0.80015
-45 → 0.83184
-44 → 0.86445
-43 → 0.89800
-42 → 0.93252
-41 → 0.96801
-40 → 1.00450
-39 → 1.04200
-38 → 1.08050
-37 → 1.12010
-36 → 1.16070
-35 → 1.20240
-34 → 1.24520
-33 → 1.28910
-32 → 1.33420
-31 → 1.38040
-30 → 1.42780
-29 → 1.47630
-28 → 1.52610
-27 → 1.57700
-26 → 1.62930
-25 → 1.68270
-24 → 1.73750
-23 → 1.79350
-22 → 1.85090
-21 → 1.90960
-20 → 1.96960
-19 → 2.03100
-18 → 2.09380
-17 → 2.15810
-16 → 2.22370
-15 → 2.29080
-14 → 2.35930
-13 → 2.42940
-12 → 2.50100
-11 → 2.57400
-10 → 2.64870
-9 → 2.72490
-8 → 2.80270
-7 → 2.88210
-6 → 2.96320
-5 → 3.04590
-4 → 3.13030
-3 → 3.21640
-2 → 3.30420
-1 → 3.39380
0 → 3.48510
1 → 3.57830
2 → 3.67330
3 → 3.77010
4 → 3.86880
5 → 3.96950
6 → 4.07200
7 → 4.17650
8 → 4.28310
9 → 4.39160
10 → 4.50220
11 → 4.61490
12 → 4.72970
13 → 4.84660
14 → 4.96580
15 → 5.08710
16 → 5.21080
17 → 5.33680
18 → 5.46510
19 → 5.59580
20 → 5.72910
21 → 5.86480
22 → 6.00310
23 → 6.14400
24 → 6.28770
25 → 6.43420
26 → 6.58370
27 → 6.73610
28 → 6.89180
29 → 7.05090
30 → 7.213701年前查看全部
- 高纯CaCl2中混有Mg杂质,除去的方法是把氯化钙的水溶液加热到90℃~95℃,在不断搅拌下
高纯CaCl2中混有Mg杂质,除去的方法是把氯化钙的水溶液加热到90℃~95℃,在不断搅拌下
加入适当的沉淀剂,使镁生成沉淀过滤除去,沉淀剂最好用
A.氢氧化钙乳浆
B.碳酸钠溶液
C.碳酸氢钠溶液
D.氢氧化钠溶液
为什么 紫藤07161年前1
紫藤07161年前1 -
 秀丽阳光 共回答了37个问题
秀丽阳光 共回答了37个问题 |采纳率89.2%因为是要除去杂质,但是不能引入新的杂质.BCD均引入了Na元素,这是不正确的.加热到90℃~95℃,氢氧化钙乳浆能部分溶解.并且没有带入新杂质.除去氢氧化钙只需将溶液冷却下来过滤.1年前查看全部
- 高纯氧化钙是用于电子工业的重要无机化工原料,用生石灰制备高纯氧化钙的工艺流程如图:
高纯氧化钙是用于电子工业的重要无机化工原料,用生石灰制备高纯氧化钙的工艺流程如图:

请回答下列问题:
(1)过滤操作中玻璃棒的作用是______;
(2)反应A中的化学方程式为______;
(3)反应B中为提高产率,所加气体的顺序是______;(填字母)
A.先通入二氧化碳再通入氨气B.先通入氨气再通入二氧化碳
(4)灼烧时发生反应的化学方程式为CaCO3
CaO+CO2↑高温 .CaCO3,该工艺流程中可循环使用的物质是______.
CaO+CO2↑高温 .
(5)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙中会混有的两种杂质分别是______和______.
(6)生产过程中的NH4NO3在农业上属于______肥,在使用过程中不能与______性物质混用,否则会降低肥效,写出硝酸铵与熟石灰反应的方程式______.检验该反应中产生的刺激性气味的气体是用湿润的______试纸. phc07141年前1
phc07141年前1 -
 footmans 共回答了17个问题
footmans 共回答了17个问题 |采纳率76.5%解题思路:(1)根据过滤操作中玻璃棒的作用是引流进行解答;
(2)根据硝酸和氧化钙反应生成硝酸钙和水进行解答;
(3)根据二氧化碳溶于水生成碳酸,溶液呈酸性,有利于氨气的吸收进行解答;
(4)根据碳酸钙高温煅烧生成氧化钙和二氧化碳,生成的二氧化碳可以循环使用进行解答;
(5)根据氧化钙能和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水进行解答;
(6)根据硝酸铵中含有氮元素,属于铵态氮肥,遇到碱会放出氨气,氨气能使湿润的红色石蕊试纸变蓝进行解答.(1)过滤操作中玻璃棒的作用是引流.故填:引流;
(2)硝酸和氧化钙反应生成硝酸钙和水,化学方程式为2HNO3+Ca0=Ca(NO3)2+H2O;故填:2HNO3+Ca0=Ca(NO3)2+H2O;
(3)二氧化碳溶于水生成碳酸,溶液呈酸性,有利于氨气的吸收,所以所加气体的顺序是先通入二氧化碳再通入氨气;故填:A;
(4)反应物是碳酸钙,生成物是氧化钙和二氧化碳,反应条件是高温,二氧化碳后面标上上升符号,所以方程式是:CaCO3
高温
.
CaO+CO2↑;因为碳酸钙受热分解能生成二氧化碳,二氧化碳在前边的反应中是反应物,所以该工艺流程中可循环使用的物质是二氧化碳;故填:CaCO3
高温
.
CaO+CO2↑;二氧化碳;
(5)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙能和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水;故填:氢氧化钙;碳酸钙;
(6)硝酸铵中含有氮元素,属于铵态氮肥,遇到碱会放出氨气,氨气能使湿润的红色石蕊试纸变蓝,硝酸铵与熟石灰反应生成硝酸钙、水和氨气,反应的方程式2NH4NO3+Ca(OH)2═Ca(NO3)2+2NH3↑+2H2O;所以硝酸铵在使用过程中不能与碱性物质混用,否则会降低肥效.
故填:铵态氮;碱;2NH4NO3+Ca(OH)2═Ca(NO3)2+2NH3↑+2H2O;红色石蕊.点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;生石灰的性质与用途;常见化肥的种类和作用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查物质之间的转化,比较简单,只要熟记教材内容即可顺利解答,知道玻璃棒在操作中的作用,熟悉方程式的书写方法,循环利用的物质在前面是反应物,在后面是生成物.1年前查看全部
- (2008•西城区一模)我国科学家研制出具有自主知识产权的国产芯片“龙芯”一号和“龙芯”二号,其芯片的核心部件是以高纯硅
(2008•西城区一模)我国科学家研制出具有自主知识产权的国产芯片“龙芯”一号和“龙芯”二号,其芯片的核心部件是以高纯硅单质(Si)为原料制成的.用化学方法制备高纯硅的化学反应方程式是X+2H2
Si+4HCl.高温 .
(1)推断X的化学式为______.
(2)计算要获得56g硅单质(Si),至少需要氢气多少克? 指间的映月之光1年前1
指间的映月之光1年前1 -
 江上烟波_vv 共回答了25个问题
江上烟波_vv 共回答了25个问题 |采纳率72%解题思路:(1)根据反应前后各原子种类和数目不变求出化学式;(2)通过方程式列比例式由硅质量计算出氢气质量即可.(1)生成物中含有1个硅原子,4个氢原子,4个氯原子,反应物中已经含有4个氢原子,还缺少1个硅原子,4个氯原子,所以X的化学式为:SiCl4;
(2)设至少需要氢气的质量为x.
SiCl4+2H2
高温
.
Si+4HCl
428
x56 g
根据[4/28=
x
56g]解得x=8 g
答:至少需要氢气的质量是8 g.
故答案为:(1)SiCl4;(2)8g.点评:
本题考点: 根据化学反应方程式的计算;质量守恒定律及其应用.
考点点评: 要熟记质量守恒定律内容并能灵活运用回答相应问题.1年前查看全部
- 科学题(物质分类)1.洁净干燥的空气 2.纯净的海水 3.冰水混合物 4.液态氧 5.高纯硅 6.高锰酸钾 7.水银 8
科学题(物质分类)
1.洁净干燥的空气 2.纯净的海水 3.冰水混合物 4.液态氧 5.高纯硅 6.高锰酸钾 7.水银 8.二氧化碳 9.氯酸钾 10.镁在氧气中燃烧生成的白色固体
混合物有哪些?
单质有哪些?
化合物有哪些?
有氧分子的有哪些?
有水分子的有哪些?
要全! 月朗云轻1年前9
月朗云轻1年前9 -
 纯情的小火鸡 共回答了21个问题
纯情的小火鸡 共回答了21个问题 |采纳率85.7%混合物125
单 质47
化合物368910
有氧分子14
有水分子23
一定对1年前查看全部
- 下列说法正确的是( )A.高纯度的二氧化硅被广泛用于制作计算机芯片B.粗硅可由二氧化硅还原制得C.高纯硅是制造光导纤维
下列说法正确的是( )
A.高纯度的二氧化硅被广泛用于制作计算机芯片
B.粗硅可由二氧化硅还原制得
C.高纯硅是制造光导纤维的原料
D.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位约占地壳质量的90% 小小彬_1年前1
小小彬_1年前1 -
 木子日一 共回答了12个问题
木子日一 共回答了12个问题 |采纳率91.7%解题思路:A.计算机芯片的成分是硅单质;
B.用碳还原二氧化硅制得粗硅;
C.二氧化硅是光导纤维的成分;
D.硅在地壳中的含量在所有的元素中居第二位.A.计算机芯片的成分是硅单质,不是二氧化硅,故A错误;
B.高温下用碳还原二氧化硅制得粗硅,故B正确;
C.光导纤维成分是二氧化硅,故C错误;
D.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第二位,故D错误.
故选B.点评:
本题考点: 硅和二氧化硅.
考点点评: 本题考查硅和二氧化硅的性质,难度不大,明确物质的成分是解题的关键.1年前查看全部
- 标准氦气钢瓶中的高纯氦从瓶中喷出时氦气体周边的温度会降低到多少?
 snsyd1年前1
snsyd1年前1 -
 www6789 共回答了12个问题
www6789 共回答了12个问题 |采纳率91.7%请问你想知道氦气喷出的温度有什么用吗?氦气是惰性气体没有危险性的!如果真的很想了解打电话到那些气体厂的技术人员问问!我们厂的仪器也有用到氦气,如果你需要我可以给你电话.他们公司电话是057788638023!他们好像有网站,网站应该有介绍!www.***.com!
希望你能找到答案!1年前查看全部
大家在问
- 1引得春风度玉关什么意思
- 2如图,三角形abc是等腰直角三角形,角bac=90°,d是三角形abc内的一点,且有角dac=角dca=15°,求证:b
- 3{x+3=0 3分之1x-3y=6
- 4请运用化学反应原理的相关知识研究碳及其化合物的性质.
- 5(2009•茂名)如图(甲)所示是小明“探究串联电路中电压的关系”的实验电路图.
- 6熟悉考研英语二的进 英语一和英语二的阅读A的区别
- 7[(a的平方-b的平方)/b]的平方除以[(a的平方+ab)]的立方乘以[ab/(b-a)]的平方结果是多少?
- 84又11/25*8/37+31/37÷25/111-36/37*111/25
- 9怎么用;美丽,尤其,形状,认识,许许多多,歌唱,安静,欢庆,刚才,绿树成荫,编一段话?
- 10如图所示,在水平向左足够大的匀强电场中,一带电小球用绝缘轻绳悬于O点,平衡时小球位于A点,此时绳与竖直方向的夹角θ=53
- 11为初中英语老师写个颁奖词,一定要有赞美的意思,急
- 12It’s ___ time that he has failed in the experiment.However,
- 13三种饮料,质量是15/4千克,21/5千克,9/2千克,要分别装入瓶中而无剩余,而且重量都相等.最少要装多少瓶
- 14细胞是______、______和______的统一体.
- 15Where can you go if you lost your things?回答


