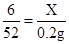锌合金材料的小东西 如何焊上锡铅焊丝
 睡越人生2022-10-04 11:39:541条回答
睡越人生2022-10-04 11:39:541条回答锌合金表面打磨后 用普通助焊剂擦拭后 用183°低温锡铅焊丝(65/35)焊台温度350° 无法上锡
买了专门适合锌材料的助焊水 还是没有效果 根本不粘锡 难道买的助焊水是假的吗
用什么方法或者什么助焊剂才能让锌合金的材料上锡
有人说用10%的稀盐酸擦拭 后可以上锡 请问是真的吗
需要锌合金可直接焊接,不用镀铜底的焊接方法

已提交,审核后显示!提交回复
共1条回复
 南糖北糠 共回答了15个问题
南糖北糠 共回答了15个问题 |采纳率86.7%- 这个需要用M51的低温焊丝锡基,然后配合M51-F的活性焊剂焊接,工作熔点温度179度,锌合金的小件可以用加热台加热焊接,也可以用第三代WE53专用多孔喷枪,单独烧液化气焊接的,具体的用喷枪配合M51焊丝焊剂焊接小件锌合金的操作可以上威欧丁焊接详细了解一下操作视频.
- 1年前
相关推荐
- 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g放入烧杯中,将80g9.8%的稀硫酸分四次加入该烧杯中
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g放入烧杯中,将80g9.8%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
试计算:次数 1 2 3 4 加入稀硫酸的质量/g 20.0 20.0 20.0 20.0 剩余固体的质量/g 8.7 7.4 6.1 5.8
(1)样品中铜的质量分数是58.0%58.0%;
(2)反应所消耗的硫酸溶液质量;
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是15.1%15.1%. sonyweiwei1年前1
sonyweiwei1年前1 -
 clswj1005 共回答了14个问题
clswj1005 共回答了14个问题 |采纳率100%解题思路:根据金属的活动性可知,黄铜中铜不能与稀硫酸发生反应,而锌可与稀硫酸放出氢气;随锌与稀硫酸发生反应,剩余固体质量不断减少;
(1)由第1次实验数据,加入20g稀硫酸固体质量减少1.3g,说明20g稀硫酸完全反应可消耗1.3g锌;
(2)对比后面的实验数据可发现,第4次加入20g稀硫酸时,固体质量只减少0.3g而非1.3g,可以说明此时黄铜中的锌已完全反应,则所剩余固体为不与稀硫酸反应的铜;根据反应的化学方程式,可由反应消耗锌的质量计算参加反应的稀硫酸的质量;
(3)前三次反应中稀硫酸都完全反应,所以,第三次加入硫酸充分反应后所得溶液为硫酸锌溶液;根据反应的化学方程式,由消耗硫酸的质量计算生成物硫酸锌的质量与所得溶液的比即溶液中溶质的质量分数.(1)黄铜样品中铜的质量分数=
5.8g
10g×100%=58.0%;
故答案为:58.0%;
(2)参加反应锌的质量=10g-5.8g=4.2g
设共消耗的硫酸溶液质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
4.2g 9.8%x
65
4.2g=
98
98%X x=64.6g
答:共消耗硫酸溶液的质量是64.6g;
(3)参加反应锌的质量=10g-6.1g=3.9g
设前三次反应生成硫酸锌的质量为y,放出氢气质量为z
Zn+H2SO4═ZnSO4+H2↑
65 161 2
3.9g y z
65
3.9g=
161
y y=9.66g
65
3.9g =
2
z z=0.12g
所得溶液中溶质的质量分数=
9.66g
3.9g+60g−0.12g×100%≈15.1%
故答案为:15.1%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 根据质量守恒定律,第三次实验后所得溶液质量=参加反应锌的质量+三次实验所加稀硫酸质量-放出氢气的质量.1年前查看全部
- 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸,反应过程中生成的气体
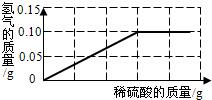 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸,反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸,反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
(1)写出该反应中涉及的反应的化学方程式______;
(2)样品中铜的质量分数;
(3)恰好完全反应时所得溶液的质量. wangjing_19861年前1
wangjing_19861年前1 -
 shdmojing 共回答了18个问题
shdmojing 共回答了18个问题 |采纳率83.3%解题思路:根据金属活动性强弱关系锌>氢>铜,向黄铜样品滴加稀硫酸,锌与稀硫酸反应放出氢气而铜不能与稀硫酸反应,利用反应的化学方程式由放出氢气的质量计算合金中锌的质量、消耗的稀硫酸的质量;然后分别利用样品中铜的质量分数=样品质量10g−锌的质量样品质量×00%和质量守恒定律计算反应后所得硫酸锌溶液的质量.(1)在金属活动性顺序表中,锌位于氢之前可与稀硫酸反应放出氢气,反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑;而铜位于氢之后不能与稀硫酸发生反应;
故答案为:Zn+H2SO4═ZnSO4+H2↑;
(2)设恰好完全反应时,消耗锌的质量为x,消耗硫酸的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 98 2
x y 0.10g
[65/x]=[2/0.10g] x=3.25g
[98/y]=[2/0.10g] y=4.9g
样品中铜的质量分数=[10g−3.25g/10g]×100%=67.5%
恰好完全反应时,消耗稀硫酸的质量=4.9g÷9.8%=50g
(3)恰好完全反应时所得溶液的质量=3.25g+50g-0.10g=53.15g
答:样品中铜的质量分数为67.5%,恰好完全反应时所得溶液的质量为53.15g.点评:
本题考点: 有关溶质质量分数的简单计算;金属的化学性质;酸的化学性质;根据化学反应方程式的计算.
考点点评: 根据质量守恒定律,恰好完全反应后所得溶液的质量=参加反应锌的质量+加入的稀硫酸的质量-放出气体的质量.1年前查看全部
- 黄铜是铜、锌合金,它用于制造机器、电器零件等.为测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到稀硫酸中,恰好完全
黄铜是铜、锌合金,它用于制造机器、电器零件等.为测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到稀硫酸中,恰好完全反应,产生氢气0.1g.试求:该黄铜样品中铜的质量分数.
 feelbyheart1年前1
feelbyheart1年前1 -
 崔崧_vv 共回答了20个问题
崔崧_vv 共回答了20个问题 |采纳率100%解题思路:利用锌与硫酸反应的化学方程式,根据氢气的质量求出锌的质量,进而求出铜的质量,从而求出铜的质量分数.设产生0.1g氢气消耗Zn的质量为x.
Zn+H2SO4=ZnSO4+H2↑
652
x0.1g
[65/x=
2
0.1g]
解得x=3.25g
所以铜的质量分数为:[10g−3.25g/10g]×100%=67.5%
答:该黄铜样品中铜的质量分数67.5%点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查根据化学方程式的简单计算,已知生成物的质量求反应物的质量.1年前查看全部
- (2013•松北区二模)为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,贝贝同学取10g黄铜样品放入烧杯中,再取4
(2013•松北区二模)为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,贝贝同学取10g黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
(1)该小组同学要用质量分数为36,5%浓盐酸配制所需的40克稀盐,则需浓盐酸的质量为_______;第一次 第二次 第二次 第四次 加入稀盐酸质量(g) 10g 10g 10g 10g 剩余固体的质量(g) 8.7g 7.4g 6.1g 5.45g
(2)上述反应的化学方程式为______;
(3)列出求解生成氢气总质量(X)的比例式[65/2]=[4.55g/X][65/2]=[4.55g/X];
(4)向第一次反应后所得溶液中加入8.74g水,则所得溶液的质量分数为______;
(5)某工厂要想制得2000t黄铜,需要含杂质50%的辉铜矿(主要成分是Cu2S)的质量为_______. miaxing1年前1
miaxing1年前1 -
 初夏的晴天 共回答了19个问题
初夏的晴天 共回答了19个问题 |采纳率94.7%解题思路:(1)溶液稀释前后,溶质质量不变;
(2)锌和稀盐酸反应能生成氯化锌和氢气;
(3)根据化学方程式可以计算生成氢气的质量;
(4)根据溶液质量分数的公式可以计算所得溶液的质量分数;
(5)根据提供的数据可以计算矿石的质量.(1)根据第一次数据计算,参加反应的锌的质量为:10g-8.7g=1.3g,
设10g稀盐酸中氯化氢的质量为X,生成氯化锌的质量为Z,生成氢气的质量为m,
Zn+2HCl═ZnCl2+H2↑,
65 73 136 2
1.3g X Z m
[65/73]=[1.3g/X],[65/136]=[1.3g/Z],[65/2]=[1.3g/m],
X=1.46g,Z=2.72g,m=0.04g,
稀盐酸的质量分数为:[1.46g/10g]×100%=14.6%,
设需浓盐酸的质量为Y,
根据稀释前后溶质质量不变有:Y×36.5%=40g×14.6%,
Y=16g.
故填:16g.
(2)上述反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑.
故填:Zn+2HCl═ZnCl2+H2↑.
(3)10g黄铜样品中锌的质量为:10g-5.45g=4.55g,
设生成氢气总质量为X,
Zn+2HCl═ZnCl2 +H2↑,
652
4.55gX
[65/2]=[4.55g/X],
X=0.14g,
故填:[65/2]=[4.55g/X].
(4)向第一次反应后所得溶液中加入8.74g水,则所得溶液的质量为:10g+1.3g-0.04g+8.74g=20g,
则所得溶液的质量分数为:[2.72g/20g]×100%=13.6%.
故填:13.6%.
(5)由表中数据可知,铜的质量为5.45g,
黄铜样品中铜的质量分数为:[5.45g/10g]×100%=54.5%,
2000t黄铜中铜的质量为:2000t×54.5%=1090t,
需要Cu2S的质量为:1090t÷([128/160]×100%)=1362.5t,
需要含杂质50%的辉铜矿的质量为:1362.5t÷50%=2725t.
故填:2725t.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查分析数据、书写化学方程式、计算质量分数等方面的知识,计算时要认真、准确,力求得出正确的结果.1年前查看全部
- 黄铜是铜,锌合金为测定某黄铜中铜的质量分数现取20g该样品粉碎加入适量的稀硫酸恰好完全反应,生成氢气0.2
 禾子也1年前1
禾子也1年前1 -
 ht_few 共回答了28个问题
ht_few 共回答了28个问题 |采纳率100%铜与稀硫酸不反应
锌能置换稀硫酸中的氢
Zn + H2SO4 === ZnSO4 + H2↑
65 2
x 0.2g
65/x=2/0.2g
x=6.5g
黄铜中铜的质量分数 (20g-6.5g)/20g*100%=67.5%1年前查看全部
- 锌合金.单价15300/KG,重量0.104/KG.材料费1.6元,怎么算出来的.
 prodigy19s1年前2
prodigy19s1年前2 -
 猪的美人鱼 共回答了27个问题
猪的美人鱼 共回答了27个问题 |采纳率85.2%重量是0.104/G,四舍五入得1.6元1年前查看全部
- 有一块铜,锌合金,其中铜与锌的比是3:4,现在加入8克锌,共得到新合金64克,求新合金中铜与锌的比是多少?
 鸭子迷糊糊1年前2
鸭子迷糊糊1年前2 -
 panpan1021 共回答了23个问题
panpan1021 共回答了23个问题 |采纳率91.3%铜的含量=(64-8)*3/(3+4)=24克
那么锌的含量=64-24=40克
新合金中铜与锌的比=24:40=3:51年前查看全部
- 为测定某黄铜(铜,锌合金)中铜的质量分数,李同学取一定量的黄铜样品放入烧杯中,再取400g稀盐酸分四次加入烧杯中,均充分
为测定某黄铜(铜,锌合金)中铜的质量分数,李同学取一定量的黄铜样品放入烧杯中,再取400g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
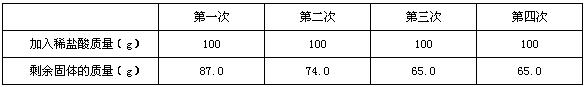
(1)求第二次生成氢气质量.
(2)所用盐酸中溶质质量分数.
(3)该黄铜样品中铜的质量分数.算了答案特别怪!
第二问盐酸溶质质量算了803哪里出错了?
 lf171年前1
lf171年前1 -
 miohael123 共回答了21个问题
miohael123 共回答了21个问题 |采纳率81%铜与盐酸不反应
第二次反应的锌的质量为 87g-74g=13g ,原样品的质量为 87g+13g=100g
Zn + 2HCl === ZnCl2 + H2↑
65 73 2
13g y x
65/13g=73/y=2/x
x=0.4g
y=14.6g
(1)第二次生成氢气质量 0.4g.
(2)所用盐酸中溶质质量分数 14.6g/100g=14.6% .
(3)该黄铜样品中铜的质量分数 65g/100g*100%=65%.1年前查看全部
- “黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56
“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56g)
甲 乙 丙 烧杯+稀盐酸质量 139g 129g 129g 加入黄铜样品质量 20g 24g 20g 充分反应后,烧杯+剩余物质质量 158.8g 152.8g 148.8g
请回答下列问题:
(1) 同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是 。
(2)计算黄铜样品中锌的质量分数。 我心Α飞翔1年前1
我心Α飞翔1年前1 -
 傲天决 共回答了17个问题
傲天决 共回答了17个问题 |采纳率82.4%(1)丙;0.2g;(2)32.5%
1年前查看全部
- 锌合金冲直径16mm的孔,材料厚度为2mm,做冲孔模放间隙要多少?
 和你在一起的日子1年前1
和你在一起的日子1年前1 -
 qlyzhlhc1 共回答了19个问题
qlyzhlhc1 共回答了19个问题 |采纳率89.5%单边最少0.1,最好放到0.1151年前查看全部
- 黄铜是铜、锌合金,它用于制造机器、电器零件等.为测某黄铜样品中铜的质量分数取10g该黄铜样品加入到稀硫
黄铜是铜、锌合金,它用于制造机器、电器零件等.为测某黄铜样品中铜的质量分数取10g该黄铜样品加入到稀硫
酸中,好反应产生氢气0.1g,(1)稀H2SO4中溶质的质量分数? one7two1年前1
one7two1年前1 -
 yxying_1018 共回答了17个问题
yxying_1018 共回答了17个问题 |采纳率94.1%设H2SO4的质量为X.
Cu + H2SO4 = CuSO4 + H2(上升)
98 2
X 0.1g
98 / 2 = X / 0.1g
X = 4.9g
题目中有没有说到稀硫酸的质量或体积,密度什么的?不然怎么么求1年前查看全部
- 锌合金和铝合金的区别是什么?
 媚眼天使1年前4
媚眼天使1年前4 -
 想你怎么这么容易 共回答了17个问题
想你怎么这么容易 共回答了17个问题 |采纳率94.1%锌合金是以锌为基加入其他元素组成的合金.常加的合金元素有铝、铜、镁、镉、铅、钛等低温锌合金.锌合金熔点低,流动性好,易熔焊,钎焊和塑性加工,在大气中耐腐蚀,残废料便于回收和重熔;但蠕变强度低,易发生自然时效引起尺寸变化.熔融法制备,压铸或压力加工成材.按制造工艺可分为铸造锌合金和变形锌合金.
铝合金是以铝为基的合金总称.主要合金元素有铜、硅、镁、锌、锰,次要合金元素有镍、铁、钛、铬、锂等.铝合金是工业中应用最广泛的一类有色金属结构材料,在航空、航天、汽车、机械制造、船舶及化学工业中已大量应用.随着近年来科学技术以及工业经济的飞速发展,对铝合金焊接结构件的需求日益增多,使铝合金的焊接性研究也随之深入.铝合金的广泛应用促进了铝合金焊接技术的发展,同时焊接技术的发展又拓展了铝合金的应用领域,因此铝合金的焊接技术正成为研究的热点之一. 纯铝的密度小(ρ=2.7g/cm3),大约是铁的 1/3,熔点低(660℃),铝是面心立方结构,故具有很高的塑性(δ:32~40%,ψ:70~90%),易于加工,可制成各种型材、板材.抗腐蚀性能好;但是纯铝的强度很低,退火状态 σb 值约为8kgf/mm2,故不宜作结构材料.通过长期的生产实践和科学实验,人们逐渐以加入合金元素及运用热处理等方法来强化铝,这就得到了一系列的铝合金.添加一定元素形成的合金在保持纯铝质轻等优点的同时还能具有较高的强度,σb 值分别可达 24~60kgf/mm2.这样使得其“比强度”(强度与比重的比值 σb/ρ)胜过很多合金钢,成为理想的结构材料,广泛用于机械制造、运输机械、动力机械及航空工业等方面,飞机的机身、蒙皮、压气机等常以铝合金制造,以减轻自重.采用铝合金代替钢板材料的焊接,结构重量可减轻50%以上. 铝合金密度低,但强度比较高,接近或超过优质钢,塑性好,可加工成各种型材,具有优良的导电性、导热性和抗蚀性,工业上广泛使用,使用量仅次于钢. 铝合金分两大类:铸造铝合金,在铸态下使用;变形铝合金,能承受压力加工,.可加工成各种形态、规格的铝合金材.主要用于制造航空器材、建筑用门窗等. 铝合金按加工方法可以分为形变铝合金和铸造铝合金.形变铝合金又分为不可热处理强化型铝合金和可热处理强化型铝合金.不可热处理强化型不能通过热处理来提高机械性能,只能通过冷加工变形来实现强化,它主要包括高纯铝、工业高纯铝、工业纯铝以及防锈铝等.可热处理强化型铝合金可以通过淬火和时效等热处理手段来提高机械性能,它可分为硬铝、锻铝、超硬铝和特殊铝合金等. 一些铝合金可以采用热处理获得良好的机械性能,物理性能和抗腐蚀性能. 铸造铝合金按化学成分可分为铝硅合金,铝铜合金,铝镁合金,铝锌合金和铝稀土合金,其中铝硅合金又有简单铝硅合金(不能热处理强化,力学性能较低,铸造性能好),特殊铝硅合金(可热处理强化,力学性能较高,铸造性能良好),1年前查看全部
- (2011•邯郸二模)Ag-Zn合金可用于工艺品的制作,某化学兴趣小组的同学为了测定某银锌合金的组成,取20g样品于烧杯
(2011•邯郸二模)Ag-Zn合金可用于工艺品的制作,某化学兴趣小组的同学为了测定某银锌合金的组成,取20g样品于烧杯中,向其中分5次加相同质量分数的稀硫酸,使之充分反应,每次所用稀硫酸的质量均为20g,剩余固体的质量记录于下表:
请计算:(1)该样品中银的质量为______.实验次数 第1次 第2次 第3次 第4次 第5次 反应后剩余固体的质量(g) 17.4 14.8 12.2 10.8 10.8
(2)所用稀硫酸溶质的质量分数. dxl198703021年前1
dxl198703021年前1 -
 西独欧阳疯 共回答了16个问题
西独欧阳疯 共回答了16个问题 |采纳率93.8%解题思路:由表格中的数据可看出,前三次实验固体质量的减少量是相同的,而第四次的固体减少量比前三次少,说明第四次实验时锌已经完全反应,所以不能用第四次和第三次实验固体质量的差值来计算.(1)由于Ag-Zn合金中只有Zn和稀硫酸反应,Ag和稀硫酸不反应,所以最后剩余固体的质量就是合金中Ag的质量,即Ag的质量为10.8g;
故填:10.8g;
(2)设所用稀硫酸中硫酸的质量分数为x,据题意得:
H2SO4 +Zn═ZnSO4+H2↑
9865
20g×x 20g-17.4g
[98/20gx=
65
20g−17.4g]
x=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 计算所用稀硫酸的溶质质量分数时,注意选取稀硫酸完全反应时的实验数据即前三次实验的数据进行计算.1年前查看全部
- 某化学兴趣小组为了测定黄铜(铜、锌合金)中锌的质量分数,取出6g合金样品,将50g稀硫酸分5次加入样品中,充分反应后过滤
某化学兴趣小组为了测定黄铜(铜、锌合金)中锌的质量分数,取出6g合金样品,将50g稀硫酸分5次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
(1)m值为 ;稀硫酸用量 剩余固体质量 第一次加入10g 4.7 g 第二次加入10g mg 第三次加入10g 2.1g 第四次加入10g 1.2 g 第五次加入10g 1.2 g
(2)求合金中锌的质量分数?
(3)求稀硫酸中溶质的质量分数? 木木之夕1年前1
木木之夕1年前1 -
 hgc7988 共回答了22个问题
hgc7988 共回答了22个问题 |采纳率95.5%(1)m为3.4(2)80%
(3)设10克稀硫酸中硫酸溶质为X
Zn+ H 2 SO 4 ===H 2 ↑+ ZnSO 4
65 98
1.3g x
65/98=1.3g/x
X=1.96g,
则稀硫酸中溶质的质量分数为1.96g/10g*100%=19.6%
通过表格可以看出第一次固体溶解了6-4.7=1.3g,所以第二次也应该溶解1.3克,所以m的值为4.7-1.3=2.4,第四次加入10克酸后,它只溶解了2.1-1.2=0.9克,而且第5次剩余固体还是1.2克,说明这1.2克是铜(铜不与酸反应),则6克合金中锌的质量为6-1.2=4.8,则合金中锌的质量分数为4.8g/6*100%=80%.通过表格可以看出10克酸可以溶解1.3克锌,所以根据1.3克锌就可以求出10克稀硫酸中硫酸溶质了。1年前查看全部
- 某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,
某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,俊充分反应,实验数据如下:
(1)黄铜样品中锌的质量分数为多少?(写出计算步骤,下同)第一次 第二次 第三次 第四次 第五次 第六次 加入稀硫酸的质量(g) 10 10 10 10 10 10 剩余固体的质量(g) 9.35 8.7 8.05 7.4 6.75 6.75
(2)10g样品完全反应产生氢气质量为多少? anythins1年前1
anythins1年前1 -
 llstar1919 共回答了13个问题
llstar1919 共回答了13个问题 |采纳率84.6%解题思路:(1)前五次每次消耗固体的质量为0.65g,所以第五次加入的硫酸被完全反应掉,比较第五次和第六次的数据可以知道,剩余固体的质量都为6.75g,即第六次加入的稀硫酸没有反应,可以据此求算出锌的质量分数;(2)根据(1)的解答,利用锌的质量结合化学方程式求算出氢气的质量.(1)比较第五次和第六次的数据可以知道,剩余固体的质量都为6.75g且都是铜的质量,黄铜样品中锌的质量为:10g-6.75g=3.25g;(2)设生成氢气的质量为xZn+H2SO4═ZnSO4+H2↑65&...
点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生判断物质间的反应关系以及运用化学方程式进行计算的能力.学生需认真分析反应关系,正确书写化学方程式,才能解决.1年前查看全部
- 为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入
为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
(1)黄铜样品中铜的质量分数为______.第一次 第二次 第三次 第四次 加入稀盐酸质量(g) 10 10 10 10 剩余固体的质量(g) 9.10 8.45 7.80 7.80
(2)求第二次生成氢气质量. 最是一年春好处1年前1
最是一年春好处1年前1 -
 ff0071981 共回答了24个问题
ff0071981 共回答了24个问题 |采纳率95.8%解题思路:(1)据金属活动性可知,铜排在氢后,不能与稀盐酸发生反应,故发生反应的是锌,可写化学反应方程式;由第三次和第四次剩余固体质量相等可知,剩余的7.80g固体即为样品中铜的质量,根据铜的质量与样品质量比可计算出黄铜样品中铜的质量分数,样品的质量=7.8g+1.95g=9.75g.
(2)分析知减少的固体的质量就是参加反应的锌的质量,由题目可知:第二次反应消耗锌的质量=9.1g-8.45g=0.65g,根据反应的化学方程式,可计算出生成氢气的质量;(1)由第三次和第四次剩余固体质量相等可知,剩余的7.80g固体即为样品中铜的质量,由第二次消耗的锌的质量可知每10g盐酸消耗的锌的质量是9.10g-8.45g=0.65g,所以原固体质量为0.65g+9.1g=9.75g,则该黄铜样品中铜的质量分数为[7.8g/9.75g]×100%=80%;
(2)分析知第二次反应消耗锌的质量=9.10g-8.45g=0.65g,设生成氢气的质量为x
Zn+2HCl═ZnCl2+H2↑
65 2
0.65gx
[65/0.65g=
2
x]
x=0.02g
故答案为:(1)80%;(2)第二次生成氢气质量是0.02g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据所给的实验数据分析每次加入10g稀盐酸固体剩余物质量的变化,可对反应进行的情况进行判断,并明确参加反应的是固体中的锌,这是解决本题的关键.1年前查看全部
- 铁、锌合金8.85g溶于稀硫酸中,充分反应后制得0.3g氢气,求合金中铁、锌的质量各为多少?
 aoming12031年前3
aoming12031年前3 -
 有事吗 共回答了16个问题
有事吗 共回答了16个问题 |采纳率100%解题思路:据铁、锌与硫酸反应方程式,合金质量和生成氢气的质量进行计算.设合金中铁的质量是x,则锌的质量是8.85g-x,铁生成氢气的质量是a,锌生成氢气的质量是b
Fe+H2SO4═FeSO4+H2↑
56 2
x a
[56/2]=[x/a]
a=[x/28]x
Zn+H2SO4═ZnSO4+H2↑
65 2
8.85g-x b
[65/2]=[8.85g−x/b]
b=[16.7g−2x/65]
则有[x/28]x+[16.7g−2x/65]=0.3g,解得x=5.6g,则锌的质量是8.85g-5.6g=3.25g;
答:合金中铁、锌的质量分别为5.6g、3.25g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 掌握金属和酸反应的方程式,并能结合题意灵活分析解答,有一定难度.1年前查看全部
- 初四化学题很难为了测定黄铜(铜.锌合金组成),某研究性学习小组称去该样品10g,向其中逐渐加入9.8%的稀硫酸至刚好不再
初四化学题很难
为了测定黄铜(铜.锌合金组成),某研究性学习小组称去该样品10g,向其中逐渐加入9.8%的稀硫酸至刚好不再生成气体为止,如下图.(横轴为稀盐酸的质量,纵轴为生成氢气的质量)
计算
1.样品中铜的质量分数.
2.反应所消耗的硫酸溶液所消耗的质量
3.凡用后所得溶液中的质量分数.
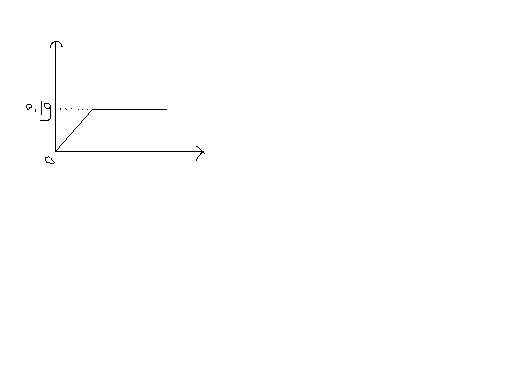
 雾失峰1年前1
雾失峰1年前1 -
 曲颈瓶 共回答了17个问题
曲颈瓶 共回答了17个问题 |采纳率82.4%0.1g氢气为0.05mol,根据得失电子守恒判断锌为0.05mol,3.25g,铜质量分数为1-32.5%=67.5%
1molH2需1mol h2so4,即反应消耗0.05mol硫酸,M=0.05*98/9.8%=50g
反应生成0.05mol硫酸锌,溶液总质量为50+0.05*(65-2)=53.15g,溶质质量分数为0.05*(96+65)/53.15=15.15%1年前查看全部
- (2011•山西)黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品.为测定某黄铜中铜的质量分数,现取10g该样品粉碎
(2011•山西)黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品.为测定某黄铜中铜的质量分数,现取10g该样品粉碎,加入到50g稀硫酸中,恰好完全反应,测得剩余固体质量为3.5g.计算:
(1)黄铜样品中铜的质量分数.
(2)稀硫酸中溶质的质量分数. lvfan55331年前1
lvfan55331年前1 -
 冷冷泪 共回答了13个问题
冷冷泪 共回答了13个问题 |采纳率92.3%解题思路:(1)铜不会和稀硫酸反应,因此剩余的固体就是铜.
(2)写出化学方程式并计算出硫酸(溶质)的质量,然后计算出溶液的质量分数.(1)根据题目信息可知,铜的质量是3.5克,所以黄铜样品中铜的质量分数=[3.5g/10g]×l00%=35%.
(2)根据题目信息可知,10g该样品中锌的质量=10g-3.5g=6.5g.设稀硫酸中溶质的质量为X.
Zn+H2SO4=ZnSO4+H2↑
6598
6.5g X
[65/98]═[6.5g/x]
得:X=9.8g
∴稀硫酸中溶质的质量分数=[9.8g/50g]×l00%=19.6%.
答:(1)黄铜样品中铜的质量分数为35%;(2)稀硫酸中溶质的质量分数为l9.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 掌握化学方程式的计算格式和规范性,记住铜不会和稀硫酸反应.1年前查看全部
- 为什么铝锌合金在温度达到150摄氏度的时候,其强度和性能会急剧下降?其组织发生了什么变化?
为什么铝锌合金在温度达到150摄氏度的时候,其强度和性能会急剧下降?其组织发生了什么变化?
为什么铝锌合金在温度达到100-150摄氏度的时候,其强度和性能会急剧下降?
铝锌合金组织发生了什么变化? 能不能解释下其机理.
 摸班转用1年前1
摸班转用1年前1 -
 1011g 共回答了16个问题
1011g 共回答了16个问题 |采纳率100%金属材料学分枝很多,我对铝合金只知道一点,希望对你有用.
铝合金,大体分两类,铸造铝合金,变形铝合金.前者加入的合金元素(锌等)高些,要杂一些,温度不高就到达液态,有共晶组织,有流动性才能用于铸造呀.后者,加入合金元素,少要纯一些,温度稍高,还是一个固态相,塑性好,锻,压,拉都行.
在变形铝合金中,还是按照加入合金元素高低,一类不可热处理的,一类可以.前者太纯,温度高低都是一个相.后者杂一些,温度高时是一个相,温度低时可以析出第二相.
后者经过淬火,还要时效处理,析出第二相,20度--100度,可以,低温可以让第二相均匀的析出,弥散分布的金相组织,强度高.一旦温度过高,第二相扩散过快,偏析,强度下去了.1年前查看全部
- 黄铜是铜、锌合金,为了测定“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数
黄铜是铜、锌合金,为了测定
“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56g)
甲
乙
丙
烧杯+稀盐酸质量
139g
129g
129g
加入黄铜样品质量
20g
24g
20g
充分反应后,烧杯+剩余物质质量
158.8g
152.8g
148.8g
请回答下列问题:求所用稀盐酸的质量分数 井里的宝1年前1
井里的宝1年前1 -
 zyong1121 共回答了17个问题
zyong1121 共回答了17个问题 |采纳率94.1%生成氢气的质量=(129g+20g)-148.8g=0.2g;
Zn+2HCl==ZnCl2+H2(气体)
73 2
x 0.2g
73/2=x/0.2g
x=7.3g
所以所用稀盐酸的质量分数=7.3g/(129g-56g)*100%=10%1年前查看全部
- 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g和90.2个稀盐酸,恰好完全反应,.
 lluyu1年前1
lluyu1年前1 -
 xm20052005 共回答了24个问题
xm20052005 共回答了24个问题 |采纳率83.3%生成0.2g氢气
铜不与盐酸反应
Zn + 2HCl === ZnCl2 + H2↑
65 136 2
x y 0.2g
65/x=136/y=2/0.2g
x=6.5g
y=13.6g1年前查看全部
- 为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,入烧杯中,
为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,入烧杯中,
洋洋同学取一定质量的黄铜样品放再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下第一次 第二次 第三次 第四次
加入稀盐酸质量(g) 10 10 10 10
剩余固体的质量(g) 9.35 8.7 8.05 8.05
(1)所用稀盐酸中溶质的质量分数为
(2)黄铜样品中铜的质量分数为 . nancy-lee1年前1
nancy-lee1年前1 -
 kathyghy 共回答了18个问题
kathyghy 共回答了18个问题 |采纳率94.4%(1)7.1%
(2)80.5%1年前查看全部
- 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
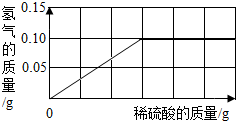
(1)样品中铜的质量分数;
(2)反应所消耗的硫酸溶液质量;
(3)反应后所得溶液质量. 花非花221年前1
花非花221年前1 -
 九龙银 共回答了18个问题
九龙银 共回答了18个问题 |采纳率83.3%解题思路:根据锌与硫酸反应的化学方程式,由图中最多生成的氢气质量0.10g,可以计算出:(1)参加反应的锌的质量,进而计算出样品中铜的质量分数;(2)参加反应的硫酸的质量,进而计算出硫酸溶液的质量;(3)利用质量守恒定律进而计算出所得硫酸锌溶液的质量.由图象可知反应完全后生成的氢气质量是0.1g
设样品中锌的质量为x;消耗硫酸溶液的质量为y;
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y×9.8% 0.10g
[65/x=
98
y×9.8%=
2
0.10g]
x=3.25g y=50g
(1)样品中铜的质量分数=[10g−3.25g/10g]×100%=67.5%
(2)反应所消耗的硫酸溶液质量为y=50g;
(3)所得溶液的质量为:3.25g+50g-0.1g=53.15g;
答:(1)样品中铜的质量分数为67.5%;
(2)消耗硫酸溶液的质量为50g;
(3)所得溶液的质量为53.15g;点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查有关化学方程式的计算,难度较大.计算所得溶液质量时,要注意:①不能把铜的质量计算在所得溶液中;②不能把生成氢气的质量计算在所得溶液中.1年前查看全部
- 黄铜是铜、锌合金,它用于制造机器、电器零件等。为测定某黄铜样品中铜的质量分数,取10g该黄铜样品,将40g19.6%的稀
黄铜是铜、锌合金,它用于制造机器、电器零件等。为测定某黄铜样品中铜的质量分数,取10g该黄铜样品,将40g19.6%的稀硫酸分四次加入,实验结果如下表:
19.6%r的硫酸/g 10g 10g 10g 10g 生成的氢气/g 0.04g 0.04g Xg 0. 02g
(1)X的值是 g
(2)该黄铜样品中铜的质量分数。 w_m_l1年前1
w_m_l1年前1 -
 hdzbc2 共回答了20个问题
hdzbc2 共回答了20个问题 |采纳率90%(1)0.04(2)54.5%
(1)根据表可知,每10g硫酸反应生成氢气0.04g,根据第四次有0.02g的氢气生成可知,第三次生成的氢气也是0.04g,
(2)根据生成的氢气的总质量是0.14g,利用化学方程式可求出锌的质量,即求出铜的质量,进行1年前查看全部
- 区别黄铜(铜,锌合金)与黄金-用火烧对不对?
 墨子风度1年前1
墨子风度1年前1 -
 rainyong 共回答了13个问题
rainyong 共回答了13个问题 |采纳率92.3%对.黄铜中的铜、锌会和氧气反应,黄金不能.1年前查看全部
- (2013•东莞二模)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸
 (2013•东莞二模)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
(2013•东莞二模)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
(1)样品中铜的质量分数;
(2)反应所消耗的硫酸溶液质量;
(3)反应后所得溶液质量. 空中云1年前1
空中云1年前1 -
 阿水yushao 共回答了13个问题
阿水yushao 共回答了13个问题 |采纳率100%解题思路:根据锌与硫酸反应的化学方程式,由图中最多生成的氢气质量0.10g,可以计算出:(1)参加反应的锌的质量,进而计算出样品中铜的质量分数;(2)参加反应的硫酸的质量,进而计算出硫酸溶液的质量;(3)利用质量守恒定律进而计算出所得硫酸锌溶液的质量.由图象可知反应完全后生成的氢气质量是0.1g
设样品中锌的质量为x;消耗硫酸溶液的质量为y;
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y×9.8% 0.10g
[65/x=
98
y×9.8%=
2
0.10g]
x=3.25g y=50g
(1)样品中铜的质量分数=[10g−3.25g/10g]×100%=67.5%
(2)反应所消耗的硫酸溶液质量为y=50g;
(3)所得溶液的质量为:3.25g+50g-0.1g=53.15g;
答:(1)样品中铜的质量分数为67.5%;
(2)消耗硫酸溶液的质量为50g;
(3)所得溶液的质量为53.15g;点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查有关化学方程式的计算,难度较大.计算所得溶液质量时,要注意:①不能把铜的质量计算在所得溶液中;②不能把生成氢气的质量计算在所得溶液中.1年前查看全部
- 请问锌合金、铝合金、钛合金、不锈钢性质上有什么区别?价格上又有什么区别啊?
 wenll08911年前1
wenll08911年前1 -
 步摇 共回答了13个问题
步摇 共回答了13个问题 |采纳率92.3%都是用于防锈的,一般来说,锌合金是压铸成型的,铝合金是热挤压成型的的,钛合金和不锈钢是轧制的.至于价格要看具体的使用场合,一般说来,前两者便宜点,后两者要贵一点.事实上这个问题不好答,这些金属的牌号多种多样,使用范围很宽,价钱自然就有千差万别.1年前查看全部
- (2012•建宁县质检)黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品.某化学兴趣小组取含铜35%的黄铜样品20克
(2012•建宁县质检)黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品.某化学兴趣小组取含铜35%的黄铜样品20克,加入到100g稀硫酸中.(假设样品中不含其它杂质)
①该黄铜样品中含铜的质量是______;
②若稀硫酸恰好完全反应,则该稀硫酸中溶质的质量分数是多少?(反应方程式:Zn+H2SO4=ZnSO4+H2↑) xiyuelang1年前1
xiyuelang1年前1 -
 haiyun0381 共回答了17个问题
haiyun0381 共回答了17个问题 |采纳率76.5%解题思路:①根据黄铜样品中铜的质量分数结合黄铜样品的质量可以求算出铜的质量;
②根据①可求出样品中锌的质量,进而结合Zn+H2SO4 ═ZnSO4 +H2↑可以求算出稀硫酸中溶质的质量,从而求算出稀硫酸中溶质的质量分数.①该黄铜样品中铜的质量为:20g×35%=7g.
②由①的解答可以知道黄铜样品中锌的质量为:20g-7g=13g
设稀硫酸中溶质的质量分数为x,则
Zn+H2SO4 ═ZnSO4 +H2↑
65 98
13g x•100g
[65/13g=
98
x•100g]
解得:x=19.6%.
答:该稀硫酸中溶质的质量分数是19.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地解答即可.1年前查看全部
- 某校化学兴趣小组想检测黄铜黄铜(铜,锌合金)样品中铜的质量分数,组员们取10g黄铜样品……
某校化学兴趣小组想检测黄铜黄铜(铜,锌合金)样品中铜的质量分数,组员们取10g黄铜样品……
某校化学兴趣小组想检测黄铜黄铜(铜,锌合金)样品中铜的质量分数,组员们取10g黄铜样品,向其中分3次共加入30g硫酸溶液,充分反应后测得实验数据如下表:
1、硫酸的质量 10 氢气的质量 0.04
2、 10 M
3、 10 0.04
求M
04g,为什么?
抱歉,第三次实验氢气的质量为0.02,不是0.04. pywmx9391年前1
pywmx9391年前1 -
 晴轩07 共回答了14个问题
晴轩07 共回答了14个问题 |采纳率78.6%这是一个数据比较,分3次加入硫酸,第一次加入以后,氢气生成0.04g,第二次未知,第三次加入后依然是0.04;
感觉题目说不清楚,有以下情况:
1.氢气的质量指的是多次反应的总质量;
2.氢气的质量指的是每次反应的总质量;
对于第一种:比较第一、第三次数据,可以知道,第一次加入的硫酸已经过量(后面加入硫酸三次后得到的氢气总量与加入一次得到的总量相同),也就是说第二次加入硫酸,也不会有氢气产生,所以是M=0.04g
对于第二种情况:比较第一、第三次数据,可以知道,第一次加入的硫酸不足量(因为第三次加入硫酸依然得到的是0.04g,若第三次硫酸过量,则得到的是少于0.04g氢气)第三次黄铜里的锌依然是过量或者恰好反应.所以第二次自然也就是黄铜中的锌是过量的.因此得到的数据M=0.04g1年前查看全部
- 为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入
为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
第一次
第二次
第三次
第四次
加入稀盐酸质量(g)
10
10
10
10
剩余固体的质量(g)
9.10
8.45
7.80
7.80
(3)所用稀盐酸中溶质的质量分数为 ;
(4)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为 ;
(5)黄铜样品中铜的质量分数为 .
(3)所用稀盐酸中溶质的质量分数为 ;
(4)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为 ;
(5)黄铜样品中铜的质量分数为 . wymanlam1年前1
wymanlam1年前1 -
 xxf09 共回答了18个问题
xxf09 共回答了18个问题 |采纳率83.3%(3)所用稀盐酸中溶质的质量分数为 ;
9.1g-8.45g=0.65g
Zn + 2HCl === ZnCl2 + H2↑
65 73
0.65g x
65/0.65g=73/x
x=0.73g
0.73g/10g*100%=7.3%
(4)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为 ;
40g*7.3%/36.5%=8g
(5)黄铜样品中铜的质量分数为 7.8g/(9.1g+9.1g-8.45g)*100%=80% .1年前查看全部
- 将19.4g铜、锌合金加入足量的浓硫酸中后加热,当合金消失时得到了一种气体,体积为6.72L
将19.4g铜、锌合金加入足量的浓硫酸中后加热,当合金消失时得到了一种气体,体积为6.72L
(1)计算合金中铜、锌的物质的量之比(2)计算反应中H+减少的物质的量 789ywl1年前2
789ywl1年前2 -
 wjm321 共回答了10个问题
wjm321 共回答了10个问题 |采纳率60%设合金中含铜X mol,锌Ymol
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
1 2 1
x 2x x
Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O
1 2 1
x 2y x
x+y=6.72/22.4=0.3
64x+65y=19.4
x=0.1mol
y=0.2mol
(1)合金中铜、锌的物质的量之比=0.1:0.2=1:2
(2)反应中H+减少的物质的量=2x + 2y= 0.2+0.4=0.6mol1年前查看全部
- 一块合金,其成分为铜和锌,他们的比是2:3,现在加入8克锌,共得锌合金68克,求锌合金中铜与锌的比.
一块合金,其成分为铜和锌,他们的比是2:3,现在加入8克锌,共得锌合金68克,求锌合金中铜与锌的比.
要列出算式! tianluo1年前5
tianluo1年前5 -
 痞子酒馆 共回答了13个问题
痞子酒馆 共回答了13个问题 |采纳率84.6%68-8=60(克)
每份:60/(2+3)=12(克)
锌:12x3=36(克)
铜:12x2=24(克)
新合金中铜与锌的比.
24:(36+8)=24:44=6:111年前查看全部
- 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入稀硫酸至刚好不再产生气体为止。反应过
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如图所示。试计算:样品中铜的质量分数;
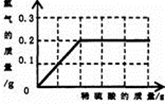
 啪这个城1年前1
啪这个城1年前1 -
 二十一头牛 共回答了22个问题
二十一头牛 共回答了22个问题 |采纳率81.8%1年前查看全部
- “黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,进行实验,取10g样品加入50g稀硫酸中,恰好完全反应,称量剩余
“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,进行实验,取10g样品加入50g稀硫酸中,恰好完全反应,称量剩余物为59.9g.求:
(1)产生氢气的质量______.
(2)计算黄铜样品中铜的质量分数. 而恶复读生1年前1
而恶复读生1年前1 -
 tt少帅 共回答了17个问题
tt少帅 共回答了17个问题 |采纳率82.4%解题思路:根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出铜的质量和铜的质量分数.(1)由质量守恒定律可知:产生的H2的质量为10g+50g-59.9g=0.1g;
(2)设锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.1g
[65/x=
2
0.1g]
解得x=3.25g
[10g−3.25g/10g]×100%=67.5%
故答案为:(1)0.1g;(2)黄铜中铜的质量分数67.5%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.1年前查看全部
- 在铁板表面镀上一层锌成为白铁,白铁是铁锌合金吗?为什么?
 lyh_00331年前4
lyh_00331年前4 -
 龙王424 共回答了11个问题
龙王424 共回答了11个问题 |采纳率90.9%是.合金是由一种或多种金属与其他的金属或非金属得到.1年前查看全部
- 07江西化学中考计算题 30.(7分)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品
07江西化学中考计算题 30.(7分)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品
30.(7分)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示.试计算:(1)样品中铜的质量分数; (2)反应所消耗的硫酸溶液质量; (3)反应后所得溶液中溶质的质量分数.要求 写出解设 找等量关系 答 都要有 正确的格式和答案 30.(7分)解:(1) 67.5% (2)50g (3)15.1 Aries031年前1
Aries031年前1 -
 忧郁歌王 共回答了18个问题
忧郁歌王 共回答了18个问题 |采纳率94.4%和硫酸反应的只是Zn
曲线因该是先升后平的
找出转平那点的硫酸质量m=50g
硫酸质量为50*9.8%=4.9g
Zn+H2SO4--->H2+ZnSO4
65 98 2 161
x 4.9 z y
65/x=98/4.9=161/y=2/z
x=3.25 y=8.05 z=0.1
(1)(10-3.25)/10=67.5%
(2)50g
(3)8.05/(50+3.25-0.1)=15.1%1年前查看全部
- 醋酸(乙酸) 对 锌合金 有腐蚀性吗?
 sammihh1年前1
sammihh1年前1 -
 fire00119 共回答了19个问题
fire00119 共回答了19个问题 |采纳率84.2%肯定的,有机酸对贱金属的腐蚀还蛮强的1年前查看全部
- “黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56
“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56g)甲 乙 丙 烧杯+稀盐酸质量 139g 129g 129g 加入黄铜样品质量 20g 24g 20g 充分反应后,烧杯+剩余物质质量 158.8g 152.8g 148.8g 请回答下列问题:(1)同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是 (2)计算黄铜样品中锌的质量分数.
 xqvq1年前1
xqvq1年前1 -
 xxxxxxshu 共回答了27个问题
xxxxxxshu 共回答了27个问题 |采纳率96.3%1.烧杯+盐酸=129 129+20g样品=149g,反应完了以后,只有148.8g 说明0.2g氢气飞走了
2.合金中只有锌与盐酸反应,根据方程式锌与氢气是对应的,也就是说有0.1mol的锌,0.1*65=6.5g
6.5/20=32.5%1年前查看全部
- 为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,阳阳同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入
为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,阳阳同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
第一次 第二次 第三次 第四次
加入稀盐酸质量(g) 10 10 10 10
剩余固体的质量(g) 9.10 8.45 7.80 7.80 (1)金属----------(填化学式)不与稀盐酸反应,原因是-------------------------(2)求参加反应的HCL的质量 3dnvcimce1年前1
3dnvcimce1年前1 -
 新恐龙化石 共回答了15个问题
新恐龙化石 共回答了15个问题 |采纳率86.7%初中的题吧,很高兴为你
1,Cu 铜在金属活动顺序表中排在氢的后面,不与盐酸反应
2,参加反应的HCl :设第三份盐酸反应的质量为x,则有
10/(9.10-8.45)=x/(8.45-7.80) 得 x=10
所以参加反应的盐酸为前三份:30克 原样品应该是9.10+0.65=9.75克
设参加反应的HCl 为y克
由Zn+2HCl=ZnCl2+H2
65 73
9.75-7.8 y
65/(9.75-7.8)=73/y 解得:y=2.19g
答,参加反应的HCl 的质量为2.19g
另外3,铜的质量分数为7.8/9.75=80%1年前查看全部
- 有一块铜锌合金,铜和锌重量的比是19:2,现在加入8克锌,共得到新合金176克,求锌合金中铜与锌的比.
 twtyvte1年前4
twtyvte1年前4 -
 sarah15 共回答了17个问题
sarah15 共回答了17个问题 |采纳率88.2%19X+2X+8=176
21X=168
X=8
19X=152
2X+8=24
152:24=19:31年前查看全部
- 金属着色都是氧化着色么?比如铝、铝合金、不锈钢、锌合金,都是氧化着色的么?
 enchun1年前2
enchun1年前2 -
 流浪狼G 共回答了19个问题
流浪狼G 共回答了19个问题 |采纳率94.7%一般 铝型材才有这样的说法,颜色变化也多些,其他几种很少有这种说法.但是不是太明白你想问什么.1年前查看全部
- 请问塑钢,铝合金.锌合金有什么区别?质感是否一样 差距大吗
 qingtianwawa1971年前1
qingtianwawa1971年前1 -
 睡着醒着 共回答了15个问题
睡着醒着 共回答了15个问题 |采纳率100%塑钢是建筑型材,塑料型材内填钢衬,铝合金是铝基合金,以铝为主,添加其他金属,提高特性,一般以拉拔、挤压产品为主,也有压铸铝合金.锌合金是锌基合金,以压铸产品为主.1年前查看全部
- 铁、锌合金8.85g溶于稀硫酸中,充分反应后制得氢气0.3g,求合金中铁、锌的质量.
铁、锌合金8.85g溶于稀硫酸中,充分反应后制得氢气0.3g,求合金中铁、锌的质量.
以产生1molH2为基准,产生1molH2需要56g Fe
产生1mol氢气锌65克,
产生1mol氢气需混合物8.85*(2/0.3)=59克(平均量)就这一步怎么回事 minarzm1年前3
minarzm1年前3 -
 叼ss情感天地楼主 共回答了19个问题
叼ss情感天地楼主 共回答了19个问题 |采纳率94.7%首先设混合物是x mol/L,然后由于铁和锌均为二价金属,所以混合物也是二价金属.通过化学方程式得出x*0.3=8.85*2折x=59.2g/mol.所以混合物的物质的平均量就出来了.而混合物由于是由铁锌组成,基设铁为x%,锌为1—x%,就有x%*56+(1-x%)*65=59.2,求出铁锌比为29:16.及锌为3.2g,铁为5.65g.1年前查看全部
- 有一块铜、锌合金,铜和锌的重量比为2:3,如果再加入锌6克,则新合金的重量为36克,求新合金中铜和锌的重量比.
有一块铜、锌合金,铜和锌的重量比为2:3,如果再加入锌6克,则新合金的重量为36克,求新合金中铜和锌的重量比.
谁能给一个如百分数和比例结合的题和答案啊? lygxiaochao1年前2
lygxiaochao1年前2 -
 snajo 共回答了23个问题
snajo 共回答了23个问题 |采纳率91.3%原来的重量:36-6=30克
铜和锌共(份):2+3=5
每份:30/5=6
铜:6*2=12克
(原来)锌:6*3=18克
(现在)锌:18+6=24克
新的比例:
铜:锌=12:24=1:21年前查看全部
- 1.45克黄铜(铜、锌合金)跟足量的盐酸反应,工放出0.02克氢气,黄铜中含锌百分之几?
 icerainer1年前1
icerainer1年前1 -
 as1g 共回答了16个问题
as1g 共回答了16个问题 |采纳率93.8%解,设锌的质量为xg
Zn+2HCl======ZnCl2+H2↑
65 2
x 0.02g
所以锌的质量为0.65g
所以Zn%=0.65g/1.45g=44.8%1年前查看全部
- (2007•江西)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚
 (2007•江西)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
(2007•江西)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
(1)样品中铜的质量分数;
(2)反应所消耗的硫酸溶液质量;
(3)反应后所得溶液的溶质的质量分数. 倾心聆听1年前1
倾心聆听1年前1 -
 haidaoxu 共回答了24个问题
haidaoxu 共回答了24个问题 |采纳率100%解题思路:根据锌与硫酸反应的化学方程式,由图中最多生成的氢气质量0.10g,可以计算出:(1)参加反应的锌的质量,进而计算出样品中铜的质量分数;(2)参加反应的硫酸的质量,进而计算出硫酸溶液的质量;(3)生成硫酸锌的质量,进而计算出所得硫酸锌溶液的溶质质量分数.设样品中铜的质量分数为x;
消耗硫酸溶液的质量为y;
生成硫酸锌的质量为z.
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
10g(1-x) y×9.8% z 0.10g
(1)[65/2]=
10g×(1−x)
0.10g,x=67.5%
(2)[98/2]=[y×9.8%/0.10g],y=50g
(3)[161/2]=[z/0.10g],z=8.05g
所得溶液的溶质质量分数为:
8.05g
10g×(1−67.5%)+50g−0.10g×100%≈15.1%
答:(1)样品中铜的质量分数为67.5%;
(2)消耗硫酸溶液的质量为50g;
(3)所得溶液的溶质质量分数为15.1%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;金属活动性顺序及其应用.
考点点评: 本题主要考查有关化学方程式的计算和质量分数的计算,难度较大.计算所得溶液质量时,要注意:①不能把铜的质量计算在所得溶液中;②不能把生成氢气的质量计算在所得溶液中.1年前查看全部
- 一块合金内铜和锌的比是二比三,现在再加入六克锌,共得锌合金6克求新合金内铜和的比
 anycallany1年前2
anycallany1年前2 -
 caelinimbus 共回答了2个问题
caelinimbus 共回答了2个问题 |采纳率原合金的质量是36-6=30g,原合金中铜的质量是30×2/5=12g,原合金中锌的质量是30×3/5=18g 新合金中锌的质量是18+6=24g 所以新合金中铜和锌的质量比是12:24=1:21年前查看全部
- 全铜三角阀和锌合金三角阀怎么区分?
 老木枯草1年前1
老木枯草1年前1 -
 redeyehe 共回答了15个问题
redeyehe 共回答了15个问题 |采纳率86.7%区分表面镀铬的全铜或铜锌合金三角阀需要掌握一定的方法:
一看,三角阀想常用常新,就先看看镀层好不好.一般来说,表面越光亮细腻,镜面效果越明显,镀层工艺处理得越好;
二听,听销售人员的介绍,主要是对镀层的介绍,好的三角阀不仅经历了前期的打磨、抛光、除尘,而且还有多达六七层的镀镍和镀铬的电镀工序,镀层越多,质量就越好;
三握,可以用握的方法看材质的好坏,有的商家会用铸铁材质冒充全铜或铜锌合金五金,手握五金件两三秒后松开,雾气和痕迹很快消失的基本可以判定是铜质,如果雾气、痕迹久久不散,材质很有可能非铜.全铜的比较好.不容易坏 ,比较贵,成本高.锌合金的比较脆弱.1年前查看全部
大家在问
- 1you ar a ture friend
- 2求函数y=X3-6X2+9X-3的单调区间,极值,曲线的凹凸区间及拐点
- 3小明买5盒糖,小丽买4盒饼干,共用去44元,如果两人对换一盒,两人所买物品的价钱相等.一盒糖和一盒饼...
- 4求mmm是 是
- 5下雨的时候扶老奶奶过马路的作文,30个字
- 6求一个简单的三阶逆矩阵0 1 2 5 4 31 1 4 =A 4 2 0=B 求A-1*B(就是A的逆乘B)2 -1 0
- 7nelly is going to learn to play the guitar(用mayb
- 82/3和4/5相比,近似值是1.6的俩位小数最大是
- 9rationality and reason都表示理性,请问他们在用法上有什么区别呢?
- 10明亮是什么词
- 11描写春节到元宵节的诗句
- 12愚公之妻于智叟提出的看法有什么不同
- 13等腰三角形的腰长为17,底边长为16,求面积
- 14在“研究电流跟电压、电阻的关系”时,同学们设计如图甲电路图,其中R为定值电阻,R′为滑动变阻器,实验后,数据记录在表一和
- 152x-y=8 3x+2x=5.解方程组