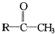Cl2+2NaOH=NaCl+NaClO+H2O 这个化学方程式中的氧化剂是啥?还有Cl的升降应该看NaCl里面的还是看
 JAON092022-10-04 11:39:542条回答
JAON092022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 lvjinglingqq 共回答了16个问题
lvjinglingqq 共回答了16个问题 |采纳率93.8%- 此反应的氧化剂和还原剂是一种物质都是氯气.
反应氯元素的化合价为0,反应氯化钠中氯元素的化合价为-1、次氯酸钠中氯元素的化合价为+1,氯元素的化合价既升高了又降低了,所以氯气既是氧化剂也是还原剂,此反应是歧化反应,在同一元素之间进行的氧化还原反应.
希望我的回答能对你的学习有帮助! - 1年前
 coconut9172 共回答了13个问题
coconut9172 共回答了13个问题 |采纳率69.2%- 选B。分解产生的气体产物倒扣到水中,水充满试管,所以反应为4NO2+O2+2H2O=4HNO3。由此NO2与O2的物质的量为4:1,即氮与氧化合价降与升的总数相等,则铀的化合价不变。故选B。
- 1年前
相关推荐
- 硫酸铜和氢氧化钠反应方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,该反应属于( )
硫酸铜和氢氧化钠反应方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,该反应属于( )
A.化合反应
B.分解反应
C.复分解反应
D.中和反应 许亭风1年前1
许亭风1年前1 -
 狼影如风 共回答了11个问题
狼影如风 共回答了11个问题 |采纳率81.8%解题思路:根据四种基本反应类型的特点进行判断,要特别注意中和反应不是基本反应类型.A、化合反应的特点是“多变一”,而上述反应的反应物和生成物都是两种,所以错误.
B、分解反应的特点是“一变多”,而上述反应的反应物和生成物都是两种,所以错误.
C、复分解反应是指两种化合物相互交换成分,生成另外两种化合物的反应,特点是“两交换,价不变”,所以正确.
D、中和反应不是基本反应类型,从属于复分解反应,所以错误.
故选C.点评:
本题考点: 反应类型的判定;复分解反应及其应用.
考点点评: 要掌握各种基本反应类型的特点,弄清复分解反应和中和反应的从属关系.1年前查看全部
- 下列化学反应中,属于分解反应的是( ) A.Na 2 CO 3 +Ca(OH) 2 ═CaCO 3 ↓+2NaOH B
下列化学反应中,属于分解反应的是( ) A.Na 2 CO 3 +Ca(OH) 2 ═CaCO 3 ↓+2NaOH B.Fe+CuSO 4 ═FeSO 4 +Cu C.CaCO 3
CaO+CO 2 ↑高温 . D.4P+5O 2
2P 2 O 5点燃 .  lizheng3541年前1
lizheng3541年前1 -
 quikewriter 共回答了17个问题
quikewriter 共回答了17个问题 |采纳率88.2%A、该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应,故选项错误.
B、该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项错误.
C、该反应符合“一变多”的特征,属于分解反应,故选项正确.
D、该反应符合“多变一”的特征,属于化合反应,故选项错误.
故选C.1年前查看全部
- CO2 +2NAOH (过量) =NA2CO3 +H2O
CO2 +2NAOH (过量) =NA2CO3 +H2O
CO2 (过量) + NAOH = NAHCO3
有没有什么原理可讲? ababddy81年前1
ababddy81年前1 -
 sam_samq 共回答了19个问题
sam_samq 共回答了19个问题 |采纳率94.7%可以认为是分步进行的1年前查看全部
- 化合物 与NaOH溶液、碘水三者混和后可发生如下反应:①I 2 +2NaOH═NaI+NaIO+H 2 O(2) (3)
化合物 
与NaOH溶液、碘水三者混和后可发生如下反应:
①I 2 +2NaOH═NaI+NaIO+H 2 O
(2)
(3)
此反应称为碘仿反应,根据上述反应方程式,推断下列物质中能发生碘仿反应的有( )A.CH 3 CH 2 COCH 2 CH 3 B.CH 3 COCH 2 CH 3 C.CH 3 CH 2 COOCH 3 D.CH 3 OOCH  rainysky20051年前1
rainysky20051年前1 -
 歆露 共回答了23个问题
歆露 共回答了23个问题 |采纳率100%1年前查看全部
- 氢氧化钠和氯气反应的化学方程式:CL2+2NaOH=Nacl+NaCLO+H2O,原理是什么?为什么会这样?
 英伦病人1年前1
英伦病人1年前1 -
 冬天里的小蚊子 共回答了17个问题
冬天里的小蚊子 共回答了17个问题 |采纳率94.1%原理就是Cl2的歧化
Cl2+H2O=HCl+HClO
再HCl和HClO作为酸分别和NaOH反应
最后就是上面的了1年前查看全部
- SiO2+2NaOH+H2O==Na2SiO3+2H2,反应的氧化剂是水还是氢氧化钠和水.
SiO2+2NaOH+H2O==Na2SiO3+2H2,反应的氧化剂是水还是氢氧化钠和水.
因为在铝和氢氧化钠的反应里氧化剂只有水. huihuangzh1年前0
huihuangzh1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 制取漂白液的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,该反应的氧化剂与还原剂之比为( )
制取漂白液的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,该反应的氧化剂与还原剂之比为( )
A. 1:1
B. 1:2
C. 2:1
D. 3:2 坐209路车的男人1年前5
坐209路车的男人1年前5 -
 xwj0805 共回答了31个问题
xwj0805 共回答了31个问题 |采纳率83.9%解题思路:在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂,还原产物是氯化钠;氯气中氯元素化合价由0价升高为+1价,氯气是还原剂,氧化产物是次氯酸钠.根据产物可知起氧化剂与还原剂的氯气各占一半.据此解答.在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂,氯元素被还原,还原产物是氯化钠;氯气中氯元素化合价由0价升高为+1价,氯气是还原剂,氯元素被氧化,氧化产物是次氯酸钠.根据产物中氯原子化合价变化,可知起氧化剂与还原剂的氯气各占一半,所以反应的氧化剂与还原剂之比为1:1.
故选A.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应概念及计算,难度不大,判断氧化剂、还原剂后,可以根据电子转移守恒计算氧化剂和还原剂的物质的量之比.1年前查看全部
- 已知:FeSO 4 +2NaOH═Fe(OH) 2 ↓(白色)+Na 2 SO 4
已知:FeSO 4 +2NaOH═Fe(OH) 2 ↓(白色)+Na 2 SO 4 白色Fe(OH) 2 露置于空气中,易与空气中的H 2 O和O 2 反应生成红褐色Fe(OH) 3 沉淀.
用下面两种方法可以制得较纯净的白色Fe(OH) 2 沉淀.
方法一:用不含Fe 3+ 的FeSO 4 溶液与用不含O 2 的蒸馏水配制的NaOH溶液反应制备.
(1)除去蒸馏水中溶解的O 2 常采用______的方法.
(2)生成白色Fe(OH) 2 沉淀的操作是用长滴管吸取不含O 2 的NaOH溶液,插入FeSO 4 溶液液面下,再挤出NaOH溶液.这样操作的理由是______.
方法二:在如图装置中,用NaOH溶液、铁屑、稀H 2 SO 4 等试剂制备.
(1)在试管Ⅰ里加入的试剂是______;发生反应的化学方程式为______
(2)在试管Ⅱ里加入的试剂是______;
(3)这样生成的Fe(OH) 2 沉淀能较长时间保持白色,其理由是______.
 云南修斯1年前1
云南修斯1年前1 -
 lwf5068 共回答了20个问题
lwf5068 共回答了20个问题 |采纳率85%方法一:(1)蒸馏水中的氧气可以通过煮沸的方法除去.
(2)用不含氧气的蒸馏水配制好硫酸亚铁溶液,为了隔绝氧气,生成白色Fe(OH) 2 沉淀的操作是用长滴管吸取不含O 2 的NaOH溶液,插入FeSO 4 溶液液面下,再挤出NaOH溶液.这样操作的理由是防止氧气进入溶液中或防止Fe(OH) 2 与O 2
方法二:(1)铁与硫酸反应生成氢气,关闭止水夹,会使装置Ι中压强变大,使Ι中的药品进入Ⅱ中,与Ⅱ中的药品反应得到氢氧化亚铁,铁与硫酸反应的反应物是铁和硫酸写在等号的左边,生成物硫酸亚铁和氢气,写在等号的右边,用观察法配平,所以方程式是Fe+H 2 SO 4 ═FeSO 4 +H 2 ↑;
(2)硫酸亚铁进入试管Ⅱ中与一种试剂反应生成氢氧化亚铁,所以试管Ⅱ中放入的是氢氧化钠溶液;
(3)这样生成的Fe(OH) 2 沉淀能较长时间保持白色,原因是试管Ⅰ中反应生成的氢气,充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入,所以不容易被氧化.
故答案为:方法一:(1)煮沸;(2)防止氧气进入溶液中或防止Fe(OH) 2 与O 2 ;方法二:(1)稀硫酸、铁屑;Fe+H 2 SO 4 ═FeSO 4 +H 2 ↑;(2)氢氧化钠溶液;(3)试管Ⅰ中反应生成的氢气,充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入,所以不容易被氧化.1年前查看全部
- 在Cl2+2NaOH=NaCl+NaClO+H2O的反应中,有关说法错误的是( )
在Cl2+2NaOH=NaCl+NaClO+H2O的反应中,有关说法错误的是( )
A.Cl2既是氧化剂又是还原剂
B.每有1mol Cl2参加反应,就有2mol电子转移
C.该反应可用于实验室制Cl2时尾气的吸收
D.该反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O hezuogupiao1年前1
hezuogupiao1年前1 -
 ttzzx 共回答了21个问题
ttzzx 共回答了21个问题 |采纳率95.2%解题思路:Cl2+2NaOH=NaCl+NaClO+H2O中,Cl元素的化合价由0升高为+1价,由0降低为-1价,以此来解答.Cl2+2NaOH=NaCl+NaClO+H2O中,Cl元素的化合价由0升高为+1价,由0降低为-1价,
A.Cl元素的化合价既升高又降低,则Cl2既是氧化剂又是还原剂,故A正确;
B.每有1molCl2参加反应,就有1mol×(1-0)=1mol电子转移,故B错误;
C.氯气有毒,利用NaOH溶液吸收尾气,故C正确;
D.该反应中只有钠离子实际不参加反应,则离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故D正确;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注意电子守恒及离子反应的书写,题目难度不大.1年前查看全部
- 下列反应属于中和反应的是 A.CO 2 +2NaOH═Na 2 CO 3 +H 2 O B.CaO+H 2 O═Ca(O
下列反应属于中和反应的是
A.CO 2 +2NaOH═Na 2 CO 3 +H 2 O B.CaO+H 2 O═Ca(OH) 2 C.2NaOH+H 2 SO 4 ═Na 2 SO 4 +2H 2 O D.AgNO 3 +HCl═AgCl↓+HNO 3  吉玉鹿1年前1
吉玉鹿1年前1 -
 worstpig 共回答了24个问题
worstpig 共回答了24个问题 |采纳率79.2%C A、氢氧化钠和二氧化碳反应生成碳酸钠和水,二氧化碳属于非金属氧化物,故A错误;B、氧化钙和水都为氧化物,该反应不是中和反应,故B错误;C、氢氧化钠和硫酸反应生成硫酸钠和水,硫酸为酸,而氢氧化...1年前查看全部
- Cl2+2NaOH==NaCl + NaClO + H2O 转移电子数 0价.-1价.+1价
Cl2+2NaOH==NaCl + NaClO + H2O 转移电子数 0价.-1价.+1价
1mol时转移了1mol.为什么不要乘Cl2下方的2啊?
我老不知道要乘什么系数,告诉下,谢谢... cathy001年前4
cathy001年前4 -
 Anke_Britta 共回答了19个问题
Anke_Britta 共回答了19个问题 |采纳率84.2%Cl2+2NaOH==NaCl + NaClO + H2O
Cl的化合价由0价变为NaClO中的+1价,是还原剂.
Cl由0价变为NaCl中的-1价,是氧化剂.
1个Cl2转移了1个电子,所以1mol时转移了1mol.1年前查看全部
- Cl2+2NaOH==NaCl+NaClO+H2O 是歧化反应还是自身氧化还原反应
 sswanglei1年前6
sswanglei1年前6 -
 tianque 共回答了16个问题
tianque 共回答了16个问题 |采纳率93.8%歧化反应属于自身氧化还原反应.所以,此反应既是自身氧化还原反应也是歧化反应.
同一物质中同一价态的同一元素间发生的氧化还原反应(发生歧化的元素会部分升价、部分降价).氧化还原反应的一种类型.又称自身氧化还原反应.在歧化反应中,化合物内的同一种元素的一部分原子
在反应中,若氧化作用和还原作用发生 在同一分子内部处于同一氧化态的元素上,使该元素的原子(或离子)一部分被氧化,另一 部分被还原.这种自身的氧化还原反应称为歧化反应.
自身氧化还原反应,是指氧化剂和还原剂都是同一物质的氧化还原反应,反应时物质里的不同元素或相同元素间发生了电子转移.1年前查看全部
- SO2+2NaOH=NaSO3+H2O 的离子方程式
 digcat121年前2
digcat121年前2 -
 零度tt 共回答了20个问题
零度tt 共回答了20个问题 |采纳率85%SO2+2OH-=(SO3)2-+H201年前查看全部
- 看看这两个化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOHCaCO3+2NaOH=Ca(OH)2↓+Na
看看这两个化学方程式
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
CaCO3+2NaOH=Ca(OH)2↓+Na2CO3
哪个是对的?为什么? 疯子抱抱1年前5
疯子抱抱1年前5 -
 01620 共回答了15个问题
01620 共回答了15个问题 |采纳率86.7%第一个对.第二个中CaCO3难溶于水,从电离平衡的角度来说其电离在水中的Ca2+例子非常微弱,难以和OH~结合.况且Ca(OH)2微溶,不能当作沉淀看.
!
小心那些“第二个对”的答案啊,错的.复分解反应中只有强酸才能和不溶物反应,其余的反应物一定要溶,而且只有生成物中有气体、沉淀或者水才能反应.
不错,的确有“强碱制弱碱”,例如NH4Cl+NaOH===NH3·H20+Nacl和MgCl2+2KOH=Mg(OH)2↓+2KCl ,但是前提是反应物都呈现溶液状,即可溶.1年前查看全部
- 判断正确或错误向纯碱溶液中滴加澄清的石灰水:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH用点燃的方法除去二
判断正确或错误
向纯碱溶液中滴加澄清的石灰水:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
用点燃的方法除去二氧化碳中少量的一氧化碳:2CO+O2=点燃==2CO2
请问哪个对哪个错呢,错误的那个请说明理由哦! coollaura1年前1
coollaura1年前1 -
 pmqpmq 共回答了18个问题
pmqpmq 共回答了18个问题 |采纳率88.9%第二个错
因为要除去少量的CO用燃烧是很困难的
无法燃烧完全
所以第二不行1年前查看全部
- 下列化学方程式正确的是( )A.2Fe+6HCl=2FeCl3+3H2↑B.CuSO4+2NaOH=Cu(OH)2↓+
下列化学方程式正确的是( )
A.2Fe+6HCl=2FeCl3+3H2↑
B.CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
C.CaCO3+HCl=CaCl+CO2↑+H2O
D.Mg+O2
MgO点燃 . 宠爱三千1年前1
宠爱三千1年前1 -
 gwlg 共回答了18个问题
gwlg 共回答了18个问题 |采纳率83.3%解题思路:A、根据铁在置换反应中常显+2价进行分析,
B、根据复分解反应的原理进行分析,
C、根据钙元素在化合物中常显+2价进行分析,
C、根据质量守恒定律进行分析,A、铁与盐酸反应,生成的是FeCl2而不是FeCl3,正确的方程式为:Fe+2HCl=FeCl2+H2↑,故A错误,
B、符合复分解反应的原理,满足质量守恒定律,故B正确,
C、CaCO3和稀HCl反应生成CaCl2,而不是CaCl,正确的方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,故C错误,
D、该方程式没有进行配平,不满足质量守恒定律,正确的方程式为:2Mg+O2
点燃
.
2MgO,故D错误,
故选B.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;金属的化学性质.
考点点评: 在解此类题时,首先检查应用的原理是否正确,然后根据方程式的书写原则再进行检验.1年前查看全部
- 2NaCl+2H2O==通电==Cl2↑+H2↑+2NaOH.若制得16g的氢氧化钠,可同时得到多少g的氯气
 小鱼也会吐泡泡1年前2
小鱼也会吐泡泡1年前2 -
 漂泊的虫子吗 共回答了23个问题
漂泊的虫子吗 共回答了23个问题 |采纳率95.7%8.875g1年前查看全部
- Cl2+2NaOH=NaC1+NaC1O+H2O若所用氢氧化钠的质量分数为10%计算吸收14.2kg氯气至少需要消耗10
Cl2+2NaOH=NaC1+NaC1O+H2O若所用氢氧化钠的质量分数为10%计算吸收14.2kg氯气至少需要消耗10%的氢氧化钠...
Cl2+2NaOH=NaC1+NaC1O+H2O若所用氢氧化钠的质量分数为10%计算吸收14.2kg氯气至少需要消耗10%的氢氧化钠多少千克? vaporshow1年前1
vaporshow1年前1 -
 bobobocat 共回答了17个问题
bobobocat 共回答了17个问题 |采纳率82.4%Cl2+2NaOH==NaCl+NaClO+H2O
71 80
14.2kg m
71/14.2kg = 80/m
m = 16kg
所以至少需要消耗10%的氢氧化钠质量 = 16/10% = 160kg1年前查看全部
- 关于制取CI2-------2NaCI+2H2O=CI2↑+H2↑+2NaOH
关于制取CI2-------2NaCI+2H2O=CI2↑+H2↑+2NaOH
饱和食盐水点解产生氯气的反应中,测得生成的氢气体积为5.60ml,电解后溶液的体积恰好为50.0ml,则溶液中NaOH的物质的量浓度为多少? 你来我往955191年前1
你来我往955191年前1 -
 inlusin 共回答了15个问题
inlusin 共回答了15个问题 |采纳率86.7%生成的氢气体积为5.60ml
生成的氢气物质的量为
0.0056L
n氢气 = -----------------=0.00025mol
22.4mol/L
生成NaOH的物质的量为
n(NaHO) = 2 * n氢气 = 0.0005mol
溶液中NaOH的物质的量浓度为
0.0005mol
c = -------------------- ------ =0.01mol/L
0.05L1年前查看全部
- 对下列事实的解释,反应的化学方程式或离子方程式正确的是 A.盛放烧碱的试剂瓶不能用玻璃塞:SiO 2 +2NaOH=Na
对下列事实的解释,反应的化学方程式或离子方程式正确的是
A.盛放烧碱的试剂瓶不能用玻璃塞:SiO 2 +2NaOH=Na 2 SiO 3 +H 2 O B.工业用FeCl 3 溶液腐蚀铜线路板:Fe 3 + +Cu=Fe 2+ +Cu 2+ C.酸性KI淀粉溶液久置后变蓝:4I - +O 2 +2H 2 O=2I 2 +4OH - D.食醋浸泡有水垢的暖壶或水壶,清除其中的水垢:2H + +CaCO 3 =Ca 2+ +H 2 O+CO 2 ↑  antonio04511年前1
antonio04511年前1 -
 taingppo 共回答了16个问题
taingppo 共回答了16个问题 |采纳率87.5%A
1年前查看全部
- 计算化学反应中得失电子的方法比如:CL2+2NaOH=NaCl+NaClO+H2O,得失电子分别是多少?如何计算?
 大梦后觉1年前1
大梦后觉1年前1 -
 花清语孤伶 共回答了22个问题
花清语孤伶 共回答了22个问题 |采纳率95.5%主要是观察元素 化合价 的变化.如题中Cl从0价变到-1和+1,得失电子都是一个.还有就是注意得失电子是守恒的.这才关键.1年前查看全部
- 氢氧化钠和硫酸铜反应会不会生成碱式硫酸铜?按常理说:CuSO4+2NaOH=Cu(OH)2(蓝色沉
氢氧化钠和硫酸铜反应会不会生成碱式硫酸铜?按常理说:CuSO4+2NaOH=Cu(OH)2(蓝色沉
淀)+Na2SO4
但是当两种试剂同为两摩尔时:2CuSO4+2NaOH=Cu2(OH)2SO4(好像是浅绿色沉淀)+Na2SO4
就是说,如果把相同质量的相同物质的量浓度的两种溶液混在一起,会生成碱式硫酸铜.
理论上好像行,但实际呢? gjzwb1年前1
gjzwb1年前1 -
 压把磨乐工 共回答了13个问题
压把磨乐工 共回答了13个问题 |采纳率84.6%反应结果:1、完全沉淀(PH=6~7)反应式:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4此时,硫酸铜与氢氧化钠物质的量之比近似1:2.所得反应产物为蓝色絮奖沉淀,久置后上层溶液无色,即生成氢氧化铜沉淀与水.2、硫酸铜过量(PH值7)反应式:4NaOH+CuSO4=Na2[Ca(OH)4]↓+Na2SO4我们在装了1/3试管的氢氧化钠后再滴入3~4滴硫酸铜溶液.久置后,上呈无色,而沉淀层为一种蓝白杂泪的糊状沉淀,此为铜酸钠.生成原因及生成物性质1、氢氧化铜[Cu(OH)2]这是实验最简单的结果,生成原因是一个铜离子正好与两个氢氧化铜.其为一种蓝色固体.难溶于水,加热易分解,微显两性.2、碱式硫酸铜.[Cu4(OH)6SO4]在实验中,氢氧化钠处于不足,故氢氧离子相对铜离子也就不足,使氢氧根离子无法完全结合所有铜离子,故它代替一部分硫酸根离子,生成碱式硫酸铜.这是一种兰绿色固体,受热可分解(生成硫酸铜和氢氧化铜),但受热时间比氢氧化钠分解的时间还要长,生成蓝色与黑色并存浊液[Cu4(OH)6SO4=CuSO4+3Cu(OH)2,Cu(OH)2=CuO+H2O]并且,碱式硫酸铜可溶于无机酸(实验用盐酸和稀硫酸),有机酸(实验用苯酚和乙酸),碱(实验用氢氧化钠和氢氧化钙)等.它还会与氨水反应,生成钢蓝色溶液,有氨味[Cu4(OH)6SO4+8NH3=3Cu(NH3)2(OH)2+Cu(NH3)2SO4]3、铜酸钠[Na2Cu(OH)4]它的形成原因相当复杂,删繁就简地就是氢氧与铜离子结合成氢氧化铜后,由于溶液中氢所氧根偏多,而氢氧化铜又微显两性(氢氧化铜可写为Cu(OH)2及H2CuO2)故又结合两个氢氧根离子,再与钠离子结合生成铜酸钠.这是一种相当不稳定的蓝白色物质,难溶于水,它只有在碱性条件下才能存在,溶液稀释后,它即分解成氢氧化铜和氢氧化钠[Na2Cu(OH)4=2NaOH+CU(OH)2↓],在久置之后,它会风化分解[Na2Cu(OH)4=2NaOH+CU(OH)2↓].它会与酸反应,例如与稀盐酸反应生成氧气与钠盐,与浓盐酸反应生成氯气和氧气.1年前查看全部
- CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
它的原型是什么,怎样配平? 只爱小雨1年前1
只爱小雨1年前1 -
 三子吴 共回答了19个问题
三子吴 共回答了19个问题 |采纳率94.7%Cu2+ +2OH- = Cu(OH)2↓
配平什么的,先确定生成物,再根据质量守恒定律和化合价进行配平.1年前查看全部
- 当温度为70℃时,Cl2与NaOH溶液能同时发生两个自身氧化还原反应:Cl2+2NaOH==NaCl+NaClO+H2O
当温度为70℃时,Cl2与NaOH溶液能同时发生两个自身氧化还原反应:Cl2+2NaOH==NaCl+NaClO+H2O,
3Cl2+6NaOH==5NaCl+NaClO3+3H2O.若反应完全后测得溶液中NaClO与NaClO3的物质的量之比为4:1,则溶液中NaCl和NaClO的物质的量浓度之比为
A.11:2 B.9:4 C.1:1 D.5:1 我爱谁乐1年前2
我爱谁乐1年前2 -
 pxz2299 共回答了18个问题
pxz2299 共回答了18个问题 |采纳率100%NaClO与NaClO3的物质的量之比为4:1
4Cl2+8NaOH==4NaCl+4NaClO+4H2O
3Cl2+6NaOH==5NaCl+NaClO3+3H2O
溶液中NaCl和NaClO的物质的量浓度之比
9NaCl 4NaClO 答案:9:4 选择B1年前查看全部
- 化学反应的基本类型属于化合反应的是( ) A.CuCl 2 +2NaOH→Cu(OH) 2 ↓+2NaCl B.Fe
化学反应的基本类型属于化合反应的是( ) A.CuCl 2 +2NaOH→Cu(OH) 2 ↓+2NaCl B.Fe 2 O 3 +3CO
3CO 2 +2Fe高温 C.2H 2 O
2H 2 ↑+O 2 ↑通电 D.2Cu+O 2
2CuO△  反方向的时钟1年前1
反方向的时钟1年前1 -
 hao34260509 共回答了17个问题
hao34260509 共回答了17个问题 |采纳率100%化合反应的特点是“多变一”即生成物有一种反应物多种,所以ABC均错,只有D符合该特征.
故选D.1年前查看全部
- (1)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,该反应的基本类型是______反应.
(1)CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,该反应的基本类型是______反应.
(2)亚硝酸钠是一种工业用盐,外观与食盐相似,误食会引起中毒,其水溶液pH大于7.鉴别亚硝酸钠和食盐两种无色溶液可选用的试剂是______.
(3)为了检验曝露在空气中的氢氧化钠溶液是否变质,可以选择酸、碱、盐三种不同物质类别的试剂进行检验.请各举一例写出它们的化学式:酸______、碱______、盐______. fhnp1年前1
fhnp1年前1 -
 liuxq1 共回答了18个问题
liuxq1 共回答了18个问题 |采纳率83.3%解题思路:由两种化合物互相交换成分生成另外两种化合物的反应叫复分解反应;亚硝酸钠水溶液的pH大于7,食盐溶液的PH值等于7,因此可以用酚酞试液、石蕊试液、硫酸铜溶液等物质鉴别;氢氧化钠溶液变质会生成碳酸钠,碳酸钠用酸检验,有气泡冒出;用碱溶液或盐溶液检验有白色沉淀生成.(1)由两种化合物互相交换成分生成另外两种化合物的反应叫复分解反应;故答案为:复分解
(2)亚硝酸钠水溶液的pH大于7,食盐溶液的pH值等于7,因此可以用酚酞试液、石蕊试液、硫酸铜溶液等物质鉴别;故答案为:酚酞试液、石蕊试液、硫酸铜等
(3)氢氧化钠溶液变质会生成碳酸钠,碳酸钠用酸检验,有气泡冒出;碳酸钠用碱溶液或盐溶液检验有白色沉淀生成.故答案为:HCl或H2SO4等;Ca(OH)2或Ba(OH)2等;CaCl2或BaCl2等点评:
本题考点: 反应类型的判定;酸、碱、盐的鉴别.
考点点评: 本考点考查的是反应类型的判断和酸碱盐的鉴别,酸碱盐是初中阶段的一个重点,也是一个难点,因此掌握好酸碱盐的性质,鉴别方法也就会迎刃而解.本考点主要出现在填空题和实验题中.1年前查看全部
- 如,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH这是复分解反应,但如果在Na2CO3中间加个H,即Ca(OH)
如,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH这是复分解反应,但如果在Na2CO3中间加个H,即Ca(OH)2+NaHCO3,那生成物是什么?这类型化学方程式怎么写?
 autumnfeng1年前1
autumnfeng1年前1 -
 hnzqzl 共回答了27个问题
hnzqzl 共回答了27个问题 |采纳率100%Ca(OH)2+NaHCO3不反应,如果反应的话会生成NaOH,碱性强于Ca(OH)2,所以不反应1年前查看全部
- 氢氧化钠和氯气反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;Cl2与石灰水反应与前“类似”,写出C
氢氧化钠和氯气反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;Cl2与石灰水反应与前“类似”,写出Cl2通入澄清石灰水中所发生的反应的化学方程式:______.
 亚梅1年前1
亚梅1年前1 -
 wlpw 共回答了18个问题
wlpw 共回答了18个问题 |采纳率83.3%解题思路:运用类比的方法,已知“氢氧化钠和氯气反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O”,Cl2与石灰水反应与之“类似”,则可写出Cl2通入澄清石灰水中氯气通入氢氧化钙溶液,和氢氧化钙发生的反应.运用类比的方法,已知“氢氧化钠和氯气反应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O”,Cl2与石灰水反应与之“类似”,则可写出Cl2通入澄清石灰水中氯气通入氢氧化钙溶液,和氢氧化钙发生的反应,即可以和碱发生反应分别生成CaCl2、Ca(ClO)2、H2O.
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要利用信息及学过的课本知识进行整合分析的能力,解题的关键是了解溶液中酸碱中和的反应.1年前查看全部
- (2013•朝阳模拟)已知反应CuCl2+2NaOH=Cu(OH)2↓+2NaCl.向一定量盐酸和氯化铜溶液的混合物中逐
 (2013•朝阳模拟)已知反应CuCl2+2NaOH=Cu(OH)2↓+2NaCl.向一定量盐酸和氯化铜溶液的混合物中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示.下列说法正确的是( )
(2013•朝阳模拟)已知反应CuCl2+2NaOH=Cu(OH)2↓+2NaCl.向一定量盐酸和氯化铜溶液的混合物中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示.下列说法正确的是( )
A.P点表示的溶液pH=7
B.M点表示的溶液中只含有一种溶质
C.从M点到N点溶液质量增加20g
D.P点表示的溶液比N点表示的溶液中氯化钠的质量分数小 电了1231年前1
电了1231年前1 -
 Nathalie_cj 共回答了13个问题
Nathalie_cj 共回答了13个问题 |采纳率92.3%解题思路:A、P点表示氢氧化钠过量;
B、M点表示氢氧化钠与盐酸恰好反应完,再去考虑溶质是谁;
C、根据方程式CuCl2+2NaOH=Cu(OH)2↓+2NaCl分析,此反应是溶液质量减少;
D、根据两点中的溶质含量分析;A、P点表示氯化铜和氢氧化钠完全反应后,氢氧化钠有剩余,溶液pH>7,故A错误;
B、M点表示氢氧化钠与盐酸恰好反应完,但氯化铜还没有反应,此时溶质是氯化铜、氯化钠,故B错误;
C、从M点到N点是增加了20g,但由方程式CuCl2+2NaOH=Cu(OH)2↓+2NaCl知,溶液应增加少于20g,故C错误;
D、N点表示的氯化铜和氢氧化钠恰好完全反应,P点表示氯化铜和氢氧化钠恰好完全反应后,又增加了一定量的氢氧化钠,两部分中氯化钠的量是一定的,所以P点表示的溶液比N点表示的溶液中氯化钠的质量分数小,故D正确;
故选D.点评:
本题考点: 碱的化学性质.
考点点评: 本题重点考查复分解反应的实质,学会分析图象,判断产物,属于一道溶液综合性的题目.1年前查看全部
- 2NaCl+2H2O=通电=H2 ↑+Cl2 ↑+2NaOH 阳极2Cl- -2e- = Cl2↑ 阴极2H2O +2e
2NaCl+2H2O=通电=H2 ↑+Cl2 ↑+2NaOH 阳极2Cl- -2e- = Cl2↑ 阴极2H2O +2e- = H2↑ +2OH- 溶液变为浅绿色
兄弟 这个可靠吗 不是铜比氯离子易得电子吗 昏昏打工族1年前1
昏昏打工族1年前1 -
 lovestudy 共回答了13个问题
lovestudy 共回答了13个问题 |采纳率76.9%不知道你为什么说铜比氯离子易得电子,反正是错的.
两者都只能失电子,怎么说得呢?
假如你说的是失,阳极若是铜,不管电解液是什么,都是铜失电子,氯离子没分.这是活泼电极啊!若是石墨作电极,就是氯离子失电子.1年前查看全部
- (2010•衡阳)兴衡中学校办工厂生产氢氧化钠的反应原理为:Ca(0H)2+Na2CO3═CaCO3↓+2NaOH,其产
(2010•衡阳)兴衡中学校办工厂生产氢氧化钠的反应原理为:Ca(0H)2+Na2CO3═CaCO3↓+2NaOH,其产品中含有少量的碳酸钠.在产品出厂前都要检验氢氧化钠的纯度,看是否达到生产要求.在某次检验中,技术员取样l00g,加入足量水溶解后,滴加氯化钡(BaCl2)溶液21.6g时,恰好反应完全,经过滤、洗涤、干燥后得到碳酸钡(BaCO3)固体3.94g.
试求:
(1)该产品中氢氧化钠的纯度(假设产品中的杂质只有碳酸钠)(最后结果准确到0.01%).
(2)反应前氯化钡溶液中溶质的质量分数. 围路1年前1
围路1年前1 -
 铁子1009 共回答了10个问题
铁子1009 共回答了10个问题 |采纳率100%解题思路:利用化学方程式根据生成的碳酸钡3.94g求出碳酸钠和氯化钡的质量,然后求出氢氧化钠的质量100-2.12=97.88g,氢氧化钠的质量比上样品的质量即是氢氧化钠的纯度;用氯化钡的质量比上氯化钡溶液的质量即是应前氯化钡溶液中溶质的质量分数.设l00 g样品中的Na2CO3的质量为x;反应的BaCl2的质量为y.
BaCl2+Na2CO3═BaCO3↓+2NaCl
208106197
yx3.94 g
[208/197=
y
3.94g]
[106/197=
x
3.94g]
x=2.12g
y=4.16 g
(1)NaOH的纯度为:
100−2.12
100×100%=97.88%
(2)BaCl2溶液中溶质的质量分数
4.16
21.6×100%=l9.26%
答:该批产品的纯度为97.88%;原氯化钡溶液中溶质的质量分数为19.26%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题考查了利用化学方程式具体的计算步骤,属于基础知识,难度不大,关键注意解题格式.1年前查看全部
- NaOH与SO2反应的方程式是SO2+2NaOH+H2O==Na2SO3+2H2O?
NaOH与SO2反应的方程式是SO2+2NaOH+H2O==Na2SO3+2H2O?
SO2+2NaOH+H2O2==Na2SO4+2H2O可以吗? x7fdwnhu1年前3
x7fdwnhu1年前3 -
 zaq50 共回答了11个问题
zaq50 共回答了11个问题 |采纳率72.7%SO2+2NaOH+H2O==Na2SO3+2H2O
实际上是SO2与H2O先生成亚硫酸 亚硫酸 在于NaOH发生酸碱中和生成Na2SO3+2H2O 明白?
SO2+2NaOH+H2O2==Na2SO4+2H2O 可以 发生了 氧化还原 反应1年前查看全部
- 反应类型判断,HClO+HCl+2NaOH=NaClO+NaCl+2H2O属于什么类型?它是如何反应的,碰到类似的方程式
反应类型判断,
HClO+HCl+2NaOH=NaClO+NaCl+2H2O
属于什么类型?它是如何反应的,碰到类似的方程式怎么写?
基本反应类型 xaiohu1年前3
xaiohu1年前3 -
 皇甫十一 共回答了18个问题
皇甫十一 共回答了18个问题 |采纳率83.3%HClO+HCl+2NaOH=NaClO+NaCl+2H2O
此反应属于酸碱中和反应.
盐酸与氢氧化钠反应生成氯化钠和水
HCl+NaOH=NaCl+H2O
次氯酸与氢氧化钠反应生成次氯酸钠和水
HClO+NaOH=NaClO+H2O
碰到类似的方程式,先思考各反应物质相互关系,具体反应情况,再作出判断下笔书写方程式.1年前查看全部
- 氢氧化钙能制氢氧化钠吗有人说Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 能进行可强碱能制取弱碱 但是氢氧化钙
氢氧化钙能制氢氧化钠吗
有人说Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 能进行
可强碱能制取弱碱 但是氢氧化钙是中强碱怎么能制出强碱氢氧化钠啊 uc847781年前5
uc847781年前5 -
 luanyw 共回答了17个问题
luanyw 共回答了17个问题 |采纳率94.1%符合复分解反应的条件:生成比反应物更难溶的物质.另外两个条件是:生成比反应物更容易挥发的物质或更难电离的物质.总之是朝溶液中离子浓度减小的方向进行.
强碱能制取弱碱的说法不一定成立.
事实上,没多少人能弄明白碱性的强弱-.-.
氢氧化物碱性依pKb由最强到最弱的排列(抄自中文Wiki`pedia):
氢氧化钾 (KOH)
氢氧化钡 (Ba(OH)2)
氢氧化铯 (CsOH)
氢氧化钠 (NaOH)
氢氧化锶 (Sr(OH)2)
氢氧化钙 (Ca(OH)2)
氢氧化锂 (LiOH)
氢氧化铷 (RbOH)
在非水溶剂中可以体现得比较明显.
1L提到的两点:
氢氧化钙是强碱,不是中强碱
还有,水有拉平效应,导致氢氧化钙电离出的氢氧根比氢氧化钠多
是正确的.
也就是说,Ca(OH)2和NaOH在水中都几乎完全电离,差别很小.
考虑到Ca(OH)2能电离出2倍物质的量,这里Ca(OH)2在溶液中体现了比NaOH更强的碱性.这个情况是符合“强碱制弱碱”的.1年前查看全部
- Cl2+2NaOH==Nacl+Nacl+H2o的氧化剂还原剂的元素名称是Cl2吗
 mxh75571年前3
mxh75571年前3 -
 核里的桃 共回答了18个问题
核里的桃 共回答了18个问题 |采纳率94.4%氧化剂和还原剂都是物质.
应该说是物质名称是Cl2.这条反应Cl2既是氧化剂又是还原剂
如果问你是被氧化或被还原的元素才是氯元素1年前查看全部
- CuSO4+2NaOH=Cu(OH)2+Na2SO4 的离子方程式
 peng21331年前5
peng21331年前5 -
 068766 共回答了19个问题
068766 共回答了19个问题 |采纳率89.5%Cu+2OH=CU(OH)2,铜后面是2+,氢氧根后面是-,最后加个沉淀符号1年前查看全部
- Na2CO3+Ca(OH)2=CaCO3↓+2NaOH反应条件
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH反应条件
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH这个反应在常温下能否进行,需要什么条件才能进行啊? 重电传媒艺术系1年前8
重电传媒艺术系1年前8 -
 asdflk 共回答了21个问题
asdflk 共回答了21个问题 |采纳率85.7%这个反应是不要条件的,也就是说两溶液一混合就可以反应!我做了此实验.原因是符合复分解反应的条件.1年前查看全部
- CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 是放热的还是吸热的?热效应是否明显?
 12码之伤1年前2
12码之伤1年前2 -
 eytery 共回答了26个问题
eytery 共回答了26个问题 |采纳率84.6%放热反应,热效应不明显,但蓝色沉淀明显.1年前查看全部
- CL2+2NaOH=NaCL+NaCLO+H2O,2NO2+4CO=N2+4CO2,它们各转移多少电子啊,
CL2+2NaOH=NaCL+NaCLO+H2O,2NO2+4CO=N2+4CO2,它们各转移多少电子啊,
还有这个Na2O2+2H2O=4NaOH+O2,假设是 1molCL2 、1mol NO2 、1molNaAO2,谁帮我解释下, 小胖人诺诺1年前0
小胖人诺诺1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,使0.1mol硫酸铜完全沉淀,需要多少氢氧化钠?
 伤情天使1年前1
伤情天使1年前1 -
 254610498 共回答了15个问题
254610498 共回答了15个问题 |采纳率80%0.2mol,8gNaOH1年前查看全部
- CuSo4+2NaoH=Cu(oH)2+NaSo4 已知氢氧化铜质量为9.8g,求氢氧化钠的质量
 度牒1年前1
度牒1年前1 -
 我是谁545 共回答了20个问题
我是谁545 共回答了20个问题 |采纳率95%2NaOH~Cu(OH)2
80 98
8g 9.8g
答:氢氧化钠质量是8g1年前查看全部
- N2O5与氢氧化钠溶液反应 N2O5 +2NaOH═2NaNO3+H2O,
N2O5与氢氧化钠溶液反应 N2O5 +2NaOH═2NaNO3+H2O,
为什么 离子方程式是 :N2O5 +2OH-═2NO3-+H2O,Na去哪里了? fcry5261年前1
fcry5261年前1 -
 不是我__是风 共回答了20个问题
不是我__是风 共回答了20个问题 |采纳率95%不用写啊,除非钠会和其他反应物生成沉淀,气体或弱电解质,否则就要省略1年前查看全部
- Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
氢氧化钙与碳酸钠的反应算是复分解反应么?
我觉得应该是,但老师说不算是,因为它是化合完再复分解? pearl19791年前1
pearl19791年前1 -
 qbzdh123 共回答了20个问题
qbzdh123 共回答了20个问题 |采纳率80%氢氧化钙与碳酸钠的反应是复分解反应,毫无疑问.老师不会这样说的,如果这样说了,那就是说错了.1年前查看全部
- 碳酸钠、碳酸氢钠是否显两性碳酸钠能与碱反应:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
 0201shuai1年前3
0201shuai1年前3 -
 rita_2317 共回答了13个问题
rita_2317 共回答了13个问题 |采纳率76.9%碳酸钠只能与酸作用,显碱性
碳酸氢钠既能与酸作用,又能与碱作用,显两性1年前查看全部
- SO2+2NaOH==NaSO3+H2O,我不知道NaSO3要不要“↓”符号,另外这个化学反应一般是干嘛的?
SO2+2NaOH==NaSO3+H2O,我不知道NaSO3要不要“↓”符号,另外这个化学反应一般是干嘛的?
rt
NaSO3到底是固体还是什么体?为什么不要沉淀符号? wj72815151年前6
wj72815151年前6 -
 sisaohuo 共回答了14个问题
sisaohuo 共回答了14个问题 |采纳率71.4%首先,是生成Na2SO3而不是NaSO3,该这样
SO2+2NaOH==Na2SO3+H2O
Na2SO3是固体,但是易溶于水.所以不用加沉淀符号`1年前查看全部
- 下列化学方程式中,不正确的是 A.Zn+2HCl===ZnCl 2 +H 2 ↑ B.Al 2 O 3 +2NaOH==
下列化学方程式中,不正确的是
A.Zn+2HCl===ZnCl 2 +H 2 ↑ B.Al 2 O 3 +2NaOH===2NaAlO 2 +H 2 O C.2Fe+3CuSO 4 ===Fe 2 (SO 4 ) 3 +3Cu D.2Al+Fe 2 O 3  2Fe+Al 2 O 3
2Fe+Al 2 O 3  好奇我也凑热闹1年前1
好奇我也凑热闹1年前1 -
 青草无情 共回答了17个问题
青草无情 共回答了17个问题 |采纳率76.5%C
Fe+CuSO 4 ===FeSO 4 +Cu,一般有铁参加的置换反应,生成的铁为亚铁。1年前查看全部
- Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 的反应类型是什么
 明天又是新的一天1年前6
明天又是新的一天1年前6 -
 b4_i 共回答了17个问题
b4_i 共回答了17个问题 |采纳率100%复分解反应,Na2CO3和Ca(OH)2相互交换成分,生成CaCO3和NaOH.1年前查看全部
大家在问
- 1天上的云是什么样的,为什么会有云,"云"是气体还是液体?
- 2第二段写( )迎春花和风筝的作用是(
- 3欲与天公试比高欲的含义欲与天公试比高中的欲在全文的表达效果.
- 4欲与天公试比高的是什么意思?主要是”试比高”的意思...
- 5如图,已知梯形ABCD,AD平行于BC,角B+角C=90度,AB比DC=4比3,AD=5,BC=15,则梯形的面积为?
- 6已知x^2-2xy-3y^2=0,求2x+y分之x-y的值
- 7求你帮我写一篇学会留心的作文
- 8求5篇初一的英语短文,并仿写如题,5篇都要仿写,短文越短越好(至少3句话)...初一水平的短文就行了,.不用翻译...8
- 9我们常用雪来描写白,那么雪花是白色的吗?
- 10如何将一篇汉语文章及其翻译整合到一起?就是那种一行汉语一行英语的文章样式?
- 11语文找错别字
- 12小猴子飞快地爬着树.找错别字.
- 13marry likes eating bananas改为一般疑问句
- 14如图,在△ABC中,∠C=90°,DM⊥AB.ME∥BC,DM=AC.证明△ABC≌△MED.
- 15求作文 《妈妈,我想对你说》