在1L0.1mol/L氨水溶液中应加入多少克NH4Cl固体才能使溶液的pH=9(忽略固体的加入对溶液体积的影响)
 visel2022-10-04 11:39:542条回答
visel2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 wangyuyu 共回答了17个问题
wangyuyu 共回答了17个问题 |采纳率88.2%- 答案是9.58克,步骤发你邮箱了
- 1年前
 ydz7447 共回答了1个问题
ydz7447 共回答了1个问题 |采纳率- 设加入a molNH4Cl固体。
NH3·H2O =可逆= NH4+ + OH-
0.1---------------a------0
0.1-x -----------a+x --- x
由题意,x = 10^-5
代入得:Kb = x*(a+x)/(0.1-x) = 1.79*10^-5
解得a = 0.179mol
质量 = 9.58g - 1年前
相关推荐
- 水溶液中凝固点的判断0.01MOL/KG 的 NA2SO40.01MOL/KG 的 HAC0.1MOL/KG 的 C3H
水溶液中凝固点的判断
0.01MOL/KG 的 NA2SO4
0.01MOL/KG 的 HAC
0.1MOL/KG 的 C3H5(OH)3
0.1MOL/KG 的 HCL
哪个水溶液的凝固点最低? 吉芳芳11年前3
吉芳芳11年前3 -
 猪儿的猪儿2 共回答了21个问题
猪儿的猪儿2 共回答了21个问题 |采纳率90.5%我认为选C C3H5(OH)3会和水形成氢键 断开需要吸收更多的热
如果要理论解释 就是稀溶液具有依数性 应该是根据物理化学的拉乌尔定律 具体降低多少是可以算出来的1年前查看全部
- 将0.1mol 下列物质置于100ml水中,溶液中的阴离子数最多的是
将0.1mol 下列物质置于100ml水中,溶液中的阴离子数最多的是
NA2CO3
HCL
NH4)2SO4
MG(OH)2 给我一个岛1年前1
给我一个岛1年前1 -
 maggie_wang28 共回答了14个问题
maggie_wang28 共回答了14个问题 |采纳率100%碳酸根水解讲过吧
CO32-+H2O=HCO-+OH-
也就是说只要有一个碳酸根水解就会有两个阴离子HCO-、OH生成
HCl、NH42SO4l完全电离,不多0.1mol
MG(OH)2不溶1年前查看全部
- 0.1mol/;的盐酸,是由盐酸电离出来的氢离子浓度是0.1还是水和盐酸共同电离出来的是0.1mol/l
 123嘟嘟1年前1
123嘟嘟1年前1 -
 haofan7758 共回答了19个问题
haofan7758 共回答了19个问题 |采纳率89.5%盐酸电离出的氢离子浓度0.1.溶液中强酸电离会抑制水的电离,常温下水的离子积常数k=10^-14,所以水电离的OH离子为10^-13,因为水电离出的H离子与OH离子相同,推出水电离的H离子为10^-13.1年前查看全部
- 0.1mol/LHCN溶液和0.1mol/L的NaCN溶液等体积混合后溶液显碱性,下列关系是怎么来的,
0.1mol/LHCN溶液和0.1mol/L的NaCN溶液等体积混合后溶液显碱性,下列关系是怎么来的,
氢离子的浓度+氰化氢分子的浓度- 氢氧根离子的浓度=0.05mol/L 康蚂1年前2
康蚂1年前2 -
 优优28 共回答了23个问题
优优28 共回答了23个问题 |采纳率87%一、钠离子被稀释了一半所以只有0.05mol/L;二、电荷守恒式:氢离子的浓度+钠离子的浓度=氢氧根离子的浓度+氰根离子的浓度;
三、物料守恒式:氰化氢分子的浓度+氰根离子的浓度=2 倍 钠离子的浓度
二、三两项相加可得:氢离子的浓度+氰化氢分子的浓度=氢氧根离子的浓度+钠离子的浓度;移项可得氢离子的浓度+氰化氢分子的浓度- 氢氧根离子的浓度=钠离子的浓度=0.05mol/L1年前查看全部
- 0.1mol氢气、0.2mol氧气、0.3mol氮气和0.4mol二氧化碳组成的混合气体在标准状况下的体积约为22.4L
0.1mol氢气、0.2mol氧气、0.3mol氮气和0.4mol二氧化碳组成的混合气体在标准状况下的体积约为22.4L.正确吗
请求回答... 爱笑的小狗狗1年前1
爱笑的小狗狗1年前1 -
 lilysatan 共回答了14个问题
lilysatan 共回答了14个问题 |采纳率78.6%对,1mol气体就是22.4L1年前查看全部
- 在0.1mol氢气中,含有H多少mol?
 风季风1年前2
风季风1年前2 -
 jianglh_007 共回答了16个问题
jianglh_007 共回答了16个问题 |采纳率93.8%0.1mol H2...含有H多少mol?
因为是氢气(H2),所以每个氢气分子中含有两个H原子,所以用0.1乘以2,也就是0.2mol.1年前查看全部
- 0.1mol/l氨水溶液中存在下列电离平衡:NH3.H2O=NH4++OH-
0.1mol/l氨水溶液中存在下列电离平衡:NH3.H2O=NH4++OH-
0.1mol/lNH3.H2O溶液中存在下列电离平衡:NH3.H2O=NH4++OH-
为什么加入少量硫酸镁固体,电离度会增加,PH会减小 chenliqiong1年前1
chenliqiong1年前1 -
 暴打美眉 共回答了13个问题
暴打美眉 共回答了13个问题 |采纳率92.3%因为加入硫酸镁之后镁离子与氢氧根离子反应生成了氢氧化镁沉淀,氢氧根离子的消耗使得平衡向右移动,所以电离度增加.氢氧根的消耗使得溶液的ph减小.1年前查看全部
- 今有0.1mol/L NaCl溶液300mL,0.1mol/L MgCl 2 溶液200mL,0.1mol/L AlCl
今有0.1mol/L NaCl溶液300mL,0.1mol/L MgCl 2 溶液200mL,0.1mol/L AlCl 3 溶液100mL,这三种溶液中Cl - 物质的量浓度之比是( ) A.3:4:3 B.3:2:3 C.1:1:1 D.1:2:3  天际归舟991年前1
天际归舟991年前1 -
 betty0925 共回答了21个问题
betty0925 共回答了21个问题 |采纳率85.7%Cl - 物质的量浓度与溶液的体积无关,
0.1mol/L NaCl溶液300mL中,Cl - 物质的量浓度为0.1mol/L,
0.1mol/L MgCl 2 溶液中,Cl - 物质的量浓度为0.2mol/L,
0.1mol/L AlCl 3 溶液中,Cl - 物质的量浓度为0.3mol/L,
所以三种溶液中Cl - 物质的量浓度之比是0.1mol/L:0.2nol/L:0.3mol/L=1:2:3.
故选D.1年前查看全部
- 某100g稀硫酸中含有H2SO4 0.1mol.计算:
某100g稀硫酸中含有H2SO4 0.1mol.计算:
(1)该稀硫酸的溶质质量分数
(2)中和这些稀硫酸需要多少摩尔氢氧化钾?这些氢氧化钾的质量是多少克 米米橙1年前1
米米橙1年前1 -
 gh11111 共回答了21个问题
gh11111 共回答了21个问题 |采纳率81%硫酸的摩尔质量为98g/mol,硫酸质量为98*0.1=9.8g,溶质的质量分数为9.8/100=9.8%
中和这些稀硫酸需要0.2mol氢氧化钾,氢氧化钾的摩尔质量为56g/mol,质量为0.2*56=11.2g.1年前查看全部
- 化学题 关于金属和酸的反应1g钠,镁,铝分别于0.1mol的硫酸溶液反应,下列说法正确的是:A.镁铝产生的氢气一样多B.
化学题 关于金属和酸的反应
1g钠,镁,铝分别于0.1mol的硫酸溶液反应,下列说法正确的是:
A.镁铝产生的氢气一样多
B.镁产生的氢气最多
C.铝产生的氢气最多
D.一样多
说原因啊 谢谢 一人笑1年前4
一人笑1年前4 -
 tszmpl 共回答了20个问题
tszmpl 共回答了20个问题 |采纳率100%2Na+H2SO4 == Na2SO4+H2
2mol的钠能和1mol的硫酸完全反应放出氢气,也就是说,需要0.2mol的钠才能和0.1mol的硫酸完全反应
Mg+H2SO4 == MgSO4+H2
0.1mol的镁能和0.1mol的硫酸完全反应
2Al+3H2SO4 == Al2(SO4)3 + 3H2
(0.1*2/3)mol的Al能和0.1mol的硫酸完全反应
所以,直接比较1/(23*2),1/24,1/27*(3/2)的物质的量可知选C1年前查看全部
- 0.1mol的CH4所含的氢原子数是多少?
 dinh_ding1年前1
dinh_ding1年前1 -
 lxwmm 共回答了24个问题
lxwmm 共回答了24个问题 |采纳率100%0.4mol1年前查看全部
- 将6.5g锌放入足量的盐酸中充分反应 ,生成标准状况下的氢气的体积是多少?题干盐酸中Hcl的物质的量为0.1mol
 匡吉舟1年前3
匡吉舟1年前3 -
 zzy1232 共回答了22个问题
zzy1232 共回答了22个问题 |采纳率81.8%6.5g ÷(65g/mol)=0.1mol
Zn + 2HCl = H2↑+ZnCl2
1 2 22.4
x 0.1mol y
1/x=2/0.1moL=22.4/y
x=0.05mol ——锌过量 ,应以0.1mol HCl 来进行计算
y=1.12L
生成标准状况下的氢气的体积x=1.12L1年前查看全部
- 1 某脂肪酸CmHnCOOH 0.1mol与碘完全反应,需碘0.2mol,0.1mol该脂肪酸完全燃烧时产生二氧化碳和水
1 某脂肪酸CmHnCOOH 0.1mol与碘完全反应,需碘0.2mol,0.1mol该脂肪酸完全燃烧时产生二氧化碳和水的物质的量之和为3.4mol.则m,n的值为——
A17,33
B17,31
C15,29
D15,27
1 分子式为C4H8O2,不能与碳酸钠反应放出二氧化碳,但能溶于热的氢氧化钠的有机物有————种
2 将分子式为C8H16O2的酯水解得到A,B两种物质,A氧化可转变为B,则符合上述性质的酯的结构有几种 潜水的宝宝1年前2
潜水的宝宝1年前2 -
 erersyp 共回答了19个问题
erersyp 共回答了19个问题 |采纳率94.7%分子式为C4H8O2----不饱和度为1,
不能与碳酸钠反应放出二氧化碳,----没有羧基
但能溶于热的氢氧化钠的有机物有----可能是酯
将4个C分
1---3,酸是甲酸,但醇有正丙醇、异丙醇两种,所以酯有2种
2---2,酸是乙酸,醇是乙醇,就是乙酸乙酯
3---1,酸只有丙酸,醇只有甲醇
所以共4种
将分子式为C8H16O2的酯水解得到A,B两种物质,A氧化可转变为B,----说明酸和醇中C原子数相同,都是4个,而且醇可以氧化成酸
从酸的角度推,除了COOH外,是C3H7-即丙基,丙基有2种,正丙基、异丙基,所以对映的酸是2种,分别对映的醇,也就是原来的酯是2种1年前查看全部
- 用惰性电极电解1mol/LCuSO4和0.1mol/LCu(NO3)2的混合溶液100ml,当阳极析出896ml气体时,
用惰性电极电解1mol/LCuSO4和0.1mol/LCu(NO3)2的混合溶液100ml,当阳极析出896ml气体时,切断电源,使电极仍浸在溶液中.
1)写出开始电解时反应式(两条)
2)电解后电极在溶液经充分反应后,阴极比原来增重多少g?溶液的H+浓度时多少(溶液体积保持不变) 5493381681年前1
5493381681年前1 -
 虚掩的门yoyo 共回答了27个问题
虚掩的门yoyo 共回答了27个问题 |采纳率88.9%cu+ + 2e- =cu
2H2o -- 4e- = O2 + 4H+
2Cu+ 2 H2O2 = 2Cu +O2 + 4H+ 0.896L/22.4L/mol=0.04mol(O2) 可推出阳极一共失去0.04*4=0.16摩尔电子,一摩尔铜有2摩尔电子,所以依照对因关系有0.08摩尔铜生成,即为0.08*64=5.12g铜,即阴极增重5.12g
在阳极增加0.16摩尔H+原子,除以液体体积0.1L得1.6摩尔每升,即H+离子的浓度为1.6摩尔每升
总体是这样了,你在组织下语言,这道题就能得分了1年前查看全部
- 常温下将0.1mol/ HCN 和0.1mol/l NaCN溶液等体积混合,测得混合溶液中c(HCN)>c(CN-) 则
常温下将0.1mol/ HCN 和0.1mol/l NaCN溶液等体积混合,测得混合溶液中c(HCN)>c(CN-) 则(1)c(HCN)+c(CN-)__1mol/L (2)c(HCN)+c(H+)___c(Na+) (3)[c(HCN)-c(CN-)]/2 ___c(OH-)
= > 12653471年前2
12653471年前2 -
 kangkang198383 共回答了21个问题
kangkang198383 共回答了21个问题 |采纳率81%第一个相等是因为离子守恒
因为c(HCN)>c(CN-) 而c(HCN)+c(CN-)=0.1mol/L
所以c(HCN)>0.1/2
而Na的浓度正好是0.1/2
所以
c(HCN)>c(Na+)
c(HCN)+c(H+)_>_c(Na+)
CN-+H20=HCN+OH-
所以HCN比CN多的正好是它水解产生的OH-的1/2
但是还有水电离的OH-所以
[c(HCN)-c(CN-)]/2 _1年前查看全部
- 将5.85gNaCl固体溶解在1L水中,能否配成0.1mol.L的Nacl?
 cr04691年前2
cr04691年前2 -
 海上_闻人 共回答了25个问题
海上_闻人 共回答了25个问题 |采纳率92%不行
首先就算能全部溶解,但形成溶液的体积不会是1L,会比1L多.c==n/V,V是溶液体积.所以不行
其次这里没说什么温度,如果温度太低根本溶不进去,那更没戏了.1年前查看全部
- 向0.1mol每升的氨水中加入少量硫酸铵固体,则溶液中氢氧根离子的浓度比氨水的浓度 为什么减小呢?
向0.1mol每升的氨水中加入少量硫酸铵固体,则溶液中氢氧根离子的浓度比氨水的浓度 为什么减小呢?
硫酸铵完全电离 ,生成的铵根离子会一直一水合氨的电离 ,可是铵根离子水解也会促进一水合氨的电离啊? 小凸子1年前3
小凸子1年前3 -
 淦越 共回答了20个问题
淦越 共回答了20个问题 |采纳率95%氨水水解生成铵离子和氢氧根离子,题中提到了少量这个词,以高中的做题思维,即不考虑水解了,但是你要纠结这点,这么说氨水是弱碱,它的的电离度强于铵根离子的水解1年前查看全部
- 常温下,将0.1mol.L-1的氢氧化钠与0.06mol/L硫酸溶液等体积混合,该混合溶液的PH等于?
 zl80541年前3
zl80541年前3 -
 vimoka 共回答了18个问题
vimoka 共回答了18个问题 |采纳率94.4%设:两溶液各1L混合
剩余H+的物质的量:0.06×2mol-0.1mol=0.02mol
H+浓度为:0.02mol÷2V=0.01mol/L
代入公式:pH=-lgc(H+)=-lg0.01=2
pH=21年前查看全部
- 0.1mol∕L硫化钠溶液中各离子浓度大小关系
 麟山玄妙堂1年前2
麟山玄妙堂1年前2 -
 那夜花谢 共回答了16个问题
那夜花谢 共回答了16个问题 |采纳率81.3%S2-会水解
S2- + H2O HS- + OH-
HS- + H2O H2S + OH-
S2-两步水解,使得溶液显碱性,故c(OH-)>c(H+)
但由于水解是微弱的,且第一步水解程度大于第二步水解,故c(S2-)>c(HS-),且由方程式看出,两步都产生了OH-,故c(OH-)>c(HS-),Na+始终未放生变化.
故c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)1年前查看全部
- 实验室配置500ml0.1mol每升的碳酸钠溶液,需用托盘天平称取Na2Co3·10H2O多少克
 dzsb19801年前1
dzsb19801年前1 -
 冷咖啡1 共回答了19个问题
冷咖啡1 共回答了19个问题 |采纳率89.5%配置500ml 0.1mol/L的溶液,需要物质的量为0.05mol,含结晶水的Na2CO3·10H2O的分子量为286,则需要称取286×0.05=14.3克1年前查看全部
- 0.1mol某种烯烃或两种烯烃的混合物(碳原子数均不超过5)充分燃烧后, 生成的二氧化碳完全被300ml/L的NaOH溶
0.1mol某种烯烃或两种烯烃的混合物(碳原子数均不超过5)充分燃烧后, 生成的二氧化碳完全被300ml/L的NaOH溶液吸收,所得溶液中含有两种物质的量相等的溶质
若为纯净物,是推断可能的行烃分子式 今天你要嫁给他1年前1
今天你要嫁给他1年前1 -
 绝对美丽 共回答了17个问题
绝对美丽 共回答了17个问题 |采纳率82.4%NaOH溶液的浓度为 2mol/L1年前查看全部
- 向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/
向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/L
向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/L的FeCl3溶液,又生成红棕色沉淀证明在相同温度下,氢氧化镁的溶解度大于氢氧化铁的溶解度为什么不对 不是往更难溶转化么 拉拉夏1年前1
拉拉夏1年前1 -
 浪漫屋 共回答了18个问题
浪漫屋 共回答了18个问题 |采纳率77.8%氢氧化钠过量,内含两种沉淀但你只能看到红色,白色被覆盖.1年前查看全部
- 0.1mol红磷在一定量的氯气中燃烧,反应后总质量怎家了15克,所生成的物质是?
0.1mol红磷在一定量的氯气中燃烧,反应后总质量怎家了15克,所生成的物质是?
A.PCl3与PCl5 B.PCl5 C.PCl3 D.无法计算 天我太傻了1年前1
天我太傻了1年前1 -
 seahllgirl 共回答了21个问题
seahllgirl 共回答了21个问题 |采纳率71.4%0.1mol P如果全部生成PCl3,则增加的质量 = 35.5*3*0.1 = 10.65g < 15g
0.1mol P如果全部生成PCl5,则增加的质量 = 35.5*5*0.1 = 17.75g > 15g
所以生成的物质是PCl3与PCl5的混合物.
选A1年前查看全部
- 沉淀溶解平衡的问题2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1mol
沉淀溶解平衡的问题
2滴0.1mol/L的硫化钠,5滴0.1mol/L的铬酸钾,混合后稀释至5mL,再加入2滴0.1mol/L硝酸铅溶液,观察首先生成黄色沉淀还是黑色沉淀?离心沉降后向清液中加2滴0.1mol/L硝酸铅溶液,会出现什么沉淀?
我的问题是,实验的时候我看到先生成的是黄色沉淀,后来清液中生成的也是黄色的.但是硫化铅的沉淀溶解系数小于铬酸铅的,为什么先生成铬酸铅?是我看错了?后来清液中的铬酸铅是怎么生成的. bud021年前1
bud021年前1 -
 784562560 共回答了19个问题
784562560 共回答了19个问题 |采纳率94.7%(Ag2CrO4),但实际上KCl溶液中产生沉淀时c(Ag+) 要远小于Ag2CrO4中银离子的浓度,因此KCl溶液中先有沉淀.这类题目不能光看Ksp,还要注意盐的形式 AB1年前查看全部
- (8分)有A、B、C、D、E五种烃,具有下列性质:①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO 2 均为
(8分)有A、B、C、D、E五种烃,具有下列性质:①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO 2 均为4.48L(标准状况),A和D燃烧所得的CO 2 都是前三者的3倍;②在适宜条件下,A、B、C都能跟H 2 发生加成反应,其中A可以转化为D,B可以转化为C,C可以转化为E;③B和C都能使溴水或酸性KMnO 4 溶液褪色,而A、D、E无此性质;④用铁屑作催化剂时,A可与溴发生取代反应。
(1)写出B与D的结构简式B_______________ D_________________
(2)写出下列反应方程式
A与溴铁粉作催化剂反应:_________________________________
C转化成E:________________________ 逍遥快活游1年前0
逍遥快活游1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 常温下,向25mL 0.1mol/LMOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(假
 常温下,向25mL 0.1mol/LMOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(假设混合后溶液体积的微小变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/LMOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(假设混合后溶液体积的微小变化忽略不计).回答下列问题:
(1)由图中信息可知MOH为______碱(填“强”或“弱”),理由是______.
(2)25℃时,一定浓度的MA稀溶液的pH=a,则a______7(填“>”、“<”或“=”),用离子方程式表示其原因为______.该温下HA的电离常数为______ (写出计算结果).
(3)D点时,溶液中c(A-)+c(HA)______2c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH=b,则 c(HA)+c(H+)=______mol/L(填准确的表达式). wangwang_5201年前1
wangwang_5201年前1 -
 惹不起的阿斗 共回答了19个问题
惹不起的阿斗 共回答了19个问题 |采纳率89.5%解题思路:(1)由图象可知0.1mol/L MOH溶液的pH=13,c(OH-)=0.1mol/L,说明为强碱,完全电离;
(2)由图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,该温下HA的电离常数为Ka=[Kw/K];
(3)根据溶液中电荷守恒、物料守恒判断溶液中离子浓度大小关系.(1)由图象可知0.1mol/L MOH溶液的pH=13,c(OH-)=0.1mol/L,说明为MOH强碱,完全电离,
故答案为:强;0.1mol/L MOH溶液的pH=13,c(OH-)=0.1mol/L,说明为MOH强碱;
(2)由图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,水解呈碱性,发生A-+H2O⇌HA+OH-,当加入13mL 时水解平衡常数K=
c(HA)•c(OH−)
c(A−)•c(H+)=
(0.0026−0.0025)
(25+13)×0.001×10−6
0.0025
(25+13)×0.001×10−7=[2/5],所以Ka=[Kw/K]=
10−13
2
5=2.5×10-13,故答案为:>;A-+H2O⇌HA+OH-;2.5×10-13;
(3)D点时,加入n(HA)=0.005mol,而加入n(MOH)=0.0025mol,A元素以A-和HA两种形式存在,而M全以M+形式存在,溶液中c(A-)+c(HA)=2c(M+),
c(M+)=0.05mol/L,c(OH-)=1×10-11mol/L,由电荷守恒c(M+)+c(H+)=c(A-)+c(OH-)和物料守恒c(A-)+c(HA)=2c(M+),则:c(HA)+c(H+)=c(M+)+c(OH-)=0.05mol/L+10-11mol/L,
故答案为:=;0.05+10-11.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合溶液定性判断,题目浓度中等,试题侧重于学生的分析能力的考查,为高考常见题型,明确图象中各个点的含义是解本题关键,结合电荷守恒、物料守恒来分析解答.1年前查看全部
- 1、完全燃烧的0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该
1、完全燃烧的0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式___________.
2、某烃2.2g,在O2中完全燃烧,生成6.6gCO2和3.6gH2O,在标准状态下其密度为1.9643g·L﹣¹,其化学式为__________. 李奇步1年前2
李奇步1年前2 -
 narcissuc 共回答了14个问题
narcissuc 共回答了14个问题 |采纳率85.7%1,C4H10.浓硫酸增重即为水的质量,可知水的物质的量是0.5mol,所以H原子物质的量是1mol.浓碱增重即为CO2的质量,可知二氧化碳物质的量为0.4mol,由于是0.1mol某烃,可得1mol烃有10molH原子,4molC原子,即烃为C4H10.
2,C3H8.和第一个基本一样,由水和二氧化碳的比例关系,可得C:H=0.15:0.4=3:8,即为C3H8.根据条件可验证1年前查看全部
- 某500mL溶液中含0.1mol Fe2+、0.2mol Fe3+,加入0.2mol 铁粉
某500mL溶液中含0.1mol Fe2+、0.2mol Fe3+,加入0.2mol 铁粉,待Fe3+完全还原后溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
A. 0.4 mol/L
B. 0.6mol/L
C. 0.8 mol/L
D. 1.0 mol/L 雪儿199905051年前2
雪儿199905051年前2 -
 ozz_le 共回答了15个问题
ozz_le 共回答了15个问题 |采纳率93.3%解题思路:铁粉放入三氯化铁溶液中发生反应:Fe+2Fe3+═3Fe2+,溶液中含0.1mol Fe2+、0.2mol Fe3+,加入0.2mol 铁粉,根据方程式计算生成的Fe2+的物质的量,进而得到溶液中Fe2+的总物质的量,再求出浓度.已知Fe3+的物质的量为0.2mol,铁粉为0.2mol 则铁粉过量,
Fe+2Fe3+═3Fe2+
0.2mol 0.3mol
所以反应生成的Fe2+为0.3mol,因此溶液中Fe2+的总物质的量为0.1+0.3=0.4mol,
所以c(Fe2+)=[n/V]=[0.4mol/0.5L]=0.8 mol/L;
故选:C.点评:
本题考点: 铁盐和亚铁盐的相互转变;离子方程式的有关计算.
考点点评: 本题考查根据方程式进行的计算,难度不大,注意对基础知识的理解掌握.1年前查看全部
- 在常温下,下列五种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L N
在常温下,下列五种溶液:①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3·H2O c(NH4+)最小的是
不是说 CH3COONH4会双水解吗?所以铵根离子应该是最少的,那为啥答案都选5 傻仔东1年前1
傻仔东1年前1 -
 4叶未明 共回答了11个问题
4叶未明 共回答了11个问题 |采纳率100%醋酸铵的双水解不能彻底,比较弱,在同浓度的情况下,醋酸铵溶液里的铵根离子多,因为醋酸铵是强电解质,完全电离,氨水是弱电解质不完全电离.1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.完全燃烧0.1mol某烃后,测得生成CO2的体积为8.96L(标准状况),生
燃烧法是测定有机化合物化学式的一种重要方法.完全燃烧0.1mol某烃后,测得生成CO2的体积为8.96L(标准状况),生成H2O的质量为9.0克.
(1)求该烃的分子式
(2)写出该烃可能有的结构简式. 淘气天08涯1年前1
淘气天08涯1年前1 -
 紫沁嫣然 共回答了13个问题
紫沁嫣然 共回答了13个问题 |采纳率100%解题思路:(1)根据有机物燃烧时,有机物中的碳全部转化为二氧化碳,由二氧化碳的质量,可求得烃中C原子个数,有机物中的氢全部转化为水,由水的其质量可以可求得烃中H原子个数,以此可求得烃的分子式;
(2)根据碳链异构来书写同分异构体;(1)二氧化碳为体积为8.96L(标准状况),n(CO2)=[8.96L/22.4L/mol]=0.4mol,n(C)=n(CO2)=0.4mol;水的质量为9.0g,n(H2O)=[9.0g/18g/mol]=0.5mol,n(H)=2n(H2O)=2×0.5mol=1mol,即0.1mol烃中含有0.4molC原子,1molH原子,所以该烃分子中C原子个数为4,H原子个数为10,所以该烃的分子式为C4H10,
答:该烃的分子式为C4H10;
(2)由碳链异构可知,C4H10的可能的结构简式为:CH3CH2CH2CH3或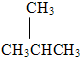 ;
;
答:该烃可能有的结构简式.CH3CH2CH2CH3或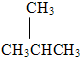 ;
;点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查学生燃烧法确定有机物分子组成和同分异构体的确定,根据原子守恒法来解答,难度不大.1年前查看全部
- 0.1mol/L盐酸滴定0.1mol/lNaOH溶液,如加到滴定终点时不慎多加了一滴盐酸(1滴溶液约为0.05ml)继续
0.1mol/L盐酸滴定0.1mol/lNaOH溶液,如加到滴定终点时不慎多加了一滴盐酸(1滴溶液约为0.05ml)继续加水至50ml,所得溶液PH?
要过程、、直接说答案的别回答、、可加悬赏分 dfefw091年前2
dfefw091年前2 -
 totowings 共回答了23个问题
totowings 共回答了23个问题 |采纳率91.3%滴定终点时溶液中是NaCl和水,ph为7
多加了一滴盐酸那么 n(H+)=(0.05×10^-3)×0.1 = 0.05×10^-4 mol
所以 c(H+)=(0.05×10^-4)÷(50×10^-3) = 1×10^-4 mol/L
所以最终 ph = 41年前查看全部
- 已知0.1mol/L一元弱酸HB的PH=3.0,则共轭碱NaB溶液的PH为
已知0.1mol/L一元弱酸HB的PH=3.0,则共轭碱NaB溶液的PH为
A.11.0 B.9.0 C.8.5 D.9.5 hyansong1年前1
hyansong1年前1 -
 与豆冰 共回答了15个问题
与豆冰 共回答了15个问题 |采纳率86.7%选B.
根据公式[H+]=√(cKa),解得Ka=10∧-5
所以,共轭碱Kb=10∧-9,
所以共轭碱[OH-]=√(cKb)=10∧-5mol/L
所以[H+]=10∧-9mol/L
所以pH=9.
希望对你有所帮助!1年前查看全部
- 对于反应A+3B═2C+D来说,下列反应速率中最快的是( ) A.v(A)=0.1mol/(L•min) B.v(B)
对于反应A+3B═2C+D来说,下列反应速率中最快的是( ) A.v(A)=0.1mol/(L•min) B.v(B)=0.6mol/(L•min) C.v(C)=0.5mol/(L•min) D.v(D)=0.3mol/(L•min)  驹逸1年前1
驹逸1年前1 -
 枫丹星跃 共回答了28个问题
枫丹星跃 共回答了28个问题 |采纳率85.7%根据各物质的反应速率之比等于其计量数之比,都换算成A的速率,再比较;
A、v(A)=0.1 mol/(L•min);
B、v(B)=0.6 mol/(L•min),所以v(A)=
1
3 v(B)=0.2mol/(L•min);
C、v(C)=0.5mol/(L•min),所以v(A)=
1
2 v(C)=0.25mol/(L•min);
D、v(D)=0.3 mol/(L•min),所以v(A)=v(D)=0.3 mol/(L•min);
所以反应速率最快的是D;
故选D.1年前查看全部
- 在某稀溶液中含有0.1mol HNO3和x mol H2SO4,向其中加入9.6g
在某稀溶液中含有0.1mol HNO3和x mol H2SO4,向其中加入9.6g 铜粉,充分反应后产生的气体在标准状况下的体积为2.24L,则x值至少为( )
A. 0.1
B. 0.12
C. 0.15
D. 0.2 featheir1年前1
featheir1年前1 -
 madcatsad 共回答了22个问题
madcatsad 共回答了22个问题 |采纳率86.4%解题思路:离子方程式为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,9.6g铜粉的物质的量为[9.6g/64g/moL]=0.15mol,反应后生成NO气体,物质的量为[2.24L/22.4L/mol]=0.1mol,根据反应的离子方程式计算需要硫酸的物质的量.9.6g铜粉的物质的量为[9.6g/64g/moL]=0.15mol,反应后生成NO气体,物质的量为[2.24L/22.4L/mol]=0.1mol,
根据反应判断
3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O
3 2 8 2
0.15mol 0.1mol (2x+0.1)mol 0.1mol
要使充分反应后产生的气体在标准状况下的体积为2.24L,则有[2x+0.1/0.1=
8
2],x=0.15,为使铜全部溶解,生成气体体积为2.24L,硫酸的物质的量最少为0.15mol,
故选C.点评:
本题考点: 有关范围讨论题的计算.
考点点评: 本题考查硫酸的物质的量的计算,题目难度不大,本题注意利用离子方程式计算,并判断反应的物质的量的关系.1年前查看全部
- A和B两种有机物,各取0.1mol 充分燃烧,都生成4.48L CO2(标准状况)和3.6g H2O.已知A对氢气的相对
A和B两种有机物,各取0.1mol 充分燃烧,都生成4.48L CO2(标准状况)和3.6g H2O.已知A对氢气的相对密度为14,B中碳元素的质量分数为40%,且B的水溶液具有导电性.试求A和B的分子式,并写出它们的结构简式.
 Google测试员55511年前1
Google测试员55511年前1 -
 龙回ff 共回答了20个问题
龙回ff 共回答了20个问题 |采纳率100%解题思路:根据二氧化碳的体积和水的质量分别计算物质的量,可知A、B分子中C、H原子个数,A对氢气的相对密度为14,则A的相对分子质量为28,B的水溶液具有导电性,则B中含有-COOH官能团,结合B中碳元素的质量分数,计算B的相对分子质量,进而推断分子式和可能的结构简式.4.48L CO2的物质的量为[4.48L/22.4L/mol]=0.2mol,3.6g H2O的物质的量为[3.6g/18g/mol]=0.2mol,
则A和B两种有机物中含有C原子个数为:[0.2mol/0.1mol]=2,
含有H原子个数为:
0.2mol
0.1mol×2=4,
A对氢气的相对密度为14,则A的相对分子质量为2×14=28,
而2×12+4=28,
所以A的分子式为C2H4,应为乙烯,结构简式为CH2=CH2,
B的水溶液具有导电性,则B中含有O元素,设B的分子式为C2H4Ox,
由B中碳元素的质量分数为40%可知
2×12
2×12+16x=0.4,解之得:x=2,
故B的分子式为C2H4O2,应为乙酸,结构简式为CH3COOH,
答:A和B的分子式分别为C2H4、C2H4O2,结构简式分别为CH2=CH2、CH3COOH.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式的计算,题目难度不大,注意相对密度与相对分子质量的关系,注重题中信息的把握.1年前查看全部
- 为什么将0.1mol氯化铁溶于1L水中,所以溶液中含有的三价铁离子少于0.1nA
为什么将0.1mol氯化铁溶于1L水中,所以溶液中含有的三价铁离子少于0.1nA
谢谢 cjlgsw1年前5
cjlgsw1年前5 -
 我想瘦脸sss 共回答了19个问题
我想瘦脸sss 共回答了19个问题 |采纳率84.2%因为铁离子要水Fe3+ +3H2O↔Fe(OH)3+3H+,所以铁离子会略小于0.1mol,所以就少于0.1NA1年前查看全部
- 分别取0.1mol钠,铁,铝和足量的盐酸反应,在相同条件下产生的氢气的体积比是?
 笑笑爱乐1年前4
笑笑爱乐1年前4 -
 此名已注销 共回答了10个问题
此名已注销 共回答了10个问题 |采纳率80%1:2:31年前查看全部
- 将镁铝的混合物0.1mol溶于100mL2mol·L-1硫酸溶液中,然后再滴加1mol·L-1氢氧化钠溶液,请回答以下问
将镁铝的混合物0.1mol溶于100mL2mol·L-1硫酸溶液中,然后再滴加1mol·L-1氢氧化钠溶液,请回答以下问题:
若在滴加NaOH溶液过程中,沉淀质量m随加入氢氧化钠的体积v变化关系如图.当V1=160ml时,金属粉末中n(Mg)= V2=
图如下: 紫眸微颤1年前2
紫眸微颤1年前2 -
 尼莫小丑鱼 共回答了12个问题
尼莫小丑鱼 共回答了12个问题 |采纳率100%看不到图呢.1年前查看全部
- 将0.3mol NaCl固体与0.1mol CuSO4•5H2O固体混合溶于水,配成1升混合液.然后
将0.3mol NaCl固体与0.1mol CuSO4•5H2O固体混合溶于水,配成1升混合液.然后取出200ml溶液,用石墨电极,通电一段时间(不考虑水解).
求Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是多少?
所得溶液的pH为多少(假设溶液体积不变)? zjjkiller1年前1
zjjkiller1年前1 -
 爱似夏花 共回答了29个问题
爱似夏花 共回答了29个问题 |采纳率86.2%解题思路:(1)根据溶液中阴阳离子的放电顺序,判断每一阶段放电的离子,然后写出电解反应的离子方程式;
(2)先确定最后阶段放电的离子,再写出阴极上发生的电极反应式;
(3)先根据题意判断当阴极有气体产生时发生的电解反应,然后计算铜全部析出时剩余的氯离子的物质的量,根据氯离子的物质的量计算阴极上生成气体的体积.根据题意知,取出的溶液中含有的溶质的物质的量分别为:NaCl 0.06mol,CuSO4 0.02mol;溶液中阴阳离子的放电顺序分别为:阳离子放电顺序Cu2+>H+>Na+,阴离子放电顺序为Cl->OH->SO42-,所以,该溶液电解三个阶段分别为:
第一阶段:Cu2+和Cl-放电,生成氯气和铜.阴极电极反应Cu2++2e-=Cu,阳极电极反应2Cl--2e-=Cl2↑;
根据得失电子相等知,铜离子先完全电解,氯离子还剩0.02mol,所以发生第二阶段电解反应;
第二阶段:H+ 和Cl-放电,生成氢气和氯气;
根据得失电子相等知,氯离子完全电解,发生第三阶段反应,
第三阶段:H+ 和OH-放电,生成氢气和氧气.
根据以上分析知,第一阶段的电解反应为Cu2++2Cl-
通电
.
Cu+Cl2
电解的最后阶段,H+ 在阴极上放电,OH-的阳极上放电,分别生成氢气和氧气.
第一阶段根据得失电子相等知,铜离子先完全电解,氯离子还剩0.02mol,所以发生第二阶段电解反应;
当阴极上有气体生成时,发生的电解反应为:
2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-
2 22.4L 2
0.02mol 0.224L 0.02mol
阴极上生成氢气0.224L;生成氢氧根离子浓度=[0.02mol/0.2L]=0.1mol/L
溶液pH=13.
答:Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是 0.224L;所得溶液的pH为13.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理的分析判断,解题时注意以下几点:混合溶液中离子的放电顺序.发生电解反应的三个阶段.只有明确知道这些问题才能正确解答本题,题目难度较大.1年前查看全部
- 下列物质各多少克?含粒子数多少?①100mol 水 ②0.1mol 氢氧根离子 ③2mol 钠离子
 青木原树海1年前2
青木原树海1年前2 -
 wangshisuifen 共回答了23个问题
wangshisuifen 共回答了23个问题 |采纳率91.3%①100mol 水 1800克 6.02×1025个水分子
②0.1mol 氢氧根离子 1.7克 6.02×1022个氢氧根离子
③2mol 钠离子 46克 1.204×1024个钠离子1年前查看全部
- 0.1mol单甘油酯完全氢化消耗0.6mol,说明每个不饱和脂肪酸上有2个双键.
0.1mol单甘油酯完全氢化消耗0.6mol,说明每个不饱和脂肪酸上有2个双键.
这是为什么呢?一个双键需要2个H,2个双键需要4个H啊 媳妇至尊宝1年前2
媳妇至尊宝1年前2 -
 ytjrtjhe 共回答了24个问题
ytjrtjhe 共回答了24个问题 |采纳率95.8%单甘油酯的通式为:
R-COOCH2
R-COOCH
R-COOCH2(其中右边的CH2、CH、CH2中三个碳原子是连接起来的)
假设每个RCOOH中含有一个双键,因为一分子中有三个RCOOH,所以要加成3分子氢气.
而这里0.1mol要加成0.6mol氢气,则说明每个单甘油酯上有6个碳碳双键.则每个不饱和脂肪酸上有2个双键.1年前查看全部
- ①0.1mol/LH2S溶液 ②0.1mol/LH2S和0.1mol/LNaHS混合液,二者硫离子浓度大小关系怎么分析?
 泰山樵夫1年前1
泰山樵夫1年前1 -
 快乐小猪与墩墩 共回答了13个问题
快乐小猪与墩墩 共回答了13个问题 |采纳率100%②>①
①中的S2-离子来源于H2S的二次电离、HS-的一次电离
②中的S2-离子来源于也是H2S的二次电离、HS-的一次电离
但是HS-的浓度比①中的浓度要大许多,电离出的S2-也大很多
所以,②中S2-更多1年前查看全部
- 200ml0.1mol/lba(oh)2溶液和0.2mol/300ml盐酸混合,放出的热量是多少.
 007_yyc1年前1
007_yyc1年前1 -
 filter999 共回答了24个问题
filter999 共回答了24个问题 |采纳率91.7%0.1*0.2*2*57 kJ1年前查看全部
- 将0.1mol铜与40ml10mol/LHNO3充分反应后,溶液中含有amolH+,由此可知生成的气体标准状况下的体积是
将0.1mol铜与40ml10mol/LHNO3充分反应后,溶液中含有amolH+,由此可知生成的气体标准状况下的体积是多少?
 lclclc009101年前2
lclclc009101年前2 -
 渔阳鼓动 共回答了20个问题
渔阳鼓动 共回答了20个问题 |采纳率80%这题可以运用守恒思想:硝酸在反应中起两个作用:一是显酸性,一是显氧化性.则可以得到:反应的硝酸=显酸性的 + 显氧化性的
显酸性的硝酸,也就是生成盐的硝酸.根据对应关系可以计算:
Cu------2NO3- -----2HNO3
1------------------------2
0.1mol-----------------x=0.2mol
因此,被还原的硝酸=0.04*10-a-0.2=(0.2-a) mol
又知,10mol/LHNO3浓硝为浓硝酸,还原产物为NO2.
则NO2的物质的量=被还原的硝酸=(0.2-a) mol
所以体积=22.4*(0.2-a)1年前查看全部
- 两种气态烃组成的混合气体0.1mol,完全燃烧得0.16 mol CO2和3.6g水混合物,则原混合
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16 mol CO2和3.6g水混合物,则原混合气体中( )
A. 一定有甲烷
B. 一定是甲烷和乙烯
C. 一定有乙烷
D. 一定有丙炔 wx3021年前1
wx3021年前1 -
 西西625 共回答了9个问题
西西625 共回答了9个问题 |采纳率88.9%解题思路:n(H2O)=[3.6g/18g/mol]=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4,根据平均分子式进行判断.n(H2O)=[3.6g/18g/mol]=0.2mol,即0.1mol混合烃完全燃烧生成0.16molCO2和0.2molH2O,根据元素守恒,则混合烃的平均分子式为C1.6H4.烃中C原子数小于1.6的只有甲烷,则一定含有甲烷,CH4分子中含4个氢原子,故另一种分子中一定含4个氢原子,且其碳原子数大于1.6,故可能是C2H4或C3H4,一定没有C2H6或C2H2,二者的H原子不等于4,
A、由上述分析可知,混和气体中一定有甲烷,故A正确;
B、由上述分析可知,混和气体中一定有甲烷,可能含有是C2H4或C3H4,故B错误;
C、由上述分析可知,混和气体中一定没有C2H6或C2H2,故C错误;
D、由上述分析可知,混和气体中一定没有C2H6或C2H2,故D错误.
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合烃组成的判断,难度中等,本题关键是能够正确分析有机物完全燃烧生成的CO2和H2O的物质的量关系,根据平均分子式进行判断.1年前查看全部
- 0.1mol OH-1的质量跟多少克氢氧化钙含有相同数目的阴离子?
 那些记忆1年前1
那些记忆1年前1 -
 尚三74 共回答了18个问题
尚三74 共回答了18个问题 |采纳率94.4%0.1mol OH-1的质量
0.1*17===1.7克
多少克氢氧化钙含有相同数目的阴离子?
0.05mol氢氧化钙有相同的阴离子的,
0.05*74==3.7克1年前查看全部
- 0.1molH2SO4中含有____个H2SO4分子,公约含有______个原子,在水溶液中可以电离出___个H离子
0.1molH2SO4中含有____个H2SO4分子,公约含有______个原子,在水溶液中可以电离出___个H离子
摆脱给步骤,过程加分 请神赐我双全法1年前1
请神赐我双全法1年前1 -
 lihongde 共回答了13个问题
lihongde 共回答了13个问题 |采纳率100%H2SO4由H2SO4分子构成,1个H2SO4分子中含7个原子;H2SO4=2H+ + SO42-
(1)0.1molX6.02X10^23/mol=6.02X10^22
(2)6.02X10^22X7=4.214X10^23
(3)6.02X10^22X2=1.204X10^231年前查看全部
- 下列与20ml0.1mol/L硫酸铵中的NH4+浓度相同的溶液是
下列与20ml0.1mol/L硫酸铵中的NH4+浓度相同的溶液是
A.0.2mol/L氨水10ml
B.0.1mol/L氯化铵溶液 40ml
C.0.1mol/L磷酸铵溶液20ml
D.0.2mol/L硝酸铵溶液10ml palewind1年前3
palewind1年前3 -
 wwbbooyy 共回答了14个问题
wwbbooyy 共回答了14个问题 |采纳率100%20ml0.1mol/L硫酸铵中的NH4+浓度:(NH4)2SO4,每mol含2molNH4+,所以浓度为
0.1mol/L*2=0.2mol/L
A.0.2mol/L氨水10ml :氨水溶质看作NH3.H2O,电离成OH-+NH4+,浓度为:0.2mol/L*1=0.2mol/L
B.0.1mol/L氯化铵溶液 40ml :NH4HCL,1mol中含1molNH4+
浓度:0.1mol/L*1=0.1mol/L
C.0.1mol/L磷酸铵溶液20ml :(NH4)3PO4,1mol(NH4)3PO4
含3molNH4+,浓度为:0.1mol/L*3=0.3mol/L
D.0.2mol/L硝酸铵溶液10ml:NH4NO3,1mol含1molNH4+
浓度:0.2*1=0.2mol/L
即A、D.主要注意不要被溶液的体积所迷惑,它问的是浓度而不是物质的量.1年前查看全部
- 一体积某烃燃烧后生成的二氧化碳比水蒸气少一体积,0.1mol该烃燃烧后生成产物全部被碱石灰吸收.碱石灰增重32.8g,求
一体积某烃燃烧后生成的二氧化碳比水蒸气少一体积,0.1mol该烃燃烧后生成产物全部被碱石灰吸收.碱石灰增重32.8g,求其分子式= =
 冷落自己的举动1年前1
冷落自己的举动1年前1 -
 阳光满巷头 共回答了25个问题
阳光满巷头 共回答了25个问题 |采纳率92%是C5H12.1年前查看全部
大家在问
- 1某班同学参加运土劳动,女学生除去一名请假外,全部分配去抬土,两人抬一筐,男生除去3名体弱者跟女生一起抬土外,其余去挑土,
- 2甲,乙两个码头之间相距60km,一渔船从甲顺流2小时到达乙,由乙返回逆流3小时到达甲,渔船在静水中的速度为多少?
- 3麦哲伦海峡和德雷克海峡离的很近,那这两个海峡有什么区别呢?
- 4铝单质是否能转化为二氧化铝?
- 5已知三角形ABC的三个顶点都在反比例函数y=1/x的图像上 设A(x1,y1) B(x2,y2),C(x3,y3).求A
- 6高中分三个年级.英文怎么说?我想当一名旅行家,可以背起行囊,周游世界。英语翻译~
- 7为科学的测量一个物体量 就需要一个公认的标准作为一个比较大小的依据 这个标准叫做?
- 8一篇四字词语很多的文章,400字
- 9“Brother,Can You Spare a Dime?”这是20世纪二三十年代美国经济危机期间相当流行的一首歌曲。
- 10解方程:10/(2/3x)+30[1/x+1/(2/3x)]=1
- 11两个磁极之间有一个小磁针,小磁针静止时的指向如图所示,请在图中标出两个磁极的极性.
- 12韦编三绝的主人公是谁的 答案
- 13在圆O上有一条小于直径的弦,则应如何表示优弧和劣弧
- 14人教数学必修一A版复习参考题82页和112页答案,都只要A组
- 15一瓶油重[9/10]千克,第一天用去它的[3/10],第二天用去它的[1/5],还剩它的几分之几没用?
