燃烧法是测定有机化合物化学式的一种重要方法.完全燃烧0.1mol某烃后,测得生成CO2的体积为8.96L(标准状况),生
 淘气天08涯2022-10-04 11:39:541条回答
淘气天08涯2022-10-04 11:39:541条回答(1)求该烃的分子式
(2)写出该烃可能有的结构简式.

已提交,审核后显示!提交回复
共1条回复
 紫沁嫣然 共回答了13个问题
紫沁嫣然 共回答了13个问题 |采纳率100%- 解题思路:(1)根据有机物燃烧时,有机物中的碳全部转化为二氧化碳,由二氧化碳的质量,可求得烃中C原子个数,有机物中的氢全部转化为水,由水的其质量可以可求得烃中H原子个数,以此可求得烃的分子式;
(2)根据碳链异构来书写同分异构体;(1)二氧化碳为体积为8.96L(标准状况),n(CO2)=[8.96L/22.4L/mol]=0.4mol,n(C)=n(CO2)=0.4mol;水的质量为9.0g,n(H2O)=[9.0g/18g/mol]=0.5mol,n(H)=2n(H2O)=2×0.5mol=1mol,即0.1mol烃中含有0.4molC原子,1molH原子,所以该烃分子中C原子个数为4,H原子个数为10,所以该烃的分子式为C4H10,
答:该烃的分子式为C4H10;
(2)由碳链异构可知,C4H10的可能的结构简式为:CH3CH2CH2CH3或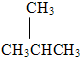 ;
;
答:该烃可能有的结构简式.CH3CH2CH2CH3或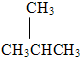 ;
;点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查学生燃烧法确定有机物分子组成和同分异构体的确定,根据原子守恒法来解答,难度不大. - 1年前
相关推荐
- 求解: 现有棉纤维、毛纤维、蚕丝纤维、涤纶丝纤维,请用感官目测法和燃烧法给予鉴别
 shenyanming1年前1
shenyanming1年前1 -
 一十百千 共回答了22个问题
一十百千 共回答了22个问题 |采纳率90.9%最好的鉴别方法是,手感,和燃烧法,化纤的一般会有气味较浓,还有就是在放大镜下面拆分,看看纤维组织,就很好的分别了1年前查看全部
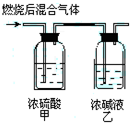
- 燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称
燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重10.8g,乙装置增重22g.求该烃的化学式,并写出其所有的结构简式.

 西秀之花1年前4
西秀之花1年前4 -
 冰哥哥1207 共回答了21个问题
冰哥哥1207 共回答了21个问题 |采纳率90.5%解题思路:根据浓硫酸具有吸水性,增重10.8g,为水的质量,可求得烃中H原子个数,生成物通入NaOH溶液,增重的质量为二氧化碳的质量,可求得烃中C原子个数,以此可求得烃的分子式.然后根据碳链异构来写结构简式.浓硫酸具有吸水性,增重10.8g,为水的质量,则n(H2O)=[10.8g /18g/mol ]=0.6mol,
n(H)=2n(H2O)=2×0.6mol=1.2mol,即0.1mol烃中含有1.2molH原子,所以该烃分子中H原子个数为12,
生成物通入NaOH溶液,增重的22g质量为二氧化碳的质量,
则n(CO2)=[22g /44g/mol ]=0.5mol,n(C)=n(CO2)=0.5mol,
即0.1mol烃中含有0.5molC原子,所以该烃分子中C原子个数为5,
所以该烃的分子式为C5H12,其结构简式为:CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C,
答:该烃的化学式C5H12,其结构简式为CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C.点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查有机物分子式的确定以及同分异构体的书写,题目难度不大,注意把握题中信息.1年前查看全部
- 燃烧法是测定有机化合物分子式的一种重要方法.已知0.1mol某烃A完全燃烧后,生成11.2L(标准状况)的CO2,生成1
燃烧法是测定有机化合物分子式的一种重要方法.已知0.1mol某烃A完全燃烧后,生成11.2L(标准状况)的CO2,生成10.8g水,回答下列问题.
(1)通过计算推导A的分子式.
(2)写出A可能的结构简式. 通宵加班1年前1
通宵加班1年前1 -
 xbddxa 共回答了14个问题
xbddxa 共回答了14个问题 |采纳率85.7%解题思路:(1)根据有机物燃烧时,有机物中的碳全部转化为二氧化碳,由二氧化碳的质量,可求得烃中C原子个数,有机物中的氢全部转化为水,由水的其质量可以可求得烃中H原子个数,以此可求得烃的分子式;
(2)根据碳链异构来书写同分异构体.(1)二氧化碳为体积为11.2L(标准状况),n(CO2)=[11.2L/22.4L/mol]=0.5mol,n(C)=n(CO2)=0.5mol;水的质量为10.8g,n(H2O)=[10.8g/18g/mol]=0.6mol,n(H)=2n(H2O)=2×0.6mol=1.2mol,即0.1mol烃中含有0.5molC原子,1.2molH原子,所以该烃分子中C原子个数为5,H原子个数为12,所以该烃的分子式为C5H12,
答:该烃的分子式为C5H12;
(2)由碳链异构可知,C5H12的可能的结构简式为:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、CH3C(CH3)3;
答:A可能的结构简式为:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、CH3C(CH3)3.点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查学生燃烧法确定有机物分子组成和同分异构体的确定,根据原子守恒法来解答,难度不大.1年前查看全部
- 燃烧法是测定有机物组成的常用方法.一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水.根据质量守恒定律判断该有机物
燃烧法是测定有机物组成的常用方法.一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水.根据质量守恒定律判断该有机物的组成正确的是( )
A.只含有C、H两种元素
B.一定含有C、H两种元素,可能含有O元素
C.含有C、H、O三种元素
D.一定含有C、0两种元素,可能含有H元素 584190311年前1
584190311年前1 -
 何子洁 共回答了15个问题
何子洁 共回答了15个问题 |采纳率100%解题思路:由题意可知,“一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水”,根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.在化学反应中,元素的种类不变,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.故可知答案.由题意可知,“一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水”,可推测有机物燃烧的符号表达式为:M+O2
点燃
CO2+H2O 根据质量守恒定律,M中一定含有碳元素、氢元素,但氧元素不一定含有,需要计算.
故选:B点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力;了解物质的组成;了解元素在化学变化过程中的特点.1年前查看全部
- 下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧气氧化硬质玻璃管内样品,根据氧化产物的质量确定
下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧气氧化硬质玻璃管内样品,根据氧化产物的质量确定有机物的组成(在装置中C里的氧化铜是确保有机物中的碳元素完全转化为二氧化碳).

请回答有关问题:
(1)写出A装置中发生反应的化学方程式2H2O2
2H2O+O2↑MnO2 .2H2O2.再写出用A装置制取另一种常见气体的化学方程式______.
2H2O+O2↑MnO2 .
(2)若去掉B装置会对______元素的测定结果有影响,会使测定结果______(填“偏大”或“偏小”).
(3)E装置中所盛放物质最好是______(选填:①石灰水;②NaOH溶液;③水).
(4)若准确称取1.12克样品(样品只含C、H、O三种元素中的两种或三种).经充分燃烧,D装置增重1.44克,E装置增重3.52克,则该有机物样品中所含的元素为______. 赤兔胭脂兽1年前1
赤兔胭脂兽1年前1 -
 xiaoyiaigy 共回答了16个问题
xiaoyiaigy 共回答了16个问题 |采纳率87.5%解题思路:(1)双氧水分解产生水和氧气,故可以写出该反应的化学方程式,在实验室中制取二氧化碳气体反应也不需要加热,可以据此解答;
(2)浓硫酸能够吸收水蒸气,结合过氧化氢分解产生的氧气会带出水蒸气来解答;
(3)根据氢氧化钙和氢氧化钠的溶解度来解答该题;
(4)根据相关方面的数据进行计算可以判断物质的元素组成.(1)根据题意可知:A中的反应为2H2O2
MnO2
.
2H2O+O2↑,在实验室中制取二氧化碳也不需要加热,且是固体和固体反应,所以A装置也可以用来制取二氧化碳;
(2)根据题给的实验设计思路可知,B装置是用来吸收A中的水蒸气的,若去掉B装置,从A中挥发出来的水会进入D中,对氢元素的测量结果会有影响,将会使测得的氢元素的质量偏大;
(3)E装置中所盛放物质最好选用氢氧化钠溶液,因为氢氧化钠易溶于水,氢氧化钙微溶于水,氢氧化钠溶液可以完全吸收反应生成的二氧化碳;
(4)D装置增重1.44g,说明反应生成了1.44g水;E装置增重3.52g,说明反应生成了3.52g二氧化碳.
1.44g水中含有的氢元素的质量为:1.44g×[2/18]×100%=0.16g;
3.52g二氧化碳中碳元素的质量为:3.52g×[12/44]×100%=0.96g;
结合质量守恒定律可以知道,有机物样品中碳元素和氢元素的质量和为:0.16g+0.96g=1.12g,与所称取的有机物的质量相等,故该样品中只含有碳元素和氢元素.
故答案为:
(1)2H2O2
MnO2
.
2H2O+O2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑(其它合理答案也可);
(2)氢(H);
(3)②;
(4)碳、氢(C、H).点评:
本题考点: 实验探究物质的组成成分以及含量;气体的净化(除杂);实验室制取氧气的反应原理;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查物质的性质和相关方面的计算等方面的知识,进行计算时不要漏掉百分号.1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要的方法.在一定温度下取0.1mol某气态烃A在
燃烧法是测定有机化合物化学式的一种重要的方法.在一定温度下取0.1mol某气态烃A在
O2中完全燃烧,生成CO2和水蒸气,放出热量QKJ,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重7.2克,碱石灰增重17.6克.将烃A加入酸性KMnO4溶液或Br2的CCI4溶液,均能使它们褪色.(1)写出烃A的分子式(2)已知烃A分子结构对称有两个甲基,请写出烃A的结构简式(3)写出烃A使Br2的CCI4溶液褪色的化学方程式
写的来这道题的人,请帮个忙.急 小楠楠_51年前1
小楠楠_51年前1 -
 wzddq 共回答了18个问题
wzddq 共回答了18个问题 |采纳率94.4%H2O的摩尔数为:7.2除以18得0.4mol,同理CO2为0.4mol,所以
(1)A为C4H8 (2)CH3-CH=CH-CH3 (3)CH3-CH=CH-CH3 +Br2——CH3-CHBr-CHBr-CH31年前查看全部
- 用燃烧法除去密闭容器中空气成分里的氧气时,为什么要选择红磷而不选择细铁丝.硫粉和木炭
 初恋的错觉1年前1
初恋的错觉1年前1 -
 应怜 共回答了16个问题
应怜 共回答了16个问题 |采纳率93.8%选铁丝会生成四氧化三铁,多余的生成物,而那个硫的话,更不行了,会生成二氧化硫,气体啊!更不行了,所以只能用红磷.1年前查看全部
- 燃烧法是测定有机化合物分子式的一种重要方法.请回答下列问题:
燃烧法是测定有机化合物分子式的一种重要方法.请回答下列问题:
(1)下列物质完全燃烧时,生成的二氧化碳与水的物质的量之比为1:2的是______(填序号)
①CH 4 ②C 2 H 6 ③C 3 H 6 ④C 6 H 6
(2)0.1mol某烃B完全燃烧后,生成的CO 2 气体体积为4.48L(STP),生成的水为5.4g.试通过计算(写出计算过程)推导烃B的分子式. 小凉鞋1年前1
小凉鞋1年前1 -
 失去朋友的痛 共回答了24个问题
失去朋友的痛 共回答了24个问题 |采纳率95.8%(1)物质完全燃烧时,生成的二氧化碳与水的物质的量之比为1:2,则有机物中碳原子和氢原子的个数之比是1:4,只有①符合,故答案为:①;
(2)生成的CO 2 气体体积为4.48L(STP)即0.2mol,所以n(C)=n(CO 2 )=0.2mol;
生成的水为5.4g,即0.3mol,所以n(H)=2n(H 2 O)=0.6mol;n(烃):n(C):n(H)=0.1:0.2:0.6=1:2:6,所以烃B的分子式为:C 2 H 6 ,
答:烃B的分子式为C 2 H 6 .1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.在一定温度下取0.1mol某气态烃A在O2中完全燃烧,生成CO2和水蒸汽,放
燃烧法是测定有机化合物化学式的一种重要方法.在一定温度下取0.1mol某气态烃A在O2中完全燃烧,生成CO2和水蒸汽,放出热量Q kJ,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重7.2g,碱石灰增重17.6g.将烃A加入酸性KMnO4溶液或Br2的CCl4溶液,均能使它们褪色.
(1)写出气态烃A燃烧的热化学方程式______;
(2)已知烃A分子结构高度对称且有两个甲基,请写出烃A的结构简式______;
(3)写出烃A使Br2的CCl4溶液褪色生成B的化学方程式______;
(4)烃A在一定条件下可以通过加聚反应合成一种塑料,则该反应的化学方程式是______.
(5)写出B在NaOH水溶液中加热的化学反应方程式______. 重新麻木1年前1
重新麻木1年前1 -
 minaiqin 共回答了20个问题
minaiqin 共回答了20个问题 |采纳率90%解题思路:浓硫酸增重7.2g为生成的水的质量,根据H原子守恒可求得0.1mol某气态烃A中H原子的物质的量,碱石灰增重17.6g为燃烧生成CO2的质量,根据C原子守恒可求得0.1mol某气态烃A中C原子的物质的量,以此可求得烃的分子式.
(1)根据热化学方程式的含义和书写方法来回答;
(2)根据物质的对称性来书写;
(3)含碳碳双键的烯烃可以和溴水发生加成反应;
(4)含碳碳双键的烯烃可以发生加聚反应得到高分子化合物;
(5)卤代烃在碱性环境下水解可以生成醇类,属于取代反应.浓硫酸增重7.2g为生成的水的质量,即水的物质的量是0.4mol,根据H原子守恒可求得0.1mol某气态烃A中H原子的物质的量为0.8mol,碱石灰增重17.6g,为燃烧生成CO2的质量,所以二氧化碳的物质的量是0.4mol,根据C原子守恒可求得0.1mol某气态烃A中C原子的物质的量为0.4mol,以此可求得烃的分子式为C4H8.
(1)取0.1mol某气态烃在O2中完全燃烧,生成CO2和水蒸汽,放出热量Q kJ,则气态烃燃烧的热化学方程式为:C4H8(g)+6O2(g)=4CO2(g)+4H2O(g),△H=-10QKJ/mol-1,故答案为:C4H8(g)+6O2(g)=4CO2(g)+4H2O(g),△H=-10QKJ/mol-1;
(2)烃分子结构高度对称且有两个甲基,烃的结构简式是CH3CH=CHCH3故答案为:CH3CH=CHCH3;
(3)含碳碳双键的烯烃CH3CH=CHCH3可以和溴水发生加成反应,即CH3CH=CHCH3+Br2→CH3CHBrCHBrCH3,
故答案为:CH3CH=CHCH3+Br2→CH3CHBrCHBrCH3;
(4)含碳碳双键的烯烃CH3CH=CHCH3可以发生加聚反应得到高分子化合物,原理是: ,故答案为:
,故答案为: ;
;
(5)卤代烃在碱性环境下水解可以生成醇类,CH3CHBrCHBrCH3的水解原理方程式为: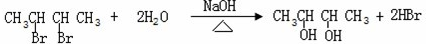 ,故答案为:
,故答案为: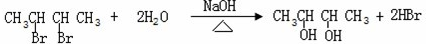 .
.点评:
本题考点: 有机物的推断;测定有机物分子的元素组成.
考点点评: 本题考查学生烯烃的性质以及有机物的推断知识,要求学生熟记教材知识,注意知识的积累是解题的关键,难度大.1年前查看全部
- 燃烧法是测定有机物组成的常用方法。一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水。根据质量守恒定律判断该有机物
燃烧法是测定有机物组成的常用方法。一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水。根据质量守恒定律判断该有机物的组成正确的是 [ ]A.只含有C、H两种元素
B.一定含有C、H两种元素,可能含有O元素
C.含有C、H、O三种元素
D.一定含有C、O两种元素,可能含有H元素 simple10041年前1
simple10041年前1 -
 xmuljj 共回答了23个问题
xmuljj 共回答了23个问题 |采纳率91.3%B1年前查看全部
- (6分)燃烧法是测定有机化合物化学式的一种重要方法。在一定温度下取0.1 mol某气态烃A在O 2 中完全燃烧,生成CO
(6分)燃烧法是测定有机化合物化学式的一种重要方法。在一定温度下取0.1 mol某气态烃A在O 2 中完全燃烧,生成CO 2 和水蒸汽,放出热量Q kJ,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重7.2 g,碱石灰增重17.6 g。将烃A加入酸性KMnO 4 溶液或Br 2 的CCl 4 溶液,均能使它们褪色。
(1)写出烃A的分子式
(2)已知烃A分子结构高度对称且有两个甲基
①写出烃A使Br 2 的CCl 4 溶液褪色的化学方程式
②烃A在一定条件下可以通过加聚反应合成一种塑料,则该反应的化学方程式是
 rippen1年前0
rippen1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 燃烧法是测定有机化合物分子式的一种重要方法.下列是通过燃烧法推断物质组成的过程,请回答下列问题:
燃烧法是测定有机化合物分子式的一种重要方法.下列是通过燃烧法推断物质组成的过程,请回答下列问题:
(1)某物质A在氧气中完全燃烧只生成二氧化碳和水.则说明______(填选项符号)
A.A一定是烃
B.A一定含有C、H两种元素,肯定不含氧元素
C.A一定含有C、H两种元素,可能含有氧元素
D.A一定含有C、H、O三种元素
(2)0.05mol某烃B完全燃烧后,生成的CO2气体体积为4.48L(STP),生成的水为4.5g.试通过计算(写出计算过程)推导烃B的分子式.并写出它可能存在的结构简式. 歪皮1年前1
歪皮1年前1 -
 zlzl2006 共回答了16个问题
zlzl2006 共回答了16个问题 |采纳率93.8%解题思路:(1)某物质A在氧气中完全燃烧只生成二氧化碳和水,说明含有C、H元素,也可能含有氧元素;
(2)根据CO2气体体积计算C原子的物质的量,根据水的质量计算H原子的物质的量,进而根据烃的物质的量可计算烃的分子式,从而可确定结构简式.(1)烃和烃的含氧衍生物燃烧时都能生成二氧化碳和水,某物质A在氧气中完全燃烧只生成二氧化碳和水,说明含有C、H元素,也可能含有氧元素,故答案为:C;
(2)n(C)=n(CO2)=[4.48L/22.4L/mol]=0.2mol,
n(H)=2n(H2O)=2ⅹ[4.5g/18g/mol]=0.5mol,
n(烃):n(C):n(H)=0.05:0.2:0.5=1:4:10,
烃B的分子式为:C4H10,
可能的结构简式为:CH3CH2CH2CH3 、CH3CH(CH3)CH3,
答:烃B的分子式为:C4H10,可能的结构简式为:CH3CH2CH2CH3 、CH3CH(CH3)CH3.点评:
本题考点: 测定有机物分子的元素组成.
考点点评: 本题考查烃的分子式的确定,题目难度不大,本题注意计算出1mol烃中含有C、H原子的物质的量可计算烃的分子式.1年前查看全部
- 燃烧法是测定有机化合物分子式的一种重要方法.3g某有机化合物A完全燃烧后,生成的CO2为2.24L(标准状况
燃烧法是测定有机化合物分子式的一种重要方法.3g某有机化合物A完全燃烧后,生成的CO2为2.24L(标准状况
),生成水1.8g,该有机化合物的相对分子质量为60.若A能与NaCO3溶液反应放出CO2,写出该反应的化学方程式
 dongjunli1年前1
dongjunli1年前1 -
 我爱你你爱我吗 共回答了14个问题
我爱你你爱我吗 共回答了14个问题 |采纳率100%2CH3COOH+NA2CO3=2CH3COONA+CO2+H2O1年前查看全部
- 燃烧法是测定有机物分子式的一种重要方法.完全燃烧0.1mol某烃后,测得生成的二氧化碳为8.96L(标准状况),生成的水
燃烧法是测定有机物分子式的一种重要方法.完全燃烧0.1mol某烃后,测得生成的二氧化碳为8.96L(标准状况),生成的水为9.0g.请通过计算:
(1)推导该烃的分子式.
(2)写出它可能存在的全部结构简式. 魔之桌椅的粉丝1年前1
魔之桌椅的粉丝1年前1 -
 香蕉里个扒拉 共回答了15个问题
香蕉里个扒拉 共回答了15个问题 |采纳率80%(1)二氧化碳为体积为8.96L(标准状况),n(CO 2 )=
8.96L
22.4L/mol =0.4mol,n(C)=n(CO 2 )=0.4mol;
水的质量为9.0g,n(H 2 O)=
9.0g
18g/mol =0.5mol,n(H)=2n(H 2 O)=2×0.5mol=1mol,
即0.1mol烃中含有0.4molC原子,1molH原子,所以该烃分子中C原子个数为4,H原子个数为10,
所以该烃的分子式为C 4 H 10 ,
答:该烃的分子式为C 4 H 10 ;
(2)根据碳链异构可得C 4 H 10 的结构简式为:CH 3 CH 2 CH 2 CH 3 、CH(CH 3 ) 3 ,
答:它可能存在的全部结构简式为CH 3 CH 2 CH 2 CH 3 、CH(CH 3 ) 3 .1年前查看全部
- 棉花和羊毛都为天然纤维为什么却能用燃烧法区别?
 妃妃01191年前1
妃妃01191年前1 -
 elapsed1977 共回答了19个问题
elapsed1977 共回答了19个问题 |采纳率78.9%棉花是纤维
羊毛是蛋白质
所以羊毛烧了会有臭味,棉花没有臭味
是这样区别的1年前查看全部
- 燃烧法是测定有机物组成的常用方法.一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水.根据质量守恒定律判断该有机物
燃烧法是测定有机物组成的常用方法.一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水.根据质量守恒定律判断该有机物的组成正确的是( )
A. 只含有C、H两种元素
B. 一定含有C、H两种元素,可能含有O元素
C. 含有C、H、O三种元素
D. 一定含有C、0两种元素,可能含有H元素 占星魔1年前1
占星魔1年前1 -
 virjoy7777 共回答了17个问题
virjoy7777 共回答了17个问题 |采纳率94.1%解题思路:由题意可知,“一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水”,根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.在化学反应中,元素的种类不变,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.故可知答案.由题意可知,“一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水”,可推测有机物燃烧的符号表达式为:M+O2
点燃
CO2+H2O 根据质量守恒定律,M中一定含有碳元素、氢元素,但氧元素不一定含有,需要计算.
故选:B点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力;了解物质的组成;了解元素在化学变化过程中的特点.1年前查看全部
- 燃烧法是测定有机化合物分子式的一种重要方法.完全燃烧0.1mol某烃后,测得生成的二氧化碳为8.9
燃烧法是测定有机化合物分子式的一种重要方法.完全燃烧0.1mol某烃后,测得生成的二氧化碳为8.9
6L(标准状况),生成的水为9.0kg,则该烃的分子式为,他可能存在的结构简式为 红裳翠袖1年前1
红裳翠袖1年前1 -
 2ly4a 共回答了21个问题
2ly4a 共回答了21个问题 |采纳率85.7%烃:C:H=0.1:8.96/22.4:9*2/18=1:4:10
该化合物的分子式为:C4H10
结构简式:CH3CH2CH2CH3
CH3CH(CH3)21年前查看全部
- 用燃烧法除去密闭容器中空气成分里的氧气,应选择下列物质中的( )
用燃烧法除去密闭容器中空气成分里的氧气,应选择下列物质中的( )
A. 细铁丝
B. 红磷
C. 硫粉
D. 木炭 yaokai2181年前1
yaokai2181年前1 -
 柳如烟雁飞 共回答了11个问题
柳如烟雁飞 共回答了11个问题 |采纳率90.9%解题思路:用燃烧法除去密闭容器中空气成分里的氧气,要求物质可在空气中燃烧并不再生成气体物质.A、细铁丝,不能在空气中燃烧,只能在氧气中燃烧;
B、红磷,可在空气中燃烧,生成白色固体五氧化二磷;
C、硫粉,硫在空气中燃烧,生成无色有刺激性气味的二氧化硫气体;
D、木炭,木炭可在空气中燃烧,生成无色无味气体二氧化碳.
故选B点评:
本题考点: 气体的净化(除杂);氧气与碳、磷、硫、铁等物质的反应现象.
考点点评: 铁在氧气中燃烧,火星四射,而在干燥的空气很难于空气发生反应,在潮湿空气中则较易生锈.1年前查看全部
- 急用!燃烧法是测定有机物化学式的重要方法,现在完全燃烧3.36L(标准状态下)某气态烃,燃烧产...
急用!燃烧法是测定有机物化学式的重要方法,现在完全燃烧3.36L(标准状态下)某气态烃,燃烧产...
急用!燃烧法是测定有机物化学式的重要方法,现在完全燃烧3.36L(标准状态下)某气态烃,燃烧产物依次通过浓硫酸和浓氢氧化钠溶液,实验结束后,称得浓硫酸增重8.1g,浓氢氧化钠溶液增重13.2g.求:
(1)该烃的化学式及结构简式.
(2)燃烧所消耗的氧气的质量.
(3)写出这种物质和cl2在光照条件下的化学反应方程式(只写第一步). 寒武纪的水果糖1年前1
寒武纪的水果糖1年前1 -
 笨过计算机 共回答了18个问题
笨过计算机 共回答了18个问题 |采纳率94.4%3.36/22.4=0.15摩尔;硫酸增重8.1g,含氢8.1*2/*18=0.9摩尔,氢氧化钠增重13.2g含碳13.2*12/*44=0.3摩尔.
(1)C2H6,乙烷
(2)2C2H6+7O2=4CO2+6H2O 2:7*32=0.3:X,X=33.6克
(3)C2H6+Cl2=C2H5Cl+HCl1年前查看全部
- JTRS---8SP沥青含量测定仪—燃烧法使用方法
 烟水阔阔1年前1
烟水阔阔1年前1 -
 toty0801 共回答了16个问题
toty0801 共回答了16个问题 |采纳率87.5%使用前要对仪器进行标定.
称取一定重量的混合料(2000g左右)放到燃烧炉里面烧,烧完之后再称取剩余重量,质量差与混合料的重量比就是含油量了1年前查看全部
- 下列物质的用途中,主要利用其物理性质的是 A.铜丝做导线 B.氧气作助燃剂 C.燃烧法鉴别纯毛织物 D.天然
下列物质的用途中,主要利用其物理性质的是
A.铜丝做导线 B.氧气作助燃剂 C.燃烧法鉴别纯毛织物 D.天然气作清洁燃料  煮鱼佬1年前1
煮鱼佬1年前1 -
 风暴2008 共回答了24个问题
风暴2008 共回答了24个问题 |采纳率100%A
1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.在一定温度下取0.1mol某气态烃A在O2中完全燃烧,生成CO2和水蒸气,放
燃烧法是测定有机化合物化学式的一种重要方法.在一定温度下取0.1mol某气态烃A在O2中完全燃烧,生成CO2和水蒸气,放出热量Q kJ,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重7.2g,碱石灰增重17.6g.将烃A加入酸性KMnO4溶液或Br2的CCl4溶液,均能使它们褪色.
(1)写出烃A的分子式______;
(2)已知烃A分子结构高度对称且有两个甲基,请写出烃A的结构简式______;
(3)写出烃A使Br2的CCl4溶液褪色的化学方程式______;
(4)烃A在一定条件下可以通过加聚反应合成一种塑料,则该反应的化学方程式是nCH3CH=CHCH3一定条件  nCH3CH=CHCH3.
nCH3CH=CHCH3.一定条件 
 celinasun1年前1
celinasun1年前1 -
 照照41792371 共回答了22个问题
照照41792371 共回答了22个问题 |采纳率95.5%解题思路:(1)通过浓硫酸增重7.2g是水的质量,碱石灰增重17.6克是生成二氧化碳的质量,根据n=[m/M]计算水、二氧化碳的物质的量,再根据原子守恒计算C原子、氢原子的物质的量,进而计算烃A中C原子、氢原子的数目,确定分子式;
(2)烃A加入酸性KMnO4溶液或Br2的CCl4溶液,均能使它们褪色,说明含有不饱和键,且烃A分子结构高度对称且有两个甲基,据此结合A的分子式判断其结构简式;
(3)A中含有不饱和键,与溴发生加成反应,结合A的结构简式书写方程式;
(4)A中含有不饱和键,发生加聚反应合成一种塑料,结合A的结构简式书写方程式.(1)通过浓硫酸增重7.2g是水的质量,水的物质的量为[7.2g/18g/mol]=0.4mol,故n(H)=2×0.4mol=0.8mol,碱石灰增重17.6克是生成二氧化碳的质量,二氧化碳的物质的量为[17.6g/44g/mol]=0.4mol,故n(C)=0.4mol,故烃A分子中C原子数目为[0.4mol/0.1mol]=4,H原子数目为[0.8mol/0.1mol]=8,故烃A的分子式为C4H8,
故答案为:C4H8;
(2)A加入酸性KMnO4溶液或Br2的CCl4溶液,均能使它们褪色,说明含有不饱和键,A的分子式为C4H8,故含有C=C双键,且烃A分子结构高度对称且有两个甲基,故A的结构简式为CH3CH=CHCH3,
故答案为:CH3CH=CHCH3;
(3)CH3CH=CHCH3与Br2发生加成反应使Br2的CCl4溶液褪色,反应方程式为:CH3CH=CHCH3+Br2→CH3CHBrCHBrCH3,
故答案为:CH3CH=CHCH3+Br2→CH3CHBrCHBrCH3;
(4)CH3CH=CHCH3含有C=C双键,在一定条件下可以通过加聚反应合成一种塑料,则该反应的化学方程式是:
nCH3CH=CHCH3
一定条件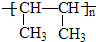 ,
,
故答案为:nCH3CH=CHCH3
一定条件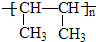 ;
;点评:
本题考点: 有机物的推断;有机物的结构式;有机物实验式和分子式的确定.
考点点评: 考查有机物的推断,难度中等,根据燃烧法利用原子守恒确定烃A的分子式是解题的关键.1年前查看全部
- 燃烧法是测定有机化合物组成的常用方法,某学习小组取一定质量的某有机化合物在足量氧气中充分燃烧,只得到CO2和H2O.根据
燃烧法是测定有机化合物组成的常用方法,某学习小组取一定质量的某有机化合物在足量氧气中充分燃烧,只得到CO2和H2O.根据质量守恒定律判断该有机化合物的组成正确的是( )
A.含有C、H、O三种元素
B.一定含有C、O两种元素,可能含有H元素
C.只含有C、H两种元素
D.一定含有C、H两种元素,可能含有O元素 comunicate1年前1
comunicate1年前1 -
 忧伤BOY 共回答了19个问题
忧伤BOY 共回答了19个问题 |采纳率89.5%由题意可知,“一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水”,可推测有机物燃烧的符号表达式为:M+O2
点燃
CO2+H2O 根据质量守恒定律中元素种类在化学反应前后不会改变可知,M中一定含有碳元素、氢元素,但氧元素不一定含有,要想判断需进行定量的计算.
故选D.1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.完全燃烧0.1mol某碳氢化合物后,测得生成的二氧化碳为8.96L(标准状况
燃烧法是测定有机化合物化学式的一种重要方法.完全燃烧0.1mol某碳氢化合物后,测得生成的二氧化碳为8.96L(标准状况),生成的水为9.0g.据此求该化合物的分子式,并写出其结构简式..
 ly4842906_lqb1年前1
ly4842906_lqb1年前1 -
 啥呀啥 共回答了19个问题
啥呀啥 共回答了19个问题 |采纳率89.5%完全燃烧后生成的CO2和H2O的物质的量分别为8.96/22.4=0.4mol 9/18=0.5mol 其中含有的C原子的物质的量为0.4mol H原子的物质的量为0.5*2=1mol 该碳氢化合物的物质的量为0.1mol 所以一分子该碳氢化合物中含有4个碳原子10个氢原子 分子式为C4H10 结构简式CH3CH2CH2CH3或者
CH3-CH-CH3
|
CH31年前查看全部
- 下列说法中,不正确的是 A.李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法都是元素定性分析法 B.红外光谱分析法常用来判断有
下列说法中,不正确的是
A.李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法都是元素定性分析法 B.红外光谱分析法常用来判断有机化合物中具有哪些基团 C.麦芽糖、乳糖、纤维二糖互为同分异构体,分子式都为C 12 H 22 O 11 D.绿色荧光蛋白质(GFP)是高分子化合物,其水溶液有丁达尔效应  cjghx1年前1
cjghx1年前1 -
 你的眼睛我的泪 共回答了22个问题
你的眼睛我的泪 共回答了22个问题 |采纳率81.8%A
李比希燃烧法可定量测定元素含量;钠熔法是定性鉴定有机化合物所含元素(氮、卤素、硫)的方法; 铜丝燃烧法 可定性确定有机物中是否存在卤素;纸层析法是以纸为载体的色谱法,实现定性、定量分析,它用于一些精度不高的分析;1年前查看全部
- 燃烧法是测定有机化合物分子式的一种重要方法.3g某有机化合物A完全燃烧后,生成的CO2为2.24L(标准状况),生成水1
燃烧法是测定有机化合物分子式的一种重要方法.3g某有机化合物A完全燃烧后,生成的CO2为2.24L(标准状况),生成水1.8g,该有机化合物的相对分子质量为60.
(1)试通过计算说明有机化合物A中是否含有氧元素.
(2)通过计算推导A的分子式.
(3)该有机化合物A显弱酸性,其稀溶液是厨房里的一种重要的调味品,则结构简式为______. 蝶De溪1年前2
蝶De溪1年前2 -
 stime66 共回答了21个问题
stime66 共回答了21个问题 |采纳率85.7%解题思路:根据有机物燃烧生成CO2的体积可计算有机物中C的物质的量和质量,根据生成水的质量可计算有机物中H原子的物质的量和质量,比较与有机物质量的大小关系可确定含有氧元素,并计算氧元素的质量,确定有机物的分子式,结合性质可确定结构简式.(1)n(C)=n(CO2)=[2.24L/22.4L/mol]=0.1mol,
n(H)=2n(H2O)=2×[1.8g/18g/mol]=0.2mol,
m(C)+m(H)=0.1 mol×12 g•mol-1+0.2 mol×1 g•mol-1=1.4 g<3 g,
这说明该物质中含有氧元素,且m(O)=3g-1.4g=1.6g,
答:该有机物含有氧元素;
(2)n(O)=[1.6g/16g/mol]=0.1mol,
n(A)=[3g/60g/mol]=0.05 mol,
n(B):n(C):n(H):n(O)=0.05 mol:0.1 mol:0.2 mol:0.1 mol=1:2:4:2,
故1molA中C、H、O的物质的量分别为2mol、4mol、2mol,则A的分子式为C2H4O2,
答:A的分子式为C2H4O2;
(3)该有机化合物A显弱酸性,其稀溶液是厨房里的一种重要的调味品,应为CH3COOH,
故答案为:CH3COOH.点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的推断,侧重于学生计算能力和分析能力的考查,题目难度中等,注意把握有机物的燃烧规律,结合有机物的性质进行推断.1年前查看全部
- 一道科学题求科学九上教与学第31页第10题解题的过程如图所示是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时
一道科学题
求科学九上教与学第31页第10题解题的过程
如图所示是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成(已知c中的氧化铜是确保有机物中的碳元素完全转换为二氧化碳,a中的反应为2H2O2====2H2O+O2)
1.若去掉b装置(其中有硫酸)会对什么元素的测量结果有影响?会使实验结果偏大还是偏小?
2.e装置中最好用1氢氧化钙2氢氧化钠3水(d装置中为硫酸)
3若称量1.12克样品(只含C.H.O中的2种或3种)燃烧后d装置增重1.44g。e装置增重3.52g。则含有元素为 zhuzhu82101年前3
zhuzhu82101年前3 -
 夏天最后一朵玫瑰 共回答了23个问题
夏天最后一朵玫瑰 共回答了23个问题 |采纳率87%请把题目打出来1年前查看全部
- 下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧气氧化硬质玻璃管内样品,根据氧化产物的质量确定
下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧气氧化硬质玻璃管内样品,根据氧化产物的质量确定有机物的组成(在装置中C里的氧化铜是确保有机物中的碳元素完全转化为二氧化碳). 
请回答有关问题:
(1)写出A装置中发生反应的化学方程式______.再写出用A装置制取另一种常见气体的化学方程式______.
(2)若去掉B装置会对______元素的测定结果有影响,会使测定结果______(填“偏大”或“偏小”).
(3)E装置中所盛放物质最好是______(选填:①石灰水;②NaOH溶液;③水).
(4)若准确称取1.12克样品(样品只含C、H、O三种元素中的两种或三种).经充分燃烧,D装置增重1.44克,E装置增重3.52克,则该有机物样品中所含的元素为______. 人面桃花zb1年前1
人面桃花zb1年前1 -
 龟隐 共回答了19个问题
龟隐 共回答了19个问题 |采纳率89.5%(1)根据题意可知:A中的反应为2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑,在实验室中制取二氧化碳也不需要加热,且是固体和固体反应,所以A装置也可以用来制取二氧化碳;
(2)根据题给的实验设计思路可知,B装置是用来吸收A中的水蒸气的,若去掉B装置,从A中挥发出来的水会进入D中,对氢元素的测量结果会有影响,将会使测得的氢元素的质量偏大;
(3)E装置中所盛放物质最好选用氢氧化钠溶液,因为氢氧化钠易溶于水,氢氧化钙微溶于水,氢氧化钠溶液可以完全吸收反应生成的二氧化碳;
(4)D装置增重1.44g,说明反应生成了1.44g水;E装置增重3.52g,说明反应生成了3.52g二氧化碳.
1.44g水中含有的氢元素的质量为:1.44g×
2
18 ×100%=0.16g;
3.52g二氧化碳中碳元素的质量为:3.52g×
12
44 ×100%=0.96g;
结合质量守恒定律可以知道,有机物样品中碳元素和氢元素的质量和为:0.16g+0.96g=1.12g,与所称取的有机物的质量相等,故该样品中只含有碳元素和氢元素.
故答案为:
(1)2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑;CaCO 3 +2HCl═CaCl 2 +H 2 O+CO 2 ↑(其它合理答案也可);
(2)氢(H);
(3)②;
(4)碳、氢(C、H).1年前查看全部
- 用燃烧法除去密闭容器中空气成分里的氧气,应选择下列物质中的( ) A.细铁丝 B.红磷 C.硫粉 D.木炭
 马儿大姐1年前1
马儿大姐1年前1 -
 笑欣 共回答了18个问题
笑欣 共回答了18个问题 |采纳率94.4%A、细铁丝,不能在空气中燃烧,只能在氧气中燃烧;
B、红磷,可在空气中燃烧,生成白色固体五氧化二磷;
C、硫粉,硫在空气中燃烧,生成无色有刺激性气味的二氧化硫气体;
D、木炭,木炭可在空气中燃烧,生成无色无味气体二氧化碳.
故选B1年前查看全部
- 燃烧法是在实验室里测定有机物组成的常用方法。
燃烧法是在实验室里测定有机物组成的常用方法。
柯明在老师的协助下,取了4.6克某有机物,在足量的氧气中充分燃烧,然后把燃烧所产生的气体全部通入下图所示的装置后,装置A质量增加了5.4克,装置C的质量无变化。通过对上述数据的分析,可以确定的该有机物中
A.一定含有C,H两种元素,可能含有O元素。
B.一定含有C,H,O三种元素
C.一定含有C,O两种元素,可能含有H元素
D.只含有C,H两种元素
请给出具体解析与答案
 王凌紫1年前2
王凌紫1年前2 -
 许愿池的少女 共回答了25个问题
许愿池的少女 共回答了25个问题 |采纳率88%选B
因为所消耗掉的小于原有的1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法,在一定温度下取0.1mol某液态烃A在O2中完全燃烧,生成二氧化碳和水蒸气,
燃烧法是测定有机化合物化学式的一种重要方法,在一定温度下取0.1mol某液态烃A在O2中完全燃烧,生成二氧化碳和水蒸气,将生成物依次通过硫酸铜和碱石灰,浓硫酸增重16.2g,碱石灰增重35.2g
 荔枝性温1年前1
荔枝性温1年前1 -
 movier 共回答了17个问题
movier 共回答了17个问题 |采纳率70.6%1年前查看全部
- 燃烧法是测定有机化合物化学式的一种方法,现进行如下实验:
燃烧法是测定有机化合物化学式的一种方法,现进行如下实验:
(1)将有机物A 置于氧气流中充分燃烧,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重7.2g,碱石灰增重13.2g,消耗氧气8.96L(标准状况下).求该物质中碳氢的原子个数比;
(2)若测的有机化合物的相对分子质量为76,写出该物质的分子式;
(3)已知0.1molA与足量的钠反应生成标准状况下2.24LH2,且两个羟基连在同一个碳原子上不稳定,则A可能的结构有______种. 天为我蓝ル1年前1
天为我蓝ル1年前1 -
 sdo163 共回答了16个问题
sdo163 共回答了16个问题 |采纳率87.5%解题思路:(1)浓硫酸增重7.2g为生成的水的质量,碱石灰增重13.2g为燃烧生成CO2的质量,根据原子守恒可求得碳氢的原子的物质的量以及原子个数比;
(2)根据相对分子质量结合原子的个数之比确定有机物的化学式;
(3)根据有机物的同分异构体的书写方法来解答.(1)将有机物A 置于氧气流中充分燃烧,生成物依次通过浓硫酸和碱石灰,浓硫酸增重7.2g,即生成水的质量是7.2g,物质的量是[7.2g/18g/mol]=0.4mol,含有氢原子是0.8mo,l碱石灰增重13.2g,即生成二氧化碳物质的量是[13.2g/44g/mol]=0.3mol,含有碳原子的物质的量是0.3mol,所以碳氢原子个数之比是0.3mol:0.8mol=3:8,答:该物质中碳氢的原子个数比3:8;
(2)消耗氧气8.96L(标准状况下),物质的量是[8.96L/22.4L/mol]=0.4mol,根据氧元素守恒,有机物中含有的氧原子的物质的量是0.3mol×2+0.4mol-0.4mol×2=0.2mol,有机物中的碳、氢、氧个数之比=0.3:0.8:0.2=3:8:2,有机化合物的相对分子质量为76,分子式为:C3H8O2,
答:该物质的分子式为C3H8O2;
(3)根据分子式C3H8O2知道,该有机物中的碳原子全部是饱和碳原子,0.1molA与足量的钠反应生成标准状况下2.24L即0.1molH2,含有两个醇羟基,两个羟基不能再同一个碳原子上,可以在不同的碳原子上,可以是1,2-丙二醇,还可以是1,3-丙二醇,共2种.
故答案为:2.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式的确定、限制条件同分异构体的书写,题目中等,注意把握题中信息.1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称
 燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重10.8g,乙装置增重22g.求该烃的化学式,并写出其所有的结构简式.
燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重10.8g,乙装置增重22g.求该烃的化学式,并写出其所有的结构简式.  二41年前1
二41年前1 -
 Apan0206 共回答了15个问题
Apan0206 共回答了15个问题 |采纳率93.3%解题思路:根据浓硫酸具有吸水性,增重10.8g,为水的质量,可求得烃中H原子个数,生成物通入NaOH溶液,增重的质量为二氧化碳的质量,可求得烃中C原子个数,以此可求得烃的分子式.然后根据碳链异构来写结构简式.浓硫酸具有吸水性,增重10.8g,为水的质量,则n(H2O)=[10.8g /18g/mol ]=0.6mol,
n(H)=2n(H2O)=2×0.6mol=1.2mol,即0.1mol烃中含有1.2molH原子,所以该烃分子中H原子个数为12,
生成物通入NaOH溶液,增重的22g质量为二氧化碳的质量,
则n(CO2)=[22g /44g/mol ]=0.5mol,n(C)=n(CO2)=0.5mol,
即0.1mol烃中含有0.5molC原子,所以该烃分子中C原子个数为5,
所以该烃的分子式为C5H12,其结构简式为:CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C,
答:该烃的化学式C5H12,其结构简式为CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C.点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查有机物分子式的确定以及同分异构体的书写,题目难度不大,注意把握题中信息.1年前查看全部
- 下列装置使用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质
下列装置使用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质
1、b中盛放的物品是()
2、若去掉B装置会对()元素的测量结果有影响
3、E装置中所盛放物质最好选用()(选填:a、氢氧化钙溶液 b、氢氧化钠溶液 c、水)
4、若准确称取1.12g样品(样品只含C、H、O三种元素中的两种或三种),经充分燃烧后,D装置增重1.44g,E装置增重3.52g,通过计算,确定该有机物样品中所含的元素为()
5、如果有机物中除了C、H、O三种元素外,还有其他元素,这个装置能不能检测出来
以上要说明原因,特别是第五问

b指的是放干燥剂的装置
下图所示装置是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成.(已知:C中的氧化铜可确保有机物中的碳元素完全转化为二氧化碳.A中的反应为2H2O2=2H2O +O2↑) friedegg1年前1
friedegg1年前1 -
 cz7677 共回答了17个问题
cz7677 共回答了17个问题 |采纳率100%1. 碱石灰 为了吸收空气中的水分
2. 氢 浓硫酸吸水性
3 a 目的是吸收二氧化碳,这样有沉淀可以测量
4 1.44g / 18mol/L =0.08mol H20
3.52g / 44g/mol= 0.08mol CO2
这样, H 的质量为 0.08mol * 1g/mol *2 =0.16g
C 的质量为 0.08mol *12g/mol =0.96g
C H 总质量 1.12g
其质量恰好等于准确称取的1.12g样品
所以, 确定该有机物样品中所含的元素为 C H
5 不能,对于氧的质量我们只是间接计算得到.
如果C H 总质量1年前查看全部
- 塑料PS和ABS的鉴别方法直观法和燃烧法?如燃烧后拉丝的情况是怎么样的?
 zxscm1年前1
zxscm1年前1 -
 风的样子 共回答了14个问题
风的样子 共回答了14个问题 |采纳率92.9%先是看颜色,PS的颜色偏白,ABS偏黄,再一个是听声音,轻轻的摔在地板砖上或由空中自由落下,声音清脆的是PS,声音比较沉闷的是ABS,燃烧后拉丝效果不是很明显,相对来说PS要比ABS拉丝长一些.1年前查看全部
- 用燃烧法鉴别乙醇,苯和四氯化碳
 渝风暴1年前3
渝风暴1年前3 -
 zttaigzy 共回答了19个问题
zttaigzy 共回答了19个问题 |采纳率94.7%乙醇的火焰淡蓝色或黄橙色1年前查看全部
- 燃烧法是测定有机化合物化学式的一种方法,现进行如下实验:
燃烧法是测定有机化合物化学式的一种方法,现进行如下实验:
(1)将有机物A 置于氧气流中充分燃烧,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重8.8g,消耗氧气6.72L(标准状况下).求该物质中各元素的原子个数比.
(2)质谱仪测定有机化合物的相对分子质量为46,写出该物质的分子式.
(3)根据价键理论,预测A的可能结构,写出一种结构简式. lsy80441年前1
lsy80441年前1 -
 fyy2006 共回答了16个问题
fyy2006 共回答了16个问题 |采纳率100%解题思路:(1)浓硫酸增重为水的质量,碱石灰增重为二氧化碳的质量,以此可确定有机物中C、H原子个数比值,结合消耗氧气的体积可确定有机物中各原子个数比值;
(2)根据有机物原子个数比值可确定最简式,结合相对分子质量可确定有机物分子式;
(3)根据有机物分子式结合价键理论可确定有机物的可能结构.(1)由题意可知n(H2O)=[5.4g/18g/mol]=0.3mol,n(CO2)=[8.8g/44g/mol]=0.2mol,n(O2)=[6.72L/22.4L/mol]=0.3mol,
根据氧原子守恒可知有机物中含有n(O)=0.3mol+0.2mol×2-0.3mol×2=0.1mol,
则有机物中N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1,
答:该物质中各元素的原子个数比为N(C):N(H):N(O)=2:6:1;
(2)该物质中各元素的原子个数比为N(C):N(H):N(O)=2:6:1,则最简式为C2H6O,其相对分子质量为46,则有机物的分子式为C2H6O,
答:有机物的分子式为C2H6O;
(3)有机物的分子式为C2H6O,分子中可能存在C-C、C-H、C-O、O-H等化学键,可能的结构简式有CH3CH2OH或
CH3OCH3,
答:有机物的结构简式可能为CH3CH2OH或CH3OCH3.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题综合考查有机物的分子的确定,题目难度中等,注意从质量守恒的角度计算有机物的分子式.1年前查看全部
- 燃烧法是测定有机化合物分子式的一种重要方法.请回答下列问题:
燃烧法是测定有机化合物分子式的一种重要方法.请回答下列问题:
(1)下列物质完全燃烧时,生成的二氧化碳与水的物质的量之比为1:2的是______(填序号)
①CH4 ②C2H6 ③C3H6④C6H6
(2)0.1mol某烃B完全燃烧后,生成的CO2气体体积为4.48L(STP),生成的水为5.4g.试通过计算(写出计算过程)推导烃B的分子式. 富贵小熊1年前1
富贵小熊1年前1 -
 鼻子出汗 共回答了19个问题
鼻子出汗 共回答了19个问题 |采纳率94.7%解题思路:(1)物质完全燃烧时,生成的二氧化碳与水的物质的量之比为1:2,则有机物中碳原子和氢原子的个数之比是1:4;
(2)根据CO2气体体积计算C原子的物质的量,根据水的质量计算H原子的物质的量,进而根据烃的物质的量可计算烃的分子式,从而可确定结构简式.(1)物质完全燃烧时,生成的二氧化碳与水的物质的量之比为1:2,则有机物中碳原子和氢原子的个数之比是1:4,只有①符合,故答案为:①;
(2)生成的CO2气体体积为4.48L(STP)即0.2mol,所以n(C)=n(CO2)=0.2mol;
生成的水为5.4g,即0.3mol,所以n(H)=2n(H2O)=0.6mol;n(烃):n(C):n(H)=0.1:0.2:0.6=1:2:6,所以烃B的分子式为:C2H6,
答:烃B的分子式为C2H6.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查烃的分子式的确定,题目难度不大,本题注意计算出1mol烃中含有C、H原子的物质的量可计算烃的分子式.1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称
燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重10.8g,乙装置增重22g.求该烃的化学式,并写出其所有的结构简式.

 dengzq1年前2
dengzq1年前2 -
 伊崎神话 共回答了15个问题
伊崎神话 共回答了15个问题 |采纳率86.7%解题思路:根据浓硫酸具有吸水性,增重10.8g,为水的质量,可求得烃中H原子个数,生成物通入NaOH溶液,增重的质量为二氧化碳的质量,可求得烃中C原子个数,以此可求得烃的分子式.然后根据碳链异构来写结构简式.浓硫酸具有吸水性,增重10.8g,为水的质量,则n(H2O)=10.8g 18g/mol =0.6mol,n(H)=2n(H2O)=2×0.6mol=1.2mol,即0.1mol烃中含有1.2molH原子,所以该烃分子中H原子个数为12,生成物通入NaOH溶液,增...
点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查有机物分子式的确定以及同分异构体的书写,题目难度不大,注意把握题中信息.1年前查看全部
- 燃烧法是测定有机物分子式的一种重要方法.完全燃烧0.1mol某泾后,测得生成气体分别通过浓硫酸和澄清石灰水憎重分别10.
燃烧法是测定有机物分子式的一种重要方法.完全燃烧0.1mol某泾后,测得生成气体分别通过浓硫酸和澄清石灰水憎重分别10.8克和22克,请通过计算
1)推导该泾的分子式
2)写出它可能存在的全部结构的简式
急 神奇一号1年前1
神奇一号1年前1 -
 sellio 共回答了20个问题
sellio 共回答了20个问题 |采纳率75%1.C5H12
C:22*(12/44)/12=0.5mol
H:10.8*(2/18)/18=1.2mol
0.1mol烃含有0.5mol C和1.2mol H,所以分子式是C5H12.
2.正戊烷:CH3CH2CH2CH2CH3
异戊烷:CH3CH(CH3)CH2CH3
新戊烷:C(CH3)41年前查看全部
- 下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是:在电炉加热时用纯净的氧气氧化管内样品
下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是:在电炉加热时用纯净的氧气氧化管内样品
根据产物的质量确定有机物的组成(已知:C中的氧化铜是确保有机物中的碳元素完全转化为二氧化碳;)若去掉B装置会对--元素的测量结果有影响.为什么

 lucky_tutu1年前1
lucky_tutu1年前1 -
 czy66 共回答了22个问题
czy66 共回答了22个问题 |采纳率90.9%D是用于测定有机物中的H元素,计测定H与氧化铜反应后生成的水.如果不用B反应体系里的水将会被带入D中,干扰测定.1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称
燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧0.1mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重10.8g,乙装置增重22g.求该烃的化学式,并写出其所有的结构简式.

 李金润1年前3
李金润1年前3 -
 阿兰王 共回答了21个问题
阿兰王 共回答了21个问题 |采纳率85.7%解题思路:根据浓硫酸具有吸水性,增重10.8g,为水的质量,可求得烃中H原子个数,生成物通入NaOH溶液,增重的质量为二氧化碳的质量,可求得烃中C原子个数,以此可求得烃的分子式.然后根据碳链异构来写结构简式.浓硫酸具有吸水性,增重10.8g,为水的质量,则n(H2O)=[10.8g /18g/mol ]=0.6mol,
n(H)=2n(H2O)=2×0.6mol=1.2mol,即0.1mol烃中含有1.2molH原子,所以该烃分子中H原子个数为12,
生成物通入NaOH溶液,增重的22g质量为二氧化碳的质量,
则n(CO2)=[22g /44g/mol ]=0.5mol,n(C)=n(CO2)=0.5mol,
即0.1mol烃中含有0.5molC原子,所以该烃分子中C原子个数为5,
所以该烃的分子式为C5H12,其结构简式为:CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C,
答:该烃的化学式C5H12,其结构简式为CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C.点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查有机物分子式的确定以及同分异构体的书写,题目难度不大,注意把握题中信息.1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.取0.1mol某烃完全燃烧,燃烧产物依次通过如图所示的装置,实验结束后,称得
 燃烧法是测定有机化合物化学式的一种重要方法.取0.1mol某烃完全燃烧,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重5.4g,乙装置增重26.4g
燃烧法是测定有机化合物化学式的一种重要方法.取0.1mol某烃完全燃烧,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重5.4g,乙装置增重26.4g
(1)求该烃的分子式
(2)该烃不能因化学反应使溴水和酸性KMnO4溶液褪色,写出其二氯代物可能的结构简式. long200320041年前1
long200320041年前1 -
 震慑1975 共回答了17个问题
震慑1975 共回答了17个问题 |采纳率94.1%解题思路:(1)甲装置增重为水的质量,乙装置增重为二氧化碳的质量,根据质量可计算C、H原子的物质的量,进而求得该有机物的分子式;
(2)根据性质确定该烃为苯,二氯代物有邻间对三种.(1)甲装置增重为水的质量,乙装置增重为二氧化碳的质量,
则n(H2O)=[5.4g/18g/mol]=0.3mol,n(H)=0.6mol,
则1mol烃中含有6molH原子,
n(CO2)=[26.4g/44g/mol]=0.6mol,n(C)=0.6mol,
则1mol烃中含有6molC原子,
所以该烃的分子式为C6H10,
答:该烃的化学式为C6H6;
(2)该烃不能因化学反应使溴水和酸性KMnO4溶液褪色,故为苯,二氯代物为邻间对三种,结构简式为

 ,
,
答:结构简式为

 .
.点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查有机物分子式的确定,题目难度不大,注意计算分子式的角度,注意结构简式的书写.1年前查看全部
- 用燃烧法去除空气中的氧气,更适宜用红磷还是蜡烛?为什么?
 垠洁1年前1
垠洁1年前1 -
 默默莫莫 共回答了18个问题
默默莫莫 共回答了18个问题 |采纳率100%用红磷,蜡烛燃烧生成的二氧化碳在水里的溶解度不大,实验效果不够理想,红磷燃烧后的是固体的五氧化二磷,效果好1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.完全燃烧0.1mol某碳氢化合物后,测得生成的二氧化碳为8.96L(标准状况
燃烧法是测定有机化合物化学式的一种重要方法.完全燃烧0.1mol某碳氢化合物后,测得生成的二氧化碳为8.96L(标准状况),生成的水为9.0g.据此求该化合物的分子式,并写出其结构简式.
 sired1年前1
sired1年前1 -
 原来什么都不是 共回答了18个问题
原来什么都不是 共回答了18个问题 |采纳率94.4%生成0.4mol CO2 和 0.5mol H2O,因为是0.1mol碳氢化合物生成的,所以可以知道是C4H101年前查看全部
- 燃烧法证明空气组成是一种混合物质的原理
 uu结束1年前1
uu结束1年前1 -
 极oo分子 共回答了21个问题
极oo分子 共回答了21个问题 |采纳率95.2%不知道你具体的实验步骤啊,我怎么看原理了?
即使是相同名字的实验由于步骤不同,而原理可能完全不同啊
可以设计一个实验,你可以在一个密闭的透明容器,里面充满空气,使气压和大气压相等,让后加入过量的点燃的红磷,使其燃烧到熄灭为止,然后扣入水中,打开一端,观察水是否浸满容器,如果没有,则说明空气不是单一组成,也就是混合物了.有条件的话 可以直接扣入水中,用电火花点燃红磷,这样密闭性更好,实验更严谨.
这原理有2个 一是氧气和红磷反应生成五氧化二磷,是固体.
2是利用大气压的原理,如果空气单一的话,燃烧完全 则容器是真空的,水就会在大气压的压力下压入容器,容器被完全充满1年前查看全部
- 用燃烧法除去密闭容器中空气成分中的氧气,又不增加其他气体成分,为什么选择红磷?为什么?
 hzs19971年前4
hzs19971年前4 -
 lixizhi 共回答了15个问题
lixizhi 共回答了15个问题 |采纳率100%生成的是P2O5是固体~
再补充下,比如碳啊生成的是CO2气体,S是SO2气体,所以都不行~1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧多.zmol某烃,燃烧产物依次通过如图所示的装置,实验结束后,称
燃烧法是测定有机化合物化学式的一种重要方法.现在完全燃烧多.zmol某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重4.4g.则该烃的化学式为______.
 陈建行1年前1
陈建行1年前1 -
 手机短信oo 共回答了18个问题
手机短信oo 共回答了18个问题 |采纳率100%解题思路:图中装置甲是利用浓硫酸的吸水性吸收该有机化合物燃烧所产生的水,浓碱液吸收二氧化碳,所以甲、乙装置增加的质量就是该有机化合物燃烧所产生的水和二氧化碳的质量,根据n=[m/M]计算出二氧化碳和水的物质的量,根据质量守恒可知0.1mol该有机物分子中C、H的物质的量,据此可以确定该有机物分子式.甲装置增重3.大g为该有机物燃烧生成水的质量,则水的物质的量n(八他5)=[3.大g/18g/m5l]=0.他m5l,n(八)=他n(八他5)=0.vm5l,
乙装置中浓碱液增加的质量就是0.1m5l该有机化合物燃烧所产生的二氧化碳的质量,二氧化碳的物质的量为:n(C5他)=[v.vg/vvg/m5l]=0.1m5lm5l,n(C)=n(C5他)=0.1m5l,
0.1m5l该有机物分子中含有0.1m5lC、0.vm5l八原子,则1m5l该有机物中含有1m5lC、vm5l八,
所以该有机物的分子式为:C八v,
故答案为:C八v.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查了常见有机物分子式确定的计算,题目难度不大,注意掌握确定有机物分子式、结构简式的方法,要求学生能够根据质量守恒确定有机物的分子式.1年前查看全部
- 燃烧法是测定有机化合物分子式的一种重要方法.下列是通过燃烧法推断物质组成的过程,请回答下列问题:
燃烧法是测定有机化合物分子式的一种重要方法.下列是通过燃烧法推断物质组成的过程,请回答下列问题:
(1)某物质A在氧气中完全燃烧只生成二氧化碳和水.则说明______(填选项符号)
A.A一定是烃
B.A一定含有C、H两种元素,肯定不含氧元素
C.A一定含有C、H两种元素,可能含有氧元素
D.A一定含有C、H、O三种元素
(2)0.05mol某烃B完全燃烧后,生成的CO 2 气体体积为4.48L(STP),生成的水为4.5g.试通过计算(写出计算过程)推导烃B的分子式.并写出它可能存在的结构简式. 2xiaosuan1年前1
2xiaosuan1年前1 -
 yz28xr 共回答了14个问题
yz28xr 共回答了14个问题 |采纳率92.9%(1)烃和烃的含氧衍生物燃烧时都能生成二氧化碳和水,某物质A在氧气中完全燃烧只生成二氧化碳和水,说明含有C、H元素,也可能含有氧元素,故答案为:C;
(2)n(C)=n(CO 2 )=
4.48L
22.4L/mol =0.2mol,
n(H)=2n(H 2 O)=2ⅹ
4.5g
18g/mol =0.5mol,
n(烃):n(C):n(H)=0.05:0.2:0.5=1:4:10,
烃B的分子式为:C 4 H 10 ,
可能的结构简式为:CH 3 CH 2 CH 2 CH 3 、CH 3 CH(CH 3 )CH 3 ,
答:烃B的分子式为:C 4 H 10 ,可能的结构简式为:CH 3 CH 2 CH 2 CH 3 、CH 3 CH(CH 3 )CH 3 .1年前查看全部
大家在问
- 1生物膜对保证细胞生命活动正常进行具有重要的作用.下列有关叙述错误的是( )
- 2Are you thirteen years oid?做否定回答
- 3一个正方体的底面面积是25平方米,它的表面积是多少平方米?
- 4小学语文第六课怀念母亲的感受
- 5主语从句与宾语从句.定语从句的区别!
- 6甲到乙长途汽车原行驶7小时,开通公路,路程缩短45千米,车速平均每时增加30千米,只行驶4小时到达,甲乙公路长
- 7(喻)可以组什么词语5个以上,越快追加的分越多
- 8比喻按照惯例处理的公事,只重形式,不讲实效的成语有
- 9借助计算器,用二分法求方程2x=3-lgx在区间(1,2)内的近似解(精确度0.01).
- 10英语排序题英语排序[1~10].( )I like oranges very much.( )Do you like s
- 11急,绵阳市实验中学2013年秋初三期末模拟检测物理答案
- 12某三地房屋在两至日的阳光照射情况,确定日期和纬度
- 13表示到处都旅游过了的成语或词语不要像“走南闯北”这样的,因为它表示闯荡.另外,动词+词语/成语也可以.急用!其实重点是“
- 14凡尔赛宫1文章从-----,----,------那三方面说明了凡尔赛宫是人类艺术宝库中的一颗明珠
- 15阅读下面这首诗,然后回答问题。同诸隐者夜登四明山施肩吾注半夜寻幽上四明,手攀松桂触云行。相呼已到无人境,何处玉萧吹一声。

