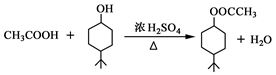
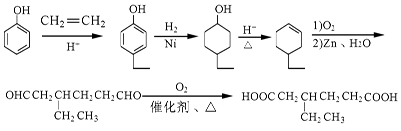
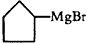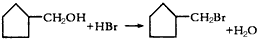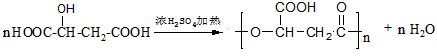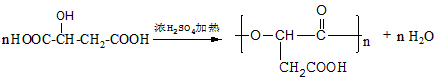有机合成 合成双醋瑞因的合成路线
 sunjianhua2022-10-04 11:39:542条回答
sunjianhua2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 寻爱的狗 共回答了16个问题
寻爱的狗 共回答了16个问题 |采纳率100%
一、芦荟大黄素(2)的制备
在反应瓶中,加入坝巴甙15g(0.036mol),三氯化铁75g(0.46mol)、水230ml,加热搅拌回流7h.反应毕,冷却,过滤,滤饼用水洗涤,干燥.将所得固体置索氏提取器中用甲苯提取,回收溶剂,得粗品(2).用冰乙酸重结晶,得精品(2)7.5g(77.16%),mp
216~218℃.
二、三乙酰芦荟大黄素(2)的制备
在干燥反应瓶中,加入乙酸酐30ml和吡啶30ml的混合液后,搅拌,加入(2)2.8g
(0.0lmol),于48~52℃继续搅拌20h.反应毕,将反应物倒入冰水中,析出黄色固体,过滤,滤饼水洗涤,干燥,得粗品(3).用苯重结晶,得黄色针状结晶精品(3)3.69g
(99.2%),mp
197~199℃.
三、双醋瑞因(1)的合成
在干燥反应瓶中,加入乙酸酐1ml、冰乙酸130ml,加入(3)500mg(0.001mol),搅拌,于50℃左右滴加三氧化铬500mg(5mmol)和水1ml的溶液,滴毕,滴加冰乙酸15ml,加毕,于65~70℃继续搅拌3h.反应毕,将反应液倒入冰水中,过滤,滤饼用水洗涤,干燥,得粗品(1).用二氧六环重结晶,得淡黄色结晶精品(1)300mg(652%),mp
237~238℃.- 1年前
 飘去飘来的云 共回答了1个问题
飘去飘来的云 共回答了1个问题 |采纳率- 你可以咨询张家港和诺
- 1年前
相关推荐
- 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图A装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图A装置制备乙酸乙酯.

(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:______.与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是______.
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是______mL和______mol•L-1.实验编号 试管Ⅰ中试剂 试管Ⅱ中试剂 有机层的厚度/cm A 2mL乙醇、1mL乙酸、
1mL 18mol•L-1浓硫酸饱和Na2CO3溶液 3.0 B 2mL乙醇、1mL乙酸 0.1 C 2mL乙醇、1mL乙酸、
3mL 2mol•L-1 H2SO40.6 D 2mL乙醇、1mL乙酸、盐酸 0.6
②分析实验______(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为______.
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.图中______内为适当的试剂,______内为适当的分离方法.
①试剂a是______;分离方法②是______,分离方法③是______.分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后______(填标号).
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出
②在得到的A中加入无水碳酸钠粉末,振荡,目的是______.
(5)为充分利用反应物,甲、乙两位同学分别设计了如图甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是______. xieyiyahoo1年前1
xieyiyahoo1年前1 -
 michaellongwang 共回答了12个问题
michaellongwang 共回答了12个问题 |采纳率100%解题思路:(1)羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水;
球形干燥管容积较大,利于乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用;
(2)①对比试验关键是要采用控制变量,即控制一个变量,其它条件不变;
②分析使用浓硫酸和稀硫酸的稀硫酸的实验,比较哪种条件下生成的乙酸乙酯多;
(3)先判断过量情况,根据反应方程式及不足量计算出生成乙酸乙酯的质量,然后计算出乙酸乙酯的产率;
(4)①由分离流程可知,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,乙酸乙酯的密度小于水,分层后乙酸乙酯在上层,下层为水层,先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出;
②无水碳酸钠粉末是一种良好的吸水剂,可以除掉乙酸乙酯中混有的少量水;
(5)根据图中甲、乙两个装置的不同点和制取乙酸乙酯的反应原理进行解答;(1)羧酸与醇发生的酯化反应中,羧酸中的羧基提供-OH,醇中的-OH提供-H,相互结合生成水,其它基团相互结合生成酯,同时该反应可逆,反应的化学方程式为
CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O;球形干燥管容积较大,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用,
CH3CO18OC2H5+H2O;球形干燥管容积较大,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用,
故答案为:冷凝和防止倒吸;
(2)①本题是研究实验D与实验C相对照,证明H+对酯化反应具有催化作用的条件,题中采用了一个变量,实验C 2mol•L-1 H2SO4,实验D盐酸,所以达到实验目的,实验D与实验C中H+的浓度一样,实验C 3mL乙醇、2mL乙酸、2mol•L-1 H2SO4,实验D 3mL乙醇、2mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,盐酸体积为4mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为4mol•L-1,
故答案为:3,4;
②对照实验A和C可知:试管Ⅰ中试剂实验A中使用1mL18mol•L-1 浓硫酸,生成的乙酸乙酯比C中生成的乙酸乙酯大很多,说明浓硫酸的吸水性提高了乙酸乙酯的产率,
故答案为:A C;
(3)90g乙酸的物质的量为:[90/60g/mol]=1.5mol,138g乙醇的物质的量为:[138g/46g/mol]=3mol,显然乙醇过量,理论上生成的乙酸乙酯的物质的量需要按照乙酸的量进行计算,根据反应CH3COOH+C2H5OH CH3COOC2H5+H2O可知,理论上生成乙酸乙酯的物质的量为1.5mol,而实际上生成了88g,则乙酸乙酯的产率为:[88g/88g/mol×1.5mol]×100%=66.7%,
CH3COOC2H5+H2O可知,理论上生成乙酸乙酯的物质的量为1.5mol,而实际上生成了88g,则乙酸乙酯的产率为:[88g/88g/mol×1.5mol]×100%=66.7%,
故答案为:66.7%;
(4)①乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可.对水层中的乙酸钠和乙醇进一步分离时应采取蒸馏操作分离出乙醇.然后水层中的乙酸钠,根据强酸制弱酸,要用浓硫酸反应得到乙酸,再蒸馏得到乙酸;乙酸乙酯的密度小于水,分层后乙酸乙酯在上层,下层为水层,先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出;
故答案为:ab;①②③;饱和Na2CO3溶液;蒸馏;蒸馏;D;
②无水碳酸钠粉末是一种良好的吸水剂,可以除掉乙酸乙酯中混有的少量水,
故答案为:除去乙酸乙酯中混有的少量水;
(5)图中甲、乙两个装置的不同点,乙装置能将易挥发的反应物乙酸和乙醇冷凝回流到反应容器中,继续反应,而甲不可,
故答案为:乙.点评:
本题考点: 乙酸乙酯的制取;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了乙酸乙酯的制备、混合物的分离和提纯,题目综合性强,注意掌握乙酸乙酯的制备原理和产物分离和提纯的实验方法,难度中等.1年前查看全部
- (2013•揭阳一模)过渡金属钯催化的偶联反应是近年来有机合成的热点之一,如反应①:
(2013•揭阳一模)过渡金属钯催化的偶联反应是近年来有机合成的热点之一,如反应①:
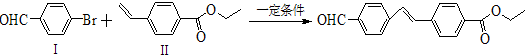
化合物Ⅱ可由以下合成路线获得: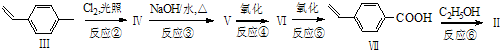
(1)化合物Ⅰ所含官能团的名称为______,化合物Ⅱ的分子式为______.
(2)化合物Ⅳ的结构简式为______,某同学设想无需经反应②、③、④和⑤,直接用酸性KMnO4溶液就可将化合物Ⅲ氧化为化合物Ⅶ,该设想明显不合理,其理由是______.
(3)化合物Ⅶ有多种同分异构体,请写出一种符合下列要求的结构简式.
(i)苯环上有两个取代基______
(ii)1mol 该物质发生银镜反应能生成4mol Ag______
(4)反应⑥的化学方程式为______.(注明条件)
(5)化合物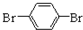 与化合物
与化合物 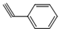 在一定条件下按物质的量之比1:2可发生类似反应①的反应,请写出其产物的结构简式______.
在一定条件下按物质的量之比1:2可发生类似反应①的反应,请写出其产物的结构简式______.  mc10101年前1
mc10101年前1 -
 yangyang_yang 共回答了17个问题
yangyang_yang 共回答了17个问题 |采纳率94.1%解题思路:(1)根据化合物Ⅰ的结构简式判断有机物的官能团;
根据结构简式判断含有的元素种类和原子个数可确定分子式;
(2)由转化关系可知,化合物Ⅲ中甲基上1个H原子被Cl原子取代生成化合物Ⅳ,化合物Ⅳ为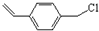 ,化合物Ⅳ发生水解反应生成化合物Ⅴ,则V为
,化合物Ⅳ发生水解反应生成化合物Ⅴ,则V为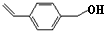 ,化合物Ⅴ连续氧化生成化合物Ⅶ,则化合物Ⅵ为
,化合物Ⅴ连续氧化生成化合物Ⅶ,则化合物Ⅵ为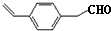 ,化合物Ⅶ与乙醇发生酯化反应生成化合物Ⅱ;
,化合物Ⅶ与乙醇发生酯化反应生成化合物Ⅱ;
某同学设想无需经反应②、③、④和⑤,直接用酸性KMnO4溶液就可将化合物Ⅲ氧化为化合物Ⅶ,其原理是将甲基氧化为-COOH,但酸性KMnO4溶液会氧化化合物Ⅲ中的碳碳双键;
(3)化合物Ⅶ有多种同分异构体,苯环上有两个取代基,1mol 该物质发生银镜反应能生成4molAg,则该同分异构体中含有2个-CHO,故取代基为-CHO、-CH2CHO,有邻、间、对三种位置关系;
(4)反应⑥是化合物Ⅶ与乙醇再浓硫酸、加热条件下发生酯化反应生成化合物Ⅱ;
(5)由反应①可知,化合物Ⅰ提供1个Br原子,化合物Ⅱ中C=C中含有H原子较多的C原子提供1个H原子,脱去1分子HBr,其余基团连接形成化合物,据此书写.(1)化合物I中的官能团名称为溴原子、醛基;
化合物Ⅱ中含有11个C、12个H、2个O,则分子式为C11H12O2,
故答案为:溴原子、醛基;C11H12O2;
(2)由转化关系可知,化合物Ⅲ中甲基上1个H原子被Cl原子取代生成化合物Ⅳ,化合物Ⅳ为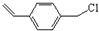 ,化合物Ⅳ发生水解反应生成化合物Ⅴ,则V为
,化合物Ⅳ发生水解反应生成化合物Ⅴ,则V为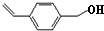 ,化合物Ⅴ连续氧化生成化合物Ⅶ,则化合物Ⅵ为
,化合物Ⅴ连续氧化生成化合物Ⅶ,则化合物Ⅵ为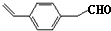 ,化合物Ⅶ与乙醇发生酯化反应生成化合物Ⅱ;
,化合物Ⅶ与乙醇发生酯化反应生成化合物Ⅱ;
某同学设想无需经反应②、③、④和⑤,直接用酸性KMnO4溶液就可将化合物Ⅲ氧化为化合物Ⅶ,其原理是将甲基氧化为-COOH,但酸性KMnO4溶液会氧化化合物Ⅲ中的碳碳双键;
故答案为: ;酸性KMnO4溶液会氧化化合物Ⅲ中的碳碳双键;
;酸性KMnO4溶液会氧化化合物Ⅲ中的碳碳双键;
(3)化合物Ⅶ有多种同分异构体,苯环上有两个取代基,1mol 该物质发生银镜反应能生成4molAg,则该同分异构体中含有2个-CHO,故取代基为-CHO、-CH2CHO,有邻、间、对三种位置关系,符合条件同分异构体为: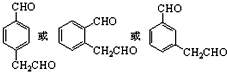 ,
,
故答案为: ;
;
(4)反应⑥是化合物Ⅶ与乙醇在浓硫酸、加热条件下发生酯化反应生成化合物Ⅱ,反应方程式为: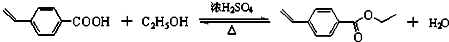 ,
,
故答案为: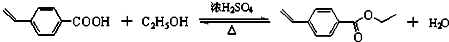 ;
;
(5)化合物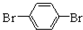 与化合物
与化合物 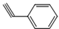 在一定条件下按物质的量之比1:2可发生类似反应①的反应,则
在一定条件下按物质的量之比1:2可发生类似反应①的反应,则 提供2个Br原子,
提供2个Br原子, 中C=C中含有H原子较多的C原子提供1个H原子,脱去2分子HBr,其余基团连接形成化合物,故产物的结构简式为:
中C=C中含有H原子较多的C原子提供1个H原子,脱去2分子HBr,其余基团连接形成化合物,故产物的结构简式为: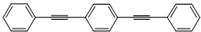 ,
,
故答案为: .
.点评:
本题考点: 有机物的合成;有机物分子中的官能团及其结构;同分异构现象和同分异构体.
考点点评: 本题考查有机物的推断与合成,注意根据转化关系中有机物的结构与反应条件、反应类型进行推断,较好的考查学生的阅读能力,对知识的迁移运用能力,难度掌握.1年前查看全部
- 高中化学竞赛有机化学在有机合成中常见的一些官能团的保护和去保护方法.要有详细的例子和说明.最好能有反应方程式.
 alice_qin1年前2
alice_qin1年前2 -
 xtfby 共回答了20个问题
xtfby 共回答了20个问题 |采纳率95%1.易于被保护基团反应,且除被保护基团外不影响其他基团.
2.保护基团必须经受得起在保护阶段的各种反应条件.
3.保护基团易于除去.
化学合成中常用的保护基
碳氢键的保护
羟基的保护
氨基的保护
羰基的保护
羧基的保护
1. 碳氢键的保护
乙炔及末端炔烃中的炔氢较活泼,它可以与活泼金属`强碱`强氧化剂及有机金属化合物反应.
常用的炔氢保护基为三甲硅基.将炔烃转变为格氏试剂后同三甲基氯硅烷作用.即可引入三甲硅基.该保护基对于金属有机试剂`氧化剂很稳定.可在使用这类试剂的场合保护炔基.
2.羟基的保护
醚类
缩醛和缩酮类
酯类
羟基是一个活性基团,它能够分解格氏试剂和其他有机金属化合物,本身易被氧化,叔醇还容易脱水,并可以发生烃基化和酰基化反应.所以在进行某些反应时,若要保留烃基,就必须将它保护起来.
醇羟基常用的保护方法有3类:
2.1 转变成醚
甲醚
用生成甲醚的方法保护羟基是一个经典方法.通常使用硫酸二甲酯,在氢氧化钠或氢氧化钡存在下,在DMF或DMSO溶剂中反应得到.
优点:该保护基很容易引入,且对酸,碱,氧化剂和还原剂都很稳定.
缺点:难于脱保护,用氢卤酸回流脱保护基条件比较剧烈,常使分子遭到破坏,只有当分子中其他部位没有敏感基团时才适用.
2.1 转变成醚
叔丁醚
将醇的二氯甲烷溶液或悬浮液在 硫酸复合物存在下,在室温与过量的异丁烯作用,可得到叔丁醚.
优点:对碱及催化氢化是稳定的.
缺点:对酸敏感,其稳定性低于甲醚.由于脱保护基所用的酸性条件剧烈,当分子中存在对酸敏感的基团时不适用
2.1 转变成醚
三甲硅醚
三甲硅醚广泛用于保护糖类,甾类及其他醇羟基.通常引入三甲基硅基保护基所用的试剂有三甲基氯化硅和碱;六甲基二硅氨烷.在含水醇溶液中加热回流即可除去保护基.
优点:醇的三甲硅醚对催化氢化,氧化还原反应是稳定的,该保护基可在非常温和的条件下引入和去除.
缺点:对酸和碱敏感,只能在中性条件下使用.
2.2 转变成缩醛或缩酮
2,3-二氢-4H-吡喃在酸的催化作用下,与醇类起加成反应,生成四氢吡喃醚衍生物.这是最常用的醇羟基的保护方法之一.此保护基广泛用于炔醇,甾类及核苷酸的合成中.
2.3 转变成酯
醇与酰卤,酸酐作用生成羧酸酯;与氯甲酸作用生成碳酸酯.
所生成的酯在中性和酸性条件下比较稳定,因此可在硝化`氧化和形成酰氯时用成酯的方法保护羟基.保护基团可通过碱性水解除去,或在锌-铜的乙酸溶液中除去.
3.氨基的保护
伯胺和仲胺很容易被氧化,且易发生烃
基化,酰基化以及与醛酮羰基的亲核加成反
应.在合成中常采用:
(1)氨基质子化
(2)变为酰基衍生物
(3)变为烃基衍生物等方法将氨基保护起来
3.1 质子化
此方法仅用于防止氨基的氧化,因为理论上说
采用氨基质子化,即占据氮尚未共用电子对,以阻
止取代反应的放生.这是对氨基保护最简单的法.
3.2 转变为酰基衍生物
将氨基酰化转变成酰胺是保护氨常用的方法.通常伯胺酰基化已足以保护基,防止其被氧化和烃化反应的发生.常用的酰基化试剂为酰卤和酸酐.
保护基可在酸性和碱性条件下水解出去.
3.2 转变为酰基衍生物
邻苯二甲酸酐与伯胺所生成的邻苯二甲酰亚胺非常稳定,不受催化氢化碱性还原,醇解以及氯化氢,溴化氢,乙酸溶液的影响,也适用于保护伯胺.在酸性或碱性条件下水解或用肼解法脱去保护.
3.3 转变为烃基衍生物
用烃基保护氨基主要用三苯甲基或苯甲
基.
三苯甲基衍生物可用胺与溴或氯代三苯
甲烷在碱存在下制备.三苯甲基由于空间位
阻效应对氨基起到很好的保护作用,它对碱
是稳定的.
苯甲基衍生物用胺和氯化苯甲基在碱存
下制得.
4.羰基的保护
羰基具有许多反应性能,是有机化学中
最易发生反应的活性官能团之一.
保护羰基常用的方法:生成缩醛和缩酮
来降低羰基活性而保护羰基.
4.羰基的保护
保护醛酮羰基最常用的方法是通过乙二醇和2-疏基乙醇的反应,生成相应的叫做环缩醛或缩酮的产物.
5.羧基的保护
羰基通常用形成酯的方法保护.常见的有转变为甲酯,乙酯,叔丁酯,苯甲酯.
甲酯和乙酯可以用羧酸直接与甲醇或乙醇发生酯化反应制得,又可以被碱水解.
5.羧基的保护
叔丁酯可由羧酸先变为酰氯,再与叔丁醇作用,或者通过羧酸与异丁烯直接作用而得.它不能氢解,在通常条件下也不被氨解及碱催化水解.
5.羧基的保护
苯甲酯可由羧酸与苯甲基卤在碱性条件下反应而得.它除了可在强酸性或碱性条件下水解,还可以被氢解.1年前查看全部
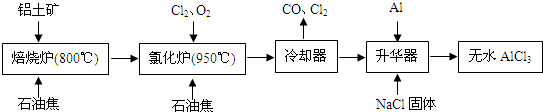
- 无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流
无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下.
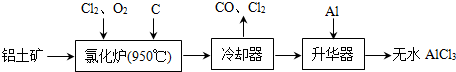
(1)氯化炉中Al2O3、C12和C反应的化学方程式为A12O3+3C12+3C
2A1C13+3CO高温 .A12O3+3C12+3C.
2A1C13+3CO高温 .
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为:______.
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是______.
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①写出除杂过程中涉及的离子方程式:______、______.
②AlCl3产品的纯度为______.
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3•6H2O脱水制备无水AlCl3,实现这一步的方法是______. longhw1年前1
longhw1年前1 -
 我是spy 共回答了26个问题
我是spy 共回答了26个问题 |采纳率92.3%解题思路:(1)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO;
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除去FeCl3;
(4)制备无水AlCl3含有杂质FeCl3,残留固体质量为0.32g为Fe2O3,根据铁原子守恒计算FeCl3质量,进而计算出AlCl3的质量,再根据产品的纯度定义计算.
(5)将AlCl3•6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水(1)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为A12O3+3C12+3C
高温
.
2A1C13+3CO
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去.所以加入少量Al目的是除去FeCl3,
(4)①除杂过程中铁离子与氢氧根离子结合成氢氧化铁沉淀,铝离子与氢氧根离子结合成偏铝酸根和水,离子方程式为:Fe3++3OH-=Fe(OH)3↓Al3++4OH-=AlO2-+2H2O
②根据铁原子守恒,令含有杂质FeCl3质量为m,则
Fe2O3~~~~~2FeCl3
160 325
0.32g m
[160/0.32g=
325
m]
解得,m=0.65g,
所以AlCl3产品的纯度为[16.25g−0.65g/16.25g]×100%=96%,
(5)将AlCl3•6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水
故答案为:(1)A12O3+3C12+3C
高温
.
2A1C13+3CO
(2)SO32-+C12+H2O=SO42-+2C1-+2H+(3)除去FeCl3
(4)①Fe3++3OH-=Fe(OH)3↓Al3++4OH-=AlO2-+2H2O ②96%
(5)在HCl气流中加热脱结晶水点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题考查了考生对自己存储的知识,进行分解、迁移转换、重组,使问题得到解决的应用能力,体现出化学是真实的.能够通过对生产、生活和科学实验中化学现象以及相关数据和图形等的观察,获取有关的感性知识和印象,并运用分析、比较、归纳等方法对所获取的信息进行初步加工和应用的能力.1年前查看全部
- 理查德·赫克、根岸英一和铃木章等三位科学家因在有机合成领域中钯催化交叉偶联反应方面的卓越研究而获得了2010年诺贝尔化学
理查德·赫克、根岸英一和铃木章等三位科学家因在有机合成领域中钯催化交叉偶联反应方面的卓越研究而获得了2010年诺贝尔化学奖。这一成果广泛应用于制药、电子工业和先进材料等领域。碳原子性质不活泼,不会轻易结合,上面三位科学家就是以钯为“媒”撮合碳原子结合在一起。早在一百多年前法国科学家格林尼亚就发明了一种试剂(格氏试剂),利用镁原子强行塞给碳原子两个电子,使碳原子变得活跃。该成果使格林尼亚获得了1912年的诺贝尔化学奖。
已知:①格氏试剂的制备: 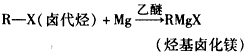
②
③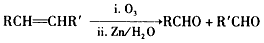
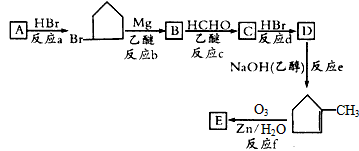
请回答下列问题:
(1)有机化合物A的官能团是________。
(2)B的结构简式是____________。
(3)B生成C的反应中间产物为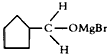 ,该中间产物水解可得C。从有机反应类型看,B生成中间产物
,该中间产物水解可得C。从有机反应类型看,B生成中间产物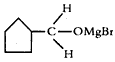 的反应类型属于____________。
的反应类型属于____________。
(4)C生成D的化学方程式为____________________。
(5)该有机合成中从原料物质A到目标产物E碳原子数增加了_____个,增加的碳原子数目决定于____(选择框图中的“反应a”~“反应f”)。 shinan551年前1
shinan551年前1 -
 灯火斑斓你在哪里 共回答了19个问题
灯火斑斓你在哪里 共回答了19个问题 |采纳率89.5%1年前查看全部
- 化学工作者从甲烷与氯气的反应受到启发,提出在农药和有机合成工业可获得副产品盐酸
化学工作者从甲烷与氯气的反应受到启发,提出在农药和有机合成工业可获得副产品盐酸
指出上述反应产物可能用到的最佳分离方法是 F5283188871年前1
F5283188871年前1 -
 求和 共回答了18个问题
求和 共回答了18个问题 |采纳率94.4%氯代后气体通入水中,氯代物与水分层,水溶液为盐酸.如还有氯气未反应完全,加热使氯气分解为盐酸.1年前查看全部
- 化合物M是可降解的聚酯,化合物E是有机合成中间体,一种合成路线如图所示.
化合物M是可降解的聚酯,化合物E是有机合成中间体,一种合成路线如图所示.
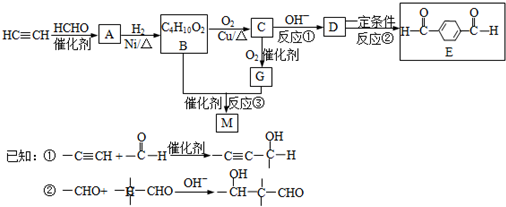
(1)写出反应类型.反应①:______反应;反应②:______ 反应.
(2)写出结构简式.B______; M______.
(3)写出反应①的化学反应方程式______.
(4)写出检验B完全转化为C的方法.所用试剂的化学式______; 实验现象______.
(5)有苯环和4种不同化学环境氢原子且与E互为同分异构体的酯有______种,写出其中的一种同分异构体的结构简式______. mmisme11年前1
mmisme11年前1 -
 gypsyangel 共回答了16个问题
gypsyangel 共回答了16个问题 |采纳率100%解题思路:在催化剂作用下,乙炔和甲醛反应生成A,A和氢气发生加成反应生成B,根据B的分子式知,乙炔和甲醛以1:2反应生成A,所以A的结构简式为:HOCH2C≡CCH2OH,B的结构简式为:HOCH2CH2CH2CH2OH,在铜作催化剂、加热条件下B被氧气氧化生成C,C的结构简式为:OHCCH2CH2CHO,C再被氧化生成G,G的结构简式为:HOOCCH2CH2COOH,B和G发生酯化反应生成M,M是聚酯,所以M的结构简式为: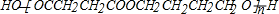 ,
,
C反应生成D,D在一定条件下反应生成E,根据E的结构简式知,D的结构简式为: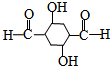 ,结合有机物的结构和性质解答.
,结合有机物的结构和性质解答.
在催化剂作用下,乙炔和甲醛反应生成A,A和氢气发生加成反应生成B,根据B的分子式知,乙炔和甲醛以1:2反应生成A,所以A的结构简式为:HOCH2C≡CCH2OH,B的结构简式为:HOCH2CH2CH2CH2OH,在铜作催化剂、加热条件下B被氧气氧化生成C,C的结构简式为:OHCCH2CH2CHO,C再被氧化生成G,G的结构简式为:HOOCCH2CH2COOH,B和G发生酯化反应生成M,M是聚酯,所以M的结构简式为:
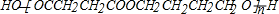 ,
,
C反应生成D,D在一定条件下反应生成E,根据E的结构简式知,D的结构简式为: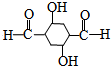 ,
,
(1)①为加成反应,②为消去反应,故答案为:加成,消去;
(2)通过以上分析知,B和M的结构简式分别为:HOCH2CH2CH2CH2OH、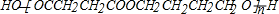 ,
,
故答案为:HOCH2CH2CH2CH2OH、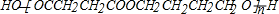 ;
;
(3)碱性条件下,C发生加成反应生成D,反应方程式为: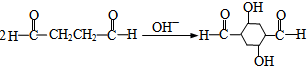 ,故答案为:
,故答案为: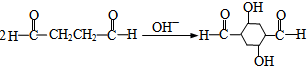 ;
;
(4)C是醇,D是醛,向混合物中加入碱石灰进行蒸馏,蒸馏出产品后加入钠观察是否有气泡产生,如果有气泡产生,说明还存在醇,否则没有醇,故答案为:碱石灰、Na,加碱石灰蒸馏出产品后加钠无气泡产生;
(5)有苯环和4种不同化学环境氢原子且与E互为同分异构体的酯有:乙酸苯酯、甲酸苯甲酯、苯甲酸甲酯,所以有3种,其中一种同分异构体的结构简式为: ,故答案为:3,
,故答案为:3, .
.点评:
本题考点: 有机物的推断.
考点点评: 本题考查有机物的推断,会利用题给信息结合有机物的结构确定发生的反应,同时考查学生知识迁移能力,难点是同分异构体的确定,难度中等.1年前查看全部
- 有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得16.8 g该有机物经燃烧生成44.0 g
有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得16.8 g该有机物经燃烧生成44.0 g
CO 2 和14.4g水,质谱图表明其相对分子质量为84;红外光谱图分析表明A中含有-O-H和位于分子端的
-C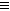 C-,核磁共振氢谱显示有3个峰,且峰面积之比为6:1:1。
C-,核磁共振氢谱显示有3个峰,且峰面积之比为6:1:1。
(1)写出A的分子式:_______。
(2)写出A的结构简式:___________。
(3)下列物质一定能与A发生反应的是__________(填序号)。
a.H 2 b.Na c.KMnO 4 d.Br 2
(4)有机物B是A的同分异构体,l mol B可以与1 mol Br 2 加成,该有机物的所有碳原子在同一平面上,且没有顺反异构现象,则B的结构简式为_______________。 hukq1年前1
hukq1年前1 -
 hoyohoyo 共回答了13个问题
hoyohoyo 共回答了13个问题 |采纳率84.6%1年前查看全部
- 化合物F是一种重要的有机合成中间体,它的合成路线如下:
化合物F是一种重要的有机合成中间体,它的合成路线如下:
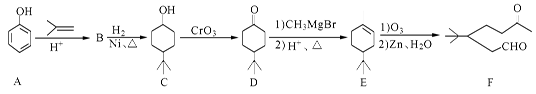
(1)化合物F中含氧官能团的名称是 和 ,由B生成C的化学反应类型是 。
(2)写出化合物C与乙酸反应生成酯的化学方程式:
(3)写出化合物B的结构简式 。
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢原子。写出该
化合物的结构简式 (任写一种)。
(5)请根据已有知识并结合相关信息,写出以苯酚(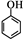 )和CH 2 =CH 2 为原料制备
)和CH 2 =CH 2 为原料制备
有机物 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
H 2 C="=" CH 2 CH 3 CH 2 Br
CH 3 CH 2 Br  CH 3 CH 2 OH
CH 3 CH 2 OH 人间何处1年前1
人间何处1年前1 -
 index82 共回答了19个问题
index82 共回答了19个问题 |采纳率94.7%1年前查看全部
- (2014•揭阳三模)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气
(2014•揭阳三模)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化.从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是______(写化学式).
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:______.
(3)析出CuCl晶体时的最佳pH在______左右.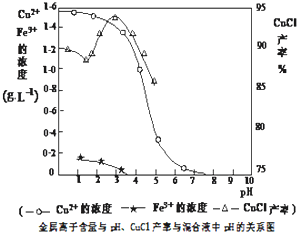
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的目的是______.
(5)从滤液A中可回收的主要物质是______(写化学式).
(6)以碳棒为电极电解CuCl2溶液可得到CuCl.写出电解CuCl2溶液后的阴极上发生的反应为______. 雪与水的纠缠1年前1
雪与水的纠缠1年前1 -
 shenhao00412 共回答了18个问题
shenhao00412 共回答了18个问题 |采纳率94.4%解题思路:电镀废液中加入碱可生成Cu(OH)2、Fe(OH)3沉淀,在pH约为4时,用酸浸得到硫酸铜溶液和氢氧化铁沉淀,在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,最后所得滤液为硫酸亚铁,结合CuCl的性质和题目要求解答该题.(1)电镀废液主要含Cu2+、Fe3+,加入碱可生成Cu(OH)2、Fe(OH)3沉淀,
故答案为:Cu(OH)2、Fe(OH)3;
(2)在硫酸铜溶液中加入氯化钠、铁,发生氧化还原反应生成CuCl,发生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+,
故答案为:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;
(3)由图2可知,析出CuCl沉淀的最佳pH应为CuCl的产率最大,且氢氧化铁杂质较少,应约为3左右,
故答案为:3;
(4)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧化,为防止氧化应隔绝空气,在干燥、真空环境中可加快乙醇和水的蒸发,
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化.
(5)由框图分析可知:滤液A中主要物质是Na2SO4和FeSO4,
故答案为:Na2SO4和FeSO4;
(6)电解CuCl2溶液时,阴极上发生的反应为Cu2+得到电子生成+1价铜,
故答案为:Cu2++Cl-+e-═CuCl↓点评:
本题考点: 金属的回收与环境、资源保护;电解原理;铜金属及其重要化合物的主要性质.
考点点评: 本题考查制备方案的设计,侧重于学生的分析能力和实验能力的考查,注意把握题给信息,答题时注意审题,把握自学能力的培养,难度中等.1年前查看全部
- 有机化学中的"多样性导向有机合成"的概念是什么?
 haozili1年前1
haozili1年前1 -
 HANSWUFE 共回答了21个问题
HANSWUFE 共回答了21个问题 |采纳率85.7%多样性导向合成(diversity-oriented synthesis ,DOS) 概念最初由Schreiber于2000 年提出,它以一种“高通量”(high-throughput)的方式产生“类天然产物”(natural product-like) 的化合物.其合成是从单一的起始原料出发以简便易行的方法合成结构多样、构造复杂的化合物集合体,再对它们进行生物学筛选.它的合成策略遵循正向合成分析法(forward-synthetic analysis),在合成过程中尽量引入多样化的官能团,构建不同的分子骨架,并希望最终建立的小分子化合物库涵盖尽可能多的化学多样性(包括密集的手性官能团、丰富的立体化学和三维结构、以及多样性的化合物骨架).DOS 的筛选目标并不是针对某一类特定的生物靶标,而是为各种靶标寻找新的配体,进而分析细胞和生物体的功能,发现大分子相互作用的“接线图”.1年前查看全部
- 水杨醛可以做什么用水杨醛可以用作分析试剂、香料、有机合成中间体,但是它具体可以用在哪啊
 eone_qiu1年前1
eone_qiu1年前1 -
 野狼22 共回答了15个问题
野狼22 共回答了15个问题 |采纳率100%水杨醛,化学名称为邻羟基苯甲醛,是一种无色或浅褐色油状液体,有杏仁味.沸点196 ℃,熔点- 7 ℃,闪点76 ℃.易溶于醇、醚,微溶于水.
水杨醛又称邻羟基苯甲醛,是一种用途极广泛的精
细化工产品,广泛用于农药、医药、香料、螯合
剂、染料中间体等的合成上.在农药方面,卤代水
杨醛、水杨醛腙和苯腙都是制备除草剂、杀虫剂、
杀菌剂和防腐剂等的重要原料,目前正在开发的一
种新型杀线虫剂也是用水杨醛为原料与2 - 氨基噻
唑席夫碱进行合成的; 在医药方面,水杨醛可用于
制备抗菌药,以及作为生产外消旋垂体促进性腺激
素药的中间体和用于生产拟肾上腺素药和抗咳喘
药; 水杨醛还用于制备香豆素和配制紫罗兰酮等香
料.由水杨醛为原料合成的香豆素,6 - 苄化香豆
素,3 - 甲基香豆素等已被广泛用于肥皂、洗涤剂、
调合香料、糖果和烟草工业; 在国外,水杨醛还是
合成植物微量营养元素的重要成分 ; 水杨醛还
可与多种金属形成螯合剂,广泛应用于石油工业;
水杨醛的许多加成物可提高燃料油、汽油和石油的
高温稳定性; 水杨醛与硝酸反应制得的3 - 硝基水
杨醛、5 - 硝基水杨醛、3 ,5 - 二硝基水杨醛等硝
基水杨醛类都是染料的中间体; 水杨醛也可用于制
备芳基偶氮染料; 另外,水杨醛及其衍生物是吲哚
啉螺苯并吡喃类有机感光材料的原料,并可合成耐
久的毛发整理剂,还用于制备多孔塑料及用作塑料
的抗氧剂、炼油工业用金属钝化剂等.水杨醛本身
也有许多用处,比如,它作为一种增亮剂和均化剂
被广泛用于电镀工业; 低浓度的水杨醛因具有很强
的足以降低细菌活性的能力而常被作为防腐剂用于
香精和香料中等.
到2000 年,世界水杨醛生产能力在6000 吨/
年以上,美国道化学公司和欧洲的罗- 布朗克公司
的产量最大,其中,道化学公司的生产能力超过
1000 吨/ 年.我国年生产能力约1000 吨/ 年,其中
大部分用于香豆素的制备,就香豆素而言,我国是
仅次于法国的世界第二大出口国.近年来水杨醛资
源紧俏,国内、国际市场都很抢手.另外,由于水
杨醛常被作为食品、饮料、烟草、酒、牙膏、化妆
品、香皂、洗涤剂等的重要配料,所以人们就对这
些与生活息息相关的产品生产原料的质量提出了更
高要求.可见研究开发生产水杨醛的经济和绿色的
工艺很有现实意义1年前查看全部
- 在生物学中什么叫有机合成作用?
 最熟悉的陌生man1年前2
最熟悉的陌生man1年前2 -
 luainide 共回答了13个问题
luainide 共回答了13个问题 |采纳率76.9%想 光和作用 呼吸作用 都是有机合成作用
他们都是把有机物和能量的之间相互转化的过程1年前查看全部
- 二甲胺和二乙胺能否在有机合成中作有效的亲核试剂?
二甲胺和二乙胺能否在有机合成中作有效的亲核试剂?
如题. hhpbj1年前1
hhpbj1年前1 -
 青青5120 共回答了22个问题
青青5120 共回答了22个问题 |采纳率90.9%能,取代基的大小对反应活性的影响较大,位阻较大的胺反应活性降低,例如二异丙基乙基胺已完全不能与卤代烷发生作用.
我用二甲胺和二氯乙烷合成四甲基乙二胺,收率很好.1年前查看全部
- 有机合成的意义有哪些以及什么是有机合成 有机合成的任务有哪些
 linanana41年前2
linanana41年前2 -
 只是粉嘟 共回答了28个问题
只是粉嘟 共回答了28个问题 |采纳率89.3%有机合成的 目的主要是合成天然界已经 有 的但数量很少的物质或者合成天然界没 有 的物质.历史上主要 有 3种有机合成设计的方式:(1)由原料开始的装配式合成设计:R.Willst?tter环辛四烯的合成以及E.Fischer关于糖的大量合成工作都是以此方式设计合成的.(2)由历程提出的合成设计:R.Robinson 三步合成莨宕碱以及W.S.Johnson的长叶松烯的全合成.(3)由目标分子出发以逆推思维方式提出的切断法 1967年由E.J.Corey 在前人逻辑推理地构建复杂有机分子的基础上,吸收了计算机程序设计的思维方法,把许多合成反应系统地进行了整理归纳后提出的.切断法合成设计是目前最常用的合成设计方法,逆推思维这一思维方式已经成为科学思维的一种普遍方式.现在有机合成一般的不是说 有 什么原料,想用这种原料能合成什么就合成什么.而是我们 有 目标,比如从天然界发现了一种化合物,它很 有 用可以做药,但是从天然界得到的很少,满足不了医药的需要,那我们就要想办法把它合成.我们的目标物非常明确,在这种情况下该采用什么样的合成路线,用什么原料、什么条件、经过 哪些 反应把它合成出来.如果从各种原料开始考虑,可用的原料 有 很多,有 天然界已经存在的一些简单化合物,或者还 有 一些比较复杂的化合物,也可以用石油化工的产品,这样要考虑的方面可能非常多.假如我们从末端开始考虑,从目标物开始考虑,从目标物的结构特点、可能 有 的性质、可能合成的方法倒着往前推,这个目标物 有 可能用什么反应把它合成,这个反应需要 哪些 原料,这些原料又需要什么样的原料才能把它合成,这么反着推过来就会比较 有 效.1年前查看全部
- 有机合成中乙醇钠的作用.最好详细点.
 geejon11年前1
geejon11年前1 -
 轻轨人生 共回答了14个问题
轻轨人生 共回答了14个问题 |采纳率85.7%用作强碱性催化剂、乙氧基化剂以及作为还原剂用于有机合成、医药合成等.也常使用于有机缩合反应中.
应用乙醇钠的医药产品有苯比妥、保泰松、扑痫酮、甲基多巴、丁卡因盐酸盐、易咳嗪、氨蝶呤、乙胺嘧啶、匹呋氨苄青霉素等.此外,还用于农药及作分析试剂.1年前查看全部
- 在有机合成中怎么通过氧化反应引入羟基?
 yxhlzry1年前1
yxhlzry1年前1 -
 西门吃烧饼 共回答了18个问题
西门吃烧饼 共回答了18个问题 |采纳率77.8%双氧水氧化一元酚产生二元酚,羟基自由基(Fenton试剂)氧化苯生成苯酚
如乙烯氧化法制取乙醛
1.烯烃用稀冷KMnO4溶液或者OsO4氧化,生成顺式邻二醇
2.烯在催化剂存在的条件下,可被氧气氧化成乙醛
乙烯与不同浓度的高锰酸钾溶液酸性溶液反应可被氧化成乙二醇或乙二醛或乙二酸甚至二氧化碳.
侧链与苯环直接相连的碳原子上有氢原子的有机物能被高锰酸钾酸性溶液氧化,侧链转化成羧基,如甲苯或乙苯都能被高锰酸钾酸性溶液氧化成苯甲酸
3.2H2+O2=点燃=2H2O
这里H2O是共价化合物 所以叫羟基是可以的!
你可以参考这个物质的叫法Ca5(PO4)3OH 叫羟基磷酸钙
希望对您有所帮助,祝您工作顺利万事如意,望采纳谢谢!1年前查看全部
- 同分异构的问题有机合成中的写出同分异构体,是不是指题目所给这个分子式,写出所有和这个分子有关的结构,根据题目信息写出合理
同分异构的问题
有机合成中的写出同分异构体,是不是指题目所给这个分子式,写出所有和这个分子有关的结构,根据题目信息写出合理的所有式子,和题目有机合成本身无关吧?给出一个准确的答案,我这个人有点不自信, xx论1年前1
xx论1年前1 -
 看了就跑 共回答了24个问题
看了就跑 共回答了24个问题 |采纳率87.5%如果题目给出的是分子式,就要写出全部的结构;
如果题目给出的是结构式,就要写出除该结构外的其它结构.1年前查看全部
- 如何由丙酸制备戊酸?大学有机合成题
 vsniuniu1年前1
vsniuniu1年前1 -
 lizi0000 共回答了17个问题
lizi0000 共回答了17个问题 |采纳率88.2%丙酸还原成醇,卤代后做成格氏试剂,与溴乙酸甲酯反应生成戊酸甲酯,再水解即得戊酸.1年前查看全部
- 精细有机合成题目,
 zzs1232231年前1
zzs1232231年前1 -
 女大十八变123 共回答了20个问题
女大十八变123 共回答了20个问题 |采纳率90%4.Cannizzaro 反应:没有α——H的醛在浓碱溶液中,一分子氧化成羧酸,另一分子还原成伯醇的反应.1年前查看全部
- 有机合成 乙烯制丁烷 苯甲酸钠制苯己烷
有机合成 乙烯制丁烷 苯甲酸钠制苯己烷
CH2=CH2→……
这种模式 人鬼情未了791年前1
人鬼情未了791年前1 -
 战鹰守护者 共回答了21个问题
战鹰守护者 共回答了21个问题 |采纳率90.5%有很多种呐,没有要求的话我就随便写一种咯~
1.CH2=CH2(+Br2)→CH2Br-CH2Br(强碱醇溶液)→
乙炔C2H2(乙炔自身加成)(催化剂)→
乙烯基乙炔CH2=CH-C2H2(+足量H2)→丁烷
2.苯甲酸钠(酸化)→苯甲酸(+SOCl2)→
C6H5COCl(+C6H13Na)→C6H5COC6H13(+Br2与NaOH)→苯己烷1年前查看全部
- 求硼烷在有机合成中的作用
 春花一笑_qq1年前3
春花一笑_qq1年前3 -
 放声大叫 共回答了20个问题
放声大叫 共回答了20个问题 |采纳率85%还原C=C,反马氏加成
比如将丙烯还原为1-丙醇1年前查看全部
- 搅拌过快是否会更易使溶解的物料析出(关于有机合成)
 三动1年前1
三动1年前1 -
 iamrice 共回答了24个问题
iamrice 共回答了24个问题 |采纳率87.5%如果是处于过饱和状态,是这样的.如果还没饱和,再怎么搅也不会析出.1年前查看全部
- 有机合成中常见卤化试剂
 lfflz1年前1
lfflz1年前1 -
 禁风 共回答了17个问题
禁风 共回答了17个问题 |采纳率88.2%氯气、三氯化磷、五氯化磷、三溴化磷、溴等1年前查看全部
- 英语翻译求2篇有机化学或有机合成的英文文献及其翻译,2000年以后,最好3000字以上
 jickie12341年前0
jickie12341年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有机合成化学题,大学有机合成习题,
有机合成化学题,大学有机合成习题,
2009年,mustafa Er等人发现一种新的化合物作为合成紫杉醇的中间体,该化合物可以一步合成紫杉醇,它的化学式如下:
 请写出该化合物的合成路线.
请写出该化合物的合成路线.
难得编辑化学式的同学们可以直接用写在纸上,用摄像头拍下来, ycl2271年前1
ycl2271年前1 -
 yj_guansheng 共回答了19个问题
yj_guansheng 共回答了19个问题 |采纳率89.5%苯环与氯乙烷在氯化铝存在下烷基化得乙苯,乙苯与氯气光卤代生成1-苯基-1-氯乙烷,再与氢氧化钠醇溶液发生消除反应,产物与氯气加成,在与氢氧化钾醇溶液消去得苯乙炔,硫酸-硫酸汞催化加水,重排得甲基苯基酮,此物有烯醇结构,烯醇式结构与氯化氢反马氏加成得1-苯基-2-氯-1-乙醇,消除得2-苯基-1-氯乙烯,再与银、氧气作用环氧化得2-苯基-1-氯环氧乙烷,再与氰化钠反应,水解得3-苯基-2,3-环氧-1-丙酸,此物与甲醇酯化便得目标产物
有简单的:苯与甲酸酐,氯化铝催化,生成苯甲醛,苯甲醛与一氯乙酸甲酯,乙醇钠作用即得产物(建议你看看布洛芬的旧合成路线)1年前查看全部
- 有机化工工艺和有机合成化学有关系吗
 alg93461年前1
alg93461年前1 -
 某年某月某日晚 共回答了21个问题
某年某月某日晚 共回答了21个问题 |采纳率90.5%当然有关系了,二者都是合成有机物的.只不过前者更偏重于工程及工艺优化,研究对象可能为更基础的有机物;后者更偏重于探讨新化合物,新合成方法.1年前查看全部
- 大学有机合成实验重结晶重结晶提纯法为什么要求溶剂沸点适中,过高为什么依附在晶体表面的溶剂不易除去?
 Aphrodite04101年前1
Aphrodite04101年前1 -
 sangexiaotian 共回答了15个问题
sangexiaotian 共回答了15个问题 |采纳率93.3%高沸点的粘度大呀 很难蒸发的1年前查看全部
- 有机合成中解释题: %e.e.表达式:
有机合成中解释题: %e.e.表达式:
rt 我爱10131年前1
我爱10131年前1 -
 bzzuu 共回答了19个问题
bzzuu 共回答了19个问题 |采纳率94.7%对映体过量百分率1年前查看全部
- 有机合成中Ar表示什么基团?
 yyyyfrswzyy1年前1
yyyyfrswzyy1年前1 -
 琪囡囡 共回答了15个问题
琪囡囡 共回答了15个问题 |采纳率93.3%表示芳环基团,比如苯基,萘基等,有简单取代的芳环也可以用Ar—表示.1年前查看全部
- 常用的有机化学试剂有哪些?我指有机合成,大学范围
 lyh59031年前1
lyh59031年前1 -
 小裸那耳朵 共回答了21个问题
小裸那耳朵 共回答了21个问题 |采纳率90.5%大学范围的有机合成反应那么多,光人名反应就100多个,不知道你到底指的是什么?这么笼统的很难回答的.1年前查看全部
- 大学 有机合成 简答题1、请解释什么叫“官能团转换”.为什么要进行官能团转换?官能团转换有哪些类型?2、简要介绍催化氢化
大学 有机合成 简答题
1、请解释什么叫“官能团转换”.为什么要进行官能团转换?官能团转换有哪些类型?
2、简要介绍催化氢化主要用于还原哪些有机化合物,产物是什么?
3、简要介绍硼烷主要用于还原哪些有机化合物,产物是什么?
4、 电子效应和立体效应是影响有机化学反应选择性的两大主要因素,请各举一例说明二者怎样影响反应的选择性.
5、在有机合成中,使用强氧化剂、强还原剂时通常会有哪些危险性?怎样避免? hustly1年前1
hustly1年前1 -
 ndgtf78ne_0af2 共回答了7个问题
ndgtf78ne_0af2 共回答了7个问题 |采纳率100%1 利用有机物的化学反应实现官能团转换是制备有机化合物的基本方法,实现目标分子的合成.类型有羟基的转换、氨基的转换、含卤化合物的转换、硝基的转换、氰基的转换、醛和酮的转换、羧酸及其衍生物的转换.
2 碳碳双键、三键,产物烷烃;醛酮,产物为醇;芳环,产物,环烷烃;腈和硝基化合物,产物为胺
3 很多
将羧基、醛酮、酸酐还原为醇,氰基还原为胺,其他羰基也能被还原,如酰胺、酯中的羰基
4 如1-苯基-2-丙醇的消除反应,丙烯苯产量比烯丙苯多,电子效应;卤代烃的水解,位阻影响反应速率
5 会发生剧烈化学反应引起燃烧爆炸、中毒污染.应分开存放.1年前查看全部
- 合成材料与有机合成材料一样么
 wila1年前2
wila1年前2 -
 wanhaicheng 共回答了18个问题
wanhaicheng 共回答了18个问题 |采纳率88.9%合成材料包括无极、有机、高分子及其他合成材料
有机合成材料仅包括有机物类别的合成材料1年前查看全部
- (2014•金山区一模)2-氯丁烷常用于有机合成等,有关2-氯丁烷的叙述正确的是( )
(2014•金山区一模)2-氯丁烷常用于有机合成等,有关2-氯丁烷的叙述正确的是( )
A.分子式为C4H8Cl2
B.与硝酸银溶液混合产生不溶于稀硝酸的白色沉淀
C.微溶于水,可混溶于乙醇、乙醚、氯仿等多数有机溶剂
D.与氢氧化钠、乙醇在加热条件下的消去反应有机产物只有一种 tsgtsg11年前1
tsgtsg11年前1 -
 anne_216 共回答了17个问题
anne_216 共回答了17个问题 |采纳率94.1%解题思路:A、2-氯丁烷可以看作丁烷中一个氢原子被氯原子取代,分子式为C4H9Cl;
B、2-氯丁烷分子在溶液中不会电离出电离出氯离子,与硝酸银溶液不会生成氯化银沉淀;
C、2-氯丁烷在水中溶解度不大,易溶于有机溶剂;
D、2-氯丁烷与氢氧化钠的醇溶液加热发生消去反应,生成的烯烃有两种:正丁烯和2-丁烯.A、2-氯丁烷分子中含有一个氯原子,分子式为分子式为C4H9Cl,故A错误;
B、2-氯丁烷不会电离出氯离子,不会与硝酸银溶液反应生成白色沉淀,故B错误;
C、2-氯丁烷在水中溶解度不大,但易溶于乙醇、乙醚、氯仿等多数有机溶剂,故C正确;
D、2-氯丁烷发生消去反应可以生成两种烯烃:正丁烯和2-丁烯,故D错误;
故选C.点评:
本题考点: 卤代烃简介.
考点点评: 本题考查了有机物的组成、结构与性质,题目难度不大,注意掌握常见有机物的结构与性质,根据卤代烃的知识进行解答即可,试题培养了学生的知识迁移能力.1年前查看全部
- 有机合成题,原料为乙酰乙酸乙酯求助!
有机合成题,原料为乙酰乙酸乙酯求助!
用A如何合成B和C啊!
 真夏的uu1年前1
真夏的uu1年前1 -
 77loveFK 共回答了14个问题
77loveFK 共回答了14个问题 |采纳率92.9%合成B的时候先用乙醇钠处理再加CH3CH2CH2Br,再加CH3Br.然后再在稀碱性水解
合成C的时候先用乙醇钠处再加CH3CH2CH2Br,再加CH3Br.然后再在强碱性水解1年前查看全部
- 氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu 2+ 、Fe 3+ 的电镀废液中
氯化亚铜不仅在无机化工生产中具有重要作用,在有机合成工业中还可作催化剂.以下是从含Cu 2+ 、Fe 3+ 的电镀废液中制备氯化亚铜的工艺流程图. 
如图曲线可表示滤液中金属离子含量与pH、CuCl产率与反应①混合液中pH的关系.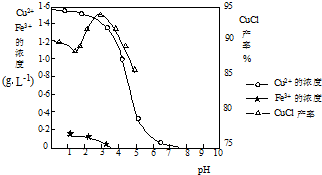
试填空.
(1)当pH=5时,在电镀废液中再加入氢氧化钠溶液生成电镀污泥的离子反应方程式为:______.
(2)由反应①制备CuCl时的最佳pH在______左右.
(3)已知在隔绝空气条件下进行反应①时CuCl产率较高,则CuCl具有______的特性.
(4)反应①中1mol铁粉完全反应转移2mol电子,该离子反应的方程式为:______.如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,则化学方程式为:______. mybmwx51年前1
mybmwx51年前1 -
 blackpeter 共回答了26个问题
blackpeter 共回答了26个问题 |采纳率96.2%(1)当pH=5时,三价铁离子已经全部沉淀,在电镀废液中再加入氢氧化钠溶液,铜离子全部沉淀;反应离子方程式为:Cu 2+ +2OH - =Cu(OH) 2 ↓,故答案为:Fe 3+ +3OH - =Fe(OH) 3 ↓;Cu 2+ +2OH - =Cu(OH) 2 ↓;
(2)因减少生成物的浓度,化学平衡正向移动,OH - 中和了反应中的H + ,有利于平衡向右移动,提高CuCl的产率.但当OH - 浓度过大时,Cu + 能与OH - 结合,生成氢氧化亚铜沉淀(Cu 2+ 能与OH - 结合,生成氢氧化铜沉淀),从而降低了CuCl的产率,图象中分析由反应①制备CuCl时的最佳pH=3.5时CuCl的产率最大,故答案为:3.5;
(3)在隔绝空气条件下进行反应①时CuCl产率较高,说明氯化亚铜能被空气中的氧气氧化,故答案为:能被空气中的氧气氧化;
(4)反应①中1mol铁粉完全反应转移2mol电子生成亚铁离子被铜离子氧化,生成氯化亚铜沉淀结合离子方程式书写方法写出的离子方程式为:2Cu 2+ +2Cl - +Fe=2CuCl↓+Fe 2+ ;如果将反应①中铁粉换为亚硫酸钠,也可以得到氯化亚铜,说明亚硫酸钠被铜离子氧化为硫酸钠,本身被还原为氯化亚铜,结合化学方程式书写方法写出的化学方程式为:2CuSO 4 +Na 2 SO 3 +2NaCl+H 2 O=2CuCl↓+2Na 2 SO 4 +H 2 SO 4 ;
故答案为:2Cu 2+ +2Cl - +Fe=2CuCl↓+Fe 2+ ;2CuSO 4 +Na 2 SO 3 +2NaCl+H 2 O=2CuCl↓+2Na 2 SO 4 +H 2 SO 4 ;1年前查看全部
- 如何用乙醇通过有机合成制取聚氯乙烯
 rebecca96301年前2
rebecca96301年前2 -
 cc1988529 共回答了19个问题
cc1988529 共回答了19个问题 |采纳率89.5%先浓硫酸脱水制取乙烯.
CH3CH2OH→H2O+CH2=CH2↑
【工业方法】乙烯催化氯化:
4CH2=CH2+O2+2Cl2=2H2O + 4CH2=CHCl
然后氯乙烯加成即可.1年前查看全部
- 有机合成题第四题,请会的人给出答案 我重重有奖
 nixihs1年前0
nixihs1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一个有机合成题目,求精讲一个是流程,一个是目标产物
一个有机合成题目,求精讲

 一个是流程,一个是目标产物
一个是流程,一个是目标产物  csdhdfj1年前1
csdhdfj1年前1 -
 oppkl 共回答了17个问题
oppkl 共回答了17个问题 |采纳率94.1%在碱性条件下,碘代反应发生在苯胺的邻、对位.考虑到位阻因素,所以对位取代应该是反应的主产物.典型的Sonogashira coupling 反应.即:炔氢与芳基卤代烃的反应.芳基胺在酸性条件下与亚硝酸钠发生重氮化反应,而后重氮盐不稳定极易被亲核试剂碘化钾中的碘离子取代生成芳基碘化物.也就是目标化合物.1年前查看全部
- 有机合成里面,怎么把C N双键做成C O双键呢?
 andy110boy1年前1
andy110boy1年前1 -
 ccGG 共回答了15个问题
ccGG 共回答了15个问题 |采纳率86.7%RC=NR' ->RC=O 在酸性条件下水解.1年前查看全部
- 有机物X是有机合成工业中一种重要的中间体。X可以由有机物A经过一系列反应制得,也可由另一种有机物Y在一定条件下制得。合成
有机物X是有机合成工业中一种重要的中间体。X可以由有机物A经过一系列反应制得,也可由另一种有机物Y在一定条件下制得。合成路径如下图所示 
已知: 
②Y分子中C、H、O(不含其它元素)的个数比为1:1:1,且Y的相对分子质量的范围在80-160之间。 ③Y是一种二元酸,且能使Br 2 /CCl 4 褪色。
④E和X中都含有五元环。
请回答以下问题:
(1)请指出反应类型:反应②______________,反应⑤_____________。
(2)Y的分子式为_______________;X的结构简式为_______________。
(3)反应①和②的顺序不能调换,请简述理由__________________________。
(4)化合物D在浓H 2 SO 4 催化作用下能生成一种高分子化合物,请写出该反应的化学方程式
__________________________。 娃哈哈jpmd1年前1
娃哈哈jpmd1年前1 -
 amanda2080 共回答了15个问题
amanda2080 共回答了15个问题 |采纳率93.3%1年前查看全部
- 一道有机合成的题,图在这里,我不知道E加上过量的Br生成的F1和F2是什么?v=1这图就是全的~
 月荒凉1年前3
月荒凉1年前3 -
 onlylovev 共回答了18个问题
onlylovev 共回答了18个问题 |采纳率94.4%E:C-C=C
F1:C-BrC-CBr
F2:C-C-CBr2
G1:C-BrC-CBr2
G2:C-Br2C-CB1年前查看全部
- 无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分
无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按如图所示流程进行一系列反应来制备无水AlCl3.
(1)AlCl3是______晶体.
(2)化炉中Al2O3、C12和C反应的化学方程式是A12O3+3C12+3C
2A1C13+3CO高温 .A12O3+3C12+3C.
2A1C13+3CO高温 .
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,写出此反应的离子方程式是______.
(4)华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是______.
(5)为测定无水AlCl3产品的纯度,现称取16.25g精制后的无水 AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.32g.则AlCl3产品的纯度为______. 想君发扬子1年前1
想君发扬子1年前1 -
 小熊1231 共回答了20个问题
小熊1231 共回答了20个问题 |采纳率90%解题思路:(1)根据工艺流程最后升华制备无水AlCl3,说明AlCl3沸点很低,应为分子晶体;
(2)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO;
(3)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-;
(4)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除去FeCl3;
(5)制备无水AlCl3含有杂质FeCl3,残留固体质量为0.32g为Fe2O3,根据铁原子守恒计算FeCl3质量,进而计算出AlCl3的质量,再根据产品的纯度定义计算.(1)根据工艺流程最后升华制备无水AlCl3,说明AlCl3沸点很低,应为分子晶体,故答案为:分子;
(2)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为
A12O3+3C12+3C
高温
.
2A1C13+3CO,故答案为:A12O3+3C12+3C
高温
.
2A1C13+3CO;
(3)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+,故答案为:SO32-+C12+H2O═SO42-+2C1-+2H+;
(4)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去.所以加入少量Al目的是除去FeCl3,
故答案为:除去FeCl3;
(5)根据铁原子守恒,令含有杂质FeCl3质量为mg,则
Fe2O3~~~~~2FeCl3
160 325
0.32gmg
所以 [0.32g/160=
mg
325],解得,m=0.65g,
所以AlCl3产品的纯度为[16.25g−0.65g/16.25g]×100%=96%,
故答案为:96%.点评:
本题考点: 镁、铝的重要化合物;制备实验方案的设计.
考点点评: 本题考查了考生对自己存储的知识,进行分解、迁移转换、重组,使问题得到解决的应用能力,体现出化学是真实的.能够通过对生产、生活和科学实验中化学现象以及相关数据和图形等的观察,获取有关的感性知识和印象,并运用分析、比较、归纳等方法对所获取的信息进行初步加工和应用的能力.1年前查看全部
- (专家来)H2O2在有机合成中的反应
(专家来)H2O2在有机合成中的反应
H2O2在有机合成中的主要几个反应,我知道是氧化,但谁能帮我总结一下主要有哪几个?
写一下作用于什么和产物是什么
比如:在硼氢化中氧化制备醇.
写的多的追加100分,谢谢!很紧急 纱线贸易1年前2
纱线贸易1年前2 -
 我常常在想 共回答了15个问题
我常常在想 共回答了15个问题 |采纳率100%1.普通氧化,将醇氧化为醛,醛到酸,这个不用说了
2.过氧化,例如在一定条件下将乙酸氧化为过氧乙酸
3.烷基硼与过氧化氢(H2O2)的氢氧化钠(NaOH)溶液作用,立即被氧化,同时水解为醇
4.H2O2-金属催化剂体系,催化剂
5.与一些有机物反应生成环氧化合物1年前查看全部
- (2013•常州一模)有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂.
(2013•常州一模)有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂.一种由废催化剂制取PdCl2的工艺流程如下:
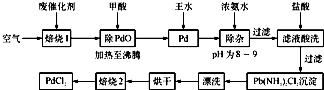
(1)“焙烧1”通入空气的目的是______.
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:______.
(3)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室中检测溶液pH的简单方法是______.
(4)写出“焙烧2”发生反应的化学方程式:Pd(NH3)2Cl2
2NH3↑+PdCl2△ .Pd(NH3)2Cl2.
2NH3↑+PdCl2△ .
(5)Pd中加入王水的反应可以表示为Pd+HCl+HNO3-→A+B↑+H2O(未配平).其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%.则A的化学式为______. fx57001年前1
fx57001年前1 -
 娅菲的世界 共回答了16个问题
娅菲的世界 共回答了16个问题 |采纳率100%解题思路:(1)使有机物、等可燃物充分燃烧;
(2)根据题给信息确定反应物和生成物,从而写出反应方程式;
(3)实验室中用pH试纸检测溶液的pH;
(4)根据题给信息结合原子守恒确定反应方程式;
(5)Pd中加入王水的反应可以表示为Pd+HCl+HNO3-→A+B↑+H2O(未配平),其中B为无色有毒气体,该气体在空气中不能稳定存在,则B是一氧化氮;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%,剩余的是氯元素,根据各元素的质量分数确定其原子个数比,从而确定其化学式.(1)钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,则该催化剂中含有有机物,为了使有机物等可燃物充分燃烧,要加入过量的氧气,
故答案为:使有机化合物等可燃物通过燃烧而除掉;
(2)根据题给信息知,甲酸被氧化生成二氧化碳,则金属氧化物被还原生成金属单质,同时该反应中还生成水,反应方程式为:HCOOH+PdO═Pd+CO2↑+H2O,
故答案为:HCOOH+PdO═Pd+CO2↑+H2O;
(3)实验室中用pH试纸检测溶液的pH,其操作方法是:用洁净的玻璃棒蘸取待测液滴在pH试纸上,然后将pH试纸与标准比色卡对比,故答案为:用洁净的玻璃棒蘸取待测液滴在pH试纸上,然后将pH试纸与标准比色卡对比;
(4)根据题给信息知,反应物是Pd(NH3)2Cl2,生成物是氨气和PdCl2,反应条件是加热,该反应方程式为:
Pd(NH3)2Cl2
△
.
2NH3↑+PdCl2,
故答案为:Pd(NH3)2Cl2
△
.
2NH3↑+PdCl2;
(5)Pd中加入王水的反应可以表示为Pd+HCl+HNO3-→A+B↑+H2O(未配平),其中B为无色有毒气体,该气体在空气中不能稳定存在,则B是一氧化氮;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%,根据元素守恒知剩余的是氯元素,Pd原子、氢原子和氯原子个数比=[42.4%/106.4]:[0.8%/1]:[1−42.4%−0.8%/35.5]=1:2:4,所以A的化学式为:H2PdCl4,
故答案为:H2PdCl4.点评:
本题考点: 制备实验方案的设计;氧化还原反应;测定溶液pH的方法;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查了制备方案的设计,涉及化学式的确定、氧化还原反应、pH的测定等知识点,会根据原子守恒及原子个数比确定化学式,明确溶液pH值的测定方法,难度不大.1年前查看全部
- LiAlH 4 是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH 4 在125 ℃分解为Li
LiAlH 4 是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH 4 在125 ℃分解为LiH、H 2 和Al。下列叙述错误的是( )。
A.LiAlH 4 与乙醛作用生成乙醇,LiAlH 4 作还原剂 B.LiAlH 4 与D 2 O反应,所得氢气的摩尔质量为4 g·mol -1 C.1 mol LiAlH 4 在125 ℃完全分解,转移3 mol电子 D.LiAlH 4 与水反应生成三种物质时,化学方程式可表示为:LiAlH 4 +4H 2 O=Al(OH) 3 +LiOH+4H 2 ↑  我是火红太阳1年前1
我是火红太阳1年前1 -
 anna2003 共回答了19个问题
anna2003 共回答了19个问题 |采纳率84.2%B
LiAlH 4 中氢显-1价,具有很强的还原性;A项,乙醛→乙醇,发生还原反应,正确;B项,生成氢气的实质是LiAlH 4 中-1价的H与D 2 O中+1价D归中生成HD气体,摩尔质量为3 g·mol -1 ,错误;C项,Al 3 + 生成Al,转移3e - ,正确;D项,该反应相当于水解,Al(OH) 3 溶于酸和强碱不溶于水,LiOH是中强碱,不溶,正确。1年前查看全部
- 环己酮是工业上主要用作有机合成的原料和溶剂.
环己酮是工业上主要用作有机合成的原料和溶剂.
A----H2/Ni-----B-----Br2/光照-----C-----D-----环己酮
问:A先加成再取代,和,A先取代再加成,有什么区别(后面步骤不变) lililee50521年前1
lililee50521年前1 -
 逸凡 共回答了23个问题
逸凡 共回答了23个问题 |采纳率91.3%应该先取代再加成.
如果A 苯先加成H2,得到 B 环己烷,烷烃的光卤代难易控制,会得到多卤代物.使得产率极低.
如果A 苯先取代得到溴苯,然后加成H2,则可以高产率的得到 溴代环己烷,然后水解、氧化得到环己酮.1年前查看全部
- 脱落酸的全合成路线哪里有?但是我要的是实验室可以实现的有机合成的全合成路线……
 孤心蓝冰1年前1
孤心蓝冰1年前1 -
 Ж一箭穿心Ж 共回答了19个问题
Ж一箭穿心Ж 共回答了19个问题 |采纳率94.7%脱落酸(ABA)生物合成一般有两条途径:C15直接途径和C40间接途径,前者经C15法呢焦磷酸(FPP)直接形成ABA;后者经由类胡萝卜素的氧化裂解间接形成ABA,是高等植物ABA生物合成的主要途径.9-顺式环氧类胡萝卜素氧化裂解为黄质醛是植物ABA生物合成的关键步骤,然后黄质醛被氧化形成一种酮,该过程需NAD为辅因子,酮再转变形成ABA-醛,ABA-醛氧化最终形成ABA.在该途径中,玉米黄质环氧化酶(ZEP)、9-顺式环氧类胡萝卜素双加氧酶(NCED)和醛氧化酶(AO)可能起重要作用.
将吲哚、γ-丁内酯、氢氧化钾加入到四氢萘中,搅拌下加热溶解,回流脱水,升温至200℃,脱水至理论量的四分之三,开始脱溶,在1~1.5h内脱水至理论量,温度上升至300℃,并保持0.5h.稍冷后加入二甲苯和热水溶解,趁热分液.水层冷却后用盐酸中和,得粗品,再用苯重结晶,得成品1年前查看全部
- 高效液相色谱图谱在做有机合成的时,最后得到产品后总要送检做个HPLC检测含量.可是每次看到老大们拿到图谱后就只跟我说图谱
高效液相色谱图谱
在做有机合成的时,最后得到产品后总要送检做个HPLC检测含量.可是每次看到老大们拿到图谱后就只跟我说图谱上的面积代表含量,也就是后面的数据里面有个98%什么的数据.我想具体了解下拿到一张HPLC图谱后,我要怎么分析,从哪里入手,如何知道我的产品的问题出在哪,质检人员的检验手段是否合格.
好了,暂时就这么多,慢慢再加吧,分不多,但我的诚意很足,希望能得到您的指导 jixu9301年前1
jixu9301年前1 -
 a394087154 共回答了24个问题
a394087154 共回答了24个问题 |采纳率83.3%常用的色谱分析的方法有外标法、内标法、归一法等.按你所说的情况,用的方法是面积归一法.我就简单的介绍一下面积归一法.面积归一法是测量各杂质峰的面积和色谱图上除溶剂峰以外的总色谱峰面积,计算各杂质峰面积及其...1年前查看全部
大家在问
- 1已知复数z=m(m+1)+mi,i为虚数单位,m属于R,(1)当复数z为纯虚数时,求m的值,(2)若(1+i)z=1+3
- 2下列根式中,与2是同类二次根式的是( )
- 3修改病句 一个很少的机会,我与他成了无话不说的朋友
- 4阅读下面文言文,完成第11~14题。(10分)
- 5胡光墉 字 雪岩 古代有了个名字为什么还有个 字 什么什么的
- 6提问已知抛物线y=x平方+2px+10的顶点再直线y=3x上,求此抛物线的解析式
- 718乘8加18x等于315怎样用两种不同的方法解方程?
- 8小明100元买了3斤苹果剩下88元 苹果一斤多少钱
- 9饥饿,可畏!好奇是饥饿的粮食,每遇到它就想吃.对这句话的理解
- 10生命力、活力旺盛的样子根据意思写词语
- 11班级趣事作文350字写班级趣事的作文,要350个字
- 12英语1到50是怎么写带汉语英语1到25怎么写,我们写英语作业呢
- 13向100G FeCl3溶液中放入一小块钠,待反应完全后,过滤,得到的棕黄色溶液91.8G,则投入钠的质量?
- 14李商隐的《柳》和曾巩的《咏柳》思想感情有什么不同?
- 15小明在实践课中做了一个三角形模型,模型的周长为5m+3n一2,第一条边长为m一n,第二条边长是第一条边长的2倍,试求第三