制氧剂能与二氧化碳反应产生氧气,它的化学式为RO2,其中含氧量为45.1%,求的的相对原子质量,并写出RO2的化学
 宝贝痴心2022-10-04 11:39:542条回答
宝贝痴心2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 niqisiwola 共回答了18个问题
niqisiwola 共回答了18个问题 |采纳率94.4%- 32÷0.451=70.953436807095
R的相对原子质量70.953436807095 -32=39
KO2
KO2 为过氧化物,O2-为-1价(比如H2O2) - 1年前
 自然er然 共回答了21个问题
自然er然 共回答了21个问题 |采纳率95.2%- 题目错了吧。。R求出来39是K。。化合价是+1 。。
- 1年前
相关推荐
- 过氧化钠(化学式为Na2O2,其中Na元素显+1价)是潜水艇中的制氧剂,它是一种淡黄色粉末,能与物质R反应生成氧气,反应
过氧化钠(化学式为Na2O2,其中Na元素显+1价)是潜水艇中的制氧剂,它是一种淡黄色粉末,能与物质R反应生成氧气,反应的化学方程式为:2Na2O2+2R═2Na2CO3+O2,则下列有关判断中,错误的是( )
A.Na2O2中氧元素化合价为-1价
B.R的化学式为CO2
C.Na2CO3的相对分子质量为106
D.Na2O2中含有氧分子 玉龙飞九天1年前1
玉龙飞九天1年前1 -
 北极星4203040 共回答了17个问题
北极星4203040 共回答了17个问题 |采纳率100%解题思路:A、根据在化合物中正负化合价代数和为零,结合过氧化钠(化学式为Na2O2)的化学式进行解答;
B、根据质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断R的化学式;
C、根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行分析解答;
D、根据物质构成的粒子进行分析判断.A、根据在化合物中正负化合价代数和为零,钠元素显+1,
设氧元素的化合价是x,
可知过氧化钠(化学式为Na2O2)中氧元素的化合价:(+1)×2+2x=0,
则x=-1;
故选项说法正确;
B、根据质量守恒定律可知,
反应前后元素种类、原子个数和种类相等
,反应物中钠、氧原子个数分别为4、4,反应后的生成物中钠、碳、氧原子个数分别为4、2、8,
根据反应前后原子种类、数目不变,
则2R中含有2个碳原子和4个氧原子,
则每个R分子由1个碳原子和2个氧原子构成,
则物质R的化学式为CO2;
故选项说法正确;
C、根据相对分子的质量为组成分子的各原子的相对原子质量之和,
可得Na2CO3的相对分子质量量为:23×2+12+16×3=106;
故选项说法正确;
D、过氧化钠是由过氧化钠分子构成的,不含氧分子,故选项说法错误;
故选:D.点评:
本题考点: 有关元素化合价的计算;物质的构成和含量分析;相对分子质量的概念及其计算;质量守恒定律及其应用.
考点点评: 本题难度不大,考查同学们灵活利用化合价的原则计算指定元素的化合价、化学反应前后原子守恒来确定物质的化学式等知识进行分析解题的能力.1年前查看全部
- 过氧化钠是一种淡黄色固体,能与二氧化碳反应生成氧气,可用于潜水艇中作制氧剂,供人呼吸,它与CO 2 反应的化学方程式为:
过氧化钠是一种淡黄色固体,能与二氧化碳反应生成氧气,可用于潜水艇中作制氧剂,供人呼吸,它与CO 2 反应的化学方程式为:2Na 2 O 2 +2CO 2 =2Na 2 CO 3 +O 2 .某学生为验证这一结论,以大理石、盐酸和Na 2 O 2 样品为原料来制取O 2 ,设计出如图所示的实验装置(C中无水硫酸铜起干燥作用): 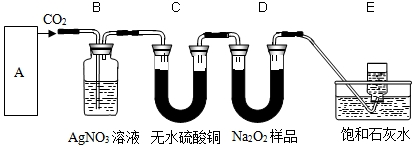
(1)A中制取CO 2 的装置,应从下面的图1~图3中选用图______,
(2)B实验装置的作用是______,写出反应的化学方程式______,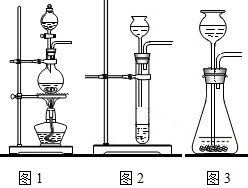
(3)为了检验E中收集的气体,可以在取出集气瓶后______,
(4)E中饱和石灰水的作用是______. 周伟吉1年前1
周伟吉1年前1 -
 LD简单爱你 共回答了18个问题
LD简单爱你 共回答了18个问题 |采纳率88.9%(1)实验室确定气体发生装置时,一般考虑是固体与液体,还是固体与固体反应,需不需要加热等条件.二氧化碳的制取是用的固体与液体,不需要加热.故答案为:A中制取CO 2 的装置,应从下面的图1~图3中选用图3;...1年前查看全部
- (1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式______
(1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式______
(2)铁与高温水蒸气反应:3Fe+4H2O
Fe3O4+4H2高温 .3Fe+4H2O
Fe3O4+4H2高温 .
(3)碳酸钠与稀盐酸反应:______. 男人不哭Alex1年前1
男人不哭Alex1年前1 -
 mlmjdh 共回答了29个问题
mlmjdh 共回答了29个问题 |采纳率93.1%解题思路:(1)过氧化钠可以和二氧化碳反应生成碳酸钠和氧气;
(2)金属铁和水蒸气在高温下发生置换反应生成四氧化三铁和氢气;
(3)碳酸钠和盐酸反应生成氯化钠、水以及二氧化碳.(1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,即2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(2)铁在高温下和水蒸气发生化学反应生成四氧化三铁和氢气,
此反应的化学方程式为:3Fe+4H2O
高温
.
Fe3O4+4H2,故答案为:3Fe+4H2O
高温
.
Fe3O4+4H2;
(3)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,
故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑.点评:
本题考点: 化学方程式的书写.
考点点评: 本题比较基础,但因为不熟练而出错或用时过长,需要熟练掌握教材中出现的方程式,才能得心应手.1年前查看全部
- 过氧化钠(Na 2 O 2 )是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用它做制氧剂,供人们呼吸.它与二氧
过氧化钠(Na 2 O 2 )是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用它做制氧剂,供人们呼吸.它与二氧化碳反应的化学方程式为:2Na 2 O 2 +2CO 2 =2Na 2 CO 3 +O 2 ,某学生为了验证这一实验,以大理石、足量的盐酸和过氧化钠为原料制取O 2 ,设计出如下实验装置: 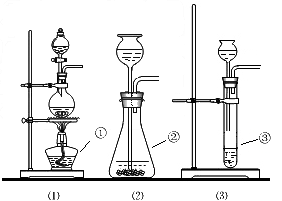

(1)写出图中有标号的仪器名称:① _________ ② _________ ③ _________
(2)A应是制取CO 2 的装置,应选择上图(1)、(2)、(3)装置中的 _________ (填代号).B装置的作用是吸收A中产生的杂质气体,C装置的作用是吸收A、B装置中产生的水蒸气.取出集气瓶后,应该用 ____ _____ 来验证E中收集到的气体.
(3)表明D中的过氧化钠样品反应完毕时E中的现象是 __ _______ ,E中发生变化的化学反应方程式是 ____ _____ . dantor3211年前1
dantor3211年前1 -
 avril4ever 共回答了24个问题
avril4ever 共回答了24个问题 |采纳率87.5%(1).酒精灯;锥形瓶;试管
(2).(2);带火星的木条
(3)D装置中的淡黄色固体变成白色,E装置中的石灰水大量变浑浊;
CO 2 +Ca(OH) 2 =CaCO 3 ↓+H 2 O1年前查看全部
- (1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式____________。
(1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式____________。
(2)工业上制取漂白粉的化学方程式为______________。
(2)在标准状况下,33.6 L氯气的质量是________g,将红热的铁丝与其完全反应,反应的化学方程式为___________ ,最多可消耗铁的物质的量为__________mol。 852911411年前0
852911411年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2007•眉山)过氧化钠是一种淡黄色固体,能与二氧化碳反应生成氧气,可用于潜水艇中作制氧剂,供人呼吸,它与CO2反应的
(2007•眉山)过氧化钠是一种淡黄色固体,能与二氧化碳反应生成氧气,可用于潜水艇中作制氧剂,供人呼吸,它与CO2反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2.某学生为验证这一结论,以大理石、盐酸和Na2O2样品为原料来制取O2,设计出如图所示的实验装置(C中无水硫酸铜起干燥作用):
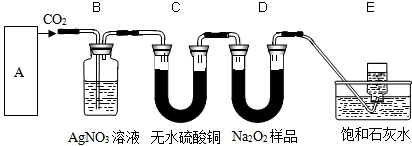
(1)A中制取CO2的装置,应从下面的图1~图3中选用图______,
(2)B实验装置的作用是______,写出反应的化学方程式______,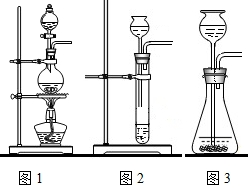
(3)为了检验E中收集的气体,可以在取出集气瓶后______,
(4)E中饱和石灰水的作用是______. gannixiaobi1年前1
gannixiaobi1年前1 -
 阳光常在风雨后 共回答了17个问题
阳光常在风雨后 共回答了17个问题 |采纳率82.4%解题思路:本题研究了过氧化钠与水反应的性质,检验生成物时用到了氧气和二氧化碳的检验方法.氧气是用带火星的木条检验;二氧化碳是用澄清的石灰水检验.本题还考查了气体的制取装置的选择,从而探究了发生装置的确定应根据:药品的状态、反应的条件等.再利用实验要求设计实验过程,本题中还含有净化气体的知识和注意气体的除杂和干燥,通入的二氧化碳需要去除氯化氢及水蒸气,以及化学方程式的书写.(1)实验室确定气体发生装置时,一般考虑是固体与液体,还是固体与固体反应,需不需要加热等条件.二氧化碳的制取是用的固体与液体,不需要加热.故答案为:A中制取CO2的装置,应从下面的图1~图3中选用图3;
(2)B实验装置的作用是 除去挥发出的氯化氢气体,写出反应的化学方程式 HCl+AgNO3=AgCl↓+HNO3;
(3)检验是否有氧气生成,用带火星的木条检验即可.故答案为:为了检验E中收集的气体,可以在取出集气瓶后将带火星的木条伸到集气瓶中,木条复燃;
(4)E中饱和石灰水的作用是 除去未反应完得二氧化碳;
故答为::(1)3,
(2)除去挥发出的氯化氢气体,HCl+AgNO3=AgCl↓+HNO3,
(3)将带火星的木条伸到集气瓶中,木条复燃,
(4)除去未反应完得二氧化碳,点评:
本题考点: 实验探究物质的性质或变化规律;常见气体的检验与除杂方法;气体的净化(除杂);氧气的检验和验满;二氧化碳的实验室制法;书写化学方程式、文字表达式、电离方程式.
考点点评: 牢记一些气体的性质鉴定是解决气体除杂及鉴定实验题的关键.该题为综合实验题,考查的知识点较多,氧气的检验,碳酸盐检验,物质的除杂,质量守恒定律的应用等,关键是熟记相关知识点.语言表述要简练准确.1年前查看全部
- 过氧化钠(化学式为Na 2 O 2 ,其中Na元素显+1价)是潜水艇中的制氧剂,它是一种淡黄色粉末,能与物质R反应生成氧
过氧化钠(化学式为Na 2 O 2 ,其中Na元素显+1价)是潜水艇中的制氧剂,它是一种淡黄色粉末,能与物质R反应生成氧气,反应的化学方程式为:2Na 2 O 2 + 2R=2Na 2 CO 3 + O 2 ,则下列有关判断中,错误的是( )
A.Na 2 O 2 中氧元素化合价为-1价 B.R的化学式为CO 2 C.Na 2 CO 3 的相对分子质量为106 D.Na 2 O 2 中含有氧气分子  wh_yzj1年前1
wh_yzj1年前1 -
 雨天qq 共回答了20个问题
雨天qq 共回答了20个问题 |采纳率95%D
1年前查看全部
- (2011•平谷区二模)小丽去爷爷家,发现爷爷买了一台氧立得便携式制氧器,她仔细阅读了所用制氧剂的说明
(2011•平谷区二模)小丽去爷爷家,发现爷爷买了一台氧立得便携式制氧器,她仔细阅读了所用制氧剂的说明
对制氧剂产生了兴趣.氧立得复方制氧剂
A剂:固体氧释放剂.
B剂:不溶于水的固体,保证出氧速率温度.
1.用法与用量:将A剂、B剂先后放入装好水的氧立得制氧器反应仓中,通过导管和鼻塞吸氧.
2.规格:A剂:50g/包 B剂:3g/包
(提出问题)A剂的主要成分和B剂的作用各是什么?
(查阅资料)过碳酸钠(化学式2Na2CO3•3H2O2)俗称固体双氧水,白色结晶颗粒.过碳酸钠溶于水或受热时,分解生成碳酸钠和过氧化氢,是很好的固体氧释放剂.
(做出猜想)猜想Ⅰ:A剂可能是过碳酸钠.
猜想Ⅱ:B剂的作用是催化作用.
(设计实验) 请你帮助小丽完成下列实验报告.
验证猜想Ⅰ
验证猜想Ⅱ主要操作步骤 主要实验现象 实验结论 实验① 
如左图,取少量A剂放入试管中,加水溶解,然后______ 生成大量气体,______ / 实验② 另取少量A剂放入试管中,加水溶解,然后将所得溶液倒入另一只装有少量二氧化锰的试管中.稍后将带火星的木条放在试管口 生成大量气体
此气体使带火星的木条复燃______
(反思拓展)请你针对制氧剂的保存或反应后的剩余物的处理提一条合理化建议:______.操作步骤 实验现象 解释或结论 实验③ 将一包A剂和一包B剂放在盛有水的制氧仓中,制完氧之后,取出剩余物,过滤、洗涤、干燥、称重. 称得固体质量为3g / 实验④ ______ 产生大量气体,该气体使带火星的木条复燃 ______  智得先行1年前1
智得先行1年前1 -
 zhth863916 共回答了19个问题
zhth863916 共回答了19个问题 |采纳率89.5%解题思路:(设计实验)根据“过碳酸钠溶于水或受热时,分解生成碳酸钠和过氧化氢”,为验证猜想I,可通过检验A剂溶于水后所得的溶液中含有碳酸钠和过氧化氢而实现;
根据催化剂的特点:变化前后质量和化学性质不变,可检验B剂变化前后的质量和化学性质,完成对猜想II的验证;
(反思拓展)根据制氧剂的性质及变化后的剩余物,对制氧剂的合理存放或使用后的处理,提出建议.(设计实验)实验①:根据后面的实验现象可知,固体溶于水形成溶液后,经过某种操作生成了二氧化碳,根据已知固体有可能是碳酸钠可知,此时需要加入盐酸;实验②:根据操作以及现象可以判定,固体溶于水产生使带火星木条复燃的气体(氧气),说明A剂溶于水产生氧气;
故答案为:
主要操作步骤 主要实验现象 实验结论
实验① 滴加稀盐酸,将导管末端通入澄清石灰水 澄清石灰水变浑浊 /
实验② A剂溶于水有过氧化氢生成实验④:根据最后的实验结论,要证明B剂的作用是催化作用,则需要证明B剂在反应产生气体的过程中性质为发生变化,故另取少量A剂放入试管中,加足量水溶解,再加入实验③所得干燥固体,然后将带火星的木条伸入试管口,以此说明B剂在制氧前后化学性质不变.
故答案为:
操作步骤 实验现象 解释或结论
实验③ /
实验④ 另取少量A剂放入试管中,加足量水溶解,再加入实验③所得干燥固体,然后将带火星的木条伸入试管 B剂在制氧前后化学性质不变(反思拓展)根据过碳酸钠溶于水或受热时会发生分解,可建议制氧剂应放置于干燥、阴凉处;根据探究,制氧后B剂性质及化学性质不变,可建议重复使用;根据探究实验,制氧后的溶液为碳酸钠溶液,可建议蒸干溶液获得纯碱;
故答案为:制氧剂应放在干燥、阴凉处(或所得残余物过滤,固体可重复使用,液体蒸干可得纯碱).点评:
本题考点: 实验探究物质的性质或变化规律;氧气的检验和验满.
考点点评: 结合实验探究所得到结论提出建议时,所提出的建议一定要切合题目所探究的实际,给出合理的建议.1年前查看全部
- (1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式______;
(1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式______;
(2)工业上制取漂白粉的化学方程式为______.漂白粉露置于空气中失效的原因是(用化学方程式表示):
①______②2HClO
2HCl+O2↑光 .2HClO.
2HCl+O2↑光 . 油闷兔子1年前1
油闷兔子1年前1 -
 濯意儿 共回答了27个问题
濯意儿 共回答了27个问题 |采纳率88.9%解题思路:根据过氧化钠的性质和氯气的性质,以及次氯酸钙的性质即可写出化学方程式.(1)根据教材内容,过氧化钠与二氧化碳反应生成碳酸钠和氧气,即2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(2)制取漂白粉的使用的是氯气和消石灰,生成氯化钙和次氯酸钙、水,即2C12+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,又漂白粉在空气中变质是因为其有效成分次氯酸钙与空气中的二氧化碳反应生成了次氯酸,并且次氯酸见光、受热分解,从而使漂白粉失效,即发生Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,2HClO
光
.
2HCl+O2↑,
故答案为:2C12+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO;2HClO
光
.
2HCl+O2↑.点评:
本题考点: 化学方程式的书写;氯、溴、碘及其化合物的综合应用;钠的重要化合物.
考点点评: 本题比较基础,但却因为不熟练而出错或用时过长,需要熟练掌握教材中出现的方程式,才能得心应手.1年前查看全部
大家在问
- 1现有200g5.0%的氯化铵溶液,若使它变为15%的氯化铵溶液,则应加入20%的溶液质量为多少
- 2电影票15元一张,降价后观众增加了一倍,收入增加了五分之一,一张电影票降价了( )元?
- 3这儿为什么用didn't try to不用didn't have a trial呢
- 4(1)Is this university__they paid a visit last month?
- 5用一张厚纸片在一把梳子的梳齿上划过时,会听到声音,若划过梳齿的快慢不同你会听到声音发生变化吗并对此现象提出问题
- 6同学们排成一行,小明也在其中.他数了数人数,排在他左面的人数是总人数的70%,排在他右面的人数是总人数的20%.你知道从
- 7即使,也,因为用这三个词造句
- 8英语“她”的宾格是什么?
- 9如果(a-b)x=la-bl的解是x=1,那么().填a和b的关系
- 10请问下“移动互联网”是什么意思?“电子商务”与“电子信息产业”有什么联系和区别?
- 11在平面直角坐标系中,入射光线经过y轴上点A(0,3),由x轴上点C反射,反射光线经过点B(-3,1),则点C的坐标为__
- 12In my () time i like to watch TV
- 13如图所示,已知平行板电容器两极板间距离d=4mm,充电后两极板电势差为120V.A板带正电,若它的电容为3 μ
- 14将5g二氧化锰加上含17g过氧化氢的完全反应能生成多少克水?同时生成多少克氧气,这些氧气
- 15上午10时,媛媛为了测量一根旗杆的高度,做了一下实验:
