卤化氢的稳定性在卤化氢(HX)当中,HI是最不稳定的吗?单质与氢气化合剧烈程度越来越弱?
 geoffreyzh2022-10-04 11:39:543条回答
geoffreyzh2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 kklf 共回答了17个问题
kklf 共回答了17个问题 |采纳率88.2%- 如果不算放射元素At,HI是最不稳定的.卤化氢稳定从强到弱
HF>HCl>HBr>HI>HAt - 1年前
 hope06 共回答了491个问题
hope06 共回答了491个问题 |采纳率- 若只考虑F、Cl、Br、I四种卤素,则LZ的结论正确。
理论上原子序数更大、原子电子层数更多的卤素At(砹,85号元素,周期表中第6周期第17列)的氢化物HAt比HI更符合LZ说的性质。但At是天然短半衰期放射性元素,研究得不多,一般化学中忽略。
另外LS错误。卤化氢是共价化合物,结构中没有离子,通过比较离子半径来确定稳定性是错误的。... - 1年前
 HAHA狂倒 共回答了71个问题
HAHA狂倒 共回答了71个问题 |采纳率- 比较卤化氢稳定性,即比较离子半径大小
由于F-所以稳定性HF>HCl>HBr>HI - 1年前
相关推荐
- 卤素单质与氢气都能反应,反应产物是卤化氢(X2+H2=2HX),这是卤素性质的相似性;但其反应条件不同,从“黑暗中即可剧
卤素单质与氢气都能反应,反应产物是卤化氢(x2+h2=2hx),这是卤素性质的相似性;但其反应条件不同,从“黑暗中即可剧烈***”→“不断加热才能缓慢反应”,这是其性质的递变性,其性质递变性原因是( )
a.最外层电子数相同
b.都是双原子分子
c.电子层数不同
d.卤化氢中卤素都是-1价 都市生活881年前1
都市生活881年前1 -
 snowfoxes 共回答了17个问题
snowfoxes 共回答了17个问题 |采纳率94.1%解题思路:同主族自上而下,元素的非金属性逐渐减弱,和氢气化合越来越难,根据原子结构和性质间的关系来回答.同主族自上而下,非金属性逐渐减弱,是由于卤素原子的电子层数不同引起的,即随着核电荷数的增加,原子核对最外层电子的吸引力逐渐减弱,因此非金属性逐渐降低.
故选C.点评:
本题考点: 卤素原子结构及其性质的比较.
考点点评: 该题是高考中的常见考点,属于基础性试题的考查.主要是考查学生对元素周期律的熟悉了解程度,特别是元素周期律变化实质的判断,有利于培养学生的逻辑推理能力,提高学生的学科素养.1年前查看全部
- 电子式 帮忙找一下氢气 氧气 卤素气体 氮气 一氧化碳卤化氢 二氧化碳 二硫化碳 水 硫化氢 三氟化硼 氨气 三氯化磷
电子式 帮忙找一下
氢气 氧气 卤素气体 氮气 一氧化碳
卤化氢 二氧化碳 二硫化碳 水 硫化氢 三氟化硼 氨气 三氯化磷 甲烷
四氯化碳 SiH4 四氟化硅 四氯化硅
谢谢了
 彭转转941年前1
彭转转941年前1 -
 云想衣裳 共回答了20个问题
云想衣裳 共回答了20个问题 |采纳率95%在化学反应中,一般是原子的最外层电子数目发生变化。为了简便起见,化学中常在元素符号周围用小黑点“·”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式。
一、原子的电子式
原子的最外层有多少个电子就在其元素符号周围画多少个小黑点“·”或小叉“×”。原子的最外层电子有成对电子和单电子之别,写原子的电子式时,应使元素符号周围各个方向的电子尽量均匀分布。严格地讲,成对电子要排在同一个方位上,单电子分别排在不同的方位上。如锂原子写成·Li(或×Li)、氮原子写成··。
二、离子的电子式
阳离子 简单的阳离子(一般指单原子形成的阳离子)是元素原子失去最外层电子后形成的,此时若原最外层没有电子,其电子式就是它的离子符号,如钠离子写成Na+、钡离子写成Ba2+;复杂的阳离子是原子团失去一个或几个电子形成的,不仅要画出各原子的最外层电子以及它们的成键关系,而且要用“?眼 ?演”将原子团括起来,并在其右上角标明所带的正电荷数,电子式中的小黑点和小叉总数为原子团中各原子最外层电子总数减去原子团所带的电荷数值。如铵根离子写成?眼H H?演。
阴离子 简单阴离子,一般最外层是2个电子或8个电子的稳定结构,在元素符号周围画出最外层电子,并用“?眼 ?演”将其括起来,并在右上角标明所带的负电荷数,其中小黑点和小叉总数为各原子的最外层电子总数加上所带的电荷数值的绝对值,如氯离子的电子式为?眼 ?演;复杂的阴离子,要根据各原子的成键关系画出所有原子的最外层电子,然后用“?眼 ?演”将它们括起来,并在右上角标明所带的负电荷数,其小黑点和小叉总数为原子团中各原子的最外层电子数之和加上所带的电荷数值的绝对值。如氢氧根离子?眼 H?演。
三、单质分子的电子式
根据原子的最外层电子数和分子的组成判断出成键电子数和各原子的成键关系,再画出所有原子的最外层电子。如H2写成HH。
四、化合物的电子式
共价化合物 原子间通过共价键形成的化合物,原子间的单键即为一对共用电子,若为双键则有两对共用电子,依此类推。一般来说,8减去原子的最外层电子数等于该原子的成键数目(H、P例外)。写电子式时,共用电子对写在两成键原子之间,未成键的最外层电子,也应在元素符号周围画出。在共价化合物中,各元素原子最外层一般都达到了8电子(或2电子)的稳定结构。如HCl写成H 、H2O2写成H H。
离子化合物 由阴、阳离子的电子式组成,但相同的离子不能合并,若有多个阳离子或多个阴离子,书写时要使每一个离子都与带相反电荷的离子直接相邻,并注意对称、规范。如K2S写成K+?眼 ?演 K+,NaOH写成Na+?眼 H ?演 。
五、游离基的电子式
游离基是由分子失去一个或多个原子所形成的活性基团,它显电中性,电子式中的小黑点和小叉总数为各原子的最外层电子数之和。如甲基的电子式为H C H,羟基的电子式为 H。1年前查看全部
- 邻二卤代烷脱两分子卤化氢生成什么?学过大学有机的进
邻二卤代烷脱两分子卤化氢生成什么?学过大学有机的进
《基础有机化学》里是生成炔,但是某些高中资料上又是生成共轭二烯烃
请教一下产物,以及解释(拜托尽量详细)
和查依采夫规则没关系
我的意思是说,邻二卤代烷的消除,比如2,3-二氯丁烷,是分步的。
那么第一步消除是生成3-氯-1-丁烯,还是2-氯-2-丁烯?这个应该和产物有关系吧……难不成第二步消除发生了重排? 沙与泡1年前2
沙与泡1年前2 -
 舍你取谁 共回答了17个问题
舍你取谁 共回答了17个问题 |采纳率82.4%对于高中生而言,能够形成共轭二烯烃就形成共轭二烯烃。不能形成二烯烃(比如,邻卤乙烷,邻卤丙烷等等),才形成炔。
对于有机化学而言,产物实际上是很复杂的。因为不可能只出现一中纯产物。在一般条件下,主要产物服从Sayzeff规则。Sayzeff规则说的是消去产物主要倾向于从氢较少的基团消除。比如, 2-甲基-3-氯丁烷发生消去,大多数产物是2-甲基-2-丁烯,次要产物是3-甲基-1-丁烯。但是,Sayzeff规则并不限制于空间位阻效应和共轭效应。对于2,3-二氯丁烷,得到1,4-丁二烯的倾向极大,这就是共轭效应的影响。但对于1,1,4,4-四叔丁基-2,3-二氯丁烷,形成炔的可能性就大了,这是由于四个叔丁基空间位阻的影响。
分步消除其实对于2,3-二氯丁烷来说是不容易做到的。但是如果形成了所谓的中间体应该是2-氯-2-丁烯。首先满足Sayzeff规则,其次从产物上讲它有一个共轭效应,即氯的一对孤对电子与碳碳双键的p-π共轭。但是第二个氯消去时,如果生成炔的话比起第一个氯消去就显得不太容易了。因为中间体2-氯-2-丁烯是比较稳定的。于是就要形成跟稳定的物质。这样,第二个氯消去时可能先生成了累积二烯烃,不稳定,易转化为稳定的共轭二烯烃。至于如何转化的,可以参考累积二烯烃的相关文献。1年前查看全部
- 为什么卤代烃与强碱在取代反应和消去反应中均发生了卤化氢与强碱的中和反应
为什么卤代烃与强碱在取代反应和消去反应中均发生了卤化氢与强碱的中和反应
如题 一洋的BLOG1年前1
一洋的BLOG1年前1 -
 zz玩刀剑 共回答了21个问题
zz玩刀剑 共回答了21个问题 |采纳率90.5%卤化氢极易溶于水,且是强酸,例如HCI、HI.酸碱中和,所以与强碱反应.1年前查看全部
- 将下列卤化物放在浓硫酸里共热,可以得到纯净的卤化氢气体的是:
将下列卤化物放在浓硫酸里共热,可以得到纯净的卤化氢气体的是:
A 氟化钠 B 氯化钠 C 溴化钠 D 碘化钠
 nanhaiyu1231年前1
nanhaiyu1231年前1 -
 hu1984418 共回答了19个问题
hu1984418 共回答了19个问题 |采纳率84.2%A和B应该是都可以的,都符合高沸点酸制低沸点酸,并且不会被氧化成单质,但A不能用玻璃容器,必须用特殊的容器进行.C和D不行,因为浓硫酸具有氧化性,可以氧化溴化氢或者碘化氢.1年前查看全部
- 比较卤素、卤化氢、次卤酸对双键的离子型加成反应的机理的异同点.如何判断加成方向,
 tentenzhang1年前1
tentenzhang1年前1 -
 dxy_312 共回答了17个问题
dxy_312 共回答了17个问题 |采纳率94.1%亲电加成,经验规律:一般情况下H加到含H多的原子上,在过氧化物的条件下相反1年前查看全部
- 乙醇氧化成乙醛是消去反应吗?有机化合物再适当的条件下,从一个分子脱去一个小分子(如水、卤化氢等分子),而生成不饱和(双键
乙醇氧化成乙醛是消去反应吗?
有机化合物再适当的条件下,从一个分子脱去一个小分子(如水、卤化氢等分子),而生成不饱和(双键或三键)化合物的反应,叫做消去反应.
消去反应一定要形成碳碳双键或碳碳三键吗?碳氧双键算不算
希望给我答案的人给我这个答案:消去反应一定要形成碳碳双键或碳碳三键吗?碳氧双键算不算? will8211181年前1
will8211181年前1 -
 米特兰的晨星 共回答了17个问题
米特兰的晨星 共回答了17个问题 |采纳率76.5%乙醇氧化成乙醛不是消去反应
消去反应
有机化合物再适当的条件下,从一个分子脱去一个小分子(如水、卤化氢等分子),而生成不饱和(双键或三键)化合物的反应,叫做消去反应.醇类和卤代烃能发生消去反应.消去反应发生的条件:醇分子中,连有羟基(-OH)的碳原子必须有相邻的碳原子且此相邻的碳原子上还必须连有氢原子时,才可发生消去反应而形成不饱和键.消去反应的规律:含一个碳原子的醇(如CH3OH)无相邻的碳原子,所以不能发生消去反应;与羟基相连碳原子相邻的碳原子上没有氢原子的醇也不能发生消去反应.1年前查看全部
- 下列 叙述中正确的是:1卤化氢都是无色比空气重的气体2卤化氢在空气中都能形成白雾3卤化银都难溶于水
下列 叙述中正确的是:1卤化氢都是无色比空气重的气体2卤化氢在空气中都能形成白雾3卤化银都难溶于水
4卤素单质与水反应都生成对应的次卤酸 窈月1年前1
窈月1年前1 -
 hangzhourice 共回答了17个问题
hangzhourice 共回答了17个问题 |采纳率88.2%答案是B
A:氟化氢的密度比空气小
C:氟化银是易溶于水的
D:氟单质和水反应不符合这个规律.氟没有正价,不存在次氟酸.
方程式是:2F2+2H2O=4HF+O21年前查看全部
- 卤化氢的稳定性由什么决定?例如HF HCL HBR HI
 心碎的糖果1年前1
心碎的糖果1年前1 -
 songyang831001 共回答了22个问题
songyang831001 共回答了22个问题 |采纳率90.9%卤化氢的稳定性由最外层电子书决定
例如HF,HCl,HBr,HI,H最外层为1个电子,最容易失去,F最外层有7个电子,最容易得到一个电子而形成8电子稳定结构,一个易得一个易失,所以稳定.1年前查看全部
- 乙烯与卤单质,卤化氢,h2O,h2 的反应条件 ,请告诉哦规律 条件、、、
 dd啊31年前2
dd啊31年前2 -
 wanjun8659 共回答了12个问题
wanjun8659 共回答了12个问题 |采纳率91.7%卤单质:CCl4溶剂(或不写条件)
卤化氢:催化剂、加热
H2O:催化剂、加压、加热
H2 :镍粉、加热
这完全是高考要求1年前查看全部
- 卤化氢的热分解温度?
 fdlog1年前1
fdlog1年前1 -
 六月雪1990 共回答了20个问题
六月雪1990 共回答了20个问题 |采纳率95%HF>HCl>HBr>HI
HF:2000度以上还不见分解迹象(一般认为氟化氢不会热分解).
HCl:1000度以上开始缓慢分解.
HBr:500度分解
HI:300度分解1年前查看全部
- 卤化氢中,分子取向力依次递增的顺序为?解题思路是什么呢?
 free毛毛虫1年前1
free毛毛虫1年前1 -
 天字第一美 共回答了20个问题
天字第一美 共回答了20个问题 |采纳率85%分子极性越大,取向力越大.
所以HI < HBr < HCl < HF1年前查看全部
- 高一化学(选择题)很简单哦下列正确的是A 卤化氢溶于水均为强酸B 碱金属在空气中加热均可生成多种氧化物C 焰色反应属于化
高一化学(选择题)很简单哦
下列正确的是
A 卤化氢溶于水均为强酸
B 碱金属在空气中加热均可生成多种氧化物
C 焰色反应属于化学变化
D 新制氯水中含有7种不同微粒 绝对是炮灰1年前4
绝对是炮灰1年前4 -
 mengxiner 共回答了18个问题
mengxiner 共回答了18个问题 |采纳率88.9%氢氟酸是弱酸,故A错
Li加热只生成Li2O,故B错
焰色反应是物理变化(实质涉及到原子光谱的问题),故C错
新制氯水中含有7种不同微粒:Cl2分子 Cl- H2O分子 ClO- H+ OH- HClO分子
新年快乐!1年前查看全部
- 烯烃与卤化氢加成会重排么那么烯烃与卤素单质,炔烃与卤化氢,卤素加成会重排么
 shzi3711年前2
shzi3711年前2 -
 vs1933 共回答了13个问题
vs1933 共回答了13个问题 |采纳率84.6%直接加卤化氢,经历碳正离子当然会重排
卤素单质不会1年前查看全部
- 11月3日化学定时练习22,醇与卤化氢加入浓硫酸共热反应是制备卤代烃的重要方法
11月3日化学定时练习22,醇与卤化氢加入浓硫酸共热反应是制备卤代烃的重要方法
实验室制备溴乙烷和1-溴丁烷均用此原理.有关数据列表如下: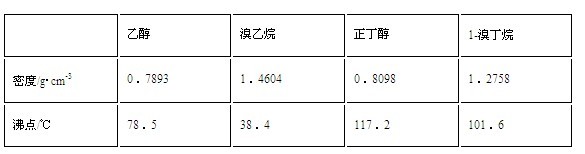
(1)请写出制溴乙烷的有关反应方程式:_____________________
请给出答案,并告诉为什么这么写, bessie_lu1年前1
bessie_lu1年前1 -
 闲着的眼_CC 共回答了22个问题
闲着的眼_CC 共回答了22个问题 |采纳率90.9%C2H5OH+HBr→浓H2SO4,△→
C2H5Br+H2O
溴化氢中的溴原子取代乙醇中的羟基,生成溴乙烷和水,是取代反应.
此反应是可逆反应,浓硫酸具有吸水性,可以吸收反应生成的水,使反应有利于向正方向进行.1年前查看全部
- 卤化氢活性为什么是HI>HBr>Hcl>HF
 pkaa1年前2
pkaa1年前2 -
 yangxiongyuan 共回答了14个问题
yangxiongyuan 共回答了14个问题 |采纳率100%这跟卤素离子的活性有关(即电负性),氟离子的电负性最大,依次降低,由于电负性大,与氢离子结合能力越强,这样形成的卤化氢的活性就越小.1年前查看全部
- 卤代烷分子内脱去卤化氢得到烯烃,烯烃双键的位置遵循什么规则?
 dmsch1年前2
dmsch1年前2 -
 ANGELBEAR 共回答了15个问题
ANGELBEAR 共回答了15个问题 |采纳率86.7%查依采夫规律
氢越少越消氢.1年前查看全部
- 卤化氢的稳定性从上到下依次减弱,可熔沸点却依次升高了(除过氟化氢)?
卤化氢的稳定性从上到下依次减弱,可熔沸点却依次升高了(除过氟化氢)?
不是越稳定的物质越不易破坏,破坏的所需能量更多,熔沸点越高 91090dxt1年前2
91090dxt1年前2 -
 文君仙子 共回答了26个问题
文君仙子 共回答了26个问题 |采纳率92.3%卤化氢的稳定性,是分子间共价键决定的,也就是氢元素与卤素的共价键.
而熔沸点是由于范德华力、氢键等分子间作用力决定的.1年前查看全部
- 下列叙述中不正确的是( )A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,分子越稳定B.以极性键结合的分子,不
下列叙述中不正确的是( )
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越强,分子越稳定
B.以极性键结合的分子,不一定是极性分子
C.判断A2B或AB2型分子是极性分子的依据是:具有极性键且分子构型不对称、键角小于180°的非直线形结构
D.非极性分子中,各原子间都应以非极性键结合 zhanglon1年前1
zhanglon1年前1 -
 sjnyammy 共回答了8个问题
sjnyammy 共回答了8个问题 |采纳率100%解题思路:A.同一主族,从上往下,原子半径在逐渐增大,非金属性减弱,I>Br>Cl>F,所以卤化氢按H-F、H-Cl、H-Br、H-I的顺序,共价键的极性依次减弱,分子稳定性依次减弱;
B.不同种元素原子之间形成的共价键是极性共价键,含有极性键结构对称且正负电荷的中心重合的分子为非极性分子;
C.分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子;
D.不同非金属元素之间易形成极性共价键,分子的结构对称、正负电荷的中心重合,则为非极性分子;A.HF和HCl,因为F的氧化性比Cl的强 所以F对H的电子的吸引力比Cl的强,所以共用电子对就更偏向F,所以HF的共价键的极性就更强,同主族中,由上到下,随核电荷数的增加半径在逐渐增大,非金属性减弱,所以卤化氢稳定性为HF>HCl>HBr>HI,共价键的极性依次减弱,故A正确;
B.如CH4含有H-C极性键,空间构型为正四面体,结构对称且正负电荷的中心重合,为非极性分子,故B正确;
C.对于A2B或AB2型分子;由极性键构成的分子,由该分子的分子空间结构决定分子极性.如果分子的立体构型为直线形键角等于180°、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子.若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子,故C正确;
D.非极性分子中,各原子间不一定以非极性键结合,如CO2中含极性键,为直线型,结构对称,为非极性分子,故D错误;
故选D.点评:
本题考点: 极性键和非极性键;判断简单分子或离子的构型.
考点点评: 本题考查键的极性与分子的极性,注意判断键的极性,抓住共价键的形成是否在同种元素原子之间;分子极性的判断,抓住正负电荷的中心是否重合,题目难度不大.1年前查看全部
- 卤化氢分子等不对称分子与碳碳双键进行加成时,显正电性的一端加成到碳碳双键上与氢原子结合较多的碳原子,显负电性的一端加成到
卤化氢分子等不对称分子与碳碳双键进行加成时,显正电性的一端加成到碳碳双键上与氢原子结合较多的碳原子,显负电性的一端加成到另一碳原子上
 嘎嘎a1年前1
嘎嘎a1年前1 -
 kanzhewo 共回答了23个问题
kanzhewo 共回答了23个问题 |采纳率82.6%就是说卤化氢分子等不对称分子与碳碳双键进行加成时,氢加在氢多的碳上
举个例子,CH3CH==CH2和HCl反应
生成的CH3CHClCH3是主产物,而CH3CH2CH2Cl则相对较少1年前查看全部
- 乙炔与卤化氢加成的第二步为什么是生成偕二卤代烃而不是邻二卤代烃?
乙炔与卤化氢加成的第二步为什么是生成偕二卤代烃而不是邻二卤代烃?
比如说CH≡CH与HCl加成第一步生成CH2=CHCl,-Cl不是会使碳正离子不稳定吗?为什么接下来生成的是CH3-CHCl2而不是CH2Cl-CH2Cl? hwcl20081年前3
hwcl20081年前3 -
 双月刊 共回答了12个问题
双月刊 共回答了12个问题 |采纳率66.7%因为在C原子的电子云在被氯原子吸附发生电子云的偏离变成带正电后,如果后续加成的是H会导致邻二卤代烃的不稳定,也就说理论上这种物质可能存在,但不稳定!因为邻二卤代烃整个分子的电子云会发生偏移二导致两个碳原子带正电.1年前查看全部
- 浓硫酸和卤化氢反应的问题 有以下两方程式:SO2 + Br2 + 2H2O = 2HBr + H2SO4 2HBr +
浓硫酸和卤化氢反应的问题
有以下两方程式:SO2 + Br2 + 2H2O = 2HBr + H2SO4
2HBr + H2SO4(浓)=Br2 + SO2↑ +2H2O
前者说明溴的氧化性大于6价的s 后者恰好相反
SO2 + Br2 + 2H2O = 2HBr + H2SO4
这个是高中化学必修一的方程式,时可逆的吗? Mr贾老练1年前5
Mr贾老练1年前5 -
 vouiybdlreb 共回答了18个问题
vouiybdlreb 共回答了18个问题 |采纳率94.4%毫无疑问,溴的氧化性是强于硫的,也强于6价的硫
但是浓硫酸6价硫离子的浓度很大,我们说的浓硫酸一般浓度不低于百分之九十八
几乎是纯的,这就大大增强了6价硫的氧化性
所以才会有
2HBr + H2SO4(浓)=Br2 + SO2↑ +2H2O
这个反应,而稀硫酸就不行,氧化性很弱
同样,浓硝酸的氧化性也强于希硝酸
物质的氧化性,主要有元素的性质决定,但也受元素的表现形式,比如氧气和臭氧的区别,氧气分子有两个氧原子组成,臭氧分子有三个氧原子组成,臭氧的氧化性比氧气强的多
还受温度,浓度的影响
比如二氧化锰常温下不能和盐酸反应,但是加热的时候可以将盐酸中的氯离子氧化成氯气
硫酸,稀硫酸氧化性很弱,只能和活泼的金属反应,而浓硫酸却能和绝大多数金属反应,还能将溴化氢,碘化氢氧化
最后你说的那个反应是不可逆的,正反应中水很多,生成的是稀硫酸;如果没有水存在溴也不可能将二氧化硫氧化成硫酸的1年前查看全部
- (2013•南昌二模)将某种金属卤化物和浓硫酸在烧瓶里加热后,可得到无色卤化氢气体,则该金属卤化物是( )
(2013•南昌二模)将某种金属卤化物和浓硫酸在烧瓶里加热后,可得到无色卤化氢气体,则该金属卤化物是( )
A.氟化物
B.氯化物
C.溴化物
D.碘化物 洒水节1年前1
洒水节1年前1 -
 snowflake_365 共回答了14个问题
snowflake_365 共回答了14个问题 |采纳率100%解题思路:浓硫酸具有强氧化性,能氧化某些强还原性的氢化物,氢氟酸能和二氧化硅反应,据此分析解答.A.玻璃中含有二氧化硅,氢氟酸和二氧化硅反应生成四氟化硅,所以不能用普通圆底烧瓶制取氟化氢,故A不选;
B.利用高沸点的酸制取挥发性酸原理,盐酸是挥发性酸,浓硫酸是高沸点酸,且氯化氢和玻璃不反应,所以可以用浓硫酸和氯化钠制取氯化氢,故B选;
C.溴化氢能被浓硫酸氧化而得不到溴化氢,故C不选;
D.碘化氢易被浓硫酸氧化生成碘单质而得不到碘化氢,故D不选;
故选B.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查了氢化物的制取,为高频考点,侧重于学生的分析能力的考查,明确氢化物和浓硫酸的性质是解本题关键,注意难挥发性酸制取易挥发性酸的反应原理,题目难度不大.1年前查看全部
- 下列关于卤化氢的说法中不正确的是( )
下列关于卤化氢的说法中不正确的是( )
A. 卤素原子半径越大,氢化物越稳定
B. 卤素原子半径越大,氢化物越不稳定
C. 卤化氢稳定性为HF>HCl>HBr>HI
D. 卤素单质与氢气越难反应,生成物越不稳定 bettywang611年前1
bettywang611年前1 -
 ulganix 共回答了15个问题
ulganix 共回答了15个问题 |采纳率93.3%解题思路:根据非金属强弱的比较依据:
1、同周期中,从左到右,随核电荷数的增加,原子半径逐渐减小,非金属性增强;同主族中,由上到下,随核电荷数的增加,原子半径逐渐增大,非金属性减弱;
2、依据最高价氧化物的水化物酸性的强弱:酸性愈强,其元素的非金属性也愈强;
3、依据其气态氢化物的稳定性:稳定性愈强,非金属性愈强;
4、与氢气化合的条件:越容易非金属性越强.A、同主族中,由上到下,随核电荷数的增加,原子半径逐渐增大,非金属性减弱,氢化物越不稳定,故A错误;
B、同主族中,由上到下,随核电荷数的增加,原子半径逐渐增大,非金属性减弱,氢化物越不稳定,故B正确;
C、同主族中,由上到下,随核电荷数的增加,非金属性减弱,卤化氢稳定性为HF>HCl>HBr>HI,故C正确;
D、同主族中,由上到下,随核电荷数的增加,非金属性减弱,与氢气越难反应,生成物越不稳定,故D正确;
故选:A.点评:
本题考点: 卤素原子结构及其性质的比较.
考点点评: 抓住非金属性越强,与氢气越容易反应,生成物越稳定.1年前查看全部
- 卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性越强?
卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性越强?
WHY? lovingrock1年前3
lovingrock1年前3 -
 冷茉DANNY 共回答了19个问题
冷茉DANNY 共回答了19个问题 |采纳率84.2%对的.
非金属性越强,电负性越大(电负性与氢的差别也越大),故键的极性越强.
这里的稳定性是指热稳定性,和键能成正比.
H-F的键能是所有H-X键中最高的.1年前查看全部
- 4.10-1/将如下卤化物跟浓硫酸放在烧瓶中共热,可以得到纯净卤化氢气体的是()?
4.10-1/将如下卤化物跟浓硫酸放在烧瓶中共热,可以得到纯净卤化氢气体的是()?
(A)NaF (B)NaCl (C)NaBr (D)NaI
到底是哪个呢?说明理由. 落叶831年前1
落叶831年前1 -
 rocksuper 共回答了18个问题
rocksuper 共回答了18个问题 |采纳率94.4%B
A选项会生成HF,而HF会腐蚀玻璃,实验应在铅皿内进行.
C、D选项中的Br-、I-还原性较强,会被浓硫酸氧化为Br2、I2,浓硫酸被还原为SO2,混入制得的气体中.1年前查看全部
- 小环与卤化氢加成,有区域选择性,那么第三个个式子里的卤素为什么加在那个碳上,
 avis1年前1
avis1年前1 -
 旭日苛 共回答了14个问题
旭日苛 共回答了14个问题 |采纳率92.9%与HCl加成的时候,从含氢最多的和含氢最少的C-C键上断裂,加成产物符合马氏规则1年前查看全部
- HBr 是否有色卤化氢是否有色
 xiejian524457921年前4
xiejian524457921年前4 -
 duxiaozi 共回答了16个问题
duxiaozi 共回答了16个问题 |采纳率93.8%HBr是无色有辛辣刺激气味的气体 ,
要Br2才有颜色的:红棕色发烟液体.
卤化氢都是无色的:
氟化氢(化学式:HF)是一种极强的腐蚀剂,有剧毒.它是无色的气体,但是在空气中,只要超过3ppm就会产生刺激的味道.
氯化氢(化学式:HCl)无色气体,其水溶液为盐酸,强酸性.
碘化氢(化学式:HI)无色气体,易溶于水.1年前查看全部
- 卤化氢分子,卤素的非金属性越强,共价键的极性越强,稳定性也越强。 这句话对吗?
卤化氢分子,卤素的非金属性越强,共价键的极性越强,稳定性也越强。 这句话对吗?
我们老师讲:呈键原子电负性差别越大电子对偏移程度越大,共价键的极性越强,越不稳定。不相矛盾吗?晕~~~帮帮忙,谁会?急~~~~
 shmhycj1年前4
shmhycj1年前4 -
 square861220 共回答了19个问题
square861220 共回答了19个问题 |采纳率89.5%我们老师讲:呈键原子电负性差别越大电子对偏移程度越大,共价键的极性越强,越不稳定.
你确定是你们老师说的吗?共价键的极性越强 原子间力的作用越强 越稳定1年前查看全部
- 1.烯烃和卤化氢反应,能与氟化氢和碘化氢反应吗?2.醇与三卤化磷反应只能与三溴化磷和三碘化磷吗?
 新节1年前1
新节1年前1 -
 yuaiyu 共回答了20个问题
yuaiyu 共回答了20个问题 |采纳率100%卤化氢包括所有卤素自然可以,后者不清楚,但是有机反应一般都不完全且有副反应1年前查看全部
- 制卤化氢的方法A NaCl与浓硝酸加热制备HClB NaF与浓硫酸加热制备HFC NaBr与浓磷酸加热制备HBrD Na
制卤化氢的方法
A NaCl与浓硝酸加热制备HCl
B NaF与浓硫酸加热制备HF
C NaBr与浓磷酸加热制备HBr
D Nal与浓硫酸加热制备HI ArieSViv11年前1
ArieSViv11年前1 -
 fggffgff 共回答了13个问题
fggffgff 共回答了13个问题 |采纳率84.6%强酸制弱酸!1年前查看全部
- 关于卤化氢 HI的制取HI可以用KI和浓磷酸制取那可以用NaI和浓磷酸制取吗?还有就是HCl可以用NaCl和浓磷酸制取吗
关于卤化氢 HI的制取
HI可以用KI和浓磷酸制取
那可以用NaI和浓磷酸制取吗?
还有就是HCl可以用NaCl和浓磷酸制取吗
我知道可以用浓硫酸拉 铁扯淡1年前1
铁扯淡1年前1 -
 psyczx 共回答了19个问题
psyczx 共回答了19个问题 |采纳率84.2%可以,只要是卤盐与高沸点酸进行反应就可以
注意:HI与HBr不能用浓硫酸制取,因为浓硫酸与HI和HBr会反应.1年前查看全部
- 卤化氢的制取问题HBr,HI的制取不能用浓硫酸,要用浓磷酸,这个问题我懂了,但是我还想问,为什么不能用稀硫酸?
 fzxfzx1年前1
fzxfzx1年前1 -
 jiagonghe 共回答了13个问题
jiagonghe 共回答了13个问题 |采纳率84.6%因为HBr,HI易溶于水,稀硫酸中含有大量的水,HBr,HI在有大量水的条件下不易挥发,不能触发复分解反应发生的条件,所以不能用稀硫酸
用浓硫酸,浓磷酸都是尽量减少水分的含量
如NaI+H3PO4(浓)==HI(气体)+NaH2PO4,必须使HI挥发离开反应体系,复分解反应才能发生.1年前查看全部
- 乙醇和卤化氢反应条件是什么?
 纪小榭1年前2
纪小榭1年前2 -
 shangshanhui 共回答了19个问题
shangshanhui 共回答了19个问题 |采纳率89.5%一般要加酸或盐做催化剂,如与HBr反应,通常要在硫酸存在的条件下进行,与HCl要在ZnCl2存在条件下加热进行.1年前查看全部
- 饱和醇与卤化氢怎么反应?形象一点:R-OH+HX====?
 沙漠中的oo1年前3
沙漠中的oo1年前3 -
 ncjskdfoaipsudf 共回答了17个问题
ncjskdfoaipsudf 共回答了17个问题 |采纳率82.4%R-OH+HX====R-X + H2O1年前查看全部
- 卤化氢都是气体吗?都易溶于水而形成白雾吗?
 changhechang1年前2
changhechang1年前2 -
 haohao3840 共回答了28个问题
haohao3840 共回答了28个问题 |采纳率92.9%常温下都是气体, 均易溶于水,在空气中形成白雾,水溶液均呈酸性,只有氢氟酸是弱酸,从HF到HI,酸性逐渐增强1年前查看全部
- 查依采夫规则查依采夫规则的内容:卤代烃脱卤化氢时,总是脱去含氢较少的β碳原子上的氢,或者说总是生成双键碳上连有烃基较多的
查依采夫规则
查依采夫规则的内容:
卤代烃脱卤化氢时,总是脱去含氢较少的β碳原子上的氢,或者说总是生成双键碳上连有烃基较多的烯烃.
这句 “总是生成双键碳上连有烃基较多的烯烃.”如何理解,请举例说明 流浪的精灵1年前1
流浪的精灵1年前1 -
 网络痴狂 共回答了17个问题
网络痴狂 共回答了17个问题 |采纳率82.4%比如
C Br
C-C-C-C 根据查依采夫规则
C
产物为 C-C=C-C
C
非C-C-C=C1年前查看全部
- 卤化氢制备装置制备HCL HBr HI的实验 用什么样子的装置?急
 冰点随心1年前1
冰点随心1年前1 -
 chengcheng2005 共回答了15个问题
chengcheng2005 共回答了15个问题 |采纳率100%就用二氧化锰制备氯气的那套装置..
就铁架台 圆底烧瓶 石棉网 酒精灯这些
用向上排空气法收集
尾气处理用水..
还有 制备氯化氢可以用浓硫酸和氯化钠反应..
但是制备溴化氢和碘化氢就只能用浓磷酸了..因为溴化氢和碘化氢的还原性较强会被浓硫酸氧化..1年前查看全部
- 帮忙解释下乙醇和卤化氢的反应药品:溴化钠2~3克,少量的乙醇,两倍于乙醇的硫酸(1:1).操作:把溴化钠2~3克,少量的
帮忙解释下乙醇和卤化氢的反应
药品:溴化钠2~3克,少量的乙醇,两倍于乙醇的硫酸(1:1).
操作:把溴化钠2~3克,少量的乙醇,两倍于乙醇的硫酸(1:1)加入圆底烧瓶中,塞上带有长导管的塞子,长导管的另一端浸入装有水和冰的试管中,用酒精灯加热烧瓶.片刻后,观察试管底部的现象.
为啥要用硫酸和溴化钠捏?
长导管的另一端浸入装有水和冰的试管中
为啥是冰和水呢 drwf331年前1
drwf331年前1 -
 bailazhang 共回答了11个问题
bailazhang 共回答了11个问题 |采纳率90.9%这个实验的目的是,乙醇与HBr发生取代反应,生成溴乙烷,
但由于实验室中没有现成的HBr,需要自己制备,
所以,用不挥发性酸硫酸与溴化钠发生复分解反应,生成HBr,这个原理类似于HCl的制备.
按道理,用浓硫酸更好,但考虑到浓硫酸具有强氧化性,而Br-的还原性较Cl-大,所以会被浓硫酸氧化成Br2,因此往往使用1:1的较浓的硫酸.
长导管浸入水和冰中,听上去应该是为了冷却,但好像没有遇到过这样的问法,又看不到图,难以回答.1年前查看全部
- 各种制卤化氢方法的优缺点求直接化合法,卤素与其他还原剂作用,高沸点酸制低沸点酸的优缺点
 abcbusi1年前1
abcbusi1年前1 -
 cbm6mb2 共回答了24个问题
cbm6mb2 共回答了24个问题 |采纳率95.8%一般用浓硫酸和氟化物以及氯化物制取氟化氢以及氯化氢,溴化氢和碘化氢因为浓硫酸氧化性过强一般用磷酸制取.
值得注意的是 浓硫酸制取前两种 硫酸会变为硫酸氢钠,当温度要很高时才会变为硫酸钠,一般不会让高温制取的.
卤素与其他还原剂 比如和氢气直接反应制取,纯度不好,反应也不易很好的控制,设备(反应容器)没有前一种方便易行.1年前查看全部
- 不与卤化氢反应说明什么问题分子式C7H8O反应的话又说明什么问题溶于NAOH说明什么问题有苯环
 LANGPING19781年前5
LANGPING19781年前5 -
 tongyitiaohe 共回答了12个问题
tongyitiaohe 共回答了12个问题 |采纳率100%不与卤化氢说明没有可加成的双键
溶NAOH说明有酚羟基或者羧基
这东西差不多就是甲苯酚,邻间对1年前查看全部
- 关于卤素单质、卤化氢、含氢键的物质的性质的问题(高中阶段)
关于卤素单质、卤化氢、含氢键的物质的性质的问题(高中阶段)
请问卤素单质、卤化氢的稳定性,熔沸点有没有一定的规律?
氢键对于一个物质的性质的影响?
请回答得详细些.感谢各路高手留意. 7moon1年前1
7moon1年前1 -
 高美人 共回答了21个问题
高美人 共回答了21个问题 |采纳率90.5%卤素单质的稳定性大小比较是:F2HI,同一组主族元素,从上到下,原子半径依次增大,对核外电子的吸引能力依次减弱,对氢原子的束缚力小,氢化物就越不稳定,
卤化氢的熔沸点也是依次增大
氢键对于一个物质的性质的影响:在极性溶剂中,如果溶质分子与溶剂分子之间可以形成氢键,则溶质的溶解度增大.HF和NH3在水中的溶解度比较大,就是这个缘故.液体分子间若形成氢键,有可能发生缔合现象,例如液态HF,在通常条件下,除了正常简HF分子外,还有通过氢键联系在一起的复杂分子(HF)n.nHF(HF)n .其中n可以是2,3,4….这种由若干个简单分子联成复杂分子而又不会改变原物质化学性质的现象,称为分子缔合.分子缔合的结果会影响液体的密度.希望可以采纳!1年前查看全部
- 2-戊烯与卤化氢如何加成2种加成是不是都有,有一种是最主要的呢?
 l1218y1年前2
l1218y1年前2 -
 睡梦中的浮萍 共回答了16个问题
睡梦中的浮萍 共回答了16个问题 |采纳率87.5%3位上卤素,2位上氢,
原因是乙基的给电子能力比甲基强
不过也是相对的,实际上这两个基团差不多,所以最后应该是2-卤戊烷和3-卤戊烷都有1年前查看全部
- 为什么烯基碳正离子不重排?在炔烃与卤化氢的亲电加成反应中,中间体是烯基碳正离子,这很不稳定,但若重排成烯丙位碳正离子会稳
为什么烯基碳正离子不重排?
在炔烃与卤化氢的亲电加成反应中,中间体是烯基碳正离子,这很不稳定,但若重排成烯丙位碳正离子会稳定很多,那为什么不重排呢? shaoping1年前2
shaoping1年前2 -
 睡在vv 共回答了17个问题
睡在vv 共回答了17个问题 |采纳率88.2%有时候并不是看中间产物的稳定性高不高,重要的是最后产物的稳定.你可以比较下两种方法获得产物的能量高低.1年前查看全部
- 氯化氢\硫化氢 酸性比较氯化氢不是更稳定么,那是不是硫化氢更易电离出氢离子,这样不就是硫化氢酸性更强了么?我是类比卤化氢
氯化氢硫化氢 酸性比较
氯化氢不是更稳定么,那是不是硫化氢更易电离出氢离子,这样不就是硫化氢酸性更强了么?
我是类比卤化氢的酸性来着.还是因为硫化氢是弱酸,而卤化氢都是强酸?
还有个问题,我总是弄不明白一个族或一个周期该比些什么,稳定性?对应酸碱强弱? 我来了也1年前4
我来了也1年前4 -
 其言也善 共回答了16个问题
其言也善 共回答了16个问题 |采纳率93.8%稳定的意思是氯化氢分子不易分解 像水可以通电变成氢气和氧气 稳定性和酸碱性不同,没直接关系 卤化氢酸性同一族越来越强 因为同一族原子半径越来越大,对电子的束缚能力越来越小,只是比较他们酸性的根本依据,同一周期原子半径越来越小,最高价氧化物对应水化物酸性越来越强 原因是与他们的结构有关,不易打字说明,记住就行了,原因找根本1年前查看全部
- 问一道化学题12.有两种卤素单质共1mol,跟氢气在一定条件下完全反应后生成的卤化氢的平均式量为38.5,则该两种卤素单
问一道化学题
12.有两种卤素单质共1mol,跟氢气在一定条件下完全反应后生成的卤化氢的平均式量为38.5,则该两种卤素单质可能是( )
A.F2和Cl2 B.F2和Br2 C.Cl2和Br2 D.Br2和I2 司徒拙1年前7
司徒拙1年前7 -
 可口可乐FLY 共回答了22个问题
可口可乐FLY 共回答了22个问题 |采纳率90.9%BC
HX平均式量为38.5→X平均式量为37.5→X2平均式量为78
F2为38
Cl2为71
Br2为160
I2为254
只有F2和Br2或Cl2和Br2平均才可能得到78的平均式量
所以选BC1年前查看全部
- 下列方法不可用于实验室制备卤化氢气体的是
下列方法不可用于实验室制备卤化氢气体的是
A.NaCl饱和溶液与稀硫酸共热制备HCl
B.NaF固体与浓硫酸共热制备HF
C.KI固体与浓硫酸共热制备HI
D.NaBr固体与稀硫酸共热制备HBr
详细解析!谢~~~~!
说一下为什么,怎么办,会有哪些后果,好的给分! yx_shan1年前1
yx_shan1年前1 -
 漫步憧憬 共回答了13个问题
漫步憧憬 共回答了13个问题 |采纳率92.3%B 是正确答案2NAF+H2SO4=2HF+_NA2SO41年前查看全部
- 在烧瓶中将一卤化物与浓H2SO4的混合物共热制卤化氢气体,该卤化物是( )
在烧瓶中将一卤化物与浓H2SO4的混合物共热制卤化氢气体,该卤化物是( )
A.CaF2 B.NaCl C.KBr D.KI scott831061年前4
scott831061年前4 -
 胡艾 共回答了17个问题
胡艾 共回答了17个问题 |采纳率88.2%B
A生成HF腐蚀玻璃,不能用烧瓶
CD的卤化氢都会被浓H2SO4氧化,不能用浓H2SO4,应用无氧化性的浓磷酸1年前查看全部
大家在问
- 1一道很难的数学题969,486,192,18下一个数字是什么?若有知道的人,请给详解.这道题之前我也在知道上挂过,但都在
- 2英语say的理解The name bothers me since my name is Joe ,which some
- 31有句子关联词填空 2修改病句 3诗词运用(在语境里) 4词语 最好要附加答案 要1小时之内
- 4在等差数列{an}中,若a3+a4+a5+a6+a7=450,则数列{an}的前9项的和为( )
- 5把I cant't find the book 和I bought a book yesterday 合并成定语从句
- 6帮我解释一个简单英语句子Busy as they are,parents should set aside at lea
- 7i am happy because that you are get along well 中文意思是什么
- 8若2和b=0.5:5分之4,a:c=0.8,则a:b:c=
- 9已知0.1mol/L的NaHSO4溶液中H﹢的物质的量浓度为0.1mol/L
- 10The spring Festival holidays are coming.中文意思
- 11用比喻句给《无锡的街巷》一书写广告词
- 12How about _____ the music? [ ]
- 13常见的物理层传输媒体是什么?
- 14(3/4-1/5÷4)×5/14 简便计算,
- 15北师大数学八年级(上)数学书勾搭定理P24的第4题答案
