硫化钙为什么在水中不存在?为什么会生成硫氢化钙?
 m4694925652022-10-04 11:39:541条回答
m4694925652022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 了即 共回答了16个问题
了即 共回答了16个问题 |采纳率81.3%- 因为生成的硫化锌溶于酸若反应则是:Zn2 H2S== ZnS 2H 这个反应是逆向进行的.而硫化钙是也是出于同样的道理硫化钙固体遇水就水解了,在水中不存在
- 1年前
相关推荐
- 各位大哥大姐,我想问下,写电子式的时候用“·”和“×”表示电子有什么区别吗?请说详细点,还有,硫化钙的电子式是什么?请画
各位大哥大姐,我想问下,写电子式的时候用“·”和“×”表示电子有什么区别吗?请说详细点,还有,硫化钙的电子式是什么?请画图,
 紫范1年前8
紫范1年前8 -
 未完的童话 共回答了16个问题
未完的童话 共回答了16个问题 |采纳率87.5%1年前查看全部
- 用化学用语填空:(1)氯气______,2个钙原子______,3个硝酸根离子______;氧化钠______;硫化钙中
用化学用语填空:
(1)氯气______,2个钙原子______,3个硝酸根离子______;氧化钠______;硫化钙中硫元素显-2价Ca−2 S Ca;硝酸铝______;硫酸亚铁______.−2 S
(2)某一消毒剂由Cl和O两种元素组成,且每个分子中含有1个Cl原子,2个O原子,该消毒剂的化学式是______. qp0cmc1年前1
qp0cmc1年前1 -
 韩小ii 共回答了18个问题
韩小ii 共回答了18个问题 |采纳率94.4%解题思路:每个氯气分子由2个氯原子构成;
元素符号可以表示一种元素,该元素的1个原子,有时还可以表示一种物质;
每个硝酸根离子带1个单位负电荷;
氧化钠中,钠元素的化合价是+1,氧元素的化合价是-2,根据化合物中元素的化合价代数和为零,可以计算出氧化钠中钠原子和氧原子的个数比是2:1;
元素的化合价应该标在元素符号的正上方;
硝酸铝中,铝元素的化合价是+3,硝酸根的化合价是-1,根据化合物中元素的化合价代数和为零,可以计算出硝酸铝中,铝离子和硝酸根离子的个数比是1:3;
硫酸亚铁中,铁元素的化合价是+2,硫酸根的化合价是-2,根据化合物中元素的化合价代数和为零,可以计算出硫酸亚铁中,亚铁离子和硫酸根离子的个数比是1:1.
(2)根据物质的构成原子个数比可以书写物质的化学式.(1)氯气可以表示为Cl2;
2个钙原子可以表示为2Ca;
3个硝酸根离子可以表示为3NO3-;
氧化钠可以表示为Na2O;
硫化钙中硫元素显-2价可以表示为Ca
−2
S;
硝酸铝可以表示为Al(NO3)3;
硫酸亚铁可以表示为FeSO4.
故填:Cl2;2Ca;3NO3-;Na2O;Ca
−2
S; Al(NO3)3;FeSO4.
(2)某一消毒剂由Cl和O两种元素组成,且每个分子中含有1个Cl原子,2个O原子,该消毒剂是二氧化氯,化学式是ClO2.
故填:ClO2.点评:
本题考点: 化学符号及其周围数字的意义;化学式的书写及意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,重点考查了学生对化学符号的书写,考查全面,注重基础,题目难度较小.1年前查看全部
- 关于CaC2(碳化钙)和CS2(二硫化钙)电子式的问题
关于CaC2(碳化钙)和CS2(二硫化钙)电子式的问题
前者电子式是Ca2+[:C三C:]- 后者是 :S::C::S:
电子式为什么要这样写呢?
成多少个键怎么看呀? rainyprince1年前1
rainyprince1年前1 -
 aibingzhu 共回答了20个问题
aibingzhu 共回答了20个问题 |采纳率85%成几个键,就是有几个共用电子对.Ca2+[:C三C:]- 这个就是成了三键 :S::C::S:成双键1年前查看全部
- 怎样改正下列错误的化学式水 H02 氖气 Ne2 氯化铝 AlCl2硫化钙 Ca2S 氮气 N
 阳之颠1年前1
阳之颠1年前1 -
 宛杭 共回答了20个问题
宛杭 共回答了20个问题 |采纳率90%水 H20 氖气 Ne2氯化铝 AlCl
硫化钙 CaS 氮气 N21年前查看全部
- 几个化学方程式1.硫化钠与五硫化二砷反应2.硫化钙与三硫化二砷反应3.三硫化二砷与过硫化钠反应
 hf_lxm1年前1
hf_lxm1年前1 -
 sonny70 共回答了23个问题
sonny70 共回答了23个问题 |采纳率100%As有正三价和正五价,即有还原性,也有氧化性.As2S3和As2S5 可类同于As2O3和As2O5.
1.Na2S+As2S5=2NaAsS3(类同AsO3-,正五价)
2.CaS+As2S3=Ca(AsS2)2(类同AsO2-,正三价)
3.3Na2S+As2S5=2Na3AsS4(类同AsO43-,正五价)
请参考:
-3:砷化氢(AsH3),
+3:三氧化物(As2O3);亚砷酸(H3AsO2);正砷酸盐(如Na3AsO3)、偏亚砷酸盐(如NaAsO2)和焦亚砷酸盐(如Na4As2O5);AsF3;AsCl3;AsBr3雄黄矿(As2O3、鸡冠石)、雌黄矿(As2S3)
+5:五氧化物(AS2O5)+5.正砷酸(H3AsO4)、偏砷酸(HAO3)和焦砷酸(H4As2O7);
AsF5、AsCl51年前查看全部
- 氯化钾,氟化钠,氟化氢,硫化钙中两核间距最小的离子化合物是
 老树新花花不败1年前1
老树新花花不败1年前1 -
 2005最爱秋天 共回答了17个问题
2005最爱秋天 共回答了17个问题 |采纳率88.2%氟化钠,因为氟化氢是共价化合物.剩下的3种只有氟化钠的两核间距最小1年前查看全部
- 下列离子化合物中,阴,阳离子电子层结构相同的是. A.氯化钠 B.硫化镁 C.硫化钙 D.
下列离子化合物中,阴,阳离子电子层结构相同的是. A.氯化钠 B.硫化镁 C.硫化钙 D.
下列离子化合物中,阴,阳离子电子层结构相同的是. A.氯化钠 B.硫化镁 C.硫化钙 D.氧化钙 暮滴子1年前1
暮滴子1年前1 -
 玄精灵 共回答了21个问题
玄精灵 共回答了21个问题 |采纳率76.2%C硫化钙,得失2个电子1年前查看全部
- 谁能帮我写出硫化钙,硫化镁,硫化钠,硫化银,硫化钡,硫化铝,硫化铜,硫化铁,刘华亚铁的化学式?
 诺尔YY1年前1
诺尔YY1年前1 -
 卓一航 共回答了23个问题
卓一航 共回答了23个问题 |采纳率95.7%CaS
MgS
Na2S
Ag2S
BaS
Al2S3
CuS
对不起,不存在硫化铁这种物质,只存在硫化亚铁是FeS
因为Fe3+会把S2-氧化成S单质,而自己变成Fe2+1年前查看全部
- 请由强至弱排列1.还原性、2.水溶液中稳定性.谢谢!硫化钠,硫化钾,硫化钙,硫化铵.谢谢!
 bruce30791年前1
bruce30791年前1 -
 多好的门牙 共回答了20个问题
多好的门牙 共回答了20个问题 |采纳率90%因为结构类似 所以只要比较不同部分的性质 即比较钠离子、钾离子、钙离子、铵根离子的性质
比较还原性的话实际上就是比较金属性 原子的金属性越强 对应离子的还原性越弱 所以是 铵钠钙钾
这些物质在水溶液中均会发生水解 都会生成硫化氢和对应的碱 所以只要比较碱性 碱性越大的 该碱就越容易电离 平衡就会逆向移动 使原物资较不易水解了 相反 碱性越弱的越不易电离 在水中形成了分子 所以平衡向右移动 继续水解 所以就是 钾钙钠铵1年前查看全部
- (2010•南通模拟)以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾
(2010•南通模拟)以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:
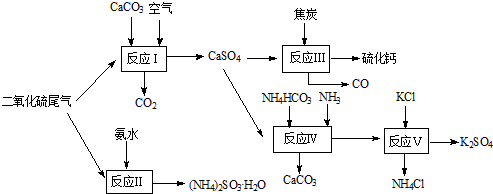
(1)生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式______.
(2)反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质,其可能的作用是______.
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为______.
(4)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是______.
(5)能用于测得尾气中SO2含量的是______.
A.滴有酚酞的NaOH溶液 B.酸性KMnO4
C.滴有淀粉的碘水 D.BaCl2溶液. pcayson1年前1
pcayson1年前1 -
 jiake811031 共回答了19个问题
jiake811031 共回答了19个问题 |采纳率89.5%(1)碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2,故答案为:2CaCO3+2SO2+O2═2CaSO4+2CO2;
(2)对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性,故答案为:防止亚硫酸铵被氧化;
(3)反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,故答案为:1:4;
(4)反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;
(5)酸性KMnO4与二氧化硫反应的方程式为:5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,碘与二氧化硫发生氧化还原的方程式为:SO2+I2+2H2O=H2SO4+2HI,碘消耗完,淀粉因没有碘单质不再显蓝色,故答案为:BC.1年前查看全部
- 硫化钡放入水为什么发生水解BaS+2H2O=Ba(HS)2 + 2OH-生成的是硫氢化钡,而硫化钙是氢氧化钙
 嗨妹1年前1
嗨妹1年前1 -
 桃烁 共回答了20个问题
桃烁 共回答了20个问题 |采纳率85%酸的通性:有腐蚀性,溶液程酸性,能与活泼金属,碱,某些盐和金属氧化物反应
碱的通性:有腐蚀性,溶液程碱性,能与某些金属,酸,某些盐和非金属氧化物反应
盐的通性:有些盐有微弱的腐蚀性,溶液的酸碱度根据盐的性质判定,能与某些酸,碱,盐反应,还能和其他某些化合物反应
酸的性质
酸+碱=盐+水 反应条件:无 反应类型:复分解
例:H2SO4(酸)+Mg(OH)2(碱)=MgSO4(盐)+H2O(水)
酸+盐=新酸+新盐 反应条件:有气体或者水或者沉淀生成 反应类型:复分解
例:HCL(酸)+Na2CO3(盐)=H2CO3(新酸)+NaCl(新盐)
但是碳酸不稳定:H2CO3=H2O+CO2↑这样就有气体和水生成了
酸+活泼金属=盐+氢气 反应条件:金属是活泼金属 反应类型:置换
例:2HCl(酸)+Fe(活泼金属)=FeCl2(盐)+H2↑(氢气)
酸+金属氧化物=盐+水 反应条件:无 反应类型:复分解
例:H2SO4(酸)+CuO(金属氧化物)=CuSO4(盐)+H2O(水)
碱的性质
碱+酸-(见酸的性质)
碱+盐=新碱+新盐 反应条件:碱和盐必须都溶于水且有沉淀 反应类型:复分解
例:Ca(OH)2(碱)+K2CO3(盐)=CaCO3↓(新盐)+2KOH(新碱)
碱+非金属氧化物=盐+水 反应条件:非金属氧化物是酸性氧化物 反应类型:非基本反应类型
例:Ca(OH)2(碱)+CO2(非金属氧化物)=CaCO3(盐)+H2O(水) 此反应用于鉴别CO2
盐的性质
盐+酸-(见酸的性质)
盐+碱-(见碱的性质)
盐+盐=新盐+新盐 反应条件:盐必须都溶于水且生成物中有沉淀 反应类型:复分解
例:CuSO4(盐)+Ba(OH)2(盐)=Cu(OH)2↓(新盐)+BaSO4↓(新盐)
这是一个双沉淀的反应,当然只有一个沉淀也是可以的
盐+某金属=新盐+新金属 反应条件:盐能溶且金属的活动性比盐中的大 反应类型:复分解
例:CuSO4(盐)+Fe(金属)=FeSO4(新盐)+Cu(新金属)
但是有些金属无法实现此反应,即除钾钙钠以外,因为他们和水就反应了
酸性氧化物:溶于水之后程酸性的物质(一般是非金属氧化物)
例CO2溶于水后是碳酸,碳酸是酸性的,所以CO2是酸性氧化物
碱性氧化物:同上类似,水合后是碱性的物质(一般是金属氧化物)
例:CaO溶于水后溶液程碱性,故CaO是碱性氧化物
离子的鉴别
氯离子:银盐(除氯化银)
硫酸根离子:钡盐(除硫酸钡)
铵根离子:碱(任意)
氢离子:碳酸盐和澄清石灰水
氢氧根离子:铵盐
铁离子:2价铁离子是浅绿色,3价是黄色(指溶液)
铜离子:2价铜离子是蓝色(指溶液)
酸、碱、盐疑点十问
1. 氯化钠晶体不能导电,是因为氯化钠晶体中不存在带有电荷的微粒,这句话对吗?
不对,因为氯化钠是典型的离子化合物,其中含有钠离子和氯离子(),但由于阴、阳离子的静电作用,氯化钠晶体中的和按一定规则紧密地排列着,只能在一定振幅范围内振动,不存在可以自由移动的离子.所以,干燥的氯化钠不导电是因为其中的带电微粒(即阴、阳离子)不能自由移动.
2. 氯化氢溶于水可电离产生,故氯化氢属于离子化合物,对吗?
不对,氯化氢是典型的共价化合物,它是由氯化氢分子构成.在氯化氢分子中氢原子和氯原子以一对共用电子对结合在一起,由于氯原子的得电子能力强于氢原子,所以共用电子对偏向氯原子,偏离氢原子.当氯化氢溶于水时,由于水分子的作用使该共用电子对完全由氯原子享用,即相当于氯原子完全获得了一个电子,形成,氢原子完全失去唯一的电子,形成了.类似的例子如硫酸,它属于共价化合物,但溶于水后可电离产生.
3. 酸溶液与酸性溶液是不是一回事?
酸溶液是酸的水溶液,它显酸性,溶液中的阳离子只有氢离子.酸性溶液是显酸性的溶液,溶液中也有氢离子,但阳离子不一定只有氢离子,因此酸性溶液不一定是酸溶液,例如溶于水时,电离产生的阳离子除了氢离子外还有钠离子,所以也表现出酸性,可使石蕊变红色.但只是呈酸性的溶液,不是酸溶液.
4. 只要在反应中能生成盐和水,则该反应一定是中和反应,对吗?
不对,因为中和反应是特指酸和碱之间发生的反应,它属于复分解反应,而反应中能生成盐和水,未必一定是复分解反应.如就不是复分解反应,那更谈不上中和反应,即使是生成盐和水的复分解反应也未必是中和反应,如,虽然能生成盐和水,但由于反应物不是酸与碱,所以不是中和反应.
5. 碱性氧化物一定是金属氧化物,此话对吗?
碱性氧化物是指能与酸起反应生成盐和水的氧化物,大多数金属氧化物是碱性氧化物,可以说碱性氧化物一定是金属氧化物,但不能说金属氧化物一定是碱性氧化物,如是金属氧化物但不是碱性氧化物.
6. 怎样保存氢氧化钠和氢氧化钙?怎样检验久置的氢氧化钠、氢氧化钙是否变质?
固体氢氧化钠吸湿性特强,易吸收空气中的水分而潮解;还能跟空气中的二氧化碳起反应生成碳酸钠而变质;氢氧化钙虽不像氧氧化钠那样潮解,但也有吸湿性,同时也容易与空气中的二氧化碳反应生成碳酸钙,所以氢氧化钠、氢氧化钙都必须密封保存.
不仅固态的氢氧化钠、氢氧化钙需密封保存,而且它们的水溶液由于容易吸收空气中的二氧化碳也必须密封保存.
久置的氢氧化钠、氢氧化钙,往往因吸收了空气中的二氧化碳,部分变质为碳酸钠、碳酸钙,要检验它们是否变质,只要加一些稀盐酸即可,如果有气体产生表示已变质,否则未变质.
7. 结晶水合物中通常含有两种或多种微粒.那么硫酸铜晶体究竟是纯净物还是混合物?
判断纯净物与混合物的依据是看该物质的组成(或构成)是否固定,而不是看该物质中所含微粒的种数.硫酸铜晶体的化学式为,即该晶体中微粒与分子之间的个数比是固定的,为1:5,所以硫酸铜晶体中各元素之间的质量比是固定的,由此可知硫酸铜晶体是纯净物.类似的碳酸钠晶体也是纯净物.
8. 碳酸钠属于盐,为什么其水溶液呈碱性?
碳酸钠溶于水后电离产生,和水分子发生如下反应:,溶液中产生一定量的离子,所以溶液显碱性,如果给碳酸钠溶液加热,可产生更多的,使溶液的碱性更强.
9. 为什么硝酸钾、硝酸钠、硫酸钡等物质一般不与其他物质发生复分解反应.
物质间发生复分解反应必须满足复分解反应发生的条件,即生成物中必须有水或气体或沉淀,硝酸钾是盐,盐能与酸、碱、盐起反应,分别生成新酸、新碱与新盐,但硝酸钾与酸、碱、盐反应后所生成的新酸是硝酸,生成的新碱是氢氧化钾,生成的新盐必定是硝酸盐或钾盐,其中既无气体也没有沉淀,而反应又不生成水,不具备复分解反应发生时对生成物的必要条件,同理,硝酸钠一般也不发生复分解反应.
根据复分解反应进行的条件,反应物必须可溶于水或酸,而硫酸钡既不溶于水又不溶于酸,所以硫酸钡不可能发生复分解反应.
10. 鉴别氯离子和硫酸根离子时,除了加溶液、溶液外,为什么还要加稀硝酸?以钠盐为例说明.
在含有氯离子或硫酸根离子的溶液鉴别反应中,必须加入稀硝酸以排除其它离子的干扰,如碳酸根离子,亚硫酸根离子等.
溶解性口诀(这里面有高中知识,不知道是不是你需要的,但初中的也可以啊,把你需要的留下来吧,哈哈,祝你进步!)
硝铵钾钠溶,盐酸除银汞(亚).硫酸去铅钡,磷盐多不溶(磷酸二氢盐溶解).碳硅和亚硫(含亚硫酸盐与硫化物),钠后(溶解性表的钠之后)多不溶.微溶氯化铅,硫酸钙银汞.镁盐碳亚硫,碱酸钙和硅.(最后两句说的是微溶物质)
硫化钡、硫化钙、硫化镁、硫化铝、硫化铁、硫化铬在水溶液中均存在,但是他们都极易水解.
钾钠铵盐溶水快,
硫酸盐除去钡铅钙.
氯化物不溶氯化银,
硝酸盐溶液都透明.
口诀中未有皆下沉.1年前查看全部
- 速求下列物质的化学式 H,2H,H2,2H2,H+.改正下列错误的化学式:氖气Ne2,硫化钙Ca2S.写出下列物质的化学
速求下列物质的化学式
H,2H,H2,2H2,H+.
改正下列错误的化学式:氖气Ne2,硫化钙Ca2S.
写出下列物质的化学式:氯化钠,硫化钾,氯化银,硫酸铜,氯化铵.
写出下列化学式的读法:CaCO3,P2O5,SO2,SO3,2N2,5HCl.
快 我一会就要 linyiyi2171年前7
linyiyi2171年前7 -
 water3001 共回答了21个问题
water3001 共回答了21个问题 |采纳率85.7%H 氢元素 H2 氢气 H+ 氢离子
氖气就是这么写的 NE2
CaS 硫化钙
氯化钠 Nacl 硫化钾 K2S 氯化银 Agcl
硫酸铜 CuSO4 氯化铵 NH4cl
CaCO3 碳酸钙 P2O5 五氧化二磷 SO2,二氧化硫
SO3,三氧化硫 2N2 氮气(不加前面的2)
5HCl.盐酸(不要前面的5)1年前查看全部
- 以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等
以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
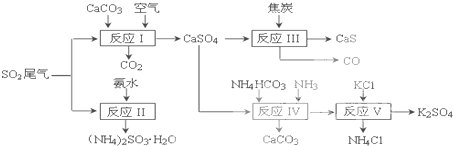
(1)写出反应Ⅰ的化学方程式______.
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是______.
(3)下列有关说法正确的是______.
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应Ⅲ中氧化剂与还原剂的物质的量之比为4:1
c.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
d.反应Ⅴ中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是______.
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式______. wang158098231年前1
wang158098231年前1 -
 yuyi919 共回答了15个问题
yuyi919 共回答了15个问题 |采纳率93.3%解题思路:(1)根据反应物和生成物写出反应的化学方程式;
(2)亚硫酸氨中的硫为+4价,易被空气中的氧气氧化;
(3)a.依据流程图结合反应生成物分析,过量的空气把亚硫酸钙氧化为硫酸钙;
b.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C;
c.防止碳酸氢铵在温度过高时分解;
d.氯化铵是一种氮肥;
(4)利用硫酸钾在不同溶剂中溶解度的不同,达到析出晶体的目的;
(5)二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,结合原子守恒配平写出.(1)碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2,故答案为:2CaCO3+2SO2+O2═2CaSO4+2CO2;
(2)对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性,故答案为:防止亚硫酸铵被氧化;
(3)a.过量的空气把亚硫酸钙氧化为硫酸钙,故a正确;
b.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,故b错误;
c.防止碳酸氢铵在温度过高时分解得不到需要的目标产物,故c正确;
D、氯化铵含N元素,是一种氮肥,故d正确;
故答案为:acd;
(4)反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;
(5)④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,由原子守恒可知化学方程式为4(NH4)2SO3+2NO2=4(NH4)2SO4+N2,
故答案为:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2.点评:
本题考点: 制备实验方案的设计;二氧化硫的化学性质.
考点点评: 本题考查二氧化硫的性质及物质的制备,为高频考点,把握习题中的信息及发生的反应为解答的关键,侧重二氧化硫的还原性及学生分析能力的考查,题目难度中等.1年前查看全部
- 谁能教我标化合价和化学方程式?不要复制的,要自己的,还有怎么硫化钙,我怎么标不出来呢?还有就是为什么好些气体后面有2,有
谁能教我标化合价和化学方程式?
不要复制的,要自己的,还有怎么硫化钙,我怎么标不出来呢?
还有就是为什么好些气体后面有2,有些却没有,如NE,但N2却没有,是怎么分别的? 非凡飘雪1年前1
非凡飘雪1年前1 -
 youxiaohu 共回答了22个问题
youxiaohu 共回答了22个问题 |采纳率86.4%把元素化合价元素符号上面,然后交叉,再约分.
稀有气体(氦,氖,氩,氪,氙,氡)没有2,气态非金属单质(氧气,氮气,氟,氯等)有21年前查看全部
- 硫氰化钙,硫化钙能否溶于水
 dm7oce1年前3
dm7oce1年前3 -
 久思量 共回答了14个问题
久思量 共回答了14个问题 |采纳率85.7%CaS在水中不存在,水解生成Ca(HS)2.
2CaS..+..2H2O..=..Ca(HS)2..+,Ca(OH)21年前查看全部
- 硫化钙和稀盐酸反应吗
 huyunyun221年前1
huyunyun221年前1 -
 北兵马司 共回答了22个问题
北兵马司 共回答了22个问题 |采纳率95.5%反应呀
CaS + 2HCl ----> CaCl2 + H2S1年前查看全部
- 硫化钙 颜色?等等
 我不是陈溪1年前1
我不是陈溪1年前1 -
 冒险家 共回答了13个问题
冒险家 共回答了13个问题 |采纳率69.2%化学式CaS.式量72.14.白色立方系晶体.含杂质的为淡黄色.相对密度2.5,折光率2.137.溶于水或遇湿气发生水解.微溶于醇.在湿空气中分解,在干燥空气中则被氧化.遇酸迅速分解而释出H2S.与氯、碘反应析出元素硫.
不是沉淀 会和水发生反应的1年前查看全部
- CaS硫化钙存在CaS这种物质吗?为什末?
 yfyzzy1年前1
yfyzzy1年前1 -
 yxblili 共回答了19个问题
yxblili 共回答了19个问题 |采纳率89.5%存在
硫化钙
化学品名称:硫化钙 (CaS)
化学品描述:
化学式CaS.式量72.14.白色立方系晶体.含杂质的为淡黄色.相对密度2.5,折光率2.137.不溶于水.在湿空气中分解,在干燥空气中则被氧化.
用途:制发光漆,还用于医药工业中.
制法:由硫酸钙粉末与焦碳或木屑在高温下制得.1年前查看全部
- 硫与石灰乳反应生成5硫化钙和硫代硫酸钙的反应方程式
 yangsky20051年前1
yangsky20051年前1 -
 lilicun2 共回答了29个问题
lilicun2 共回答了29个问题 |采纳率93.1%4S + 3Ca(OH)2 = 2CaS + CaS2O3 + 3H2O1年前查看全部
- 一道有机物反应的化学题20.请用下列仪器和药品组成一套由含有硫化钙杂质的电石进行乙炔气体的制备、净化、检验,并可通过计算
一道有机物反应的化学题
20.请用下列仪器和药品组成一套由含有硫化钙杂质的电石进行乙炔气体的制备、净化、检验,并可通过计算确定乙炔产率的系列实验装置,溴水的浓度为0.1 mol/L,体积是20mL,NaOH溶液足量
若在标准状况下进行上述实验,假定溴水与乙炔完全反应,生成C2H2Br4,用含amol碳化钙的电石Wg与足量X反应,反应完全后,量筒内排入了VL溶液,则生成乙炔的产率为多少 101981年前1
101981年前1 -
 yinwh0755 共回答了17个问题
yinwh0755 共回答了17个问题 |采纳率88.2%amol碳化钙与水反应理论上生成amol乙炔,
生成的乙炔其中一部分乙炔与溴水加成,消耗乙炔0.1*0.02=0.002mol
VL是剩余的乙炔,即V/22.4 mol
所以产率为生成乙炔/理论量
即(0.002+V/22.4)/a1年前查看全部
- 改正下列错误的化学式:水HO2.氖气Ne2.氯化铝AICI2.硫化钙Ca2S.氮气N.
 40633561年前1
40633561年前1 -
 bbryan 共回答了8个问题
bbryan 共回答了8个问题 |采纳率75%水H2O.氖气Ne.氯化铝AICI3.硫化钙CaS.氮气N21年前查看全部
- 氢氧化钠 硫化钙 碳酸钾 氯化铝 二氧化碳 硫酸铜 氢气 高锰酸钾
 hnwccrj1年前1
hnwccrj1年前1 -
 我会回来的0 共回答了17个问题
我会回来的0 共回答了17个问题 |采纳率94.1%NaOH CaCl2 K2CO3 AlCl3 CO2 CuSO4 H2 K2MnO41年前查看全部
- 硫化铵,硫化钠,硫化钾,硫化钙,请排列还原性由高至低,排列水溶液中稳定性由高至低.
 形式桔子1年前1
形式桔子1年前1 -
 278348705 共回答了23个问题
278348705 共回答了23个问题 |采纳率78.3%还原性:(NH4)2S=Na2S=K2S>CaS
稳定性:都挺稳定的,不会分解……如果你是问溶液的碱性强弱,那么:
Na2S=K2S>(NH4)2S>CaS
如果你问的是水解的程度,那么:
(NH4)2S>CaS>Na2S=K2S
我解释一下,碱性Na2S和K2S最强,是因为NH4+结合了S2-水解生成的OH-,而CaS的溶解度太小,使得微量的S2-水解的OH-浓度很小.
而水解的程度,因为(NH4)2S中阴阳离子都要水解,会相互促进,所以其水解程度最大;而CaS由于溶解度小,溶液中S2-的浓度很低,所以水解程度比Na2S和K2S高.1年前查看全部
- (2010•南通模拟)以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾
(2010•南通模拟)以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:
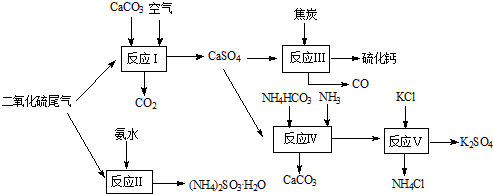
(1)生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式2CaCO3+2SO2+O2═2CaSO4+2CO22CaCO3+2SO2+O2═2CaSO4+2CO2.
(2)反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质,其可能的作用是防止亚硫酸铵被氧化防止亚硫酸铵被氧化.
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为1:41:4.
(4)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出.
(5)能用于测得尾气中SO2含量的是BCBC.
A.滴有酚酞的NaOH溶液 B.酸性KMnO4
C.滴有淀粉的碘水 D.BaCl2溶液. yuenjun1年前1
yuenjun1年前1 -
 征征猫 共回答了17个问题
征征猫 共回答了17个问题 |采纳率94.1%(1)碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2,故答案为:2CaCO3+2SO2+O2═2CaSO4+2CO2;
(2)对苯二酚具有还原性,空气中的氧气具有氧化性,亚硫酸氨中+4价的硫具有还原性,故答案为:防止亚硫酸铵被氧化;
(3)反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,氧化剂为CaSO4,还原剂为C,氧化剂与还原剂物质的量之比为1:4,故答案为:1:4;
(4)反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出,
故答案为:乙二醇是有机溶剂能减小K2SO4的溶解度,使硫酸钾充分析出;
(5)酸性KMnO4与二氧化硫反应的方程式为:5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,碘与二氧化硫发生氧化还原的方程式为:SO2+I2+2H2O=H2SO4+2HI,碘消耗完,淀粉因没有碘单质不再显蓝色,故答案为:BC.1年前查看全部
大家在问
- 1看图回答(英语),全部的题,
- 2将0.1mol/LCH3COONa溶液20mL与0.01mol/LHCl l0mL混合后,溶液显酸性,则溶液中有关浓度关
- 3五体投地,走投无路,出人头地,三个词的造句
- 4请帮分析比喻还是拟人小鸟的歌声真好听.我认为这句是比喻,是暗喻,因为把这句把小鸟的叫声比作人的歌声.有人说是拟人句,因为
- 5双曲线中心点在原点左右焦点在X轴上离心率为√2且过点(4,-√10)
- 6如图所示,已知RT三角形ABC的顶点A在一个反比例函数的图像上,直角顶点B在x轴上,且三角形AOB的面积为3,OB=3
- 7怎么用在同一根直线上的两个焦点画椭圆
- 8想红外线一样但是它的光是绿色的那是什么
- 9圆的面积公式中S=派R2,S于R成正比例关系还是反比例关系?
- 10地球形成大气层的重要条件为什么是地球的体积&地球的质量
- 11《小桥流水人家》这篇课文先勾勒出一副“_____”的写意画——小溪潺潺绕村庄、_____、_____,色彩清新而明快,情
- 12看这两个题1.The meeting room is ___for 200 students to sit in.A.b
- 13急:“工作信念”英语咋翻译?谢谢
- 14The student uses a c_____ to write music.提示:所填单词要含有字母u
- 15数学趣味题(纳什均衡理论)设想有一个小居民点,居民住宅沿着一条公路均匀地排开.现在设想有两家杂货铺要在这个小居民点开张,

