氨水中什么成分最多?第二多的呢?
 一舍5052022-10-04 11:39:545条回答
一舍5052022-10-04 11:39:545条回答请说明原因!详细一点的原因,

已提交,审核后显示!提交回复
共5条回复
 luag糖糖 共回答了21个问题
luag糖糖 共回答了21个问题 |采纳率85.7%- 最多的是水,第二多的是氨.虽然氨极易溶于水,但最多也是1:700,一个是液体一个是气体,溶液中含量最多的还是水.
氨水的电离度是很弱的,5%以下,大约 3%.因此大部分氨溶于水后未电离,因此成分第二多的是氨. - 1年前
 faesdafgoe 共回答了10个问题
faesdafgoe 共回答了10个问题 |采纳率- 上面几楼所说都略有不妥,最多的自然是水分子但是第二多的一般我们认为是一水合氨,NH3.H2O
- 1年前
 对天一笑 共回答了33个问题
对天一笑 共回答了33个问题 |采纳率- 首先同意上面这位。但是解释的不详细。
溶液中含有很多物质:NH3·H2O NH4+ OH- H2O NH3(少量) H+微量
第一多的自然是H2O。因为氨水是是氨气的水溶液。
第二多的是NH3·H2O。氨气进入水中,大部分溶解形成NH3·H2O,我所说的很多物质其余的基本上是电离出来的:NH3·H2O=(可逆)=NH4+ +OH- 。H+最少,它是由水分子... - 1年前
 pinty 共回答了35个问题
pinty 共回答了35个问题 |采纳率- 第一多的是:H2O
第二多的是:NH3
氨在水中的溶解度偏低。 - 1年前
 z7z8998 共回答了3个问题
z7z8998 共回答了3个问题 |采纳率- 最多为水,第二多为氨水
- 1年前
相关推荐
- 制银氨溶液时,为什么先加氨水,在加硝酸银不对
 pwb9991年前1
pwb9991年前1 -
 神笔二画 共回答了20个问题
神笔二画 共回答了20个问题 |采纳率100%先加氨水,再加硝酸银,会生成不稳定的氢氧化银,极易爆炸.应该将氨水滴加到硝酸应溶液中,这样生成的氢氧化银会很快转变成氢氧化二胺合银.也可以通过实验现象记这个:先生成白色沉淀,然会白色沉淀迅速消失.1年前查看全部
- 氨水我知道是碱,但是请问是强碱还是弱碱
 Chris_Rcq1年前1
Chris_Rcq1年前1 -
 印小阿 共回答了17个问题
印小阿 共回答了17个问题 |采纳率94.1%弱碱性.
危险标记:20(碱性腐蚀品)
反应平衡常数Kb = 1.8×10−5.
1M氨水的pH值为11.63,大约有0.42%的NH3变为NH4+.
氨水工厂
氨水是实验室中氨的常用来源.它可与含铜(II)离子的溶液作用生成深蓝色的配合物,也可用于配置银氨溶液等分析化学试剂.
物理性质
性状:无色透明液体,有强烈的刺激性气味.
熔点:-77℃
蒸汽压:1.59kPa(20℃)
相对密度:氨含量越多,密度越小.质量分数28%的氨水相对密度0.91,35%的0.88,
电离常数:K=1.8×10ˇ-5(25℃)
稳定性:受热或见光易分解
其它:极易挥发出氨气.浓氨水对呼吸道和皮肤有刺激作用,并能损伤中枢神经系统.1年前查看全部
- 实验设计:氢氧化铝制取和氢氧化铝两性的验证.(试剂:盐酸,氢氧化钠溶液,硫酸铝溶液,氨水)谢
 tiats10031年前2
tiats10031年前2 -
 凌乱711 共回答了14个问题
凌乱711 共回答了14个问题 |采纳率100%因为氢氧化铝只能溶于强碱不溶于弱碱,所以要用弱碱制氢氧化铝,用强碱溶氢氧化铝.
1、取少量硫酸铝溶液,加入足量氨水,生成白色沉淀(即氢氧化铝的制取)
2、把沉淀分装2个试管,分别滴入盐酸,氢氧化钠溶液,发现沉淀都消失,证明氢氧化铝具有两性.1年前查看全部
- 下列事实不能用勒夏特列原理解释的是 ( ) A.氨水应密闭保存,置低温处 B.在FeCl 2 溶液中加入铁粉防止
下列事实不能用勒夏特列原理解释的是 ()
A.氨水应密闭保存,置低温处 B.在FeCl 2 溶液中加入铁粉防止氧化变质 C.生产硝酸中使用过量空气以提高氨的利用率 D.实验室用排饱和食盐水法收集氯气  快来吧11年前1
快来吧11年前1 -
 丁丁老板 共回答了23个问题
丁丁老板 共回答了23个问题 |采纳率82.6%B
1年前查看全部
- 氨水要与什么物质在化学反映情况下进行去除异味?
氨水要与什么物质在化学反映情况下进行去除异味?
有没有谁知道;知道请Q我1046441318 ektciu1年前4
ektciu1年前4 -
 卡鲁博那 共回答了17个问题
卡鲁博那 共回答了17个问题 |采纳率88.2%氨水显碱性
用酸性物质反应就好1年前查看全部
- 滴定时为什么要加入氨水缓冲溶液
 非典型性云游1年前1
非典型性云游1年前1 -
 piglhy 共回答了20个问题
piglhy 共回答了20个问题 |采纳率95%酸度对配位滴定影响非常大,影响酸效应系数.
加氨水缓冲液是为了控制溶液的酸度,即PH值1年前查看全部
- 能正确表示下列反应的离子方程式是( ) A.硫酸铝溶液中加入过量氨水 Al 3+ +3OH - =Al(OH
能正确表示下列反应的离子方程式是( ) A.硫酸铝溶液中加入过量氨水Al 3+ +3OH - =Al(OH) 3 ↓ B.碳酸钠溶液中加入澄清石灰水Ca(OH) 2 +CO 3 2- =CaCO 3 ↓+2OH - C.冷的氢氧化钠溶液中通入氯气Cl 2 +2OH - =ClO - +Cl - +H 2 O D.稀硫酸中加入铁粉2Fe+6H + =2Fe 3+ +3H 2 ↑  hlnhly1年前1
hlnhly1年前1 -
 封印酒舞 共回答了21个问题
封印酒舞 共回答了21个问题 |采纳率90.5%A.硫酸铝溶液中加入过量氨水的离子反应为Al 3+ +3NH 3 .H 2 O=Al(OH) 3 ↓+3NH 4 + ,故A错误;
B.碳酸钠溶液中加入澄清石灰水的离子反应为Ca 2+ +CO 3 2- =CaCO 3 ↓,故B错误;
C.冷的氢氧化钠溶液中通入氯气的离子反应为Cl 2 +2OH - =ClO - +Cl - +H 2 O,故C正确;
D.稀硫酸中加入铁粉的离子反应为Fe+2H + =Fe 2+ +H 2 ↑,故D错误;
故选C.1年前查看全部
- 在25℃时,用蒸馏水稀释1mol/L氨水至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
在25℃时,用蒸馏水稀释1mol/L氨水至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.c(N
)H +4c(OH−)
B.c(NH3•H2O) c(OH−)
C.c(NH3•H2O) c(N
)H +4
D.OH-物质的量 朵丫1年前1
朵丫1年前1 -
 hhhxxxjjj123 共回答了15个问题
hhhxxxjjj123 共回答了15个问题 |采纳率93.3%解题思路:氨水中溶质是一水合氨,加水稀释促进一水合氨电离,则溶液中氢氧根离子、铵根离子的物质的量增大,一水合氨分子的物质的量减小,因为溶液中一水合氨电离增大程度小于溶液体积增大程度,所以溶液中氢氧根离子浓度、铵根离子浓度和一水合氨浓度都减小.A.溶液中氢氧根离子、铵根离子的物质的量增大,且水电离出氢氧根离子,所以
c(N
H+4)
c(OH−)之比变小,故A错误;
B.加水稀释促进一水合氨电离,则溶液中氢氧根离子、铵根离子的物质的量增大,一水合氨分子的物质的量减小,所以
c(NH3•H2O)
c(OH−)减小,故B错误;
C.加水稀释促进一水合氨电离,则溶液中氢氧根离子、铵根离子的物质的量增大,一水合氨分子的物质的量减小,所以
c(NH3•H2O)
c(N
H+4)减小,故C错误;
D.加水稀释促进一水合氨电离,则溶液中n(OH-)增大,故D正确;
故选D.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱电解质电离,稀释弱电解质促进弱电解质电离,但是离子的浓度一般会减小,氢离子和氢氧根离子的浓度的变化趋势相反,题目难度不大.1年前查看全部
- 将60kg20%的浓氨水稀释成农业施肥用的0.3%稀氨水,应加水多少千克?
将60kg20%的浓氨水稀释成农业施肥用的0.3%稀氨水,应加水多少千克?
要详细过程
要用设x求!
我很菜,高手详细点教啊!
 yygywc1年前1
yygywc1年前1 -
 卡卡也爱打炮 共回答了20个问题
卡卡也爱打炮 共回答了20个问题 |采纳率90%设加水X千克
60*20%/(60+X)*100%=0.3%
解X=3940千克1年前查看全部
- 同物质的量浓度氨水与醋酸氨的中铵根离子浓度大小比较?
 两性之间1年前2
两性之间1年前2 -
 _淡墨痕 共回答了8个问题
_淡墨痕 共回答了8个问题 |采纳率100%当然是醋酸铵中的铵根离子浓度大.因为对于弱电解质来说,电离和水解都是微弱的.所以,在氨水中,电离的一水合氨很少,所以铵根离子少;在醋酸铵中,水解的铵根离子很少,消耗的就很少.总的来说,氨水中铵根离子靠电离产生,电离程度小铵根就少.在醋酸铵中水解会消耗铵根,水解程度小铵根就多.1年前查看全部
- 铬酸铜在氨水中的溶解性和在水中的溶解性
 夏柳儿1年前2
夏柳儿1年前2 -
 丢丢的梦想 共回答了19个问题
丢丢的梦想 共回答了19个问题 |采纳率94.7%铬酸铜溶于酸,不溶于水和氨水.1年前查看全部
- 下列反应的离子方程式书写正确的是( ) A.氯化铝溶液中加入过量氨水:Al 3+ +4NH 3 •H 2 O=AlO
下列反应的离子方程式书写正确的是( ) A.氯化铝溶液中加入过量氨水:Al 3+ +4NH 3 •H 2 O=AlO 2 - +4NH 4 + +2H 2 O B.氧化钠与水反应:O 2- +H 2 O=2OH - C.碳酸钙溶于醋酸:CaCO 3 +2H + =Ca 2+ +CO 2 ↑+H 2 O D.氯化亚铁溶液中通入氯气:2Fe 2+ +Cl 2 =2Fe 3+ +2Cl -  商鞅变法1年前1
商鞅变法1年前1 -
 爱蓝成痴7 共回答了11个问题
爱蓝成痴7 共回答了11个问题 |采纳率100%A、氯化铝溶液中加入过量氨水生成氢氧化铝沉淀,离子方程式为Al 3+ +3NH 3 •H 2 O=Al(OH) 3 +3NH 4 + ,故A错误;B、书写离子方程式时氧化物不能拆成离子,故B错误;C、醋酸是弱电解质,离子方程式中用分子...1年前查看全部
- 25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A. c(NH4+)=c(SO42-)
B. c(NH4+)>c(SO42-)
C. c(NH4+)<c(SO42-)
D. c(OH-)+c(SO42-)=c(H+)+c(NH4+) 1982beven1年前1
1982beven1年前1 -
 天下第一炮 共回答了15个问题
天下第一炮 共回答了15个问题 |采纳率100%解题思路:稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,c(OH-)=c(H+),结合电荷守恒来解答.稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,c(OH-)=c(H+),
由电荷守恒可知,c(OH-)+2c(SO42-)=c(H+)+c(NH4+),
则2c(SO42-)=c(NH4+),
所以c(NH4+)>c(SO42-),
故选B.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合溶液中离子浓度的关系,注意pH=7及电荷守恒的应用即可解答,题目难度不大.1年前查看全部
- 25℃时,20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液(如图),下列说法正确的是( )
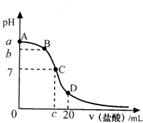 25℃时,20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液(如图),下列说法正确的是( )
25℃时,20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液(如图),下列说法正确的是( )
A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+)
C.若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12
D.在D点:c(NH4+)+c(NH3•H2O)=2c(Cl-) lhy8208231年前1
lhy8208231年前1 -
 fox_male 共回答了17个问题
fox_male 共回答了17个问题 |采纳率94.1%解题思路:氨水呈碱性,盐酸呈酸性,向氨水中加入盐酸,发生酸碱中和反应导致溶液的pH值降低,当盐酸和氨水的物质的量相等时,恰好生成氯化铵;当继续加盐酸时,盐酸的物质的量远远大于氨水时,溶液中以盐酸为主,溶液的PH值近似于盐酸的PH值.
溶液中根据物料守恒和电荷守恒判断溶液中离子浓度的相对大小.A、在A、C间任一点,当盐酸的量很少时,溶液中以氨水的电离为主,所以溶液中离子存在的关系可能是c(NH4+)>c(OH-)>c(Cl-)>c(H+),故A错误;B、氯化铵是强酸弱碱盐,其水溶液呈酸性,当溶液的PH=7时,氨水...
点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱中和反应中PH值图象的分析,难度不大,注意特殊点的分析,1未加盐酸溶液时,2酸碱恰好反应时,3溶液的PH=7时.1年前查看全部
- 下列离子方程式正确的是( ) A.在稀氨水中通入少量CO 2 :NH 3 •H 2 O+CO 2 ═NH 4 + +H
下列离子方程式正确的是( ) A.在稀氨水中通入少量CO 2 :NH 3 •H 2 O+CO 2 ═NH 4 + +HCO 3 - B.向次氯酸钙溶液通入SO 2 :Ca 2+ +2ClO - +SO 2 +H 2 O=CaSO 3 ↓+2HClO C.过量的NaHSO 4 与Ba(OH) 2 溶液反应:Ba 2+ +OH - +H + +SO 4 2- =BaSO 4 ↓+2H 2 O D.在氯化亚铁溶液中加入稀硝酸:3Fe 2+ +4H + +NO 3 - =3Fe 3+ +NO↑+2H 2 O  ljljlrr801年前1
ljljlrr801年前1 -
 u_Doria 共回答了19个问题
u_Doria 共回答了19个问题 |采纳率94.7%A.在稀氨水中通入少量CO 2 生成CO 3 2- ,反应的离子方程式为2NH 3 •H 2 O+CO 2 ═2NH 4 + +CO 3 2- +H 2 O,故A错误;
B.SO 2 具有还原性,向次氯酸钙溶液通入SO 2 生成CaSO 4 和Cl - ,发生氧化还原反应,故B错误;
C.过量的NaHSO 4 与Ba(OH) 2 溶液反应,参加反应Ba 2+ 、OH - 的比值为1:2,反应的离子方程式为Ba 2+ +2OH - +2H + +SO 4 2- =BaSO 4 ↓+2H 2 O,故C错误;
D.在氯化亚铁溶液中加入稀硝酸,Fe 2+ 与稀硝酸之间发生氧化还原反应,反应的离子方程式为3Fe 2+ +4H + +NO 3 - =3Fe 3+ +NO↑+2H 2 O,故D正确.
故选D.1年前查看全部
- 质量分数为10%和30%的氨水等体积混合,溶质质量分数为什么小于20%?
质量分数为10%和30%的氨水等体积混合,溶质质量分数为什么小于20%?
如果把氨水换成等质量分数的硫酸再进行等体积混合,溶质质量分数为什么大于20%? 逢头勿语1年前1
逢头勿语1年前1 -
 11696471 共回答了15个问题
11696471 共回答了15个问题 |采纳率86.7%设质量分数为10%和30%的氨水密度分别为p1、p2,体积为V等体积混合溶质质量分数=(V*p1*10%+V*p2*30%)/(V*p1+V*p2)*100%=(p1*10%+p2*30%)/(p1+p2)*100%=[(p1*(20%-10%)+p2*(20%+10%)/(p1+p2)*100%=[(p1...1年前查看全部
- 氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用浓氨水与生石灰反应来制取氨气.
氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用浓氨水与生石灰反应来制取氨气.
(1)请你从图中选择实验室用此方法制取氨气的发生装置.
(2)若用C装置收集氨气,则气体要从 (填“a”或“b”)进入集气瓶.
(3)将石蕊溶液滴加到盛有氨气的集气瓶中,可观察到的现象是什么?
(4)氨气具有强烈刺激性,怎么才能正确闻氨气的气味?
 baci12211年前1
baci12211年前1 -
 蝙蝠狂人 共回答了21个问题
蝙蝠狂人 共回答了21个问题 |采纳率71.4%(1)B;(2)B;(3)石蕊试液变成蓝色;(4)用手在容器口轻轻扇动,让极少量气体飘进鼻孔.
1年前查看全部
- 下列物质中属于强碱的是( ) A小苏打 B氨水 C洗涤剂 D氢氧化钠
 南宁的天空1年前3
南宁的天空1年前3 -
 片片啊片片 共回答了22个问题
片片啊片片 共回答了22个问题 |采纳率81.8%选D.
A.小苏打是盐
B.氨水是弱碱
C.洗涤剂是乳化剂
D.氢氧化钠是强碱
主要靠记忆这个内容.1年前查看全部
- 那氨水只是和一水合氨浓度有关?不能像水一样加入什么物质的吗?
 flyxuefei1年前1
flyxuefei1年前1 -
 90743241 共回答了21个问题
90743241 共回答了21个问题 |采纳率85.7%氨水本身就是混合物了 其实对于水加入了醇什么的 目的主要是 应用的是 醇中的-OH结构 进而利用的氢键 之后形成了一种 混合的 “共同沸腾的”物质 而氨气溶解水中形成氨水 这儿也是用的 氢键
这个问题不用深入 了解 大学 去图书馆你就会很明白了 哟1年前查看全部
- 在AgOH中滴入氨水,会有白色沉淀产生吗?
在AgOH中滴入氨水,会有白色沉淀产生吗?
AgOH不是很不稳定,很容易分解成Ag2O的吗?为什么很多人都说反应过程中会产生白色沉淀在氨水过量后又会溶解?
写错了。是在AgNO3中滴入氨水。 姚明的眼神1年前3
姚明的眼神1年前3 -
 minsan1 共回答了24个问题
minsan1 共回答了24个问题 |采纳率100%是要溶解的,氢氧化银与过量氨水反应生成氢氧化银氨,是溶于水的物质1年前查看全部
- 三氯化铝和氨水反应化学方程式
 hechao_10011年前1
hechao_10011年前1 -
 scandyding 共回答了22个问题
scandyding 共回答了22个问题 |采纳率86.4%AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl1年前查看全部
- 《全科王》中求物理题答案某同学在一只容积为50ml的烧杯中倒入10ml的浓氨水,然后迅速将一张潮湿的并滴有无色酚酞试液的
《全科王》中求物理题答案
某同学在一只容积为50ml的烧杯中倒入10ml的浓氨水,然后迅速将一张潮湿的并滴有无色酚酞试液的滤纸放在烧杯正上方,该同学发现了:变红的现象,对于该现象的解释是______.该同学在实验时惊奇地发现变色的湿润滤纸离开烧杯上方一段时间后______,这是因为_______. YumiTT1年前1
YumiTT1年前1 -
 chenjihuai 共回答了16个问题
chenjihuai 共回答了16个问题 |采纳率93.8%浓氨水显碱性,溶于水后,氨水中氨分子易挥发且易溶于水,生成碱性氨水,所以湿的无色酚酞滤纸接触到挥发的氨气变红.一段时间后,氨气挥发,滤纸变为无色,这是因为氨分子挥发扩散到空气中了.1年前查看全部
- 氨水是什么性?氯化氨呢?
 raincome1年前2
raincome1年前2 -
 快乐生活20062006 共回答了24个问题
快乐生活20062006 共回答了24个问题 |采纳率87.5%氨水是碱性的,氯化铵溶液是酸性的1年前查看全部
- 在100ml 0.2mol/L 的氯化锰溶液中加入100ml 含氯化铵的0.01mol/L的氨水,计算氨水中含有多少氯化
在100ml 0.2mol/L 的氯化锰溶液中加入100ml 含氯化铵的0.01mol/L的氨水,计算氨水中含有多少氯化铵才不至生成氢氧化锰沉淀?
已知:氢氧化锰的Ksp=4*10^-14,氨水的Kb=1.8*10^-5
7克,按您的计算好像不对……
请问平衡时[Mn2+]是0.1mol/L吗?铵根应该抑制氨水的电离啊,这是湖南师大的《奥赛经典》上的一道题,我太傻…… woxiangzuoxingnu1年前1
woxiangzuoxingnu1年前1 -
 迈克儿唐僧 共回答了21个问题
迈克儿唐僧 共回答了21个问题 |采纳率95.2%[Mn2+][OH-]^2=Ksp=4*10^-4
等体积混合:[Mn2+]=0.1mol/L ; [OH-]=(4*10^-3)^1/2
[OH-]{NH4+}/[NH3]=Kb=1.8*10^-5
[OH-]=(4*10^-3)^1/2 ;[NH3]=0.005 mol/L
[NH4+] =(0.005*1.8*10^-5)/(4*10^-3)^1/2
含有2[NH4+]的NH4Cl.1年前查看全部
- 向 Al2(SO4)3 溶液中滴加氨水(NH3.H2O)至过量 现象?
向 Al2(SO4)3 溶液中滴加氨水(NH3.H2O)至过量 现象?
可氨水是个弱碱阿? 哈哈haha的ww1年前1
哈哈haha的ww1年前1 -
 33513336 共回答了21个问题
33513336 共回答了21个问题 |采纳率90.5%出现白色沉淀 沉淀不消失 就因为是弱碱 沉淀才不消失
AL(OH)3是两性的,碱性比氨水还 弱 所以才会产生沉淀1年前查看全部
- 葡萄糖的银镜反应中配制银氨溶液时,为何不可加入过量的氨水?
葡萄糖的银镜反应中配制银氨溶液时,为何不可加入过量的氨水?
听说加入过量的NH3.H2O(aq)且若试管没及时清理,就会生成AgN3(叠氮化银),这好像是种很危险的物质, d267431年前5
d267431年前5 -
 icvyp 共回答了16个问题
icvyp 共回答了16个问题 |采纳率81.3%不太对
加入过量的氨水容易在银镜反应中生成受热或撞击时有爆炸的危险的雷酸银Ag(ONC)
银氨溶液久置后容易生成AgN3,受振动时很容易分解而发生猛烈爆炸.
发生过银镜反应的试管要及时清理,不然会生成雷酸银.1年前查看全部
- 氨水和酚酞实验中,将变红的(上一个实验完成了)滤纸放到空气中,为什么变回去了?
 蚂蚁32111年前2
蚂蚁32111年前2 -
 breaklove 共回答了18个问题
breaklove 共回答了18个问题 |采纳率88.9%氨气挥发掉了,氨水没有碱性,不能使酚酞变红1年前查看全部
- 向硝酸银溶液中逐滴滴入稀氨水直至过量:Ag+ + 2NH3·H2O=========[Ag(NH3)2]+ + H2O
向硝酸银溶液中逐滴滴入稀氨水直至过量:Ag+ + 2NH3·H2O=========[Ag(NH3)2]+ + H2O 如果错,
是我打少了!SORRY,这方程配平正确的! yxdlj1年前3
yxdlj1年前3 -
 若_有所思 共回答了15个问题
若_有所思 共回答了15个问题 |采纳率80%不对,没有配平.Ag+ + 2NH3·H2O=========[Ag(NH3)2]+ +2 H2O1年前查看全部
- 用含氨25分之3的氨水进行有才追肥.现有含氨20分之4的氨水30千克,配制时需加水多
 zzg20081年前1
zzg20081年前1 -
 hellen78118 共回答了16个问题
hellen78118 共回答了16个问题 |采纳率93.8%(4/20)×30=(3/25)×(30 +x)
解得X=20Kg
所以,需加20Kg水.1年前查看全部
- 题目为废酸中含有硫酸和盐酸,要就分离和回收,第一步是加氨水,生成了硫酸铵和氯化铵,接下来分离他们
题目为废酸中含有硫酸和盐酸,要就分离和回收,第一步是加氨水,生成了硫酸铵和氯化铵,接下来分离他们
最终分别要得到氯化铵和硫酸铵,提示是用溶解性,我不知道具体的, haifeng5321年前2
haifeng5321年前2 -
 yang_cheng7261 共回答了22个问题
yang_cheng7261 共回答了22个问题 |采纳率81.8%查找一下在不同温度下两种物质的溶解度,找一个合适的温度可以分离出两种物质的晶体!1年前查看全部
- 答得好加50分1.在一熟苹果切片上分别滴1滴碘水和银氨溶液.颜色变化:滴氨水的区域显蓝色.滴银氨溶液显黑色.则( )A.
答得好加50分
1.在一熟苹果切片上分别滴1滴碘水和银氨溶液.颜色变化:滴氨水的区域显蓝色.滴银氨溶液显黑色.则( )
A.熟透 的苹果中含有脂肪 B.熟透的苹果中不含淀粉
C.熟透的苹果中含有还原性的糖 D熟透的苹果中不含还原性的糖
2.BACL2有剧毒,万一不小心误服,应该食大量鸡蛋清和适量解毒剂.下列可以做为解毒剂的是( )
A.AgNO3 B.CuSO4
C.Na2CO3 D.MgSO4
3.手脚皮肤磨出水泡.其中浅黄色的液体是___,它来源与___.
A.组织液,血浆 B.组织液.淋巴
C.血清.血浆 D.组织液.血清
4.人体激烈运动后,血浆的PH会有所下降.这是因为
A.血浆中的水分少了 B.血浆中的乳酸多了
C.血浆中的酒精多了 D.血浆中的钾离子少了
5.产生渴感的感受器和神经中枢分别位于
A.下丘脑和大脑皮层 B.下丘脑和上丘脑
C.大脑皮层和下丘脑 D.下丘脑和脊髓
6.反射活动的完成必须通过反射弧实现?这种说法对吗?
7.在神经元之间传递兴奋时,突触小体完成的信息传递转换模式是
A.电信号-化学信号-电信号 B.化学信号-电信号-化学信号 阿优爱小可1年前1
阿优爱小可1年前1 -
 woaini1234 共回答了24个问题
woaini1234 共回答了24个问题 |采纳率91.7%1a,2d,3b,4d,5c,6b,6不对,7a1年前查看全部
- 用吸管吸取浓氨水,在试管口的脱脂棉花上滴10-15滴 则试管中出现的现象是什么?此现象说明了什么问题?
 坨坨花1年前2
坨坨花1年前2 -
 锈气得摔锅 共回答了17个问题
锈气得摔锅 共回答了17个问题 |采纳率88.2%试管中出现的现象是滤纸上的酚酞试液由试管口向管底逐渐变红
此现象说明了分子是不停运动的
由于氨气具有挥发性,氨气溶于水形成氨水,氨水显碱性,氨水能使酚酞试液变红色;又因为氨分子是不停运动的,所以将会观察到滤纸上的酚酞试液由试管口向管底逐渐变红.1年前查看全部
- (水解基础问题)稀氨水逐滴加入稀硫酸中 解释得好的追加
(水解基础问题)稀氨水逐滴加入稀硫酸中 解释得好的追加
生成硫酸铵 按根离子会水解成一水合氨 那么请问这水解生成的一水合氨能和硫酸共存么? 战锋1年前2
战锋1年前2 -
 -分花拂柳- 共回答了19个问题
-分花拂柳- 共回答了19个问题 |采纳率89.5%(NH4)2SO4+2H2O==2NH3·H2O+H2SO4
首先你要知道水解是微弱进行的,硫酸铵的水解很微弱,以至生成的氨水和硫酸的浓度很小,发生化学反应需要达到一定的浓度,这里的氨水,硫酸浓度太小了,以至于不能发生反应,所以可以共存.
求采纳1年前查看全部
- 25度下,将a mol/L 的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(cl-),用
25度下,将a mol/L 的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(cl-),用含a的代数式表示NH3.H2O的电离常数Kb=?
(我主要是不知道NH3.H2O的浓度如何计算,大虾们尽量说详细点) bob_ying1年前1
bob_ying1年前1 -
 我爱蒙蒙 共回答了20个问题
我爱蒙蒙 共回答了20个问题 |采纳率95%由题意可知;反应以后的溶液是中性的(电荷守恒,氯离子浓度等于按根离子浓度的话,氢离子浓度就会等于氢氧根离子浓度),铵根离子浓度等于氯离子的0.01mol/L,氢氧根离子浓度是10^-7mol/L,再由N元素守恒可得:[NH3.H2O](剩余)=[NH3.H2O](初始)-[NH4+]=(a-0.01)mol/L.所以,Kb=10^-9/(a-0.01).1年前查看全部
- 硝酸银和稀氨水反应后,再和葡萄糖反应生成银镜
硝酸银和稀氨水反应后,再和葡萄糖反应生成银镜
银镜是什么? mount_cat1年前2
mount_cat1年前2 -
 xins322 共回答了24个问题
xins322 共回答了24个问题 |采纳率83.3%银镜是银Ag单质沉积在试管上,形成的类似镜子的现象1年前查看全部
- (1)硫酸铝溶液中滴过量氨水?(2)二氧化硅于氢氧化钠反应?(3)四氧化三铁加入盐酸中?(4)金属铝与氢氧化...
(1)硫酸铝溶液中滴过量氨水?(2)二氧化硅于氢氧化钠反应?(3)四氧化三铁加入盐酸中?(4)金属铝与氢氧化...
(1)硫酸铝溶液中滴过量氨水?(2)二氧化硅于氢氧化钠反应?(3)四氧化三铁加入盐酸中?(4)金属铝与氢氧化钠溶液反应?的化学反应方程式 jinxb1年前2
jinxb1年前2 -
 小桔灯 共回答了19个问题
小桔灯 共回答了19个问题 |采纳率84.2%1、Al2(SO4)3+6NH3H2O=2Al(OH)3↓+3(NH4)2SO4
2、SiO2+2NaOH=Na2SiO3+H2O
3、Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
4、2Al+2NaOH+2H2O=2NaAlO2+3H2↑1年前查看全部
- 氨水中的NH4+会水解吗?若会水解,溶液中的OH-为什么仍然比H+多?
 宝儿51061年前3
宝儿51061年前3 -
 压手 共回答了15个问题
压手 共回答了15个问题 |采纳率93.3%会 但是NH4+和OH-合成的是NH3.H2O 溶液中NH3.H2O有很多 抑制NH4+和OH-的反应正向移动1年前查看全部
- 1mol/L的硫酸和氨水等体积混合后剩下多少
 蜗拉牛1年前2
蜗拉牛1年前2 -
 陆佰88 共回答了25个问题
陆佰88 共回答了25个问题 |采纳率84%根据化学方程式H2SO4+2NH3·H2O=(NH4)2SO4+2H2O可以知道,硫酸有剩余,剩余的物质的量为原来的一半,又由于体积增大到原来的2倍,剩余硫酸的浓度为原来的1/4.1年前查看全部
- 物质的量相同的氨水和氯化铵混合液中,氨水电离能力大于铵根的水解能力,氨水和氢氧根还有铵根的浓度怎样
 zhou_ho1年前2
zhou_ho1年前2 -
 我不是风芝 共回答了11个问题
我不是风芝 共回答了11个问题 |采纳率90.9%因为氨水电离(呈碱性)能力大于铵根的水解(呈酸性)能力,所以溶液呈碱性,即c(H+)c(Cl-).
又c(NH4+)+c(NH3.H2O)=2c(Cl-),所以c(NH4+)>c(NH3.H2O).
无论是氨水电离还是铵根水解都是很微弱的,所以c(OH-)是三者中最小的.
综上所述:c(NH4+)>c(NH3.H2O)>c(OH-)1年前查看全部
- 求硫化亚铁与盐酸,硝酸钡与硫酸钠 醋酸与氢阳化钠 石灰石与盐酸 氯化铝与氨水的离子方程式?
 耒木451年前1
耒木451年前1 -
 rqshen 共回答了18个问题
rqshen 共回答了18个问题 |采纳率83.3%FeS+2H+=H2S+Fe2+
Ba2++SO42-=BaSO4
CH3COOH+OH-=CH3COO-+H2O
CaCO3+2H+=Ca2++H2O+CO2
Al3++3NH3.H2O=Al(OH)3+3NH4+1年前查看全部
- 氨水溶液中存在的三种离子和三种分子分别是什么?
 xs_hyj1年前3
xs_hyj1年前3 -
 512800 共回答了20个问题
512800 共回答了20个问题 |采纳率90%由于氨水中存在下列平衡:NH3 + H2O = NH3·H2O = NH4+ + OH-(可逆号在百度没法打,前面都是可逆号),所以氨水中存在以下分子和离子:H2O、NH3·H2O、NH3,OH-、NH4+、H+,且浓度顺序也如上表示.1年前查看全部
- 植绒时,胶水里面为什么添加氨水,添加氨水的作用是什么?
 iismajia1年前2
iismajia1年前2 -
 风影1969 共回答了18个问题
风影1969 共回答了18个问题 |采纳率83.3%根据不同的布料来调节胶水的粘度(只需加水成氨水),氨水或水所起的作用相当于分散剂或交联剂!1年前查看全部
- Na+,Ba2+,CL-,SO42-在溶液中既可以大量共存,且加入氨水后也不产生沉淀吗?
 哼哼哈嘿哈哈1年前1
哼哼哈嘿哈哈1年前1 -
 huojianu 共回答了13个问题
huojianu 共回答了13个问题 |采纳率84.6%Na+,Ba2+,CL-,SO42-在溶液中不能大量共存,Ba2+ + SO42- = BaSO4↓ 生成沉淀1年前查看全部
- 在FeSO4溶液中加入少量KSCN溶液,再滴入几滴氨水后溶液是什么颜色?为什么?
 815206301年前3
815206301年前3 -
 开外飞仙 共回答了10个问题
开外飞仙 共回答了10个问题 |采纳率100%加硫氰化钾后变成血红色溶液,加了氯水应该还是血红色的吧,因为氯水的漂白性来源于它的强氧化性,而亚铁离子本身已经被硫氰化钾氧化成铁离子了.应该是这样1年前查看全部
- 氨水能制氢氧化镁吗
 lydiazlf1年前1
lydiazlf1年前1 -
 安静的黑色 共回答了11个问题
安静的黑色 共回答了11个问题 |采纳率72.7%实验室可以用氯化镁、硫酸镁、硝酸镁溶液加入氨水生成氢氧化镁沉淀.工业上用菱镁矿煅烧生产氧化镁,加水熟化就可以制得氢氧化镁.1年前查看全部
- 计算AgCl的溶解度 在25℃时在6.O mol•L一1氨水溶液中[Kθ稳(Ag(NH3)2+)=1.12×107].
计算AgCl的溶解度 在25℃时在6.O mol•L一1氨水溶液中[Kθ稳(Ag(NH3)2+)=1.12×107].
 luck_mw1年前1
luck_mw1年前1 -
 山野之间 共回答了17个问题
山野之间 共回答了17个问题 |采纳率88.2%缺少AgCl溶度积条件,设为Ks,再设溶解度为x mol/L
AgCl(s) + 2NH3 == [Ag(NH3)2]+ + Cl- 该反应平衡常数K=Ks*K稳
平衡时 6-2x x x
根据K=x*x/(6-2x)^2
求解即可得出x1年前查看全部
- 25%的氨水和15%的氨水混合,混合溶液的浓度却小于20%,
 飘渺枪1年前1
飘渺枪1年前1 -
 lulu0513 共回答了15个问题
lulu0513 共回答了15个问题 |采纳率93.3%你缺少了一个条件:等体积混合.
要理解这个问题,需要先理解 等质量混合时,混合溶液的浓度等于20%.比如各取100g,溶液总质量就是200g,溶质总质量是25+15=40g,所以,混合溶液的浓度等于20%;
再理解 不等质量混合时,混合溶液的浓度不等于20%【这个就不解释了】,而是离开20%,向质量较大的那种溶液的质量分数靠拢【这个你最好是实际试一下】;
然后还得知道,氨水这种溶液,它的密度是 浓度越大,密度就越小.
下面就可以解释了:等体积混合,浓度不同,密度不同,质量也就不同→混合溶液的浓度不等于20%,而是离开20%,向质量较大的那种溶液的质量分数靠拢→15%的氨水密度较大,等体积时质量较大→混合溶液的浓度向15%靠拢→混合溶液的浓度小于20% .1年前查看全部
- 为什么氨水易挥发可以从更微观的角度解释吗?也就是从分子结构的角度来解释.不是为了考试来问的,不要告诉我记下就可以了.
 newlife200707201年前8
newlife200707201年前8 -
 andy1979107 共回答了17个问题
andy1979107 共回答了17个问题 |采纳率88.2%因为氨水的浓度太大了,如果同等浓度的氨水(氨气的水溶液)和氧气的水溶液相比,氨水的挥发速度要比氧慢很多,因为氨和水之间的氢健作用比较强.所以,氨水挥发速度太快的根本原因是氨水的浓度,而不是氨的性质.1年前查看全部
- 在 硝酸银溶液中加入氨水,开始在 硝酸铵溶液中出现( 1)反应的 离子方程式为( 2),继续滴入氨水则(3 ),反应的化
在 硝酸银溶液中加入氨水,开始在 硝酸铵溶液中出现( 1)反应的 离子方程式为( 2),继续滴入氨水则(3 ),反应的化学方程式为(4 ),边滴边振荡直滴到(5 )为止,再加入乙醛溶液后,水溶液加热的 现象是(6),化学方程式为 (7)
 cctvsonic1年前4
cctvsonic1年前4 -
 清风明月a 共回答了19个问题
清风明月a 共回答了19个问题 |采纳率94.7%1:白色沉淀(白色!不是黑色氧化银!)
2:Ag(+) + NH3.H2O == AgOH + NH4(+) (括号内为电荷角标)
3:沉淀逐渐减少
4:AgOH + 2NH3.H20 == Ag(NH3)2OH + 2H2O
5:沉淀刚好完全溶解(注意是刚好!)
6:出现光亮的银附着在试管底
7:2Ag(NH3)2OH + HCHO =水浴加热= 2Ag(沉淀箭号)+ HCOONH4 +3NH3 + H20 (注意氨没有气体箭号!)
没法弄角标……凑合看吧……好好学习吧!这块是高考要点!1年前查看全部
大家在问
- 1因为那是母亲出生和长大的地方,那里还有美丽的田野.翻译成英文
- 2The Class Five students have already been to Century Park.对C
- 3减速机扭矩的计算公式和传动比计算
- 4小方看一本科幻书,第一天看了全书的30%,如果在看24页,正好是全书的一半,这本书共有多少页?
- 5I heard the news (新闻) ______ the radio this morning.
- 6不动笔墨不读书 禹强读小学的时候,最怕写文章,费了好大劲,写出来的作文,老师总是说内容( ),词汇( ),她心里非常(
- 7xsec^2(x)/(1+tanx)^2的不定积分
- 8父亲节我们应该送给父亲什么礼物最有价值,最能体现做儿女的一片孝心?
- 9这是必须的英语怎么说sheineng zhidao
- 10四大类人猿的生活方式的共同点
- 11翻译Kspice EYEWEAR (关于眼镜)
- 12最珍贵稀有的陨石是什么,英文怎么写?
- 13下列有关横波与纵波的说法中,正确的是( )
- 14世界上唯一不用努力就能得到的是什么?
- 15长相思这首诗中,一个聒字,突出了 ;两个一更突出了 .
