我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献。下图是侯氏联合制碱法和西方索尔维制碱法的工艺流程。已知有
 leiming7692022-10-04 11:39:541条回答
leiming7692022-10-04 11:39:541条回答| 我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献。下图是侯氏联合制碱法和西方索尔维制碱法的工艺流程。已知有关物质重要反应的化学方程式如下:2NH 4 Cl +X====2NH 3 ↑+CaCl 2 +2H 2 O NH 4 Cl ==  ="=" NH 3 ↑+HCl↑ ="=" NH 3 ↑+HCl↑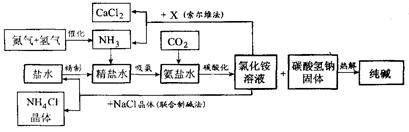 根据以上信息回答下列问题。 (1)盐水精制的过程是除去溶液中各种杂质的过程。为将盐水中含有的MgCl 2 沉淀除去,可以向其中加入过量的烧碱.此时反应的化学方程式为 ,将混合液中不溶物除去的实验方法是 ;溶液中多余烧碱可以加 ( 填试剂名称)来除去,反应的化学方程式为 。 (2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通人二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要“加压”的原因是:____________ 。 (3)在氨碱工业的历史上,如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”,即在氯化铵溶液中加入物质X (填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化铵的 ,使氯化铵晶体单独析出得到另一种产品——氮肥。氯化钠溶液则可以循环利用。 (4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体? 答: 。 |

已提交,审核后显示!提交回复
共1条回复
 xbp138 共回答了24个问题
xbp138 共回答了24个问题 |采纳率95.8%- (1)MgCl 2 +2NaOH ="=" Mg(OH) 2 ↓+2NaCl过滤
盐酸 NaOH + HCl ="=" NaCl + H 2 O
(2)增大二氧化碳的溶解度
(3)Ca(OH) 2 溶解度
(4)氯化铵受热易分解
(1)氢氧化钠和氯化镁生成氢氧化镁沉淀和氯化钠,分离固液混合物,要采用过滤的方法,氢氧化钠和盐酸生成氯化钠和水,(2) 气体的溶解度随着压强的增大而增大,(3)根据生成物是氨气和氯化钙可知X为Ca(OH) 2 ,氯化钠溶解溶液减少,是氯化铵的溶解度降低,(4)氯化铵受热易分解 - 1年前
相关推荐
- 我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答:
 我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答:
我国科学家侯德榜创造了一种著名的纯碱生产方法-“联合制碱法”.请你回答:
(1)纯碱(Na2CO3)属于______类物质(填“酸”、“碱”或“盐”).向纯碱的水溶液中滴入酚酞试液,试液变红色,则其pH______7(填“=”、“<”或“>”).
(2)“联合制碱法”生产过程用化学方程式可简要表示为:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl
③2NaHCO3
Na2CO3+H2O+CO2↑△ .
该过程中没有涉及到的基本反应类型是(______)
A.化合反应B.分解反应C.置换反应D.复分解反应
(3)第②步中加入的是磨细食盐粉.食盐磨细的目的是:______
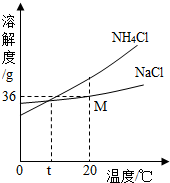
(4)从图中溶解度曲线中,你能获得的信息有:(写出2条)
______
(5)将第②步所得滤液(NH4Cl与剩余NaCl的混合溶液)
降温,NH4Cl晶体大量析出,而NaCl却仍留在了溶液中.
结合上图,你认为可能原因是:______.
所得NH4Cl属于化学肥料中的______肥,其中氮元素的质量分数为______.(精确到0.1%) leehom131年前1
leehom131年前1 -
 雨打芭蕉1976 共回答了13个问题
雨打芭蕉1976 共回答了13个问题 |采纳率100%解题思路:(1)根据碳酸钠的组成和结构判断物质种类;根据碳酸钠溶液呈碱性判断其pH大小.
(2)根据四种基本反应类型的定义和特点回答.
(3)根据磨细食盐粉的表面积增大分析回答.
(4)根据溶解度曲线的含义和信息回答.
(5)根据氯化钠和氯化铵的溶解度受温度影响的情况回答前一空;根据氯化铵的组成回答第二空;根据氯化铵的化学式和元素质量分数的公式计算后一空.(1)碳酸钠是由钠离子和碳酸根离子构成的,属于盐类,其水溶液呈碱性,溶液的pH大于7.
(2)①NH3+CO2+H2O=NH4HCO3的特点是“多变一”,符合化合反应的定义和特点,为化合反应,
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl的特点是“两交换,价不变”,符合复分解反应的定义和特点,为复分解反应,③2NaHCO3
△
.
Na2CO3+H2O+CO2↑的特点是“一变多”,符合分解反应的定义和特点,为分解反应,缺少的基本反应类型是置换反应.
(3)磨细食盐粉的表面积增大,加快食盐溶解,增大食盐和碳酸氢铵的接触面积,进而加快反应速率.
(4)由图示的溶解度曲线可得多种信息,如:NH4Cl溶解度随温度升高而明显增大,或NaCl溶解度受温度影响不大,或t℃时,NH4Cl和NaCl的溶解度相同,或20℃时,NaCl的溶解度为36g等.
(5)NH4Cl溶解度受温度影响较大,且随温度降低而明显减小,而NaCl溶解度受温度影响不大,所以降温后NH4Cl晶体大量析出,而NaCl却仍留在了溶液中;氯化铵中含有氮元素,为氮肥;氯化铵的化学式为NH4Cl,其中氮元素的质量分数为[14/14+1×4+35.5]×100%=26.2%.
故答案为:
(1)盐;>;
(2)C;
(3)增大食盐和水的接触面积,加快食盐溶解,进而加快反应速率;
(4)NH4Cl溶解度随温度升高而NaCl溶解度受温度影响不大.(或t℃时,NH4Cl和NaCl的溶解度相同;20℃时,NaCl的溶解度为36g.);
(5)NH4Cl溶解度受温度影响较大,而NaCl溶解度受温度影响不大;氮;26.2%.点评:
本题考点: 纯碱的制取;影响溶解快慢的因素;固体溶解度的影响因素;固体溶解度曲线及其作用;溶液的酸碱性与pH值的关系;常见化肥的种类和作用;常见的氧化物、酸、碱和盐的判别;元素的质量分数计算;反应类型的判定.
考点点评: 学来源于生产、生活,又服务于生产、生活,氨碱工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写,二氧化碳和氨气通入的顺序及原因,反应时析出碳酸氢钠的原因与物质溶解度的关系等重点内容.1年前查看全部
- 国科学家卢瑟福通过什么实验,提出了原子的什么结构模型
 未成年绅士1年前3
未成年绅士1年前3 -
 我爱打边炉 共回答了16个问题
我爱打边炉 共回答了16个问题 |采纳率100%α粒子轰击金属箔
现象太复杂了
行星模型1年前查看全部
大家在问
- 1一半在河海,一半在天空,问它住哪里,老家在山东
- 2一天24小时,时针和分针夹角成90度,有几次?
- 3Lucy已经打开窗户了.她是一个小时前打开的.这句话用英语怎么说
- 4I want you to do the dishes.(用would you mind改写)
- 5计算200g硫酸同0.4%的烧碱200g中和.生成的溶液的质量分数是?(当滴加在硫酸中的烧碱为200g时PH值为7)
- 67.2与三又五分之四的和除以2,商是多少?
- 7找规律填数:(1)2、3、5、8、13、______、34、______;(2)1、4、3、8、5、______、7、1
- 8水太珍贵了,对于沙漠缺水的问题,你有什么建设性的想法?
- 9读下图,回答下列问题。 (1)若AB为晨线,日期为________________(月、日)前后,太阳直射点的坐标为__
- 10若△ABC的三边为a,b,c,其中a,b满足a−2+b2−6b+9=0,则c的取值范围为______.
- 11—
- 12已知方程3m-6=2m的解也是关于x的方程2(x-3)-n=4的解.
- 13一,句型转换。Can the tigers climb trees?(用jump high改为选择疑问句)二,同义句转换
- 141.10名同学参加数学竞赛,前四名同学平均得分150分,后6名同学平均得分比10人的平均分少20分,这十名同学的平均分是
- 1510.12 某制糖场第一年制糖5万吨,如果平均每年的制糖产量比上一年增加10%,那么从第一年起,大约几年可以
