炼铜最早开始于A商代B春秋战国C战国晚期D秦朝
 7号啊2022-10-04 11:39:542条回答
7号啊2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 kuangrenzmp 共回答了20个问题
kuangrenzmp 共回答了20个问题 |采纳率85%- A
- 1年前
 梦竹521 共回答了5个问题
梦竹521 共回答了5个问题 |采纳率- a
- 1年前
相关推荐
- .火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯.在
.火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯.在电解精炼时.
A.精炼粗铜接电源负极 B.精炼时纯铜做阴极
C.杂质都将以单质形式沉淀到池底 D.纯铜片增重2.56 g,电路通过电子为0.08mol
 gjdong041年前2
gjdong041年前2 -
 侯禀鹊 共回答了13个问题
侯禀鹊 共回答了13个问题 |采纳率92.3%选B
精炼时阳极是被氧化的,阴极是还原的,所以要把粗铜接在电源正极上,纯铜接在负极上这样从溶液中Cu2+才会析出在纯铜上达到精炼的目的。
C答案不对因为粗铜中比铜活泼的金属先放电成离子,如锌会在溶液中,但是在阴极还原时铜要在锌前面。
D答案不对因为还有锌这类的活泼金属会被氧化在溶液中,所以通过的电子要大于0.08mol。
这些希望对你有些帮助。有什么问题还可补充。...1年前查看全部
- 下列说法中正确的是( )A.合金一定是由几种金属一起熔化而成的B.“湿法炼铜”中的铜是指可溶性的铜盐C.有一种单质与一
下列说法中正确的是( )
A.合金一定是由几种金属一起熔化而成的
B.“湿法炼铜”中的铜是指可溶性的铜盐
C.有一种单质与一种化合物生成的反应一定是置换反应
D.炼铁是用焦炭还原铁矿石的过程 janetchengjing1年前1
janetchengjing1年前1 -
 av120 共回答了19个问题
av120 共回答了19个问题 |采纳率73.7%解题思路:根据已有的知识进行分析,合金是在一种金属中加热熔合其他金属或非金属而形成的混合物,湿法炼铜中的铜指的是铜单质,置换反应是一种单质与一种化合物反应生成另一种单质和化合物的反应,炼铁时使用到了焦炭.A、合金是在一种金属中加热熔合其他金属或非金属而形成的混合物,不一定是金属熔合,故A错误;
B、湿法炼铜中的铜指的是铜单质,故B错误;
C、置换反应是一种单质与一种化合物反应生成另一种单质和化合物的反应,分解反应也能生成一种单质和一种化合物,故C错误;
D、炼铁时使用到了焦炭,故D正确.
故选D.点评:
本题考点: 金属活动性顺序及其应用;合金与合金的性质;铁的冶炼.
考点点评: 本题考查了金属的冶炼以及一些化学基本概念,完成此题,可以依据已有的知识进行.1年前查看全部
- 孔雀石稀硫酸反应,制炼铜的化学方程式···在线等··老师们帮下忙
 bme811年前2
bme811年前2 -
 乒乓乒乓 共回答了15个问题
乒乓乒乓 共回答了15个问题 |采纳率73.3%Cu2(OH)2CO3 + 2H2SO4 = 2CuSO4 + 3H2O + CO2
火法炼铜
Cu2(OH)2CO3 ══2CuO + CO2↑+ H2O (加热)
CuO + CO ══Cu + CO2 (加热)
湿法炼铜
Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2+3HO2
CuSO4+Fe=FeSO4+Cu1年前查看全部
- 古代有火烧孔雀石{cu(oH)co3}炼铜,用必要的文字及方程式说明上述冶炼过程
 我是深烂大道1年前1
我是深烂大道1年前1 -
 圣殿骑士七人 共回答了15个问题
圣殿骑士七人 共回答了15个问题 |采纳率73.3%火烧孔雀石炼铜其实隐藏了一个条件,就是用木头或者炭烧的火,在火烧条件下,碳会和孔雀石里面的氧元素反应,生成二氧化碳或者一氧化碳,因为一氧化碳在逸出之后也会燃烧成二氧化碳,所以反应式就是孔雀石加氧气,燃烧或者高温生成二氧化碳和铜这么一个反应式,配平的话我就不帮你了,你自己试试比较好.1年前查看全部
- 地壳中铝铁的含量位于1、2位,但在人类的历史中炼铜已有6000年的历史,炼铁晚了3000年,至于炼铝则只有200年,根据
地壳中铝铁的含量位于1、2位,但在人类的历史中炼铜已有6000年的历史,炼铁晚了3000年,至于炼铝则只有200年,根据金属的性质,你认为关键的因素是什么
 yixuanw1年前3
yixuanw1年前3 -
 蓝色懈寄生 共回答了15个问题
蓝色懈寄生 共回答了15个问题 |采纳率73.3%按金属活动性由小到大排列为Cu、Fe、Al,故Cu制品比较稳定,耐腐蚀,技术要求相对较低.1年前查看全部
- 由黄铁矿炼铜的过程中发生了反应:Cu2S+2Cu2O 高温 . 6Cu+SO2↑,下列叙述
由黄铁矿炼铜的过程中发生了反应:Cu2S+2Cu2O
6Cu+SO2↑,下列叙述正确的是( )高温 .
A.该反应从氧化还原反应的电子转移看,与SO2+2H2S═3S+2H2O是同一反应类型
B.该反应中,氧元素氧化了硫元素
C.该反应从氧化还原反应的电子转移角度看,与6NO2+8NH3
7N2+12H2O是一种反应类型300℃ .
D.该反应中,Cu2S既是还原剂又是氧化剂 haomaomao771年前1
haomaomao771年前1 -
 politics99 共回答了19个问题
politics99 共回答了19个问题 |采纳率94.7%解题思路:Cu2S+2Cu2O
6Cu+SO2↑中,Cu元素化合价降低,S元素化合价升高,则反应中Cu2S和Cu2O都表现为氧化性,而Cu2S还表现为还原性,以此来解答.高温 .A.SO2+2H2S═3S+2H2O中只有S元素的化合价变化,为归中反应,而Cu2S+2Cu2O
高温
.
6Cu+SO2↑中Cu、S元素的化合价均变化,类型不同,故A错误;
B.反应中O元素的化合价不变,Cu元素氧化硫元素,故B错误;
C.6NO2+8NH3
300℃
.
7N2+12H2O中只有N元素的化合价变化,为归中反应,而Cu2S+2Cu2O
高温
.
6Cu+SO2↑中Cu、S元素的化合价均变化,类型不同,故C错误;
D.Cu元素化合价降低,S元素化合价升高,则该反应中,Cu2S既是还原剂又是氧化剂,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化及归中反应为解答的关键,注意选项AC考查点相同,题目难度不大.1年前查看全部
- 古代湿法炼铜的化学原理是Fe+CuSO4=FeSO4+Cu,下列说法正确的是,
古代湿法炼铜的化学原理是Fe+CuSO4=FeSO4+Cu,下列说法正确的是,
A.氧化性Fe>Cu .B.还原性CuSO4>FeSO4
C.氧化性CuSO4>FeSO4
D.还原性Fe>FeSO4 手爪子31年前4
手爪子31年前4 -
 程育宣 共回答了23个问题
程育宣 共回答了23个问题 |采纳率91.3%氧化剂:CuSO4,有氧化性
还原剂:Fe,有还原性
氧化产物:FeSO4
还原产物:Cu
根据“氧化剂的氧化性大于氧化产物”所以氧化性CuSO4>FeSO4
C对.1年前查看全部
- 如图所示火法炼铜首先要焙烧黄铜矿……
如图所示火法炼铜首先要焙烧黄铜矿……

第三题,. 霉酸1年前3
霉酸1年前3 -
 东方狮 共回答了19个问题
东方狮 共回答了19个问题 |采纳率78.9%1年前查看全部
- 为什么炼铜史比炼铁史早要从化学的角度上来看
 ftj12261年前1
ftj12261年前1 -
 numoral 共回答了18个问题
numoral 共回答了18个问题 |采纳率88.9%根据金属元素的活泼性排列顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
铜排在铁后面,说明铜的活泼性不如铁,更好冶炼.1年前查看全部
- 古代湿法炼铜,“曾青得铁则化为铜”的化学方程式为( ),反映的基本类型是(),从反应物之间电子发生
古代湿法炼铜,“曾青得铁则化为铜”的化学方程式为( ),反映的基本类型是(),从反应物之间电子发生
转移的角度看,该反应属于() fengyunfa991年前1
fengyunfa991年前1 -
 mikko 共回答了23个问题
mikko 共回答了23个问题 |采纳率95.7%Fe +CuSO4====Cu +FeSO4
置换反应
氧化还原反应1年前查看全部
- 工业上火法炼铜的一个主要反应是cu2so4 o2===2cu so2(点燃).cu2s中铜元素的质量分数为_______
工业上火法炼铜的一个主要反应是cu2so4 o2===2cu so2(点燃).cu2s中铜元素的质量分数为______________.用500吨含cu2s80%的铜矿石,理论上可以炼出_______________吨铜.(写计算过程)
 aini271901年前1
aini271901年前1 -
 kiss小鱼儿 共回答了18个问题
kiss小鱼儿 共回答了18个问题 |采纳率77.8%3.8克的Cu-Zn合金,氧化铜的质量是3.8克
描述相同的质量的质量的锌和氧
16 /(64 +16)== 0.2 0.2 * 3.8 == 0.76克,即锌的质量是0.76克
所以铜的质量分数(3.8-0.76)/ 3.8 = 80%1年前查看全部
- 写下列化学方程式:(1)湿法炼铜______(2)氯化铁溶液和氢氧化钠混合反应______.
 ivanwang11221年前1
ivanwang11221年前1 -
 action1983 共回答了15个问题
action1983 共回答了15个问题 |采纳率93.3%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)湿法炼铜是铁与硫酸铜溶液发生置换反应生成铜和硫酸亚铁,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
(2)氯化铁溶液和氢氧化钠混合反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为:3NaOH+FeCl3═Fe(OH)3↓+3NaCl.
故答案为:(1)Fe+CuSO4═FeSO4+Cu;(2)3NaOH+FeCl3═Fe(OH)3↓+3NaCl.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 写下列化学方程式:(1)湿法炼铜______(2)氯化铁溶液和氢氧化钠混合反应______.
 aitdkbc1年前1
aitdkbc1年前1 -
 wenjin 共回答了18个问题
wenjin 共回答了18个问题 |采纳率100%(1)湿法炼铜是铁与硫酸铜溶液发生置换反应生成铜和硫酸亚铁,反应的化学方程式为:Fe+CuSO 4 ═FeSO 4 +Cu.
(2)氯化铁溶液和氢氧化钠混合反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为:3NaOH+FeCl 3 ═Fe(OH) 3 ↓+3NaCl.
故答案为:(1)Fe+CuSO 4 ═FeSO 4 +Cu;(2)3NaOH+FeCl 3 ═Fe(OH) 3 ↓+3NaCl.1年前查看全部
- 火法炼铜首先要焙烧黄铜矿,主要涉及以下反应:
火法炼铜首先要焙烧黄铜矿,主要涉及以下反应:
①2CuFeS2+O2=Cu2S+2FeS+SO2
②Cu2S+O2=2Cu+SO2
下列说法正确的是( )
A.在反应①中:SO2既是氧化产物又是还原产物
B.在反应②中:Cu2S仅作还原剂,硫元素被氧化
C.在反应①中:每转移1.2 mol电子,有0.2 mol硫被氧化
D.在反应②中:每消耗1.0 molCu2S,有4.0 mol电子转移 二十四桥依旧1年前1
二十四桥依旧1年前1 -
 回头是岸吗 共回答了19个问题
回头是岸吗 共回答了19个问题 |采纳率100%解题思路:A、标注元素化合价变化,依据氧化还原反应的概念分析判断,还原剂被氧化生成氧化产物,氧化剂被还原生成氧化产物;
B、标注化合价分析判断;
C、依据化学方程式和电子守恒、化合价变化计算判断;
D、依据化学方程式和电子守恒、化合价变化计算判断;A、2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,则SO2既是氧化产物又是还原产物,故A正确;
B、Cu2S+O2=2Cu+SO2,铜元素化合价从+1价降到0价,氧元素化合价从 0价降低到-2价,硫元素化合价从-2价升高到+4价,则在反应②中:Cu2S即作氧化剂又做还原剂,硫元素被氧化,故B错误;
C、2CuFeS2+O2=Cu2S+2FeS+SO2中,硫元素化合价从-2价升高到+4价,所以生成1molSO2转移电子为6mol,被氧化的硫元素为1mol,每转移1.2 mol电子,有0.2 mol硫被氧化,故C正确;
D、Cu2S+O2=2Cu+SO2,铜元素化合价从+1价降到0价,氧元素化合价从 0价降低到-2价,硫元素化合价从-2价升高到+4价,消耗1molCu2S,电子转移6mol,故D错误;
故选AC.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应的概念应用,电子守恒的判断,化合价的升降分析判断概念的应用,转移电子的计算方法.1年前查看全部
- 将一根洁净的铁丝插入硫酸铜的溶液中,很快铁丝表面就会附着一层亮红色的金属铜,这也是湿法炼铜的原理,其主要反应是Fe+Cu
将一根洁净的铁丝插入硫酸铜的溶液中,很快铁丝表面就会附着一层亮红色的金属铜,这也是湿法炼铜的原理,其主要反应是Fe+CuSO4═Cu+FeSO4该反应属于( )
A.化合反应
B.分解反应
C.置换反应
D.以上都不对 我是果皮1年前1
我是果皮1年前1 -
 zhyd7822807 共回答了10个问题
zhyd7822807 共回答了10个问题 |采纳率100%解题思路:置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,据此进行分析判断.湿法炼铜的原理,其主要反应是Fe+CuSO4═Cu+FeSO4,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应.
故选C.点评:
本题考点: 置换反应及其应用.
考点点评: 本题难度不大,掌握置换反应的特征(反应物和生成物均是两种,其中一种是单质和另一种是化合物)是正确解答本题的关键.1年前查看全部
- (2014•陕西一模)黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氧化二铁和氧化亚铜.三氧化二铁和氧
(2014•陕西一模)黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氧化二铁和氧化亚铜.三氧化二铁和氧化亚铜都是红色粉末.常用作颜料.某学校化学兴趣小组通过实验探究一红色粉末是Fe2O3、Cu2O或两者的混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物.溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3.
假设2:红色粉末是Cu2O.
假设3:红色粉末是Fe2O3和Cu2O的混合物.
设计探究实验:
取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂.
(1)若假设1成立,则实验现象是______.
(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含三氧化二铁.你认为这种说法合
理吗?______.简述你的理由(不需写出反应的化学方程式):______.
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色.则证明原同体粉末是______,写出发生的氧化还原反应的离子方程式:______.
探究延伸:
(4)经实验分析.确定红色粉末为Fe2O3和Cu2O的混合物.实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4•5H2O).经阅资料得知.在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如表:
实验小组设汁如图实验方案:物质 Cu(OH)2 Fe(OH)2 Fe(OH)3 开始沉淀时的pH 6.0 7.5 1.4 完全沉淀时的pH 13 14 3.7 
①试剂Ⅰ为______.试剂2为______.(填字母)
A.氯水B.H2O2C.NaOH D.Cu2(OH)2CO3
②同体X的化学式为______.
③操作Ⅱ为______. 雪兰狐1年前1
雪兰狐1年前1 -
 seth1023 共回答了26个问题
seth1023 共回答了26个问题 |采纳率84.6%解题思路:(1)依据假设1为氧化铁,和实验工厂分析,固体溶解后生成硫酸铁,遇到硫氰酸钾会发生反应生成血红色溶液;
(2)滴加KSCN试剂后溶液不变红色,说明溶液中无铁离子,可能是氧化亚铜在酸中发生氧化还原反应生成氧化铜和铜,生成的铜能把铁离子还原为亚铁离子,使溶液遇到硫氰酸钾不变红色;
(3)固体完全溶解,无固体存在,说明固体含有氧化铁和氧化亚铜;反应生成的铜会和铁离子全部反应;
(4)①红色粉末为Fe2O3和Cu2O的混合物溶于硫酸后氧化亚铜反应生成的铜会还原铁离子为亚铁离子,加入氧化剂过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀;
②X推断为氢氧化铁沉淀;
③操作Ⅰ是溶液中得到溶质结晶水合物;是通过蒸发浓缩冷却结晶,过滤洗涤干燥得到晶体;(1)取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂,若假设1成立,红色粉末是Fe2O3,则实验现象是固体完全溶解,溶液呈血红色;
故答案为:固体完全溶解,溶液呈血红色;
(2)滴加KSCN试剂后溶液不变红色,说明溶液中无铁离子,可能是氧化亚铜在酸中发生氧化还原反应生成氧化铜和铜,生成的铜能把铁离子还原为亚铁离子,使溶液遇到硫氰酸钾不变红色,所以滴加KSCN试剂后溶液不变红色,不能说明原混合物不含氧化铁;
故答案为:不合理;当原固体粉末为Fe2O3和Cu2O的混合物时,加入稀H2SO4后产生的Fe3+与Cu反应生成Fe2+,滴加KSCN溶液后也可能不变红色;
(3)固体完全溶解,无固体存在,说明固体含有氧化铁和氧化亚铜;反应生成的铜会和铁离子全部反应,反应的离子方程式为:Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+;
故答案为:Fe2O3和Cu2O;Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+;
(4)①红色粉末为Fe2O3和Cu2O的混合物溶于硫酸后氧化亚铜反应生成的铜会还原铁离子为亚铁离子,加入氧化剂过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀,为不引入杂质需要加入氧化铜或碱式碳酸铜调节溶液PH,AC会引入新的杂质;
故答案为:B;D;
②流程分析判断固体X为氢氧化铁沉淀;
故答案为:Fe(OH)3;
③操作Ⅰ是溶液中得到溶质结晶水合物;是通过蒸发浓缩冷却结晶,过滤洗涤干燥得到晶体;
故答案为:蒸发浓缩、冷却结晶;点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了实验探究物质组成和性质的实验分析,物质的性质和转化关系,掌握基础,细心审题是解题关键,题目难度中等.1年前查看全部
- 工业可采取火法炼铜Cu2S+O2=2Cu+SO2每生成2molcu,反应转移6mol电子为何是6MOL,怎能的
 zhizi_li1年前1
zhizi_li1年前1 -
 xy_jy 共回答了16个问题
xy_jy 共回答了16个问题 |采纳率93.8%我们分析一下化合价变化
在这个反应中硫化亚铜中亚铜离子+1变为两份的0价铜单质 得2mol电子
氧气从零价变为-2价两份氧原子 得4mol电子
硫化亚铜中的硫从-2价 变为二氧化硫中的+4加 失去6mol电子
转移6mol电子1年前查看全部
- 西汉湿法炼铜实验现象是什么
 水果果1年前1
水果果1年前1 -
 zhaominiloveyou 共回答了16个问题
zhaominiloveyou 共回答了16个问题 |采纳率87.5%硫酸铜和铁生成铜和硫酸亚铁1年前查看全部
- (2012•润州区二模)以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种
(2012•润州区二模)以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种.近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐,某工厂运用该原理生产铜和绿矾(FeSO4的晶体,含结晶水).

回答下列问题:
(1)写出反应Ⅰ的化学反应方程式:______;
(2)欲从溶液中获得绿矾晶体,分离“操作2”应为蒸发浓缩、______、过滤. jackingyu1年前1
jackingyu1年前1 -
 没有dd 共回答了26个问题
没有dd 共回答了26个问题 |采纳率88.5%解题思路:(1)根据化学方程式的书写方法考虑;(2)根据固体溶质从溶液中结晶析出的方法是:蒸发溶剂,降温结晶,再过滤.(1)反应Ⅰ中的反应物是CuFeS2、O2、H2SO4三种物质,生成物是硫酸铁、硫酸铜和水,根据奇偶法配平,所以方程式是:4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O;
(2)获得绿矾晶体时先蒸发浓缩,因为硫酸铁的溶解度随温度的升高而增大,所以降温溶解度减小,会析出晶体,最后过滤即可.
故答案为:(1)4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O;(2)降温结晶.点评:
本题考点: 物质的相互转化和制备;结晶的原理、方法及其应用;金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关键是要知道方程式的书写方法,熟悉溶液中溶质结晶析出的方法.1年前查看全部
- 火法炼铜技术原理及工作总结急求1000字左右 的总结,
 又見xx1年前1
又見xx1年前1 -
 mol_hcy 共回答了16个问题
mol_hcy 共回答了16个问题 |采纳率100%主要写一下主要的工作内容,取得的成绩,以及不足,最后提出合理化的建议或者新的努力方向.工作总结就是让上级知道你有什么贡献,体现你的工作价值所在.所以应该写好几点:
1、你对岗位和工作上的认识2、具体你做了什么事3、你如何用心工作,哪些事情是你动脑子去解决的.就算没什么,也要写一些有难度的问题,你如何通过努力解决了
4、以后工作中你还需提高哪些能力或充实哪些知识
5、上级喜欢主动工作的人.你分内的事情都要有所准备,即事前准备工作以下供你参考:
总结,就是把一个时间段的情况进行一次全面系统的总评价、总分析,分析成绩、不足、经验等.总结是应用写作的一种,是对已经做过的工作进行理性的思考.
总结的基本要求
1.总结必须有情况的概述和叙述,有的比较简单,有的比较详细.
2.成绩和缺点.这是总结的主要内容.总结的目的就是要肯定成绩,找出缺点.成绩有哪些,有多大,表现在哪些方面,是怎样取得的;缺点有多少,表现在哪些方面,是怎样产生的,都应写清楚.
3.经验和教训.为了便于今后工作,必须对以前的工作经验和教训进行分析、研究、概括,并形成理论知识.
总结的注意事项:
1.一定要实事求是,成绩基本不夸大,缺点基本不缩小.这是分析、得出教训的基础.
2.条理要清楚.语句通顺,容易理解.
3.要详略适宜.有重要的,有次要的,写作时要突出重点.总结中的问题要有主次、详略之分.
总结的基本格式:
1、标题
2、正文
开头:概述情况,总体评价;提纲挈领,总括全文.
主体:分析成绩缺憾,总结经验教训.
结尾:分析问题,明确方向.
3、落款
署名与日期1年前查看全部
- 孔雀石炼铜的方程式
 joy_hee1年前1
joy_hee1年前1 -
 钱的前身2 共回答了20个问题
钱的前身2 共回答了20个问题 |采纳率100%Cu2(OH)2CO3=2CuO+H20+CO2
条件为加热.
CuO再和某些还原剂反应(如CO,H2)生成铜.
CuO+CO=CO2+Cu
或者你可以直接写成
Cu2(OH)2CO3=2Cu+02+H20+CO2
注意要打气体向上符号.1年前查看全部
- 读炼铜工业的生产过程图,完成问题。
读炼铜工业的生产过程图,完成问题。
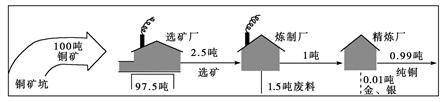
小题1:据图分析,影响选矿厂布局的主导因素是
小题2:结合所学知识及图可知,影响炼制厂和精炼厂布局的主导因素分别是A.动力 B.劳动力 C.原料 D.市场 A.动力、原料 B.动力、市场 C.动力、动力 D.原料、原料  遥守你身边1年前1
遥守你身边1年前1 -
 苍穹一破 共回答了19个问题
苍穹一破 共回答了19个问题 |采纳率84.2%小题1:C
小题2:B
本题考查工业区位。
小题1:由图可知,选矿厂应接近铜矿坑,其布局的主导因素是原料。
小题2:炼铜厂为动力导向型工业, 故影响炼制厂布局的主导因素是动力;由图中运输的吨数变化可知,精炼厂应接近市场。1年前查看全部
- 1.制造青铜器2.冶铁炼钢3.湿法炼铜年代排序
1.制造青铜器2.冶铁炼钢3.湿法炼铜年代排序
a123
b132
c321
d312 水草不长在水里1年前2
水草不长在水里1年前2 -
 liyajun760629 共回答了19个问题
liyajun760629 共回答了19个问题 |采纳率94.7%应为B1年前查看全部
- 下列化学方程式书写正确的是( ) A.湿法炼铜:Fe+CuSO 4 =Cu+FeSO 4 B.白磷在空气中燃烧:P+O
下列化学方程式书写正确的是( ) A.湿法炼铜:Fe+CuSO 4 =Cu+FeSO 4 B.白磷在空气中燃烧:P+O 2
P 2 O 5点燃 . C.铁与盐酸反应:2Fe+6HCl=2FeCl 3 +3H 2 ↑ D.硫酸铜溶液和氢氧化钠溶液反应:CuSO 4 +NaOH=CuOH↓+NaSO 4  faery20071年前1
faery20071年前1 -
 冰凉雨露 共回答了15个问题
冰凉雨露 共回答了15个问题 |采纳率80%A、湿法炼铜就是铁将硫酸铜溶液中的铜置换出来生成硫酸亚铁和铜,故A正确,
B、书写的化学方程式必须进行配平,而该题中的方程式没有配平,故B错误,
C、铁在置换反应中常显示+2价,而生成的氯化铁中的铁是+3价,故C错误,
D、复分解反应中的元素的化合价不变,铜显+2价,硫酸根离子显-2价,所以氢氧根离子和钠离子的角标需要加2,故D错误,
故选A.1年前查看全部
- 下列说法中正确的是( ) A.合金一定是由几种金属一起熔化而成的 B.“湿法炼铜”中的铜是指可溶性的铜盐 C.有一种单
下列说法中正确的是( )
A.合金一定是由几种金属一起熔化而成的
B.“湿法炼铜”中的铜是指可溶性的铜盐
C.有一种单质与一种化合物生成的反应一定是置换反应
D.炼铁是用焦炭还原铁矿石的过程 江中无水1年前1
江中无水1年前1 -
 Hmilqc 共回答了12个问题
Hmilqc 共回答了12个问题 |采纳率100%A、合金是在一种金属中加热熔合其他金属或非金属而形成的混合物,不一定是金属熔合,故A错误;
B、湿法炼铜中的铜指的是铜单质,故B错误;
C、置换反应是一种单质与一种化合物反应生成另一种单质和化合物的反应,分解反应也能生成一种单质和一种化合物,故C错误;
D、炼铁时使用到了焦炭,故D正确.
故选D.1年前查看全部
- 31、某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):
31、某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在高温条件下进行):
2 Cu2S+3O22Cu2O+2 SO2 2Cu2O+Cu2S6Cu+SO2
(1) 若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
(2) 若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?(保留3位小数)
(3) 今将a mol Cu2S与b mol空气(氧气约占空气体积的20%)在密闭容器中高温加热,设反应前容器内的压强为P1,反应结束后冷却到原来的温度,容器内的压强为P2,请完成下列表格:
反应后固体的成分 Cu Cu2S、Cu Cu2O、Cu
b的取值范围
P1与P2的关系
(填>、 法兰西上空的鹰1年前1
法兰西上空的鹰1年前1 -
 dyh1972 共回答了16个问题
dyh1972 共回答了16个问题 |采纳率93.8%31. (1)设需精辉铜矿的质量为x,根据元素守恒:
Cu2S —— 2Cu
160 t 128 t 则x= =60 t
x·80% 38.4 t
(2)设可生产98%的浓H2SO4的质量为y,根据元素守恒:
Cu2S → 2Cu → H2SO4
160 128 98 38.4×92%×98% y×98% y=27.05
(3)
反应后固体
的成分 Cu Cu2S 、Cu Cu2O、 Cu
b的取值范围 b=5a 01年前查看全部
- (2013•德州模拟)黄铜矿的主要成分是CuFeS2(硫元素一2价,铁元素+2价).是工业炼铜的主要原料.已知黄铜矿在空
(2013•德州模拟)黄铜矿的主要成分是CuFeS2(硫元素一2价,铁元素+2价).是工业炼铜的主要原料.已知黄铜矿在空气中焙烧生成cu、FeS和S02,FeS+2Hcl=FeCl+H2S.H2S是一种剧毒气体.某科研小组设计以黄铜矿为原料涮取单质铜和氯化铁晶体(FeCl3•6H2O)的流程如下:

(1)92gCuFeS2在空气中焙烧生成Cu、FeS和S02转移电子的物质的量为______.
(2)请简述检验气体Ⅰ的操作步骤.
(3)在实验室中,欲用38%(密度为1.18g.mL-1)的盐酸配制30%的盐酸,需要的玻璃仪器主要有______.
(4)气体Ⅲ最好选用______(填写序号),其主要作用是______;
A.02B.H2C.Cl2D.N2
欲选用下列仪器在实验室中制取纯净干燥的该气体.
装置A中发生反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O△ .MnO2+4H++2Cl-.
Mn2++Cl2↑+2H2O△ .
选用合适装置导管口的连接顺序为a接______.图中仪器G的名称是______;在使用该仪器时,应首先______. 景萱1年前1
景萱1年前1 -
 妮妮1111 共回答了16个问题
妮妮1111 共回答了16个问题 |采纳率93.8%解题思路:(1)根据n=[m/M]计算92gCuFeS2的物质的量,根据原子守恒计算Cu、FeS和SO2的物质的量,反应中只有生成SO2的硫元素化合价升高,由-2价升高为+4价,据此计算转移电子物质的量;
(2)由工艺流程可知,焙烧产生的气体Ⅰ为SO2,利用品红溶液进行检验;
(3)用38%(密度为1.18g.mL-1)的盐酸配制30%的盐酸,用量筒量取需要浓盐酸与水的体积,在烧杯中稀释,丙用玻璃棒搅拌;
(4)由工艺流程可知,过滤得到的滤液中主要为FeCl2,产品为FeCl3•6H2O,故通入的气体将Fe2+氧化为Fe3+,且不引入杂质,应为氯气最好;
制备干燥纯净的氯气:由发生装置可知,应是二氧化锰与浓盐酸加热制备,生成的氯气中含有HCl、水蒸气,利用饱和氯化钠溶液吸收氯气中的氯化氢气体;再利用浓硫酸除去氯气中的水蒸气,最后用氢氧化钠溶液吸收尾气中的氯气,连接时注意洗气与干燥装置导气管需要长进短出、收集装置应长进短出;
G是分液漏斗,使用之前应检查是否漏水.(1)92gCuFeS2的物质的量=[92g/184g/mol]=0.5mol,根据原子守恒可知生成Cu、FeS的物质的量分别为0.5mol、0.5mol,由硫原子守恒可知SO2的物质的量=0.5mol×2-0.5mol=0.5mol,反应中只有生成SO2的硫元素化合价升高,由-2价升高为+4价,故转移电子物质的量=0.5mol×[4-(-2)]=3mol,
故答案为:3mol;
(2)由工艺流程可知,焙烧产生的气体Ⅰ为SO2,利用品红溶液进行检验,具体操作为:收集适量气体Ⅰ通入品红溶液中,品红溶液褪色,加热溶液恢复红色,
故答案为:收集适量气体Ⅰ通入品红溶液中,品红溶液褪色,加热溶液恢复红色;
(3)用38%(密度为1.18g.mL-1)的盐酸配制30%的盐酸,用量筒量取需要浓盐酸与水的体积,在烧杯中稀释,丙用玻璃棒搅拌,故需要的仪器有:量筒、玻璃棒、烧杯,
故答案为:量筒、玻璃棒、烧杯;
(4)由工艺流程可知,过滤得到的滤液中主要为FeCl2,产品为FeCl3•6H2O,故通入的气体将Fe2+氧化为Fe3+,且不引入杂质,应为氯气最好;
制备干燥纯净的氯气:由发生装置可知,应是二氧化锰与浓盐酸加热制备,反应离子方程式为:MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O;
生成的氯气中含有HCl、水蒸气,利用饱和氯化钠溶液吸收氯气中的氯化氢气体;再利用浓硫酸除去氯气中的水蒸气,最后用氢氧化钠溶液吸收尾气中的氯气,连接时注意洗气与干燥装置导气管需要长进短出、收集装置应长进短出,故连接顺序为aghefb;
G是分液漏斗,使用之前应检查是否漏水,
故答案为:C;将Fe2+氧化为Fe3+;MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O;ghefb;分液漏斗;检查是否漏水.点评:
本题考点: 制备实验方案的设计;气体发生装置.
考点点评: 本题考查氧化还原反应、元素化合物性质、实验方案设计、氯气实验室制备等,侧重对化学基本操作与技能的考查,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.1年前查看全部
- 工业上用黄铜矿(CuFeS 工业上用黄铜矿(CuFeS 2 )炼铜的后期主要发生如下两个反应(假设两反应进行得很完全):
工业上用黄铜矿(CuFeS
工业上用黄铜矿(CuFeS 2 )炼铜的后期主要发生如下两个反应(假设两反应进行得很完全):2Cu 2 S+3O 2 =2Cu 2 O+2SO 2 、2Cu 2 O+Cu 2 S=6Cu+SO 2 根据以上两个化学反应,判断下列说法不正确的是 [ ] A.氧化剂与还原剂的质量之比为17:15
B.工业炼铜时应注意控制向炉内通入氧气的量
C.若制取3molCu,转移电子物质的量为9 mol
D.工业炼铜可以和硫酸工业联合建厂 gyang1140011年前1
gyang1140011年前1 -
 ee的那首歌 共回答了17个问题
ee的那首歌 共回答了17个问题 |采纳率88.2%A1年前查看全部
- (2010•鲤城区质检)小红同学在西汉《淮南子•万毕术》一书中看到了湿法炼铜的文字记载:“曾青得铁则化铜”.为了能对古代
(2010•鲤城区质检)小红同学在西汉《淮南子•万毕术》一书中看到了湿法炼铜的文字记载:“曾青得铁则化铜”.为了能对古代湿法炼铜有更深入的认识,小红与同学们展开了以下的学习与交流.
(1)请按金属活动性的顺序,将铁和铜的元素符号填在下图的方框内.
(2)若曾青为硫酸铜.请用化学方程式表示“曾青得铁则化铜”所包含的化学反应:CuSO4+Fe=FeSO4+CuCuSO4+Fe=FeSO4+Cu.
(3)为模拟古代湿法炼铜的过程,同学们设计了以下的实验方案:
请问:步骤①中,加入过量细铁粉的目的是使硫酸铜全部反应使硫酸铜全部反应,该步骤所得的金属混合物成分是铜和铁铜和铁(填物质名称);步骤②中发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑Fe+H2SO4=FeSO4+H2↑. 等着挖秦陵1年前1
等着挖秦陵1年前1 -
 小菜的yy 共回答了23个问题
小菜的yy 共回答了23个问题 |采纳率87%(1)金属活动顺序表中,铁在氢前,铜在氢后,故答案为;Fe、Cu
(2)在金属活动顺序表中,铁在铜前边,所以铁会把铜从其盐溶液中置换出来,故选CuSO4+Fe=FeSO4+Cu
(3)该实验的流程是:过量的铁粉把硫酸铜中所有的Cu2+都置换出来,得到铁和铜的混合物,然后加入足量的稀硫酸或稀盐酸,把所有的铁粉消耗完,最后经过滤、洗涤、干燥,即可得到纯净的铜.
故答案为:使硫酸铜全部反应;铜和铁;Fe+H2SO4=FeSO4+H2↑或Fe+2HCl=FeCl2+H2↑.1年前查看全部
- 火法炼铜的原理是利用碳还原氧化铜,化学方程式为C+2CuO高温2Cu+CO2↑.对该反应的下列分析中,错误的是
火法炼铜的原理是利用碳还原氧化铜,化学方程式为C+2CuO高温2Cu+CO2↑.对该反应的下列分析中,错误的是
A反应需在高温的条件下进行
B体现C的还原性
C CuO发生了氧化反应
D反应中,元素化合价都发生改变
(多选题,可选一个或两个选项) layol1年前4
layol1年前4 -
 joceci 共回答了14个问题
joceci 共回答了14个问题 |采纳率85.7%A B 正确
C CuO生成Cu,Cu的化合价降低,发生了还原反应.
D O的化合价不变,都是-2
选CD1年前查看全部
- (2012•柳州)某化学兴趣小组根据以下图示进行模拟炼铜的实验,并对产物成分进行探究.
(2012•柳州)某化学兴趣小组根据以下图示进行模拟炼铜的实验,并对产物成分进行探究.
(3)为探究红色粉末C的组成,丁同学做了如下实验:
取洗净、烘干的7.2g红色粉末C,放在纯氧气流中加热,观察到粉末由红色逐渐变为黑色.充分反应,冷却、称量,质量为8.0g.将该黑色粉末放于足量稀硫酸中,黑色粉末全部溶解,得到蓝色溶液.已知(黑色固体CuO)
大家分析、讨论、计算,最后得出红色粉末C的组成元素是
,各元素的质量比为
,红色粉末C的化学式为 dqcren1年前2
dqcren1年前2 -
 tt_dd 共回答了24个问题
tt_dd 共回答了24个问题 |采纳率91.7%设红色物质的成分为Cu、Cu2O,它们的物质的量分别为x mol;y mol.
2Cu+O2=2CuO 固体质量增加
1mol 32
x 32x
2Cu2O+O2=4CuO 固体质量增加
2mol 32
y 16y
得:32x+16y=8.0-7.2=0.8
64x+32y=1.6
解得:x=0;y=0.05mol
所以最后得出的红色粉末C为Cu2O,m(Cu):m(O)=128:16=8:11年前查看全部
- (2014•陕西三模)火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2→Cu2S+2FeS+SO2则下列说法正确的
(2014•陕西三模)火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2→Cu2S+2FeS+SO2则下列说法正确的是( )
A.CuFeS2仅作还原剂,硫元素被氧化
B.每生成1mol Cu2S,有4 mol硫被氧化
C.SO2只是氧化产物,FeS只是还原产物
D.每转移1.2 mol电子,有0.2 mol硫被氧化 mingmei351年前1
mingmei351年前1 -
 qq海角1234 共回答了18个问题
qq海角1234 共回答了18个问题 |采纳率100%解题思路:反应2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,以此解答该题.A.Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,CuFeS2既是氧化剂又是还原剂,故A错误;
B.由方程式可知,每生成1mol Cu2S,有1mol硫被氧化生成SO2,其它物质中的S元素化合价没有发生变化,故B错误;
C.生成FeS,元素化合价没有变化,FeS不是还原产物,也不是氧化产物,故C错误;
D.元素化合价升高的只有S元素,由-2价升高到+4价,变化6价,则每转移1.2mol电子,有0.2mol硫被氧化,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意元素化合价的判断,为解答该题的关键,从元素化合价的角度解答该类题目,难度不大.1年前查看全部
- 关于炼铜硫化铜 氧化铜 硫化亚铜 哪个炼铜好
 地狱火ii1年前1
地狱火ii1年前1 -
 名被用了 共回答了22个问题
名被用了 共回答了22个问题 |采纳率90.9%硫化铜 CuS 分子量64+32=96 铜含量=64/96=66.7%
氧化铜 CuO 分子量64+16=80 铜含量=64/80=80%
硫化亚铜 Cu2S 分子量64X2+32=160 铜含量=64X2/160=80%
使用氧化铜和硫化亚铜炼铜好1年前查看全部
- 有关生物炼铜越多越好,
 川中大侠1年前1
川中大侠1年前1 -
 zhangqianfeng 共回答了13个问题
zhangqianfeng 共回答了13个问题 |采纳率76.9%生物炼铜
矿堆浸铜法是一种已被人们沿用了几百年的生物炼铜法,直到最近,生物工程学家才认识到是微生物在帮助我们从矿石中提取铜.铜矿石中的铜常常与其他元素结合在一起,特别是和硫结合得非常牢固,此外铜矿石中铜的含量往往较低,因而冶炼困难.生物炼铜利用某些具有特殊本领的细菌帮助我们解决这个问题.这些被称为“吃岩石的细菌”能耐受铜盐的毒性,并能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化为可溶性的铜盐,使铜的冶炼变得非常简单.生物炼铜的成本远远低于其他冶炼法,具有污染小、反应条件简单、即使含量(品味)很低的矿石也可以被利用等优点,所以引起了人们极大关注.目前,美国生产的铜中10%是通过这种方法获得的.1年前查看全部
- 在炼铜的过程中发生:Cu 2 S + 2Cu 2 O =" 6Cu" + SO 2 ↑,则下列叙述正确的是 A.该反应从
在炼铜的过程中发生:Cu 2 S + 2Cu 2 O =" 6Cu" + SO 2 ↑,则下列叙述正确的是
A.该反应从电子转移角度看,与SO 2 + 2H 2 S =" 3S" + 2H 2 O是同一反应类型 B.该反应从电子转移角度看,每生成6 mol铜,转移电子12 mol C.该反应中,氧元素氧化了硫元素 D.该反应中,Cu 2 S既是还原剂又是氧化剂  第21天1年前1
第21天1年前1 -
 yansong77 共回答了21个问题
yansong77 共回答了21个问题 |采纳率90.5%D
1年前查看全部
- (2013•河南模拟)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的
(2013•河南模拟)火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的是( )
A.SO2既是氧化产物又是还原产物
B.CuFeS2仅作还原剂,硫元素被氧化
C.每生成1 molCu2S,有4mol硫被氧化
D.每转移1.2 mol电子,有0.1 mol硫被氧化 eleven-l1年前1
eleven-l1年前1 -
 雪河之子 共回答了24个问题
雪河之子 共回答了24个问题 |采纳率75%解题思路:2CuFeS2+O2→Cu2S+2FeS+SO2中,Cu元素的化合价由+2价降低为+1价,O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,以此来解答.A.O元素的化合价由0降低为-2价,S元素的化合价由-2价升高为+4价,则SO2既是氧化产物又是还原产物,故A正确;
B.Cu元素的化合价降低,S元素的化合价升高,则CuFeS2既作还原剂又作还原剂,S元素被氧化,故B错误;
C.由反应可知,生成1 molCu2S,有1mol硫被氧化,故C错误;
D.由反应可知,1molS被氧化转移6mol电子,则每转移1.2 mol电子,有0.2mol硫被氧化,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,注意把握元素的化合价及反应中的变化为解答的关键,侧重基本概念的考查,题目难度不大.1年前查看全部
- 古代湿法炼铜“曾青得铁则化为铜”,写出发生反应的化学方程式:
古代湿法炼铜“曾青得铁则化为铜”,写出发生反应的化学方程式:
该反应的反应类型:
哥哥姐姐帮帮忙 130789146991年前1
130789146991年前1 -
 mbhjk 共回答了21个问题
mbhjk 共回答了21个问题 |采纳率90.5%Fe+CuSO4=Cu+FeSO41年前查看全部
- 修改病句这个炼铜车间,由十天开一炉,变为五天开一炉,时间缩短了一倍。(可拍照 清晰 第一个必采纳)
 richardtcl1年前4
richardtcl1年前4 -
 wmwm1 共回答了8个问题
wmwm1 共回答了8个问题 |采纳率12.5%一倍改为二分之一1年前查看全部
- 请你写出铁与氯化铜`硝酸铜为原料进行湿法炼铜的化学反应方程式
 nanxin1001年前1
nanxin1001年前1 -
 忘却浪漫 共回答了21个问题
忘却浪漫 共回答了21个问题 |采纳率100%Fe+CuCl2=Cu+FeCl2
Fe+Cu(NO3)2=Cu+Fe(NO3)2
要在水溶液中进行,所以叫湿法...
其实比较常用的是下面的反应
Fe+CuSO4=FeSO4+Cu
湿法炼铜目前主要用于处理氧化铜矿.有氧化铜矿直接酸浸和氨浸(或还原焙烧后氨浸)等法;酸浸应用较广,氨浸限于处理含钙镁较高的结合性氧化矿.处理硫化矿多用硫酸化焙烧-浸出或者直接用氨或氯盐溶液浸出等方法.①硫酸化焙烧-浸出法是将精矿中的铜转变为可溶性硫酸铜溶出;②氨液浸出法是将铜转变为铜氨络合物溶出,浸出液在高压釜内用氢还原,制成铜粉,或者用溶剂萃取-电积法制取电铜;氯盐浸出法是将铜转变为铜氯络合物进入溶液,然后进行隔膜电解得电铜.
氧化铜矿酸浸法流程 氧化铜矿一般不易用选矿法富集,多用稀硫酸溶液直接浸出,所得溶液含铜一般为1~5g/L,可用硫化沉淀、中和水解、铁屑置换以及溶剂萃取-电积等方法提取铜.近年来,萃取-电积法发展较快.其主要过程包括:①用对铜有选择性的肟类螯合萃取剂(LiX-64 N,N-510,N-530等)的煤油溶液萃取铜,铜进入有机相而与铁、锌等杂质分离.②用浓度较高的H2SO4溶液反萃铜,得到含铜约50g/L的溶液.反萃后的有机溶剂,经洗涤后,返回萃取过程使用.③电积硫酸铜溶液得电铜,电解后液返回用作反萃剂.1年前查看全部
- 古代湿法炼铜中的硫酸铜是怎么来的?
古代湿法炼铜中的硫酸铜是怎么来的?
有天然的硫酸铜矿物吗? TMMTTT1年前1
TMMTTT1年前1 -
 pkwen 共回答了18个问题
pkwen 共回答了18个问题 |采纳率94.4%有,天然硫酸铜叫胆矾,还是一味中药,多与铜矿拌生1年前查看全部
- 炼铜的铜水温度多高我想问下,炼铜炉中的铜水温度大概有多高?请专家指点一二。
 lanzibaobao1年前1
lanzibaobao1年前1 -
 llol 共回答了19个问题
llol 共回答了19个问题 |采纳率94.7%铜的熔点为1084摄氏度.1年前查看全部
- 公元前1200年的炼铜方法是什么
 hotwin951年前1
hotwin951年前1 -
 晓苇 共回答了11个问题
晓苇 共回答了11个问题 |采纳率81.8%湿法炼铜,即 Fe+CuSO4=Cu+FeSO4(置换反应)1年前查看全部
- 古代湿法炼铜的化学原理
 dadadejibadada1年前5
dadadejibadada1年前5 -
 zxb61573928 共回答了15个问题
zxb61573928 共回答了15个问题 |采纳率100%反应的方程式是:Fe+CuSO4=Cu+FeSO4
利用的是铁比铜的金属活泼性强的原理.
另外,给你一部分金属活泼顺序表参考一下:
钾 钙 钠 镁 铝 锌 铁 锡 铅(H)铜 汞 银 铂 金
其中,在氢前面的金属能与酸反应生成氢气,从左到右,金属活泼性较强的金属能从排在它后面的金属所形成的溶液中把该金属置换出来(也就是金属活泼性较强的金属能置换出相对它来说金属活泼性教弱的金属.)1年前查看全部
- 火法炼铜的氧化剂是什么都分别是氧化剂和还原剂
 快乐男孩781年前2
快乐男孩781年前2 -
 neogao 共回答了22个问题
neogao 共回答了22个问题 |采纳率95.5%火法炼铜是用Cu2S和氧气,反映得到Cu和SO2
氧气是氧化剂这不用多说.铜原来是+1价,降到0价,也是氧化剂.
Cu2S既是氧化剂也是还原剂,氧气是氧化剂1年前查看全部
- 火法炼铜和湿法炼铜分别指什么
 meet20021年前1
meet20021年前1 -
 zhongchengsa 共回答了26个问题
zhongchengsa 共回答了26个问题 |采纳率84.6%火法炼铜是利用还原性物质如一氧化碳在高温下还原氧化铜,湿法炼铜是用铁放入硫酸铜溶液炼得铜1年前查看全部
- 我们的祖先很早就掌握了炼铜的工艺,他们将孔雀石,主要成分Cu2(OH)2CO3和木炭一起加热就可得到红色的金属铜.请你写
我们的祖先很早就掌握了炼铜的工艺,他们将孔雀石,主要成分Cu2(OH)2CO3和木炭一起加热就可得到红色的金属铜.请你写出化学反应原理.提示:孔雀石受热易分解,得到氧化铜、二氧化碳和水,加热时,用木炭作还原剂就能把氧化铜中的铜还原出来.
 见谁抽谁1年前2
见谁抽谁1年前2 -
 232345 共回答了15个问题
232345 共回答了15个问题 |采纳率93.3%解题思路:充分运用提示的信息,分析出反应物生成物和反应条件,从而写出正确的化学方程式.由提示知:孔雀石加热时分解,生成氧化铜、二氧化碳和水,故方程式为:Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;加热时,用木炭作还原剂把氧化铜中的铜还原出来,根据反应物的组成,还应生成二氧化碳,但条件应是加热,故方程式为:C+2CuO
高温
.
2Cu+CO2↑.
故选Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑;C+2CuO
高温
.
2Cu+CO2↑.点评:
本题考点: 探究金属铜的冶炼原理;金属的化学性质;碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 解题时要充分利用信息,不能对不熟悉的反应无所适从,同时掌握基础知识,提高知识的衍生能力.1年前查看全部
- 火法炼铜过程中发生如下反应:Cu2S+O2=2Cu+SO2.若已知反应消耗3mol Cu2S,则被O2氧化的硫(S)的物
火法炼铜过程中发生如下反应:Cu2S+O2=2Cu+SO2.若已知反应消耗3mol Cu2S,则被O2氧化的硫(S)的物质的量为多少?
S不是由-2价变成了+4价么,那1mol S转移的电子数不是6mol 么..被O2氧化的怎么算啊? 闲雅居1年前6
闲雅居1年前6 -
 卡妙ACMUS 共回答了21个问题
卡妙ACMUS 共回答了21个问题 |采纳率95.2%这里Cu2S 中 cu为正一价 反应后 变成了 cu 0价
根据方程式 来看 氧化剂有 氧气和cu+1 而 还原剂就只有s2- 所以3摩尔s2- ====== s+4 共转移了18mol 电子 还有6mol cu+1得到了 6mol 电子 可以算得 那么还有18-6=12mol的电子 是被氧气得到的 那么 被氧气氧化的硫(s)就是12/6=2mol了1年前查看全部
- 火法炼铜和湿法炼铜的优缺点Cu2S+O2==2Cu+So2 这是火法的 反应条件是高温Fe+CuSO4==FeSO4+C
火法炼铜和湿法炼铜的优缺点
Cu2S+O2==2Cu+So2 这是火法的 反应条件是高温
Fe+CuSO4==FeSO4+Cu 这是湿法的 没有反应条件
它们的优缺点是什么?
你们两个...结论都相反的...... yuanliju1年前2
yuanliju1年前2 -
 西安流浪猫 共回答了16个问题
西安流浪猫 共回答了16个问题 |采纳率81.3%火法炼铜排出来的二氧化硫污染空气,并且能耗太大,并且容易使Cu和氧气反应生成氧化铜.湿法炼铜反应条件简单,但是Fe比Cu活泼,大自然中不存在单质铁,因此获得铁也是件麻烦的事,综合起来能耗比火法要大些1年前查看全部
- 化学与工农业生产和人类生活密切相关。下列说法中正确的是 A.铜矿石在细菌作用下可直接转化为单质铜,这个过程叫生物炼铜 B
化学与工农业生产和人类生活密切相关。下列说法中正确的是
A.铜矿石在细菌作用下可直接转化为单质铜,这个过程叫生物炼铜 B.用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体 C.海轮外壳上镶入锌块,可减缓船体的腐蚀,该方法叫牺牲阳极的阴极保护法 D.酸雨就是pH <7的雨水,主要是由大气中的SO 2 、NO 2 等造成的  adidass1年前1
adidass1年前1 -
 ccyy7923 共回答了20个问题
ccyy7923 共回答了20个问题 |采纳率90%C
A.生物炼铜利用某些具有特殊本领的细菌帮助我们解决这个问题。这些被称为“吃岩石的细菌”能耐受铜盐的毒性,并能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化为可溶性的铜盐,使铜的冶炼变得非常简单。铜矿石在细菌作用下可直接转化为单质铜这种说法错误;
B.用纯碱制玻璃、用铁矿石炼铁、都会产生温室气体CO 2 ,用氨制碳酸铵,是氨吸收CO 2 ,不产生温室气体,B错误;
C.海轮外壳上镶入锌块,可减缓船体的腐蚀,该方法叫牺牲阳极的阴极保护法。正确;
D.酸雨就是pH <5.6的雨水,主要是由大气中的SO 2 、NO 2 等造成的,通常由于雨水中溶解了CO 2 ,都显酸性pH <7,所以并不是所有pH <7的都是酸雨。D错误。1年前查看全部
大家在问
- 1三个数成等比数列,a1+a2=2,a2+a3=6,则公比为___
- 21到100的奇数 偶数 质数 合数
- 3求两道数学题!速度!1.抛物线y^2=2px(p>0)上有一点,其纵坐标为-4√2,该点到准线的距离为6,求此抛物线的标
- 4甲、乙两人从A地到B地,丙从B地到A地.他们同时出发,甲骑车每小时行8千米,丙骑车每小时行10千米,甲丙两人经过5小时相
- 5甲、乙两人从A地到B地,丙从B地到A地.他们同时出发,甲骑车每小时行8千米,丙骑车每小时行10千米,甲丙两人经过5小时相
- 6春节里,远在北京一家的姑姑回来了,“( )”,我们欢天喜地地接待了他们,还精心设了盛宴款待他们.
- 7无价 拟一个作文题目特殊一点
- 8青山不老有哪些多音字?5个要5个多音字加组词
- 9已知抛物线y=ax方+bx+c的顶点为(1,8),且该抛物线过点(2,b)求此解析式
- 10和子字型相近的字念什么求大神帮助
- 11左右两个山字组合的字怎么读?
- 12空气的密度为1.29千克每立方米,初三学生正常呼气一次,估计吸入肺内的空气质量最接近于
- 13地球表面平均1平方厘米上的空气质量约为1千克,地球表面积大约是5×10的8次方平方千米.地球表面全部空气质量约为多少千克
- 14你所在教室的空气质量是(已知空气密度为1.29千克每立方米)( )A几十克B几千克C几百千克D几十毫克
- 15比喻含混笼统地接受,不加以分析辨别,不求甚解.是什么成语?

