在 X+2O2═CO2+2H2O的反应中,根据质量守恒定律可判断出X的化学式为( )
 轩辕豆豆2022-10-04 11:39:541条回答
轩辕豆豆2022-10-04 11:39:541条回答A.C
B.CO
C.CH4
D.C2H5OH

已提交,审核后显示!提交回复
共1条回复
 669dd8 共回答了14个问题
669dd8 共回答了14个问题 |采纳率85.7%- 解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.
根据反应的化学方程式X+2O2═CO2+2H2O,反应物中氧原子个数分别为4,反应后的生成物中碳、氧、氢原子个数分别为1、4、4,根据反应前后原子种类、数目不变,则每个X分子由1个碳原子和4个氢原子构成,则物质X的化学式为CH4.
故选:C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键. - 1年前
相关推荐
- +2O2 点燃 CO2+2H2O是置换反应吗?
 lanhui831年前8
lanhui831年前8 -
 lero8410 共回答了13个问题
lero8410 共回答了13个问题 |采纳率92.3%不是置换反应
置换反应是单质与化合物反应生成另外的单质和化合物的化学反应
Cl2+2HBr=HCl+Br2 (置换反应)
它生成物里没有单质,所以不是置换反应
是氧化还原反应1年前查看全部
- 天然气、液化石油气(主要成分是C3~C6的烷烃)燃烧的化学方程式分别为:CH4+2O2→CO2+2H2O;C3H8+5O
天然气、液化石油气(主要成分是C3~C6的烷烃)燃烧的化学方程式分别为:CH4+2O2→CO2+2H2O;C3H8+5O2→3CO2+4H2O.现有一套以天然气为燃料的炊具,欲改燃烧液化石油气,应采取的正确措施是( )
A. 两种气体的进入量都减少
B. 增大空气进入量或减少液化气的进入量
C. 两种气体的进入量都增大
D. 减少空气进入量或增大液化气的进入量 齐春虎1年前1
齐春虎1年前1 -
 xinqiu99 共回答了16个问题
xinqiu99 共回答了16个问题 |采纳率100%解题思路:可燃物完全燃烧的条件是要有充足的氧气,则在改造过程中要保证氧气必须充足.促进可燃物燃烧的方法有:(1)增大氧气的浓度;(2)增大可燃物与氧气的接触面积.
由化学方程式可知,天然气燃烧时,甲烷与氧气的物质的量之比为1:2,液化石油气燃烧时,丙烷与氧气的物质的量之比为1:5,
所以同体积的两种燃气,液化石油气耗氧量多,把天然气为燃料的灶具改用液化石油气为燃料时,需要加大空气气的量,减少液化石油气的进入量.
故选B.点评:
本题考点: 烷烃及其命名.
考点点评: 本题主要考查了运用化学知识解决实际问题,关键在于明确保证可燃物燃烧时氧气充足.1年前查看全部
- CH4+2O2→CO2+2H2O能够设计成原电池的原因
 jj9921341年前2
jj9921341年前2 -
 寒佛 共回答了11个问题
寒佛 共回答了11个问题 |采纳率100%因为这是氧化还原反应,反应中有电子的转移,可以设计为原电池,负极为CH4失去电子,正极为O2得到电子,电解质溶液可以是OH-离子也可以是H+离子.1年前查看全部
- 为什么CH4+2O2===点燃====CO2+2H2O不是取代反应?
为什么CH4+2O2===点燃====CO2+2H2O不是取代反应?
哪点不符合了? yi_eee1年前3
yi_eee1年前3 -
 莫睦邻 共回答了20个问题
莫睦邻 共回答了20个问题 |采纳率95%取代反应是指有机化合物受到某类试剂的进攻,致使分子中一个基(或原子)被这个试剂所取代的反应.
这个反应是将有机物变成无机物的反应,不属于取代反应.1年前查看全部
- 现有如下两个反应:A、2NaOH+H2SO4═Na2SO4+2H2OB、CH4+2O2═CO2+2H2O(1)根据反应的
现有如下两个反应:
A、2NaOH+H2SO4═Na2SO4+2H2O
B、CH4+2O2═CO2+2H2O
(1)根据反应的本质,两个反应都为______反应(放热或吸热),判断两个反应能否设计为原电池?(能或不能)
A______B______
(2)如果不能,说明其理由______
(3)如果能,最好应选择______电解质溶液(NaOH或H2SO4).则负极电极反应式:______正极电极反应式:______. catch--221年前1
catch--221年前1 -
 rr小朱 共回答了17个问题
rr小朱 共回答了17个问题 |采纳率76.5%解题思路:(1)中和反应、物质的燃烧反应是放热反应,自发的氧化还原反应能设计成原电池;
(2)自发的氧化还原反应能设计成原电池;
(3)燃料电池的放电规律:负极是燃料失电子的过程,正极是氧气得电子的过程来回答.(1)中和反应、物质的燃烧反应均是放热反应,A不是自发的氧化还原反应不能设计成原电池,B是自发的氧化还原反应能设计成原电池,故答案为:放热;不能;能;
(2)A的反应为复分解反应,属于非氧化还原反应,无电子转移,只有自发的氧化还原反应能设计成原电池,故答案为:A的反应为非氧化还原反应,无电子转移;
(3)甲烷燃料电池中,负极是甲烷燃料失电子的过程,正极是氧气得电子的过程,电极反应分别为:负极 CH4-8e-+10 OH-═CO32-+7H2O,正极 2O2+8e-+4H2O═8 OH-,为了保证放电的充分进行,可以选择碱来作电解质溶液,故答案为:NaOH;CH4-8e-+10OH-═CO32-+7H2O;2O2+8e-+4H2O═8OH-.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生原电池的工作原理知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 据2CO+O2=2CO2,2H2+O2=2H2O,CH4+2O2-CO2+2H2O可知燃烧相同体积的管道煤气和天然气消耗
据2CO+O2=2CO2,2H2+O2=2H2O,CH4+2O2-CO2+2H2O可知燃烧相同体积的管道煤气和天然气消耗空气体积较大的是_
我知道应该是天然气消耗较大,但是为什么呢? bleupinus1年前3
bleupinus1年前3 -
 cheern5730 共回答了14个问题
cheern5730 共回答了14个问题 |采纳率71.4%管道煤气主要是氢气和一氧化碳,天然气主要成分为甲烷.你如果是高中学生,就知道参加反应的气体体积之比等于参加反应气体的物质的量之比,等于化学方程式中化学计量数之比,氢气和一氧化碳都是一体积消耗氧气0.5体积,甲烷是一体积消耗2体积氧气,所以天然气消耗较大1年前查看全部
- 某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2═2CO2+2H2O,试推出X的化学式( )
某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2═2CO2+2H2O,试推出X的化学式( )
A. C2H4
B. CH2
C. CH2O
D. C2H2 hfblackcat1年前3
hfblackcat1年前3 -
 benny_post 共回答了15个问题
benny_post 共回答了15个问题 |采纳率86.7%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.根据反应的化学方程式X+3O2
点燃
2CO2+2H2O,反应物中氧原子个数为6,反应后的生成物中碳、氢、氧原子个数分别为2、4、6,根据反应前后原子种类、数目不变,则每个X分子由2个碳原子和4个氢原子构成,则物质X的化学式为C2H4.
故选A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- 某纯净物X在空气中完全燃烧,反应的化学方程式为X+2O2 点燃 . CO2+2H2O,则X
某纯净物X在空气中完全燃烧,反应的化学方程式为X+2O2
CO2+2H2O,则X的化学式为( )点燃 .
A. CO
B. C2H4
C. CH4
D. CH4O sky3111年前1
sky3111年前1 -
 清风茶坊 共回答了14个问题
清风茶坊 共回答了14个问题 |采纳率100%解题思路:在化学反应中遵循质量守恒定律,即反应前后元素的种类不变,原子的种类、个数不变.由X+2O2
点燃
.
CO2+2H2O可知,左边4个氧原子;右边4个氧原子,1个碳原子,4个氢原子;根据元素守恒,两边的原子种类和个数应该相等,所以左边还差了1个C和4个H,那么X的化学式就是CH4.
故选:C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 在化学反应中遵循质量守恒定律,参加反应的物质的质量总和等于反应后生成的物质的质量总和.1年前查看全部
- X+3O2=点燃=2CO2+2H2O.
X+3O2=点燃=2CO2+2H2O.
求出来X是由4个氢原子和两个碳原子构成的,是H4C2,需不需要化成2H2C这样子?为什么? 沈先生1年前5
沈先生1年前5 -
 zgzjhm 共回答了20个问题
zgzjhm 共回答了20个问题 |采纳率80%根据方程式两边的元素种类和原子个数守恒 生成物中C元素的数量:2*1=2 O元素的数量:2*2+2*1=6 H元素的数量:2*2=4 所以x中的原子数量为:C:2/1=2 H:4/1=4 O:(6-3*2)/1=0 所以x的分子式为C2H4 至于不能写成2C4H?或者H4C2...1年前查看全部
- 2CH3CH2OH+O2→2CH3CHO+2H2O和CH4+2O2→CO2+2H2O那个是取代反应
2CH3CH2OH+O2→2CH3CHO+2H2O和CH4+2O2→CO2+2H2O那个是取代反应
请想好了再答 jellian1年前5
jellian1年前5 -
 yangyun300 共回答了17个问题
yangyun300 共回答了17个问题 |采纳率88.2%都不是取代反应
取代反应是官能团或离子的代替,不会有键的变化
第一个很明显是氧化反应本来O的单键变为了双键
第二个也是氧化反应,本来C是单键的,后来也有了双键1年前查看全部
- X+O2点燃CO2+2H2O 求X是什么
 llfgxx19881年前4
llfgxx19881年前4 -
 可怜没人疼 共回答了18个问题
可怜没人疼 共回答了18个问题 |采纳率88.9%名称:甲二醇
分子式:CH4O2
结构式:H
I
HO---C---OH
I
H
常温下是一种无色无味气体,密度比空气略大,能溶于水,溶于水后生成酸性物质.1年前查看全部
- 天然气、液化石油气燃烧的化学方程式分别为:CH4+O2→CO2+2H2O;C3H8+5O2→3CO2+4H2O.现有一套
天然气、液化石油气燃烧的化学方程式分别为:CH4+O2→CO2+2H2O;C3H8+5O2→3CO2+4H2O.现有一套以液化石油气为燃料的灶具,要改为以天然气为燃料的灶具,应采取的措施是( )
A.减气空气进入量或增大天然气的进入量
B.增大空气进入量或减小天然气的进入量
C.减小空气进入量,同时减小天然气的进入量
D.增大空气进入量,同时增大天然气的进入量 不羁乖乖仔1年前1
不羁乖乖仔1年前1 -
 chenxin1982 共回答了11个问题
chenxin1982 共回答了11个问题 |采纳率100%解题思路:根据已知的反应方程式,来分析相同体积的液化石油气、天然气消耗的氧气的多少,消耗氧气多时需要增大空气的进入量,消耗氧气少的则应减小空气的进入量.由天然气的主要成分为CH4,液化石油气的主要成分为C3H8,燃烧的化学方程式为CH4+2O2→CO2+2H2O;C3H8+5O2→3CO2+4H2O.显然相同体积的C3H8、CH4,C3H8消耗的氧气多,
则液化石油气为燃料的灶具,欲改为燃烧天然气,
需要减小空气的进入量或增大天然气进量,
故选A.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查学生利用已知信息来分析解答问题,明确相同体积的气体消耗的氧气的量的多少是解答的关键,注重利用化学知识来处理生活中的常见问题.1年前查看全部
- 在空气中燃烧形成水和二氧化碳X+3O2=2CO2+2H2O求X的化学式
 想学学lou1年前2
想学学lou1年前2 -
 哈比塞拉 共回答了12个问题
哈比塞拉 共回答了12个问题 |采纳率83.3%C2H4 乙烯 根据原子守恒 等式左右原子数相等1年前查看全部
- (2009•白下区二模)天然气、液化石油气燃烧的化学方程式分别为:CH4+2O2═CO2+2H2O;C3H8+5O2═3
(2009•白下区二模)天然气、液化石油气燃烧的化学方程式分别为:CH4+2O2═CO2+2H2O;C3H8+5O2═3CO2+4H2O.现有一套以天然气为燃料的灶具,要改为以液化石油气为燃料的灶具,应采取的措施是( )
A.燃料气和空气的进入量都减少
B.燃料气和空气的进入量都增大
C.减少燃料气进入量或增大空气进入量
D.增大燃料气进入量或减少空气进入量 aiilion1年前1
aiilion1年前1 -
 lanxi1230 共回答了17个问题
lanxi1230 共回答了17个问题 |采纳率94.1%解题思路:根据天然气、液化石油气燃烧的化学方程式,1分子的天然气燃烧需要2分子氧气,而1分子液化石油气燃烧需要5分子氧气,由此可得知相同体积的液化石油气完全燃烧需要消耗氧气的体积大于相同体积的天然气,从而判断改为液化石油气时为保证气体完全燃烧对灶具所需要做的改动.相同情况下,气体体积相同所含分子数相同;根据反应的化学方程式,相同分子即同体积的天然气、液化石油气完全燃烧,液化石油气需要更多的氧气;为确保液化石油气完全燃烧所需要的氧气量充分,需要把以天然气为燃料的灶具的燃料进气量减少或增大空气进入量;
故选:C.点评:
本题考点: 完全燃烧与不完全燃烧;根据化学反应方程式的计算.
考点点评: 化学方程式可以表示参加反应的各物质的微粒间个数关系,即化学方程式中各物质前的化学计量数.1年前查看全部
- CxHyOz+2O2——CO2+2H2O
CxHyOz+2O2——CO2+2H2O
要详细解法.在线等,谢谢了,大虾们 妖阳1年前6
妖阳1年前6 -
 scautsao 共回答了23个问题
scautsao 共回答了23个问题 |采纳率95.7%右边1C、4H、4O,减去左边4O
剩下CH4
X=1,Y=4,Z=01年前查看全部
- 某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2 点燃 . 2CO2+2H2O,
某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2
2CO2+2H2O,试推出X的化学式______.点燃 . vian08231年前3
vian08231年前3 -
 candy0302 共回答了15个问题
candy0302 共回答了15个问题 |采纳率93.3%解题思路:化学反应前后,元素的种类不变,原子的种类、总个数不变.由X+3O2=2CO2+2H2O可知,反应后碳原子是2个,反应前应该是2个,包含在X中;
反应后氧原子是6个,反应前是6个;
反应后氢原子是4个,反应前应该是4个,包含在X中;
由分析可知,每个X中含有2个碳原子和4个氢原子,是乙烯,乙烯的化学式是C2H4.
故填:C2H4.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.1年前查看全部
- 化学方程式CH4+2O2 点燃 . CO2+2H2O的读法正确的是( )
化学方程式CH4+2O2
CO2+2H2O的读法正确的是( )点燃 .
A.甲烷加氧气等于二氧化碳和水
B.每16份质量的甲烷跟64份质量的氧气反应,生成44份质量的二氧化碳和18份质量的水
C.甲烷和氧气在点燃的条件下反应生成二氧化碳和水
D.一个甲烷分子和氧分子点燃生成二氧化碳分子和水分子 bjmedia1年前1
bjmedia1年前1 -
 zhanglz126 共回答了15个问题
zhanglz126 共回答了15个问题 |采纳率100%解题思路:化学方程式的含义有:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等.但要注意读化学方程式时,“+”应读作“和”,“═”应读作“生成”.A、“+”不能读作“加”、“═”不能读作“等于”,故选项错误;
B、从物质质量的变化来读,该反应是每16份质量的甲烷和64份质量的氧气在点燃条件下生成44份质量的二氧化碳和36份质量的水,故选项错误;
C、化学方程式CH4+2O2
点燃
.
CO2+2H2O的读法是甲烷和氧气在点燃的条件下反应生成二氧化碳和水,故C正确;
D、微观上应读作:每一个甲烷分子和2个氧分子点燃生成一个二氧化碳分子和2个水分子,故D错误.
故选C.点评:
本题考点: 化学方程式的概念、读法和含义.
考点点评: 本题难度不大,充分理解化学方程式表示的含义是解题的关键.1年前查看全部
- 已知化学方程式:R+2O2 点燃 . CO2+2H2O,则关于R的组成,叙述正确的是(
已知化学方程式:R+2O2
CO2+2H2O,则关于R的组成,叙述正确的是( )点燃 .
A. 只含碳元素
B. 一定含有碳、氢、氧元素
C. 只含碳、氢元素
D. 一定含碳、氢元素,可能含氧元素 xx美眉1年前4
xx美眉1年前4 -
 鬼叫飞跑 共回答了15个问题
鬼叫飞跑 共回答了15个问题 |采纳率86.7%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物R的化学式,进行分析解答即可.根据反应的化学方程式R+2O2
点燃
.
CO2+2H2O,反应物中氧原子个数为4,反应后的生成物中碳、氢、氧原子个数分别为1、4、4,根据反应前后原子种类、数目不变,则每个R分子由1个碳原子、4个氢原子构成,则物质R的化学式为CH4.
A、物质R的化学式为CH4,R中一定含有碳元素和氢元素,故选项错误.
B、物质R的化学式为CH4,R中一定含有碳元素和氢元素,不含氧元素,故选项错误.
C、物质R的化学式为CH4,R中一定含有碳元素和氢元素,故选项正确.
D、物质R的化学式为CH4,R中一定含有碳元素和氢元素,不含氧元素,故选项错误.
故选:C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,掌握质量守恒定律(反应前后,元素种类不变)并能灵活运用是正确解答本题的关键.1年前查看全部
- 某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2═2CO2+2H2O,试推出X的化学式( )
某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2═2CO2+2H2O,试推出X的化学式( )
A.C2H4
B.CH2
C.CH2O
D.C2H2 柯一梦1年前1
柯一梦1年前1 -
 mengyeak 共回答了12个问题
mengyeak 共回答了12个问题 |采纳率58.3%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.根据反应的化学方程式X+3O2
点燃
2CO2+2H2O,反应物中氧原子个数为6,反应后的生成物中碳、氢、氧原子个数分别为2、4、6,根据反应前后原子种类、数目不变,则每个X分子由2个碳原子和4个氢原子构成,则物质X的化学式为C2H4.
故选A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- 某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2═2CO2+2H2O,试推出X的化学式( )
某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2═2CO2+2H2O,试推出X的化学式( )
A. C2H4
B. CH2
C. CH2O
D. C2H2 茗聆夜1年前3
茗聆夜1年前3 -
 wfmxh 共回答了10个问题
wfmxh 共回答了10个问题 |采纳率100%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.根据反应的化学方程式X+3O2
点燃
2CO2+2H2O,反应物中氧原子个数为6,反应后的生成物中碳、氢、氧原子个数分别为2、4、6,根据反应前后原子种类、数目不变,则每个X分子由2个碳原子和4个氢原子构成,则物质X的化学式为C2H4.
故选A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- 天然气、液化石油气(主要成分C3H8)燃烧的化学方程式分别为:CH4+2O2=(点燃)CO2+2H2O;C3H8+5O2
天然气、液化石油气(主要成分C3H8)燃烧的化学方程式分别为:CH4+2O2=(点燃)CO2+2H2O;C3H8+5O2=(点燃)3CO2+4H2O.现有一套以天然气为燃料的灶具,要改为以液化石油气为燃料的灶具应采取的措施是( )
A 燃料气和空气的进入量都减少
B 燃料气和空气的进入量都增加
C 减少燃料气进入量或增大空气进入量
D 增大燃料气进入量或减少空气进入量
为什么是选D呢?能不能解释一下 weiqichen1231年前3
weiqichen1231年前3 -
 344129761 共回答了19个问题
344129761 共回答了19个问题 |采纳率94.7%气体体积与其物质的量成正比,在化学方程式中就是与其化学计量数成正比.改用C3H8之后每1体积的燃料所需的氧气的体积为5体积,而原来只需要2体积,由此可以看出单位燃料的所需氧气的体积增加,所以应该是增大空气进入量.我感觉应该是选C1年前查看全部
- 元素守恒是什么意思CH4+2O2--CO2+2H2O反应中有混合气体CO2和CO,已知CH4的摩尔质量为0。7,为什么C
元素守恒是什么意思
CH4+2O2--CO2+2H2O反应中有混合气体CO2和CO,已知CH4的摩尔质量为0。7,为什么CO和CO2摩尔质量和为0。7? 单薄的aa1年前5
单薄的aa1年前5 -
 neimenggua 共回答了17个问题
neimenggua 共回答了17个问题 |采纳率88.2%化学反应之前和之后,元素的种类都没有变化.
无论怎么样都不能少了或者多出来了.
和质量守恒差不多吧,就是把质量换成元素的种类.1年前查看全部
- 用双桥线法表示氧化还原反应中电子的转移. 1.H2+CuO=Cu+H2O 2.CH4+2O2=CO2+2H2O
用双桥线法表示氧化还原反应中电子的转移. 1.H2+CuO=Cu+H2O 2.CH4+2O2=CO2+2H2O
3.2Na+Cl2=2NaCl
其实其他都需要,我需要的是注得失这步骤.写明得到或失去多少的电子,最好有解释,我就是不知道变价原子个数是怎么求的. qwerasd121年前1
qwerasd121年前1 -
 yefenglulu 共回答了15个问题
yefenglulu 共回答了15个问题 |采纳率86.7%今天不知道怎么发不了图,直接给你写吧,希望能对你有所帮助
H2+CuO=Cu+H2O H2到H2O,H升高1价,氢气中H是0价的,水中H是+1价的;CuO到Cu,Cu降低2价,氧化铜中Cu是+2价,铜中Cu是0价的
CH4+2O2=CO2+2H2O,CH4到CO2,C升高8价,甲烷中C是-4价的,二氧化碳中C是+4价的;O2到H2O和CO2,O降低2价,氧气中O是0价,水和二氧化碳中O是-2价的
2Na+Cl2=2NaCl,Na到NaCl,Na升高1价,钠中Na是0价,氯化钠中Na是+1价;Cl2到NaCl,Cl降低1价,氯气中Cl是0价,氯化钠中Cl是-1价的1年前查看全部
- 在X+2O2 点燃 . CO2+2H2O中,根据质量守恒定律,X的化学式为( )
在X+2O2
CO2+2H2O中,根据质量守恒定律,X的化学式为( )点燃 .
A. CH4
B. C2H5OH
C. CH3OH
D. CH3COOH cshbfly1年前7
cshbfly1年前7 -
 ouyangxin520 共回答了14个问题
ouyangxin520 共回答了14个问题 |采纳率85.7%解题思路:此题根据质量守恒定律,反应前后原子种类和个数都不变,分别统计出反应前后原子种类及个数,比较分析就可以求出所求物质的化学式.根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知生成物中含有的原子种类及原子个数为C,1;H,4;O,4;已知反应物中含有的原子种类及原子个数为O,4;比较分析可知X中含有C和H元素,其原子个数分别为1和4,故X的化学式为CH4.
故选:A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 此题主要考查学生对质量守恒定律的实际运用,只有掌握了这一知识的内涵,才能自由驾御,正确解答.1年前查看全部
- (2011•南通)已知反应x+3O2 点燃 . 2CO2+2H2Ox,则X的化学式为(
(2011•南通)已知反应x+3O2
2CO2+2H2Ox,则X的化学式为( )点燃 .
A.C2H6
B.C2H4
C.C2H2
D.C2H60 bhmona1年前1
bhmona1年前1 -
 juanzi831220 共回答了27个问题
juanzi831220 共回答了27个问题 |采纳率92.6%解题思路:根据反应X+3O2
2CO2+2H2O,利用质量守恒定律来推断X的化学式.点燃 .在反应X+3O2
点燃
.
2CO2+2H2O中,
该反应遵循质量守恒定律,则反应前后元素的种类、原子个数不变,
O原子个数在反应前后都是6,没有变化,
在反应后有C、H两种元素,则X中含有C、H两种元素,
反应后共2个C原子、4个H原子,则X中含有2个C原子、4个H原子,
又X的化学计量数为1,
则X的化学式为C2H4,
故选B.点评:
本题考点: 有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题考查学生利用化学方程式和质量守恒定律来推断物质的化学式,学生应学会利用元素守恒、原子守恒的方法来解答.1年前查看全部
- 乙烯燃烧的化学方程式c2h4+3o2=点燃=2co2+2h2o有哪些含义?
乙烯燃烧的化学方程式c2h4+3o2=点燃=2co2+2h2o有哪些含义?
分三点宏观,微观,质量
(质量守恒定律,化学方程式的意义和读法)
我在刷新苦等之中啊! contrawu1年前1
contrawu1年前1 -
 kun223 共回答了25个问题
kun223 共回答了25个问题 |采纳率92%化学反应的实质:在化学反应过程中分子被破坏成原子,而原子又重新组成新的分子,简单的说就是原子的重新组合过程.
微观角度:在化学反应前后原子的种类、原子个数、原子质量没有变化;反应式表示反应物和产物之间的粒子个数比(即微观意义和微观读法).
因此答案是,在微观上,一个分子乙烯与3个分子氧气充分燃烧生成2个分子二氧化碳和2个分子水.
宏观角度:在化学反应前后元素的种类、质量没有变化或者说参加化学的各物质的质量总和等于反应生成的各物质的质量总和.也就是表示反应物和产物之间的质量比(即质量读法).
因此答案是,28份质量的乙烯与96份质量的氧燃烧得到88份质量的二氧化碳和36份质量的水.
化学反应就是有新物质生成.表示反应物、产物和反应条件(即宏观意义和宏观读法).
因此答案是,乙烯在氧气中燃烧生成二氧化碳和水.
以上三部分答案综合在一起就是你要的答案.1年前查看全部
- (2013•安徽模拟)据报道,光合作用能够借助太阳能用CO2和H2制备RCH其反应原理如下:2CO2+2H2O
(2013•安徽模拟)据报道,光合作用能够借助太阳能用CO2和H2制备RCH其反应原理如下:2CO2+2H2O
2HCOOH+O2,下列说法正确的是( )光照 .
A.HCOOH分子中既有极性键,又有非极性键
B.反应中,CO2被氧化,O2是还原产物
C.反应中,每转移4×6.02×1023个电子,生成2.24L气体
D.该过程是将太阳能转化为化学能的过程 ouyang4221年前1
ouyang4221年前1 -
 糖糖81 共回答了24个问题
糖糖81 共回答了24个问题 |采纳率91.7%解题思路:2CO2+2H2O
2HCOOH+O2中,O元素的化合价升高,C元素的化合价降低,该过程利用太阳能转化为化学能,以此来解答.光照 .A.HCOOH分子中只有极性键,不存在非极性键,-COOH中不含O-O键,故A错误;
B.O元素的化合价升高,C元素的化合价降低,则反应中,CO2被还原,O2是氧化产物,故B错误;
C.反应中,每转移4×6.02×1023个电子,生成1mol气体,但状况未知,体积不能确定,故C错误;
D.由反应条件为光照可知,该过程利用太阳能转化为化学能,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,选项C为易错点,题目难度不大.1年前查看全部
- 现有如下两个反应:Ⅰ.A.2NaOH+H2SO4═Na2SO4+2H2OB.CH4+2O2═CO2+2H2O(1)根据反
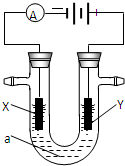 现有如下两个反应:
现有如下两个反应:
Ⅰ.A.2NaOH+H2SO4═Na2SO4+2H2OB.CH4+2O2═CO2+2H2O
(1)根据反应的本质,两个反应都为______反应(放热或吸热),判断两个反应能否设计为原电池?(能或不能)A______B______
(2)如果不能,说明其理由______
(3)如果能,最好应选择______电解质溶液(NaOH或H2SO4).则负极电极反应式:______正极电极反应式:______.
Ⅱ.电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中X极上的电极反应式为______,在X极附近观察到的实验现象是______.
②Y电极上的电极反应式为______.
检验该电极反应产物的方法是______.
③电解总反应化学方程式2NaCl+2H2O
2NaOH+H2↑+Cl2↑电解 .2NaCl+2H2O.
2NaOH+H2↑+Cl2↑电解 .
(2)若X、Y都是惰性电极,a是CuSO4溶液,电解的总反应方程式2CuSO4+2H2O
2Cu+O2↑+2H2SO4电解 .2CuSO4+2H2O.
2Cu+O2↑+2H2SO4电解 .
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是______,电极反应式为______.
②Y电极的材料是______,电极反应式为______. renlifeng1年前1
renlifeng1年前1 -
 changri5555 共回答了20个问题
changri5555 共回答了20个问题 |采纳率95%解题思路:I(1)中和反应、物质的燃烧反应是放热反应,自发的氧化还原反应能设计成原电池;
(2)自发的氧化还原反应能设计成原电池;
(3)燃料电池的放电规律:负极是燃料失电子的过程,正极是氧气得电子的过程来回答;
II(1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,溶液中氢氧根离子浓度增大,遇到酚酞变红色,氯气能使湿润的淀粉碘化钾试纸变蓝;
(2)惰性电极电解硫酸铜溶液阳极生成氧气,阴极析出铜,溶液中生成硫酸;
(3)根据电解精炼铜的工作原理知识来回答.I(1)中和反应、物质的燃烧反应均是放热反应,A不是自发的氧化还原反应不能设计成原电池,B是自发的氧化还原反应能设计成原电池,
故答案为:放热;不能;能;
(2)A的反应为复分解反应,属于非氧化还原反应,无电子转移,只有自发的氧化还原反应能设计成原电池,
故答案为:A的反应为非氧化还原反应,无电子转移;
(3)甲烷燃料电池中,负极是甲烷燃料失电子的过程,正极是氧气得电子的过程,电极反应分别为:负极 CH4-8e-+10 OH-═CO32-+7H2O,正极2O2+8e-+4H2O═8OH-,为了保证放电的充分进行,可以选择碱来作电解质溶液,
故答案为:NaOH;CH4-8e-+10OH-═CO32-+7H2O;2O2+8e-+4H2O═8OH-;
II(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,
故答案为:2H++2e-=H2↑;电极上有气泡,周围溶液变红色;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,氯气能使湿润的淀粉碘化钾试纸变蓝;
故答案为:2Cl--2e-=Cl2↑;湿润的淀粉碘化钾试纸变蓝,证明有Cl2;
(2)惰性电极电解硫酸铜溶液阳极生成氧气,阴极析出铜,溶液中生成硫酸,反应的化学方程式为:2H2O+2CuSO4
通电
.
2Cu+O2↑+2H2SO4 ;
故答案为:2H2O+2CuSO4
通电
.
2Cu+O2↑+2H2SO4 ;
(3)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,故答案为:精铜; Cu2++2e-=Cu;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜;Cu-2e-=Cu2+.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生原电池和电解池的工作原理知识、粗铜精炼原理分析,明确正负极及阴阳极上发生的反应和电极方程式的书写是解题的关键,题目难度不大.1年前查看全部
- 某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2 =点燃=2CO2+2H2O,试推出X的化学式.
某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2 =点燃=2CO2+2H2O,试推出X的化学式.
我知道X中含有2个碳原子 4个氢原子 X为C2H4 可是疑惑一下.为什么不是H4C2?
不是说正价元素写在前 负价元素写在后. ak0107081年前4
ak0107081年前4 -
 deng8111 共回答了16个问题
deng8111 共回答了16个问题 |采纳率81.3%C2H4是有机物 一般有机物的按C H O N的顺序写的,这是约定俗成
无机物的氢化物(氢元素显正价)除了个别的如NH3、PH3外一般都是写在前面的
当然一些金属氢化物(氢元素显负价),如NaH、KH等写在后面1年前查看全部
- (2007•北京)在X+2O2 点燃 . CO2+2H2O的反应中,根据质量守恒定律可判断
(2007•北京)在X+2O2
CO2+2H2O的反应中,根据质量守恒定律可判断出X的化学式为( )点燃 .
A.CH4
B.C2H5OH
C.C
D.CO bension1年前1
bension1年前1 -
 寻觅的阿郎 共回答了18个问题
寻觅的阿郎 共回答了18个问题 |采纳率94.4%解题思路:此题根据质量守恒定律,反应前后原子种类和个数都不变,分别统计出反应前后原子种类及个数,比较分析就可以求出所求物质的化学式.根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知生成物中含有的原子种类及原子个数为C,1;H,4;O,4;已知反应物中含有的原子种类及原子个数为O,4;比较分析可知X中含有C和H元素,其原子个数分别为1和4,故X的化学式为CH4.
故选A点评:
本题考点: 有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 此题主要考查学生对质量守恒定律的实际运用,只有掌握了这一知识的内涵,才能自由驾御,正确解答.1年前查看全部
- 某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2 点燃 . 2CO2+2H2O,
某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2
2CO2+2H2O,试推出X的化学式______.点燃 . kfnc1101年前1
kfnc1101年前1 -
 AceKrimie 共回答了14个问题
AceKrimie 共回答了14个问题 |采纳率92.9%解题思路:化学反应前后,元素的种类不变,原子的种类、总个数不变.由X+3O2=2CO2+2H2O可知,反应后碳原子是2个,反应前应该是2个,包含在X中;
反应后氧原子是6个,反应前是6个;
反应后氢原子是4个,反应前应该是4个,包含在X中;
由分析可知,每个X中含有2个碳原子和4个氢原子,是乙烯,乙烯的化学式是C2H4.
故填:C2H4.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.1年前查看全部
- 在CH4+2O2 点燃 . CO2+2H2O反应中,每 _____
在CH4+2O2
CO2+2H2O反应中,每 ______份质量的甲烷(CH4)跟 ______份质量的氧气反应,就生成 ______份质量的二氧化碳.点燃 . 阿上鱼1年前3
阿上鱼1年前3 -
 kkk12111 共回答了19个问题
kkk12111 共回答了19个问题 |采纳率94.7%解题思路:根据化学方程式,得出参加反应的CH4的相对分子质量和O2的相对分子质量,写出它们之间的比即可正确解答.甲烷燃烧的方程式为CH4+2O2
点燃
.
CO2+2H2O,
CH4 的相对分子质量为16,O2的相对分子质量为32,CO2的相对分子质量为44,
故答案为:
16; 64; 44点评:
本题考点: 常见化学反应中的质量关系.
考点点评: 本题主要考查学生运用化学方程式和元素的相对原子质量进行计算的能力.1年前查看全部
- (天然气)CH4+2O2----CO2+2H2O (液化石油气)C3H8+5O2------3CO2+4H2O
(天然气)CH4+2O2----CO2+2H2O (液化石油气)C3H8+5O2------3CO2+4H2O
把以石油气为燃料的灶具改为天然气为燃料的灶具()
A:减少燃料气或增多空气进入量
B:增多燃料气或减少空气进入量
为什么不考虑密度啊? 线面小超人1年前3
线面小超人1年前3 -
 ritaqin99 共回答了19个问题
ritaqin99 共回答了19个问题 |采纳率84.2%B 天然气燃烧只需要2倍于自己体积的氧气
丙烷是5倍 当然应该减少空气进入量
甲烷热值低 丙烷热值高 当然应该增加燃料1年前查看全部
- 天然气、液化石油气(主要成分是C3~C6的烷烃)燃烧的化学方程式分别为:CH4+2O2→CO2+2H2O;C3H8+5O
天然气、液化石油气(主要成分是C3~C6的烷烃)燃烧的化学方程式分别为:CH4+2O2→CO2+2H2O;C3H8+5O2→3CO2+4H2O.现有一套以天然气为燃料的炊具,欲改燃烧液化石油气,应采取的正确措施是( )
A.两种气体的进入量都减少
B.增大空气进入量或减少液化气的进入量
C.两种气体的进入量都增大
D.减少空气进入量或增大液化气的进入量 赌坊517号1年前1
赌坊517号1年前1 -
 wizardisme 共回答了20个问题
wizardisme 共回答了20个问题 |采纳率100%解题思路:可燃物完全燃烧的条件是要有充足的氧气,则在改造过程中要保证氧气必须充足.促进可燃物燃烧的方法有:(1)增大氧气的浓度;(2)增大可燃物与氧气的接触面积.
由化学方程式可知,天然气燃烧时,甲烷与氧气的物质的量之比为1:2,液化石油气燃烧时,丙烷与氧气的物质的量之比为1:5,
所以同体积的两种燃气,液化石油气耗氧量多,把天然气为燃料的灶具改用液化石油气为燃料时,需要加大空气气的量,减少液化石油气的进入量.
故选B.点评:
本题考点: 烷烃及其命名.
考点点评: 本题主要考查了运用化学知识解决实际问题,关键在于明确保证可燃物燃烧时氧气充足.1年前查看全部
- 天然气和液化石油气(主要成分为C3-C5的烷烃)燃烧的化学方程式分别为:CH4+2O2→CO2+2H2O,C3H8+5O
天然气和液化石油气(主要成分为C3-C5的烷烃)燃烧的化学方程式分别为:CH4+2O2→CO2+2H2O,C3H8+5O2→3CO2+4H2O
将一套以天然气为燃料的灶具改用液化石油气为燃料,应采取的正确措施是( )
A.增大空气进入量或减小石油气进入量
B.同时增大空气和石油气进入量
C.减小空气进入量或增大石油气进入量
D.同时减小空气和石油气进入量 愿你能爱我一天1年前1
愿你能爱我一天1年前1 -
 czm944 共回答了23个问题
czm944 共回答了23个问题 |采纳率91.3%解题思路:可燃物完全燃烧的条件是要有充足的氧气.在改造过程中要保证氧气必须充足.促进可燃物燃烧的方法有:(1)增大氧气的浓度.(2)增大可燃物与氧气的接触面积.
由化学方程式可知,天然气燃烧时,反应物微观粒子个数比是:1:2,液化石油气燃烧时,反应物微观粒子个数比是:1:5
所以同体积的两种燃气,液化石油气耗氧量多,把天然气为燃料的灶具改用液化石油气为燃料时,需要加大空气气的量,减少液化石油气的进入量.
故选A.点评:
本题考点: 燃料的充分燃烧.
考点点评: 本题主要考查了运用化学知识解决实际问题,关键在于明确保证可燃物燃烧时氧气充足.1年前查看全部
- (2003•松江区二模)一种可作为绿色能源的物质X,其燃烧的化学反应为:X+2O2→CO2+2H2O,判断X的化学式为(
(2003•松江区二模)一种可作为绿色能源的物质X,其燃烧的化学反应为:X+2O2→CO2+2H2O,判断X的化学式为( )
A.H2
B.CH4
C.CH3OH
D.C2H5OH 838483841年前1
838483841年前1 -
 懒 猫 共回答了27个问题
懒 猫 共回答了27个问题 |采纳率70.4%解题思路:根据在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变回答本题.生成物中有:1个C原子、4个氧原子、4个氢原子,反应物中已经有4个氧原子,还少1个C原子、4个氢原子,所以X的化学式为:CH4.
故选B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力.要根据原子个数在反应前后不变求化学式.1年前查看全部
- CH4+2O2_点燃__CO2+2H2O 质量守恒定律里的3个含义
 披个ee来问问题1年前1
披个ee来问问题1年前1 -
 chobno 共回答了23个问题
chobno 共回答了23个问题 |采纳率82.6%1、甲烷与氧气在点燃的条件下生成二氧化碳和水
2、16份质量的甲烷与64份质量的氧气反应生成44份质量的二氧化碳和36份质量的水
3、1个甲烷分子与2个氧气分子反应生成1个二氧化碳分子和2个水分子1年前查看全部
- X+2O2==点燃==CO2+2H2O中 可以推断出X是?
 isolubin1年前2
isolubin1年前2 -
 heku119 共回答了20个问题
heku119 共回答了20个问题 |采纳率95%根据物质等恒定理,在点燃之后得出来的物质CO2加2H2O共有C 4O 4H那么在点燃前也必须要这些物质,那么除去写出来的4O,那么就要有C 4H,符合的就是CH4了1年前查看全部
- CH4 + 2O2=== CO2+2H2O
CH4 + 2O2=== CO2+2H2O
如果5 L 的CH4 和 20L 的氧气,两个都是在压强为101Kpa 和 温度298K 下,有多少克的水产生. 酒鬼兔1年前4
酒鬼兔1年前4 -
 fqyyz 共回答了14个问题
fqyyz 共回答了14个问题 |采纳率100%5 L 的CH4 和 20L 的O2,两者比例 = 5:20 = 1:4
而根据反应方程式,两者反应的比例是1:2
说明O2过量
所以要按CH4的量计算
根据阿伏伽德罗定律,298温度下气体摩尔体积 Vm = 22.4*298/273 = 24.5L
n(CH4) = 5/24.5 = 0.2mol
生成的n(H2O) = 0.2*2 = 0.4mol
m(H2O) = 18*0.4 = 7.2g1年前查看全部
- (2008•绵阳)已知化学方程式X+2O2 点燃 . CO2+2H2O,下列对X的判断不正
(2008•绵阳)已知化学方程式X+2O2
CO2+2H2O,下列对X的判断不正确的是( )点燃 .
A.X是一种最简单的有机化合物
B.一定含碳、氢、氧三种元素
C.X是一种重要的气体燃料
D.X的化学式是CH4 郎7121年前1
郎7121年前1 -
 yinling1984 共回答了16个问题
yinling1984 共回答了16个问题 |采纳率93.8%解题思路:由题目中:化学方程式X+2O2
CO2+2H2O,则可知:X的物质分类(有机物);X的元素组成;X是否为燃料;X的化学式.点燃 .已知化学方程式X+2O2
点燃
.
CO2+2H2O,则可知:
A、根据质量守恒定律的元素守恒可知,X中含有碳元素,其可燃烧,具有有机物的特点,推测其化学式为CH4,则为一种最简单的有机化合物,故A正确;
B、根据质量守恒定律的元素守恒可知,X只含有碳元素、氢元素,而无氧元素,故B错误;
C、由化学方程式可知,X可以燃烧,所以是一种重要的气体燃料,故C正确;
D、根据质量守恒定律的元素守恒可知,可推测其化学式为CH4,故D正确.
故选B.点评:
本题考点: 化学方程式的概念、读法和含义;质量守恒定律及其应用.
考点点评: 本题是运用化学中的基本思想质量守恒思想;学会分析此类题目:仔细查清反应前后的元素种类,原子个数.1年前查看全部
- CH4+2O2=点燃=CO2+2H2O中的能量转换
CH4+2O2=点燃=CO2+2H2O中的能量转换
能量转化形式 由--------能转化为-------------能?填空! 风云骑士1年前2
风云骑士1年前2 -
 Nigal 共回答了13个问题
Nigal 共回答了13个问题 |采纳率84.6%由----化学----能转化为-----热--------能1年前查看全部
- 某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2═2CO2+2H2O,试推出X的化学式( )
某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2═2CO2+2H2O,试推出X的化学式( )
A. C2H4
B. CH2
C. CH2O
D. C2H2 663691771年前3
663691771年前3 -
 daphen 共回答了17个问题
daphen 共回答了17个问题 |采纳率88.2%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物X的化学式.根据反应的化学方程式X+3O2
点燃
2CO2+2H2O,反应物中氧原子个数为6,反应后的生成物中碳、氢、氧原子个数分别为2、4、6,根据反应前后原子种类、数目不变,则每个X分子由2个碳原子和4个氢原子构成,则物质X的化学式为C2H4.
故选A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- (2006•郴州)根据化学方程式x+2O2 点燃 . CO2+2H2O,确定x为( )
(2006•郴州)根据化学方程式x+2O2
CO2+2H2O,确定x为( )点燃 .
A.C2H6O
B.CO
C.CH4
D.C2H4 xhjxyz1年前1
xhjxyz1年前1 -
 yyyyyyyyii 共回答了8个问题
yyyyyyyyii 共回答了8个问题 |采纳率100%解题思路:本题考查的是质量守恒定律,其内容是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和.在化学反应中,从微观上原子种类、原子数目和原子的质量都不变.反应后有C:1,H:4,O:3;反应前有O:4,故x中有C:1,H:4,故x为CH4
故选C点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本考点考查了质量守恒定律的应用,有关质量守恒定律的考题在中考中经常出现,要抓住要点:五个一定不变,一个一定变.还要注意化学方程式的配平,本考点经常出现在选择题、填空题和实验题中.1年前查看全部
- (2013•泰安)关于化学方程式CH4+2O2 点燃 . CO2+2H2O的描述正确的是(
(2013•泰安)关于化学方程式CH4+2O2
CO2+2H2O的描述正确的是( )点燃 .
A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水
B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水
C.1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子
D.1 g CH4和2 g O2在点燃条件下,生成1 g CO2和2 g H2O yzls1年前1
yzls1年前1 -
 enlysun 共回答了12个问题
enlysun 共回答了12个问题 |采纳率100%解题思路:化学方程式可表示:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等.但要注意读化学方程式时,“+”应读作“和”,“═”应读作“生成”.A、在反应中“+”读作“和”,该反应可读作:甲烷和氧气在点燃条件下,反应生成二氧化碳和水,故选项读法错误.
B、该反应不能读作,1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水;从微观上,1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子,故选项读法错误.
C、从微观上,1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子,故选项读法正确.
D、该反应可读作:每16份质量的甲烷和64份质量的氧气在点燃条件下恰好反应生成44份质量的二氧化碳和36份质量的水,则1gCH4和4gO2在点燃条件下能充分反应,故选项读法错误.
故选C.点评:
本题考点: 化学方程式的概念、读法和含义.
考点点评: 化学方程式是最重要的化学用语之一,掌握化学方程式的含义、了解方化学方程式的读法是正确解答此类题的关键.1年前查看全部
- 已知反应X+3O2 点燃 . 2CO2+2H2O,则X的化学式为( )
已知反应X+3O2
2CO2+2H2O,则X的化学式为( )点燃 .
A.C2H6
B.C2H4
C.C2H2
D.C2H6O TANGJWWW1年前1
TANGJWWW1年前1 -
 西夕 共回答了16个问题
西夕 共回答了16个问题 |采纳率93.8%解题思路:根据反应X+3O2
2CO2+2H2O,利用质量守恒定律的元素守恒来推断X的化学式.点燃 .在反应X+3O2
点燃
.
×中,该反应遵循质量守恒定律,则反应前后元素的种类、原子个数不变,O原子个数在反应前后都是6,没有变化,在反应后有C、H两种元素,则X中含有C、H两种元素,
反应后共2个C原子、4个H原子,则X中含有2个C原子、4个H原子,又X的化学计量数为1,则可知X的化学式为C2H4.
故选:B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查学生利用化学方程式和质量守恒定律来推断物质的化学式,学生应学会利用元素守恒、原子守恒的方法来解答.1年前查看全部
大家在问
- 1在生活中热现象的例子常常可见,下列有关热现象的叙述不正确的是( ) A.小明同学戴眼镜到厨房帮妈妈炒菜,眼镜片立即模糊
- 2从0.1.2.3.4.5.6这7个数字中,任意取两个做除法,可得出不同的商的个数为_____.
- 32014九年级第五单元英语作文
- 4为什么山顶的气温日较差比平原小?
- 5A boy with two dogs ______when the earthquake rocked the cit
- 6Lucy has a great sense of humor and always keeps her coleagu
- 7由某某整理的英文由XXX整理的英文怎么翻译?请不要给我翻译器答案谢谢!
- 8下列句字中,哪个词语有活用现象,指出并解释1窗扉皆洞开2逾时,楼渐低3故又名"鬼市"云
- 9动物应该作为人类食物和衣服的来源
- 10某化学兴趣小组想探究竹子里面气体的成分:
- 11东东看一本科幻书第一天看了20%第二天看了40%两天一共看了120页这本书共有多少页?
- 12《香伯》第十段与哪段呼应,有什么好好处
- 13物理静电场概念题,如果某点的场强为零,检验电荷在该点的电势能一定为零.这题为什么错啊?
- 14He asked me not to go there.改为被动语态该怎么改?
- 15__milk do you __every day ----a bag.
