乙醇燃料电池在碱性条件下的反应方程式
 张颖tianqing2022-10-04 11:39:542条回答
张颖tianqing2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 pooshy 共回答了17个问题
pooshy 共回答了17个问题 |采纳率82.4%- 负极:C2H5OH变成CO32-,反应物少O多H,碱性条件补OH-
C2H5OH+16OH--12e-=2CO32-+11H2O
正极:O2+2H2O+4e-=4OH-
总:C2H5OH+3O2+4OH-=2CO32-+5H2O - 1年前
 温_馨 共回答了547个问题
温_馨 共回答了547个问题 |采纳率- 总反应:C2H5OH+3O2+4KOH=2K2CO3+5H2O
负极:C2H5OH+16OH(-)-12e(-)=2CO3(2-)+11H2O
正极:O2+4e(-)+2H2O=4OH(-) - 1年前
相关推荐
- 圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如
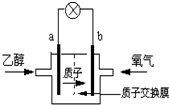 圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )
圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )
A.a极为电池的正极
B.电池正极的电极反应为:4H++O2+4e-═2H2O
C.电池工作时电流由a极沿导线经灯泡再到b极
D.电池工作时,1mol乙醇被氧化时就有6 mol电子转移 不解的心结1年前1
不解的心结1年前1 -
 细细砂砾 共回答了15个问题
细细砂砾 共回答了15个问题 |采纳率93.3%解题思路:由质子的移动方向可知a为负极,a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-═2CO2+12H+,b为正极,发生还原反应,电极方程式为4H++O2+4e-═2H2O,以此解答该题.A.原电池工作时,阳离子向正极移动,则a为负极,故A错误;
B.正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故B正确;
C.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故C错误;
D.乙醇中C元素的化合价为-2价,被氧化后升高到+4价,则电池工作时,1mol乙醇被氧化时就有12mol电子转移,故D错误.
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,本题注意把握根据电池总反应书写电极方程式的方法,难度不大.1年前查看全部
- 2012福建理综乙醇燃料电池工作时的装置
2012福建理综乙醇燃料电池工作时的装置
.如图所示是某乙醇燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N、两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是________,电极名称是________;N极的电极反应式为__________________,加入乙醇的铂电极的电极反应式为______________________.
答案是N是石墨,M是铁.
为什么?甲池做原电池.而不是乙池做原电池? 天空飘过彩虹1年前1
天空飘过彩虹1年前1 -
 和尚119 共回答了23个问题
和尚119 共回答了23个问题 |采纳率100%甲池是乙醇氧气燃料电池,乙池由题目中给的铁电极和石墨电极这两个电极是能组成原电池的,但由于电解液是硫酸铜溶液,而题目要求铁电极的质量不能减少,若做原电池,铁电极的质量是会减少的.所以乙池不能是原电池.手机码字不容易,有不懂的可以再追问,本人本科大三,专业电化学~1年前查看全部
- (2014•怀柔区一模)美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200℃左右供电.电池总反应为:C
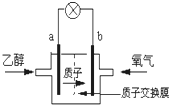 (2014•怀柔区一模)美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200℃左右供电.电池总反应为:C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )
(2014•怀柔区一模)美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200℃左右供电.电池总反应为:C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )
A.a极为电池的正极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池正极的电极反应为:4H++O2+4e-═2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 feng515201年前1
feng515201年前1 -
 爱的阳光普照 共回答了16个问题
爱的阳光普照 共回答了16个问题 |采纳率100%解题思路:由质子的移动方向可知a为负极,a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-═2CO2+12H+,b为正极,发生还原反应,电极方程式为4H++O2+4e-═2H2O,以此解答该题.A.原电池工作时,阳离子向正极移动,则a为负极,故A错误;
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B错误;
C.正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故C正确;
D.乙醇中C元素的化合价为-2价,被氧化后升高到+4价,则电池工作时,1mol乙醇被氧化时就有12mol电子转移,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,本题注意把握根据电池总反应书写电极方程式的方法,难度不大.1年前查看全部
- 乙醇燃料电池,NaOH作电解质
 等待下一秒1年前1
等待下一秒1年前1 -
 娓娓_到来 共回答了23个问题
娓娓_到来 共回答了23个问题 |采纳率87%负极:C2H5OH - 12e- + 16OH- == 2CO3^2- + 11H2O
正极:O2 + 4e- + 2H2O == 4OH-
总方程式:C2H5OH + 3O2 + 4OH- == 2CO3^2- + 5H2O
注意,因为是NaOH作电解质,所以不会有CO2生成,而是生成CO3^2-1年前查看全部
- 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:

(1)N的电极反应式为______.
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气______L(标准状况下).
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇______ g.
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011催化剂 .
反应II:2CO2(g)+4H2(g)
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022催化剂 .
①写出反应I的平衡常数表达式K=______,
②条件相同时,反应I与反应II相比,转化程度更大的是______.
③在一定压强下,测得反应I的实验数据如下表:
根据表中数据分析:温度升高,K值______(填“增大”、“减小”或“不变”),提高氢碳比.n(H2)/n(CO2),对生成乙醇______(填“不利”或“有利”).
温度(K)
CO2转化率(%)
n(H2)/n(CO2)500 600 700 800 1.5 45 33 20 12 2 60 43 28 15 3 83 62 37 22  jing21jj1年前1
jing21jj1年前1 -
 朋友不要忘记 共回答了27个问题
朋友不要忘记 共回答了27个问题 |采纳率92.6%解题思路:(1)根据燃料电池的正负极确定电解池的阴阳极,进而确定电极反应式的书写;
(2)甲池和乙池是串联电路,电路中转移电子的量相等,根据电子守恒来计算消耗氧气的量;
(3)根据乙池中两电极的电极反应计算两电极产生的气体体积恰好相等时转移的电子数,进而确定消耗乙醇的量;
(4)①平衡常数K=[生成物平衡浓度系数次方的乘积/反应物平衡浓度系数次方的乘积];
②根据平衡常数表征的意义来回答;
③根据化学平衡与移动原理结合表中的数据来回答.(1)燃料电池中,通入燃料的电极是负极,通入氧气的电极是正极,所以N极是电解池的阳极,放电的是电解质中的氢氧根离子,即4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)乙池中M极是阴极,该极上析出金属铜,电极反应为:Cu2++2e-=Cu,当生成金属铜6.4g即0.1mol时,转移电子为0.2mol,甲池和乙池是串联电路,电路中转移电子的量相等,根据甲池中氧气的放电反应O2+2H2O+4e-=4OH-,当转移0.2mol电子时,消耗氧气的物质的量为0.05mol,体积是0.05mol×22.4L/mol=1.12L,,故答案为:1.12;
(3)乙池中阳极反应是4OH--4e-=O2↑+2H2O,阴极反应依次是:Cu2++2e-=Cu,2H++2e-=H2,当铜离子全部放电时,转移电子是0.6mol,设转移nmol电子时,两极上产生气体的体积相等,则两极上产生气体的物质的量等式表示为:0.25n=0.5(n-0.6),解得n=1.2,根据反应C2H6O+3O2=2CO2+3H2O,在转移,12mol电子时,消耗C2H6O的量为1mol,当转移1.2mol电子时,理论上消耗乙醇0.1moL,质量是4.6g,故答案为:4.6;
(4)①平衡常数K=[生成物平衡浓度系数次方的乘积/反应物平衡浓度系数次方的乘积]=
[C2H6O][H2O]3
[CO2]2[H2]6 ,故答案为:
[C2H6O][H2O]3
[CO2]2[H2]6 ;
②根据平衡常数表征的意义:K越大表示反应物的转化程度大,故答案为:反应II;
③根据表中的数据可以看出,温度越高,二氧化碳的转化率越小,所以平衡越往左移动,说明向左的方向是吸热的,即反应是放热,温度越高K越小,根据表中数据提高氢碳比n(H2)/n(CO2),二氧化碳的转化率增大,所以向右进行,有利于乙醇的生成,故答案为:减小,有利.点评:
本题考点: 原电池和电解池的工作原理;化学平衡常数的含义.
考点点评: 本题是一道综合应用知识题目,考查角度广,难度很大.1年前查看全部
- 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意
 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图.下列说法中,正确的是( )
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图.下列说法中,正确的是( )
A.电池工作时,H+向电池的负极迁移
B.电池工作时,电流由a极沿导线流向b极
C.a极上发生的电极反应是:C2H5OH+3H2O+12e-=2CO2+12H+
D.b极上发生的电极反应是:4H++O2+4e-=2H2O jackpop81431年前1
jackpop81431年前1 -
 小小小木马 共回答了18个问题
小小小木马 共回答了18个问题 |采纳率94.4%解题思路:由质子的移动方向可知a为负极,a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-═2CO2+12H+,b为正极,发生还原反应,电极方程式为4H++O2+4e-═2H2O,以此解答该题.A、电池中,阳离子向正极移动,所以氢离子向电池的正极迁移,故A错误;
B、电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B错误;
C、a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-═2CO2+12H+,故C错误;
D、正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故D正确.
故选:D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,题目难度中等,本题注意把握根据电池总反应书写电极方程式的方法.1年前查看全部
- 以熔融的氧化钠为电解质的乙醇燃料电池 正负极以及总方程式
以熔融的氧化钠为电解质的乙醇燃料电池 正负极以及总方程式
问题补充: 注意!是熔融的 氧化钠 Na2O Na2O也会和H2O反应啊 森林猎人1年前2
森林猎人1年前2 -
 gg神厕16 共回答了16个问题
gg神厕16 共回答了16个问题 |采纳率87.5%1、负极反应:C2H6O + 11O 2- - 12e- = 2CO3 2- + 6OH-
2、正极反应:3O2 + 12e- = 6O 2-
3、电池离子反应:C2H6O + 3O2 + 5O 2- = 2CO3 2- + 6OH-
化学反应:C2H6O + 3O2 + 5Na2O = 2Na2CO3 + 6NaOH1年前查看全部
- 美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H + )溶剂,在200℃左右供电.电池总反应为:C 2 H 5 OH+
美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H + )溶剂,在200℃左右供电.电池总反应为:C 2 H 5 OH+3O 2 →2CO 2 +3H 2 O,如图是该电池的示意图,下列说法正确的是( ) A.a极为电池的正极 B.电池工作时电流由a极沿导线经灯泡再到b极 C.电池正极的电极反应为:4H + +O 2 +4e - ═2H 2 O D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 
 adas3921年前1
adas3921年前1 -
 gc-liao 共回答了21个问题
gc-liao 共回答了21个问题 |采纳率90.5%A.原电池工作时,阳离子向正极移动,则a为负极,故A错误;
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B错误;
C.正极氧气得到电子被还原,电极反应式为4H + +O 2 +4e - =2H 2 O,故C正确;
D.乙醇中C元素的化合价为-2价,被氧化后升高到+4价,则电池工作时,1mol乙醇被氧化时就有12mol电子转移,故D错误.
故选C.1年前查看全部
- 若以乙醇燃料电池为电源来电解足量硝酸银溶液,当消耗46g乙醇时,电解产生的气体体积(标况)为多少L?(已知:C2H5OH
若以乙醇燃料电池为电源来电解足量硝酸银溶液,当消耗46g乙醇时,电解产生的气体体积(标况)为多少L?(已知:C2H5OH-12e-+3H2O=2CO2+12H+)
 难忘鱼儿1年前2
难忘鱼儿1年前2 -
 WNLO 共回答了15个问题
WNLO 共回答了15个问题 |采纳率100%题中问的是电解硝酸银溶液产生的气体,而不是燃料电池产生的气体,楼上的回答有些许偏差.
燃料电池部分:46g的乙醇,恰好1mol,代入到C2H5OH-12e-+3H2O=2CO2+12H+中可知转移了12NA的电子.这12NA的电子就是电解池中电子转移量.
再来看电解池部分:由于AgNO3中离子放电顺序Ag+>H+,OH->NO3-.所以电解产生的气体是O2(难点,这里需要详解请追问).根据电极反应式:4OH- - 4e - = O2 + 2H2O ,代入12NA的电子,可得生成O2的物质的量为3mol,换算成标况体积为67.2L .
【化学一加一】团队:sy930915为您解答
如有疑惑,欢迎追问1年前查看全部
- 乙醇燃料电池 在酸性和碱性 下的总反应式
 1120林1年前3
1120林1年前3 -
 cdscd 共回答了16个问题
cdscd 共回答了16个问题 |采纳率81.3%乙醇燃料电池,KOH作电解质
总反应:C2H5OH+3O2+4KOH=2K2CO3+5H2O
负极:C2H5OH+16OH(-)-12e(-)=2CO3(2-)+11H2O
正极:O2+4e(-)+2H2O=4OH(-)
乙醇燃料电池,酸作电解质
正:O2 + 4H+ + 4e = 2H2O
负:C2H6O + 3H2O - 12e = 2CO2 + 12H+1年前查看全部
- 1.乙醇汽油燃烧时是将_______能大部分转化为热能,从而推动汽车发动机工作.乙醇燃料电池是一种常用的化学电源,它作电
1.乙醇汽油燃烧时是将_______能大部分转化为热能,从而推动汽车发动机工作.乙醇燃料电池是一种常用的化学电源,它作电源时能量转化形式是______.
2.下列说法不符合"节能减排"这一要求的是( )
A推广使用以氢氧燃料电池提供动力的客车
B综合利用化石能源
C在田野里大量焚烧 laoqi721年前1
laoqi721年前1 -
 dreamofshanghai 共回答了19个问题
dreamofshanghai 共回答了19个问题 |采纳率89.5%1,化学能,化学能→电能,这种化学物质产生能量一般都是有化学能变成其它的
2,c 明显不是节能减排嘛,ab都没错,a是新能源1年前查看全部
- 乙醇燃料电池以熔融的K2CO3为电解质,写出正负极方程式和总的方程式
 灵幻游侠1年前1
灵幻游侠1年前1 -
 55杯 共回答了14个问题
55杯 共回答了14个问题 |采纳率78.6%因为是无水环境,要这样写:
负极:C2H5OH--12e^-+6CO3^2- ===8CO2 +3H2O
正极:3O2+12e- +6CO2====6CO3^2-1年前查看全部
- 乙烷和乙醇燃料电池的正负极反应方程式电解质酸碱都要…快~
 我就是这样啊1年前1
我就是这样啊1年前1 -
 shaomingx 共回答了19个问题
shaomingx 共回答了19个问题 |采纳率100%乙醇燃料电池
KOH作电解质
总反应:C2H5OH+3O2+4KOH=2K2CO3+5H2O
负极:C2H5OH+16OH(-)-12e(-)=2CO3(2-)+11H2O
正极:O2+4e(-)+2H2O=4OH(-)
酸作电解质
正:O2 + 4H+ + 4e = 2H2O
负:C2H60 + 3H2O - 12e = 2CO2 + 12H+1年前查看全部
- 电解质是碳酸钾溶液的乙醇燃料电池
电解质是碳酸钾溶液的乙醇燃料电池
负极产物会是碳酸氢根吗?(二氧化碳与碳酸根生成的) oppoipo765768iuy1年前1
oppoipo765768iuy1年前1 -
 qhxnls 共回答了14个问题
qhxnls 共回答了14个问题 |采纳率92.9%当然可能,只要燃料过量就会有HCO3-
但是一般燃料电池都要保证电解质过量,否则反应到最後会停止,电池就作废了1年前查看全部
- 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO 4 溶液.请回答下列问题: 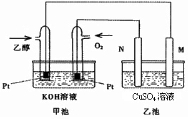
(1)N的电极反应式为______.
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气______L(标准状况下).
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇______ g.
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO 2 (g)+6H 2 (g)
CH 3 CH 2 OH(g)+3H 2 O(g) 25℃时.K=2.95×10 11催化剂 .
反应II:2CO 2 (g)+4H 2 (g)
CH 3 CH 2 OH(g)+H 2 O(g)25℃时,K=1.7l×10 22催化剂 .
①写出反应I的平衡常数表达式K=______,
②条件相同时,反应I与反应II相比,转化程度更大的是______.
③在一定压强下,测得反应I的实验数据如下表:
根据表中数据分析:温度升高,K值______(填“增大”、“减小”或“不变”),提高氢碳比.n(H 2 )/n(CO 2 ),对生成乙醇______(填“不利”或“有利”).
温度(K)
CO 2 转化率(%)
n(H 2 )/n(CO 2 )500 600 700 800 1.5 45 33 20 12 2 60 43 28 15 3 83 62 37 22  上ii知了1年前1
上ii知了1年前1 -
 joselt 共回答了23个问题
joselt 共回答了23个问题 |采纳率100%(1)燃料电池中,通入燃料的电极是负极,通入氧气的电极是正极,所以N极是电解池的阳极,放电的是电解质中的氢氧根离子,即4OH - -4e - =O 2 ↑+2H 2 O,故答案为:4OH - -4e - =O 2 ↑+2H 2 O;
(2)乙池中M极是阴极,该极上析出金属铜,电极反应为:Cu 2+ +2e - =Cu,当生成金属铜6.4g即0.1mol时,转移电子为0.2mol,甲池和乙池是串联电路,电路中转移电子的量相等,根据甲池中氧气的放电反应O 2 +2H 2 O+4e - =4OH - ,当转移0.2mol电子时,消耗氧气的物质的量为0.05mol,体积是0.05mol×22.4L/mol=1.12L,,故答案为:1.12;
(3)乙池中阳极反应是4OH - -4e - =O 2 ↑+2H 2 O,阴极反应依次是:Cu 2+ +2e - =Cu,2H + +2e - =H 2 ,当铜离子全部放电时,转移电子是0.6mol,设转移nmol电子时,两极上产生气体的体积相等,则两极上产生气体的物质的量等式表示为:0.25n=0.5(n-0.6),解得n=1.2,根据反应C 2 H 6 O+3O 2 =2CO 2 +3H 2 O,在转移,12mol电子时,消耗C 2 H 6 O的量为1mol,当转移1.2mol电子时,理论上消耗乙醇0.1moL,质量是4.6g,故答案为:4.6;
(4)①平衡常数K=
生成物平衡浓度系数次方的乘积
反应物平衡浓度系数次方的乘积 =
[C 2 H 6 O][ H 2 O ] 3
[C O 2 ] 2 [ H 2 ] 6 ,故答案为:
[C 2 H 6 O][ H 2 O ] 3
[C O 2 ] 2 [ H 2 ] 6 ;
②根据平衡常数表征的意义:K越大表示反应物的转化程度大,故答案为:反应II;
③根据表中的数据可以看出,温度越高,二氧化碳的转化率越小,所以平衡越往左移动,说明向左的方向是吸热的,即反应是放热,温度越高K越小,根据表中数据提高氢碳比n(H 2 )/n(CO 2 ),二氧化碳的转化率增大,所以向右进行,有利于乙醇的生成,故答案为:减小,有利.1年前查看全部
- (化学)甲烷燃料电池和乙醇燃料电池在碱性条件下的电极方程和电池方程怎么写?
 石头马1年前2
石头马1年前2 -
 abbreviation 共回答了14个问题
abbreviation 共回答了14个问题 |采纳率92.9%在实用中没有以甲烷或乙醇为燃料的碱性燃料电池.原因很简单,甲醇燃料电池正常运行时的排出产物是水和二氧化碳,而二氧化碳是弱酸性气体,会和碱液性电解质反应生成碳酸盐和水.这样,电解质就被燃料电池自己的排出产物所消耗,使得工作性能严重衰减了.因此,以甲烷或乙醇为燃料的燃料电池都是在酸性环境下运行的.1年前查看全部
- 乙醇燃料电池,氢氧化钾为电解质溶液,负极的电极反应式
 Gustavzhang1年前1
Gustavzhang1年前1 -
 wojiaoblp 共回答了15个问题
wojiaoblp 共回答了15个问题 |采纳率86.7%氢离子和氢氧根反应生成水1年前查看全部
- 乙醇燃料电池中为什么是乙醇失电子而不是氢氢根失电子
 星空小月1年前1
星空小月1年前1 -
 linxinfu 共回答了17个问题
linxinfu 共回答了17个问题 |采纳率100%燃料电池当成一个简单的原电池处理
是原电池的话,可以看成是一个氧化还原反应
燃料电池对应的这个氧化还原反应就是乙醇燃烧
C2H6O + 3O2 == 2CO2 + 3H2O
反应中失去电子的还原剂就是乙醇,所以即使变形成电池的形式,也一定是乙醇失去电子1年前查看全部
- (2014•闸北区一模)美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200°C左右供电.电池总反应为:
 (2014•闸北区一模)美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200°C左右供电.电池总反应为:C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )
(2014•闸北区一模)美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200°C左右供电.电池总反应为:C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )
A.a极为电池的正极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H++O2+4e-=2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 happybeauty5201年前1
happybeauty5201年前1 -
 烧煳的开水 共回答了16个问题
烧煳的开水 共回答了16个问题 |采纳率75%解题思路:由质子的移动方向可知a为负极,a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-═2CO2+12H+,b为正极,发生还原反应,电极方程式为4H++O2+4e-═2H2O,以此解答该题.A.原电池工作时,阳离子向正极移动,则a为负极,故A错误;
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B正确;
C.正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,故C正确;
D.乙醇中C元素的化合价为-2价,被氧化后升高到+4价,则电池工作时,1mol乙醇被氧化时就有12mol电子转移,故D错误;
故选BC.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池知识,侧重于学生的分析能力的考查,本题注意把握根据电池总反应书写电极方程式的方法,难度不大.1年前查看全部
- (2012•上饶一模)乙醇燃料电池中采用磺酸类质子溶剂,电池总反应为:C2H5OH+3O2=2CO2+3H2O下列说法错
 (2012•上饶一模)乙醇燃料电池中采用磺酸类质子溶剂,电池总反应为:C2H5OH+3O2=2CO2+3H2O下列说法错误的是( )
(2012•上饶一模)乙醇燃料电池中采用磺酸类质子溶剂,电池总反应为:C2H5OH+3O2=2CO2+3H2O下列说法错误的是( )
A.电池工作时,质子向电池的正极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a为负极,电极反应式是C2H5OH+3H2O+12e−=2CO2+12H+
D.b为正极,电极反应式是4H++O2+4e−=2H2O damida1年前1
damida1年前1 -
 你鸟我我不鸟你 共回答了15个问题
你鸟我我不鸟你 共回答了15个问题 |采纳率93.3%解题思路:燃料电池中,燃料失去电子发生氧化反应,所以a极是负极,则b极是正极,正极上氧化剂得电子发生还原反应;燃料电池放电时,电子从负极沿外电路流向正极,则电流从正极沿外电路流向负极;电解质溶液中带正电荷的微粒向正极移动,据此分析解答.A、该燃料电池放电时,带正电荷的微粒向正极移动,所以质子向正极移动,故A正确.
B、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,所以该燃料电池放电时,电流从正极b沿导线流向负极a,故B正确.
C、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,负极上燃料失去电子发生氧化反应,所以电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,故C错误.
D、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,正极上氧气得电子和氢离子反应生成水,所以电极反应式为4H++O2+4e-=2H2O,故D正确.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,明确正负极的判断方法、电极反应式的书写即可分析解答本题,难度不大.1年前查看全部
- “乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-=2CO2↑+3H2O”
“乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-=2CO2↑+3H2O”
电池的负极反应是错误的,很明显,在碱性条件下的氢氧根也应该参加的反应,但正确的负极反应应该怎么写?就是不会配平负极方程式啊! 心儿有空1年前1
心儿有空1年前1 -
 qiyandong_123 共回答了21个问题
qiyandong_123 共回答了21个问题 |采纳率95.2%方法一、很简单,先写出总反应化学方程式,再写出正极反应方程式:2H2O+O2+4e- = 4OH- 用总反应方程式减去正极反应就得到正极反应方程式
方法二、分析化合价变化就可以找出失电子数目,但是要注意因为电解质是氢氧化钾,所以产物不能是二氧化碳,应该是碳酸根
C2H5OH-12e-+ 16OH-=2CO3^2- + 11H2O1年前查看全部
- 某乙醇燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少.
某乙醇燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少.
请回答下列问题:
(1)M电极名称是______;N极的电极反应式为______,加入乙醇的铂电极的电极反应式为______.
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气______L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为______.
(3)若在常温常压下,1g C 2 H 5 OH燃烧生成CO 2 和液态H 2 O时放出29.71kJ热量,表示该反应的热化学方程式为______.
 scutcjq1年前1
scutcjq1年前1 -
 beacons 共回答了20个问题
beacons 共回答了20个问题 |采纳率85%碱性乙醇电池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨,
(1)通过以上分析知,M是阴极,N极是阳极,N上电极反应式为4OH - -4e - =O 2 ↑+2H 2 O,乙醇电极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:C 2 H 5 OH-12e - +16OH - =2CO 3 2- +11H 2 O,
故答案为:阴极,4OH - -4e - =O 2 ↑+2H 2 O,C 2 H 5 OH-12e - +16OH - =2CO 3 2- +11H 2 O;
(2)n(Ag)=
4.32g
108g/mol =0.04mol,根据Ag + +e - =Ag可知转移电子为0.04mol,
甲池中通入氧气的一极为正极,反应式为2O 2 +8H + +8e - =4H 2 O,则消耗n(O 2 )=
1
4 ×0.04mol=0.01mol,
V(O 2 )=0.01mol×22.4L/mol=0.224L;
乙池中某一电极析出金属银4.32g时,同时产生氢离子的物质的量是0.04mol,则其浓度是0.1mol/L,所以溶液的pH=1,故答案为:0.224,1;
(3)1g C 2 H 5 OH燃烧生成CO 2 和液态H 2 O时放出29.71kJ热量,则1mol乙醇燃烧放出的热量=
29.7kJ
1g
46g/mol =1366.66kJ,所以其热化学反应方程式为:C 2 H 5 OH(l)+3O 2 (g)=2CO 2 (g)+3H 2 O(l)△H=-1366.66kJ/mol,
故答案为:C 2 H 5 OH(l)+3O 2 (g)=2CO 2 (g)+3H 2 O(l)△H=-1366.66kJ/mol.1年前查看全部
- 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料
 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
(1)甲池中O2所在电极为______极,乙池中M为______极
(2)N的电极反应式为______.
(3)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气为______升(标准状况下).
(4)在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况下),理论上需通入______克乙醇. MiraiNoYume1年前1
MiraiNoYume1年前1 -
 黑舞 共回答了11个问题
黑舞 共回答了11个问题 |采纳率81.8%解题思路:(1)燃料电池中氧气为正极反应物,燃料为负极反应物,与原电池的负极相连为阴极;
(2)电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,和电源的负极相连的是阴极,该极上发生得电子的还原反应;
(3)根据电极反应式结合电子守恒来计算;
(4)根据电极反应式结合电子守恒来计算.(1)燃料电池中氧气为正极反应物,燃料为负极反应物,与原电池的负极相连为阴极,则M与负极相连为阴极;
故答案为:正;阴;
(2)燃料电池的正极上是氧气发生得电子的还原反应,电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,所以N是阳极,该极上电极反应为:2H2O-4e-=O2↑+4H+,故答案为:2H2O-4e-=O2↑+4H+;
(3)乙池中M电极析出金属铜6.4g,根据电极反应:Cu2++2e-=Cu,析出金属铜6.4g即0.1mol,转移电子的物质的量是0.2mol,在燃料电池的正极上发生电极反应:
O2+2H2O+4e-=4OH-,当转移电子的物质的量是0.2mol时,消耗氧气的物质的量是0.05mol,体积是0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)乙池中发生的反应分别是:阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,2H++2e-=H2↑,100mL3.00mol•L-1的CuSO4溶液中铜离子物质的量是:0.3mol,铜离子得电子的是0.6mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+0.6=4n,解得n=0.3,即装置在转移电子的物质的量是1.2mol,乙醇燃料电池的负极上发生反应:C2H6O+16OH--12e-=2CO32-+11H2O,当转移电子是1.2mol,消耗乙醇的物质的量是0.1mol,质量是0.1mol×46g/mol=4.6g,
故答案为:4.6.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理和电解池原理的应用,注意根据串联电路中转移的电子的物质的量相等结合电极方程式计算分析,题目难度中等.1年前查看全部
- 乙醇燃料电池的电极反应式,电解质分别为H2SO4,KOH,O2-
 lllya1年前0
lllya1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1直角三角形ACB中,BC的垂直平分线DE交于点D,交AB于点E,点F在DE的延长线上,且AF=CE,问ACEF是平行四边
- 2告诉自己,我能行 作文
- 3在家庭电路中,当家用电器全部使用时
- 4Janet is a good singer.Janet is only a normal dancer.(compou
- 5下列有关酶的说法,哪一项正确( )
- 6Mom and Dad arrived back from vacation a day earlier 小题1:___
- 7用两个单词说宝贝你做的很好 用英语怎么说?
- 8美的CFXB型“220V 440W”电饭煲的原理如图所示,它有高温烧煮和焖饭保温两挡,其铭牌如下表所示。
- 9教科版四年级下册语文日积月累 三分钟内谢谢
- 10两个数的乘积是0.75,和是2,这两个数的差是多少?
- 11孤独的女孩变身记 作文
- 12活字印刷 沈括第一段介绍了雕版印刷的历史,这段文字有什么作用
- 13下列实验操作与预期实验目的或所得实验结论一致的是( )
- 14《繁星》读后感
- 15因为一词在古文中的意思
