MDEA脱碳溶液腐蚀的原因是什么
 zzcc10202022-10-04 11:39:542条回答
zzcc10202022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 xf1983 共回答了13个问题
xf1983 共回答了13个问题 |采纳率92.3%- 因为所吸收的水和CO2及少量的H2S,形成酸性溶液,产生腐蚀性主要有下列腐蚀机理:1.R2NH-H2S-CO2-H2O腐蚀:腐蚀主要是由CO2引起的,游离的或化合的CO2均能引起腐蚀,严重的腐蚀发生于有水的高温段部位(90℃以上),如再...
- 1年前
 524sdf87sdf 共回答了11个问题
524sdf87sdf 共回答了11个问题 |采纳率90.9%- 腐蚀的原因很多的,如液体中降解产物多,溶液中杂质增多,气体中带入某些易腐蚀物质等。我车间前两年就一直被这个困扰,现在已经解决了
- 1年前
相关推荐
- 截面尺寸较大的弹簧钢中常含Si、Mn元素,其主要目的是:A.提高淬透性 B.细化晶粒 C.减少脱碳倾向 D.减小
 青蜈蚣1年前1
青蜈蚣1年前1 -
 小桥流水9 共回答了15个问题
小桥流水9 共回答了15个问题 |采纳率66.7%A1年前查看全部
- 炼钢不是要脱碳吗?怎么沸腾钢、镇静钢和半镇静钢都在讲怎样脱氧?
 lfddq1年前1
lfddq1年前1 -
 恶丫头 共回答了17个问题
恶丫头 共回答了17个问题 |采纳率94.1%脱碳只要往铁水里充氧并保温足够的时间,让C和O反应变成气体出去就行了.但多余O和其他金属元素反应后产生的物质才是麻烦的东东,所以一般在讲这部分时都在讲如何脱氧.1年前查看全部
- 火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为______.
(2)脱碳.将CO2转化为甲醇:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H3
①在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:0~10min内,氢气的平均反应速率为______mol/(L•min);第10min后,保持温度不变,向该密闭容器中再充入1mol CO2(g)和1mol H2O(g),则平衡______(填“正向”、“逆向”或“不”)移动.
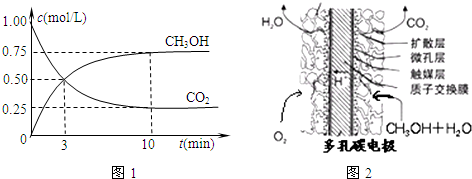
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL某NaCl溶液,正极反应式为______.在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为______mol.
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3______0(填“>”、“<”或“=”).
(3)脱硫.燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵.硫酸铵水溶液呈酸性的原因是______(用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)______c(NH3•H2O).(填“>”、“<”或“=”) 可爱木炭火锅1年前1
可爱木炭火锅1年前1 -
 魇之灵 共回答了14个问题
魇之灵 共回答了14个问题 |采纳率85.7%解题思路:(1)根据盖斯定律,利用已知化学反应方程式乘以某个系数相加或相减,构造出目标化学反应方程式,该化学反应的焓变即为已知化学反应方程式的焓变乘以某个系数相加或相减得到.
(2)①先根据图表,利用v=[△c/△t] 计算v(CO2),再利用各物质的反应速率之比等于计量数之比,确定v(H2);该温度下该反应的K=
,并据此判断;c(CH3OH)c(H2O) c(CO2)c3(H2)
②在甲醇燃料电池中,在正极放点的为氧气,结合酸性的电解质溶液,即写出正极反应;NaCl溶液的pH值变为13,即可求出电解池中放电的H+的物质的量为0.03mol,即电解池的阴极得0.03mol电子,根据流经四个电极的电量相等,从而得出消耗甲醇的量.
③由图可知最高点反应到达平衡,到达平衡后,温度越高,φ(CH3OH)越小,升高平衡向逆反应进行,据此判断;
(3)(NH4)2SO4为强酸弱碱盐,水解显酸性.滴人NaOH溶液至溶液呈中性,根据物料守恒和电荷守恒列式即得出Na+和NH3•H2O浓度的关系.(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加除2,可得
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol
(2)①由图可知,10min时,反应已经达平衡,△c(CO2)=1.00mol/L-0.25mol/L=0.75mol/L,所以10min内,v(CO2)=
△c(CO2)
△t=[0.75mol/L/10min]=0.075mol/(L•min),反应速率之比等于计量数之比,故v(H2)=3v(CO2)=3×0.075mol/(L•min)=0.225mol/(L•min),
∵根据图象可知:c(CO2)平衡=0.25mol/L,c(CH3OH)平衡=0.75mol/L,因为CO2的起始浓度为1mol/L而加入的物质的量为1mol,所以可知容器的体积为1L,再根据反应CO2(g)+3H2(g) CH3OH(g)+H2O可求得,c(H2)平衡=[3mol/1L]-3×0.75=0.75mol/L,c(H2O)平衡=c(CH3OH)平衡=0.75mol/L,
CH3OH(g)+H2O可求得,c(H2)平衡=[3mol/1L]-3×0.75=0.75mol/L,c(H2O)平衡=c(CH3OH)平衡=0.75mol/L,
该温度下该反应的K=
c(CH3OH)c(H2O)
c(CO2)c3(H2)=[0.75mol/L×0.75mol/L
0.25mol/L×(0.75mol/L)3=
16/3],保持温度不变,
向该密闭容器中再充入1mol CO2(g)和1mol H2O(g)时,比值
c(CH3OH)c(H2O)
c(CO2)c3(H2)=[0.75mol/L×1.75mol/L
1.25mol/L×(0.75mol/L)3=
112/45]<[16/3],所以平衡要向正反应方向移动,
故答案为:0.225;正向;
②在甲醇燃料电池(电解质溶液为稀硫酸)中,正极发生还原反应,即O2放电,根据电解质溶液为酸性溶液,得出正极反应为:O2+4e-+4H+=2H2O;
NaCl溶液的pH值变为13,即得出△n(OH-)=(10-1-10-7)×0.3L=0.03mol=△n(H+),根据电解池中阴极的电极反应2H++2e-=H2↑可知:
电解池的阴极得0.03mol电子.而流经四个电极的电量相等,根据燃料电池的负极反应CH3OH-6e-+H2O=CO2+6H+可知CH3OH~6e-,故失0.03mol电子时消耗0.005mol甲醇.
故答案为:O2+4e-+4H+=2H2O; 0.005
③由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,说明升高温度平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0,故答案为:<;
(3)(NH4)2SO4为强酸弱碱盐,NH4+水解显酸性:NH4++H2O NH3•H2O+H+
NH3•H2O+H+
向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,根据电荷守恒可得:C(NH4+)+C(Na+)+C(H+)=C(OH-)+2C(SO42-) ①
根据物料守恒列式可得:C(NH4+)+C(NH4•H2O)=2C(SO42-) ②
将①②联立即得:C(Na+)=C(NH4•H2O),
故答案为:NH4++H2O NH3•H2O+H+;=
NH3•H2O+H+;=点评:
本题考点: 热化学方程式;化学电源新型电池;反应速率的定量表示方法;化学平衡的影响因素;离子浓度大小的比较.
考点点评: 本题考查了热化学方程式的书写、平衡的移动以及平衡常数的计算、原电池和电解池等内容,综合性较强,难度较大.1年前查看全部
- 转炉炼钢过程中,氧枪喷吹氧气,进行脱碳 造渣.同时氧气会不会把铁水中铁给氧化了?
 lkxzvcjlk23jlkfa1年前1
lkxzvcjlk23jlkfa1年前1 -
 房山山人 共回答了22个问题
房山山人 共回答了22个问题 |采纳率95.5%会,在吹炼初期与末期都会有铁的氧化,量的大小取决于终点碳含量,碳低则量大,因此尽量高拉碳.1年前查看全部
- 煤油能用来渗碳吗?用煤油擦洗金属,可以防止热处理时金属脱碳么?有渗碳效果没?
 yuyoubao1年前1
yuyoubao1年前1 -
 山城胡子 共回答了18个问题
山城胡子 共回答了18个问题 |采纳率88.9%擦洗没效果的,渗碳可用煤油的.1年前查看全部
- 脱碳层的金相是什么样子?
 wle沙沙1年前1
wle沙沙1年前1 -
 王的麻子 共回答了23个问题
王的麻子 共回答了23个问题 |采纳率95.7%脱过碳的组织没有碳化物,所以组织是很白的,在显微镜下是亮白色,由脱碳层往里半脱碳层到芯部组织组件增加黑色的碳化物.1年前查看全部
- 炼钢是铁水氧化脱碳的过程,铁水含碳量与冶炼时间有一定关系,现将某炼钢炉所练的10炉钢的钢水含碳量X与冶
炼钢是铁水氧化脱碳的过程,铁水含碳量与冶炼时间有一定关系,现将某炼钢炉所练的10炉钢的钢水含碳量X与冶
时间Y的数据记录如下,求Y对X的回归方程,相关系数病检验回归效果(取a=0.01)
含碳量X(0.01X%)180 134 204 150 121 147 165 116 151 170
冶炼时间Y(分) 200 135 235 170 125 155 195 100 180 185 右手遮住了左脸1年前1
右手遮住了左脸1年前1 -
 智慧雪 共回答了17个问题
智慧雪 共回答了17个问题 |采纳率88.2%时间Y的数据记录如下,求Y对X的回归方程,相关系数病检验回归效果(取a=0.01)
含碳量X(0.01X%)180 134 204 150 121 147 165 116 151 170
冶炼时间Y(分) 200 135 235 170 125 155 195 100 180 1851年前查看全部
- 生铁用什么方法脱碳成钢?
 小愣儿1年前1
小愣儿1年前1 -
 Christopherist 共回答了17个问题
Christopherist 共回答了17个问题 |采纳率88.2%生铁炼钢是一个氧化过程,其基本原理是,在高温下,利用氧气与生铁水中的碳发生反应,生成二氧化碳或一氧化碳气体,从而使铁水中的含碳量降低,来达到脱碳的目的.
具体反应式:[C]+(O2)=(CO2)↑ 或2[C]+(O2)=2(CO )↑
注:方括号表示铁水中;圆括号表示气体.
因此,炼钢的过程实质是一个生铁水氧化脱碳的过程.也可以看出,含碳量越低的钢冶炼时间也就越长.1年前查看全部
- 火力发电厂产生大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可
火力发电厂产生大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为______.
(2)脱碳.将CO2转化为甲醇的化学方程式为: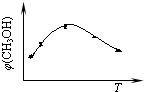
CO2+3H2 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,tmin后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述合成甲醇的反应的逆反应为______反应(填“放热”或“吸热”).
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度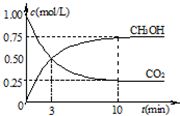 随时间变化如图所示.下列说法正确的是______
随时间变化如图所示.下列说法正确的是______
A.10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol•L-1
B.0~10min内,氢气的平均反应速率为0.075mol•L-1•min-1
C.达到平衡时,氢气的转化率为75%
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)减小
③能说明CO2(g)+3H2(g) CH3OH(g)+H2O(g)达到平衡状态的是______
CH3OH(g)+H2O(g)达到平衡状态的是______
A.生成甲醇的速率与生成水的速率相等
B.v(H2)=3v(CH3OH)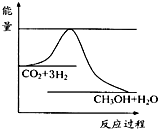
C.恒容容器中,体系的压强不再改变
D.恒容容器中,混合气体密度不再发生改变
④右图表示反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是______.
CH3OH(g)+H2O(g)进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,达到平衡后,采取下列措施中能使c(CH3OH)增大的是______.
A.使用新高效催化剂B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来D.再充入1mol CO2和3mol H2
⑤甲醇燃料电池结构如图所示,其工作时正极的电极反应式可表示为______.
(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.
硫酸铵溶液的pH<7,其原因为:______(用离子方程式表示);在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)______c(NO3-)(选填“大于”、“等于”或“小于”) kerr-com1年前1
kerr-com1年前1 -
 weihe1983 共回答了22个问题
weihe1983 共回答了22个问题 |采纳率95.5%解题思路:(1)根据已知反应和目标反应及盖斯定律来计算反应热,并书写热化学反应方程式;
(2)①由图可知,最高点以后随温度的升高,甲醇的体积分数减小,则正反应为放热反应;
②根据化学平衡的三段法计算来分析;
③根据化学平衡的特征“等”与“定”来分析;
④能使c(CH3OH)增大,则化学平衡应正向移动,以此来分析;
⑤甲醇燃料电池中,负极为甲醇,正极为氧气,正极发生还原反应;
(3)硫酸铵溶液的pH<7,利用盐类水解来分析;硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,利用电荷守恒来分析离子浓度的关系.(1)由①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1,
根据盖斯定律可知,[①+②/2]可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),
则△H=
△H1+△H2
2=-867 kJ/mol,
即热化学反应方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①由图可知,最高点以后随温度的升高,甲醇的体积分数减小,则正反应为放热反应,则该反应的逆反应为吸热反应,
故答案为:吸热;
②CO2+3H2 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始 1 3 0 0
转化0.75 2.25 0.75 0.75
平衡 0.25 0.75 0.75 0.75
A.10min后,向该密闭容器中再充入1mol CO2和3molH2,化学平衡正向移动,则再次达到平衡时
c(CH3OH)>1.5mol•L-1,故A错误;
B.0~10min内,氢气的平均反应速率为[2.25mol/L/10min]=0.225mol•L-1•min-1,故B错误;
C.达到平衡时,氢气的转化率为[2.25mol/L/3mol/L]×100%=75%,故C正确;
D.该温度下,反应的平衡常数的值为[0.75×0.75/0.25×0.75]=3,故D错误;
E.该反应为放热反应,升高温度化学平衡逆向移动,则将使n(CH3OH)/n(CO2)减小,故E正确;
故答案为:CE;
③A.生成甲醇的速率与生成水的速率相等,只能说明正反应的关系,无法确定正逆反应速率的关系,故A错误;
B.由v(H2)=3v(CH3OH)可知,反应速率之比等于化学计量数之比,但无法确定是否达到平衡,故B错误;
C.该反应为反应前后体积不等的反应,则在恒容容器中,体系的压强不再改变,化学反应达到平衡,故C正确;
D.恒容容器中,混合气体密度不再发生改变,因质量与体积始终不变,则密度一直不变,不能作为判断平衡的方法,故D错误;
故答案为:C;
④A.使用新高效催化剂,化学平衡不移动,则c(CH3OH)不变,故A错误;
B.充入He(g),使体系压强增大,但体积不变,反应体系中的浓度不变,化学平衡不移动,故B错误;
C.将H2O(g)从体系中分离出来,能使化学平衡正向移动,使c(CH3OH)增大,故C正确;
D.再充入1mol CO2和3molH2,压强增大,化学平衡正向移动,则c(CH3OH)增大,故D正确;
故答案为:CD;
⑤甲醇燃料电池中,正极为氧气,正极发生还原反应,则正极反应式为O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
(3)由题意可知,硫酸铵溶液的pH<7,硫酸铵为强酸弱碱盐,则铵根离子水解显酸性,水解离子反应为NH4++H2O NH3•H2O+H+,
NH3•H2O+H+,
硝酸铵溶液中滴加适量的NaOH溶液,由电荷守恒可知,c(NH4+)+c(Na+)+c(H+)=c(NO3-)+c(OH-),而pH=7,则c(H+)=c(OH-),
所以c(NH4+)+c(Na+)=c(NO3-),即c(Na+)<c(NO3-),故答案为:NH4++H2O NH3•H2O+H+;小于.
NH3•H2O+H+;小于.点评:
本题考点: 用盖斯定律进行有关反应热的计算;吸热反应和放热反应;化学电源新型电池;化学平衡的影响因素;化学平衡状态的判断.
考点点评: 本题综合性强,难度较大,主要考查反应热、化学平衡、原电池、盐类水解等知识,注重对高考考点的考查,(2)为学生解答的难度和易错点.1年前查看全部
- 奥氏体不锈钢与珠光体耐热钢钢焊接时,在什么上会形成脱碳层?
 tybjxr1年前1
tybjxr1年前1 -
 被爱而蓝 共回答了21个问题
被爱而蓝 共回答了21个问题 |采纳率95.2%奥氏体钢和珠光体钢组成的焊接接头中,由于珠光体钢的含碳量较高,但合金元素含量较少(主要指碳化物形成元素),而奥氏体钢则相反,这样在熔合区珠光体钢一侧的碳和碳化物形成元素含量差.当接头在温度高于350~400℃长期工作时,熔合区便出现明显的碳的扩散,即碳从珠光体钢一侧通过熔合区向奥氏体焊缝扩散.结果,在靠近熔合区的珠光体钢母材上形成了一层脱碳软化层,在奥氏体焊缝一侧产生了增碳硬化层.1年前查看全部
- 火力发电厂释放出大量的氮氧化物(NO x )、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处
火力发电厂释放出大量的氮氧化物(NO x )、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NO x :
CH 4 (g)+4NO 2 (g)=4NO(g)+CO 2 (g)+2H 2 O(g)△H 1 =-574kJ•mol -1
CH 4 (g)+4NO(g)=2N 2 (g)+CO 2 (g)+2H 2 O(g)△H 2 =-1160kJ•mol -1
甲烷直接将NO 2 还原为N 2 的热化学方程式为______.
(2)脱碳.将CO 2 转化为甲醇的热化学方程式为:CO 2 (g)+3H 2 (g)═CH 3 OH(g)+H 2 O(g)△H 3
①取五份等体积的CO 2 和H 2 的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH 3 OH) 与反应温度T的关系曲线如图1所示,则上述CO 2 转化为甲醇的反应的△H 3 ______0(填“>”、“<”或“=”).
②在一恒温恒容密闭容器中充入1mol CO 2 和3mol H 2 ,进行上述反应.测得CO 2 和CH 3 OH(g)的浓度随时间变化如图2所示.试回答:0~10min内,氢气的平均反应速率为______mol/(L•min);该温度下,反应的平衡常数的值为______;第10min后,向该容器中再充入1mol CO 2 和3mol H 2 ,则再次达到平衡时CH 3 OH(g)的体积分数______(填变大、减少、不变).
(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.硫酸铵和硝酸铵的水溶液的pH<7,其原因用离子方程式表示为______;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na + )+c(H + )______c(NO 3 - )+c(OH - )(填写“>”“=”或“<”) 刺鸟腹语录1年前1
刺鸟腹语录1年前1 -
 天天6170 共回答了23个问题
天天6170 共回答了23个问题 |采纳率95.7%(1)已知:①CH 4 (g)+4NO 2 (g)=4NO(g)+CO 2 (g)+2H 2 O(g)△H 1 =-574kJ•mol -1 ②CH 4 (g)+4NO(g)=2N 2 (g)+CO 2 (g)+2H 2 O(g)△H 2 =-1160kJ•mol -1 则CH 4 (g)+2NO 2 (g)=N 2 ...1年前查看全部
- 高中化学一道题中 “烟气喷按脱碳技术,喷淋氨水吸收过量co2的产物NH4HCO3与过量NAOH溶液供共热产生的气体可循环
高中化学
一道题中 “烟气喷按脱碳技术,喷淋氨水吸收过量co2的产物NH4HCO3与过量NAOH溶液供共热产生的气体可循环使用,其离子方程式”
答案是 NH4+HCO3+2OH-=NH3+CO32-+2H20
这样写不行么?2NH4+2HCO3+20H-=2NH3+3H2O+CO32-+CO2
 xxxhhh99991年前1
xxxhhh99991年前1 -
 暗暗2903 共回答了20个问题
暗暗2903 共回答了20个问题 |采纳率85%写离子方程式的时候要看准"过量'这样的字眼.
谁的量少,谁的系数就肯定是1(反正先按它的系数是1来写,如果发现写出来后有分数再乘东西)
那么NH4+ 和HCO3-的系数都是1了. 1个OH-跟NH4+反应 另一个跟HCO3-反应
就只能写成NH4+HCO3+2OH-=NH3+CO32-+2H20
而且你写的方程式也有错误吖....OH-跟HCO3-反应怎么可能...1年前查看全部
- 火力发电厂释放出的大量氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃烧废气进行脱硝、脱碳和脱硫等处理,
火力发电厂释放出的大量氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃烧废气进行脱硝、脱碳和脱硫等处理,可实验绿色环保、节能减排、废物利用.
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为______.
(2)脱碳:将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0
T℃时,取2mol CO2和4mol H2混合,加入到1L恒容密闭容器中,发生上述反应,10分钟后达到平衡时测得甲醇的体积分数为25%,计算氢气的转化率______.T℃时该反应的化学平衡常数K=______;升高温度,K______.(选填“增大”“减小”“不变”)
(3)脱硫:某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物.设烟气中SO2、NO2的物质的量为1:1,写出该反应的化学方程式(不要求配平)______.将生成的硫酸铵和硝酸铵的混合物溶解于水,室温下测得溶液的pH小于7,其原因是______. 过年去媳妇1年前1
过年去媳妇1年前1 -
 XIAYE1994 共回答了15个问题
XIAYE1994 共回答了15个问题 |采纳率93.3%解题思路:(1)根据盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关.
(2)根据化学平衡计算三步曲,求出参加反应氢气的物质的量,计算氢气的转化率;根据化学平衡常数概念,代入数据,求出常数;根据温度对对化学平衡的影响.
(3)根据题目信息,抓住质量守恒,写出化学方程式;考虑盐类的水解.(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加,可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
故答案为:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
(2)CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0
起始(mol) 2 4 0 0
反应(mol) X3X XX
10分钟后(mol) 2-X 4-3X X X
甲醇的体积分数为[X/2-X+4-3X+X+X]×100%=25%可得:X=1
所以氢气的转化率为:[3/4]×100%=75%,
平衡常数K=
C(CH3OH)C(H2O)
C(CO2)C3( H2) =[1×1/1×1]=1
升高温度,平衡向吸热的方向移动,即逆向移动,K减小.
故答案为:75%;1;减小;
(3)由题目信息可知反应为NH3、O2、SO2、NO2、H2O,生成物为(NH4)2SO4、NH4NO3,
由此可写出方程式为NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3,
故答案为:NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3
(4)因铵盐要发生水NH4++H2O NH3•H2O+H+,故答案为:NH4++H2O
NH3•H2O+H+,故答案为:NH4++H2O NH3•H2O+H+
NH3•H2O+H+
点评:
本题考点: 二氧化硫的污染及治理;热化学方程式;化学平衡的计算;氮的氧化物的性质及其对环境的影响.
考点点评: 本题从多个角度对化石燃料进行了全面的考查,培养了学生分析问题的能力.1年前查看全部
- 钢淬火加热温度不够会造成( ).A、氧化 B、脱碳 C、硬度偏低 D、变形
 modo1231年前1
modo1231年前1 -
 忍顾花丛半缘道 共回答了19个问题
忍顾花丛半缘道 共回答了19个问题 |采纳率73.7%C、硬度偏低1年前查看全部
- 高中范围内,下列反应方程式侯式制碱法炼钢的脱碳脱硫反应热还原法制镁精制饱和食盐水:钙镁铁硫酸根离子煤的液化泡沫灭火器反应
高中范围内,下列反应方程式
侯式制碱法
炼钢的脱碳脱硫反应
热还原法制镁
精制饱和食盐水:钙镁铁硫酸根离子
煤的液化
泡沫灭火器反应
混凝法净水
钢铁生锈 iom_xd3b_ve688f1年前4
iom_xd3b_ve688f1年前4 -
 进士 共回答了19个问题
进士 共回答了19个问题 |采纳率94.7%1第一步:CO2 + NH3 + NaCl + H2O = NaHCO3 + NH4Cl
第二部:NaHCO3 (加热)=Na2CO3 + CO2↑+ H2O
2炼钢主要是用氧化剂把生铁里过多的碳和其它杂质氧化而除去,常用的氧化剂:空气、氧气或氧化铁,降低碳量:C+FeO==CO+Fe-热量;
脱硫:炉渣脱硫
气化去硫:3(Fe2O3)+CaS=CaO+6(FeO)+SO2↑
3碳热还原:MgO+C=Mg+CO
4加入足量NaCO3,去沉淀,之后加入BaCl2,去沉淀,之后蒸馏使其饱和(这个不一定对)
5直接液化
间接液化:高温液化、低温液化
6、Al2(SO4)3+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑
7混凝法:在混凝剂的作用下,使废水中的胶体和细微悬浮物凝聚成絮凝体,然后予以分离除去的水处理法.
8在潮湿的空气中:4Fe + 3O2 + XH2O ==== 2Fe2O3·XH2O
铁的缓慢氧化:4Fe+3O2=2Fe2O31年前查看全部
- 关于轧钢技术计算题,计算最大脱碳速度和脱碳所需氧气量(设氧气利用系数为95%).具体如下面——
关于轧钢技术计算题,计算最大脱碳速度和脱碳所需氧气量(设氧气利用系数为95%).具体如下面——
100吨氧气顶吹转炉,氧气流量FO2=12000NM3/h,铁水含C4.3%,废钢比为20%,废钢中C Si Mn含量忽略不计,吹炼终点时[C]为0.1%,吹炼过程中90%的碳氧化成CO,10%的碳氧化成CO2,计算最大脱碳速度和脱碳所需氧气量(设氧气利用系数为95%). 冰63631年前1
冰63631年前1 -
 ajeff 共回答了17个问题
ajeff 共回答了17个问题 |采纳率88.2%(1)设100Kg金属料W[C]=4.3%生成CO消耗氧气量为xKg,生成CO2消耗氧气量为yKg.
[C]+1/2{O2}={CO}
12 16
100×90%×(4.3-0.1)% x
x=100×90%×4.2%×16/12=5.04Kg
[C]+{O2}={CO2}
12 32
100×10%×(4.3-0.1)% y
y=100×10%×4.2%×32/12=1.12Kg
脱碳总氧气消耗量:100×(1-20%)×10×(5.04+1.12)/95%=5187.3 Kg
(2)转炉吹炼中期供氧气全部用于脱碳生成CO,此时脱碳速度最大
[C]+1/2{O2}={CO}
12 16
500mol(11.2 Nm3) O2可氧化1000mol C(12kg),则每1Nm3氧气可氧化C为:
95%×12/11.2=1.108kg/Nm3
已知FO2=12000NM3/h,脱碳量为1.108×12000=12220(kg/h)
钢水量为100吨,脱碳速度为:
12220/100/1000/60=0.2%/min1年前查看全部
- 火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
甲烷直接将NO2还原为N2的热化学方程式为______.
(2)脱碳.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H3<0
①在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.下列说法正确的是______(填字母代号).
A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol•L-1
B.0~10min内,氢气的平均反应速率为0.075mol/(L•min)
C.达到平衡时,氢气的转化率为75%
D.该温度下,反应的平衡常数的值为[3/16]
E.升高温度将使
减小n(CH3OH) n(CO2)
②甲醇燃料电池结构如图2所示.其工作时正极的电极反应式可表示为:______.
(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表为:______;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+)______c(NO3-)+c(OH-)(填写“>”“=”或“<”). 冷月心蓝1年前1
冷月心蓝1年前1 -
 25只蜜蜂 共回答了20个问题
25只蜜蜂 共回答了20个问题 |采纳率95%解题思路:(1)利用盖斯定律分析;
(2)①A、再充入1mol CO2和3mol H2,可等效为开始体积变为原来的2倍,加入2mol CO2和6mol H2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大;
B、利用v=[△n/△t]计算v(H2)判断;
C、根据转化率的定义计算判断;
D、该温度下该反应的K=
,代入数据计算;[CH3OH][H2O] [CO2][H2]3
E、该反应为放热反应,升高温度平衡向逆反应进行,n(CH3OH)减小,n(CO2)增大.
②正极上氧化剂得电子发生还原反应;
(3)强酸弱碱盐易水解而使其溶液呈酸性,根据电荷守恒判断.(1)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加,可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
即CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1;
(2)①由图2可知,开始二氧化碳的浓度为1.0mol/L,开始容器中充入1mol CO2和3mol H2,所以开始氢气的浓度为3.0mol/L,容器体积为[1.0mol/1.0mol/L]=1L.
平衡时,甲醇的浓度为0.75mol/L
CO2(g)+3H2(g)
一定条件
CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.250.75 0.75
平衡(mol/L):0.25 0.750.75 0.75
A、通过上述计算可知二氧化碳的转化率为[0.75mol/L/1.0mol/L]×100%=75%,再充入1mol CO2和3mol H2,可等效为开始体积变为原来的2倍,加入2mol CO2和6mol H2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大,所以再次达到平衡时c(CH3OH)>1.5mol/L,故A错误;
B、10分钟内,氢气的平均反应速率为v(H2)=[2.25mol/L/10min]=0.225mol/(L•min),故C错误;
C.通过上述计算可知氢气的转化率为[2.25mol/L/3mol/L]×100%=75%,故C正确;
D、该温度下该反应的K=
[CH3OH][H2O]
[CO2][H2]3=[0.75×0.75
0.25×(0.75)3=
16/3],故D错误;
E、该反应为放热反应,升高温度平衡向逆反应进行,n(CH3OH)减小,n(CO2)增大,所以n(CH3OH)/n(CO2)值减小,故E正确.
故选:CE;
②正极上氧气得电子和氢离子反应生成水,所以电极反应式为:O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
(3)硫酸铵和硝酸铵都是强酸弱碱盐,铵根离子易水解而使其溶液呈酸性,水解离子方程式为:NH4++H2O⇌NH3•H2O+H+,溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,则c(Na+)+c(H+)+c(NH4+)=c(NO3-)+c(OH-),所以c(Na+)+c(H+)<c(NO3-)+c(OH-),
故答案为:NH4++H2O⇌NH3•H2O+H+;<.点评:
本题考点: 二氧化硫的污染及治理;热化学方程式;化学电源新型电池;化学平衡建立的过程;氮的氧化物的性质及其对环境的影响.
考点点评: 本题考查了盖斯定律、原电池原理、化学平衡、盐类水解等知识点,难点是化学平衡的有关计算,有关化学平衡的计算是考试热点,难度中等.1年前查看全部
- 钎焊炉氮气保护气体钎焊会造成脱碳吗
钎焊炉氮气保护气体钎焊会造成脱碳吗
保护气体是氮气氢气,会造成碳流失吗 ym6091年前1
ym6091年前1 -
 蓝水木 共回答了12个问题
蓝水木 共回答了12个问题 |采纳率83.3%最好是用纯度是99.999%以上的氮气,含水量小于零下60摄氏度,整套设备有99.9%的PSA制氮机和加碳脱氧纯化,可达到理想效果,加氢从成本和安全角度不可取,氨分解的氮气指标达不到使用要求.1年前查看全部
- 炼钢不是要脱碳吗?怎么沸腾钢、镇静钢和半镇静钢都在讲怎样脱氧啊?
 珠儿01年前1
珠儿01年前1 -
 songwangwei 共回答了16个问题
songwangwei 共回答了16个问题 |采纳率87.5%炼钢的主要任务,以下几点:
1.四脱.脱 C O S P
2.二去.去杂质,去气体
3.二调.调成分,调温度1年前查看全部
大家在问
- 1动物分成几类?
- 2蚂蚁的触角形状
- 3(2004•防城港)用秸秆作源料来生产一次性饭盒、碗、筷,既可减缓用“焚烧还田”的方法处理大量秸秆给环境带来的负面影响,
- 4easy to the peasy求翻译
- 5把图中的三角形绕a点顺时针旋转90度,再向下平移6格,画出这个三角形.
- 6根据你听到的内容,选择正确的汉语意思。 ( ) 1. A. 那个房间里有
- 7为什么I'm sorry,but是固定词组
- 8已知等比数列{an}的公比是2,a3=3,则a5的值是______.
- 9谁来帮我连词成句啊,1.a,long,climb,it's,but,to,the,top,well,worth,the,
- 10设函数f(x)=sin(2x+4分之派)求函数的增区间
- 11星期一早晨,王老师走进教室,发现教室里的桌椅都修好了.有人告诉老师,是许丙、李平、刘成、张明
- 12step out onto the track 造两个句子 好急的 谢谢 在线等
- 13Look at the picture and fill i
- 14这有什么关系呢?改成陈述句
- 151÷6X=2÷9(126-X)-7
