制革工业用熟石灰给毛皮脱毛,剩余的熟石灰用盐酸来中和的化学方程式
 隐居士20062022-10-04 11:39:541条回答
隐居士20062022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 跳舞的卡门 共回答了19个问题
跳舞的卡门 共回答了19个问题 |采纳率89.5%- Ca(OH)2+2HCl=CaCl2+2H2O
满意请采纳 - 1年前
相关推荐
- 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr 3 + ,其次是Fe 3 + 、Al 3 + 、Ca 2 + 和Mg 2 + 。
(1)实验室用18.4 mol·L - 1 的浓硫酸配制250 mL 4.8 mol·L - 1 的H 2 SO 4 溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需_______________________ _。
(2)酸浸时,为了提高浸取率可采取的措施有_____________________________
______________________________________________________(答出两点)。
(3)H 2 O 2 的作用是将滤液Ⅰ中的Cr 3 + 转化为Cr 2 O 7 2 — ,写出此反应的离子方程式:_____________________________________________________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:阳离子 Fe 3 + Mg 2 + Al 3 + Cr 3 + 开始沉淀时的pH 2.7 - - - 沉淀完全时的pH 3.7 11.1 8 9(>9溶解)
加入NaOH溶液使溶液呈碱性,Cr 2 O 7 2 — 转化为CrO 4 2 — 。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_________________________。
(5)钠离子交换树脂的反应原理为M n + +nNaR―→MR n +nNa + ,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是_______________________________。
(6)写出上述流程中用SO 2 进行还原时发生反应的化学方程式:__________________________________________________。 LHJAMES151年前1
LHJAMES151年前1 -
 鬼堂院公主 共回答了17个问题
鬼堂院公主 共回答了17个问题 |采纳率70.6%(1)250 mL容量瓶、胶头滴管
(2)升高反应温度、增大固体颗粒的表面积、加快搅拌速度等(答两点即可)
(3)2Cr 3 + +3H 2 O 2 +H 2 O===Cr 2 O 7 2 — +8H +
(4)Na + 、Mg 2 + 、Ca 2 + pH超过8会使部分Al(OH) 3 溶解生成AlO 2 — ,最终影响Cr(Ⅲ)的回收与再利用
(5)Ca 2 + 、Mg 2 +
(6)3SO 2 +2Na 2 CrO 4 +12H 2 O===2CrOH(H 2 O) 5 SO 4 ↓+Na 2 SO 4 +2NaOH
(1)结合一定物质的量浓度的溶液的配制步骤即可写出缺少的玻璃仪器,注意容量瓶必须注明规格。(4)加入NaOH溶液调节pH=8,Fe 3 + 、Al 3 + 以Fe(OH) 3 、Al(OH) 3 形式沉淀下来,溶液中还有Mg 2 + 、Ca 2 + 及加入的Na + 。(5)运用钠离子交换树脂的目的是除去滤液Ⅱ中的Mg 2 + 、Ca 2 + 。1年前查看全部
- 光气(COCl2)在塑料、制革、制药等工业中有许多用途,COCl2的分解反应为:
光气(COCl2)在塑料、制革、制药等工业中有许多用途,COCl2的分解反应为:
COCl2(g)⇌Cl2(g)+CO(g)△H=+108KJ•mol-1
该反应在密闭容器中各物质的浓度随时间的变化如下图所示:
下列叙述中,正确的是( )
A. 反应在8 min时的平衡常数小于2 min时的平衡常数
B. COCl2的平均反应速率
<1V(2min~4min) V(8min~10min)
C. 该反应在13 min时与8 min时比较,气体的平均相对分子质量减小
D. 与10 min时相比,10 min后的CO气体物质的量减少 tmsxjc1年前1
tmsxjc1年前1 -
 杰王子 共回答了24个问题
杰王子 共回答了24个问题 |采纳率87.5%解题思路:A、根据图象可知2min、8min都处于平衡状态,根据平衡浓度计算平衡常数,据此判断;
B、根据平衡常数判断温度关系,温度越高反应速率越快;
C、由图可知,10min是改变条件,反应混合物的浓度瞬间都降低,且平衡向正反应移动,应是增大体积,降低压强,13min时处于平衡状态,反应混合物的物质的量增大;
D、10min时改变条件,是增大体积,降低压强,平衡向正反应移动.A、根据图象可知2min、8min都处于平衡状态,2min时平衡常数k=0.12×0.060.04=0.18,8min时平衡常数为0.14×0.080.02=0.56,故8min时的平衡常数大于2min时的平衡常数,故A错误;B、由A分析可知,8 min时的平衡常...
点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 本题考查化学平衡图象、平衡常数、化学平衡与反应速率的影响因素,题目难度中等,根据平衡常数与改变条件的瞬间各物质的浓度变化判断条件是解题的关键.1年前查看全部
- 12.光气(COCl2)在塑料、制革、制药等工业中有许多用途,COCl2的分解反应为:COCl2(g) Cl2(g) +
12.光气(COCl2)在塑料、制革、制药等工业中有许多用途,COCl2的分解反应为:COCl2(g) Cl2(g) + CO(g)
12.光气(COCl2)在塑料、制革、制药等工业中有许多用途,COCl2的分解反应为:
COCl2(g) Cl2(g) + CO(g)△H = +108 KJ·mol-1
该反应在密闭容器中各物质的浓度随时间的变化如下图所示:

下列叙述中,正确的是
A.反应在8 min时的平衡常数小于2 min时的平衡常数
B.COCl2的平均反应速率 v(8min)>v(13min)
C.该反应在13 min时与8 min时比较,气体的平均相对分子质量减小
D.与10 min时相比,10 min后的CO气体物质的量减少
我按比例计算C是正确的 何叶绿1年前1
何叶绿1年前1 -
 13517615043 共回答了12个问题
13517615043 共回答了12个问题 |采纳率83.3%该反应在13 min时与8 min时比较,气体的平均相对分子质量增大的
该反应在8 min时与13min时比较,气体的平均相对分子质量减小!
反应在8 min时时59 ,后13min时是53.8.
考的是语文,不是化学!1年前查看全部
- 光气(COCl 2 )在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl 2 在活性炭催化下合成。
光气(COCl 2 )在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl 2 在活性炭催化下合成。
已知COCl 2 (g) Cl 2 (g)+CO(g) ΔH=+108 kJ·mol -1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl 2 浓度变化曲线未示出):
Cl 2 (g)+CO(g) ΔH=+108 kJ·mol -1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl 2 浓度变化曲线未示出):
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl 2 )=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。 xinxincao1年前1
xinxincao1年前1 -
 xuliqun88 共回答了19个问题
xuliqun88 共回答了19个问题 |采纳率84.2%(1) 0.234 (2)<
0.234 (2)<
(3)0.031 mol·L -1 0.005 mol·L -1 ·min -1
(4)v(5~6)>v(2~3)=v(12~13)
(1)由题图示可知8 min时COCl 2 、Cl 2 、CO三种物质的浓度分别为
0.04 mol·L -1 、0.11 mol·L -1 、0.085 mol·L -1 。所以此时其平衡常数为:0.11 ×0.085 ÷0.04 =0.234。(2)第8 min时反应物的浓度比第2 min时减小,生成物浓度增大,平衡向正反应方向移动。又因为正反应为吸热反应,所以T(2)<T(8)。(4)根据图像可知反应在2~3 min和12~13 min时反应处于平衡状态,平均反应速率为0,故v(5~6)>v(2~3)>v(12~13)。1年前查看全部
- 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca 2+ 、Mg 2+ 、Fe 3+
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca 2+ 、Mg 2+ 、Fe 3+ 、Cl - 和SO 4 2- 等杂质,提纯工艺路线如下: 
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示: 
回答下列问题:
(1)滤渣的主要成分为____。
(2)“趁热过滤”的原因是____。
(3)若在实验室进行“趁热过滤”,可采取的措施是____(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是____。
(5)已知:
Na 2 CO 3 ·l0H 2 O(s)=Na 2 CO 3 (s) +10H 2 O(g) △H 1 = +532. 36kJ·mol -1
Na 2 CO 3 ·10H 2 O(s)=Na 2 CO 3 ·H 2 O(s) +9H 2 O(g) △H 2 = +473.63kJ·mol -1
写出Na 2 CO 3 ·H 2 O脱水反应的热化学方程式__________________________________。 横刀断水1年前1
横刀断水1年前1 -
 什么么都有 共回答了12个问题
什么么都有 共回答了12个问题 |采纳率91.7%(1)Fe(OH) 3 、CaCO 3 和Mg(OH) 2
(2)防止温度下降时Na 2 CO 3 ·H 2 O溶解,避免析出Na 2 CO 3 ·10H 2 O,或Na 2 CO 3 ·7H 2 O
(3)预热过滤装置
(4)产品纯度降低,因为循环使用时母液中Cl - 与SO 4 2- 累积,导致产品含或Na 2 SO 4 杂质
(5)Na 2 CO 3 ·H 2 O==Na 2 CO 3 +H 2 O △H=+58.73KJ/mol1年前查看全部
- 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料.工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和S
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料.工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下:

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:回答下列问题:
(1)滤渣的主要成分为______
(2)“趁热过滤”的原因是______.
(3)若在实验室进行“趁热过滤”,可采取的措施是______(写出一种)
(4)若“母液”循环使用,可能出现的问题及其原因是______.
(5)已知:
Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol-1;Na2CO3•10H2O(s)=Na2CO3•H2O(s)+9H2O(g)△H2=+473.63kJ•mol-1,写出Na2CO3•H2O脱水反应的热化学方程式______. wugang12931年前1
wugang12931年前1 -
 yanjintotti 共回答了20个问题
yanjintotti 共回答了20个问题 |采纳率95%解题思路:(1)因工业碳酸钠(钝度约98%)中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀;
(2)观察坐标图,温度减少至313K时发生突变,溶解度迅速减少,若不趁热过滤将析出晶体;
(3)思路方向:1.减少过滤的时间 2.保持过滤时的温度;
(4)分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响;
(5)通过观察两个热化学方程式,利用盖斯定律来计算焓变即可.(1)工业碳酸钠(钝度约98%)中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀,滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3,
故答案为:Mg(OH)2、Fe(OH)3、CaCO3;
(2)根据所给的坐标图可以发现:温度减少至313K时发生突变,溶解度迅速减少,若不趁热过滤将析出晶体,所以“趁热过滤”的原因是使析出的晶体为Na2CO3•H2O,防止因温度过低而析出Na2CO3•10H20晶体或Na2CO3•7H20晶体,使后续的加热脱水耗时长,
故答案为:使析出的晶体为Na2CO3•H2O,防止因温度过低而析出Na2CO3•10H20晶体或Na2CO3•7H20晶体,使后续的加热脱水耗时长;
(3)在实验室进行“趁热过滤”时,要注意减少过滤的时间和保持过滤时的温度,可采取的措施是用预热过滤装置(或已预热的布氏漏斗趁热抽滤,或用常压热过滤漏斗进行过滤),故答案为:用预热过滤装置(或已预热的布氏漏斗趁热抽滤,或用常压热过滤漏斗进行过滤);
(4)根据流程图内容“母液”中存在氯离子和硫酸根离子,若参与循环,将使离子浓度增大,导致产品纯度降低,故答案为:产品纯度降低;因为循环使用时母液中Cl-与SO42-浓度增大,导致产品含有NaCl或Na2SO4杂质;
(5)通过观察两个热化学方程式,利用盖斯定律,可将两式相减得到Na2CO3•H2O(S)═Na2CO3(s)+H2O(g),即Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol,
故答案为:Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题是一道综合题,考查学生分析和解决问题的能力,综合性强,难度大.1年前查看全部
- 碳酸钠是造纸、纺织、制革和生产肥皂、洗涤剂等工业的重要原料.
 碳酸钠是造纸、纺织、制革和生产肥皂、洗涤剂等工业的重要原料.
碳酸钠是造纸、纺织、制革和生产肥皂、洗涤剂等工业的重要原料.
(1)碳酸钠属于盐类,但它的俗名叫纯碱的原因是______.
(2)化学兴趣小组的同学在学习过化学反应CaCO3+CO2+H2O=Ca(HCO3)2后,提出“Na2CO3溶液是否也能与CO2发生反应”的猜想,在老师的指导下进行实验探究.
【实验目的】:探究Na2CO3溶液与CO2的反应
【查阅资料】:碳酸氢钠与氯化钙溶液反应生成碳酸钙、氯化钠、水和二氧化碳.
请写出该反应的化学方程式______
【实验装置】:如图
【实验操作步骤与现象】
①装置Ⅰ是实验室制取二氧化碳的发生装置,实验室用盐酸和大理石反应而不用硫酸和大理石反应制取CO2的原因是______
②将制取的CO2通过装置Ⅱ饱和的NaHCO3溶液的目的是______.
③使过量的CO2通过装置Ⅲ,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入氯化钙溶液.当试管中______现象时,说明Na2CO3溶液与CO2发生了化学反应,其反应的化学方程式______
【结论】:通过实验探究,Na2CO3溶液能用于CO2反应
(3)实验室用过量的稀盐酸和大理石制取CO2取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.回答下列问题:
①开始加入碳酸钠溶液至10g时,还没有沉淀生成的原因是______.
②计算滤液中氯化钙的质量分数. winowner1年前1
winowner1年前1 -
 落入海的雨滴 共回答了19个问题
落入海的雨滴 共回答了19个问题 |采纳率94.7%解题思路:(1)欲知它的俗名叫纯碱的原因,须知它的水溶液的性质.
(2)【查阅资料】:根据反应物、生成物和条件书写方程式.
【实验操作步骤与现象】
①H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生;
②用稀盐酸制取的二氧化碳中可能混有部分氯化氢气体,饱和的NaHCO3溶液与氯化氢气体可反应,除去氯化氢气体,防止进入Ⅲ与碳酸钠溶液反应,影响实验进行;
③由题意可知:氢氧化钙与碳酸钠溶液和碳酸氢钠溶液都能反应生成沉淀,现象相同,无法鉴别,所以选择氯化钙;根据是否生成气体进行区分碳酸钠溶液和碳酸氢钠溶液;并根据题目提供信息书写反应方程式.
(3)①根据稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应进行解答;
②根据沉淀的最大质量可求出原滤液中氯化钙的质量,然后根据溶质的质量分数的计算方法计算质量分数.(1)碳酸钠属于盐类,但它的俗名叫纯碱是因为碳酸钠的水溶液显碱性.
(2)【查阅资料】:碳酸氢钠与氯化钙溶液反应生成碳酸钙、氯化钠、水和二氧化碳,方程式为:2NaHCO3+CaCl2═CaCO3↓+2NaCl+H2O+CO2↑
【实验操作步骤与现象】
①H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生,所以不用硫酸和大理石反应制取CO2;
②浓盐酸易挥发,用浓盐酸制取的二氧化碳中混有氯化氢气体,饱和的NaHCO3溶液与氯化氢气体可反应,除去氯化氢气体,防止进入Ⅲ与碳酸钠溶液反应,影响实验进行;
③由题意可知:氢氧化钙与碳酸钠溶液和碳酸氢钠溶液都能反应生成沉淀,现象相同,无法鉴别,所以选择氯化钙;
碳酸钠与氯化钙反应生成碳酸钙沉淀,碳酸氢钠与氯化钙溶液反应生成碳酸钙沉淀、氯化钠、水和二氧化碳,所以可以根据是否生成气体进行区分碳酸钠溶液和碳酸氢钠溶液;
由CaCO3+CO2+H2O=Ca(HCO3)2可知,Na2CO3溶液与CO2发生化学反应的化学方程式是:Na2CO3+CO2+H2O═2NaHCO3;
(3)①因稀盐酸过量,故加入碳酸钠后首先与过量的稀盐酸反应,然后再与氯化钙反应;
②设原滤液中CaCl2的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
111100
x5g
[111/x]=[100/5g]
x=5.55g
故原滤液中氯化钙的质量分数为:[5.55g/50g]×100%=11.1%
答:原滤液中氯化钙的质量分数是11.1%.
故答案为:(1)碳酸钠的水溶液显碱性
(2)【查阅资料】:2NaHCO3+CaCl2═CaCO3↓+2NaCl+H2O+CO2↑
【实验操作步骤与现象】
①H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生
②除去混入的氯化氢气体
③既有气体又有沉淀生成;Na2CO3+CO2+H2O═2NaHCO3
(3)①稀盐酸先与碳酸钠反应;②11.1%点评:
本题考点: 实验探究物质的性质或变化规律;气体的净化(除杂);有关溶质质量分数的简单计算;盐的化学性质;根据化学反应方程式的计算.
考点点评: 本题注重考查了学生分析信息,并结合所学知识分析信息、解决问题的能力,有思维深度.1年前查看全部
- (2013•重庆二模)铬是一种银白色的坚硬金属,铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废
(2013•重庆二模)铬是一种银白色的坚硬金属,铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废气是环境中的主要污染源.请回答下面与铬有关的一些问题.

(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH.该反应中氧化剂是______(填化学式),生成1mol Cr(OH)3时转移电子的物质的量为______mol;
②步骤IV中电解Cr2O3的阳极反应式为______
(2)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图2,A为电源的______ (填“正极”“负极”),阳极区溶液中发生的氧化还原反应为______
(3)化学需氧量(COD)可量度水体受有机物污染的程度.它是在强酸并加热条件下,用K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量,换算成相当于O2的含量(以mg/L计).某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取Va mL水样于锥形瓶,加入l0.00mL 0.2500mol/L K2Cr2O7溶液;
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热;
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵(NH4)2Fe(SO4)2溶液滴定.终点时消耗硫酸亚铁铵溶液Vb mL(此步操作的目的是用Fe2+把多余的Cr2O72-反应成Cr3+)
①Ⅰ中,量取K2Cr2O7溶液的仪器是______
②Ⅱ中,碎瓷片的作用是______
③该水样的化学需氧量COD=8000(15−cVb) Va 8000(用含c、Va、Vb的表达式表示).(15−cVb) Va  路程_20071年前1
路程_20071年前1 -
 iloveourlove 共回答了25个问题
iloveourlove 共回答了25个问题 |采纳率96%解题思路:(1)①8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH中,Cr元素的化合价由+6价降低为+3价,生成1mol Cr(OH)3时转移电子1mol×(6-3);
②步骤IV中电解Cr2O3的阳极反应为氧离子失去电子生成氧气;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,所以B为负极,则A为正极;阳极发生Cr2O72-、Fe2+的氧化还原反应,所以阳极几乎不含Cr2O72-;
(3)①K2Cr2O7溶液具有氧化性;
②碎瓷片可防止液体剧烈沸腾;
③由电子守恒可知,1mol废液中失去的电子为
,再由电子守恒转化为相当于O2的含量,以此来解答.[10×0.25×2×(6−3)−c×Vb]×10−3 Va×10−3 (1)①8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH中,Cr元素的化合价由+6价降低为+3价,则Na2CrO4为氧化剂,该反应中生成1mol Cr(OH)3时转移电子1mol×(6-3)=3mol,故答案为:Na2CrO4;3;
②步骤IV中电解Cr2O3的阳极反应为氧离子失去电子生成氧气,该阳极反应为2O2--4e-=O2↑,故答案为:2O2--4e-=O2↑;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,所以B为负极,则A为正极;阳极发生Cr2O72-、Fe2+的氧化还原反应,所以阳极几乎不含Cr2O72-;,则阳极的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:正极;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(3)①K2Cr2O7溶液具有氧化性,则量取K2Cr2O7溶液的仪器为酸式滴定管(或移液管),故答案为:酸式滴定管(或移液管);
②碎瓷片可防止液体剧烈沸腾,其作用为防止暴沸,故答案为:防止暴沸;
③由I可知废水与K2Cr2O7溶液发生氧化还原反应,由Ⅲ可知Fe2+把多余的Cr2O72-反应成Cr3+,由电子守恒可知,1mol废液中失去的电子为
[10×0.25×2×(6−3)−c×Vb]×10−3
Va×10−3=
15−cVb
Va,
由电子守恒转化为相当于O2的含量n(O2)=
15−cVb
4Vamol,
则COD=
15−cVb
4Vamol×32g/mol×1000mg/L=8000
(15−cVb)
Va,故答案为:8000
(15−cVb)
Va.点评:
本题考点: 探究物质的组成或测量物质的含量;氧化还原反应;原电池和电解池的工作原理.
考点点评: 本题为综合题,以废水的处理考查氧化还原反应、电化学及物质成分的测定,题目难度较大,注意电子守恒再解答中的重要作用,COD的计算为易错点.1年前查看全部
- 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:

其中硫酸浸取液中的金属离子主要是Cr 3+ ,其次是Fe 3+ 、Al 3+ 、Ca 2+ 和Mg 2+ 。
(1)实验室用18.4 mol·L ― 1 的浓硫酸配制250 mL 4.8 mol·L ― 1 的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、
。(写出两个措施)
(3)H 2 O 2 的作用是将滤液Ⅰ中的Cr 3+ 转化为Cr 2 O 7 2 ― ,写出此反应的离子方程式:
。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:阳离子 Fe 3+ Mg 2+ Al 3+ Cr 3+ 开始沉淀时的pH 2.7 —— —— —— 沉淀完全时的pH 3.7 11.1 8 9(>9溶解)
加入NaOH溶液使溶液呈碱性,Cr 2 O 7 2 ― 转化为CrO 4 2 ― 。滤液Ⅱ中阳离子主要有 ;但溶液的pH不能超过8,其理由是 。
(5)钠离子交换树脂的反应原理为:M n+ +nNaR→MR n +nNa + ,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是 。
(6)写出上述流程中用SO 2 进行还原的化学方程式 。 怡然夏天1年前1
怡然夏天1年前1 -
 1894年在tt英女 共回答了10个问题
1894年在tt英女 共回答了10个问题 |采纳率80%(1)250mL容量瓶(1分)、量筒(1分)
(2)升高反应温度、增大固体颗粒的表面积、加快搅拌速度等(3点中答到2点即给2分)
(3)2Cr 3+ + 3H 2 O 2 + H 2 O = Cr 2 O 7 2— + 8H + (2分)
(4)Na + 、Mg 2+ 、Ca 2+ (2分)
pH超过8会使部分Al(OH) 3 溶解生成AlO 2 - ,最终影响Cr(III)回收与再利用(2分)
(5)Ca 2+ 、Mg 2+ (2分)
(6)3SO 2 + 2Na 2 CrO 4 + 12H 2 O = 2CrOH(H 2 O) 5 SO 4 ↓+ Na 2 SO 4 + 2NaOH (2分,
或3SO 2 + 2CrO 4 2 - + 12H 2 O = 2CrOH(H 2 O) 5 SO 4 ↓+ SO 4 2 - + 2OH - )
(1)考查物质的量浓度的配制。根据所给的仪器可知,好缺少250ml容量瓶和量筒。
(2)考查外界条件对反应速率的影响。可从温度,浓度和接触面积等角度进行考虑。
(3)考查氧化还原反应方程式的配平,依据得失电子守恒进行配平。
(4)根据沉淀时的pH值可以判断,当pH=8时,溶液中的Fe 3+ 、Al 3+ 已经以氢氧化物沉淀的形成析出,溶液中的阳离子主要还有Na + 、Mg 2+ 、Ca 2+ 。因为pH太高,会溶解氢氧化铝沉淀,影响其后续实验的分离和提纯。
(5)根据钠离子交换树脂的反应原理可知,滤液中的Ca 2+ 、Mg 2+ 将被交换而除去。
(6)根据物质反应前后的变化可知二氧化硫是用来还原溶液中的CrO 4 2― ,其还原产物是CrOH(H 2 O) 5 SO 4 ,然后根据得失电子守恒配平即可。1年前查看全部
- 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca 2 + 、Mg 2 + 、Fe 3
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca 2 + 、Mg 2 + 、Fe 3 + 、Cl - 和SO 4 2- 等杂质,提纯工艺路线如下:

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为____________________________________。
(2)“趁热过滤”的原因是_______________________________________。
(3)若在实验室进行“趁热过滤”,可采用的措施是__________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_______________。
(5)已知:Na 2 CO 3 ·10H 2 O(s)=Na 2 CO 3 (s)+10H 2 O(g)ΔH 1 =+532.36 kJ·mol -1
Na 2 CO 3 ·10H 2 O(s)=Na 2 CO 3 ·H 2 O(s)+9H 2 O(g)ΔH 2 =+473.63 kJ·mol -1
写出Na 2 CO 3 ·H 2 O脱水反应的热化学方程式______________________。 bat9991年前1
bat9991年前1 -
 shentijiankang 共回答了17个问题
shentijiankang 共回答了17个问题 |采纳率88.2%(1)Mg(OH) 2 、Fe(OH) 3 、CaCO 3
(2)防止温度下降时Na 2 CO 3 ·H 2 O溶解,避免析出Na 2 CO 3 ·10H 2 O或Na 2 CO 3 ·7H 2 O
(3)预热过滤装置(或用常压热过滤漏斗进行过滤)
(4)产品纯度降低,因循环使用时母液中Cl - 与SO 4 2- 累积,导致产品中含有NaCl或Na 2 SO 4 等杂质
(5)Na 2 CO 3 ·H 2 O(s)=Na 2 CO 3 (s)+H 2 O(g) ΔH=+58.73 kJ/mol
(1)加入过量的NaOH后,溶液中的Mg 2 + 、Fe 3 + 与OH - 反应生成难溶物Mg(OH) 2 、Fe(OH) 3 ,CO 3 2- 与Ca 2 + 反应生成CaCO 3 ,所以滤渣的主要成分为Mg(OH) 2 、Fe(OH) 3 、CaCO 3 。
(3)保持滤液的温度使过滤过程尽快完成,可以采取的措施有:一是选用热水漏斗(保温漏斗),保温漏斗应先加好热水并预热;二是选用无颈漏斗(或短颈粗玻璃漏斗),可避免样品在颈部析出结晶,影响操作;三是使用折叠滤纸(菊花滤纸),使用折叠滤纸可增大接触面积,有利于热的溶液快速流下,过滤前用少量溶剂润湿滤纸,避免干滤纸在过滤时因吸附溶剂而使晶体析出。
(4)母液中含有NaCl、Na 2 SO 4 等杂质,循环使用会降低Na 2 CO 3 的纯度。
(5)根据盖斯定律有:1 mol Na 2 CO 3 ·H 2 O脱水反应的ΔH=+532.36 kJ/mol-473.63 kJ/mol=+58.73 kJ/mol,再根据热化学方程式的书写原则即可写出Na 2 CO 3 ·H 2 O脱水反应的热化学方程式。1年前查看全部
- 某市污水处理流程设计 水量:10万m3/d 水质:30%生活污水+70%工业废水,(制革行业为主) 求设计方案
某市污水处理流程设计 水量:10万m3/d 水质:30%生活污水+70%工业废水,(制革行业为主) 求设计方案
越详细越好,最好有流程图 琴麻岛0041年前1
琴麻岛0041年前1 -
 angellmm 共回答了21个问题
angellmm 共回答了21个问题 |采纳率85.7%制革的废水很难去处理.因为.浮动太大 排放次数多.PH 不稳定 每次排放的水量也不等
楼上说的A/O 工艺处理生活污水足够了. 也能达标 处理制革废水的话 酸吸收法+ 碱沉淀法 也是可
以很好的去除的.1年前查看全部
- 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气
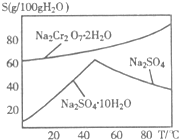 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2高温 ..
②2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O
(1)反应①是在回转窑中进行,反应时需不断搅拌,其目的是______.
(2)右图是红矾钠(Na2Cr2O7•2H2O)和Na2SO4的溶解度曲线.从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:先将混合溶液蒸发浓缩,趁热过滤.趁热过滤的目的是______;然后将滤液______,从而析出红矾钠.
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶解度见右表):______.
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:温度 0℃ 100℃ 溶解度 物质 K2Cr2O7 4.6g 94.1g KCl 28g 55g NaCl 35g 39g
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol•L.重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式______.
②如省去步骤③,则所测定的铁的含量______(填“偏高”、“偏低”或“无影响”).
③步骤5使用的玻璃仪器有______. garmin1年前1
garmin1年前1 -
 hfhczs 共回答了19个问题
hfhczs 共回答了19个问题 |采纳率100%解题思路:(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;
滤液的温度较高,从溶液中获得晶体需要冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl混合,再冷却结晶,可得K2Cr2O7;
(4)①SnCl2还原Fe3+生成亚铁离子,自身被氧化为Sn4+;
②重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高;
③步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液.(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
故答案为:使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;滤液的温度较高,从溶液中获得晶体需要冷却结晶,
故答案为:有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7,
故答案为:较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7;
(4)①SnCl2还原Fe3+生成亚铁离子,自身被氧化为Sn4+,反应离子方程式为:2Fe3++Sn2+=Sn4++2Fe2+,
故答案为:2Fe3++Sn2+=Sn4++2Fe2+;
②重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高,所测定的铁的含量偏高,
故答案为:偏高;
③步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液,
故答案为:酸式滴定管、锥形瓶.点评:
本题考点: 化学平衡的调控作用;探究物质的组成或测量物质的含量.
考点点评: 本题考查学生对数据及图象的分析、常用化学用语、氧化还原反应滴定等,难度中等,是对学生综合能力的考查,需要学生基本扎实的基础与运用知识分析解决问题的能力.1年前查看全部
- (2012•江苏一模)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.某工厂对制革工业污泥中Cr(Ⅲ)的
(2012•江苏一模)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.某工厂对制革工业污泥中Cr(Ⅲ)的工艺如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.
(1)实验室用18.4mol•L-1的浓硫酸配制250mL 4.8mol•L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需250mL容量瓶、胶头滴管250mL容量瓶、胶头滴管.
(2)酸浸时,为了提高浸取率可采取的措施有升高反应温度升高反应温度、增大固体颗粒的表面积增大固体颗粒的表面积.
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:2Cr3++3H2O2+H2O=Cr2O72-+8H+2Cr3++3H2O2+H2O=Cr2O72-+8H+.
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.滤液Ⅱ中阳离子主要有Na+、Mg2+、Ca2+Na+、Mg2+、Ca2+;但溶液的pH不能超过8,其理由是pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)回收与再利用pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)回收与再利用.阳离子 Fe3+ Mg2+ Al3+ Cr3+ 开始沉淀时的pH 2.7 -- -- -- 沉淀完全时的pH 3.7 11.1 8 9(>9溶解)
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是Ca2+、Mg2+Ca2+、Mg2+.
(6)写出上述流程中用SO2进行还原的化学方程式3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH. lanshaomin1年前1
lanshaomin1年前1 -
 langlang0603 共回答了16个问题
langlang0603 共回答了16个问题 |采纳率87.5%(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管,故答案为:250mL容量瓶、胶头滴管;
(2)酸浸时,为了提高浸取率可采取的措施是:延长浸取时间、加快溶解速度等措施,
故答案为:升高反应温度;增大固体颗粒的表面积;
(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,
故答案为:2Cr3++3H2O2+H2O=Cr2O72-+8H+;
(4)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.
溶液PH=8,Fe3+、Al3+沉淀完全,滤液Ⅱ中阳离子主要Na+、Ca2+和Mg2+;超过PH=8,氢氧化铝是两性氢氧化物会溶解于强碱溶液中影响铬离子的回收利用;
故答案为:Na+、Mg2+、Ca2+;pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)回收与再利用;
(5)钠离子交换树脂交换的离子是钙离子和镁离子,故答案为:Ca2+、Mg2+;
(6)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成氢氧化钠溶液和硫酸反应生成硫酸钠,依据原子守恒分析书写配平;3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH,
故答案为:3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH.1年前查看全部
- (2012•江苏一模)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.某工厂对制革工业污泥中Cr(Ⅲ)的
(2012•江苏一模)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.某工厂对制革工业污泥中Cr(Ⅲ)的工艺如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.
(1)实验室用18.4mol•L-1的浓硫酸配制250mL 4.8mol•L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需______.
(2)酸浸时,为了提高浸取率可采取的措施有______、______.
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______.
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是______.阳离子 Fe3+ Mg2+ Al3+ Cr3+ 开始沉淀时的pH 2.7 -- -- -- 沉淀完全时的pH 3.7 11.1 8 9(>9溶解)
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是______.
(6)写出上述流程中用SO2进行还原的化学方程式______. 流年尘埃1年前1
流年尘埃1年前1 -
 jld198248 共回答了22个问题
jld198248 共回答了22个问题 |采纳率95.5%解题思路:(1)依据溶液配制的步骤和过程分析所用到的仪器,主要仪器应有配制溶液的容量瓶和定容需要的胶头滴管;配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;
(2)酸浸时,为了提高浸取率可采取的措施是延长浸取时间、加快溶解速度等措施;硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;
(3)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质,依据氧化还原反应电子守恒、原子守恒配平书写离子方程式;
(4)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.
溶液PH=8,Fe3+、Al3+沉淀完全,滤液Ⅱ中阳离子主要Na+、Ca2+和Mg2+;超过PH=8,氢氧化铝是两性氢氧化物会溶解于强碱溶液中影响铬离子的回收利用;
(5)钠离子交换树脂交换 的离子是钙离子和镁离子.
(6)依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写.(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管,故答案为:250mL容量瓶、胶头滴管;
(2)酸浸时,为了提高浸取率可采取的措施是:延长浸取时间、加快溶解速度等措施,
故答案为:升高反应温度;增大固体颗粒的表面积;
(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,
故答案为:2Cr3++3H2O2+H2O=Cr2O72-+8H+;
(4)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.
溶液PH=8,Fe3+、Al3+沉淀完全,滤液Ⅱ中阳离子主要Na+、Ca2+和Mg2+;超过PH=8,氢氧化铝是两性氢氧化物会溶解于强碱溶液中影响铬离子的回收利用;
故答案为:Na+、Mg2+、Ca2+;pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)回收与再利用;
(5)钠离子交换树脂交换的离子是钙离子和镁离子,故答案为:Ca2+、Mg2+;
(6)二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成氢氧化钠溶液和硫酸反应生成硫酸钠,依据原子守恒分析书写配平;3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH,
故答案为:3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了离子方程式、化学方程式的书写、物质的分离等知识点,难度较大,注意会运用溶液的PH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.1年前查看全部
- 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.COCl2的分解
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.COCl2的分解反应为COCl2(g)⇌Cl2(g)+CO(g)△H=+108kJ/mol.反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未画出):
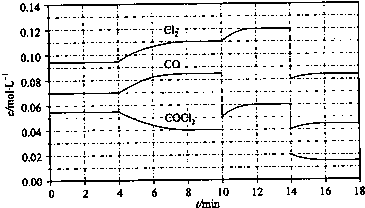
①计算反应在第8min时的平衡常数K=______.
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)______T(8)(填“<”、“>”或“=”);
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=______mol/L;
④比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:υ(5-6)______υ(15-16)(填“<”、“>”或“=”),原因是______. 我来看骂朱军的帖1年前1
我来看骂朱军的帖1年前1 -
 cola328 共回答了18个问题
cola328 共回答了18个问题 |采纳率88.9%解题思路:①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,代入平衡常数表达式计算;
②第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动,4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,据此结合温度对平衡影响判断;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
④在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,故该温度下化学平衡常数k=[0.11mol/L×0.085mol/L/0.04mol/L]=0.234 mol•L-1,故答案为:0.234 mol•L-1;
②第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动.4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,又因为正反应为吸热反应,所以T(2)<T(8),故答案为:<;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:
0.06mol/L×0.12mol/L
c(COCl2)=0.234mol/L,解得c(COCl2)=0.031mol/L,故答案为:0.031;
④在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),故答案为:>;在相同温度时,该反应的反应物的浓度越高,反应速率越大.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡建立的过程;化学平衡常数的含义.
考点点评: 本题涉及化学方程式、热化学方程式的书写和化学平衡图象的有关计算,意在考查考生对反应热、化学平衡等化学反应原理掌握的情况,难度中等.1年前查看全部
- 化学在生产、生活中有着广泛的应用。下列做法正确的是 A.农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 B.回收制革工厂
化学在生产、生活中有着广泛的应用。下列做法正确的是
A.农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 B.回收制革工厂的边角皮料生产食用明胶,加工成医用胶囊或做食品增稠剂 C.将工业废水“再生”处理,用于城市道路保洁、喷泉和浇花用水 D.食品加工时,尽可能多的使用各种色素、香味剂等添加剂,改善食品的品质  chuhx11年前1
chuhx11年前1 -
 淘气怡儿 共回答了15个问题
淘气怡儿 共回答了15个问题 |采纳率93.3%C
A不正确,就地焚烧秸秆,易造成环境污染。B不正确,制革工厂的边角皮料生产食用明胶中化工原料,不能用作医用胶囊或做食品增稠剂。添加剂的使用,必须严格控制用量和范围,D不正确。所以正确的答案是C。1年前查看全部
- 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca 2+ 、Mg 2+ 、Fe 3+
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca 2+ 、Mg 2+ 、Fe 3+ 、Cl - 和SO
 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:

已知碳酸钠的溶解度( S )随温度变化的曲线如下图所示:
回答下列问题:
小题1:(1)滤渣的主要成分为 。
小题2:(2)“趁热过滤”的原因是 。
小题3:(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
小题4:(4)若“母液”循环使用,可能出现的问题及其原因是 。
小题5:(5)已知:
Na 2 CO 3 ·10H 2 O(s)=Na 2 CO 3 (s)+10H 2 O(g)Δ H 1 =" +532.36" kJ·mol -1
Na 2 CO 3 ·10H 2 O(s)=Na 2 CO 3 ·H 2 O(s)+9H 2 O(g) Δ H 1 =" +473.63" kJ·mol -1
写出Na 2 CO 3 ·H 2 O脱水反应的热化学方程式 。 zhutizen1年前1
zhutizen1年前1 -
 砜中乱发 共回答了26个问题
砜中乱发 共回答了26个问题 |采纳率92.3%小题1:(1)滤渣的主要成分为Mg(OH) 2 、Fe(OH) 3 、CaCO 3 。
小题2:(2)“趁热过滤”的原因是使析出的晶体为Na 2 CO 3 ·H 2 O,防止因温度过低而析出Na 2 CO 3 ·10H 2 O晶体,令后续的加热脱水耗时长。
小题3:(3)若在实验室进行“趁热过滤”,可采取的措施是用已预热的布氏漏斗趁热抽滤。
小题4:(4)若“母液”循环使用,可能出现的问题及其原因是问题:溶解时有大量沉淀生成,使Na 2 CO 3 损耗且产物Na 2 CO 3 混有杂质;原因:“母液”中,含有的离子有Ca 2+ ,Na + ,Cl - ,SO 4 2- ,OH - ,CO 3 2- ,当多次循环后,使用离子浓度不断增大,溶解时会生成CaSO 4 ,Ca(OH) 2 ,CaCO 3 等沉淀。
小题5:(5)写出Na 2 CO 3 ·H 2 O脱水反应的热化学方程式
Na 2 CO 3 ·H 2 O(S)="===" Na 2 CO 3 (s) + H 2 O(g);H= +58.73kJ/mol
小题1:(1)因工业碳酸钠中含有Mg 2+ ,Fe 3+ ,Ca 2+ ,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH) 2 、Fe(OH) 3 、Ca(OH) 2 沉淀。
小题2:(2)观察坐标图,温度减少至313K时发生突变,溶解度迅速减少,弱不趁热过滤将析出晶体。
小题3:(3)思路方向:1.减少过滤的时间 2.保持过滤时的温度。
小题4:(4)思路:分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响。
小题5:(5)通过观察两个热化学方程式,可将两式相减,从而得到Na 2 CO 3 ·H 2 O(s)="===" Na 2 CO 3 (s)+ H 2 O(g)。1年前查看全部
- 用TOC测定仪测试到的TCO的值怎么转化或换算成COD的值?我的样品是制革废液,
 huan10001年前1
huan10001年前1 -
 lycop 共回答了19个问题
lycop 共回答了19个问题 |采纳率94.7%TOC跟COD虽无直接联系,但是本质上都是表征水体中有机物污染程度的指标,因此是有线性对应关系的,这个换算系数,不同的水体是不一样的,如果你的水体中的污染物成分比较稳定,你可以通过实验确定这个系数.后面你就可以测TOC然后乘以这个系数就是COD了,比你直接做COD快得多,当然这个系数你隔一段时间需要校正一次.有问题可以继续提问.1年前查看全部
- 翻译成英语:我们有四个系列 30多个种类的产品,广泛用于发酵、食品、医药、印染、造纸、制革、洗涤等行业
 tinghao1年前1
tinghao1年前1 -
 奥利奥好吃 共回答了19个问题
奥利奥好吃 共回答了19个问题 |采纳率89.5%We have four products of categories with more than 30 series and Be extensively used for ferment,food,medicine,print to dye,deckle,make professions,such as Ge and rinse...etc.1年前查看全部
大家在问
- 1什么是我们的立国之本
- 2求下列各组数的最大公因数8和9 9和18 17和51 7和13 27和9 14和15
- 324分之20,27分之18,18分之15,2分之1,90分之60,54分之45
- 4she did her homework yesterday evening when i saw her.哪错了
- 5聪聪读一本科幻书,已经读了全书的五分之一,如果再读10页,则读过的页数与未读的页的比是1:3,
- 6The history of_English can be divided into three parts,_Old
- 72009乘以(2分之1减1)(3分之1减1)(4分之1减1)……(2009分之1减1)
- 8在直角坐标系xoy中,以m(-1,0)为圆心的圆与直线x-3y-3=0相切.求圆m的方程
- 9蟋蟀的住宅为什么说是伟大的工程呢
- 10翻译:I'm gald I have taken Russian lessons in my unversity
- 11问几个英语问题把下列句子变成一般疑问句.I do my homework.They often tead books o
- 12如果,AB=AC,AD=AE,试判断△ABE,与△ACD是否全等,请说明理由
- 13Dog——A Friend of Man胡迪
- 14看到森林你会想到什么名人名言
- 15景公闻命中晏子有哪一句话有言外之意
