重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气
 garmin2022-10-04 11:39:541条回答
garmin2022-10-04 11:39:541条回答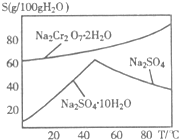 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:①4FeO•Cr2O3+8Na2CO3+7O2
| ||
. |
②2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O
(1)反应①是在回转窑中进行,反应时需不断搅拌,其目的是______.
(2)右图是红矾钠(Na2Cr2O7•2H2O)和Na2SO4的溶解度曲线.从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:先将混合溶液蒸发浓缩,趁热过滤.趁热过滤的目的是______;然后将滤液______,从而析出红矾钠.
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶解度见右表):______.
| 温度 | 0℃ | 100℃ |
| 溶解度 | ||
| 物质 | ||
| K2Cr2O7 | 4.6g | 94.1g |
| KCl | 28g | 55g |
| NaCl | 35g | 39g |
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol•L.重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式______.
②如省去步骤③,则所测定的铁的含量______(填“偏高”、“偏低”或“无影响”).
③步骤5使用的玻璃仪器有______.

已提交,审核后显示!提交回复
共1条回复
 hfhczs 共回答了19个问题
hfhczs 共回答了19个问题 |采纳率100%- 解题思路:(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;
滤液的温度较高,从溶液中获得晶体需要冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl混合,再冷却结晶,可得K2Cr2O7;
(4)①SnCl2还原Fe3+生成亚铁离子,自身被氧化为Sn4+;
②重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高;
③步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液.(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
故答案为:使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;滤液的温度较高,从溶液中获得晶体需要冷却结晶,
故答案为:有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7,
故答案为:较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7;
(4)①SnCl2还原Fe3+生成亚铁离子,自身被氧化为Sn4+,反应离子方程式为:2Fe3++Sn2+=Sn4++2Fe2+,
故答案为:2Fe3++Sn2+=Sn4++2Fe2+;
②重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高,所测定的铁的含量偏高,
故答案为:偏高;
③步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液,
故答案为:酸式滴定管、锥形瓶.点评:
本题考点: 化学平衡的调控作用;探究物质的组成或测量物质的含量.
考点点评: 本题考查学生对数据及图象的分析、常用化学用语、氧化还原反应滴定等,难度中等,是对学生综合能力的考查,需要学生基本扎实的基础与运用知识分析解决问题的能力. - 1年前
相关推荐
- 重铬酸钠中的“重”字读“chong”还是“zhong”?
 笑影子1年前1
笑影子1年前1 -
 孩nn 共回答了26个问题
孩nn 共回答了26个问题 |采纳率80.8%读‘zhong’.1年前查看全部
- 用与环己醇与重铬酸钠制备环己酮时,反应完温度下降后,为什么会出现墨绿色的溶液啊?..
用与环己醇与重铬酸钠制备环己酮时,反应完温度下降后,为什么会出现墨绿色的溶液啊?..
是生成的三价铬的颜色吗? lucky71年前2
lucky71年前2 -
 中原枪手的老乡 共回答了17个问题
中原枪手的老乡 共回答了17个问题 |采纳率82.4%3 R2CHOH (环己醇)+ Cr2O72- + 2 H+ → 3 R2C=O + Cr2O3 + 4 H2O
因为水合的Cr2O3在水溶液中呈现绿色,是这是一种工业上应用的色素.也被称为铬绿1年前查看全部
- 化工原料红矾钠(重铬酸钠:Na2Cr207-2H20)主要是以铬铁矿(主要成份为FeO-Cr2O3,还含有A1203,S
化工原料红矾钠(重铬酸钠:Na2Cr207-2H20)主要是以铬铁矿(主要成份为FeO-Cr2O3,还含有A1203,Si02等
化工原料红矾钠(重铬酸钠:Na2Cr207-2H20)主要是以铬铁矿(主要成份为FeO-Cr2O3,还含有A1203,Si02等杂质)为主要原料生产,其主要工艺流程如图1: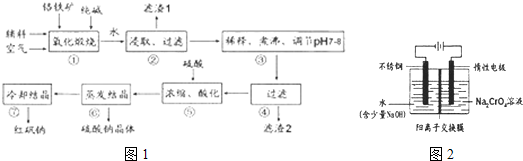
步骤①中主要反应的化学方程式为:Fe0?Cr2O3+8Na2C03+702=8Na2Cr04+2Fe2O3+8C02
(I)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是______.
(2)杂质A1203,SiO2在①中转化的化学反应方程式为______
(3)用化学平衡移动原理说明③中煮沸的作用是______(用离子方程式结合文字说明),若调节pH过低产生的影响是______
(4)⑤中酸化是使Cr042一转化为Cr2072一,写出该反应的离子方程式:______
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如图2:
阴极发生的电极反应式为:______
阳极发生的电极反应式为:______.
 帅气乖巧的俞小灏1年前1
帅气乖巧的俞小灏1年前1 -
 shao008 共回答了13个问题
shao008 共回答了13个问题 |采纳率76.9%(1)固体反应物在搅拌时可充分接触而反应,故答案为:增大反应物的接触面积,加快反应速率;(2)Al2O3与纯碱反应转变为可溶性盐,生成NaAlO2,反应的化学方程式为Al2O3+Na2CO3 高温 . 2NaAlO2+CO2...1年前查看全部
- 工业上以铬铁矿(主要成分为FeO·Cr 2 O 3 )、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na 2 Cr 2 O 7
工业上以铬铁矿(主要成分为FeO·Cr 2 O 3 )、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na 2 Cr 2 O 7 ·2H 2 O),其主要反应如下:
①4FeO·Cr 2 O 3 +8Na 2 CO 3 +7O 2 8Na 2 CrO 4 +2Fe 2 O 3 +8CO 2
8Na 2 CrO 4 +2Fe 2 O 3 +8CO 2
②2Na 2 CrO 4 +H 2 SO 4 Na 2 SO 4 +Na 2 Cr 2 O 7 +H 2 O
下列说法正确的是( )A.反应①和②均为氧化还原反应 B.反应①的氧化剂是O 2 ,还原剂是FeO·Cr 2 O 3 C.Na 2 Cr 2 O 7 中Cr元素的化合价为+7 D.反应①中生成1 mol的Na 2 CrO 4 时共转移28 mol电子  warriorsword1年前1
warriorsword1年前1 -
 辉芳 共回答了22个问题
辉芳 共回答了22个问题 |采纳率72.7%B
反应②中元素无化合价的变化,A项错误;Na 2 Cr 2 O 7 中Cr的化合价为+6价,C项错误;从反应①看该反应转移电子数为28 mol,故生成1 mol Na 2 CrO 4 转移电子数为3.5 mol,D项错误。1年前查看全部
- 为什么分析测试中用重铬酸钾而不用重铬酸钠做基准试剂呢?
 那你还不如去抢1年前2
那你还不如去抢1年前2 -
 weaving0526 共回答了14个问题
weaving0526 共回答了14个问题 |采纳率92.9%钾盐不吸水,钠盐容易吸水变潮.1年前查看全部
- 重铬酸钠与用硫酸酸化的过氧化氢反应生成什么
 笨得一塌糊涂1年前3
笨得一塌糊涂1年前3 -
 littlelazycat 共回答了20个问题
littlelazycat 共回答了20个问题 |采纳率95%硫酸钠,硫酸铬,水,氧气
Cr2O7 2- +8H+ +3H2O=======2Cr3+ +7H2O+3O21年前查看全部
- 重铬酸钾工业制法好像是重铬酸钠与氯化钾发生反应,具体描述一下反应条件和过程、注意事项等
 czywindy1年前1
czywindy1年前1 -
 寻找生活的感觉 共回答了22个问题
寻找生活的感觉 共回答了22个问题 |采纳率95.5%由重铬酸钠与氯化钾或硫酸钾进行复分解反应而制得. 比较详细的,等查阅相关资料再回答你.1年前查看全部
- 重重铬酸钠与浓硫酸混合液为什么要冷至室温后使用?
 energy19851年前0
energy19851年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主
工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为(1)4(FeO•Cr2O3)+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2(2)2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O下列说法正确的是( )高温 .
A.反应(1)和(2)均为氧化还原反应
B.反应(1)中FeO•Cr2O3既是氧化剂又是还原剂
C.高温下O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时转移7mol电子 人生坎坷生活所迫1年前1
人生坎坷生活所迫1年前1 -
 上下一致不求有功 共回答了21个问题
上下一致不求有功 共回答了21个问题 |采纳率90.5%解题思路:A.反应(2)中不存在元素的化合价变化;
B.反应(1)O2中O元素的化合价降低,Fe、Cr元素的化合价均升高;
C.根据氧化剂的氧化性大于氧化产物的氧化性判断;
D.根据反应方程式中元素化合价的变化分析.A.反应(2)中不存在元素的化合价变化,则不属于氧化还原反应,故A错误;
B.反应(1)O2中O元素的化合价降低,Fe、Cr元素的化合价均升高,所以氧化剂是O2,还原剂是FeO•Cr2O3,故B错误;
C.反应中O2作氧化剂,Fe2O3和Na2CrO4均为氧化产物,所以O2的氧化性大于Fe2O3和Na2CrO4,故C错误;
D.已知(1)4(FeO•Cr2O3 )+8Na2CO3+7O2
高温
.
8Na2CrO4+2Fe2O3+8CO2(2)2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O,则7O2~28e-~8Na2CrO4~4Na2Cr2O7,则生成1mol的Na2Cr2O7时转移7mol电子,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重电子的转移、氧化剂和还原剂的判断的考查,注意从化合价角度分析,难度不大.1年前查看全部
- 用重铬酸钠与环己醇合成环己酮 如果蒸出的馏出液过多,会有什么后果,怎样弥
 桃花浅处1年前1
桃花浅处1年前1 -
 济南一村民 共回答了23个问题
济南一村民 共回答了23个问题 |采纳率87%可能是把没反应的环己醇也蒸出来了.环己醇沸点161度,环己酮155.差不多的.
--再重蒸一遍吧.只收集150-156度的部分,温度再高就不要收集了.
因为两种物质极性大小不同,用柱层析也可以分离.1年前查看全部
- 实验室使用重铬酸钠会中毒吗重铬酸钠和亚硫酸钠反应70摄氏度,会生成什么物质?
 girlshuiling1年前2
girlshuiling1年前2 -
 76867175 共回答了17个问题
76867175 共回答了17个问题 |采纳率82.4%重铬酸钠强氧化性,特别是在酸性条件下氧化性更强,可以用其酸液洗玻璃仪器.
长期大量接触有可能致癌.它和亚硫酸钠反应,变成三价的铬离子,毒性会小很多.
带手套,不要用直接接触就没有什么问题.1年前查看全部
- 重铬酸钠和硫酸体系氧化环己醇的反应机制
 w3539932411年前1
w3539932411年前1 -
 1jtibgg2 共回答了15个问题
1jtibgg2 共回答了15个问题 |采纳率86.7%强氧化体系,让羟基成醛酮
反应机理一般是不需要的,这里牵涉到Cr的电子转移,不是一般的有机物反应过程1年前查看全部
- 重铬酸钠怎么读 求拼音 准确的!
 烤地瓜啊1年前1
烤地瓜啊1年前1 -
 知了大师 共回答了19个问题
知了大师 共回答了19个问题 |采纳率100%重 zhòng
铬 gè
酸 suān
钠 nà1年前查看全部
- 工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主
工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为:
(1)4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2高温 .
(2)2Na2CrO4+H2SO4⇌Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A. 反应(1)和(2)均为氧化还原反应
B. 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3
C. Na2CrO4中Cr元素的化合价为+7
D. 反应(2)中生成1mol的Na2Cr2O7时共转移7mol电子 孤单的优秀1年前1
孤单的优秀1年前1 -
 ben3sha 共回答了19个问题
ben3sha 共回答了19个问题 |采纳率94.7%解题思路:A.反应(2)中不存在元素的化合价变化;
B.反应(1)中O元素的化合价降低,Fe、Cr元素的化合价均升高;
C.化合物中正负化合价的代数和为0;
D.反应(2)为非氧化还原反应.A.反应(2)中不存在元素的化合价变化,则不属于氧化还原反应,故A错误;B.反应(1)中O元素的化合价降低,Fe、Cr元素的化合价均升高,所以氧化剂是O2,还原剂是FeO•Cr2O3,故B正确;C.化合物中正负化合价的代数...
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子的转移、氧化剂和还原剂的判断的考查,注意从化合价角度分析,难度不大.1年前查看全部
- 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2□+8CO2高温 .
②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①中的氧化剂是O2,还原剂是FeO•Cr2O3
C.□内的物质是Fe3O4
D.生成1 mol Na2Cr2O7,时共转移6 mol电子 亲爱的ミ1年前1
亲爱的ミ1年前1 -
 yyuu852 共回答了11个问题
yyuu852 共回答了11个问题 |采纳率72.7%解题思路:A.有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的升降;
B.得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
C.根据元素守恒及原子守恒判断;
D.根据Na2Cr2O7和转移电子之间的关系式计算.A.在反应前后,②中各元素的化合价都不变化,所以不是氧化还原反应,故A错误;
B.反应①氧气得电子化合价降低,所以氧气是氧化剂,FeO•Cr2O3中铁和铬元素化合价都升高,所以FeO•Cr2O3是还原剂,故B正确;
C.根据原子守恒知,□内的物质是Fe2O3,故C错误;
D.反应②中生成1molNa2Cr2O7需要2molNa2CrO4,由反应①可知,参加反应FeO•Cr2O3为1mol,反应中Fe元素化合价由+2价升高为+3价,Cr由+3升高为+6,故生成1molNa2Cr2O7共转移电子的物质的量为1mol×[1+(6-3)]=7mol,故D错误;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应基本概念与计算等,难度中等,注意根据化合价理解氧化还原反应.1年前查看全部
大家在问
- 1今年按天干地支纪年是什么年 今年是2011了
- 2已知韩国交流电的频率是60赫兹,你能求得韩国交流电的周期是多少吗?
- 3(1-x+x2)(1+x)6的展开式中x5项的系数等于______.(用数字作答)
- 4下列溶液pH最大的是A.10%KOH B.20%NaOH C.10%HCl D.20%KOH
- 5关于多项式的几个问题①已知余式和除式怎么求多项式一、若以2x²-3x-2除多项式f(x)和g(x)分别得余式2
- 6若关于x的方程aˇx=3m-2(a>0且a≠1)有负根,求实数m的取值范围?
- 7(2013•蓟县二模)某工厂生产的零件标准分成9个等级,等级系数X依次为1,2,…,9,X≥4为合格标准,且该厂的零件都
- 8写出下列反应式的化学方程式,并求出各反应物和生成物的质量比.1)分解双氧水制取氧气.
- 9大队委竞选演讲稿 1000字
- 10万有引力为什么指向地心
- 11两个正六边形的边长分别是3和4,则这两个正六边形的面积之比是
- 12和亡羊补牢相同意思的成语
- 13英语翻译从2月10日开始休息,一直到5月4日才正式上班.他手头上的工作,现由xx正式接手.如有任何的问题,请与xx及时联
- 14在地球表面的物体所受的万有引力和重力还有向心力之间又怎样的关系,什么情况下可以近似看成相等?
- 15关于一些酸碱盐的化学式和俗称!
