重重铬酸钠与浓硫酸混合液为什么要冷至室温后使用?
 energy19852022-10-04 11:39:540条回答
energy19852022-10-04 11:39:540条回答
已提交,审核后显示!提交回复
共0条回复
相关推荐
- 重铬酸钠中的“重”字读“chong”还是“zhong”?
 笑影子1年前1
笑影子1年前1 -
 孩nn 共回答了26个问题
孩nn 共回答了26个问题 |采纳率80.8%读‘zhong’.1年前查看全部
- 用与环己醇与重铬酸钠制备环己酮时,反应完温度下降后,为什么会出现墨绿色的溶液啊?..
用与环己醇与重铬酸钠制备环己酮时,反应完温度下降后,为什么会出现墨绿色的溶液啊?..
是生成的三价铬的颜色吗? lucky71年前2
lucky71年前2 -
 中原枪手的老乡 共回答了17个问题
中原枪手的老乡 共回答了17个问题 |采纳率82.4%3 R2CHOH (环己醇)+ Cr2O72- + 2 H+ → 3 R2C=O + Cr2O3 + 4 H2O
因为水合的Cr2O3在水溶液中呈现绿色,是这是一种工业上应用的色素.也被称为铬绿1年前查看全部
- 化工原料红矾钠(重铬酸钠:Na2Cr207-2H20)主要是以铬铁矿(主要成份为FeO-Cr2O3,还含有A1203,S
化工原料红矾钠(重铬酸钠:Na2Cr207-2H20)主要是以铬铁矿(主要成份为FeO-Cr2O3,还含有A1203,Si02等
化工原料红矾钠(重铬酸钠:Na2Cr207-2H20)主要是以铬铁矿(主要成份为FeO-Cr2O3,还含有A1203,Si02等杂质)为主要原料生产,其主要工艺流程如图1: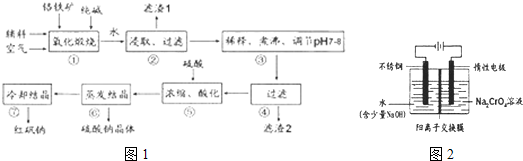
步骤①中主要反应的化学方程式为:Fe0?Cr2O3+8Na2C03+702=8Na2Cr04+2Fe2O3+8C02
(I)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是______.
(2)杂质A1203,SiO2在①中转化的化学反应方程式为______
(3)用化学平衡移动原理说明③中煮沸的作用是______(用离子方程式结合文字说明),若调节pH过低产生的影响是______
(4)⑤中酸化是使Cr042一转化为Cr2072一,写出该反应的离子方程式:______
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如图2:
阴极发生的电极反应式为:______
阳极发生的电极反应式为:______.
 帅气乖巧的俞小灏1年前1
帅气乖巧的俞小灏1年前1 -
 shao008 共回答了13个问题
shao008 共回答了13个问题 |采纳率76.9%(1)固体反应物在搅拌时可充分接触而反应,故答案为:增大反应物的接触面积,加快反应速率;(2)Al2O3与纯碱反应转变为可溶性盐,生成NaAlO2,反应的化学方程式为Al2O3+Na2CO3 高温 . 2NaAlO2+CO2...1年前查看全部
- 工业上以铬铁矿(主要成分为FeO·Cr 2 O 3 )、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na 2 Cr 2 O 7
工业上以铬铁矿(主要成分为FeO·Cr 2 O 3 )、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na 2 Cr 2 O 7 ·2H 2 O),其主要反应如下:
①4FeO·Cr 2 O 3 +8Na 2 CO 3 +7O 2 8Na 2 CrO 4 +2Fe 2 O 3 +8CO 2
8Na 2 CrO 4 +2Fe 2 O 3 +8CO 2
②2Na 2 CrO 4 +H 2 SO 4 Na 2 SO 4 +Na 2 Cr 2 O 7 +H 2 O
下列说法正确的是( )A.反应①和②均为氧化还原反应 B.反应①的氧化剂是O 2 ,还原剂是FeO·Cr 2 O 3 C.Na 2 Cr 2 O 7 中Cr元素的化合价为+7 D.反应①中生成1 mol的Na 2 CrO 4 时共转移28 mol电子  warriorsword1年前1
warriorsword1年前1 -
 辉芳 共回答了22个问题
辉芳 共回答了22个问题 |采纳率72.7%B
反应②中元素无化合价的变化,A项错误;Na 2 Cr 2 O 7 中Cr的化合价为+6价,C项错误;从反应①看该反应转移电子数为28 mol,故生成1 mol Na 2 CrO 4 转移电子数为3.5 mol,D项错误。1年前查看全部
- 为什么分析测试中用重铬酸钾而不用重铬酸钠做基准试剂呢?
 那你还不如去抢1年前2
那你还不如去抢1年前2 -
 weaving0526 共回答了14个问题
weaving0526 共回答了14个问题 |采纳率92.9%钾盐不吸水,钠盐容易吸水变潮.1年前查看全部
- 重铬酸钠与用硫酸酸化的过氧化氢反应生成什么
 笨得一塌糊涂1年前3
笨得一塌糊涂1年前3 -
 littlelazycat 共回答了20个问题
littlelazycat 共回答了20个问题 |采纳率95%硫酸钠,硫酸铬,水,氧气
Cr2O7 2- +8H+ +3H2O=======2Cr3+ +7H2O+3O21年前查看全部
- 重铬酸钾工业制法好像是重铬酸钠与氯化钾发生反应,具体描述一下反应条件和过程、注意事项等
 czywindy1年前1
czywindy1年前1 -
 寻找生活的感觉 共回答了22个问题
寻找生活的感觉 共回答了22个问题 |采纳率95.5%由重铬酸钠与氯化钾或硫酸钾进行复分解反应而制得. 比较详细的,等查阅相关资料再回答你.1年前查看全部
- 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气
 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2高温 ..
②2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O
(1)反应①是在回转窑中进行,反应时需不断搅拌,其目的是______.
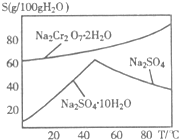
(2)右图是红矾钠(Na2Cr2O7•2H2O)和Na2SO4的溶解度曲线.从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:先将混合溶液蒸发浓缩,趁热过滤.趁热过滤的目的是______;然后将滤液______,从而析出红矾钠.
(3)Na2Cr2O7与KCl或K2SO4进行复分解反应可制取K2Cr2O7,现用Na2Cr2O7与KCl来制备K2Cr2O7,简述操作步骤(有关物质的溶解度见右表):______.
(4)重铬酸钾可用于铁矿石中铁的含量测定,实验步骤如下:温度 0℃ 100℃ 溶解度 物质 K2Cr2O7 4.6g 94.1g KCl 28g 55g NaCl 35g 39g
步骤1:将mg铁矿石加浓盐酸加热溶解
步骤2:加入SnCl2溶液将Fe3+还原至黄色消失
步骤3:将所得溶液冷却,加入HgC2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15mL硫酸和磷酸的混合酸及5滴O.2%二苯胺磺酸钠指示剂
步骤5:立即用cmol•L.重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液VmL
①写出SnCl2还原Fe3+的离子方程式______.
②如省去步骤③,则所测定的铁的含量______(填“偏高”、“偏低”或“无影响”).
③步骤5使用的玻璃仪器有______. garmin1年前1
garmin1年前1 -
 hfhczs 共回答了19个问题
hfhczs 共回答了19个问题 |采纳率100%解题思路:(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;
滤液的温度较高,从溶液中获得晶体需要冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl混合,再冷却结晶,可得K2Cr2O7;
(4)①SnCl2还原Fe3+生成亚铁离子,自身被氧化为Sn4+;
②重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高;
③步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液.(1)反应①是在回转窑中进行,反应时需不断搅拌,使反应物充分接触,加快反应速率;
故答案为:使反应物充分接触,加快反应速率;
(2)由图可知,温度高有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;滤液的温度较高,从溶液中获得晶体需要冷却结晶,
故答案为:有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;冷却结晶;
(3)由溶解度可知,较高温下K2Cr2O7的溶解度大,氯化钠、氯化钾的溶解度较小,较低温度下,下K2Cr2O7的溶解度小,氯化钠、氯化钾的溶解度较大,K2Cr2O7的溶解度受温度影响大.应在较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7,
故答案为:较高温度下将Na2Cr2O7与KCl配成饱和溶液后混合,再降低温度到0℃冷却结晶,过滤洗涤,可得K2Cr2O7;
(4)①SnCl2还原Fe3+生成亚铁离子,自身被氧化为Sn4+,反应离子方程式为:2Fe3++Sn2+=Sn4++2Fe2+,
故答案为:2Fe3++Sn2+=Sn4++2Fe2+;
②重铬酸钾溶液能氧化Sn2+,使消耗的重铬酸钾溶液体积偏大,计算铁元素的质量偏高,所测定的铁的含量偏高,
故答案为:偏高;
③步骤5的操作是滴定,酸性高锰酸钾具有强氧化性,应使用酸式滴定管,锥形瓶内盛放待测液,
故答案为:酸式滴定管、锥形瓶.点评:
本题考点: 化学平衡的调控作用;探究物质的组成或测量物质的含量.
考点点评: 本题考查学生对数据及图象的分析、常用化学用语、氧化还原反应滴定等,难度中等,是对学生综合能力的考查,需要学生基本扎实的基础与运用知识分析解决问题的能力.1年前查看全部
- 工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主
工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为(1)4(FeO•Cr2O3)+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2(2)2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O下列说法正确的是( )高温 .
A.反应(1)和(2)均为氧化还原反应
B.反应(1)中FeO•Cr2O3既是氧化剂又是还原剂
C.高温下O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时转移7mol电子 人生坎坷生活所迫1年前1
人生坎坷生活所迫1年前1 -
 上下一致不求有功 共回答了21个问题
上下一致不求有功 共回答了21个问题 |采纳率90.5%解题思路:A.反应(2)中不存在元素的化合价变化;
B.反应(1)O2中O元素的化合价降低,Fe、Cr元素的化合价均升高;
C.根据氧化剂的氧化性大于氧化产物的氧化性判断;
D.根据反应方程式中元素化合价的变化分析.A.反应(2)中不存在元素的化合价变化,则不属于氧化还原反应,故A错误;
B.反应(1)O2中O元素的化合价降低,Fe、Cr元素的化合价均升高,所以氧化剂是O2,还原剂是FeO•Cr2O3,故B错误;
C.反应中O2作氧化剂,Fe2O3和Na2CrO4均为氧化产物,所以O2的氧化性大于Fe2O3和Na2CrO4,故C错误;
D.已知(1)4(FeO•Cr2O3 )+8Na2CO3+7O2
高温
.
8Na2CrO4+2Fe2O3+8CO2(2)2Na2CrO4+H2SO4═Na2SO4+Na2Cr2O7+H2O,则7O2~28e-~8Na2CrO4~4Na2Cr2O7,则生成1mol的Na2Cr2O7时转移7mol电子,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重电子的转移、氧化剂和还原剂的判断的考查,注意从化合价角度分析,难度不大.1年前查看全部
- 用重铬酸钠与环己醇合成环己酮 如果蒸出的馏出液过多,会有什么后果,怎样弥
 桃花浅处1年前1
桃花浅处1年前1 -
 济南一村民 共回答了23个问题
济南一村民 共回答了23个问题 |采纳率87%可能是把没反应的环己醇也蒸出来了.环己醇沸点161度,环己酮155.差不多的.
--再重蒸一遍吧.只收集150-156度的部分,温度再高就不要收集了.
因为两种物质极性大小不同,用柱层析也可以分离.1年前查看全部
- 实验室使用重铬酸钠会中毒吗重铬酸钠和亚硫酸钠反应70摄氏度,会生成什么物质?
 girlshuiling1年前2
girlshuiling1年前2 -
 76867175 共回答了17个问题
76867175 共回答了17个问题 |采纳率82.4%重铬酸钠强氧化性,特别是在酸性条件下氧化性更强,可以用其酸液洗玻璃仪器.
长期大量接触有可能致癌.它和亚硫酸钠反应,变成三价的铬离子,毒性会小很多.
带手套,不要用直接接触就没有什么问题.1年前查看全部
- 重铬酸钠和硫酸体系氧化环己醇的反应机制
 w3539932411年前1
w3539932411年前1 -
 1jtibgg2 共回答了15个问题
1jtibgg2 共回答了15个问题 |采纳率86.7%强氧化体系,让羟基成醛酮
反应机理一般是不需要的,这里牵涉到Cr的电子转移,不是一般的有机物反应过程1年前查看全部
- 重铬酸钠怎么读 求拼音 准确的!
 烤地瓜啊1年前1
烤地瓜啊1年前1 -
 知了大师 共回答了19个问题
知了大师 共回答了19个问题 |采纳率100%重 zhòng
铬 gè
酸 suān
钠 nà1年前查看全部
- 工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主
工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为:
(1)4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2高温 .
(2)2Na2CrO4+H2SO4⇌Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A. 反应(1)和(2)均为氧化还原反应
B. 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3
C. Na2CrO4中Cr元素的化合价为+7
D. 反应(2)中生成1mol的Na2Cr2O7时共转移7mol电子 孤单的优秀1年前1
孤单的优秀1年前1 -
 ben3sha 共回答了19个问题
ben3sha 共回答了19个问题 |采纳率94.7%解题思路:A.反应(2)中不存在元素的化合价变化;
B.反应(1)中O元素的化合价降低,Fe、Cr元素的化合价均升高;
C.化合物中正负化合价的代数和为0;
D.反应(2)为非氧化还原反应.A.反应(2)中不存在元素的化合价变化,则不属于氧化还原反应,故A错误;B.反应(1)中O元素的化合价降低,Fe、Cr元素的化合价均升高,所以氧化剂是O2,还原剂是FeO•Cr2O3,故B正确;C.化合物中正负化合价的代数...
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子的转移、氧化剂和还原剂的判断的考查,注意从化合价角度分析,难度不大.1年前查看全部
- 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2□+8CO2高温 .
②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①中的氧化剂是O2,还原剂是FeO•Cr2O3
C.□内的物质是Fe3O4
D.生成1 mol Na2Cr2O7,时共转移6 mol电子 亲爱的ミ1年前1
亲爱的ミ1年前1 -
 yyuu852 共回答了11个问题
yyuu852 共回答了11个问题 |采纳率72.7%解题思路:A.有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的升降;
B.得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
C.根据元素守恒及原子守恒判断;
D.根据Na2Cr2O7和转移电子之间的关系式计算.A.在反应前后,②中各元素的化合价都不变化,所以不是氧化还原反应,故A错误;
B.反应①氧气得电子化合价降低,所以氧气是氧化剂,FeO•Cr2O3中铁和铬元素化合价都升高,所以FeO•Cr2O3是还原剂,故B正确;
C.根据原子守恒知,□内的物质是Fe2O3,故C错误;
D.反应②中生成1molNa2Cr2O7需要2molNa2CrO4,由反应①可知,参加反应FeO•Cr2O3为1mol,反应中Fe元素化合价由+2价升高为+3价,Cr由+3升高为+6,故生成1molNa2Cr2O7共转移电子的物质的量为1mol×[1+(6-3)]=7mol,故D错误;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应基本概念与计算等,难度中等,注意根据化合价理解氧化还原反应.1年前查看全部
大家在问
- 1902÷31≈( )A.20B.30C.40
- 2关于X 的二元一次方程组{3X-Y=2K-1,4X+2Y=K.的解满足x>y求k的取值范围
- 3小丽给小方打电话,已知小方家电话号码是个能被3整除的五位数,这个五位数的中间三位都是8,末尾不是0,
- 4已知α与β是钝角,甲、乙、丙、丁四个人计算[1/6](α+β)的结果依次为28°,48°,60°,88°其中只有一个结果
- 5(2014•淮北二模)玉米中赖氨酸的含量较低,原因是赖氨酸合成过程中,天冬氨酸激酶和二氢吡啶二羧酸合成酶的活性受细胞内赖
- 6某厂甲车间人数比乙车间少12人,现在从甲车间调10人到乙车间,这时乙车间的人数比甲车间的3倍少4人
- 7最小心的动物是什么
- 8在标准状况下,将氧气和二氧化氮按1比4的体积充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐上生,假设瓶内液体不扩散,求瓶内
- 9飞船在太空中绝对静止能穿越时空吗?
- 10写出下列小写字母对应的大小字母并按字母表顺序排列。dfclzjqbmekhxnag
- 11跨经度最多的省区
- 12同时学 新概念,直捷英语,friends ,空中英语教室,大家说英语,看英文杂志,一天用多久都能学一课,会不会很多,
- 13she can't find the way to hospital .she looks ____(worry)
- 1424,25两题,
- 15she can make a large a___ of money if she tries her best
