漂白液漂白原理如题 漂白粉溶于水,与CO2 H2O反应生成碳酸钙沉淀,也就有了次氯酸.但次氯酸钠与CO2 H2O没有发生
 琬弋2022-10-04 11:39:541条回答
琬弋2022-10-04 11:39:541条回答漂白粉溶于水,与CO2 H2O反应生成碳酸钙沉淀,也就有了次氯酸.但次氯酸钠与CO2 H2O没有发生复分解反应,如何生成次氯酸?

已提交,审核后显示!提交回复
共1条回复
 gaga1979 共回答了11个问题
gaga1979 共回答了11个问题 |采纳率90.9%- 原理是这样的:次氯酸钙与二氧化碳,水反应的原因不知是生成了碳酸钙沉淀,还因为生成的次氯酸为弱电解质,次氯酸钠反映的原理就是生成了次氯酸这种弱电解质
- 1年前
相关推荐
- 为什么氯气通入氢氧化钠溶液可制漂白液而通入氢氧化钙溶液可制漂白粉
 唐2斩1年前4
唐2斩1年前4 -
 kyle315 共回答了21个问题
kyle315 共回答了21个问题 |采纳率90.5%氯气通入氢氧化钠,方程式:Cl2+2NaOH=NaCl+NaClO+H2O,其中NaClO是漂白液的主要成分,因其溶解度较高且溶液稳定性好而被制成漂白液.
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,其中Ca(ClO)2就是漂白粉的主要成分,因其溶解度低,制成溶液所需存放空间过大,用的时候太稀也不方便,就做成固体的漂白粉.实际上它和NaClO的漂白原理是一样的.1年前查看全部
- 制取漂白液的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,该反应的氧化剂与还原剂之比为( )
制取漂白液的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,该反应的氧化剂与还原剂之比为( )
A. 1:1
B. 1:2
C. 2:1
D. 3:2 坐209路车的男人1年前5
坐209路车的男人1年前5 -
 xwj0805 共回答了31个问题
xwj0805 共回答了31个问题 |采纳率83.9%解题思路:在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂,还原产物是氯化钠;氯气中氯元素化合价由0价升高为+1价,氯气是还原剂,氧化产物是次氯酸钠.根据产物可知起氧化剂与还原剂的氯气各占一半.据此解答.在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂,氯元素被还原,还原产物是氯化钠;氯气中氯元素化合价由0价升高为+1价,氯气是还原剂,氯元素被氧化,氧化产物是次氯酸钠.根据产物中氯原子化合价变化,可知起氧化剂与还原剂的氯气各占一半,所以反应的氧化剂与还原剂之比为1:1.
故选A.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应概念及计算,难度不大,判断氧化剂、还原剂后,可以根据电子转移守恒计算氧化剂和还原剂的物质的量之比.1年前查看全部
- 2011沈阳中考化学23题小立在家洗衣服时,发现一瓶刚过期的漂白液,对漂白液的漂白原理和该漂白液是否还有漂白作用产生了疑
2011沈阳中考化学23题
小立在家洗衣服时,发现一瓶刚过期的漂白液,对漂白液的漂白原理和该漂白液是否还有漂白作用产生了疑问.于是将其带到学校,在老师的指导下,与小组同学一起展开探究.
x05 【查阅资料】
x05 x05x05①制取漂白液的原理:Cl2+2NaOH==NaClO+NaCl+H2O,起有效成分是NaClO;
x05x05②漂白液的漂白原理:
x05x05NaClO在空气中很快发生反应:2NaClO+H2O+CO2==Na2CO3+2HClO
x05x05生成的HClO能使有色布条(含有机色素)褪色;
x05x05③HClO不稳定,易分解,分解后丧失漂白作用.
【提出问题】刚过期的漂白液是否失效?
【实验探究】该小组的实验报告如下:
实验操作x05实验现象x05实验结论
取适量该漂白液与烧杯中,x05 x05该漂白液已完全失效
小组同学对失效后漂白液的主要成分很感兴趣,纷纷提出猜想并作进一步探究.
【提出猜想】 小立猜想有:NaCL
x05x05x05x05小英猜想有:NaCl、Na2CO3
x05x05x05x05小洁猜想有:NaCl、Na2CO3、NaOH
【设计方案】
x05x05小组同学经过讨论,认为用足量的稀盐酸就可以验证x05x05x05的猜想成立.
x05x05为验证另两位同学的猜想,他们设计了如下方案:
实验步骤x05预期实验现象x05实验目的或预期结论
步骤①;取少量该漂白液于试管中,加入 ,静置,观察x05产生白色沉淀x05目的:
取上层清液于试管中,,观察x05 x05结论:
x05 猜想成立;否则,另一位同学猜想成立.
最后,他们综合小组同学的设计,经实验得出了结论. fhl1212121年前1
fhl1212121年前1 -
 单眼皮的男孩 共回答了21个问题
单眼皮的男孩 共回答了21个问题 |采纳率85.7%取适量该漂白液与烧杯中, 若放入彩色布条后布条不褪色 该漂白液已完全失效
小组同学经过讨论,认为用足量的稀盐酸就可以验证 小立 的猜想成立(加入HCL后如果无气泡,即表明没有NA2CO3).
步骤①;取少量该漂白液于试管中,加入 足量BaCl2溶液 ,静置,观察 是否x09产生白色沉淀x09目的:检验溶液中是否存在CO3 2-离子
步骤②:取上层清液于试管中,加入酚酞 ,观察溶液是否变红结论:若变红,溶液中有OH-离子,小洁猜想正确,否则小英猜想正确1年前查看全部
- 生活离不开化学,应用所学知识选出表中酸性最强的物质( ) 选项 A B C D 物质 肥皂水 漂白液 柠檬汁 玉米粥
生活离不开化学,应用所学知识选出表中酸性最强的物质( ) 选项 A B C D 物质 肥皂水 漂白液 柠檬汁 玉米粥 PH 10 12 3.5 6.8 A.A B.B C.C D.D  only8141年前1
only8141年前1 -
 chiqiaoyun 共回答了14个问题
chiqiaoyun 共回答了14个问题 |采纳率92.9%肥皂水、漂白液的pH均大于7,均显碱性;柠檬汁、玉米粥的pH均小于7,均显酸性,但柠檬汁的pH比玉米粥小,所以柠檬汁的酸性最强.
故选C.1年前查看全部
- (2014•房山区一模)某化学小组用下图1装置电解CuCl2溶液制少量漂白液:
(2014•房山区一模)某化学小组用下图1装置电解CuCl2溶液制少量漂白液:
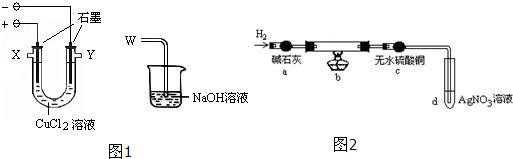
(1)其阳极的反应式是:______;导气管W端应与出气口______连接.
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.查阅资料显示:
化学小组分析提出:①红色物质可能有______、或Cu2O、或二者都有;②白色物质为CuCl物质名称及化学式 氯化亚铜CuCl 碱式氯化铜Cu2(OH)3Cl 性质 白色固体、不溶水 绿色固体、不溶水
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:
取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
①碳棒上的红色物质是______,无水硫酸铜的作用是______;
②d中反应的离子方程式是______;
③装置b中发生反应的化学方程式是______.
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为______.
⑤阴极上产生白色物质的物质的量是
molW1−W2 35.5 ;若装置b冷却时不继续通H2,则计算所得Cu+的产率会______(偏大、偏小、不变).
molW1−W2 35.5  ee的抱抱熊1年前1
ee的抱抱熊1年前1 -
 再见睡美人 共回答了12个问题
再见睡美人 共回答了12个问题 |采纳率83.3%解题思路:(1)电解氯化铜溶液,铜离子在阴极得到电子析出铜,氯离子在阳极失电子生成氯气,氯气用氢氧化钠溶液吸收;
(2)依据可能和假设红色物质可能为铜或氧化亚铜;
(3)①无水硫酸铜不变色说明阴极碳棒上的产物与氢气反应产物中没有水;
②根据CuCl与氢气反应生成了氯化氢,通过检验氯离子判断是否存在CuCl;
③装置b中发生反应的化学方程式为氯化亚铁与氢气反应生成铜和氯化氢;
④电极氯化铜溶液阴极铜离子得到电子生成铜离子和氯化亚铜,据此写成电极反应的离子方程式;
⑤依据反应2CuCl+H2=2Cu+2HCl,反应前后固体质量变化为氯元素质量分析计算,装置b冷却时不继续通H2,氧气会进入反应,使亚铜离子产率减少;(1)电解氯化铜溶液,铜离子在阴极得到电子析出铜,氯离子在阳极失电子生成氯气,氯气用氢氧化钠溶液吸收;
故答案为:2Cl--2e-=Cl2↑;X;
(2)依据假设和物质现象分析,红色物质可能为Cu或Cu2O、或二者都有;②白色物质为CuCl;
故答案为:Cu;
(3)①由于无水硫酸铜不变色,证明b中反应产物没有水生成,碳棒上的红色物质中没有氧元素,一定不会含有氧化亚铜,一定含有铜;无水硫酸铜来检验红色物质中有无Cu2O;
故答案为:铜,检验红色物质中有无Cu2O;
②假设②中,白色物质若为CuCl,CuCl与氢气反应会生成氯化氢,将生成产物通入硝酸银溶液中,若生成了白色沉淀,证明白色物质为CuCl,反应的离子方程式为:
Ag++Cl-=AgCl↓;
故答案为:Ag++Cl-=AgCl↓;
③装置b中发生反应为CuCl与氢气反应,反应的化学方程式为:2CuCl+H2=2Cu+2HCl,
故答案为:2CuCl+H2=2Cu+2HCl;
④电解CuCl2溶液时,阴极上发生的反应为铜离子得到电子生成铜:Cu2++2e-=Cu和铜离子失去电子生成氯化亚铜:Cu2++e-+Cl-=CuCl;
故答案为:Cu2++e-+Cl-=CuCl↓;
⑤2CuCl+H2=2Cu+2HCl,反应前后固体质量变化为氯元素质量,白色固体为CuCl,所以n(CuCl)=n(Cl)=
W1−W2
35.5mol,装置b冷却时不继续通H2,空气中的氧气进入会增加固体质量使测定亚铜离子产率减小;
故答案为:
W1−W2
35.5mol,偏小;点评:
本题考点: 电解原理;制备实验方案的设计.
考点点评: 本题考查物质的检验与鉴别,题目难度中等,该题是高考中的常见题型,试题综合性强,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.该类试题需要注意的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象.1年前查看全部
- NaOH、Cl2和H2都是重要的化工生产原料,工业上可用它们中的两种物质生产漂白液,其
 黑头发甩甩1年前1
黑头发甩甩1年前1 -
 simon_yxd 共回答了23个问题
simon_yxd 共回答了23个问题 |采纳率95.7%是NaOH、Cl2,反应方程式是:
Cl2+2NaOH=NaCl+NaClO+H2O1年前查看全部
- 彩漂液与漂白液有什么区别 主要用途是什么呀 具体怎么用啊!从来没用过这类东西 越具体越好
彩漂液与漂白液有什么区别 主要用途是什么呀 具体怎么用啊!从来没用过这类东西 越具体越好
顺便说下哪个牌子好 希望用过的推荐呀 wcm_zjhz1年前1
wcm_zjhz1年前1 -
 zhangxc000 共回答了18个问题
zhangxc000 共回答了18个问题 |采纳率94.4%彩漂可以用来清理彩色衣服上的重污渍,不伤害衣服本身的质量和颜色,漂白液只能洗白颜色的衣物,一旦碰触有颜色的衣物,就会弄花衣服的
还有,无论是使用彩漂液还是漂白液,都要先和水或加了洗衣粉的水均匀了以后再放衣服,千万不能把彩漂液或漂白液直接倒到衣服上,否则衣服也会花的1年前查看全部
- 漂白液 漂白粉 漂粉精 漂白精 都什么东西
 oak0001年前3
oak0001年前3 -
 我是你的小老虎 共回答了24个问题
我是你的小老虎 共回答了24个问题 |采纳率91.7%漂白液 :氯气与氢氧化钠溶液反应制得以次氯酸钠为有效成分的溶液
漂白粉 :氯气与石灰乳反应制得以次氯酸钙为有效成分固态混合物
漂粉精 :氯气与石灰乳充分反应,并使次氯酸钙成为主要成分,则得到漂粉精
漂白精:次氯酸钠的成分比漂白液中的高1年前查看全部
- 感觉金能溶于漂白液,碘水(KI+I2=KI3),过硫酸?
感觉金能溶于漂白液,碘水(KI+I2=KI3),过硫酸?
金能溶于漂白液,过硫酸?
比如漂白粉(CaCl2+Ca(ClO)2)
最好是NaCl+NaClO
2Au++5Cl-+3Cl0-+H2O=2[AuCl4]-+6OH-
(最好有NaHCO3,防止pH升得太高,降低ClO-氧化能力)
再说碘水:I2虽氧化性不强,但I-配位性强
2Au+3I2+2I-=2[AuI4]-
查表得:
S2O82-+2e-=2SO42- +2.010
Au3++3e-=Au +1.498
所以过硫酸氧化金应该绰绰有余? fjbo1年前2
fjbo1年前2 -
 王奇怪怪 共回答了14个问题
王奇怪怪 共回答了14个问题 |采纳率78.6%前两个是定性分析,没有具体数据谁也不知道.
后面一个只说明热力学是可行的,但是动力学,也就是具体的反应速率就很难说了,比如过硫酸氧化高锰酸根还要银作催化剂.1年前查看全部
- 漂白液、漂粉精、漂白粉的差别是什么?
 可六三1年前5
可六三1年前5 -
 偶然相逢1010 共回答了20个问题
偶然相逢1010 共回答了20个问题 |采纳率90%成分不一样
漂白液 次氯酸钠,氯化钠的混合水溶液
漂白精 次氯酸钙,氯化钙的混合物(有的为片)
漂白粉 次氯酸钙,氯化钠的混合粉末1年前查看全部
- 家庭常用洗涤剂的pH如表所示,其中碱性最强的是( ) 洗涤剂 洗发露 漂白液 肥皂水 洁厕灵 pH 7.6 13.4
家庭常用洗涤剂的pH如表所示,其中碱性最强的是( )
洗涤剂 洗发露 漂白液 肥皂水 洁厕灵 pH 7.6 13.4 10.5 1.0
A.洗发露
B.漂白液
C.肥皂水
D.洁厕精 飞璇03281年前1
飞璇03281年前1 -
 ara126jn8 共回答了15个问题
ara126jn8 共回答了15个问题 |采纳率93.3%解题思路:当溶液的PH小于7时,呈酸性.当溶液的PH大于7时,呈碱性.当溶液的PH>7时,随着PH的升高碱性增强.洁厕精的PH=1.0,显酸性.洗发露、肥皂水、漂白液等物质的PH大于7,显碱性.漂白液的PH最大,碱性最强.
故选B.点评:
本题考点: 溶液的酸碱性与pH值的关系.
考点点评: 解答本题要充分理解溶液的酸碱性和溶液PH之间的关系,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 化学与生产、生活密切相关。下列叙述中,不正确的是 A.制作计算机芯片的材料是Si晶体,漂白液的有效成分是NaClO B.
化学与生产、生活密切相关。下列叙述中,不正确的是
A.制作计算机芯片的材料是Si晶体,漂白液的有效成分是NaClO B.二氧化碳和氮气均是造成温室效应的气体 C.食醋可去除水垢,NH 4 Cl溶液可去除铁锈 D.SO 2 和NO 2 都能使雨水的pH < 5.6,造成酸雨  尖子牙1年前1
尖子牙1年前1 -
 ysyswan 共回答了12个问题
ysyswan 共回答了12个问题 |采纳率100%1年前查看全部
- 在抗震救灾中要用大量漂白粉和漂白液杀菌消毒.下列说法中正确的是( )
在抗震救灾中要用大量漂白粉和漂白液杀菌消毒.下列说法中正确的是( )
A. 漂白粉是纯净物,漂白液是混合物
B. 漂白粉的有效成分是Ca(ClO)2
C. 工业上将氯气通入澄清石灰水制取漂白粉
D. 漂白液的有效成分是Na2O2 magiclili1年前1
magiclili1年前1 -
 陈阳 共回答了14个问题
陈阳 共回答了14个问题 |采纳率85.7%解题思路:A、根据物质的组成成分判断;
B、根据漂白粉的有效成分;
C、根据工业制取漂白粉的原理;
D、漂白液的有效成分是次氯酸钠;A、因漂白粉的主要成分是氯化钙和次氯酸钙,是混合物;漂白液的主要成分是氯化钠和次氯酸钠,是混合物,故A错误;
B、因漂白粉的主要成分:氯化钙和次氯酸钙,有效成分是次氯酸钙,故B正确;
C、因为澄清石灰水中氢氧化钙浓度太低成本较高,工业上通常用石灰乳与氯气反应制取漂白粉,故C错误;
D、漂白液的主要成分是氯化钠和次氯酸钠,有效成分是次氯酸钠,故D错误;
故选B.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题主要考查了物质的组成成分,要注意区分主要成分和有效成分.1年前查看全部
- 氯化钠加洁厕灵(主要成分无机酸)加漂白液(含次氯酸钠)是否可以产生氯气
 我第一次用xx1年前2
我第一次用xx1年前2 -
 盖棺尸论 共回答了12个问题
盖棺尸论 共回答了12个问题 |采纳率83.3%可以1年前查看全部
- (四009•重庆)下列物质中碱性最强的是( ) 选项 A B C D 物质 玉米粥 橙汁 漂白液 肥皂水 pH 6.8
(四009•重庆)下列物质中碱性最强的是( )
选项 A B C D 物质 玉米粥 橙汁 漂白液 肥皂水 pH 6.8 3.5 它四 它0
A.A碱性最强
B.B碱性最强
C.C碱性最强
D.D碱性最强 htm8881年前1
htm8881年前1 -
 mumian326 共回答了17个问题
mumian326 共回答了17个问题 |采纳率82.4%解题思路:当溶液的pH大于7时,呈碱性.当溶液的pH>7时,随着pH的升高碱性增强.玉米粥、橙汁pPH小于7,显酸性;漂白液、肥皂水的pH大于7,显碱性;漂白液的pH大于肥皂水的pH,所以漂白液的碱性比肥皂水强.
故选手.点评:
本题考点: 溶液的酸碱性与pH值的关系.
考点点评: 解答本题要充分理解溶液的pH与溶液酸碱性强弱之间的关系方面的知识,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 漂白粉,漂白精,漂粉精,漂白液都是啥?(有效成分必要成分)怎么制取.
 fallinglabyrinth1年前1
fallinglabyrinth1年前1 -
 afamlspa 共回答了21个问题
afamlspa 共回答了21个问题 |采纳率100%漂白粉是氢氧化钙、氯化钙和次氯酸钙的混合物,其主要成分是次氯酸钙[Ca(ClO)2 ]
漂白精的主要成分是氯化钙和次氯酸钙,且混合在水里.
漂粉精又名高效漂白粉,主要成分是次氯酸钙,根据生产工艺的不同,还含有氯化钙或氯化钠及氢氧化钙等成分,漂粉精具有很强的杀菌、消毒、净化和漂白作用,在洗毛、纺织、地毯、造纸等行业具有广泛的应用.主要是由次氯酸钙与水和二氧化碳发生反应生成具有强氧化性的次氯酸.由次氯酸消除污渍.
漂白液是次氯酸钙和氯化钙的水溶液
漂白粉是由氯气与氢氧化钙(消石灰)反应而制得
漂白精在工业上常用:2Cl₂+2Ca(OH)2=CaCl₂+Ca(ClO)₂+2H2O 来制取
漂白液制取原理:2cl2+2Ca(OH)2=Cacl2+Ca(clo)2+2H2o1年前查看全部
- 漂白液(84)消毒液的制备原理
 小小剑侠1年前3
小小剑侠1年前3 -
 批着狼皮的羊G 共回答了20个问题
批着狼皮的羊G 共回答了20个问题 |采纳率75%Cl2 + 2 NaOH = NaCl + NaClO + H2O
将氯气通入氢氧化钠溶液,就得到84消毒液1年前查看全部
- 工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol/LNaOH溶液中得到漂白液。某同学想在实验室探究
工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol/LNaOH溶液中得到漂白液。某同学想在实验室探究Cl 2 性质并模拟制备漂白液,下图是部分实验装置。已知KMnO 4 与盐酸溶液反应可以制取Cl 2 。 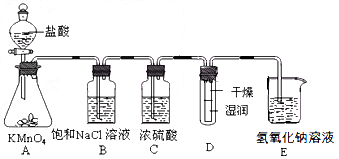
⑴配制450 mL物质的量浓度为0.375 mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和__________。
⑵浓硫酸的作用是____________________。
⑶装置E中发生化学反应的离子方程式为____________________。
⑷装置B中饱和NaCl溶液可用于除去Cl 2 中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl 2 中HCl气体的原理(用离子方程式表示和文字说明)
____________________。
⑸实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl 2 的密度比空气大,可能是试管下部Cl 2 的浓度大于试管上部Cl 2 的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_______________;如需改进,请简述设计方案______________(若认为合理。则此问可不作答)。
⑹氯元素含量为10%的漂白液355 g,其中含NaClO的物质的量为_________mol。 4620564651年前1
4620564651年前1 -
 zonglei2006 共回答了20个问题
zonglei2006 共回答了20个问题 |采纳率90%⑴500 mL容量瓶⑵干燥氯气⑶Cl 2 + 2OH - = Cl - + ClO - + H 2 O⑷HCl溶于水电离出的H + 和饱和NaCl溶液中的Cl - 都会对反应Cl 2 + H 2 O H + + Cl - + HClO 起到抑制作用⑸不合理,实验进行中Cl 2...1年前查看全部
- 工业制漂白液的化学方程式
 丝丝入扣的菠菜1年前1
丝丝入扣的菠菜1年前1 -
 边鸟 共回答了17个问题
边鸟 共回答了17个问题 |采纳率94.1%LZ您好!
CaCO3=高温==CaO+CO2↑
CaO+H2O=Ca(OH)2
2Ca(OH)2+2CL2=CaCL2+Ca(CLO)2+2H2O1年前查看全部
- 用游泳池的漂白液来漂白白色的校服,
 flower111年前2
flower111年前2 -
 fa123 共回答了22个问题
fa123 共回答了22个问题 |采纳率90.9%这个如果你要用当然没有问题,想用什么又没有人会阻止你,只不过这种漂白液会将校服上面带颜色的也给褪色了,很可能使得校服颜色混合,最好局部漂白1年前查看全部
- 漂白液变质是与空气中的二氧化碳反应,请问是生成碳酸钠还是碳酸氢钠?与二氧化碳的量有关吗?次氯酸与碳酸,碳酸氢根的酸性排序
漂白液变质是与空气中的二氧化碳反应,请问是生成碳酸钠还是碳酸氢钠?与二氧化碳的量有关吗?次氯酸与碳酸,碳酸氢根的酸性排序是怎样的?
 hsrkathy1年前3
hsrkathy1年前3 -
 jshliu 共回答了23个问题
jshliu 共回答了23个问题 |采纳率91.3%这个问题其实很简单,
因为HClO的酸性介于H2CO3与HCO3-之间.
所以ClO-的碱性介于HCO3-和CO32-之间.
假定生成碳酸根,那么是2 NaClO + CO2 + H2O = Na2CO3 + 2 HClO,
由于CO32-结合H+能力最强(碱性最强),会继续和次氯酸反应,生成HCO3-.
所以说不管CO2少量还是过量都得到HCO3-,但不能得到CO32-1年前查看全部
- 醋酸和漂白液的化学方程式
 rt65681年前1
rt65681年前1 -
 陕西MT 共回答了20个问题
陕西MT 共回答了20个问题 |采纳率100%NaClO + CH3COOH === HClO + CH3COONa
漂白液酸化后,漂白杀菌作用大大提高.1年前查看全部
- 84漂白液的成分是什么?去霉效果如何?
 renrong1年前1
renrong1年前1 -
 sxb71 共回答了15个问题
sxb71 共回答了15个问题 |采纳率80%一楼的想当然,不懂不要乱回答嘛!
84漂白液的主要成分是次氯酸钠,这是一种含氯漂白剂,比双氧水的氧化性强烈多了!漂白霉斑当然完全可以了,不过要看具体在什么物品上的霉斑?不能乱用的.
很多面料都无法承受84的剧烈作用,比如丝绸、羊毛、兔毛、驼毛这些蛋白质纤维,合成纤维中的锦纶,因为化学结构跟蛋白质近似,所以同样也不能用84漂白.一旦用了,局部强力下降严重,丝绸或者毛的先是变黄,再就是破洞.
聚酯(涤纶)、混纺、棉布、麻这些纤维织成的面料不怕84,可以使用.1年前查看全部
- 漂白粉(次氯酸钙)在空气中变质,漂白液(次氯酸钠)为什么呢?
 leftist1年前4
leftist1年前4 -
 身长八尺周宽九丈 共回答了19个问题
身长八尺周宽九丈 共回答了19个问题 |采纳率94.7%次氯酸钙 在空气中易和二氧化碳和水反应生成碳酸钙和次氯酸,而次氯酸不稳定易分解,所以容易变质,次氯酸钠 比 次氯酸钙更稳定, 所以不会变质,其实原理都是 氯元素变价的问题.1年前查看全部
- 为什么次氯酸钠是漂白液而次氯酸钙是漂白粉?
为什么次氯酸钠是漂白液而次氯酸钙是漂白粉?
RT. 军中紫花1年前2
军中紫花1年前2 -
 三毛流浪儿 共回答了30个问题
三毛流浪儿 共回答了30个问题 |采纳率83.3%因为次氯酸钠在水中的溶解度很大,通常使用的也是不同浓度的水溶液,而次氯酸钙溶解度很小.我们通常使用的都是粉剂.
2者都能释放出次氯酸根,具有强氧化性,能漂白有色织物、油漆等,也能腐蚀金属和消毒.1年前查看全部
- 2013年H7N9禽流感肆虐期间为了保证卫生环境,常使用漂白液和漂白粉对环境和饮用水进行杀菌、消毒,以抑制大规模传染病爆
2013年H7N9禽流感肆虐期间为了保证卫生环境,常使用漂白液和漂白粉对环境和饮用水进行杀菌、消毒,以抑制大规模传染病爆发.回答下列问题:
(1)漂白粉的有效成分是(填化学式)______;
(2)某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质______(填序号).
A.酸性B.碱性C.强氧化性D.还原性
(3)工业上用氯气通入石灰乳[Ca(OH)2]制取漂白粉的化学方程式:______.
(4)已知二氧化硫和亚硫酸盐具有较强的还原性.若将少量的SO2通入漂白粉溶液中,有同学认为发生的反应为:Ca(ClO)2+SO2+H2O═CaSO3↓+2HClO.你认为该同学的说法是否正确?______(填“正确”或“不正确”),若不正确请说明理由______若正确此空不填.
(5)二氧化氯是世卫组织确认的A级新型高效安全的消毒剂,其安全性远高于氯气.制备方法之一是:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,当转移0.2mol电子时,参加反应的还原剂的物质的量为______. xgww52177581年前1
xgww52177581年前1 -
 patrickhuangxf 共回答了23个问题
patrickhuangxf 共回答了23个问题 |采纳率95.7%解题思路:(1)漂白粉的主要成分为氯化钙和Ca(ClO)2,次氯酸根离子具有强氧化性;
(2)发现溶液先变蓝色后褪色,说明溶液呈碱性,且具有强氧化性;
(3)氯气通入石灰乳,反应生成氯化钙和次氯酸钙;
(4)次氯酸具有强氧化性,可与二氧化硫发生氧化还原反应;
(5)反应中HCl为还原剂,被氧化生成氯气,化合价由-1价升高到0价.(1)漂白粉的主要成分为氯化钙和Ca(ClO)2,次氯酸根离子具有强氧化性,则Ca(ClO)2为有效成分,故答案为:Ca(ClO)2;
(2)发现溶液先变蓝色后褪色,说明溶液呈碱性,原因是次氯酸钙为强碱弱酸盐,水解呈碱性,水解生成的HClO具有强氧化性,具有漂白作用,故答案为:BC;
(3)氯气通入石灰乳,反应生成氯化钙和次氯酸钙,反应的方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(4)次氯酸具有强氧化性,可与二氧化硫发生氧化还原反应,则反应后不可能生成亚硫酸钙,应生成硫酸钙,
故答案为:不正确;因为亚硫酸钙(CaSO3)具有强的还原性,会被HClO氧化生成硫酸钙;
(5)反应中HCl为还原剂,被氧化生成氯气,化合价由-1价升高到0价,当转移0.2mol电子时,参加反应的还原剂的物质的量为为0.2mol,故答案为:0.2mol.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;含硫物质的性质及综合应用.
考点点评: 本题考查漂白粉的性质及制备,注意利用信息提供的反应物与生成物书写反应,侧重化学反应方程式的考查,题目难度不大.1年前查看全部
大家在问
- 1写出下列人称的所属格形式.I______ you_______ he _______ she______it______
- 2帮我解答数学题~@!AB两人以一定的速度从甲往乙,A每步距离比B大10%,在单位时间内,A走的步数比B少10%.如果两人
- 3假如你的好朋友莉萨(Lisa)喉咙疼,请你用英语写一封信告诉她应该怎么做.不少于5句话.
- 4elder与old的区别,能用简单的句子举例吗?
- 5制甜酒时在中间挖一个凹坑的目的是什么?
- 6基因型分别为ddEeFF和DdEeff的2种豌豆杂交,在3对等位基因各自独立遗传的条件下,其子代表现型不同于2个亲本的个
- 7关于解缙的诗有一首他的诗,第一句是“鹅鹅鹅鹅鹅鹅鹅”第二句是『 』 后两句是:“食尽皇家千钟粟,凤凰何少尔何多?”有人知
- 8高中数学解析几何问题设直线l过点A(0,1),其方向向量为e=(1,k)(k>0),令向量n满足n·e=0.双曲线C方程
- 9下列动物的行为不属于鸟类生殖行为的是( )
- 101.CO(NH2)2含有45kg净重50kg求:(1)纯度(2)N在化合物中的质量分数.2.CO(NH2)2净重50kg
- 11the long term physical effects are not yet known
- 12卖油翁.练习.1.本文告诉我们一个什么道理?用一个成语概括,还给你一个什么启示?2.说说一对文中两个人物的看法,用简洁的
- 13求助!20CrMnTi钢材的正火
- 14把“is,He,tall,strong,and”连成句子
- 15结合自身实际谈谈学习辩证唯物主义物质观、运动观原理的意义

