2molCO分子中含有几个二氧化碳分子,总共有几个原子?
 0o雾雨o02022-10-04 11:39:541条回答
0o雾雨o02022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 sparkhoo 共回答了21个问题
sparkhoo 共回答了21个问题 |采纳率90.5%- CO2
分子1.204乘以10的24次方
原子3.612乘以10的24次方
CO
分子1.204乘以10的24次方
原子2.408乘以10的24次方 - 1年前
相关推荐
- CO与H2可在一定条件下发生反应生成燃料甲醇,现将2molCO和4molH2置于一体积不变的2L密闭容器中,反应生成气态
CO与H2可在一定条件下发生反应生成燃料甲醇,现将2molCO和4molH2置于一体积不变的2L密闭容器中,反应生成气态甲醇:CO(g)+2H2(g)⇌CH3OH(g)AH=akj•mol-1
测定不同条件、不同时间段内CO的转化率,得到如下数据:
(1)根据上述信息,可判读a______0 (填“>”、“<”、“=”或“无法判断”)
1小时 2小时 3小时 4小时 T1 40% 70% 80% 80% T 2 55% 65% a1 a2
(2)T1℃下,第1小时内H2的平均反应速率为______mol•L-1•h-1该温度下的化学平衡常数为______.
(3)根据所给的数据作出的下列判断中正确的是______.
A.温度T1℃时,反应在2小时的时候混合气体密度比1小时的时候打大
B.温度T2℃时,反应在2小时的时候混合气体平均相对分子质量比1小时的时候大
C.温度T2℃时,反应在2小时的时候v正(H2)=2v逆(CH3OH)
D.温度T2℃时,a1=a2>65%
(4)在图中画出温度T2℃时,CO物质的量浓度随时间的变化趋势
 ccbcb1年前1
ccbcb1年前1 -
 濮阳 共回答了23个问题
濮阳 共回答了23个问题 |采纳率82.6%解题思路:(1)根据单位时间内物质的转化率的变化确定温度的高低;
(2)化学反应速率之比等于方程式的系数之比;根据三行式计算化学平衡常数数;
(3)A、据ρ=[m/V]求算;
B、据M=[混合气体的质量总和/混合气体的物质的量总和]结合平衡移动进行判断;
C、平衡后正逆反应速率相等,2h时并未平衡;
D、T2温度较高,2h时可能已经达到平衡状态.
(4)T2温度较高,达到平衡时间短,CO浓度高.(1)在时间间隔一个小时内,T2温度下一氧化碳的转化率变化较大,所以T2温度较高,在1小时时,温度从T1到T2,升高温度,则一氧化碳的转化率降低,所以平衡逆向移动,该反应是放热的,即a<0,故答案为:<;
(2)T1℃下,在第一小时内用CO表示的反应速率为:
2mol×40%
2L
1h=0.4mol/(L•h),H2表示的化学反应速率是CO速率的一倍,即为0.8mol/(L•h);
T1℃下,CO(g)+2H2(g)⇌CH3OH(g)
初始浓度:1 2 0
变化浓度:0.8 1.6 0.8
平衡浓度:0.2 0.4 0.8
则K=[0.8
0.2×0.42=25,故答案为:0.8;25;
(3)A、混合气体质量不变,容器体积不变,所以密度始终不变,故A错误;
B、M=
混合气体的质量总和/混合气体的物质的量总和],温度升高,平衡逆向移动,混合气体的物质的量增多,M减小,故B正确;
C、T2温度较高,2h时可能已经达到平衡状态,也可能未达到平衡状态,故C错误;
D、T2温度较高,2h时可能已经达到平衡状态,a1=a2=65%,故D错误;
故选B.
(4)T2温度较高,达到平衡时间短,CO浓度高,如图: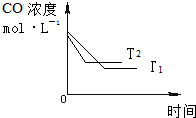 ,故答案为:
,故答案为: .
.点评:
本题考点: 化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了平衡移动、化学平衡常数的计算、浓度时间图象,题目难度中等.1年前查看全部
- 化学平衡的计算题在密闭容器中,将2molCO与10molH2O混合加热到800℃,达到平衡后,CO(g)+H2O(g)=
化学平衡的计算题
在密闭容器中,将2molCO与10molH2O混合加热到800℃,达到平衡后,CO(g)+H2O(g)==CO2(g)+H2(g),且k=1 求CO转化为CO2 的转化率 好人与kk1年前1
好人与kk1年前1 -
 鹤羽柔心 共回答了21个问题
鹤羽柔心 共回答了21个问题 |采纳率100%K=1=([CO2]*[H2])/([CO]*[H2O])
=x^2/{(2-x)*(10-x)}
x=5/3,所以CO的转化率=5/3/2*100%=83%1年前查看全部
- 目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的密闭容器中,充入2molCO
目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的密闭容器中,充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1测得CO2和CH3OH(g)的浓度随时间变化如图1

(1)从反应开始到平衡,CO2的平均反应速率v(CO2)=______mol/(L•S).
(2)下列措施中能使CO2的转化率增大的是(填写字母代号)______.
A.加入催化剂
B.升高温度
C.恒容充入He(g),使体系压强增大
D.再充入1molCO2和3molH2
(3)下列说法正确的是(填字母代号)______.
A.反应进行到3S时达到平衡
B.只有平衡时有v(CO2)/v(H2)=1:3
C.反应进行到3S时浓度关系为c(CH3OH)=c(CO2)
D.2molCO2和6molH2反应达到平衡时放热73.5kJ
(4)高甲醇分子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是______.
A.CH3OH的燃烧热为192.9kJ•mol-1
B.CH3OH转变成H2的过程一定要吸收能量
C.反应②中的能量变化如图2
D.根据②推知反应:
CH3OH(1)+[1/2]O2(g)=CO2(g)+2H2(g)的△H<-192.9kJ•mol-1. rr光棍男1年前1
rr光棍男1年前1 -
 萱妃 共回答了13个问题
萱妃 共回答了13个问题 |采纳率92.3%解题思路:(1)根据反应速率v=[△c/△t]来计算;
(2)根据影响化学平衡移动的因素判断;
(3)根据化学平衡特征判断;
(4)利用盖斯定律,判断各选项.(1)从反应开始到平衡,CO2的平均速率v(CO2)=[△c/△t]=
(1−0.25)mol/L
10s=0.075mol/(L•s),故答案为:0.075;
(2)A、催化剂不影响化学平衡的移动,CO2转化率不变,故A错误;
B、△H<0,正反应方向放热,升高温度,平衡向逆反应方向移动,CO2转化率降低,故B错误;
C、恒容充入He(g),化学平衡不移动,CO2转化率不变,故C错误;
D、再充入1molCO2和3molH2,体系压强增大,由于正反应方向,为气体体积减小的方向,化学平衡向正反应方向移动,CO2转化率增大,故D正确;
故选D;
(3)A.反应进行到10s时达到平衡,故A错误;
B.不是化学平衡状态也有可能v(CO2)/v(H2)=1:3,故B错误;
C.反应进行到3S时图1中两条曲线相交,即c(CH3OH)=c(CO2),故C正确;
D.根据CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1可知:1molCO2(完全转化时,放出49.0kJ热量,根据图1可知,CO2转化了(1mol/L-0.25mol/L)×2L=1.5mol,则放出1.5mol×(-49.0kJ•mol-1)=73.5kJ,故D正确;
故选CD;
(4)A、反应②甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol;而1 mol CH3OH充分燃烧生成二氧化碳和水放出的热量大于192.9 kJ,即燃烧热大于192.9kJ•mol-1,故A错误;
B、CH3OH转变成H2的过程按照反应①是吸热反应,按照②反应是放热反应,所以不一定要吸收能量,故B错误;
C、图中表示的是放热反应,而反应②是放热反应,符合题意,故C正确;
D、CH3OH(l)燃烧放出热量小于192.9kJ,由于反应放热,△H<0,故CH3OH(1)+[1/2]O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1,故D错误;故选C.点评:
本题考点: 物质的量或浓度随时间的变化曲线;反应热和焓变;化学平衡的影响因素.
考点点评: 考查方程式书写、反应速率计算、平衡状态特征等,难度不大;解化学平衡图象题要注意“四看”:一看点:看起点、交点、拐点等;二看线:看线的走向和变化趋势:三看面:看清横坐标和纵坐标表示的物理量;四看要不要作辅助线:看是否需要作等温线或等压线.1年前查看全部
- 2molCO(NH2)2所含H原子数跟多少克H2O所含H原子数相等?
 sethst1年前2
sethst1年前2 -
 curlyhairdo 共回答了19个问题
curlyhairdo 共回答了19个问题 |采纳率94.7%2molCO(NH2)2所含H原子数为2×2×2=8mol
跟4molH2O所含H原子数相等
H2O摩尔质量为18g/mol
H2O质量为4mol×18g/mol=72g1年前查看全部
- 将2molH 2 O和2molCO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
将2molH 2 O和2molCO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H 2 O(g)
2H 2 (g)+O 2 (g)2CO(g)+O 2 (g)
2CO 2 (g)
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是______和______或______和______.(填化学式)
(2)若平衡时,O 2 和CO 2 的物质的量分别为:n(O 2 ) 平 =amol,n(CO 2 ) 平 =bmol.试求n(H 2 O) 平 =______.(用含a、b的代数式表示). _yalqbf2ih_0a_531年前1
_yalqbf2ih_0a_531年前1 -
 xiaolm036 共回答了25个问题
xiaolm036 共回答了25个问题 |采纳率92%(1)由两个方程式可知,两个反应靠O 2 联系起来,只要知道O 2 和另外任意一种气体的平衡浓度,均可求出混合气体的平衡组成,当知道H 2 O和H 2 或CO和CO 2 的平衡浓度时,由于两个方程式无法通过O 2 建立反应量的关系,所以无法求其混合气体的平衡组成,因而不能是这两组,故答案为:H 2 O,H 2 ;CO,CO 2 ;
(2)因n(CO 2 ) 平 =bmol,由方程式 2CO(g)+O 2 (g)
2CO 2 (g)可知平衡时反应的O 2 为
b
2 mol,
则反应2H 2 O(g)
2H 2 (g)+O 2 (g)中生成O 2 的物质的量为(a+
b
2 )mol,
消耗的水为2×(a+
b
2 )mol=(2a+b)mol,
所以n(H 2 O) 平 =2mol-(2a+b)mol=(2-2a-b)mol,
故答案为:(2-2a-b)mol.1年前查看全部
- 将2molCO 2 和6molH 2 充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO 2 (g)
将2molCO 2 和6molH 2 充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO 2 (g)+3H 2 (g)
 CH 3 OH(g)+H 2 O(g) ΔH=- 49.0 kJ·mol -1 。反应达到平衡时,改变温度(T)和压强(P),反应混合物中CH 3 OH的“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是
CH 3 OH(g)+H 2 O(g) ΔH=- 49.0 kJ·mol -1 。反应达到平衡时,改变温度(T)和压强(P),反应混合物中CH 3 OH的“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是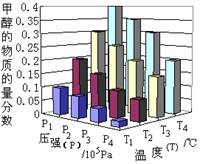
A.P 3 >P 2 T 3 >T 2 B.P 2 >P 4 T 4 >T 2 C.P 1 >P 3 T 3 >T 1 D.P 1 >P 4 T 2 >T 3  yijcz1年前1
yijcz1年前1 -
 jx009qjpl 共回答了17个问题
jx009qjpl 共回答了17个问题 |采纳率94.1%D
该反应是体积减小的、放热的可逆反应,所以温度越低或压强越大,生成物甲醇的含量越多,所以根据图像可知,温度是T 1 >T 2 >T>T 3 ,压强是P 1 >P 2 >P 3 >P 4 ,答案选D。1年前查看全部
- 2molCO(NH2)2所含氧原子数与_gH2O中所含氧原子数相等,为_?
 cyz55551年前1
cyz55551年前1 -
 nanouril 共回答了11个问题
nanouril 共回答了11个问题 |采纳率81.8%2molCO(NH2)2所含氧原子数为2mol,H2O中所含氧原子数也应为2mol,所以是2x18=36g1年前查看全部
- 已知某烃的含氧衍生物CxHyOz,其相对分子质量为60,若1mol该有机物完全燃烧得2molCO 2 和2mol
已知某烃的含氧衍生物CxHyOz,其相对分子质量为60,若1mol该有机物完全燃烧得2molCO 2 和2mol H 2 O,则:
(1)有机物C x H y O z 的分子式为______;写出该有机物完全燃烧的化学方程式______;
(2)若1mol该有机物与足量碳酸氢钠反应放出1mol有CO 2 ,则该有机物为一元有机羧酸,它的名称是______;结构简式为______;
(3)若该有机物为酯类,它的名称是______;结构简式为______;
(4)若该有机物不与碳酸氢钠反应,但能与金属钠反应.1mol该有机物与足量金属钠反应,生成0.5molH 2 ,则该有机物为羟基醛,它的结构简式为______. ly1016171年前1
ly1016171年前1 -
 错过了就错过了 共回答了15个问题
错过了就错过了 共回答了15个问题 |采纳率100%若1mol该有机物完全燃烧得2molCO 2 和2mol H 2 O,则有机物分子中N(C)=2、N(H)=4,则N(O)=
60-12×2-4
16 =2
(1)有机物的分子式为C 2 H 4 O 2 ,完全燃烧的化学方程式为:C 2 H 4 O 2 +2O 2
点燃
2CO 2 +2H 2 O,
故答案为:C 2 H 4 O 2 ;C 2 H 4 O 2 +2O 2
点燃
2CO 2 +2H 2 O;
(2)若1mol该有机物与足量碳酸氢钠反应放出1mol有CO 2 ,则该有机物为一元有机羧酸,则含有-COOH,该有机物的结构简式为CH 3 COOH,名称为乙酸,
故答案为:乙酸;CH 3 COOH;
(3)若为酯类,则为甲酸甲酯,结构简式为HCOOCH 3 ,
故答案为:甲酸甲酯;HCOOCH 3 ;
(4)若该有机物不与碳酸氢钠反应,则不含-COOH,但能与金属钠反应,含有-OH,1mol该有机物与足量金属钠反应,生成0.5molH 2 ,则分子中含有1个-OH,故还含有1个-CHO,故该有机物的结构为HOCH 2 CHO,
故答案为:HOCH 2 CHO.1年前查看全部
- 以下关于2molCO 2 的说法中,错误的是( ) A.含有1.204×10 24 个CO 2 B.质量为88g C.
以下关于2molCO 2 的说法中,错误的是( ) A.含有1.204×10 24 个CO 2 B.质量为88g C.含有2mol碳原子 D.含有2mol氧原子  pauperlfx1年前1
pauperlfx1年前1 -
 applecat7625 共回答了19个问题
applecat7625 共回答了19个问题 |采纳率94.7%A、2molCO 2 含有 6.02×10 23 ×2=1.204×10 24 个CO 2 ;故A说法正确;
B、2molCO 2 的质量为:44g/mol×2mol=88g;故B说法正确;
C、2molCO 2 的含有2mol碳原子;故C说法正确;
D、2molCO 2 的含有氧原子的量为:2×2mol=4mol;故D错误;
故选D.1年前查看全部
- 在一个容积为500ml的密闭容器中,充入5mol的H2和2molCO.在一定条件下,发生如下反应:2H2(g)+CO(g
在一个容积为500ml的密闭容器中,充入5mol的H2和2molCO.在一定条件下,发生如下反应:2H2(g)+CO(g)---(为可逆号,且条件是催化剂)CH3OH(g),经过5s后达到平衡状态.若此时CH3OH蒸气的浓度为2mol/L,求(1) 求H2的反应速率.(2)求CO的转化率为多少,(3)求平衡时混合气的平均相对分子质量为多少?
(1)0.8mol/(L.s) (2)50% (3)13.2
THANKYOU~ 珊蔡姐1年前1
珊蔡姐1年前1 -
 yuan_zhi_fei 共回答了22个问题
yuan_zhi_fei 共回答了22个问题 |采纳率81.8%2H2(g)+CO(g)→ CH3OH(g),
2 1 1
x y 2*0.5
x== 2 y==1
即反应了 2 mol H2 和1mol CO
反应前 c(H2)==5/0.5=10 mol/L 反应后c(H2)==(5-2)/0.5=6 mol/L
H2的反应速率==(10-6 )/5==0.8 mol/Ls
CO转换率为 ===反应了的/总量==1/2==50%
反应后 H2 为 5-2=3 mol CO为 2-1=1 mol CH3OH为 1 mol
则 分子总物质的量为 3+1+1=5 mol
总质量==5*2+2*28==66 g
则平均物质的量==66/5==13.2 g/mol1年前查看全部
- 在密闭容器中进行下列反应:CO2(g)+C(s)⇌2CO(g)△H>0,起始通入2molCO,达到平衡后,改变下列条件
在密闭容器中进行下列反应:
CO2(g)+C(s)⇌2CO(g)△H>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡______,c(CO)______.
(2)减小密闭容器的体积,保持温度不变,则平衡______,c(CO2)______.
(3)通入N2,保持密闭容器的体积和温度不变,则平衡______,c(CO2)______.
(4)保持密闭容器的体积不变,升高温度,则平衡______,c(CO)______
(5)恒压通入N2,CO2的百分含量______
(6)恒压再通入2molCO,CO2的百分含量______. dgro1年前1
dgro1年前1 -
 tanghaibuku 共回答了15个问题
tanghaibuku 共回答了15个问题 |采纳率86.7%解题思路:根据平衡移动的原理,增加反应物浓度平衡正向移动,改变固体或纯液体的量平衡不移动,升高温度平衡向吸热的方向移动,增大压强平衡向体积减小的方向移动,恒压通CO可以用等效平衡的思想解决,据此答题;(1)因为C为固体,所以增加C,平衡不移动,一氧化碳的浓度不变,故答案为:不移动,不变;
(2)由于该反应是气体体积增大的反应,所以减小密闭容器的体积,保持温度不变,压强增大,平衡逆向移动,二氧化碳的浓度增大,故答案为:逆移;增大;
(3)通入N2,保持密闭容器的体积和温度不变,参加反应的各物质的浓度都不变,所以平衡不移动,二氧化碳的浓度不变,故答案为:不移;不变;
(4)由于该反应是吸热反应,升高温度,则平衡向正反应方向移动,一氧化碳的浓度增大,故答案为:正移;增大;
(5)恒压通入N2,则容器体积增大,相当于减压,平衡正向移动,CO2的百分含量减小,故答案为:减小;
(6)恒压再通入2molCO,平衡时则可以形成与原平衡为等效平衡的体系,所以CO2的百分含量不变,故答案为:不变;点评:
本题考点: 化学平衡的计算.
考点点评: 本题主要考查了影响平衡移动的外界因素,以及平衡移动后有关物理量的变化情况,难度不大,注重基础知识的应用.1年前查看全部
大家在问
- 1一艘轮船3小时航行90千米.照这样的速度,航行300千米需要多少小时?算式
- 2红花比黄花多百分之六十,黄花比红花少百分之几?
- 3有小学行程趣题H,急盼详解一条单线铁路上有A、B、C、D四个车站,他们之间的路程如图(AB=95千米,BC=15千米,C
- 4如图,在直角梯形ABCD中,AD‖BC,∠ADC=90°,AB=5,CD=3,线段AD上有一动点E,过E作EF⊥AB,垂
- 5Sue's parents bought a large house ____a siwmming pool.it___
- 6将一振子分别拉离平衡位置2厘米和3厘米,由静止释放,问周期,振幅,加速度是否相同?
- 7从一张长0.96dm宽0.8dm的长方形纸剪去一个最大的正方形剩下长方形面积是多少
- 8居里夫人有哪些品质,课文又是怎样把他的品质变形出来的.急
- 9第二题填空求分类 仔细些哟!第二题填空求分类仔细些哟!
- 10珠穆朗玛峰是世界上最高的山峰,地质学家却说它所在的喜玛朗雅山在远古时代曾经是一片汪洋大海.
- 11关于热爱生命写人的故事fgghg
- 12一个正方体的棱长是4cm的正方体,它的表面积和体积一样大,
- 13以“党在我心中 '” 读书 为主题的征文 急
- 14英语翻译All has something to do with you可以翻译成“和你在一起总会有事情做
- 15英语翻译是说different children's TV watching habits好,还是说TV watchin
