催化剂是如何加快或减慢化学反应速度
 分手后是春天2022-10-04 11:39:541条回答
分手后是春天2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 JD极爱自己 共回答了18个问题
JD极爱自己 共回答了18个问题 |采纳率94.4%- 催化剂加快反应速率的原因与温度对反应速率的影响是根本不同的.催化剂可以改变反应的路线,降低反应的活化能,使反应物分子中活化分子的百分数增大,反应速率加快. 催化作用可分为均相催化和非均相催化两种.如果催化剂...
- 1年前
相关推荐
- 下列对催化剂描述正确的是( )
下列对催化剂描述正确的是( )
A.在化学反应里能加快其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质
B.要使氯酸钾受热分解放出氧气,必须加入二氧化锰,否则就不能发生反应
C.任何化学反应都需要催化剂
D.某些化学反应可以有多种催化剂 4钻1年前1
4钻1年前1 -
 陶二娃 共回答了22个问题
陶二娃 共回答了22个问题 |采纳率90.9%解题思路:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂(又叫触媒).催化剂的特点可以概括为“一变二不变”,一变是能够改变化学反应速率,二不变是指质量和化学性质在化学反应前后保持不变.A、在化学反应里能改变(而不是只是加快)其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质,叫做催化剂,故选项说法错误.
B、只加热氯酸钾,也能产生氧气,只是所需温度较高,反应速率较慢,故选项说法错误.
C、不是任何化学反应都需要催化剂,如人的呼吸,不需要使用催化剂,故选项说法错误.
D、某些化学反应可以有多种催化剂,如分解过氧化氢溶液制取氧气,可使用二氧化锰、氧化铜等作催化剂,故选项说法正确.
故选:D.点评:
本题考点: 催化剂的特点与催化作用;实验室制取氧气的反应原理.
考点点评: 本题难度不大,考查对催化剂概念的理解,掌握催化剂的特征(“一变二不变”)是正确解答本题的关键.1年前查看全部
- 某实验小组以H 2 O 2 分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.下列说法不正确的是
某实验小组以H 2 O 2 分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.下列说法不正确的是
( )
反应物 催化剂 温度 ① 10mL10% H 2 O 2 溶液 无 25℃ ② 10mL20% H 2 O 2 溶液 无 25℃ ③ 10mL20% H 2 O 2 溶液 无 40℃ ④ 10mL20% H 2 O 2 溶液 1mL0.1mol•L -1 FeCl 3 溶液 40℃ A.实验④反应速率最快 B.实验①反应速率最慢 C.实验②速率小于实验④的原因不仅仅是实验④加入了催化剂 D.FeCl 3 不但可以催化H 2 O 2 分解,也能催化Zn与盐酸反应制H 2  葡萄丸子1年前1
葡萄丸子1年前1 -
 zkyaooo 共回答了15个问题
zkyaooo 共回答了15个问题 |采纳率93.3%A、由表中数据可知,实验④中浓度最高、温度最高且使用催化剂,故反应速率最快,故A正确;
B、由表中数据可知,实验①中浓度最低、温度最低且没有使用催化剂,故反应速率最慢,故B正确;
C、由表中数据可知,实验②、④的不同之处是④中使用催化剂、温度比实验②中高,故实验②速率小于实验④的原因有催化剂、温度的影响,故C正确;
D、催化剂具有专一性,FeCl 3 可以催化H 2 O 2 分解,但不一定是其它反应的催化剂,FeCl 3 与Zn与发生反应,不能催化Zn与盐酸反应,故D错误.
故选D.1年前查看全部
- 甲醇 乙腈 在甲醇钠催化剂存在下反应生成什么?
甲醇 乙腈 在甲醇钠催化剂存在下反应生成什么?
反应条件 25摄氏度 保温12H.
具体条件有知道者也可! 誊娆1年前1
誊娆1年前1 -
 十里啷铛被ll了 共回答了24个问题
十里啷铛被ll了 共回答了24个问题 |采纳率83.3%CH3C(OCH3)31年前查看全部
- 在氯酸钾受热制氧气的实验中,若没有催化剂二氧化锰,则加入少量的高锰酸钾后,反应的速度会______(填“加快”或“减慢”
在氯酸钾受热制氧气的实验中,若没有催化剂二氧化锰,则加入少量的高锰酸钾后,反应的速度会______(填“加快”或“减慢”或“不变”),产生的氧气的质量会______(填“增加”或“减少”或“不变”),高锰酸钾在反应中______催化剂(填“是”或“不是”).氯酸钾受热制氧气的化学方程式为:2KClO3
2KCl+3O2↑MnO2 .△ 2KClO3.
2KCl+3O2↑MnO2 .△  橙小丸91年前1
橙小丸91年前1 -
 shengchiyou 共回答了16个问题
shengchiyou 共回答了16个问题 |采纳率93.8%解题思路:根据高锰酸钾分解的产物(锰酸钾、二氧化锰和氧气)、催化剂的定义进行分析解答本题.高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,高锰酸钾分解生成的二氧化锰能对氯酸钾的分解起到催化作用,故在氯酸钾受热制氧气的实验中,若没有催化剂二氧化锰,则加入少量的高锰酸钾后,反应的速度会加快;由于高锰酸钾分解生成氧气,故产生的氧气的质量会增加;高锰酸钾在反应中不是催化剂,作催化剂的是高锰酸钾分解生成的二氧化锰.氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑.
故答案为:加快;增加;不是;2KClO3
MnO2
.
△2KCl+3O2↑.点评:
本题考点: 实验室制取氧气的反应原理;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握实验室制取氧气的原理原理、催化剂的概念等并能灵活运用是正确解答本题的关键.1年前查看全部
- 把H2和空气放入一密闭容器中 用电火花点燃,完全反应再向其中充入一定量的氢气,用铂丝做催化剂,再一次引发反应,当反应完成
把H2和空气放入一密闭容器中 用电火花点燃,完全反应再向其中充入一定量的氢气,用铂丝做催化剂,再一次引发反应,当反应完成后,向其中滴入酚酞试液,试液变红,
1.写出上述各部反应的方程式
2、若两次反应后测得容器内压强几乎为0,计算充入的氢气总量与容器中空气的体积比 森磊12031年前1
森磊12031年前1 -
 xswcfl 共回答了21个问题
xswcfl 共回答了21个问题 |采纳率95.2%解1、2H2+O2=2H2O(点燃)
N2+3H2=2NH3(Pt)
(氨气是碱性气体,可使酚酞试液变红)
2、压强几乎为0,说明N2和O2完全反应了
根据上两个方程式
2H2:O2=2:1
N2:3H2=1:3
空气中N2:78%、O2:21%
H2总量78%*3+21%*2=2.76
H2与空气的体积比为
2.76:(78%+21%)=2.79:11年前查看全部
- 生化问题11P18/19酶与一般催化剂相比有特点:“专一性强,一种酶只作用一种或一类物质,产生一定的产物”这句话为什么不
生化问题11
P18/19酶与一般催化剂相比有特点:
“专一性强,一种酶只作用一种或一类物质,产生一定的产物”这句话为什么不对?
P18/20“变构剂通常与酶活性中心以外的某一特定部位结合”不对吗?希望得到详细回答, doglim1年前2
doglim1年前2 -
 liye-1985 共回答了14个问题
liye-1985 共回答了14个问题 |采纳率85.7%P18/19酶并不只一种底物反应,例如你可以查阅三羧酸循环,其中很多酶可以催化双向反应,使底物与产物的浓度处于平衡状态.
P18/20似乎是对的啊……1年前查看全部
- (2013•常州一模)有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂.
(2013•常州一模)有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂.一种由废催化剂制取PdCl2的工艺流程如下:
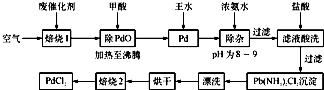
(1)“焙烧1”通入空气的目的是______.
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:______.
(3)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室中检测溶液pH的简单方法是______.
(4)写出“焙烧2”发生反应的化学方程式:Pd(NH3)2Cl2
2NH3↑+PdCl2△ .Pd(NH3)2Cl2.
2NH3↑+PdCl2△ .
(5)Pd中加入王水的反应可以表示为Pd+HCl+HNO3-→A+B↑+H2O(未配平).其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%.则A的化学式为______. fx57001年前1
fx57001年前1 -
 娅菲的世界 共回答了16个问题
娅菲的世界 共回答了16个问题 |采纳率100%解题思路:(1)使有机物、等可燃物充分燃烧;
(2)根据题给信息确定反应物和生成物,从而写出反应方程式;
(3)实验室中用pH试纸检测溶液的pH;
(4)根据题给信息结合原子守恒确定反应方程式;
(5)Pd中加入王水的反应可以表示为Pd+HCl+HNO3-→A+B↑+H2O(未配平),其中B为无色有毒气体,该气体在空气中不能稳定存在,则B是一氧化氮;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%,剩余的是氯元素,根据各元素的质量分数确定其原子个数比,从而确定其化学式.(1)钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,则该催化剂中含有有机物,为了使有机物等可燃物充分燃烧,要加入过量的氧气,
故答案为:使有机化合物等可燃物通过燃烧而除掉;
(2)根据题给信息知,甲酸被氧化生成二氧化碳,则金属氧化物被还原生成金属单质,同时该反应中还生成水,反应方程式为:HCOOH+PdO═Pd+CO2↑+H2O,
故答案为:HCOOH+PdO═Pd+CO2↑+H2O;
(3)实验室中用pH试纸检测溶液的pH,其操作方法是:用洁净的玻璃棒蘸取待测液滴在pH试纸上,然后将pH试纸与标准比色卡对比,故答案为:用洁净的玻璃棒蘸取待测液滴在pH试纸上,然后将pH试纸与标准比色卡对比;
(4)根据题给信息知,反应物是Pd(NH3)2Cl2,生成物是氨气和PdCl2,反应条件是加热,该反应方程式为:
Pd(NH3)2Cl2
△
.
2NH3↑+PdCl2,
故答案为:Pd(NH3)2Cl2
△
.
2NH3↑+PdCl2;
(5)Pd中加入王水的反应可以表示为Pd+HCl+HNO3-→A+B↑+H2O(未配平),其中B为无色有毒气体,该气体在空气中不能稳定存在,则B是一氧化氮;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%,根据元素守恒知剩余的是氯元素,Pd原子、氢原子和氯原子个数比=[42.4%/106.4]:[0.8%/1]:[1−42.4%−0.8%/35.5]=1:2:4,所以A的化学式为:H2PdCl4,
故答案为:H2PdCl4.点评:
本题考点: 制备实验方案的设计;氧化还原反应;测定溶液pH的方法;常见金属元素的单质及其化合物的综合应用.
考点点评: 本题考查了制备方案的设计,涉及化学式的确定、氧化还原反应、pH的测定等知识点,会根据原子守恒及原子个数比确定化学式,明确溶液pH值的测定方法,难度不大.1年前查看全部
- 下列说法正确的是( )A. 制氧气一定要用二氧化锰作催化剂B. 所有的酸和碱都能使指示剂变色C. 物质发生缓慢氧化时一
下列说法正确的是( )
A. 制氧气一定要用二氧化锰作催化剂
B. 所有的酸和碱都能使指示剂变色
C. 物质发生缓慢氧化时一定放出热量
D. 检测某溶液的pH时,pH试纸要预先用水湿润 dotku1年前1
dotku1年前1 -
 盈诺9 共回答了22个问题
盈诺9 共回答了22个问题 |采纳率90.9%解题思路:A、二氧化锰只是制取氧气中催化剂多种中的一种.
B、只有能形成溶液的酸碱才能时指示剂变色.
C、试纸润湿会使测量的PH数值误差变大.
D、缓慢氧化一定有热量放出,只是较为缓慢.A、二氧化锰只是制取氧气催化剂中多种中的一种,不一定必须用二氧化锰,故此选项错误.
B、只有能形成溶液的酸碱才能时指示剂变色,像氢氧化铜这种不溶性碱就不能使指示剂变色,故此选项错误.
C、缓慢氧化一定有热量放出,只是较为缓慢,故此选项正确.
D、试纸润湿会使测量的PH数值不准确,主要原因是这样会使溶液变稀,故此选项错误.
故选C点评:
本题考点: 催化剂的特点与催化作用;溶液的酸碱度测定;酸碱指示剂及其性质;燃烧、爆炸、缓慢氧化与自燃.
考点点评: 此题是一道多点知识考查题,主要是对教材中的基础知识的考查,考查的是学生分析问题及识记能力.1年前查看全部
- 处理汽车尾气中的有毒气体化学式:黄蓝+黑蓝 在催化剂作用下生成 蓝黑蓝+黄黄,每种颜色代表一种原子.
 我是你三1年前2
我是你三1年前2 -
 mc8007029 共回答了22个问题
mc8007029 共回答了22个问题 |采纳率81.8%2CO+2NO=催化剂=2CO2+N21年前查看全部
- 氢化是什么反应?有道题说3-甲基-1-丁烯将其在催化剂下完全氢化所得烷烃的系统命名是?
 三八38C1年前6
三八38C1年前6 -
 kshen111 共回答了27个问题
kshen111 共回答了27个问题 |采纳率88.9%就是加成反应,把碳碳二健拆开补上氢1年前查看全部
- 下列说法不正确的是( )A.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱B.一定条件下,使用催化剂能
下列说法不正确的是( )
A.相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱
B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
C.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
D.根据反应2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应
CH3CH2OH(g)+3H2O(g)需在300℃进行可推测该反应是吸热反应  nimamabi1年前1
nimamabi1年前1 -
 梦无意 共回答了17个问题
梦无意 共回答了17个问题 |采纳率94.1%解题思路:A.按金属活动性顺序,金属性依次减弱,金属单质还原性也依次减弱,对应离子氧化性依次增强,同时Fe3+对应排在Cu2+之后.另外据Fe3++Cu=Fe2++Cu2+、Fe+Cu2+=Fe2++Cu也不难看出溶液中的氧化性依次减弱次序为:Fe3+>Cu2+>Zn2+;
B.催化剂能同等程度地加快正逆反应速率,对平衡移动无影响;
C.反应的焓变只与反应的始态和终态有关;
D.反应吸热或放热与反应的条件无关.A.根据金属活动性顺序可知金属性由强到弱:Zn>Fe>Cu,而离子的氧化性却是:Fe3+>Cu2+>Zn2+,故A正确;
B.因催化剂能同等程度地加快正逆反应速率,对平衡移动无影响,则不能提高反应物的平衡转化率,故B错误;
C.反应的焓变只与反应的始态和终态有关,与反应的过程无关,对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同,故C正确;
D.反应吸热或放热与反应的条件无关,取决于反应物与生成物总能量的相对大小,故D错误.
故选BD.点评:
本题考点: 催化剂的作用;焓变和熵变;化学平衡的调控作用.
考点点评: 本题考查催化剂、盖斯定律、吸热反应、离子的氧化性比较,注意掌握催化剂能同等程度地加快正逆反应速率,对平衡移动无影响,则不能提高反应物的平衡转化率.1年前查看全部
- (12分)利用光能和光催化剂,可将CO 2 和H 2 O(g)转化为CH 4 和O 2 。紫外光照射时,在不同催化剂(I
(12分)利用光能和光催化剂,可将CO 2 和H 2 O(g)转化为CH 4 和O 2 。紫外光照射时,在不同催化剂(I,II,III)作用下,CH 4 产量随光照时间的变化如图所示。

(1)在0-15小时内,CH 4 的平均生成速率vⅠ、vⅡ和 v Ⅲ 从大到小的顺序为 ;
反应开始后的30小时内,在第 种催化剂的作用下,收集的CH 4 最多。
(2)将所得CH 4 与H 2 O(g)通入聚焦太阳能反应器,发生反应:CH 4 (g)+H 2 O(g) CO(g)+3H 2 (g),该反应的△H="+206" kJ•mol -1
CO(g)+3H 2 (g),该反应的△H="+206" kJ•mol -1
①在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)
②将等物质的量的CH 4 和H 2 O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH 4 的平衡转化率(计算结 果保留两位有效数字)。
果保留两位有效数字)。
(3)已知CH 4 (g)+2O 2 (g)=CO 2 (g)+2H 2 O(l) H = -890kJ·mol -1 ,现有甲烷和一氧化碳的混合气体共0.75mol,完全燃烧后生成气态二氧化碳和18g液态水,并放出515kJ热量,请写出一氧化碳燃烧的热化学方程式__________________ 。 bmx9991年前1
bmx9991年前1 -
 sulphurous 共回答了17个问题
sulphurous 共回答了17个问题 |采纳率82.4%(共12分)
(1)vⅡ>vⅠ>vⅢ(2分)Ⅲ(2分)
(2)①(2分)图略,划出正确能量变化1分,标出反应热1分
②设开始时通入CO和H 2 (g) 的物质的量浓度分别为a
CH 4 (g)+H 2 O(g) CO(g)+3H 2 (g)
CO(g)+3H 2 (g)
开始物质的量浓度(mol/L) aa 0 0
转化物质的量浓度(mol/L) 0.1 0.10.1 0.3
平衡物质的量浓度(mol/L) a-0.1a-0.10.10.1 (2分)
0.1·(0.3) 3
(a-0.1) 2
 因为 K =
因为 K = ="" = 27, 所以得a=0.11mol/L(1分) CO的转化率=
="" = 27, 所以得a=0.11mol/L(1分) CO的转化率= =91%(1分)
=91%(1分)
(3)CO(g)+1/2O 2 (g)=CO 2 (g)△ H =―280kJ/mol (2分)
略1年前查看全部
- 分子式为C5H10O2的有机物A在硫酸作催化剂时得到两种相对分子质量相等的产物.A的可能结构是?
 皓皓20061年前2
皓皓20061年前2 -
 flyliying 共回答了17个问题
flyliying 共回答了17个问题 |采纳率94.1%乙酸丙酯
乙酸异丙酯1年前查看全部
- 加成反应需要催化剂吗?好像一般来说都是要的.但是书本上有些简单的加成反应条件省略了,比如乙烯和溴加成.我怕自己答题不规范
加成反应需要催化剂吗?
好像一般来说都是要的.但是书本上有些简单的加成反应条件省略了,比如乙烯和溴加成.
我怕自己答题不规范,想知道到底要不要写催化剂的条件?如果能省略,哪些可以省略? 轩辕阿星1年前1
轩辕阿星1年前1 -
 色既是狼 共回答了23个问题
色既是狼 共回答了23个问题 |采纳率95.7%化学上越规范越好,不规范会扣分,没听过规范扣分的,加成反应一般要催化剂的1年前查看全部
- 某同学在做了“用双氧水和二氧化锰制取氧气”的实验后,展开了思考与探究:催化剂二氧化锰的用量对反应速率有没有影响呢?
某同学在做了“用双氧水和二氧化锰制取氧气”的实验后,展开了思考与探究:催化剂二氧化锰的用量对反应速率有没有影响呢?
他做了这样一组实验:每次均用30毫升10%的H2O2溶液,使用不同量的二氧化锰粉末做催化剂,测定每次收集到0.96克氧气时所用的时间,结果如下:(其他实验条件均相同)
实验次序 1 2 3 4 5 6 7 8 9 10
二氧化锰粉末用量/克
0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
所用时间/秒
17 8 7 5 4 3 2 2 2 2
(1)从表中的数据看出:二氧化锰的用量对反应速率是有影响的,请描述二氧化锰的用量对反应速率的影响是______ .
(2)如果在实验中忘了加入二氧化锰.下列对实验结果的描述正确的是( )
A、不影响化学反应速度
B、反应速度慢,产生氧气比应有的量少
C、产生氧气总量不少,但反应速度慢
D、无法产生氧气
(3)实验中要产生0.96克氧气至少需要多少克H2O2?(通过化学方程式计算说明) leocw1年前1
leocw1年前1 -
 lcs9 共回答了23个问题
lcs9 共回答了23个问题 |采纳率87%(1)一定量的二氧化锰可以促进反应的进行
(2)C
(3)2h2o2=2h2o+o2
68 32
x 0.96
x=2.04g1年前查看全部
- 纳米材料和纳米技术的应用涉及现代工业的各个领域.用纳米级的某种氧化物做催化剂,可以使汽车尾气中的CO和NO迅速反应转化为
纳米材料和纳米技术的应用涉及现代工业的各个领域.用纳米级的某种氧化物做催化剂,可以使汽车尾气中的CO和NO迅速反应转化为两种气体,其中一种是空气中含量最多的气体.请你写出该反应的化学方程式 ___ .
 xixuemao1年前1
xixuemao1年前1 -
 风之鱼 共回答了23个问题
风之鱼 共回答了23个问题 |采纳率95.7%解题思路:根据一种是空气中含量最多的气体,可以知道该气体是氮气,根据化学反应前后的元素种类不变,另一种也是气体,所以应该是二氧化碳,然后根据题目的叙述和上面的推导确定反应物、生成物、反应条件,再结合化学方程式的书写原则写出方程式.空气中含量最多的是氮气,另一种是二氧化碳,反应物是一氧化碳和一氧化氮,生成物是氮气和二氧化碳,反应条件是氧化物作催化剂,所以方程式为:2CO+2NO
氧化物
.
.N2+2CO2点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;空气的成分及各成分的体积分数.
考点点评: 在解此类方程式的书写题时,关键是根据反应物判断出生成物,再依据条件写方程式.1年前查看全部
- CuO能作催化剂吗?比如像二氧化锰那样催化过氧化氢
 pairsouter1年前3
pairsouter1年前3 -
 毛毛的木马 共回答了19个问题
毛毛的木马 共回答了19个问题 |采纳率89.5%催化H2O2分解可以的,但不是什么反应都能催化1年前查看全部
- 高一化学题1.宣传科学知识,揭露伪科学,是我们的义务,下列各项中属于伪科学的是( )A.用催化剂将水变为燃油(由碳氢元素
高一化学题
1.宣传科学知识,揭露伪科学,是我们的义务,下列各项中属于伪科学的是( )
A.用催化剂将水变为燃油(由碳氢元素组成) B.使白磷在空气中自燃
C.用液氢发射火箭 D.用扫描隧道显微镜可观察到分子的图像
2.将一小块金属钠投入足量的下列物质中,既能生成气体,又能生成白色沉淀的是( )
A.MgSO4溶液 B.BaCl2溶液 C.Fe2(SO4)3溶液 D.CuCl2溶液
3.可以证明次氯酸为弱酸的事实是( )
A.次氯酸具有强氧化性 B.次氯酸不稳定,见光易分解
C.可与强酸反应 D.漂白粉在空气中易失效
4.自来水可用氯气消毒,某同学用这种自来水配制以下物质的溶液,不会使溶液明显变质的是( )
A.AgNO3 B.NaOH C.NaHCO3 D.MgCl2
5.下列说法中正确的是( )
A.摩尔是化学上常用的一个物理量.
B.某物质含有6.02×1023个粒子,含有这个数目粒子的物质一定是1mol.
C.1摩尔氢气分子可以表示为1molH2.
D.硫酸的摩尔质量为98g. 往西的风1年前1
往西的风1年前1 -
 赋雨 共回答了9个问题
赋雨 共回答了9个问题 |采纳率100%1.宣传科学知识,揭露伪科学,是我们的义务,下列各项中属于伪科学的是( A )
A.用催化剂将水变为燃油(由碳氢元素组成) B.使白磷在空气中自燃
C.用液氢发射火箭 D.用扫描隧道显微镜可观察到分子的图像
2.将一小块金属钠投入足量的下列物质中,既能生成气体,又能生成白色沉淀的是(A )
A.MgSO4溶液 B.BaCl2溶液 C.Fe2(SO4)3溶液 D.CuCl2溶液
3.可以证明次氯酸为弱酸的事实是( B )
A.次氯酸具有强氧化性 B.次氯酸不稳定,见光易分解
C.可与强酸反应 D.漂白粉在空气中易失效
4.自来水可用氯气消毒,某同学用这种自来水配制以下物质的溶液,不会使溶液明显变质的是( D )
A.AgNO3 B.NaOH C.NaHCO3 D.MgCl2
5.下列说法中正确的是( C )
A.摩尔是化学上常用的一个物理量.
B.某物质含有6.02×1023个粒子,含有这个数目粒子的物质一定是1mol.
C.1摩尔氢气分子可以表示为1molH2.
D.硫酸的摩尔质量为98g.1年前查看全部
- 催化剂只能加快物质的反应速率对吗
催化剂只能加快物质的反应速率对吗
反应前后,催化剂物理性质改变吗? popoff01081年前3
popoff01081年前3 -
 jemdu1f 共回答了25个问题
jemdu1f 共回答了25个问题 |采纳率92%不对,催化剂分为正催化剂和逆催化剂.正催化剂加快反应速率而逆催化剂减慢反应速率.
催化剂的一变两不变.
一变:能改变化学反应的速率.
两不变:自身的质量和化学性质在化学反应前后保持不变.
物理性质包括很多方面.密度质量性状表面积含水量都是.所以一般是会发生变化的.1年前查看全部
- 关于热交换器,下列说法中错误的是( ) A.热交换器装在接触室中,位于两层催化剂中间 B.预热含有二氧化硫的混合气体,
关于热交换器,下列说法中错误的是( )
A.热交换器装在接触室中,位于两层催化剂中间 B.预热含有二氧化硫的混合气体,有利于接触氧化 C.预热三氧化硫,有利于浓硫酸的吸收 D.热交换器可调节流体温度,利用余热  alazwei1年前1
alazwei1年前1 -
 世俗爱 共回答了15个问题
世俗爱 共回答了15个问题 |采纳率93.3%C
热交换器用来预热SO 2 和O 2 的混合气体,不是预热SO 3 ,温度高不利于SO 3 的吸收。1年前查看全部
- 如何从五氧化二钒催化剂中提取金属钒?
 隋编凑凑1年前3
隋编凑凑1年前3 -
 blackwhitehumor 共回答了19个问题
blackwhitehumor 共回答了19个问题 |采纳率84.2%用硫酸浸泡,碳铵中和,再用树脂萃取.1年前查看全部
- 认为高锰酸钾不是氯酸钾分解的催化剂的理由是?
 清瘦的浮云1年前3
清瘦的浮云1年前3 -
 郁金飘香 共回答了20个问题
郁金飘香 共回答了20个问题 |采纳率90%在化学反应前后的KMno4的化学性质和质量都发生改变,而催化剂不变1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
(1)写出CO燃烧的热化学方程式______;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);
①温度升高该反应的平衡常数______(增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是3nB 2tB mol•L-1•min-13nB 2tB
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-═CO32-+3H2O,负极的反应式为______. mwemei1年前1
mwemei1年前1 -
 津女 共回答了16个问题
津女 共回答了16个问题 |采纳率100%解题思路:(1)依据热化学方程式书写方法和注意问题标注物质聚集状态和对应焓变;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)①依据先拐先平的判断方法可知T1<T2,温度变化判断平衡移动的分析分析平衡常数变化;
②依据图象分析甲醇的平衡物质的量和时间,结合化学方程式计算消耗氢气的物质的量,结合反应速率概念计算得到;
(4)甲醇燃料电池,燃料在负极失电子发生氧化反应.(1)由CO(g)的燃烧热△H分别为-283.0kJ•mol-1,则一氧化碳燃烧的热化学方程式为:CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566KJ•mol-1
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566KJ•mol-1;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)①图象分析先拐先平,温度高,T1<T2,温度越高甲醇物质的量越小,说明平衡逆向进行,平衡常数减小,故答案为:减小;
②B过程依据图象分析,在tB达到平衡时生成甲醇nBmol,依据化学方程式CO2+3H2=CH3OH+H2O,消耗氢气物质的量为3nBmol,用H2表示该反应的化学反应速率=
3nBmol
2L
tBmin=
3nB
2tBmol/L•min,故答案为:
3nB
2tB;
(4)直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-═CO32-+3H2O,甲醇燃料电池,燃料在负极失电子发生氧化反应,负极的反应式为:
CH3OH-6e-+8OH-═CO32-+6H2O,故答案为:CH3OH-6e-+8OH-═CO32-+6H2O.点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡的影响因素.
考点点评: 本题考查了热化学方程式的书写和盖斯定律的应用,化学平衡的影响因素分析判断,图象分析应用能力,原电池电极反应书写方法,题目难度中等.1年前查看全部
- 不能用作过氧化氢制氧气时的催化剂为( )
不能用作过氧化氢制氧气时的催化剂为( )
A.二氧化锰
B.硫酸铜
C.红砖粉末
D.碎瓷片 yang5232708201年前1
yang5232708201年前1 -
 tianyi0802 共回答了21个问题
tianyi0802 共回答了21个问题 |采纳率90.5%解题思路:根据该物质能否加快过氧化氢的分解速率判断.碎瓷片不能改变过氧化氢的分解速率.A、二氧化锰能加快过氧化氢分解生成氧气的速率,可做催化剂,故不符合题意;
B、硫酸铜溶液能加快过氧化氢的分解速率,可做催化剂,故不符合题意;
C、红砖粉末能加快过氧化氢分解生成氧气的速率,可做催化剂,故不符合题意;
D、碎瓷片不能改变过氧化氢的分解速率,不可为催化剂,故符合题意.
故选D.点评:
本题考点: 催化剂的特点与催化作用.
考点点评: 熟悉一些常见反应的催化剂,能根据催化剂的特点做出正确的判断.1年前查看全部
- 双氧水在常温下不加任何催化剂产生氧气速率多少
 羽习习1年前1
羽习习1年前1 -
 oo上网 共回答了21个问题
oo上网 共回答了21个问题 |采纳率95.2%和压强 表面积等有关1年前查看全部
- CO和H2在催化剂条件下生成什么
CO和H2在催化剂条件下生成什么
产物要继续在催化剂和O2中反应两次,求三次反应的产物 0asd6q224o1年前1
0asd6q224o1年前1 -
 PisenLiu 共回答了22个问题
PisenLiu 共回答了22个问题 |采纳率95.5%CO+2H2(催化剂,加热)→CH3OH
甲醇在催化剂作用下继续氧化成为甲醛
由於醛基不稳定 继续氧化成甲酸1年前查看全部
- 29.已知:图地址从A出发可发生下图所示的一系列反应,其中G为高分子化合物,化合物B的分子式为C8H8O,当以铁做催化剂
29.已知:
图地址
从A出发可发生下图所示的一系列反应,其中G为高分子化合物,化合物B的分子式为C8H8O,当以铁做催化剂进行氯化时,一元取代物只有两种.
请填空:
写出下列物质的结构简式:
A____________________,M_________________________
指出下列反应类型:
I___________________,IV_________________________-.
写出下列反应的化学方程式:
B→C_________________________________________________________
C+D→H______________________________________________________
(4)与C互为同分异构体且均属于酯类芳香族的化合物共有_____________种. 屋外1年前1
屋外1年前1 -
 jisodoi 共回答了13个问题
jisodoi 共回答了13个问题 |采纳率92.3%29.
A:甲苯 M:对苯二甲酸
I:氧化反应 IV:缩合反应
对-甲基苯甲醛+2Cu(OH)2→对-甲基苯甲酸+Cu2O+2H2O
对-甲基苯甲醇+对-甲基苯甲酸→对-甲基苯甲酸对-甲基苯甲醇酯+H2O
4种1年前查看全部
- 高中物理:下列事实不能用勒夏特列原理解释的是 ( ) A.合成氨工业采用高温和催化剂等条件
高中物理:下列事实不能用勒夏特列原理解释的是 ( ) A.合成氨工业采用高温和催化剂等条件
下列事实不能用勒夏特列原理解释的是 ( )
A.合成氨工业采用高温和催化剂等条件
B.H2.I2.HI混合气体加热后颜色变深
C.合成氨时尽可能增大体系压强
D.打开汽水瓶,看到大量的气泡逸出
标准答案是 A.这与网上的答案不同.请您向详细解释其中的道理.谢谢.
是高中化学 tuna_lover1年前1
tuna_lover1年前1 -
 NoRoomintheArk 共回答了18个问题
NoRoomintheArk 共回答了18个问题 |采纳率88.9%合成氨是一个放热反应,按照勒夏特列原理,降低温度有利于提高氨气产率.实际工业中取高温是为了最大发挥催化剂的活性.且催化剂不影响化学平衡,所以本题选A1年前查看全部
- 一道化学平衡题25.接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行2SO2+O2可逆符号2SO3+190KJ
一道化学平衡题
25.接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行2SO2+O2可逆符号2SO3+190KJ
1)该反应所用的催化剂是___(填写化合物名称),该反应450℃时的平衡常数 _____500℃时的平衡常数(填“大于”、“小于”或“等于”).
4)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含 SO30.18mol,则 O2的速率=______ :若继续通入0.20mol SO2和0.10molO2 ,则平衡______移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,______ mol fatdabaicai1年前1
fatdabaicai1年前1 -
 健之懒懒 共回答了16个问题
健之懒懒 共回答了16个问题 |采纳率100%在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,若继续通入0.20mol SO2和0.10mol O2,则平衡 向正反应方向 移动,【增大反应物浓度,平衡右移.】再次达到平衡后,0.36mol1年前查看全部
- 一定温度下,将2mol SO2和1mol O2充入一定密闭容器中,在催化剂存在下进行下列反应 2SO2(g) +O2(g
一定温度下,将2mol SO2和1mol O2充入一定密闭容器中,在催化剂存在下进行下列反应 2SO2(g) +O2(g )==2SO3(g) H=-197KJ/mol,当达到平衡状态是,下列说法正确的是 A 生成SO3为2mol
B,放出197KJ的热量 C SO2和SO3物质的量只和为3mol D SO2的物质的量和SO3的物质的量一定相等
C SO2和SO3物质的量只和为2mol Shinna19851年前1
Shinna19851年前1 -
 yiwa923 共回答了22个问题
yiwa923 共回答了22个问题 |采纳率72.7%ΔH是化学反应焓变,焓是物体的一个热力学能状态函数,焓变即物体焓的变化量
ΔH=ΔU+PV 在只做体积功条件下 ΔH=-Q
即通常情况下,ΔH为热量增加的相反数,所以,这里ΔH=-197KJ/mol就是反应放出197KJ的热
好,下面我们来看这道题、、、
因为是可逆反应,转化率不会达到100%,所以生成的SO3的物质的量小于2mol,且放出的热小于197KJ,AB错
又因为每xmol的SO2被消耗就有xmol的SO3生成
反应开始时
SO2为2mol,SO3 0mol
所以无论怎么反应,限度是否改变,都有SO2和SO3物质的量之和为2mol
C对D错
不懂再问,1年前查看全部
- 化学计算题,求分析.分析 MnO2作为催化剂在反应前后其质量和化学性质都不改变,所以13.32g-9.48g=3.84g
化学计算题,求分析.
分析 MnO2作为催化剂在反应前后其质量和化学性质都不改变,所以13.32g-9.48g=3.84g,这3.84g就是放出O2的质量,这也是解本题的关键.
根据质量守恒定律
mO2 = 13.32g – 9.48g = 3.84g
设生成物中KCI质量为xg
2KClO2 = 2KCl + 3O2↑
149 96
x 3.84g
∴ x=5.96g
为什么1氯酸钾分子的相对分子质量要乘3,明明氯酸钾的质量只是指一个氯酸钾的啊
难道两个都是生成物的物质也可以组成比例式么?而不是偏要反应物和生成物一边一个组成比例式么?我们化学老师将都没有讲过这些细节.弄的我算出来也不敢肯定, 长春163长春1631年前1
长春163长春1631年前1 -
 准娘 共回答了21个问题
准娘 共回答了21个问题 |采纳率85.7%你好,你的第一个问题”为什么1氯酸钾分子的相对分子质量要乘3,明明氯酸钾的质量只是指一个氯酸钾的",我不知道你的意思,希望你能补充说明一下,ok?第二个问题:"难道两个都是生成物的物质也可以组成比例式么?而不是偏要反应物和生成物一边一个组成比例式么?"你的顾虑是多余的,这犹如:若A/B=C/D,A/B=E/F,则C/D=E/F,在化学方程中,所有参与反应的物质中,任意两个都可以列到比例式中,都是符合的,嘿嘿,用手机回答的,没法分行,希望你能看明白1年前查看全部
- 下列描述正确的是( )A.一切物质都是由分子构成的B.催化剂的质量和性质在化学反应前后均不变C.不同种元素的本质区别是
下列描述正确的是( )
A.一切物质都是由分子构成的
B.催化剂的质量和性质在化学反应前后均不变
C.不同种元素的本质区别是质子数不同
D.电解水中所得氢气和氧气的体积比是1:2 hongjiu91年前1
hongjiu91年前1 -
 wythidtf 共回答了21个问题
wythidtf 共回答了21个问题 |采纳率95.2%解题思路:A.根据物质的构成微粒进行分析;
B.根据催化剂的作用和特点进行分析;
C.根据元素的定义进行分析;
D.根据电解水实验及现象进行分析.A.构成物质的基本微粒有分子、原子、离子,有的物质是由分子构成的,有的物质是由原子或离子构成的,故说法错误;
B.一般情况下,催化剂只改变其他物质的反应速率,而本身在反应前后质量和化学性质都没有发生变化.这里指化学性质,所以说性质不恰当,故说法错误;
C.决定元素的种类的是质子数(即核电荷数),不同种元素最本质的区别是质子数不同,故选项正确;
D.电解水中所得氢气和氧气的体积比是2:1,故说法错误.
故答案为:C.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;催化剂的特点与催化作用;电解水实验;元素的概念.
考点点评: 本题主要考查物质的构成、催化剂的性质及作用、决定元素种类的因素以及电解水实验等,熟练掌握相关化学知识是解决此题的关键.1年前查看全部
- 实验室用过氧化氢溶液制取氧气的时候为什么用二氧化锰作催化剂而不直接加热过氧化氢溶液呢?
 土豆00451年前3
土豆00451年前3 -
 happy游柚 共回答了21个问题
happy游柚 共回答了21个问题 |采纳率95.2%只有加热很浓的过氧化氢才可以制取氧气.而用二氧化锰催化的双氧水浓度不必很高.用二氧化锰来催化制取也更方便1年前查看全部
- 二氧化锰作催化剂时,用质量守恒定律计算,用反应物的质量减生成物的质量,放映物种算不算二氧化锰的质量
 snwvh19781年前1
snwvh19781年前1 -
 nobarking 共回答了25个问题
nobarking 共回答了25个问题 |采纳率92%不算1年前查看全部
- (1)一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式:4X+5O 2 催化剂 .
(1)一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式:4X+5O 2
4NO+6H 2 O,根据质量守恒定律可以推断出X的化学式:______.催化剂 .
(2)尾气中含一氧化氮、一氧化碳等有毒气体,处理方法是在汽车尾气管上装一个催化转化器,在催化作用下,一氧化氮与一氧化碳生成二氧化碳和氮气,该反应的方程式为:______. 成琴1年前1
成琴1年前1 -
 开心走过一次 共回答了12个问题
开心走过一次 共回答了12个问题 |采纳率91.7%(1)根据质量守恒定律,化学反应前后元素种类及原子个数不变,由方程式可知,生成物中各元素及原子个数为:N,4;O,10;H,12; 已知反应物中各元素及原子个数为:O,10; 比较可知X中含有N和H元素,原子个数分别为1和3,故化学式为 NH 3 ,故答案为NH 3
(2)根据反应物是一氧化氮与一氧化碳,生成物是二氧化碳和氮气,反应条件是催化剂,写出方程式为2CO+2NO
催化剂
.
2CO 2 +N 2 ;故答案为2CO+2NO
催化剂
.
2CO 2 +N 2
故答案为:(1)NH 3 (2)2CO+2NO
催化剂
.
2CO 2 +N 21年前
11年前查看全部
- (18分)工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH 3 与NOx在催化剂作用下反应生成无毒的物质。某校活动小
(18分)工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH 3 与NOx在催化剂作用下反应生成无毒的物质。某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物 的处理过程。
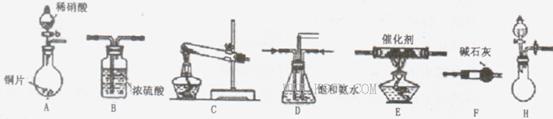
I.探究制取NH 3 的方法
(1)B装置的名称:______________
(2)在上述装置中,H能快速、简便制取,装置中需要添加的反应试剂为_________ 。
(3)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据。
分析表中数据,你认为哪种方案制取氨气的效果最好________(填序号),从该方案选择的原料分析制气效果好的可能原因是________,__________。试剂组合序号 固体试剂 NH 3 体积(mL) a 6.0gCa(OH) 2 过量 5.4gNH 4 Cl 1344 b 5.4g(NH 4 ) 2 SO 4 1364 c 6.0gNaOH过量 5.4gNH 4 Cl 1568 d 5.4g(NH 4 ) 2 SO 4 1559 e 6.0gCaO过量 5.4gNH 4 Cl 1753 f 5.4g(NH 4 ) 2 SO 4 1792
II.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验。
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复)。
(2)A中反应的离子方程式为__________________________
(3)D装置的作用有:_____________、____________、_____________。
(4)D装置中的液体还可换成(填序号)。
A.H 2 OB.CCl 4 C.浓H 2 SO 4 D.CuSO 4 溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是___________. 6233388271年前1
6233388271年前1 -
 萧萧的宝 共回答了18个问题
萧萧的宝 共回答了18个问题 |采纳率94.4%(18分)Ⅰ(1)洗气瓶(1分)
(2)生石灰与浓氨水(或烧碱与浓氨水)(答化学式给分)(2分)
(3)f (2分);(NH 4 ) 2 (SO 4 )受热不分解,CaO又有吸水作用(合理答案均给分)(2分)
Ⅱ(1)F E B(2分)
(2)3Cu+2NO 3 - +8H + =2NO↑+4H 2 O +3Cu 2+ (2分)
(3)使气体混合均匀,调节气流速度,防止氨气溶解(或防倒吸)(3分)
(4)b(2分)
(5)未反应的NO无法处理,会污染环境(2分)
1年前查看全部
- 氧化钙与一氧化碳反应吗?如果要反应,在什么条件下反应或在什么催化剂下反应.
 zcxvbnm1年前3
zcxvbnm1年前3 -
 Jocey 共回答了27个问题
Jocey 共回答了27个问题 |采纳率92.6%不反应,因为一氧化碳的还原能力不能还原正2价的钙.所以,如果打算用氧化钙与一氧化碳反应生成钙和二氧化碳是很难的.1年前查看全部
- 2CO+O2=2CO2反应是放热反应,反应是等压过程,要提高CO2的产率,采取的措施.A加催化剂B加热C加
2CO+O2=2CO2反应是放热反应,反应是等压过程,要提高CO2的产率,采取的措施.A加催化剂B加热C加
C加二氧化碳D加氮气 狄琅1年前3
狄琅1年前3 -
 大硕0525 共回答了19个问题
大硕0525 共回答了19个问题 |采纳率73.7%选D.
A 加催化剂只能改变反应速率,不会改变反应平衡.
B 加热 该反应为放热反应,加热会使平衡逆向进行,CO2的产率变低.所以错
C 加CO2 导致平衡逆向进行,CO2的产率变低.错
D 加氮气 反应等压,加氮气会使反应体积增大,所以会是反应的正反应增大,即能提高CO2的产率.对1年前查看全部
- 什么东西与二氧化锰反应或将其作为催化剂,加热生成气体?
什么东西与二氧化锰反应或将其作为催化剂,加热生成气体?
生成的气体是什么?
(制氧气的反应就别说了……) nn小狗1年前2
nn小狗1年前2 -
 wangqi198321 共回答了17个问题
wangqi198321 共回答了17个问题 |采纳率88.2%制氯气的,MnO2+4HCl(浓)(加热)=Cl2+MnCl2+2H2O1年前查看全部
- 碳氮双键如何氢化,如CH2=NH怎样氢化成CH3-NH2,什么条件,用什么催化剂?
 煜晟1年前2
煜晟1年前2 -
 find_888 共回答了22个问题
find_888 共回答了22个问题 |采纳率95.5%用镍做催化剂与氢气直接加热即可1年前查看全部
- 下列说法正确的是( )A. 在合成氨反应中,相同条件下有催化剂时(a)和无催化剂时(b)速率时间图象可用图1表示B.
下列说法正确的是( )

A. 在合成氨反应中,相同条件下有催化剂时(a)和无催化剂时(b)速率时间图象可用图1表示
B. 已知:A+H2O⇌B+C两份初始浓度不同的A溶液得到c(A)随时间变化如图2.由图可以充分说明A的水解反应速率随温度升高而增大
C. 图3表示合成氨反应在其他条件不变的情况下,改变n(H2)起始对平衡的影响.由此可知,N2的转化率最高的是b点
D. 用0.1000 mol/L NaOH溶液分别滴定浓度相同的两种一元酸①和②,由图4曲线可确定酸性:②强于① 诸葛火逍遥1年前1
诸葛火逍遥1年前1 -
 逸然930 共回答了23个问题
逸然930 共回答了23个问题 |采纳率91.3%解题思路:A.加入催化剂,反应速率增大;
B.应在浓度相同的条件下比较;
C.氮气的转化率最大的是c;
D.浓度相同的两种一元酸①和②,pH越小,酸的电离程度越大.A.加入催化剂,反应速率增大,a、b的反应速率不等,故A错误;
B.比较温度对反应速率的影响,应在同浓度下比较,否则不具有可比性,故B错误;
C.增大氢气的浓度,平衡向正向移动,氢气的起始量越大,氮气的转化率越大,故C错误;
D.浓度相同的两种一元酸①和②,pH越小,酸的电离程度越大,故D正确.
故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;化学反应速率的影响因素;化学平衡的影响因素.
考点点评: 本题考查较为综合,涉及化学反应速率的影响、平衡移动以及酸碱混合的定性判断等知识,为高考常见题型,侧重于学生的分析能力的考查,难度中等,注意相关基础知识的积累.1年前查看全部
- 用于二茂铁及其衍生物合成的最新催化剂及其优缺点?
 xiaoan19831年前1
xiaoan19831年前1 -
 l3gi 共回答了15个问题
l3gi 共回答了15个问题 |采纳率86.7%优缺点很难说,但此类催化剂目前常被用于不对称催化反应,而且在很多场合下都能得到不错的ee值,这应该算是一个优点.但是作为手性源,此类催化剂很少能自己作为催化反应进行的物种,而往往是辅助一些贵重金属催化剂,在偶联等反应中实现不对称.另外,此类催化剂合成也不是特别容易,算是一个缺点.1年前查看全部
- 催化剂能使反应速率逐渐加快吗?h202中mno2
 juzihlyl1年前2
juzihlyl1年前2 -
 jiapeng521 共回答了18个问题
jiapeng521 共回答了18个问题 |采纳率94.4%能加快双氧水的分解速率,但不是逐渐加快的.1年前查看全部
- 催化剂只能改变化学反应速率(包括——和 —— 两种作用)不能增大或渐少生成物的——
 江西玉米0521年前1
江西玉米0521年前1 -
 wu2636686 共回答了20个问题
wu2636686 共回答了20个问题 |采纳率100%催化剂只能改变化学反应速率(包 括[改变正反应速率] 和 [改变逆反应速率]两种作用)
不能增大或渐少生成物的(质量)1年前查看全部
- 氢氧化钠可以作30%过氧化氢分解反应的催化剂吗会不会产生其他的物质?
 雪狼_791年前1
雪狼_791年前1 -
 ll2004 共回答了24个问题
ll2004 共回答了24个问题 |采纳率87.5%过氧化氢制氧的催化剂十分广泛,一般的金属氧化物,氢氧化物都可以.当然氢氧化钠也可以.不会产生其他物质.1年前查看全部
- 如何检验糖类水解产物?需先加入___________溶液中和作催化剂的____________,再加入_________
如何检验糖类水解产物?
需先加入___________溶液中和作催化剂的____________,再加入_____________和__________________进行检验. wsssss1年前1
wsssss1年前1 -
 娃哈哈7501 共回答了19个问题
娃哈哈7501 共回答了19个问题 |采纳率89.5%还原性糖用氢氧化铜和氢氧化钠在酒精灯的加热下生成羧酸,氧化亚铜和水1年前查看全部
- 氮气和氢气以1:1的物质量混合后等分成2份分别冲入装有催化剂的真空密闭容器中在保持温度的条件下,反应相继达到平衡,A容器
氮气和氢气以1:1的物质量混合后等分成2份分别冲入装有催化剂的真空密闭容器中在保持温度的条件下,反应相继达到平衡,A容器中氢气的转化率是60%.B容器中氮气的转化率是10%.问A容器和B容器哪个体积大?
 yangsong121年前2
yangsong121年前2 -
 深色领带 共回答了17个问题
深色领带 共回答了17个问题 |采纳率94.1%A容器中氢气的转化率是60%,氮气的转化率就是20%,比B容器中氮气的转化率大,氮气和氢气的反应是一个体积减小的,则B容器体积大.1年前查看全部
- 氢气和氧气在催化剂作用下反应做燃料电池的化学方程式?
 云舞飞扬11年前2
云舞飞扬11年前2 -
 chouch 共回答了19个问题
chouch 共回答了19个问题 |采纳率89.5%负极:2H2-4e-=4H+
正极:O2+2H2O+4e-=4OH-
总反应:2H2+O2=2H2O1年前查看全部
- 在一本书中提到一种碱性催化剂:氯原子链接至少为十二个碳原子的季铵碱@小弟很是迷惑,
 蝴蝶梦与飞1年前2
蝴蝶梦与飞1年前2 -
 兰心如梦 共回答了16个问题
兰心如梦 共回答了16个问题 |采纳率87.5%这是一种有亲水基(铵基)和疏水基(烷基)的相转移催化剂(也叫表面活性剂);在聚合反应中用来从水相向油滴中运送单体的.1年前查看全部
大家在问
- 1紫藤萝瀑布以()为线索,对于紫藤萝花的描写按()的顺序,先写(),次写(),再写(),从抒写()之情到()之憾
- 2将3mol一氧化碳和6mol氢气充入容积为0.5L的密闭容器中,进行如下反应:CO+2H2=CH3OH 反应进行到6秒时
- 3treat表示治疗,强调过程`有个短语结构是:treat sb.for disease
- 4我们应该养成艰苦朴素,热爱劳动(改病句) 以日出为内容各写一个比喻和拟人句
- 5怎样简便计算5×【(68.41-32.17)÷0.4】
- 6Who did it is still a mystery,为何这句没连接词呢?
- 7什么东西的沸点在零下7摄氏度左右?
- 8请帮我完成句子 1.这次会议在2012年冬天举行。 2.这次会议举行在2012年冬天。 哪个正确?
- 9赤壁之战是我国著名长篇历史小说《三国演义》中的有名的什么战役
- 10Kids who receive special education are, without doubt, the h
- 11中国汽车行业如何走可持续发展之路,
- 12our classmates是单数复数
- 13飞行员驾驶飞机,前4分钟用半速飞行,后4分钟用全速飞行.在8分钟内一共飞行100千米,
- 14立平方米的立平方分米之间的进率是多少
- 15已知A、B是抛物线y^2=2px上的两个点,O为坐标原点,且抛物线的焦点恰为△ABO的垂心,求直线AB的方程
