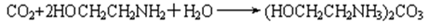科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)
 mwemei2022-10-04 11:39:541条回答
mwemei2022-10-04 11:39:541条回答(1)写出CO燃烧的热化学方程式______;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
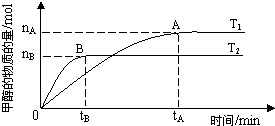
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);

①温度升高该反应的平衡常数______(增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是
| 3nB |
| 2tB |
| 3nB |
| 2tB |
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-═CO32-+3H2O,负极的反应式为______.

已提交,审核后显示!提交回复
共1条回复
 津女 共回答了16个问题
津女 共回答了16个问题 |采纳率100%- 解题思路:(1)依据热化学方程式书写方法和注意问题标注物质聚集状态和对应焓变;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)①依据先拐先平的判断方法可知T1<T2,温度变化判断平衡移动的分析分析平衡常数变化;
②依据图象分析甲醇的平衡物质的量和时间,结合化学方程式计算消耗氢气的物质的量,结合反应速率概念计算得到;
(4)甲醇燃料电池,燃料在负极失电子发生氧化反应.(1)由CO(g)的燃烧热△H分别为-283.0kJ•mol-1,则一氧化碳燃烧的热化学方程式为:CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566KJ•mol-1
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566KJ•mol-1;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)①图象分析先拐先平,温度高,T1<T2,温度越高甲醇物质的量越小,说明平衡逆向进行,平衡常数减小,故答案为:减小;
②B过程依据图象分析,在tB达到平衡时生成甲醇nBmol,依据化学方程式CO2+3H2=CH3OH+H2O,消耗氢气物质的量为3nBmol,用H2表示该反应的化学反应速率=
3nBmol
2L
tBmin=
3nB
2tBmol/L•min,故答案为:
3nB
2tB;
(4)直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-═CO32-+3H2O,甲醇燃料电池,燃料在负极失电子发生氧化反应,负极的反应式为:
CH3OH-6e-+8OH-═CO32-+6H2O,故答案为:CH3OH-6e-+8OH-═CO32-+6H2O.点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡的影响因素.
考点点评: 本题考查了热化学方程式的书写和盖斯定律的应用,化学平衡的影响因素分析判断,图象分析应用能力,原电池电极反应书写方法,题目难度中等. - 1年前
相关推荐
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (g)、CO(g)和CH 3 OH(l)的燃烧热△H分别为-285.8 kJ·mol -1 、-283.0 kJ·mol -1 和-726.5kJ·mol -1 。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______________________________。
(3)在容积为2L的密闭容器中,由CO 2 和H 2 合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T 1 、T 2 均大于300℃);下列说法正确的是________(填序号)
①温度为T 1 时,从反应开始到平衡,生成甲醇的平均速率为v(CH 3 OH)= mol·L -1 ·min -1
mol·L -1 ·min -1
②该反应在T 1 时的平衡常数比T 2 时的小
③该反应为放热反应
④处于A点的反应体系从T 1 变到T 2 ,达到平衡时增大
(4)在T 1 温度时,将1molCO 2 和3molH 2 充入一密闭恒容器中,充分反应达到平衡后,若CO 2 转化率为a,则容器内的压强与起始压强之比为__________;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为____________________________、正极的反应式为________________________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
 季毛毛1年前1
季毛毛1年前1 -
 绿叶仙踪 共回答了14个问题
绿叶仙踪 共回答了14个问题 |采纳率92.9%1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (g)、CO(g)和CH 3 OH(l)的燃烧热△H分别为-285.8 kJ·mol -1 、-283.0 kJ·mol -1 和-726.5kJ·mol -1 。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______________________________。
(3)在容积为2L的密闭容器中,由CO 2 和H 2 合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T 1 、T 2 均大于300℃);下列说法正确的是________(填序号)
①温度为T 1 时,从反应开始到平衡,生成甲醇的平均速率为v(CH 3 OH)= mol·L -1 ·min -1
mol·L -1 ·min -1
②该反应在T 1 时的平衡常数比T 2 时的小
③该反应为放热反应
④处于A点的反应体系从T 1 变到T 2 ,达到平衡时增大
(4)在T 1 温度时,将1molCO 2 和3molH 2 充入一密闭恒容器中,充分反应达到平衡后,若CO 2 转化率为a,则容器内的压强与起始压强之比为__________;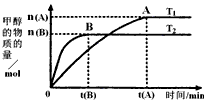
 不只隔云端1年前1
不只隔云端1年前1 -
 9sp4ac 共回答了20个问题
9sp4ac 共回答了20个问题 |采纳率80%1年前查看全部
- 二甲醚(CH 3 OCH 3 ,沸点为-24.9℃)被称为21世纪的新型能源。科学家利用太阳能分解水生成的氢气与从烟道气
二甲醚(CH 3 OCH 3 ,沸点为-24.9℃)被称为21世纪的新型能源。科学家利用太阳能分解水生成的氢气与从烟道气中分离出的CO 2 在催化剂作用下合成二甲醚,并开发出直接以二甲醚为燃料的燃料电池。其合成流程如下:

(1)已知:CH 3 OCH 3 (g)、H 2 (g)的标准燃烧热分别为:△H= -1455.0kJ·mol -1 、△H=" -285.8" kJ·mol -1 。写出以CO 2 、H 2 合成CH 3 OCH 3 的热化学方程式: ;
(2)15~20%的乙醇胺(HOCH 2 CH 2 NH 2 )水溶液具有弱碱性,上述合成线路中用作CO 2 吸收剂。写出吸收CO 2 反应的化学方程式 ;
(3)一定条件下用CO 2 和H 2 合成二甲醚,反应物气流量对CO 2 的转化率、二甲醚的选择性(是指转化生成二甲醚的碳占已转化碳的比例)影响结果如图1所示,当控制气流量为28mL· min -1 时,则生成0.3mol二甲醚需要通入CO 2 的物质的量为 ;
图1 图2
(4)图2为二甲醚燃料电池示意图。
①a电极的电极反应式为 ;
②若以1.12 L·min -l (标准状况)的速率向该电池中通入二甲醚,用该电池电解50mL2 mol·L -1 CuSO 4 溶液,通电0.50 min后,计算理论上可析出金属铜的质量为 。 lopr1231年前1
lopr1231年前1 -
 花大哈 共回答了13个问题
花大哈 共回答了13个问题 |采纳率100%1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.
请回答下列问题:
(1)用太阳能分解5mol水消耗的能量是______kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);
下列说法正确的是______(填序号)
①度为T1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH3OH)=
mol•L-1•min-1nA tA
②该反应为放热反应
③该反应在T1时的平衡常数比T2时的小
④处于A点的反应体系从T1变到T2,达到平衡时
增大n(H2) n(CH3OH)
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______. 晨風sg1年前1
晨風sg1年前1 -
 k2tt6 共回答了18个问题
k2tt6 共回答了18个问题 |采纳率88.9%解题思路:(1)根据氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)根据图象中甲醇的变化来计算反应速率,并利用图象中时间与速率的关系来分析T1、T2,再利用影响平衡的因素来分析解答;
(4)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来解答.(1)由H2(g)的燃烧热△H为-285.8kJ•mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,
即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解5mol H2O(l)消耗的能量为285.8kJ×5=1429kJ,
故答案为:1429;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+[1/2]O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+[1/2]O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知,②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),则△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)根据题给图象分析可知,T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应,则T1时的平衡常数比T2时的大;
①v(CH3OH)=
nA
2L
tA=
nA
2tAmol/L•min,故①错误;
②依据图象分析T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应,故②正确;
③正反应为放热反应,根据题给图象分析可知,T2先达到平衡则T2>T1,升高温度,平衡向逆反应方向移动,该反应在T1时的平衡常数比T2时的大,故③错误;
④处于A点的反应体系从T1变到T2,升高温度,平衡向逆反应方向移动,达到平衡时,氢气物质的量增大、甲醇的物质的量减小,故
n(H2)
n(CH3OH)增大,故④正确;
故答案为:②④;
(4)由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始 13 0 0
变化 a3aa a
平衡 1-a 3-3a aa
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为=(1-a+3-3a+a+a):(1+3)=(2-a):2,
故答案为:(2-a):2.点评:
本题考点: 化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题主要考查了燃烧热计算、盖斯定律、热化学反应方程式、反应速率、化学平衡等重要知识,难度中等,注意对基础知识的理解掌握.1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (g)、CO(g)和CH 3 OH(l)的燃烧热△H分别为-285.8 kJ·mol -1 、-283.0 kJ·mol -1 和-726.5kJ·mol -1 。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______________________________。
(3)在容积为2L的密闭容器中,由CO 2 和H 2 合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T 1 、T 2 均大于300℃);下列说法正确的是________(填序号)
①温度为T 1 时,从反应开始到平衡,生成甲醇的平均速率为v(CH 3 OH)=  mol·L -1 ·min -1
mol·L -1 ·min -1
②该反应在T 1 时的平衡常数比T 2 时的小
③该反应为放热反应
④处于A点的反应体系从T 1 变到T 2 ,达到平衡时 增大
增大
(4)在T 1 温度时,将1molCO 2 和3molH 2 充入一密闭恒容器中,充分反应达到平衡后,若CO 2 转化率为a,则容器内的压强与起始压强之比为__________;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为____________________________、正极的反应式为________________________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比) vv教女vv1年前1
vv教女vv1年前1 -
 wqskjq 共回答了20个问题
wqskjq 共回答了20个问题 |采纳率70%1年前查看全部
- 科学家利用太阳能分解水生成的H2在催化剂作用下与CO2反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已
 科学家利用太阳能分解水生成的H2在催化剂作用下与CO2反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的H2在催化剂作用下与CO2反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是______kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______.
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,温度对反应的影响结果如右上图所示,则下列有关说法正确的是______(填序号).
A.该反应为放热反应
B.该反应在T1时的平衡常数比T2时的小
C.T1时,从反应开始到平衡,生成甲醇的平均化学反应速率为υ(CH3OH)=nA/t2mol•min-1
D.处于A点的反应体系从T1变到T2,达到平衡时
增大n(H2) n(CH3OH)
(4)在直接以甲醇为燃料的燃料电池中,电极为惰性电极,电解质溶液为稀H2SO4,则负极的电极反应式为______. cloudybird1年前1
cloudybird1年前1 -
 Kevin377 共回答了15个问题
Kevin377 共回答了15个问题 |采纳率93.3%解题思路:(1)根据氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)根据图象中甲醇的变化来计算反应速率,并利用图象中时间与速率的关系来分析T1、T2,再利用影响平衡的因素来分析解答;
(4)负极上燃料甲醇失电子发生氧化反应生成二氧化碳.(1)由H2(g)的燃烧热△H为-285.8kJ•mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,
即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解10mol H2O(l)消耗的能量为285.8kJ×10=2858kJ,
故答案为:2858;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+[1/2]O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+[1/2]O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知,②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),则△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)根据题给图象分析可知,T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应,则T1时的平衡常数比T2时的大;
A、依据图象分析T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应,故A正确;
B、正反应为放热反应,根据题给图象分析可知,T2先达到平衡则T2>T1,升高温度,平衡向逆反应方向移动,该反应在T1时的平衡常数比T2时的大,故B错误;
C、v(CH3OH)=
nA
2L
tA=
nA
2tAmol/L•min,故C错误;
D、处于A点的反应体系从T1变到T2,升高温度,平衡向逆反应方向移动,达到平衡时,氢气物质的量增大、甲醇的物质的量减小,故
n(H2)
n(CH3OH)增大,故D正确;
故答案为:AD;
(4)酸性条件下,负极上燃料甲醇失电子发生氧化反应生成二氧化碳和氢离子,电极反应式为:CH3OH+H2O-6e-=CO2+6H+,
故答案为:CH3OH+H2O-6e-=CO2+6H+.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学电源新型电池;化学平衡建立的过程.
考点点评: 本题主要考查了燃烧热计算、盖斯定律、热化学反应方程式、反应速率、化学平衡、电极方程的书写等重要知识,难度中等,注意对基础知识的理解掌握.1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H 2 (
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H 2 (g)、CO(g)和CH 3 OH(l)的燃烧热△H分别为-285.8kJ-mol -1 、-283.0kJ-mol -1 和-726.5kJ-mol -1 .
请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是______kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
(3)在容积为2L的密闭容器中,由CO 2 和H 2 合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T 1 、T 2 均大于300℃);
下列说法正确的是______(填序号)
①温度为T 1 时,从反应开始到平衡,生成甲醇的平均速率为:v(CH 3 OH)=
mol-L -1 -min -1n A t A
②该反应在T 1 时的平衡常数比T 2 时的小
③该反应为放热反应
④处于A点的反应体系从T 1 变到T 2 ,达到平衡时
增大n( H 2 ) n(C H 3 OH)
(4)在T 1 温度时,将1mol CO 2 和3mol H 2 充入一密闭恒容器中,充分反应达到平衡后,若CO 2 转化率为a,则容器内的压强与起始压强之比为______.
 stranger9951年前1
stranger9951年前1 -
 smxxxt 共回答了21个问题
smxxxt 共回答了21个问题 |采纳率90.5%(1)由H 2 (g)的燃烧热△H为-285.8kJ?mol -1 知,1molH 2 (g)完全燃烧生成1molH 2 O(l)放出热量285.8kJ,
即分解1mol H 2 O(l)为1mol H 2 (g)消耗的能量为285.8kJ,则分解10mol H 2 O(l)消耗的能量为285.8kJ×10=2858kJ,
故答案为:2858;
(2)由CO(g)和CH 3 OH(l)的燃烧热△H分别为-283.0kJ?mol -1 和-726.5kJ?mol -1 ,则
①CO(g)+1/2O 2 (g)=CO 2 (g)△H=-283.0kJ?mol -1
②CH 3 OH(l)+3/2O 2 (g)=CO 2 (g)+2 H 2 O(l)△H=-726.5kJ?mol -1
由盖斯定律可知用②-①得反应CH 3 OH(l)+O 2 (g)=CO(g)+2 H 2 O(l),该反应的反应热△H=-726.5kJ?mol -1 -(-283.0kJ?mol -1 )=-443.5kJ?mol -1 ,
故答案为:CH 3 OH(l)+O 2 (g)=CO(g)+2 H 2 O(l)△H=-443.5kJ?mol -1 ;
(3)根据题给图象分析可知,T 2 先达到平衡则T 2 >T 1 ,由温度升高反应速率增大可知T 2 的反应速率大于T 1 ,
又温度高时平衡状态CH 3 OH的物质的量少,则说明可逆反应CO 2 +3H 2 ?CH 3 OH+H 2 O向逆反应方向移动,故正反应为放热反应,
则T 1 时的平衡常数比T 2 时的大,③、④正确,②中该反应在T 1 时的平衡常数比T 2 时的大,则②错误,①中按照其计算速率的方法可知反应速率的单位错误,应为mol?min -1 ,则①错误,
故答案为:③④;
(4)由化学平衡的三段模式法计算可知,
CO 2 (g)+3H 2 (g)=CH 3 OH(g)+H 2 O(g)
起始1300
变化a3 aaa
平衡 1-a3-3aaa
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为
(1-a+3-3a+a+a)
1+3 =
2-a
2 ,故答案为:
2-a
2 .1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (g)、CO(g)和CH 3 OH(l)的燃烧热ΔH分别为-285.8 kJ/mol、-283.0 kJ/mol和-726.5 kJ/mol。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是__________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________________; shmilyan_61年前1
shmilyan_61年前1 -
 epwjm 共回答了15个问题
epwjm 共回答了15个问题 |采纳率93.3%(4分)(1)2 858(2分)
(2)CH 3 OH(l)+O 2 (g)===CO(g)+2H 2 O(l) ΔH=-443.5 kJ/mol(2分)
1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
(1)用太阳能分解10mol液态水消耗的能量是______kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
(3)用甲醇与氧气在碱性条件下形成燃料电池的负极电极离子方程式为______
(4)在容积为2L的密闭容器中,由CO2和H2合成甲醇(CO2+3H2CH3OH+H2O)
在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=nA/tA mol•L-1•min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)增大
(5)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______. eileen_lin1年前1
eileen_lin1年前1 -
 依屏沙 共回答了18个问题
依屏沙 共回答了18个问题 |采纳率94.4%解题思路:(1)根据氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)燃料电池的负极上是燃料发生失电子的氧化反应,根据电解质环境来回答,甲醇失电子在碱溶液中生成碳酸盐和水;
(4)利用图象中甲醇的变化来计算反应速率,并利用图象中时间与速率的关系来分析T1、T2,再利用影响平衡的因素来分析解答;
(5)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来解答.(1)由H2(g)的燃烧热△H为-285.8kJ•mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,
即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解10mol H2O(l)消耗的能量为285.8kJ×10=2858kJ,
故答案为:2858;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+[1/2]O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+[1/2]O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知,②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),则△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)燃料电池的负极上是燃料甲醇发生失电子的氧化反应,电解质环境是碱性,则电极反应为:CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(4)根据题给图象分析可知,T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应,则T1时的平衡常数比T2时的大,③、④正确,②中该反应在T1时的平衡常数比T2时的大,故②错误,①中按照其计算速率的方法可知反应速率的单位错误,应为mol•min-1,故①错误,
故答案为:③④;
(5)由化学平衡的三段模式法计算可知,
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
转化(mol):a3aaa
平衡(mol):1-a 3-3a aa
根据相同条件下气体的压强之比等于物质的量之比,即(1-a+3-3a+a+a):(1+3)=[4−2a/4];
故答案为:[4−2a/4].点评:
本题考点: 反应热和焓变;原电池和电解池的工作原理;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查较为综合,涉及热化学方程式的书写、化学平衡的相关知识,该题对这些知识的要求比较高,综合性强,解答本题比较费时,该题难度较大.1年前查看全部
- (10分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池。
(10分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (g)、CO(g)和CH 3 OH(l)的热值分别为143kJ· g -1 、10kJ·g -1 和23kJ·g -1 。请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_ ______;
(2)在直接以甲醇为燃料电池中,电解质溶液为碱性,负极的反应式为_____ , 总反应式 。
(3)在350℃时,保持温度不变,将1molCO 2 和3molH 2 充入一密闭恒容器中,充分反应生成甲醇蒸汽和水蒸气达到平衡后,若CO 2 转化率为a,则容器内的压强与起始压强之比为______;若350℃时,保持温度不变,将1molCO 2 和3molH 2 充入一密闭恒压器中,充分反应达到平衡后,若CO 2 转化率为b,则a b(用“>、=、<”表示) yav_2_ffxy0ebf1年前1
yav_2_ffxy0ebf1年前1 -
 茄子鱼酱 共回答了25个问题
茄子鱼酱 共回答了25个问题 |采纳率84%(10分)(1)CH 3 OH(l)+O 2 (g)=CO(g)+2H 2 O(l) △H =-456KJ/mol
(2)CH 3 OH+8OH - -6e - =CO 3 2- +6H 2 O ; 2CH 3 OH+3O 2 +4OH - =2CO 3 2- +6H 2 O。
(3)1-a,<
(1)H 2 (g)、CO(g)和CH 3 OH(l)的燃烧热分别为:286kJ· mol -1 、280kJ· mol -1 、713kJ· mol -1 ;由盖斯定律求
2CO(g) + O 2 (g) =2CO 2 (g) △H=-560KJ mol -1 ②
CH 3 OH(l)+3/2 O 2 (g)=CO 2 (g)+2 H 2 O(l) △H=-736kJ·mol -1 ③
将③-②/2可知:CH 3 OH(l)+ O 2 (g)="CO(g)+2" H 2 O(l) △H=-456kJ·mol -1
(2)总反应:2CH 4 O + 3O 2 + 4OH — = 2CO 3 2- + 6H 2 O
负极:CH 3 OH+8OH - -6e - =CO 3 2- +6H 2 O正极:O2 + 4e– + 2H 2 O→ 4OH –
(3)CO 2 + 3H 2 CH 3 OH + H 2 O
CH 3 OH + H 2 O
初n: 1mol 1mol 0 0
△n: a 3a a a
平n: 1-a 1-3a a a
恒容下,由压强比等于物质的量比可得到:(2-2a)/2=1-a
该反应是正反应的气体系数减小,随着反应的进行,气体的物质的量减小,所以恒容下达到平衡相对于恒压是减压,所以a<1年前查看全部
- 科学家利用太阳能分解水中生成的氧气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池,已知H2(g
科学家利用太阳能分解水中生成的氧气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池,已知H2(g)CO(g)和CH20HCl的燃烧,△H分别为-285.8KJ/m0l一和一726.5KJ/mol,请回答下列问题:(1)用太阳能分解10mol水消耗的能量是多少?
(2)甲醇不完全燃烧生成一氧化碳和液态水的色化学方程式 遇见自己那一天1年前1
遇见自己那一天1年前1 -
 幻时佳人 共回答了9个问题
幻时佳人 共回答了9个问题 |采纳率100%首先看硫酸 碳酸氢钠 它们都是酸式盐 所以不考虑水解的话 可以把它们看做一元酸 但是由于碳酸氢钠电离后有碳酸根 会水解 导致碳酸氢钠碱性比硫酸氢钠强 由于此两种酸式盐的电离 使溶液中氢离子和氢氧根离子浓度不同 但氢氧根全部是由水电离的 所以可比较比两种酸式盐的碱性来比较氢离子的浓度 碳酸氢钠大于硫酸氢钠 然后比较碳酸 硫酸钠 用同样的方法比较 可知碳酸钠大于硫酸钠 因为酸式盐有氢离子抑制了水的电离 所以总体顺序是碳酸钠大于硫酸钠大于碳酸氢钠大于硫酸氢钠1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (g)、CO(g)和CH 3 OH(l)的燃烧热△H分别为-285.8 kJ·mol - 1 、-283.0 kJ·mol - 1 和-726.5 kJ·mol - 1 。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________________;
(3)在容积为2 L的密闭容器中,由CO 2 和H 2 合成甲醇(CO 2 +3H 2 CH 3 OH + H 2 O)
CH 3 OH + H 2 O)
在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T 1 、T 2 均大于300℃);下列说法正确的是______(填序号)
①温度为T 1 时,从反应开始到平衡,生成甲醇的平均速率为v(CH 3 OH) =n A /t A mol·L -1 ·min -1
②该反应在T 1 时的平衡常数比T 2 时的小
③该反应为放热反应
④处于A点的反应体系从T 1 变到T 2 ,达到平衡时n(H 2 )/n(CH 3 OH)增大
(4)在T 1 温度时,将1mol CO 2 和3mol H 2 充入一密闭恒容器中,充分反应达到平衡后,若CO 2 转化率为a,则容器内的压强与起始压强之比为_________________________。 y袁琳1年前1
y袁琳1年前1 -
 千山暮雪后 共回答了21个问题
千山暮雪后 共回答了21个问题 |采纳率90.5%(1)2858(2)CH 3 OH(l)+O 2 (g)===CO(g)+2H 2 O(l) △H=-443.5kJ/moL
(3)③④ (4)(4-2a):4
(1)氢气的燃烧热是-285.8 kJ·mol,所以1mol水分解需要的能量就是285.8 kJ,则分解10mol水就需要2858 kJ。
(2)根据题意可知,①CH 3 OH(l)+3/2O 2 (g)=CO 2 (g)+2H 2 O(l)△H=-726.5kJ/moL、②CO(g)+
1/2O 2 (g)=CO 2 (g) △H=-283.0kJ/mol,所以①-②即得到CH 3 OH(l)+O 2 (g)=CO(g)+2H 2 O(l),所以反应热是-726.5kJ/moL+283.0kJ/mol=-443.5kJ/moL。
(3)①不正确,因为平衡时甲醇的浓度是n A /2 mol·L -1 .T2时首先达到平衡状态,则温度是T2大于T1,温度高甲醇的含量底,说明升高温度平衡向逆反应方向移动,即正反应是放热反应,所以②不正确,③④正确。答案选③④。
(4)CO 2 转化率为a,则消耗CO 2 时amol,氢气时3amol,生成甲醇和水蒸气都是amol,所以容器内的压强与起始压强之比为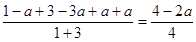 。
1年前查看全部
。
1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料
的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1.请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是————Kl
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________; Min_L1年前1
Min_L1年前1 -
 yuhao18153 共回答了17个问题
yuhao18153 共回答了17个问题 |采纳率94.1%(1)285.8KJ/mol *10mol==2858KJ
(2) CH3OH(l) + O2(g) == CO(g) + 2H2O(l) △H==439.5KJ/mol
ok!1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.已知H2(
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ•g-1、10kJ•g-1和23kJ•g-1.请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______;
(2)在直接以甲醇为燃料电池中,电解质溶液为碱性,负极的反应式为______,总反应式______.
(3)在350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒容器中,充分反应生成甲醇蒸汽和水蒸气达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为[2−a/2][2−a/2];若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,充分反应达到平衡后,若CO2转化率为b,则a______b(用“>、=、<”表示) zzheng1年前1
zzheng1年前1 -
 wcmwi1 共回答了15个问题
wcmwi1 共回答了15个问题 |采纳率93.3%解题思路:(1)依据物质的热值计算燃烧热,根据热化学方程式书写方法和注意问题标注物质聚集状态和对应焓变;
(2)甲醇燃料电池,燃料在负极失电子发生氧化反应,正极上是氧气得电子的还原反应,总反应是燃料燃烧的方程式;
(3)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来计算压强之比;根据压强对平衡移动的影响来确定平衡的移动方向.(1)CO(g)和CH3OH(l)的热值分别为10kJ•g-1和23kJ•g-1,即由CO(g)和CH3OH(l)的燃烧热△H分别为-280.0kJ•mol-1和-736kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-280.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-736kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-736kJ•mol-1-(-280.0kJ•mol-1)=-456kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-456kJ•mol-1;
(2)直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:2CH3OH+3O2+4OH-═2CO32-+6H2O,甲醇燃料电池,燃料在负极失电子发生氧化反应,负极的反应式为:CH3OH-6e-+8OH-═CO32-+6H2O,故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;2CH3OH+3O2+4OH-═2CO32-+6H2O;
(3)由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始1300
变化a3 aaa
平衡 1-a3-3aaa
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为[1−a+3−3a+a+a/1+3]=[2−a/2],若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,由于反应中气体的物质的量
是减小的,所以恒压相当于在恒容的基础上加大压强,平衡会正向移动,CO2转化率会增大,即a<b.
故答案为:[2−a/2];<.点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了热化学方程式的书写和盖斯定律的应用、化学平衡的计算、原电池电极反应书写方法等知识,题目难度中等.1年前查看全部
- 芒硝是重要的化工原料,具有广泛的用途.芒硝可调节室内温度.科学家利用太阳能的方法之一,是将装有芒硝的密闭聚乙烯管安装在房
芒硝是重要的化工原料,具有广泛的用途.芒硝可调节室内温度.科学家利用太阳能的方法之一,是将装有芒硝的密闭聚乙烯管安装在房屋的外墙内,当太阳照射的时候,它能将太阳能转化为化学能,达到蓄热效果,使室内保持较低温度;晚上,它能将化学能转化为热能,使室内保持温度,请结合方程式解析其原因.
 菜鸟0零七1年前1
菜鸟0零七1年前1 -
 6950301 共回答了16个问题
6950301 共回答了16个问题 |采纳率93.8%芒硝就是十水硫酸钠.温度较高时,脱去结晶水,是吸热过程,低温下,结合结晶水,是放热过程.因此可以利用这个原理储备和放出热量.1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(它)的燃烧热△H分别为-28多.8下J•do它-7、-283.0下J•do它-7和-723.多下J•do它-7,
(7)实验测得H2和CO的混合气体共多do它,完全燃烧生成液态水时放热7477.8下J,则混合气体中H2和CO的体积比是______.已知H2O(它)═H2O(g)△H=+44.0下J•do它-7写出甲醇燃烧生成CO2和气态水的热化学方程式______
(2)一定条件下,在体积为3它的密闭容器中反应CO(g)+2H2(g)⇌CH3OH(g)达到化学平衡状态.
①该反应的化学平衡常数表达式为下=C(CH3OH) C(CO)•C2(H2) ,温度升高该反应的平衡常数______(增大、减小、不变)C(CH3OH) C(CO)•C2(H2)
②判断该可逆反应达到化学平衡状态的标志是______(填字母).
s.v生成(CH3OH)=v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.CO、H2、CH3OH的浓度相等
6.混合气体的压强不再变化
③在300℃时,将7do它CO和3do它H2充入一密闭恒容容器中,充分反应达到平衡后,若CO的转化率为2多%,则容器内的压强与起始压强之比为______.
④多00℃时,将容器的容积压缩到原来的7/2,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母).
s.c(H2)减小B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加D.重新达到平衡时,[cH2/cCH3OH]减小
⑤300℃时 CO(g)+2H2(g)⇌CH3OH(g) 达到平衡状态时,平衡常数为2.4×70-4,若在某一时刻测得c(CO)=2.0do它•它-7,c(H2)=7.0do它•它-7,c(CH3OH)=4.0×70-4 do它•它-7,该反应是否处于化学平衡状态______(选填“是”或“否”),此时,化学反应速度是v正______v逆(选填“>”、“<”或“=”). peng777771年前1
peng777771年前1 -
 三叶草222 共回答了17个问题
三叶草222 共回答了17个问题 |采纳率88.2%解题思路:(1)根据H2和CO的燃烧热,然后设出H2的物质的量,利用方程式组来解;写出甲醇的燃烧的化学方程式,根据盖斯定律来解题;
(2)①根据化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,列出平衡常数的表达式;根据盖斯定律得出反应的热效应,进而判断温度升高该反应的平衡常数的变化;
②反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,可以及由此衍生的一些量也不发生变化,由此进行判断,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来解答;
④将容器的容积压缩到原来的[1/2],压强增大,反应速率增大,平衡向正反应方向移动,以此判断;
⑤根据浓度商Qc和平衡常数K的大小比较来分析.(1)设混合气中个图的物质的量为x,则Cw的物质的量为5mwl-x,根据题意,列方程为:图w5.wkJ/mwl×x+图w图.0kJ•mwl-1×(5mwl-x)=1w1你.wkJ,解大 x=1 mwl,则Cw的物质的量为5mwl-1mwl=wmwl,所以混合气体中个图与Cw的体积比即物质的量之比为1:w,
根据C个图w个(l)的燃烧热△个为-你图6.5kJ•mwl-1可知:
图C个图w个(l)+图w图(g)=图Cw图(g)+w个图w(l)△个=-1w5图KJ/mwl ①
又知:个图w(l)═个图w(g)△个=+ww.0kJ•mwl-1②
根据盖斯定律,将①+②×w可大:
图C个图w个(l)+图w图(g)=图Cw图(g)+w个图w(g)△个=(-1w5图KJ/mwl )+(+ww.0kJ•mwl-1)×w=-1图你你KJ/mwl
故答案为:1:w;图C个图w个(l)+图w图(g)=图Cw图(g)+w个图w(g)△个=-1图你你KJ/mwl;
(图)①化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,反应物的生成物都是气体,故平衡常数表达式为K=
C(C个图w个)
C(Cw)•C图(个图),
根据个图(g)、Cw(g)和C个图w个(l)的燃烧热△个分别为-图w5.wkJ•mwl-1、-图w图.0kJ•mwl-1和-你图6.5kJ•mwl-1,可知:
个图(g)+[1/图]w图(g)=个图w(l)△个=-图w5.wkJ•mwl-1 ①
Cw(g)+[1/图]w图(g)=Cw图(g)△个=-图w图.0kJ•mwl-1②
C个图w个(l)+[图/图]w图(g)=Cw图(g)+图个图w(l)△个=-你图6.5KJ/mwl ③
根据盖斯定律可知:将①×图+②-③可大:
Cw(g)+图个图(g)⇌C个图w个(g)△个=(-图w5.wkJ•mwl-1 )×图+(-图w图.0kJ•mwl-1)-(-你图6.5KJ/mwl)=-1图w.1KJ/mwl,可知反应放热,故当
温度升高时该反应的平衡逆向移动,故平衡常数K的值会减小,
故答案为:
C(C个图w个)
C(Cw)•C图(个图);减小;
②A、v生成(C个图w个)=v消耗(Cw),都表示正反应速率,始终按此比例进行,不能说明反应到达平衡,故A错误;
B、混合气体的总质量不变,容器的容积不变,混合气体的密度始终不变,故混合气体的密度不再改变,不能说明到达平衡,故B错误;
C、根据混合气体的平均相对分子质量=[混合气体的总质量/混合气体的总物质的量],而混合气体的总质量不变,平衡之前,混合气体的总物质的量在改变,故平衡之前混合气体的平均相对分子质量在改变,一旦不变了,说明反应达到平衡,故C正确;
D.平衡时各组分的浓度不变,Cw、个图、C个图w个的浓度不再改变,但不一定相等,故D错误;
上、随着反应的进行,平衡之前,容器内混合气体的总的物质的量减小,故压强逐渐降低,当容器内气体的压强保持不变时,即说明反应到达平衡,故上正确.
故选C上;
③由化学平衡的三段模式法:将1mwlCw和图mwl个图充入一密闭恒容容器中,充分反应达到平衡后,当Cw的转化率为图5%时,Cw反应掉0.图5mwl.
Cw(g)+图个图(g)⇌C个图w个(g)
初始:1mwl 图mwl 0mwl
△n:0.图5mwl 0.5mwl 0.图5mwl
平衡:0.你5mwl 图.5mwl0.图5mwl
平衡时容器内的压强与起始压强之比=气体的物质的量之比=[0.你5mwl + 图.5mwl + 0.图5mwl/ 1mwl+图mwl]=你:w,
故答案为:你:w;
④将容器的容积压缩到原来的[1/图],压强增大,正逆反应速率都增大,平衡向正反应方向移动,C个图w个的物质的量增加,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,故有
c(个图)
c(C个图w个)减小,故选CD,故答案为:CD;
⑤根据某一时刻测大c(Cw)=图.0mwl•L-1,c(个图)=1.0mwl•L-1,c(C个图点评:
本题考点: 热化学方程式;化学平衡的影响因素;化学平衡状态的判断;化学平衡的计算.
考点点评: 本题考查了化学平衡常数表达式及计算、影响化学平衡移动的因素,题目知识面广,难度较大,做题时注意三段式的应用.1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池。
已知H 2 (g)、CO(g)和CH 3 OH(l)的热值分别为143kJ·g -1 、10kJ·g -1 和23kJ·g -1 。
请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______________;
(2)在直接以甲醇为燃料电池中,电解质溶液为碱性,负极的反应式为________, 总反应式_____________。
(3)在350℃时,保持温度不变,将1molCO 2 和3molH 2 充入一密闭恒容器中,充分反应生成甲醇蒸汽和水蒸气达到平衡后,若CO 2 转化率为a,则容器内的压强与起始压强之比为______;若350℃时,保持温度不变,将1molCO 2 和3molH 2 充入一密闭恒压器中,充分反应达到平衡后,若CO 2 转化率为b,则a________b(用“>、=、<”表示) sdusc1年前1
sdusc1年前1 -
 becdibowrir 共回答了15个问题
becdibowrir 共回答了15个问题 |采纳率86.7%(1)CH 3 OH(l)+O 2 (g)= CO(g)+2H 2 O(l)△H =-456KJ/mol
(2)CH 3 OH+8OH - -6e - =CO 3 2- +6H 2 O ; 2CH 3 OH+3O 2 +4OH - =2CO 3 2- +6H 2 O。
(3)(2-a)/2 ; <1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.如图中甲池
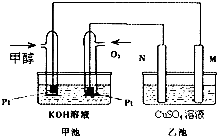 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.如图中甲池是一个甲醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol.L-1的CuSO4溶液.已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ•g-1、10kJ•g-1和23kJ•g-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.如图中甲池是一个甲醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol.L-1的CuSO4溶液.已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ•g-1、10kJ•g-1和23kJ•g-1.请回答下列问题:
(1)N的电极反应式为______;
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气为多少______L;
(3)在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况下),理论上需通入______g甲醇;
(4)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______;
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为碱性,负极的反应式为______,总反应式______;
(6)在350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒容器中,充分反应生成甲醇蒸汽和水蒸气达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为[2−a/2][2−a/2];若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,充分反应达到平衡后,若CO2转化率为b,则a______b(用“>、=、<”表示). CLAUDIO71年前1
CLAUDIO71年前1 -
 某向 共回答了15个问题
某向 共回答了15个问题 |采纳率93.3%解题思路:(1)燃料电池的正极上是氧气发生得电子的还原反应,负极上是燃料失电子的还原反应,电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,和电源的负极相连的是阴极,该极上发生得电子的还原反应;
(2)根据电极反应式结合电子守恒来计算;
(3)根据电极反应式结合电子守恒来计算;
(4)根据H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ•g-1、10kJ•g-1和23kJ•g-1,结合热化学方程式的意义来回答;
(5)氢氧燃料电池中,乙醇从负极通入,在反应中失电子被氧化,碱性条件下生成碳酸根离子和水,燃料电池的总反应是燃料燃烧的化学方程式;
(6)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来计算压强之比;根据压强对平衡移动的影响来确定平衡的移动方向.(1)燃料电池的正极上是氧气发生得电子的还原反应,电解池中,和电源的正极相连的是阳极,该极上发生氧化反应,所以N是阳极,该极上电极反应为:2H2O-4e-=O2↑+4H+,故答案为:2H2O-4e-=O2↑+4H+;
(2)乙池中M电极析出金属铜6.4g,根据电极反应:Cu2++2e-=Cu,析出金属铜6.4g即0.1mol,转移电子的物质的量是0.2mol,在燃料电池的正极上发生电极反应:
O2+2H2O+4e-=4OH-,当转移电子的物质的量是0.2mol时,消耗氧气的物质的量是0.05mol,体积是0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)乙池中发生的反应分别是:阳极上:4OH-=O2↑+2H2O+4e-,阳极上Cu2++2e-=Cu,2H++2e-=H2↑,100mL3.00mol•L-1的CuSO4溶液中铜离子物质的量是:0.3mol,铜离子得电子的是0.6mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+0.6=4n,解得n=0.3,即装置在转移电子的物质的量是1.2mol,甲醇燃料电池的负极上发生反应:CH3OH+8OH--6e-=CO32-+6H2O,当转移电子是1.2mol,消耗甲醇的物质的量是0.2mol,质量是0.2mol×32g/mol=6.4g,
故答案为:6.4;
(4)已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ•g-1、10kJ•g-1和23kJ•g-1,即:
①2H2(g)+O2(g)=2H20(l);△H=-572kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-560.0kJ•mol-1
③2CH3OH(l)+3O2(g)=2CO2(g)+4 H2O(l)△H=-1472kJ•mol-1
根据盖斯定律,则CH3OH(l)+O2(g)=CO(g)+2H2O(l)是反应③×[1/2]-②×[1/2]得到,所以反应的△H=-456 kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-456 kJ•mol-1
(5)在甲醇燃料电池的负极上是甲醇失电子的氧化反应,在碱性电解质下,电极反应为:CH3OH+8OH--6e-=CO32-+6H2O,总反应是甲醇燃烧的方程式,即2CH3OH+3O2+4OH-=2CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;2CH3OH+3O2+4OH-=2CO32-+6H2O;
(6)由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始1300
变化a3 aaa
平衡 1-a3-3aaa
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为[1−a+3−3a+a+a/1+3]=[2−a/2],若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,由于反应中气体的物质的量
是减小的,所以恒压相当于在恒容的基础上加大压强,平衡会正向移动,CO2转化率会增大,即a<b.
故答案为:[2−a/2];<.点评:
本题考点: 化学电源新型电池;电解原理.
考点点评: 本题综合考查学生热化学方程式的书写、电解池和燃料电池的工作原理、化学平衡的影响因素和计算等知识,属于综合知识的考查,难度中等.1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
(1)用太阳能分解10mol液态水消耗的能量是______kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
(3)在容积为2L的密闭容器中,由一定量的CO2和H2合成甲醇,在其他条件不变的情况下,温度对反应的影响,实验结果如右图所示(注:T1、T2均大于300℃);
下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=
mol•L-1•min-1nA tA
②该反应在T1时的平衡常数比T2时的大
③该反应的△H<0
④处于A点的反应体系从T1变到T2,达到平衡时容器中气体密度减小
⑤处于A点时容器中的压强比处于B点时容器中的压强大
(4)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为[2−a/2][2−a/2];
(5)在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为______. yunziqi1年前1
yunziqi1年前1 -
 绿茶1979 共回答了17个问题
绿茶1979 共回答了17个问题 |采纳率82.4%解题思路:(1)根据氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)根据图象中甲醇的变化来计算反应速率,并利用图象中时间与速率的关系来分析T1、T2,再利用影响平衡的因素来分析解答;
(4)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来解答;
(5)根据原电池中负极发生氧化反应,正极发生还原反应,并考虑电解质溶液参与电极反应来分析;(1)由H2(g)的燃烧热△H为-285.8kJ•mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,
即分解1mol H2O(l)生成1mol H2(g)消耗的能量为285.8kJ,则分解10mol H2O(l)消耗的能量为285.8kJ×10=2858kJ,
故答案为:2858;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+[1/2]O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+[3/2]O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),
该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)根据题给图象分析可知,T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应,则T1时的平衡常数比T2时的大;
①中按照其计算速率的方法可知反应速率=
na
2
ta=
na
2tamol/L•min,故①错误;
②正反应为放热反应,根据题给图象分析可知,T2先达到平衡则T2>T1,该反应在T1时的平衡常数比T2时的大,故②正确;
③依据图象分析T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应,该反应的△H<0,故③正确;
④处于A点的反应体系从T1变到T2,达到平衡时,容器中气体的质量不变,体积减小,密度增大,故④错误;
⑤A点甲醇的物质的量大于B点,反应是气体体积减小的反应,图象分析温度,T2先达到平衡则T2>T1,处于A点时容器中的压强比处于B点时容器中的压强小,故⑤错误;
故答案为:②③;
(4)由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始 13 0 0
变化 a3aa a
平衡 1-a 3-3a aa
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为=[1−a+3−3a+a+a/1+3]=[2−a/2]
故答案为:[2−a/2]
(5)由燃料电池是原电池的一种,负极失电子发生氧化反应,正极得电子发生还原反应,甲醇燃烧生成二氧化碳和水,但在酸性介质中,正极不会生成大量氢离子,则电解质参与电极反应,甲醇燃料电池的负极反应式为:CH3OH+H2O-6e-=CO2+6H+;
故答案为:CH3OH+H2O-6e-=CO2+6H+;点评:
本题考点: 热化学方程式;化学平衡的影响因素;物质的量或浓度随时间的变化曲线.
考点点评: 本题综合性较强,考查知识点较多,注重了对高考热点的考查,学生应熟悉燃烧热、盖斯定律、热化学反应方程式、反应速率、化学平衡、原电池等重要知识来解答.1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.
请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是______kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
______;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=nA tA
mol•L-1•min-1nA tA
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时增大
(4)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强之比为1-[a/2]1-[a/2]. bohemianbao20_11年前1
bohemianbao20_11年前1 -
 细细发菜 共回答了19个问题
细细发菜 共回答了19个问题 |采纳率89.5%解题思路:(1)氢气的燃烧热可知水分解吸收的能量,然后利用化学计量数与反应热的关系来计算;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)利用图象中甲醇的变化来计算反应速率,并利用图象中时间与速率的关系来分析T1、T2,再利用影响平衡的因素来分析解答;
(4)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来解答.(1)H2(g)的燃烧热△H为-285.8kJ•mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即分解1mol H2O(l)为1mol H2(g)消耗的能量为285.8kJ,则分解10mol H2O(l)消耗的能量为285.8kJ×10=2858kJ,
故答案为:2858;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+[1/2]O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+[3/2]O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),
该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)根据题给图象分析可知,T2先达到平衡则T2>T1,由温度升高反应速率增大可知T2的反应速率大于T1,又温度高时平衡状态CH3OH的物质的量少,则说明可逆反应CO2+3H2⇌CH3OH+H2O向逆反应方向移动,故正反应为放热反应,则T1时的平衡常数比T2时的大,③、④正确,②中该反应在T1时的平衡常数比T2时的大,故②错误,①中按照其计算速率的方法可知反应速率的单位错误,应为mol•min-1,故①错误,
故答案为:③④;
(4)由化学平衡的三段模式法计算可知,
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
转化(mol):a 3aa a
平衡(mol):1-a 3-3a aa
根据相同条件下气体的压强之比等于物质的量之比,即(1-a+3-3a+a+a):(1+3)=[4−2a/4]=1-[a/2],
故答案为:1-[a/2].点评:
本题考点: 化学平衡的计算;有关反应热的计算;物质的量或浓度随时间的变化曲线.
考点点评: 本题考查较为综合,涉及热化学方程式的书写、化学平衡的相关知识,该题对这些知识的要求比较高,综合性强,解答本题比较费时,该题难度较大.1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H 2 (g)、CO(g)和CH 3 OH(l)的燃烧热△H分别为-285.8 kJ·mol -1 、-283.0 kJ·mol -1 和-726.5kJ·mol -1 。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______________________________。
(3)在容积为2L的密闭容器中,由CO 2 和H 2 合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T 1 、T 2 均大于300℃);下列说法正确的是________(填序号)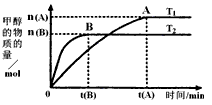
①温度为T 1 时,从反应开始到平衡,生成甲醇的平均速率为v(CH 3 OH)=  mol·L -1 ·min -1
mol·L -1 ·min -1
②该反应在T 1 时的平衡常数比T 2 时的小
③该反应为放热反应
④处于A点的反应体系从T 1 变到T 2 ,达到平衡时 增大
增大
(4)在T 1 温度时,将1molCO 2 和3molH 2 充入一密闭恒容器中,充分反应达到平衡后,若CO 2 转化率为a,则容器内的压强与起始压强之比为__________;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为____________________________、正极的反应式为________________________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比) 红日茜菲儿1年前1
红日茜菲儿1年前1 -
 tim8943 共回答了25个问题
tim8943 共回答了25个问题 |采纳率96%1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.已知H2(
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ•g-1、10kJ•g-1和23kJ•g-1.请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_______;
(2)在直接以甲醇为燃料电池中,电解质溶液为碱性,负极的反应式为______,总反应式______.
(3)在350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒容器中,充分反应生成甲醇蒸汽和水蒸气达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,充分反应达到平衡后,若CO2转化率为b,则a______b(用“>、=、<”表示) jou81231年前1
jou81231年前1 -
 huerguai 共回答了18个问题
huerguai 共回答了18个问题 |采纳率100%解题思路:(1)依据物质的热值计算燃烧热,根据热化学方程式书写方法和注意问题标注物质聚集状态和对应焓变;
(2)甲醇燃料电池,燃料在负极失电子发生氧化反应,正极上是氧气得电子的还原反应,总反应是燃料燃烧的方程式;
(3)根据化学平衡的三段法计算平衡时各物质的物质的量,再利用反应前后气体的物质的量之比等于压强之比来计算压强之比;根据压强对平衡移动的影响来确定平衡的移动方向.(1)CO(g)和CH3OH(l)的热值分别为10kJ•g-1和23kJ•g-1,即由CO(g)和CH3OH(l)的燃烧热△H分别为-280.0kJ•mol-1和-736kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-280.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-736kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-736kJ•mol-1-(-280.0kJ•mol-1)=-456kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-456kJ•mol-1;
(2)直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:2CH3OH+3O2+4OH-═2CO32-+6H2O,甲醇燃料电池,燃料在负极失电子发生氧化反应,负极的反应式为:CH3OH-6e-+8OH-═CO32-+6H2O,故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;2CH3OH+3O2+4OH-═2CO32-+6H2O;
(3)由化学平衡的三段模式法计算可知,
CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)
起始1300
变化a3 aaa
平衡 1-a3-3aaa
根据相同条件下气体的压强之比等于物质的量之比,
则容器内的压强与起始压强之比为[1−a+3−3a+a+a/1+3]=[2−a/2],若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,由于反应中气体的物质的量
是减小的,所以恒压相当于在恒容的基础上加大压强,平衡会正向移动,CO2转化率会增大,即a<b.
故答案为:[2−a/2];<.点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了热化学方程式的书写和盖斯定律的应用、化学平衡的计算、原电池电极反应书写方法等知识,题目难度中等.1年前查看全部
大家在问
- 1请问这个西班牙语单词是什么意思?
- 2江湖救急 函数已知直线y=kx+b在平行于直线y=-3x+4,且与直线y=2x-6的交点在x轴上,求此一次函数的解析式已
- 3以‘’My home town ‘’广东,为题写一篇英语短文。
- 4一道初二的因式分解题x的三次方+6x的平方+11x+6因式分解
- 5填量词.一( )硝烟 一( )泪珠 一(
- 6《十六年前的回忆》中从“他脸上的表情非常安定,非常沉着”体会的父亲是一个【】的人.
- 7把一块石头放入一个盛满水的容器里后,容器里溢出的水刚好倒满一个长4分米,宽3.高2分米的容器.石头的体积是多少?
- 8一种摩托车原价每辆5500元,加价20%后又降价20%,现在每辆售价是多少元?
- 9为什么要倒香槟吗?香槟寓意着什么吗?
- 10生态公园计划在园内造一片有A、B两种树的混合林,需要购买这两种树苗2000株.A树苗的存活率为95%,B树苗的存活率为9
- 11有一块正方体的木料,它的棱长是4分米.如果把这块木料加工成一个最大的圆柱,那么这个圆柱的体积大约是
- 12六个字以上不超过十一个字的句子.
- 13选词填空(宽阔,宽广)1,(——)的马路上人来人往,热闹非凡.2,来到草原,每个人都会被眼前这一片(——)的草原迷住.
- 14"去年年底公司的出货量创造了历史最好纪录”用英语怎么说呢?
- 15以奇异的草为题,写一篇50字的作文.急死我了!