氧化铜和木炭的混合物在加热条件下恰好完全反应固体物质质量减少了22g原混合物中氧化铜和木炭粉各多少克?
 哈悠兜兜2022-10-04 11:39:542条回答
哈悠兜兜2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 xiaoyu502004 共回答了19个问题
xiaoyu502004 共回答了19个问题 |采纳率89.5%- 固体物质减少了22.0g
说明生成22.0gCO2
反应方程式为:
C+2CuO=高温=2Cu+CO2
12 160 44
x y 22g
12/x=160/y=44/22g
x=6g
y=80g
原混合物中氧化铜80g
木炭粉6g
满意请采纳
谢谢 - 1年前
 wangjy1387 共回答了13个问题
wangjy1387 共回答了13个问题 |采纳率- 这是反应方程式:C+2CuO=2Cu+CO2
固体减少的质量就是放出二氧化碳的质量。22g的二氧化碳的物质的量为0.5mol。所以反应物中碳的物质的量也是0.5mol,即6g,根据反应方程式,氧化铜的物质的量应为1mol,即79.5g。 - 1年前
相关推荐
- 如何去除铜中的氧化铜
 lm6o1年前2
lm6o1年前2 -
 cinderella的泪 共回答了25个问题
cinderella的泪 共回答了25个问题 |采纳率84%通氢气或一氧化碳1年前查看全部
- 根据要求写化学方程式.木炭还原氧化铜.电解水 实验室中加热分解高锰
根据要求写化学方程式.木炭还原氧化铜.电解水 实验室中加热分解高锰
根据要求写化学方程式.木炭还原氧化铜.电解水 实验室中加热分解高锰酸 陪陪自己1年前1
陪陪自己1年前1 -
 Melonxiang 共回答了20个问题
Melonxiang 共回答了20个问题 |采纳率90%C+2CuO=2Cu+CO2 (反应条件是加热)
2H2O=通电=2H2↑+O2↑
2KMnO4 ==加热== K2MnO4 + MnO2 + O2↑1年前查看全部
- (2003•哈尔滨)炭粉中混有少量的氧化铜,为了除去氧化铜得到纯净的炭粉,可采取的措施是( )
(2003•哈尔滨)炭粉中混有少量的氧化铜,为了除去氧化铜得到纯净的炭粉,可采取的措施是( )
A.直接高温加热
B.加入稀硫酸并微热后过滤、干燥
C.在二氧化碳气流中高温灼烧
D.通入一氧化碳并加热 皖A一条狼1年前1
皖A一条狼1年前1 -
 super_lxh 共回答了20个问题
super_lxh 共回答了20个问题 |采纳率85%解题思路:除去炭粉中的氧化铜,要根据炭粉和氧化铜的性质,选择一种能与氧化铜反应而不与碳反应的试剂,反应后炭粉的质量不能减少,不能带入新的杂质,操作尽量要简便.A、碳和氧化铜在高温下会发生反应生成铜和二氧化碳,炭粉的质量会减少,此项错误;
B、氧化铜能溶于稀硫酸,炭粉和稀硫酸不反应,过滤、干燥后能得到纯净的炭粉,方法正确;
C、在高温下炭粉会与氧化铜、二氧化碳都发生反应,会使炭粉的质量减少,方法错误;
D、在加热条件下炭粉会与氧化铜反应,会使炭粉的质量减少,一氧化碳虽然能还原氧化铜,但生成的铜还是不能和炭粉分离,故方法错误.
故选B.点评:
本题考点: 物质除杂或净化的探究.
考点点评: 物质除杂时要注意可以将杂质转化为主要成分,也可以将之直接除去.选最简单易行的方法,后期要便于分离和净化.1年前查看全部
- 使H2和CO的混合气体3.2g与足量灼热的氧化铜充分反应,将所得气体充分干燥;使干燥后的气体全部通入过量的澄清石灰水中,
使H2和CO的混合气体3.2g与足量灼热的氧化铜充分反应,将所得气体充分干燥;使干燥后的气体全部通入过量的澄清石灰水中,测得最终所得溶液的质量比原澄清石灰水的质量减少5.6g,则原混合气体中H2和CO的质量比为( )
A. 1:7
B. 7:1
C. 1:3
D. 1:2 小鱼儿酷风1年前1
小鱼儿酷风1年前1 -
 打狗贼 共回答了20个问题
打狗贼 共回答了20个问题 |采纳率95%解题思路:先分析发生的反应,根据信息共有两个反应,即氢气与氧化铜反应生成铜和水,一氧化碳与氧化铜反应生成二氧化碳,根据最终所得溶液的质量比原澄清石灰水的质量减少5.6g,判断生成的二氧化碳的质量,根据二氧化碳的质量求混合气体中的一氧化碳质量,再进一步求出氢气的质量.设一氧化碳与氧化铜反应生成二氧化碳的质量为X,消耗一氧化碳的质量为Y
Ca(OH)2+CO2═CaCO3↓+H2O 溶液减少质量
44100100-44=56
X 5.6g
[44/56=
X
5.6g] X=4.4g
CO+CuO
高温
.
Cu+CO2
28 44
Y 4.4g
[28/44=
Y
4.4g] Y=2.8g
混合气体中氢气的质量为3.2g-2.8g=0.4g,则原混合气体中H2和CO的质量比为0.4g:2.8g=1:7.
故选A.点评:
本题考点: 常见化学反应中的质量关系;物质组成的综合计算;根据化学反应方程式的计算.
考点点评: 本题是一道较为复杂的化学方程式的计算题,理解所发生的反应,能正确分析数据代表的意义,问题可迎刃而解.1年前查看全部
- 氨与灼热的氧化铜反应的化学方程式怎么写?
 lj199981年前1
lj199981年前1 -
 夜lolita 共回答了19个问题
夜lolita 共回答了19个问题 |采纳率94.7%nh3 + cuo = cu + h2o + n21年前查看全部
- 如图所示,用氢气还原w mol氧化铜,实验中当看到大部分黑色固体变成光亮的红色时,停止加热.共消耗x
如图所示,用氢气还原w mol氧化铜,实验中当看到大部分黑色固体变成光亮的红色时,停止加热.共消耗x mol氢气,生成y mol水和z mol铜.下列说法正确的是( )

A. 反应后玻璃管内固体质量为64zg
B. 反应前后玻璃管内固体的质量之差是16wg
C. 玻璃管中固体减少的质量就是N装置中固体增加的质量
D. z=y<x gentlemanxw1年前1
gentlemanxw1年前1 -
 kk城 共回答了7个问题
kk城 共回答了7个问题 |采纳率71.4%解题思路:根据题干信息“大部分黑色固体变成光亮的红色时”可看出氧化铜没有全部参与反应,这是解题的关键.由题意可知:
(1)反应后剩余固体为CuO和Cu.
(2)反应前后固体变化CuO→Cu,固体质量减少量就是参加反应的CuO中氧元素的质量.
(3)干燥管内的物质可以吸收空气的二氧化碳.反应的化学方程式为:H2+CuO
加热
.
Cu+H2O
A、由于大部分黑色固体变成光亮的红色,知氧化铜没有全部参与反应,所以管内固体质量为生成的Cu的质量64Z和剩余的氧化铜的质量,所以A错误.
B、固体减少的质量为氧元素的质量(CuO→Cu),即16Z (因为氧化铜没有全部参加反应,所以W不等于Z),所以B错误.
C、固体减少质量为16Z 而不是N装置中的吸收水的质量,同时干燥管内的物质还要吸收空气的物质,所以C错误.
D、根据反应方程式可知,生成的铜和水的物质的量相等,所以Y=Z;但是由于氢气还原氧化铜实验开始和结束都要通入大量氢气,并没有完全参与反应,有部分被排出,所以X>Z,所以D正确.
故选D点评:
本题考点: 碳、一氧化碳、氢气还原氧化铜实验;根据化学反应方程式的计算.
考点点评: 在解答有关氢气还原氧化铜的实验的计算题时,要分清氢气的消耗量的叙述,一般有两种:一是反应掉的氢气为多少,一种是实验中需要通入氢气多少,后者要考虑实验实际.1年前查看全部
- 要除去碳粉中的氧化铜加适量盐酸搅拌过滤可以吗?如不行怎么半
 chen51chen1年前3
chen51chen1年前3 -
 jh8779 共回答了17个问题
jh8779 共回答了17个问题 |采纳率88.2%可以.
C不与盐酸反应,CuO+2HCl=CuCl2+H2O反应生成的CuCl2溶于水,过滤即可.1年前查看全部
- 把H2通入装有50g氧化铜的试管中发生反应,反应一段时间后,称量试管中剩余物质的质量46.8g.
把H2通入装有50g氧化铜的试管中发生反应,反应一段时间后,称量试管中剩余物质的质量46.8g.
求发生反应的氧化铜的质量为多少 showhlx1年前1
showhlx1年前1 -
 fengliguantou 共回答了14个问题
fengliguantou 共回答了14个问题 |采纳率85.7%CuO + H2 ==Cu + H2O △m
80 16
x 50-46.8
x=16g
∴发生反应的氧化铜的质量为16g
❤您的问题已经被解答~(>^ω^1年前查看全部
- 用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实
用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验.
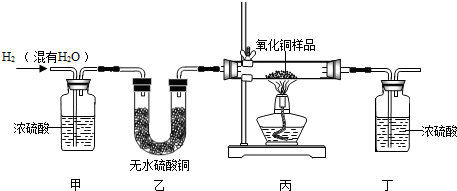
【查阅资料】①无水硫酸铜为白色固体,遇水变成蓝色。
②浓硫酸具有吸水性,可做干燥剂。
请根据资料回答:
(1)在实验中,乙装置的作用是 .
(2)准确称取完全反应前后装置丙和丁的质量如表:
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度(写出计算过程).装置丙 装置丁 反应前 48.8克 161.2克 反应后 46.5克 163.9克
(3)小明根据装置丙的质量变化计算,发现小丽结果偏大。请分析导致这一结果的原因可能是 .
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.氧化铜没有完全被还原 qrambk1年前1
qrambk1年前1 -
 小添2000 共回答了24个问题
小添2000 共回答了24个问题 |采纳率95.8%(1)检验氢气中水分是否全部被吸收 (2)80% (3) B
1年前查看全部
- 氧化亚铜潮湿空气中氧化成氧化铜方程式?
 yehong1111年前1
yehong1111年前1 -
 猫尜尜 共回答了22个问题
猫尜尜 共回答了22个问题 |采纳率95.5%2Cu2O+O2=4CuO1年前查看全部
- 化学.以氧化铜制作硫酸铜的问题.
化学.以氧化铜制作硫酸铜的问题.
以氧化铜和稀硫酸为原料制作500克硫酸铜.问题1.需要多少克氧化铜?问题2.需要浓度为多少的稀硫酸?(请具体说明如何配比.)问题3.具体操作步骤?请高手解答.谢谢.
那制作500克硫酸铜就需要20升水和100~120毫升浓硫酸吗? amwqlwjf1年前2
amwqlwjf1年前2 -
 bigtou8 共回答了13个问题
bigtou8 共回答了13个问题 |采纳率100%1、n(CuSO4)==500/160=3.125mol 根据铜守恒得n(CuO)==3.125mol==250g 2、硫酸的浓度没有要求的,一般用是0.1mol/L的,大概是一升水中加入5~6mL的市售浓硫酸 3、操作步骤:在大烧杯中用稀硫酸溶解氧化铜,再用坩埚蒸干溶液,就能得到硫酸铜晶体(蒸干的时间可以长一点,可以去除硫酸铜晶体中的结晶水,切不可用铁制容器代替坩埚,因为铜离子与铁发生置换反应)1年前查看全部
- 木炭还原氧化铜中黑色固体和稀硫酸反应生成蓝色溶液,黑色固体是什么?
 kssq1年前6
kssq1年前6 -
 mghelei 共回答了19个问题
mghelei 共回答了19个问题 |采纳率89.5%C+2CuO=高温=2Cu+CO2
反应物中黑色粉末是碳和氧化铜,反应一段时间后黑色粉末有三种可能:加入硫酸后1、全部溶解变成蓝色溶液,黑色固体是氧化铜;2、全部不溶,黑色固体是碳;3、黑固部分溶解、溶液变蓝,此时黑色固体既有氧化铜,也有碳.1年前查看全部
- 木碳还原氧化铜的反应是不是吸热反应
 游客6171年前1
游客6171年前1 -
 倾ww之美 共回答了17个问题
倾ww之美 共回答了17个问题 |采纳率88.2%这个化学反应是放热的,它刚开始是需要加热那是为了达到反应所需的温度之后就不用再加热了!1年前查看全部
- 实验装置如图,B中的固体物质可能是碳酸钙或锌或两者的混合物,D中的黑色粉末可能是炭粉或氧化铜或两者的混合物,向A中加入稀
实验装置如图,B中的固体物质可能是碳酸钙或锌或两者的混合物,D中的黑色粉末可能是炭粉或氧化铜或两者的混合物,向A中加入稀盐酸,点燃酒精灯(或对D加强热),根据实验现象回答:

(1)如果G中出现白色浑浊,H处导出的气体不可燃,U型管中的白色硫酸铜无明显现象,则在B中反应的方程式______,D中放入的粉末是______.
(2)如果U型管中的无水硫酸铜变为蓝色,G中的石灰水仍澄清,H处导出的气体可以点燃,则B中反应的方程式______,D中放入的粉末是______.
(3)如果U型管中的无水硫酸铜变为蓝色,G中的石灰水变浑浊,H处导出的气体可以点燃,则B和D中的固体物质分别可能是:(有几种填几种,可以不填满)
B中①______,D中①______
B中②______,D中②______
B中③______,D中③______. 加3分1年前1
加3分1年前1 -
 clppcb 共回答了22个问题
clppcb 共回答了22个问题 |采纳率95.5%解题思路:(1)根据G中出现白色浑浊,H处导出的气体不可燃,U型管中的白色硫酸铜无明显现象,可知产物有二氧化碳,没有可燃性气体及水的产生进行分析;
(2)根据U型管中的无水硫酸铜变为蓝色,G中的石灰水仍澄清,H处导出的气体可以点燃,可知有水和可燃性气体的产生,没有二氧化碳的产生进行解答;
(3)根据U型管中的无水硫酸铜变为蓝色,G中的石灰水变浑浊,H处导出的气体可以点燃,说明有水、二氧化碳和可燃性气体的产生进行解答.(1)实验现象G中出现白色浑浊,说明有二氧化碳生成;U型管中的白色硫酸铜无明显现象,H处导出的气体不可燃,说明没有水生成,即没有氢气,装置B中盛放的固体物质应是碳酸钙,而没有金属锌,反应的方程式为:2HCl+CaCO3=CaCl2+CO2↑+H2O;装置D玻璃管内盛放的黑色粉末是氧化铜;
(2)装置G中的石灰水仍澄清可知没有二氧化碳生成;U型管中的无水硫酸铜变为蓝色,说明有水的生成,因而有氢气产生,因而装置B盛放的固体物质是锌,其中发生反应的化学方程式是:2HCl+Zn=ZnCl2+H2↑;装置D玻璃管内盛放的黑色粉末是氧化铜;
(3)U型管中的无水硫酸铜变为蓝色,说明有水生成,则水是氢气和氧化铜反应生成的,说明装置B中一定含有锌,装置D玻璃管内一定含有氧化铜;G中的石灰水变浑浊,可能是碳酸钙和盐酸反应产生的,也可能是碳和氧化铜反应产生的;因此,若B中没有碳酸钙,则D中一定含有碳;若B中含有碳酸钙,则D中可能含有碳;故可能的组合是:①Zn;CuO、C;②Zn、CaCO3;CuO;③Zn、CaCO3;CuO、C.
故答案为:(1)2HCl+CaCO3=CaCl2+CO2↑+H2O; 氧化铜;
(2)2HCl+Zn=ZnCl2+H2↑; 氧化铜;
(3)①Zn;CuO、C;②Zn、CaCO3;CuO;③Zn、CaCO3;CuO、C.点评:
本题考点: 物质的鉴别、推断;酸的化学性质;碳的化学性质;书写化学方程式、文字表达式、电离方程式;氢气的化学性质与燃烧实验.
考点点评: 此题是一道实验探究综合题,解题的关键是对根据实验的现象及实验目的原理结合物质的性质据此分析,得出结论,难度较大.1年前查看全部
- 描述下列实验中观察到的现象并书写有关反应的化学方程式:在盛有少量新制备的氧化铜的试管里,加少量稀硫酸.
 上vv古剑1年前1
上vv古剑1年前1 -
 小子各足处 共回答了21个问题
小子各足处 共回答了21个问题 |采纳率90.5%CuO+2HCl=CuCl2+H2O(=后的2为角码)黑色粉末逐渐消失,溶液显淡蓝色.1年前查看全部
- (2011年浙江丽水,37题)氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中单质铜含
(2011年浙江丽水,37题)氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中单质铜含量进行测定,三组同学各取10克粉末样品置于烧杯中,然后加入不同质量的稀硫酸,充分反应后,对烧杯中剩余固体进行称量,实验数据记录如下:
组别编号 样品质量(克) 加入稀硫酸质量(克) 剩余固体质量(克) 1 10 20 8.4 2 10 30 8 3 10 40 8
(1)分析表中数据可知,第2组实验中的剩余固体是 。(写出物质名称或符号)
(2)样品中单质铜的质量分数为 。
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程) xinlong12171年前0
xinlong12171年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列
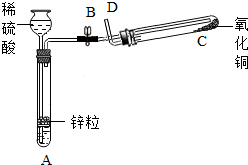 某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:
某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:
(1)实验时,打开B处止水夹,在试管A中,除了液面上升以外,用眼睛还可以观察到的现象是______,过一段时间后,用手触摸试管A的外壁可以感觉到的现象是______,试管A中发生反应的化学方程式为______,其反应类型为______.
(2)在做氢气还原氧化铜实验之前,必须在D出口处______,然后在______处点燃酒精灯加热;实验过程中,在试管C中可以观察到的现象是______;发生反应的化学方程式为H2+CuO
Cu+H2O△ .H2+CuO;实验结束时,______关闭B处止水夹,______停止加热(填“先”或“后”).
Cu+H2O△ .
(3)实验过程中,该同学若想证明氢气具有可燃性,其实验操作是______. 日白小ss1年前1
日白小ss1年前1 -
 飞羽79 共回答了20个问题
飞羽79 共回答了20个问题 |采纳率90%解题思路:(1)根据锌粒和稀硫酸反应的现象、反应原理、反应特点进行解答;
(2)根据氢气还原氧化铜的操作步骤和注意事项及反应原理分析解答;
(3)根据装置特点进行分析.(1)锌粒和稀硫酸反应生成硫酸锌和氢气,放出热量,方程式是Zn+H2SO4═ZnSO4+H2↑,该反应由一种单质和一种化合物生成另一种单质和化合物,属于置换反应;故答案为:有气泡冒出; 发热; Zn+H2SO4═ZnSO4...
点评:
本题考点: 氢气的制取和检验;碳、一氧化碳、氢气还原氧化铜实验;书写化学方程式、文字表达式、电离方程式;氢气的化学性质与燃烧实验.
考点点评: 本题对氢气的制取和性质进行了细致的考查,解题时要根据相关知识并结合实验装置细心分析,才能正确解答.1年前查看全部
- 做H2还原氧化铜的实验时,要使80克氧化铜全部还原为铜,需要通入H2质量为A大于2克 B小于2克
 l50130641年前3
l50130641年前3 -
 liujingzheng1986 共回答了21个问题
liujingzheng1986 共回答了21个问题 |采纳率90.5%A大于2克
实验开始要先通氢气,排净空气才能加热.
实验结束要继续通氢气,直到冷却,防止生成的铜又被氧化.这两部分氢气都没有参与反应,所以要大于2克的氢气1年前查看全部
- 若用八克氧化铜与足量一氧化碳反应能制得铜的质量为多少
 ssdfg1年前0
ssdfg1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2006•杨浦区二模)采用两种方法制取铜,现有锌、氧化铜、稀硫酸三种物质及下列实验装置供选择.
(2006•杨浦区二模)采用两种方法制取铜,现有锌、氧化铜、稀硫酸三种物质及下列实验装置供选择.
(1)第一种方法的实验过程中有蓝色溶液产生,应选用下面装置中的______,写出此现象的化学方程式______.
(2)第二种方法应选用下面装置中的______和 D.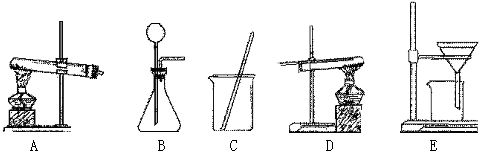
(3)在第二种方法制取的铜中,可能存在的黑色杂质是______.
(4)在以上两个设计方法中,你认为第______种方法操作更合理、更简便. glay19821年前1
glay19821年前1 -
 icyicy 共回答了15个问题
icyicy 共回答了15个问题 |采纳率100%解题思路:根据锌、氧化铜、稀硫酸三种物质之间的反应规律分析解答,氧化铜能与稀硫酸反应生成硫酸铜,锌能置换硫酸铜溶液中的铜;锌能与稀硫酸反应生成氢气,氢气能置换氧化铜中的铜.(1)用锌、氧化铜、稀硫酸三种物质制取铜,实验过程中有蓝色溶液产生,因此方法是将氧化铜与硫酸反应生成硫酸铜,然后将锌粒与硫酸铜反应置换出铜,采用过滤法即可得到铜.故选用的装置应为CE;化学方程式为
CuO+H2SO4=CuSO4+H2O
(2)第二种方法用到装置D氢气还原氧化铜,因此实验方案是用锌粒与稀硫酸反应生成氢气,氢气再还原氧化铜得到金属铜,因此用到的装置还有B,固液常温下制取气体的装置;
(3)用氢气还原氧化铜的方法制取时可能由于氧化铜未完全反应而留在反应后的固体中,故答案为氧化铜;
(4)以上两个方法中,第1种方法操作更合理,简便,得到的铜不含有杂质.
故答案为:(1)CECuO+H2SO4=CuSO4+H2O用HCl和HNO3都可以
(2)B(3)CuO(4)1点评:
本题考点: 物质的相互转化和制备;金属的化学性质;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 明确单质、氧化物、酸碱盐之间的反应规律是解答制备物质题的关健1年前查看全部
- 某同学收集了班级其他同学做的“氢气还原氧化铜“的实验后的固体残渣(含铜和氧化铜),欲从中回收单质铜和制取硫酸铜溶液,他设
某同学收集了班级其他同学做的“氢气还原氧化铜“的实验后的固体残渣(含铜和氧化铜),欲从中回收单质铜和制取硫酸铜溶液,他设计了如下实验方案:
(1)称量.称量收集到的固体残渣20g,需要的仪器名称是______.
(2)溶解.将20g称量好的固体残渣放入烧杯中,加入过量的稀硫酸溶液,用玻璃棒不断搅拌,直至反应完全.烧杯中发生反应的化学方程式为______
(3)过滤.除滤纸外,还需要从下图中选用哪些仪器______(填字母).
(4)洗涤干燥.洗净滤纸上的固体,干燥后称量,此固体名称为______.
(5)收集滤液.滤液中所含溶质的化学式是______
(6)分析.为了除去滤液中过量的硫酸,应往滤液中加入过量的下列______(填编号)固体粉末,过滤.
①氧化铜②氢氧化钠③铁④硫酸铜
判断固体过量的实验现象是______. tiger_lisa1年前1
tiger_lisa1年前1 -
 鬼爷 共回答了12个问题
鬼爷 共回答了12个问题 |采纳率100%(1)称量固体使用的仪器是托盘天平,所以本题答案为:托盘天平;
(2)氧化铜能与硫酸反应生成硫酸铜和水,所以本题答案为:CuO+H 2 SO 4 ═CuSO 4 +H 2 O;
(3)过滤所用的仪器有漏斗、烧杯、玻璃棒和铁架台,所以本题答案为:A,C,E,F;
(4)铜不与硫酸反应,过滤后留在滤纸上,所以本题答案为:铜;
(5)硫酸过量,故滤液中含有硫酸和生成的硫酸铜,所以本题答案为:H 2 SO 4 和CuSO 4 ;
(6)要除去滤液中的硫酸,不能引入新的杂质,选用氧化铜比较合适,当硫酸全部参加反应时,加入的氧化铜不再溶解,有固体剩余,所以本题答案为:①,有固体不溶解.1年前查看全部
- 氧化铜和铜混合物20克加热使其与足量一氧化碳充分反应后气体全通足澄清石灰水中得白色沉淀10克原混合物铜
氧化铜和铜混合物20克加热使其与足量一氧化碳充分反应后气体全通足澄清石灰水中得白色沉淀10克原混合物铜
你能详细点给我说说吗?氧化铜和铜混合物20克加热使其与足量一氧化碳充分反应后气体全通足澄清石灰水中得白色沉淀10克原混合物铜的质量 sk171131年前3
sk171131年前3 -
 SHADOUDOUO66 共回答了20个问题
SHADOUDOUO66 共回答了20个问题 |采纳率90%CO2+ Ca(OH)2 == CaCO3 + H2O
44 100 质量数
可求出 CO2 质量为 4.4g
CuO + CO == Cu + CO2
80 44 质量数
可求出 CuO质量为 8g
所以Cu 是12g
初学化学的话这个方法挺好用1年前查看全部
- 在一大试管中加热5克氧化铜和木炭的混合物,充分反应后冷却,在试管中的固体产物中得到单质铜3.2克.问:
在一大试管中加热5克氧化铜和木炭的混合物,充分反应后冷却,在试管中的固体产物中得到单质铜3.2克.问:
(1)若在反应后的固体产物中加入稀硫酸,溶液变成蓝色,说明哪种物质过量?并求原混合物中氧化铜和木炭各占多少克?
(2)5克氧化铜和木炭的混合物按照怎样的比例混合加热,得到的单质铜质量最多? qoop1年前2
qoop1年前2 -
 yishiyoufeng 共回答了20个问题
yishiyoufeng 共回答了20个问题 |采纳率95%给你个思路,自己计算.
1.加入稀硫酸,溶液变成蓝色.说明氧化铜过量,只有氧化铜可以与稀硫酸反映生成硫酸铜蓝色溶液.通过3.2克单质铜,你可以直接知道木炭一共有多少.5克减去木炭的质量,就是氧化铜的质量.反应方程式:C + CuO = CO + Cu 都是1:1的反应,应该很好算.
2.这个就更简单了,既然是1:1的反应,就按照他们的摩尔质量来比.12克碳和79.54克氧化铜这个比例.所以碳的比例就是5 X 12/(12+79.5),氧化铜就是5减去碳的质量
你自己亲自算算吧,这样印象更深刻.但是解题思路我都给你写清楚了.1年前查看全部
- 将氢气通过盛有12g氧化铜的玻璃管中,并加热一段时间后,冷却、称重,剩余固体的质量为10g.
将氢气通过盛有12g氧化铜的玻璃管中,并加热一段时间后,冷却、称重,剩余固体的质量为10g.
试求参加反应的氧化铜的质量. 吃饭看花1年前3
吃饭看花1年前3 -
 邵明化 共回答了20个问题
邵明化 共回答了20个问题 |采纳率90%设参加反应的氧化铜的质量为X
H2 + CuO =△= Cu + H2O△m增加质量
80 64 80-64=16
X 12g-10g=2g
80g:16=X:2g
X=10g
希望我的回答能对你的学习有帮助!1年前查看全部
- 气体M是由氢气,一氧化碳,二氧化碳,稀盐酸四种气体混合而成,将M依次通过氢氧化钠溶液,灼热的氧化铜,
 夫卞霸唱1年前4
夫卞霸唱1年前4 -
 afwew64 共回答了14个问题
afwew64 共回答了14个问题 |采纳率85.7%楼上的第一步说错了吧,不能吸收二氧化碳 氢氧化钠如果先和二氧化碳反映生成碳酸钠 稀盐酸照样反映掉碳酸钠生成二氧化碳 所以第一步氢氧化钠只能中和稀盐酸(氢氧化钠过量除外),之后还剩3中气体 氢气和一氧化碳与氧化同反映 生成二氧化碳与水蒸气1年前查看全部
- 将木炭和氧化铜的粉末混合物30g,加热一段时间后冷却,称得剩余固体25.6g
将木炭和氧化铜的粉末混合物30g,加热一段时间后冷却,称得剩余固体25.6g
生成了多少克CO2?
生成了多少克Cu?
有多少克氧化铜参加了反应? hummerbaby1年前2
hummerbaby1年前2 -
 依依0289 共回答了14个问题
依依0289 共回答了14个问题 |采纳率100%CO2:30-25.6=4.4
根据2化学方程式算出Cu,CuO,就可以了啊.1年前查看全部
- 氨气通过灼热的氧化铜有什么现象产生.检验生成的N2的方法和现象是什么.
 lilin0911251年前1
lilin0911251年前1 -
 杭州嘉木 共回答了15个问题
杭州嘉木 共回答了15个问题 |采纳率93.3%2NH3+3CuO=N2+3H2O+3Cu
在这个系统里N2的检验方法可以先通过热的NaOH溶液,(因为体系中还可能生成其他氮氧化物),再用排水法收集(NH3溶解),置于空气中不变红就是N2 .1年前查看全部
- 甲醛与氧化铜能反应吗不是氢氧化铜在加热条件下与氧化铜粉反应,化学方程式是什么?以及条件。
 海边螃蟹1年前3
海边螃蟹1年前3 -
 漂浮的狼 共回答了20个问题
漂浮的狼 共回答了20个问题 |采纳率80%可以,反应后生成甲酸和铜1年前查看全部
- 氧化铜和碳反应方程式
 whiskeyfly1年前1
whiskeyfly1年前1 -
 轻描淡写xx 共回答了18个问题
轻描淡写xx 共回答了18个问题 |采纳率83.3%C+2CuO=高温=2Cu+CO2↑(还原反应)1年前查看全部
- 李老师在指导学生记忆化学方程式时指出很多反应可以归纳,如:氧化铜、氢氧化铜、碳酸铜等与硫酸反应时生成物中都含有硫酸铜和水
李老师在指导学生记忆化学方程式时指出很多反应可以归纳,如:氧化铜、氢氧化铜、碳酸铜等与硫酸反应时生成物中都含有硫酸铜和水.同学们兴趣很高,也进行了归纳:

(1)甲物质与盐酸反应时生成物中有NaCl和H20,甲物质可以是______和______(请填两种不同类别物质的化学式);上述转化过程中,属于中和反应的化学方程式是______.
(2)A、B、C、D、E都是初中化学常见的物质,其中D是一种紫红色金属单质,它们之间的转化关系如图所示,反应条件均已略去.图中E的化学式是______;若A是化合物,反应A+B→C+D的化学方程式是______. 回眸31笑1年前1
回眸31笑1年前1 -
 无望的干鱼片 共回答了25个问题
无望的干鱼片 共回答了25个问题 |采纳率84%解题思路:(1)根据盐酸的化学性质解答;
(2)根据题干提供的信息,找准解题的突破口,直接得出物质的化学式,然后代入图框中验证;(1)盐酸与NaOH或Na2CO3反应都可生成NaCl和H20,盐酸和氢氧化钠反应是中和反应,反应的化学方程式为:NaOH+HCl═NaCl+H2O;故答案为:NaOH;Na2CO3;NaOH+HCl═NaCl+H2O;
(2)D是一种紫红色金属单质,可猜测为铜单质,有铜生成的反应可以是一些氧化还原反应,如一氧化碳还原氧化铜,A是一氧化碳,C是二氧化碳,一氧化碳与氧气反应可以生成二氧化碳,故答案为:O2;CO+CuO
△
.
Cu+CO2点评:
本题考点: 酸的化学性质;物质的鉴别、推断.
考点点评: 本题为框图式物质推断题,完成此题,关键是找准解题突破口,直接得出有关物质的化学式,然后顺推或逆推或由两边向中间推得出其他物质的化学式.1年前查看全部
- 在实验室里用一氧化碳还原氧化铜制取铜并生成二氧化碳.若制取3.2g铜,需要氧化铜的质量是多少?
 深海孤帆3211年前2
深海孤帆3211年前2 -
 oo拂尘 共回答了16个问题
oo拂尘 共回答了16个问题 |采纳率81.3%解题思路:正确书写化学反应反应方程式,根据化学反应方程式的计算步骤和格式,依据制得铜的质量,进行分析解答本题.设需要氧化铜的质量为x;
CO+CuO
△
.
Cu+CO2
8064
x3.2g
[80/x=
64
3.2g]
解得:x=4g
答:需要氧化铜的质量为4g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查学生根据化学反应方程式进行计算的解题能力,必须掌握正确的计算步骤和格式.1年前查看全部
- 把一定量的稀硫酸倒入盛有氧化铜和过量的铁粉的是试管微热,静置片刻后过滤,滤纸上留下的物质一定有———
把一定量的稀硫酸倒入盛有氧化铜和过量的铁粉的是试管微热,静置片刻后过滤,滤纸上留下的物质一定有———
滤纸上可能有的物质是———,滤液中留有溶质的是—————— 长一下1年前2
长一下1年前2 -
 homepeng 共回答了17个问题
homepeng 共回答了17个问题 |采纳率94.1%滤纸上可能有的物质是Cu 和Fe
滤液中留有溶质的是FeSO41年前查看全部
- 某样品为铜和氧化铜混合物为测定样品中氧化铜质量分数,称10克样品在空气中充分加热直至固体质量不再变化
某样品为铜和氧化铜混合物为测定样品中氧化铜质量分数,称10克样品在空气中充分加热直至固体质量不再变化
冷却后称量反应后固体质量为11.6克
计算样品中氧化铜的质量分数? lijinxing20021年前1
lijinxing20021年前1 -
 宁波圣豹行者无疆 共回答了22个问题
宁波圣豹行者无疆 共回答了22个问题 |采纳率81.8%铜和氧气高温生成氧化铜,增加的1.6g质量也就是原来铜的质量10g-1.6g就是样品中氧化铜的质量,再除10就能算出质量分数了Cu + O2 = CuO2
56 88
10-X 11.6-X
56(11.6-X)=(10-X)88
x=7.21年前查看全部
- 向铁粉和氧化铜的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,向滤液中插入铁片,有气泡产生,则滤渣中一定含有____
向铁粉和氧化铜的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,向滤液中插入铁片,有气泡产生,则滤渣中一定含有______;氧化铜与稀硫酸反应的化学反应方程式为______.实验室用浓硫酸配制一定量的稀硫酸,正确操作是将______,并不断搅拌.  rosemarying1年前1
rosemarying1年前1 -
 baoyuhai 共回答了19个问题
baoyuhai 共回答了19个问题 |采纳率84.2%根据氧化铜与硫酸反应生成硫酸铜和水;铁与硫酸反应生成硫酸亚铁和氢气;由题目给出的信息可知:向滤液中插入薄铁片,有气泡产生,说明滤液中一定含有硫酸,没有硫酸铜;也说明铁把硫酸铜中的铜置换出来,因此固体中一定有铜,其中氧化铜和硫酸反应的方程式为CuO+H 2 SO 4 =CuSO 4 +H 2 O;浓硫酸溶于水会释放大量的热,可能会溅出伤人,所以用浓硫酸配制一定量的稀硫酸时,要把浓硫酸沿容器壁慢慢注入水中,并不断搅拌.
故答案为:铜;CuO+H 2 SO 4 =CuSO 4 +H 2 O;要把浓硫酸沿容器壁慢慢注入水中;1年前查看全部
- 把氧化铜和木炭粉的混合物30g,加热到高温,过一会停止加热,冷却后称量,混合物的质量减轻了4.4g,求有多
把氧化铜和木炭粉的混合物30g,加热到高温,过一会停止加热,冷却后称量,混合物的质量减轻了4.4g,求有多
少克氧化铜参加了反应? wdstar991年前1
wdstar991年前1 -
 lion021 共回答了27个问题
lion021 共回答了27个问题 |采纳率81.5%减少的质量是生成CO2的质量,4.4g.
设参加反应的氧化铜的质量是x.
2CuO+C=高温=2Cu+CO2↑
160 44
x 4.4g
160/x=44/4.4
x=16g
答:16g氧化铜参加了反应.1年前查看全部
- 将氧化铜和木炭粉(不含杂质)按一定质量比混合,充分研磨混合均匀后,称出10.0g置于试管中.在隔绝空气的情况下,对试管中
将氧化铜和木炭粉(不含杂质)按一定质量比混合,充分研磨混合均匀后,称出10.0g置于试管中.在隔绝空气的情况下,对试管中的混合物加热至高温.待充分反应后,冷却.称得试管中残余固体为7.8g.(不考虑高温下C与CO2的反应)试求:
①残余固体中铜是多少克?
②原混合物中氧化铜与木炭粉的质量比. havearest_ok1年前1
havearest_ok1年前1 -
 豆蔻乌骨鸡 共回答了17个问题
豆蔻乌骨鸡 共回答了17个问题 |采纳率76.5%解题思路:根据固体质量的减少量就是生成气体的质量,根据二氧化碳的质量算出生成的铜的质量,再根据二氧化碳的质量计算出参加反应的氧化铜和碳的质量,算出过量的物质质量,过量的物质可能是碳也可能是氧化铜,再进行分析.①根据质量守恒定律可知生成二氧化碳的质量为10g-7.8g=2.2g,设生成2.2g二氧化碳,参加反应的氧化铜质量为X,需要参加反应的碳的质量为Y,生成铜的质量为Z则:
2CuO+C
高温
.
2Cu+CO2↑
160 12 128 44
X Y Z 2.2g
根据:[160/44=
X
2.2g]解得X=8g,根据:[12/44=
Y
2.2g]解得Y=0.6g;根据:[128/44=
Z
2.2g]解得Z=6.4g;
所以残余固体中铜是6.4g,没有参加反应的固体质量为:7.8g-6.4g=1.4g,
②假设碳过量:碳为:0.6g+1.4g=2g,氧化铜质量为:8g,所以原混合物中氧化铜与木炭粉的质量比8g:2g=4:1;
假设氧化铜过量:氧化铜:8g+1.4g=9.4g,碳:0.6g,所以原混合物中氧化铜与木炭粉的质量比9.4g:0.6g=47:3.
故答案为:①6.4g;②4:1或47:3.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 解答本题容易出错的地方是氧化铜和碳过量问题,不要忽略到底是谁过量.1年前查看全部
- 碳与氧气的反应中具有什么性?木炭还原氧化铜的反应中被氧化的物质是什么?议论文的分论点是什么?
 zlf261261年前2
zlf261261年前2 -
 edmc 共回答了22个问题
edmc 共回答了22个问题 |采纳率90.9%还原性
木炭
支撑中心论点的小观点1年前查看全部
- 1木炭不充分燃烧2 一氧化碳燃烧 3甲烷燃烧4 酒精燃烧5碳和二氧化碳反应6碳还原氧化铜7碳还原氧化铁8氢气还原氧化铜9
1木炭不充分燃烧2 一氧化碳燃烧 3甲烷燃烧4 酒精燃烧5碳和二氧化碳反应6碳还原氧化铜7碳还原氧化铁8氢气还原氧化铜9工业煅烧石灰石10一氧化碳还原氧化铜 11加热铜粉 最好发图片谢谢
 qwteryeru1年前1
qwteryeru1年前1 -
 cqitic-solow 共回答了14个问题
cqitic-solow 共回答了14个问题 |采纳率92.9%1、2C+O2=2CO
2、2CO+O2=2CO2
3、CH4+2O2=CO2+2H2O
4、C2H5OH+3O2=2CO2+3H20
5、C+CO2=2CO
6、C+CUO=CO+CU;C+2CUO=CO2+2CU
7、3C+Fe2O3=3CO+2Fe;3C+2Fe2O3=2CO2+4Fe
8、H2+CUO=CU+H2O
9、CaCO3=CaO+CO2
10、CO+CUO=CU+CO2
11、2CU+O2=2CUO
我的答题到此结束,谢谢
希望我的答案对你有帮助1年前查看全部
- 以锌.稀硫酸.氧化铜制取铜的方案最简单的是
 捻花郎1年前1
捻花郎1年前1 -
 kemior 共回答了16个问题
kemior 共回答了16个问题 |采纳率87.5%CuO+H2SO4=CuSO4+H2O
Zn+CuSO4=ZnSO4+Cu1年前查看全部
- 将a克铜粉和木炭粉的混合物在空气中充分灼烧后,生成a克剩余物,求混合物中木炭粉和氧化铜质量
 11603656591033881年前3
11603656591033881年前3 -
 teachertan 共回答了12个问题
teachertan 共回答了12个问题 |采纳率91.7%生成CuO,得到的黑色物质与原混合物的质量相同,可知铜粉和木炭粉的质量=CuO的质量,所以混合物中铜与木炭的质量比=CuO中铜的质量:氧的质量=64:16=4:1.1年前查看全部
- 把氧化铜和铁粉的混合物放在一定量的稀硫酸中,反应停止后过滤除去不溶物,向滤液中加入一块薄铁片,观察不到
把氧化铜和铁粉的混合物放在一定量的稀硫酸中,反应停止后过滤除去不溶物,向滤液中加入一块薄铁片,观察不到
A.滤出的不溶物中只有铜,不可能含铁
B.滤出的不溶物中只有铁,不可能含铜
C.滤出的不溶物中一定含有铜,也可能含有铁
D.滤液中一定含有FeSO4,不可能有CuSO4和H2SO4
为什么答案上说C也是对的呢?哪有Cu? zhangyying1年前1
zhangyying1年前1 -
 若渝 共回答了22个问题
若渝 共回答了22个问题 |采纳率90.9%稀硫酸先和氧化铜反应生成CuSO4,因为稀硫酸是一定量的所以还有铁粉剩下,剩下的铁粉再和CuSO4发生反应,所以有Cu.1年前查看全部
- 用氢氧化铜制取氧化铜 的化学方程式
 猫猫月盈1年前3
猫猫月盈1年前3 -
 ma1jie 共回答了10个问题
ma1jie 共回答了10个问题 |采纳率90%2Cu(OH)2=(等号上面写"加热")2Cu+2H2O1年前查看全部
- 用高锰酸钾,氧化铜,碳酸钙,氢氧化钙,氯化钡能做什么实验
 morpheus121年前1
morpheus121年前1 -
 uaka 共回答了32个问题
uaka 共回答了32个问题 |采纳率87.5%高锰酸钾加热制氧,氯化钡和氢氧化钙反应制取氢氧化钡1年前查看全部
- 某CO和CO2的混合气体中,碳的质量分数为36%.取5.0g该气体混合物通过足量灼热的氧化铜,再将气体通入足量的澄清石灰
某CO和CO2的混合气体中,碳的质量分数为36%.取5.0g该气体混合物通过足量灼热的氧化铜,再将气体通入足量的澄清石灰水中,得到白色沉淀的质量为( )
A. 5g
B. 10g
C. 15g
D. 20g 葡萄酒瓶1年前1
葡萄酒瓶1年前1 -
 无笔墨憨 共回答了12个问题
无笔墨憨 共回答了12个问题 |采纳率83.3%解题思路:因为混合气体通过足量的氧化铜后,气体就都变成了二氧化碳;那么,5g混合气体中含的碳,最后都变成二氧化碳,由题意中“通入足量的澄清石灰水”然后都变成碳酸钙,利用碳元素的守恒就可以计算了.5.0g该气体混合物中碳的质量=5.0g×36%=1.8g;那么CaCO3中碳的质量为1.8g,又因为碳的质量分数=[碳的相对分子质量×其原子个数/碳酸钙的相对分子质量]×100%=[12/100]×100%=12%,那么白色沉淀碳酸钙的质量=[1.8g/12%]=15g
故选:C点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查了根据化学方程式中元素的质量守恒来计算所求的生成的物质,方法多种;但是根据某元素的质量守恒更简单,培养学生的实际解决问题能力.1年前查看全部
- 氧化铜加稀硫酸 加热硫酸铜晶体 搅拌食盐 三个实验的实验报告单,
 wzhao888881年前1
wzhao888881年前1 -
 edwardzs 共回答了17个问题
edwardzs 共回答了17个问题 |采纳率82.4%CuO+H2SO4=CuSO4+H2O 固体氧化铜被溶解掉了生成蓝色溶液CuSO4
CuSO4.5H2O=△=CuSO4+5H2O 熔融产生水,持续加热水分完全蒸发,只剩下CuSO4
水中加入食盐的话搅拌可以使溶解更快1年前查看全部
- 有关混合物中求质量分数有二氧化碳和一氧化碳的混合物共70g,通入足量的灼热氧化铜,充分反应后,固体质量减少32g,二氧化
有关混合物中求质量分数
有二氧化碳和一氧化碳的混合物共70g,通入足量的灼热氧化铜,充分反应后,固体质量减少32g,二氧化碳的质量分数为多少?
(不求最快,只求最好的) chenxin1281年前1
chenxin1281年前1 -
 hlw3607353017 共回答了15个问题
hlw3607353017 共回答了15个问题 |采纳率93.3%CuO+CO=Cu+CO2
减少的32克都是CuO中的氧,也就是32/16=2mol
根据反应式与CuO反应的CO也是2mol,所以CO的质量为28*2=56g
CO2含量为70-56=14g
质量分数为14/70=20%1年前查看全部
- 木炭粉、一氧化碳分别还原相同质量的氧化铜,则所需木炭粉、一氧化碳二者的质量比
木炭粉、一氧化碳分别还原相同质量的氧化铜,则所需木炭粉、一氧化碳二者的质量比
C+2CuO=2Cu+CO2
12 160
CO+CuO=Cu+CO2
28 80
x=56 160
12:56=3:14
不是3:7 可是x=56是怎么来的啊 只爱奕1年前1
只爱奕1年前1 -
 2337425 共回答了21个问题
2337425 共回答了21个问题 |采纳率85.7%CO+CuO=Cu+CO2 28 80 x=56 160 28/x=80/160 x=561年前查看全部
- 将一定质量的锌,氧化铁,氧化铜的混合粉末放入含有0.22molHCl中,充分反应后生成448mlH2(标准状况),残留
将一定质量的锌,氧化铁,氧化铜的混合粉末放入含有0.22molHCl中,充分反应后生成448mlH2(标准状况),残留
固体0.64g.过滤,滤液中无Cu2+.滤液中还有0.04molHCl.那么原混合物中Zn的质量为多少克? jlzh1年前2
jlzh1年前2 -
 卖精来上网 共回答了26个问题
卖精来上网 共回答了26个问题 |采纳率96.2%解;固体0.64g为铜,物质的量为0.01mol,氧化铜的物质的量为0.01mol.耗HCl 0.02mol
448mlH2(标准状况),物质的量为0.02mol,耗HCl 0.04mol.滤液中还有0.04molHCl.
所以氧化铁耗HCl 为0.22-0.02-0.04-0.04=0.12mol.发生反应如下:
Fe2O3+6HCl=2FeCl3+3H2O 2FeCl3+Zn=2FeCl2+ZnCl2
6mol 2mol 2mol 1mol
0.12mol 0.04mol 0.04mol 0.02mol
CuO +2HCl = CuCl2+H2O CuCl2 + Zn= ZnCl2+Cu
0.01mol 0.01mol 0.01mol 0.01mol
Zn+2HCl = ZnCl2+ H2
0.02mol 0.02mol
所以共消耗锌的物质的量为0.02mol+0.01mol+0.02mol =0.05mol
原混合物中Zn的质量为;0.05mol乘以65=3.25克1年前查看全部
- 如果按某种标准能将氧化铜,亚硫酸钠,一氧化氮划为同一类物质,则下列物质中能划分的是()
如果按某种标准能将氧化铜,亚硫酸钠,一氧化氮划为同一类物质,则下列物质中能划分的是()
A,K2SO4,B,K2MnO4 C,NaH2PO4 D.HNO3
是氧化亚铜不是氧化铜 cheer981年前1
cheer981年前1 -
 情绪爆发 共回答了22个问题
情绪爆发 共回答了22个问题 |采纳率81.8%选B,锰酸钾,所给的三个化合物中均有非最高正价的元素,一价铜,四价硫,二价氮,四个选项中只有B有六价锰1年前查看全部
大家在问
- 1看图说话(英语)
- 2英语语法Today ,the high sales of popular consumer goods reflect
- 3已知氨基酸平均分子量为a,某蛋白质分子由n条肽链组成,相对分子质量为b,求该蛋白质分子中的肽键数
- 4how long does it take ___(walk) to the train station
- 5一块砖重24牛,长25厘米,宽15厘米,厚4厘米,放在水平地面上最大压强为______帕,若这样放置的砖沿竖直方向切去一
- 6Mr Wang is ____ _____the homework.王老师正在批改作业
- 7A车和B车的速度比是4:7,两车同时从两地出发,相向而行,在离终点15千米处相遇,这时B车行驶了()千米?
- 8四字词语都代表什么历史人物好多 比如:望梅止渴、投笔从戎、画龙点睛、完璧归赵、卧薪尝胆、三顾茅庐、程门立雪
- 9常用的条形统计图有()统计图和()统计图。()又可分为()向条形统计图和()向统计图。
- 10英语太阳、云、雨、雪、下雪的英文怎么读?
- 11求下两个句子各有的一处错误:1.Listen!Your mother calls you.
- 12倾斜的adj 英文是什么lean只有动词是倾斜,adj是“瘦的”意思
- 13已知椭圆a2分之x2+2分之y2=1(a>根号2)的离心率为2分之根号2,双曲线C与已知椭圆…
- 14幂函数底数不同 指数相同怎么比大小
- 15请用下列成语造句寻章摘句味同嚼蜡吹毛求疵咬文嚼字豁然贯通
