盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列的5个反应
 agan152022-10-04 11:39:541条回答
agan152022-10-04 11:39:541条回答请判断反应④的反应热_____________________________________.
①NH3(g)+HCl(g)=NH4Cl(s) △H=-176kJ/mol
②NH3(g)+H2O(l)=NH3(aq) △H=-35.1kJ/mol
③HCl(g)+H2O(l)=HCl(aq) △H=-72.3kJ/mol
④NH4C1(s)+H2O(1)=NH4C1(aq)
⑤NH3(aq)+HCl(aq)=NH4C1(aq) △H=-52.3kJ/mol

已提交,审核后显示!提交回复
共1条回复
 pipiyongbo 共回答了25个问题
pipiyongbo 共回答了25个问题 |采纳率84%- (2-1)+3+5=4
- 1年前
相关推荐
- 盖斯定律中不同焓变相加减是否符合事实客观规律?利用已知热方程式求未知热方程焓变时常用几个方程式加加减减,是否符合事实客观
盖斯定律中不同焓变相加减是否符合事实客观规律?利用已知热方程式求未知热方程焓变时常用几个方程式加加减减,是否符合事实客观规律?加加减减是否要求先符合事实客观规律?
按这个加加减减不是任何物质都能反应? ycliuyang1年前2
ycliuyang1年前2 -
 203010222 共回答了13个问题
203010222 共回答了13个问题 |采纳率92.3%符合
不必
键能是一定的
结果理论值,即使确实无法反应,但是结果也是正确的1年前查看全部
- 怎么用盖斯定律计算?
 火爱上水1年前1
火爱上水1年前1 -
 牵小猪逛商场 共回答了25个问题
牵小猪逛商场 共回答了25个问题 |采纳率84%盖斯定律是热化学中一个重要的基本定律.一些难于实现、难于控制和难于测定其热效应的化学反应,都可以通过盖斯定律用间接方法把它的热效应计算出来.因此,如何运用盖斯定律解题是一个关键.一般来说,应用盖斯定律有两种方法:一种是图解法,一种是代数运算法.由于图解法需要设计几种反应途径,比较繁杂,所以,经常采用代数运算法.但在教学中发现,所有版本的教材在应用此法解题时,同解代数方程一样,
举例
已知
(1)NH3(g) +HCl(g)==NH4Cl(s)ΔH=-176kJ/mol
(2)NH3(g)+H2O(l)== NH3•H2O(aq)ΔH=-35.1 kJ/mol
(3)HCl(g)+ H2O(l)== HCl(aq)ΔH=-72.3 kJ/mol
(4)NH3(aq)+ HCl(aq)== NH4Cl(aq)ΔH=-52.3 kJ/mol
(5)NH4Cl(s)+2 H2O(l)== NH4Cl(aq)ΔH=Q
则第(5)个方程式中的反应热是多少?
首先这题有点错误——NH3(aq)+ HCl(aq)== NH4Cl(aq)ΔH=-52.3 kJ/mol
应该是——NH3(g)+ HCl(g)== NH4Cl(aq)ΔH=-52.3 kJ/mol
再说这题,应该先把(1)反过来 ——NH4Cl(s)==NH3(g) +HCl(g)ΔH=+176kJ/mol
加 NH3(g)+H2O(l)== NH3•H2O(aq)ΔH=-35.1 kJ/mol
加 HCl(g)+ H2O(l)== HCl(aq)ΔH=-72.3 kJ/mol
得——NH4Cl(s)+2 H2O(l)== NH3•H2O(aq)+HCl(aq)ΔH=自己算 Q1
加 NH3(aq)+ HCl(aq)== NH4Cl(aq)ΔH=-52.3 kJ/mol
得 NH4Cl(s)+2 H2O(l)== NH4Cl(aq)ΔH= 自己算的Q1-52.3kJ/mol1年前查看全部
- (1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个
(1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe 2 O 3 (s)+3CO(g)═2Fe(s)+3CO 2 (g)△H=-24.8kJ•mol -1
3Fe 2 O 3 (s)+CO(g)═2Fe 3 O 4 (s)+CO 2 (g)△H=-47.4kJ•mol -1
Fe 3 O 4 (s)+CO(g)═3FeO(s)+CO 2 (g)△H=+640.5kJ•mol -1
写出CO气体还原FeO固体得到Fe 固体和CO 2 气体的热化学反应方程式:______.
(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H 2 在催化剂作用下反应生成甲醇:CO(g)+2H 2 (g)⇌CH 3 OH(g);CO的转化率与温度、压强的关系如图所示.①该反应的△H______0(填“<”、“>”或“=”).
②在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H 2 ,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”).
(3)实验室中配制AgNO 3 溶液时通常需要向其中加入______,目的是______; AgCl在水中存在沉淀溶解平衡:AgCl(s)═Ag + (aq)+Cl - (aq).25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol•L -1 AgNO 3 溶液;③100mL 0.1mol•L -1 氯化镁溶液;④100mL 0.1mol•L -1 氯化钠溶液.充分搅拌后,相同温度下Ag + 浓度由大到小的顺序是______ (填写序号).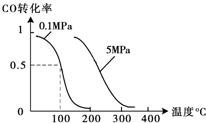
 yh32219441年前1
yh32219441年前1 -
 jinlong0726 共回答了25个问题
jinlong0726 共回答了25个问题 |采纳率88%(1)①Fe 2 O 3 (s)+3CO(g)═2Fe(s)+3CO 2 (g)△H=-24.8kJ•mol -1
②3Fe 2 O 3 (s)+CO(g)═2Fe 3 O 4 (s)+CO 2 (g)△H=-47.4kJ•mol -1
③Fe 3 O 4 (s)+CO(g)═3FeO(s)+CO 2 (g)△H=+640.5kJ•mol -1
依据盖斯定律②+③×2得到6CO(g)+6FeO(s)═6Fe(s)+6CO 2 (g)△H=-1308kJ/mol;
故热化学方程式为:CO(g)+FeO(s)═Fe(s)+CO 2 (g)△H=-218.0kJ/mol;
故答案为:CO(g)+FeO(s)═Fe(s)+CO 2 (g)△H=-218.0kJ/mol;
(2)①图象分析,温度升高一氧化碳转化率减,平衡逆向进行,逆向是吸热反应,正向是放热反应,△H<0,故答案为:<;
②CO(g)+2H 2 (g)⇌CH 3 OH(g);反应是气体体积减小的反应,再增加a mol CO与 2a mol H 2 ,达到新平衡,相当于增大压强对平衡的影响,中等压强平衡正向进行,一氧化碳转化率增大,故答案为:增大;
(3)实验室中配制AgNO 3 溶液时通常需要向其中加硝酸抑制银离子的水解;AgCl在水中存在沉淀溶解平衡:AgCl(s)═Ag + (aq)+Cl - (aq).相同温度下氯化银存在沉淀溶解平衡,AgCl(s)⇌c(Ag + )+c(Cl - );温度不变溶度积常数不变,25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol•L -1 AgNO 3 溶液中c(Ag + )=0.2mol/L;③100mL 0.1mol•L -1 氯化镁溶液中,c(Cl - )=0.2mol/L;④100mL 0.1mol•L -1 氯化钠溶液中c(Cl - )=0.1mol/L.充分搅拌后,Ag + 浓度由大到小的顺序是②①④③;
故答案为:硝酸;抑制Ag + 水解;②①④③.1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义.已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,放出了X kJ热量
盖斯定律在生产和科学研究中有很重要的意义.已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,放出了X kJ热量.已知碳完全燃烧的焓变△H=-Y kJ•mol-1,则lmol C与O2反应生成CO的反应热△H为( ) kJ•mol-1.
A.-Y
B.-(10X-Y)
C.-(5X-O.5Y)
D.+(10X-Y) 咋不行呀1年前1
咋不行呀1年前1 -
 46fk6fo11gbos 共回答了23个问题
46fk6fo11gbos 共回答了23个问题 |采纳率95.7%解题思路:碳在氧气中燃烧,氧气不足发生反应2C+O2
2CO,氧气足量发生反应C+O2点燃 .
CO2,3.6g碳的物质的量为0.3mol,6.4g的氧气的物质的量为0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生.令生成的CO为xmol,CO2为ymol,根据碳元素与氧元素守恒列方程计算x、y的值,计算生成ymol二氧化碳方程的热量,放出的总热量减去生成二氧化碳放出的热量为生成xmolCO放出的热量,据此计算1molC与O2反应生成CO的反应热△H.点燃 .碳在氧气中燃烧,氧气不足发生反应2C+O2
点燃
.
2CO,氧气足量发生反应C+O2
点燃
.
CO2,3.6g碳的物质的量为[3.6g/12g/mol]=0.3mol,6.4g的氧气的物质的量为[6.4g/32/mol]=0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生.
令生成的CO为xmol,CO2为ymol,
根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1.单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ.由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-[XkJ−0.1YkJ/0.2mol]=-(5X-0.5Y)kJ/mol.
故选C.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查反应热的计算,难度不大,判断碳与氧气反应产物中一氧化碳与二氧化碳的物质的量是关键,注意反应热△H的单位与符号,容易忽略.1年前查看全部
- 下列说法正确的是( )A.需要加热的化学反应都是吸热反应B.应用盖斯定律可以计算某些难以测量的反应焓变C.任何能使熵值
下列说法正确的是( )
A.需要加热的化学反应都是吸热反应
B.应用盖斯定律可以计算某些难以测量的反应焓变
C.任何能使熵值增大的过程都能自发进行
D.化学平衡发生移动,平衡常数一定发生变化 verayy1982101年前1
verayy1982101年前1 -
 zhiyuan_978 共回答了16个问题
zhiyuan_978 共回答了16个问题 |采纳率81.3%解题思路:A.反应的热效应与反应条件无关;
B.反应的热效应取决于反应物、生成物的状态与反应的途径无关;
C.反应能否自发进行取决于△H-T△S是否小于0;
D.平衡常数只与温度有关.A.铝热反应为放热反应,但是需要在高温条件下发生,故A错误;
B.应用盖斯定律可以计算某些难以测量的反应焓变,故B正确;
C.反应能否自发进行取决于焓变和熵变的综合判据,当△G=△H-T•△S<0判断反应能自发进行,故C错误;
D.平衡常数只与温度有关,温度不变,平衡常数不变,故D错误;
故选:B.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应的热效应、反应自发进行的判断依据、化学平衡常数的影响因素,题目难度不大,熟悉相关概念是解题关键,注意反应吸热与放热与反应的条件无关.1年前查看全部
- (4分)利用盖斯定律回答下列问题:
(4分)利用盖斯定律回答下列问题:
已知热化学方程式
C(s、金刚石)+O 2 (g) —→ CO 2 (g); △H=-395.4kJ·mol —1
C(s、石墨)+O 2 (g) —→ CO 2 (g); △H = -393.5kJ·mol —1
由金刚石转化为石墨的热化学方程式为 ,由热化学反应方程式看来,更稳定的碳的同素异形体是 。 lxm19821301年前1
lxm19821301年前1 -
 三星小胖 共回答了21个问题
三星小胖 共回答了21个问题 |采纳率85.7%(4分)
热化学方程式C(s、金刚石)—→C(s、石墨);△H = -1.9kJ·mol —1 ,
更稳定的碳的同素异形体是 石墨 。
略1年前查看全部
- 利用盖斯定律回答下列问题已知热化学反应方程式,C(s、金刚石)+O2(g)=CO2(g) ΔH=-395.4kj/mol
利用盖斯定律回答下列问题
已知热化学反应方程式,C(s、金刚石)+O2(g)=CO2(g) ΔH=-395.4kj/mol
C(s、石墨)+O2(g)=co2(g) ΔH=-395.4kj/mol
由金刚石转化为石墨的热化学方程式为:
由热化学反应方程式来看,更稳定的碳的同素异形体是:
这类题我不会,不知道怎么合并两个化学方程式,
我是高二的新生,自己在家预习 清风蝶影221年前2
清风蝶影221年前2 -
 jy00459921 共回答了21个问题
jy00459921 共回答了21个问题 |采纳率76.2%C(石墨,s)+O2(g)=CO2(g) ΔH=-393.51KJ/mol
C(金刚石,s)+O2(g)=CO2(g) ΔH=-395.41KJ/mol
你看错了
石墨更稳定,因为石墨的能量更低,能量越低越稳定.
C(石墨,s)=C(金刚石,s )ΔH=1.90KJ/mol1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
①CO(g)+[1/2]O2(g)=CO2(g)△H1=-283.0kJ/mol
②H2(g)+[1/2]O2(g)=H2O(l)△H2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H3=-1370kJ/mol
计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的△H. lilielf1年前1
lilielf1年前1 -
 小紅豆 共回答了23个问题
小紅豆 共回答了23个问题 |采纳率87%解题思路:根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算.已知:①CO(g)+1/2O2(g)=CO2(g)△H1=-283.0kJ/mol
②H2(g)+[1/2]O2(g)=H2O(l)△H.2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H3=-1370kJ/mol
根据盖斯定律,①×2-③+②×4得2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)△H.=2△H1-△H3+4△H2;
故△H.4=2△H1-△H3+4△H2=2×(-283.0kJ/mol)-(-1370kJ/mol)+4×(-285.8kJ/mol)=-339.2kJ/mol
答:2CO(g)+4H2(g)═H2O(l)+C2H5OH(l)的△H=-339.2 kJ/mol.点评:
本题考点: 热化学方程式.
考点点评: 本题考查根据盖斯定律进行的有关反应热的计算,难度中等,注意理解盖斯定律,关键是构造目标热化学方程式.1年前查看全部
- 关于反应热的计算中盖斯定律的问题!
关于反应热的计算中盖斯定律的问题!
书上说,利用盖斯定律,可以将两个或者两个以上的热化学方程式(包括德尔塔H)相加或者相减,这是因为什么? 风色男1年前1
风色男1年前1 -
 love雨中漫步 共回答了18个问题
love雨中漫步 共回答了18个问题 |采纳率88.9%一个典型的例子,如C+O2=CO2,可以认为分两步反应,第一步C+1/2O2=CO,第二步CO+1/2O2=CO2,这两步的方程式相加即得到前面的总方程式,两步放出的热量相加即得到总反应放出的热量.这就是盖斯定律.1年前查看全部
- 下列说法不正确的是 ( ) A.化学反应是旧键断裂和新键形成的过程 B.盖斯定律实质上是能量守恒定律的体现 C.反应前
下列说法不正确的是 ( )
A.化学反应是旧键断裂和新键形成的过程 B.盖斯定律实质上是能量守恒定律的体现 C.反应前后分子数不变遵循的是质量守恒定律 D.溶解平衡、水解平衡和电离平衡均为动态平衡  acrab1年前1
acrab1年前1 -
 执子之手朝朝暮暮 共回答了20个问题
执子之手朝朝暮暮 共回答了20个问题 |采纳率90%C
质量守恒定律的本质是反应前后原子数不变1年前查看全部
- 盖斯定律的含义
 洛翎星1年前1
洛翎星1年前1 -
 yi拉罐 共回答了254个问题
yi拉罐 共回答了254个问题 |采纳率63.8%盖斯定律换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关,而这可以看出,盖斯定律实际上是“内能和焓是状态函数”这一结论的进一步体现。利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。尽管盖斯定律出现在热力学第一定律提出前,但亦可通过热力学第一定律推导出。 由于热力学能(U)和焓(H)都是状态函数,所以ΔU和ΔH只与体系的始、末状态有关而与“历程”无关。 可见,对于恒容或恒压化学反应来说,只要反应物和产物的状态确定了,反应的热效应Qv或Qp也就确定了,反应是否有中间步骤或有无催化剂介入等均对Qv或Qp数值没有影响。 希望可以帮到你,(*^__^*) 如果我的回答可以帮助到你,烦请您点击可爱的右上角给我好评哦,谢谢!1年前查看全部
- 下列说法不正确的是( )A.利用盖斯定律可计算某些难以直接测量的反应焓变B.如果一个化学方程式通过其他几个化学方程式相
下列说法不正确的是( )
A.利用盖斯定律可计算某些难以直接测量的反应焓变
B.如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓变可由相关的化学方程式的焓变相加减而得到
C.对于放热反应,放出的热量越多,焓变越小
D.当同一个化学反应以不同的过程完成时,反应的焓变是不同的 一夜采遍vv花1年前1
一夜采遍vv花1年前1 -
 黑夜白眼 共回答了18个问题
黑夜白眼 共回答了18个问题 |采纳率88.9%解题思路:A、利用盖斯定律可以求算难以通过实验测得的反应的焓变;
B、焓变决定于反应物和生成物的能量差;
C、放热反应的焓变小于0;
D、焓变大小决定于反应物和生成物的能量差.A、有些化学反应的焓变难以通过实验测得,通过盖斯定律可以求得,故A正确;
B、焓变的大小决定于反应物和生成物的能量差,和反应过程无关,故B正确;
C、放热反应的焓变小于0,放热越多焓变越小,故C正确;
D、焓变的大小决定于反应物和生成物的能量差,和反应过程无关,故D错误;
故选D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了盖斯定律的实质,关键是对盖斯定律的正确理解,题目难度不大.1年前查看全部
- 热力学第一定律与盖斯定律有什么关系
 噬魂天下1年前1
噬魂天下1年前1 -
 麦兜先生 共回答了15个问题
麦兜先生 共回答了15个问题 |采纳率100%盖斯定律:定压定容条件下,任意一个反应其总反应的热效应只与反应的始态和终态有关而与反应的路程无关.
热力学第一定律:Q=W+△U
化学反应,定压定容条件,不对外做膨胀功,W=0.故Q=△U.而热力学能U是温度T的单值函数,从而Q正比于△T,即反应其总反应的热效应(吸热量Q)只与反应的始态和终态(温度)有关.1年前查看全部
- 下列叙述正确的是( )A.运用盖斯定律可以计算某些难以直接测量的反应焓变B.同温同压下,H2(g)+Cl2(g)=2H
下列叙述正确的是( )
A.运用盖斯定律可以计算某些难以直接测量的反应焓变
B.同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H不同
C.化学反应一定有能量变化,有能量变化的一定是化学反应
D.化学平衡发生移动,速率一定改变.速率改变,化学平衡一定发生移动 mbnbv1年前1
mbnbv1年前1 -
 20040913 共回答了20个问题
20040913 共回答了20个问题 |采纳率90%解题思路:A、盖斯定律是和起始状态、终了状态物质的能量有关,与变化过程无关,可以计算难以测定的反应的焓变;
B、反应的焓变只与起始和终了物质状态能量有关,与变化过程,反应条件无关;
C、化学反应实质是断裂化学键吸收能力,形成化学键放出能量,反应过程中一定伴随能量变化,但能量变化的过程不一定是化学反应;
D、化学平衡移动,反应速率一定变化,但速率变化平衡不一定移动.A、盖斯定律是和起始状态、终了状态物质的能量有关,与变化过程无关,可以计算难以测定的反应的焓变,故A正确;
B、依据盖斯定律分析可知,反应的焓变只与起始和终了物质状态能量有关,与变化过程,反应条件无关,故B错误;
C、化学反应实质是断裂化学键吸收能量,形成化学键放出能量,反应过程中一定伴随能量变化,但能量变化的过程不一定是化学反应如灯泡发光过程中放热是物理变化,故C错误;
D、化学平衡移动,反应速率一定变化,但速率变化平衡不一定移动,如反应前后气体体积不变的反应,中等压强速率增大,但平衡不动,故D错误;
故选A.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了化学反应的焓变分析,盖斯定律含义理解应用,化学反应实质分析判断,题目难度中等.1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe 2 O 3 (s)+3CO(g)=2Fe(s)+3CO 2 (g)△H=―24.8kJ•mol -1
②3Fe 2 O 3 (s)+CO(g)=2Fe 3 O 4 (s)+CO 2 (g)△H=―47.2kJ•mol -1
③Fe 3 O 4 (s)+CO(g)=3FeO(s)+CO 2 (g)△H=+640.5kJ•mol -1
写出CO气体还原FeO固体得到Fe固体和CO 2 气体的热化学反应方程式:__________________________________________________ yesterday1001年前1
yesterday1001年前1 -
 xx民间xx会 共回答了16个问题
xx民间xx会 共回答了16个问题 |采纳率87.5%CO(g)+FeO(s)=Fe(s)+CO 2 (g)△H=―218.0kJ•mol -1
1年前查看全部
- 1.简述什么是盖斯定律?2.简述杂化轨道理论要点?3.简述什么是元素电势图?4.如何鉴别NaNO2和NaNO3?
 decrilend1年前1
decrilend1年前1 -
 dine 共回答了18个问题
dine 共回答了18个问题 |采纳率100%1定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等).即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
2在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道.
3许多元素具有多种氧化值,不同氧化值的物种可以组成电对.将某种元素不同氧化值的物种从左到右按氧化值由高到低的顺序排成一行,每两个物种间用直线连接表示一个电对,并在直线上标明此电对的标准电极电势的数值.这种图称为元素电势图.
4加入硝酸银有白色沉淀的是亚硝酸钠,是溶液的是硝酸钠1年前查看全部
- (1)利用盖斯定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。已知:N 2 (g)+ 2O 2
(1)利用盖斯定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。已知:N 2 (g)+ 2O 2 (g)="=" 2NO 2 (g) ΔH=" +67.7" kJ·mol -1 ,
N 2 H 4 (g)+ O 2 (g)="=" N 2 (g)+ 2H 2 O(g) ΔH=" -534" kJ·mol -1 。
请写出气态肼与NO 2 气体完全反应生成氮气和水蒸气的热化学方程式: 。
(2)已知:N≡N的键能是946kJ·mol -1 ,H—H的键能为436kJ·mol -1 ,N—H的键
能为393kJ·mol -1 ,计算合成氨反应生成1molNH 3 的△H= kJ·mol -1 。
(3)现有25℃、pH=13的Ba(OH) 2 溶液,
①该Ba(OH) 2 溶液的物质的量浓度为________
②加水稀释100倍,所得溶液中由水电离出c(OH - )=____________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na + ) c(CH 3 COO - )(填“ >” 或“=” 或“<” )。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na + )
c(CH 3 COO - ) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。 康脱三分集1年前1
康脱三分集1年前1 -
 say迅 共回答了19个问题
say迅 共回答了19个问题 |采纳率89.5%(1)2N 2 H 4 (g)+ 2NO 2 (g)= 3N 2 (g)+ 4H 2 O(g) ΔH=" -1135.7" kJ·mol -1 (2分)
(2)-52kJ·mol -1 (2分)
(3)① 0.05mo1·L -1 (1分) ②1×10 -11 mo1/L(2分) ③ 2(2分)
(4)(1)碱性,>;(2分) (2)酸性,<;(2分) (3)中性,>; (2分)
1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19.42kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:______. 郁闷人生-1年前1
郁闷人生-1年前1 -
 philisp109 共回答了23个问题
philisp109 共回答了23个问题 |采纳率95.7%解题思路:根据盖斯定律将三个化学方程式进行处理合并计算得到;Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19.42kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)═6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+19.42kJ/mol)×2=-66kJ/mol,
即 CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11kJ/mol
故答案为:CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11kJ/mol;点评:
本题考点: 热化学方程式.
考点点评: 本题考查反应热的计算,题目难度不大,注意盖斯定律的应用.1年前查看全部
- 盖斯定律的热化学反应方程式怎么算?三个式子就不会了,大神求解
 御剑阁1年前3
御剑阁1年前3 -
 apples111 共回答了1个问题
apples111 共回答了1个问题 |采纳率求唅变么知道啊,但是内个式子不会合在一起就找起点和终点1年前查看全部
- 盖斯定律的题目NH3(g)燃烧生成N2(g)和H2O(l)已知1.H2(g)+ 1/2 O2(g)=H2O(g)2.1/
盖斯定律的题目
NH3(g)燃烧生成N2(g)和H2O(l)已知
1.H2(g)+ 1/2 O2(g)=H2O(g)
2.1/2 N2(g)+3/2 H2(g)=NH3(g)
则NH3(g)的燃烧热△H=?
补充 1.△H1=-285.8KJ/moL H2(g)+ 1/2 O2(g)=H2O(l)
2.△H3=-46.0KJ/moL 1/2 N2(g)+3/2 H2(g)=NH3(g) 不打领带的人1年前4
不打领带的人1年前4 -
 dengguo2008 共回答了21个问题
dengguo2008 共回答了21个问题 |采纳率90.5%3/2X2式 -1式1年前查看全部
- 利用盖斯定律回答下列问题:已知热化学方程式
利用盖斯定律回答下列问题:已知热化学方程式
C(s、金刚石)+O2(g)-→CO2(g);△H=-395.4kJ•mol-1
C(s、石墨)+O2(g)-→CO2(g);△H=-393.5kJ•mol-1
由金刚石转化为石墨的热化学方程式为______,由热化学反应方程式看来,更稳定的碳的同素异形体是______. liuhai11151年前1
liuhai11151年前1 -
 w234comcn 共回答了26个问题
w234comcn 共回答了26个问题 |采纳率88.5%解题思路:二式相减可得金刚石转化为石墨的热化学方程式,物质的能量越高,越不稳定.已知:①C(s、金刚石)+O2(g)-→CO2(g);△H=-395.4kJ•mol-1
②C(s、石墨)+O2(g)-→CO2(g);△H=-393.5kJ•mol-1
利用盖斯定律将①-②可得:
C(s、金刚石)→C(s、石墨);△H=(=-395.4kJ•mol-1)-(-393.5kJ•mol-1)=-1.9kJ•mol-1,
该反应放热,说明金刚石的能量大于石墨,物质的能量越高,越不稳定,说明石墨较稳定.
故答案为:C(s、金刚石)→C(s、石墨);△H=-1.9kJ•mol-1,石墨.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查反应热的计算,题目难度不大,注意盖斯定律的应用.1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以用盖斯定律间接求得。已知3.6 g碳在
盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以用盖斯定律间接求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量;已知每摩尔单质碳完全燃烧生成CO 2 放出热量为y kJ,则1 mol C与O 2 反应生成CO的反应热ΔH为
A.-y kJ·mol -1 B.-(10x-y)kJ·mol -1 C.-(5x-0.5y)kJ·mol -1 D.+(10x-y)kJ·mol -1  猫腰的老头1年前1
猫腰的老头1年前1 -
 qita5 共回答了26个问题
qita5 共回答了26个问题 |采纳率92.3%C
1年前查看全部
- 下列与化学反应能量变化相关的叙述正确的是 ( )。 A.应用盖斯定律,可计算某些难以直接测量的反
下列与化学反应能量变化相关的叙述正确的是( )。
A.应用盖斯定律,可计算某些难以直接测量的反应焓变 B.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O 2 =SO 2 ΔH=-297.3 kJ·mol-1 C.1 mol H 2 SO 4 与1 mol Ba(OH) 2 反应生成1 mol BaSO 4 沉淀时放出的热量叫做中和热 D.反应热的大小与反应物所具有的能量和生成物所具有的能量无关  zlj2006101年前1
zlj2006101年前1 -
 fengk001 共回答了22个问题
fengk001 共回答了22个问题 |采纳率95.5%A
B项,没有注明物质的状态,不正确;在一定条件下,酸和碱在稀溶液中,发生中和反应而生成1 mol水时放出的热量是中和热,C不正确。1年前查看全部
- 下列有关说法正确的是 A.放热反应在任何条件都能自发进行 B.应用盖斯定律,可计算某些难以直接测量的反应焓变 C.在铁制
下列有关说法正确的是
A.放热反应在任何条件都能自发进行 B.应用盖斯定律,可计算某些难以直接测量的反应焓变 C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 D.电解精炼铜时,外电路中转移电子数为2N A 个时,阳极铜质量减少64g  DDT00841年前1
DDT00841年前1 -
 梦雨玄 共回答了25个问题
梦雨玄 共回答了25个问题 |采纳率96%B
放热反应不是在任何条件下都能发生的;铁制品上镀铜时,镀件做阴极;精炼铜时,阳极铜质量减少的质量小于64g。答案选B。1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接
盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接
计算求得.已知3.6gC在6.4gO2中燃烧,至反应物耗尽,并放出X千焦热量.已知单质碳的标准燃烧热为Y千焦每摩,则1摩C与O2反应生成CO的反应热三角H为 答案是-(5X-0.5)千焦每摩 正方形与乌龟1年前1
正方形与乌龟1年前1 -
 jiuaiswj4 共回答了21个问题
jiuaiswj4 共回答了21个问题 |采纳率90.5%答案应该为:-(5X-0.5Y)千焦每摩
由已知条件得:
参与反应的C为0.3mol,参与反应的O2为0.2mol.
C+O2=CO2 (1)
2C+O2=2CO (2)
计算得,参与(1)反应的C为0.1mol,参与(2)反应的C为0.2mol.
单质碳的标准燃烧热为Y千焦每摩,所以(2)反应的反应热为:-(X-0.1Y)
则1摩C与O2反应生成CO的反应热为:-(X-0.1Y)/0.2=-(5X-0.5Y)千焦每摩1年前查看全部
- 请高手赐教,望回复及时,1 根据热化学方程式的计算以及盖斯定律的应用:1.已知:CH4(g)+2O2(g)=CO2(g)
请高手赐教,望回复及时,
1 根据热化学方程式的计算以及盖斯定律的应用:
1.已知:ch4(g)+2o2(g)=co2(g)+2h2o(l);△h=-890kj/mol
co(g)+1/2o2(g)=co2(g);△h=-282.5kj/mol.假如标准状况下由ch4、co、co2组成***.6升混和气体完全燃烧时能放出1010千焦的热量,并生成18克液态水,那么燃烧前混和气体中co占的体积百分含量约为 ( )
a.40% b.50% c.60% d.70% wanwan892111年前4
wanwan892111年前4 -
 朝日的光 共回答了19个问题
朝日的光 共回答了19个问题 |采纳率100%原来的总物质的量是89.6/22.4=4mol
水是1mol
按照第一个方程式知道生成的热量是890/2=445mol
那么余下1010-445=565J
那么下面生成565J的热量,需要燃烧2molCO
那么比例是2/4=50%
选B1年前查看全部
- 下列关于盖斯定律的说法不正确的是( )
下列关于盖斯定律的说法不正确的是( )
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中△H直接相加即可得总反应热 kschumy1年前1
kschumy1年前1 -
 派克和赫本 共回答了16个问题
派克和赫本 共回答了16个问题 |采纳率93.8%解题思路:A、根据盖斯定律的含义判断.
B、反应物的总能量与产物的总能量决定反应热效应.
C、如果一反应能由数个其它反应的代数和表示时,其反应热亦等于数个相对应方程式反应热的代数和.
D、反应热的数值与化学计量数有关.A、盖斯定律指若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同,故A正确;
B、反应物的总能量与产物的总能量决定反应热效应,所以反应热只与反应体系的始态和终态有关,而与反应的途径无关,故B正确.
C、有些反应很慢,有的反应有副反应,其反应热通过实验测定有困难,可以用盖斯定律间接计算出来,故C正确.
D、方程式按一定系数比加和时其反应热也按该系数比加和,故D错误.
故选:D点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查盖斯定律的含义,题目难度不大,注意对盖斯定律的理解.1年前查看全部
- 盖斯定律的题目的计算方法求盖斯定律计算题目的几个方法!
 VICKYWXJ1年前1
VICKYWXJ1年前1 -
 mikco6 共回答了13个问题
mikco6 共回答了13个问题 |采纳率92.3%老师给我们总结了一个思路,希望对你有所帮助.
依盖斯定律:对已知方程进行加减变为目标方程
已知方程与代求方程(目标方程)对比
物质在同侧相加,异侧相减
若计量数不同,找最小公倍数统一
ΔH与方程同样运算1年前查看全部
- 运用盖斯定律可计算一些不易测定的反应的反应热
 liuzimin1年前1
liuzimin1年前1 -
 zhe959 共回答了10个问题
zhe959 共回答了10个问题 |采纳率80%表明反应所放出或吸收热量的方程式
热化学方程式书写注意事项:
(1)各物质化学式右侧用圆括弧()表明物质的聚集状态.可以用g、l、s分别代表气态、液态、固态.固体有不同晶态时,还需将晶态注明,例如S(斜方),S(单斜),C(石墨),C(金刚石)等.溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq,∝) 代表无限稀释水溶液.
(2) 热化学方程式中化学计量数只表示该物质的物质的量,不表示物质分子个数或原子个数,因此,它可以是整数,也可以是分数.
(3) △H只能写在化学方程式的右边,若为放热反应,则△H为“-”;若为吸热反应,则△H为“+”.其单位一般为kJ/mol.对于同一反应来说,计量系数不同,△H不同.
(4) 热化学方程式是表示反应已完成的数量.由于△H与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反.
(5)不标“↑”或“↓”
(6)不注明反应条件,例如:△(加热)
(7)有机热化学方程式用“=”,不用“→”1年前查看全部
- 盖斯定律运用到这题
盖斯定律运用到这题
 coolnesser1年前1
coolnesser1年前1 -
 蚊子23 共回答了15个问题
蚊子23 共回答了15个问题 |采纳率73.3%热化学方程式的叠加就是盖斯定律的应用.将2式的反应物和生成物对调再加上1式就得到了所求式子.ΔΗ=ΔΗ1+(-ΔΗ2)1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.金红石(TiO2)制
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.金红石(TiO2)制钛,涉及的步骤为:TiO2-TiCl4-Ti,
已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol①
O2(g)+2CO(g)=2CO2 (g)△H=-566kJ/mol②
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g)△H=+141kJ/mol③
写出金红石与氯气、石墨制取TiCl4(s)和CO的热化学反应方程式______. suny03271年前1
suny03271年前1 -
 徽徽的笑 共回答了18个问题
徽徽的笑 共回答了18个问题 |采纳率94.4%解题思路:根据盖斯定律结合已知热化学反应的方程式来回答即可.金红石与氯气、石墨制取TiCl4(s)和CO的化学反应方程式可以通过③+①×2-②得到,
所以TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=141kJ/mol-393.5kJ/mol×2+566kJ/mol=-80KJ/mol,
即TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=-80KJ/mol,
故答案为:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=-80KJ/mol.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查学生盖斯定律的应用知识,属于重要的考点,难度不大.1年前查看全部
- 化学反应式之间的运算问题在大学化学中的盖斯定律和多重平衡规则中经常需要从已知的几个反应式推导出另外一个与这些式子相关的另
化学反应式之间的运算问题
在大学化学中的盖斯定律和多重平衡规则中经常需要从已知的几个反应式推导出另外一个与这些式子相关的另外一个反应式,那么这其中的规则是什么呢?
若不知道最终的反应式,例如推导弱酸弱碱盐的水解平衡常数之类的问题,那在这种情况下又如何解决,怎么判断哪个式子该加哪个该减去呢? 快乐会传染1年前3
快乐会传染1年前3 -
 xx8829486 共回答了18个问题
xx8829486 共回答了18个问题 |采纳率94.4%可以由已知条件和目标方程式入手,找出相同物质,再抓住该物质,进行逆推.这和平衡常数的推导类似.或者你还可以列数学方程,但是太麻烦.1年前查看全部
- 下列说法不正确的是( ) A.吸热反应在常温下也可能发生 B.应用盖斯定律,可计算某些难以直接测量的反应焓变 C.化学
下列说法不正确的是( ) A.吸热反应在常温下也可能发生 B.应用盖斯定律,可计算某些难以直接测量的反应焓变 C.化学能可转化为热能、光能、电能等 D.拆开旧化学键吸收的能量一定大于形成新键放出的能量  白墨莫白1年前1
白墨莫白1年前1 -
 jqfdtfl 共回答了15个问题
jqfdtfl 共回答了15个问题 |采纳率93.3%A、氯化铵和氢氧化钡晶体的反应是吸热反应,在常温下即可发生,故A正确;B、利用盖斯定律可以计算化学反应的焓变,故B正确;C、化学反应有的是放热反应,此反应是化学能转化为热能,化学反应如果发光,则化学能...1年前查看全部
- (1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个
 (1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
(1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ•mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:______.
(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g);CO的转化率与温度、压强的关系如图所示.①该反应的△H______0(填“<”、“>”或“=”).
②在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”).
(3)实验室中配制AgNO3溶液时通常需要向其中加入______,目的是______; AgCl在水中存在沉淀溶解平衡:AgCl(s)═Ag+(aq)+Cl-(aq).25℃时,现将足量AgCl分别放入:①100mL蒸馏水;②100mL 0.2mol•L-1AgNO3溶液;③100mL 0.1mol•L-1氯化镁溶液;④100mL 0.1mol•L-1氯化钠溶液.充分搅拌后,相同温度下Ag+浓度由大到小的顺序是______ (填写序号). 梦幻浮泛1年前1
梦幻浮泛1年前1 -
 hdktvh 共回答了14个问题
hdktvh 共回答了14个问题 |采纳率92.9%解题思路:(1)依据热化学方程式和盖斯定律计算得到;
(2)①依据图象分析,温度升高一氧化碳转化率减小结合平衡一定原理分析;
②反应是气体体积减小的反应,再增加a mol CO与 2a mol H2,达到新平衡,相当于增大压强对平衡的影响,压强增大平衡正向进行;
(3)配制AgNO3溶液需要防止银离子水解需要加入硝酸;依据氯化银沉淀溶解平衡的溶度积常数分析判断.(1)①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ•mol-1③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ•mol-1依据盖斯定律②+...
点评:
本题考点: 热化学方程式;反应热和焓变;化学平衡建立的过程;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素分析判断,平衡移动原理的分析应用,沉淀溶解平衡中溶度积常数随温度变化是解题关键,题目难度中等.1年前查看全部
- 盖斯定律怎么才知道谁和谁相加,谁和谁相减
盖斯定律怎么才知道谁和谁相加,谁和谁相减
已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) H=-25
(2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 H=-47
(3)Fe3O4(s)+CO(s)=3FeO(s)+CO2(g) H=19
由Feo(s)被CO还原成Fe和CO2的热化学方程式为?
解析是说(3)x2+(2)=(4) 再用(1)-(4).
我就是不知道为什么是这样?
还有是在(3)x2+(2)中,为什么2CO(g)能和2CO2(g)抵消啊 ?不是说相同的才能抵消吗?
求各位高手详细解答下,谢谢了! zgirlz1年前2
zgirlz1年前2 -
 杜杜的风筝 共回答了18个问题
杜杜的风筝 共回答了18个问题 |采纳率94.4%先看要求的方程式 由Feo(s)被CO还原成Fe和CO2的热化学方程式
其中没有涉及到 Fe3O4 而(2).(3)中都有Fe3O4 , 因此要把Fe3O4给消除掉
(2)中右式Fe3O4前系数为2 ,(3)中左式Fe3O4前系数为1
所以有(3)*2+(2) 把Fe3O4给消除掉
得到(4):3Fe2O3(s)+3CO(g)=6FeO(s)+3CO2(g)
再看题目要求 由Feo(s)被CO还原成Fe和CO2的热化学方程式
其中也没有涉及到Fe2O3 而(1).(4)中都有Fe2O3 所以还要把Fe2O3给消除掉
(4)中左式Fe2O3前系数为3 ,(1)中左式Fe2O3前系数为1
所以应该是(1)*3-(4)=(5):6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)
得到的热化学方程式 为6CO(g)+6FeO(s)=6Fe(s)+6CO2(g) H=H1*3-(H3*2+H2)
还可以再约 CO(g)+FeO(s)=Fe(s)+CO2(g) H=1/6[H1*3-(H3*2+H2)]
符号比较多 希望耐心点看吧.
另外(3)x2+(2)中 没有出现2CO(g)能和2CO2(g)抵消 在(4)中还是保留着的
希望可以帮到 如果还有不懂的 可以问我 谢谢1年前查看全部
- 盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:
盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:
已知:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q1 kJ/mol,C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol,H2O(g)=H2O(l);△H3=-Q3 kJ/mol.若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中△H为______kJ.(用Q1、Q2、Q3表示) 生命是什么1年前1
生命是什么1年前1 -
 mykk66 共回答了20个问题
mykk66 共回答了20个问题 |采纳率100%解题思路:依据热化学方程式,结合盖斯定律计算得到热化学方程式(1)①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H1=-Q1 kJ/mol,
②C2H5OH(g)=C2H5OH(l);△H2=-Q2 kJ/mol,
③H2O(g)=H2O(l);△H3=-Q3 kJ/mol.
依据盖斯定律:①-②+3×③得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H1=-(Q1-Q2+3Q3)kJ/mol,
若使23g液态无水酒精物质的量为0.5mol,完全燃烧,并恢复到室温,则整个过程中放出的热量为(0.5Q1-0.5Q2+1.5Q3 )KJ,△H=(-0.5Q1+0.5Q2-1.5Q3)KJ/mol
,故答案为:-0.5Q1+0.5Q2-1.5Q3.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了热化学方程式的知识分析,盖斯定律的运用,题目难度不大.1年前查看全部
- 根据盖斯定律,热化学方程式中△h之和相加即得总反应热,错哪了?
 vanelevy1年前1
vanelevy1年前1 -
 爱已出发 共回答了18个问题
爱已出发 共回答了18个问题 |采纳率88.9%错误
要在某些特定气压、温度之类的,记不得了,但是用△h求反应热是要条件的1年前查看全部
- 盖斯定律和计算有啥关系选修书盖斯定律的定义说反应热是和体系的始态终态有关和途径无关.这和计算有啥关系.
 rainrose11年前1
rainrose11年前1 -
 淡雅姿姿 共回答了20个问题
淡雅姿姿 共回答了20个问题 |采纳率95%就是告诉你不用考虑体积变化方式,从哪个方向缩小等等,这是你现在接触到的题目的隐含条件1年前查看全部
- 根据盖斯定律,热化学方程式具有-----?
 caspoor1年前2
caspoor1年前2 -
 cdxul7 共回答了13个问题
cdxul7 共回答了13个问题 |采纳率92.3%能量守恒1年前查看全部
- 什么是盖斯定律氨合成中的
 街头枪手1年前1
街头枪手1年前1 -
 sdfwqef 共回答了16个问题
sdfwqef 共回答了16个问题 |采纳率100%是说如果两个化学反应能组成一个化学反应
则这两个反应的反应热与第三个的反应热相等
比如液态氢气变成气态和气态氢气与气态氮气反应生成氨气这两个反应的反应热之和就等于液态氢气与气态氮气反应生成气态氨气的反应热
有点晕,仔细看1年前查看全部
- 用盖斯定律有好几步反应,怎样将这几步连起来呢?因为有时要用到能量的正负,所以必须要知道是通过哪及步连起来的.请给举个例子
用盖斯定律
有好几步反应,怎样将这几步连起来呢?因为有时要用到能量的正负,所以必须要知道是通过哪及步连起来的.请给举个例子, sanysany1年前2
sanysany1年前2 -
 qiutian520 共回答了10个问题
qiutian520 共回答了10个问题 |采纳率100%直接把方程相加(左边、右边分别相加),有时需要乘一个系数.
例: 2C+O2=2CO 2CO+O2=2CO2.相加后:C+O2=CO2.1年前查看全部
- 利用盖斯定律算反应热的时候,若只移一个项,△H需要变符号吗
 heatzp1年前1
heatzp1年前1 -
 sallyia 共回答了20个问题
sallyia 共回答了20个问题 |采纳率85%不需要.1年前查看全部
- 用盖斯定律计算化学反应热,正负号怎么判断
用盖斯定律计算化学反应热,正负号怎么判断
比如,Fe2O3(S) + 3/2 C(S) == 3/2 CO2(g) + 2 Fe(s) △H=+234.1KJ/mol
C(s)+O2(g)==CO2(g) △H=-393.5KJ/mol
求2Fe(s) + 3/2 O2(g) ==Fe2O3 的△H christina07261年前2
christina07261年前2 -
 rdsee 共回答了18个问题
rdsee 共回答了18个问题 |采纳率94.4%在计算反应热的时候先用已知方程式配出第三个要求反应热的方程式,原则:反应物加减反应物,生成物加减生成物,如果所求反应物在等号的右边,那就让它带上负号(通过数学方法能让它移项到反应物这边),同理对于生成物.
运用盖斯定律(2)х3/2-(1)得2Fe(s)+ 3/2O2(g)=Fe2O3(s)的ΔH是3/2х(-393.5kJ•mol-1)-234.1kJ•mol-1=-824.4 kJ•mol-11年前查看全部
- 为什么热和功根据途径不同数值也就不同呢 盖斯定律不是说了一个反应不论是几步完成 热效应只与始态终态有关吗
 明日扉1年前1
明日扉1年前1 -
 ningmu88 共回答了16个问题
ningmu88 共回答了16个问题 |采纳率81.3%盖斯定律中是求算差值1年前查看全部
- 下列原理和定律中,可用于判断化学平衡移动方向的是 A.盖斯定律 B.阿伏加德罗定律 C.勒夏特列原理 D.质量守恒定律
 melissa-zhu1年前1
melissa-zhu1年前1 -
 毒蟒蛇 共回答了23个问题
毒蟒蛇 共回答了23个问题 |采纳率95.7%C
1年前查看全部
- 盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:______. 张纪中先生1年前1
张纪中先生1年前1 -
 米饭女孩 共回答了12个问题
米饭女孩 共回答了12个问题 |采纳率91.7%解题思路:根据盖斯定律将三个化学方程式进行处理.Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查反应热的计算,题目难度不大,注意盖斯定律的应用.1年前查看全部
- 根结盖斯定律,结合方程,回答下列问题
根结盖斯定律,结合方程,回答下列问题
按照盖斯定律,结合下述反应方程式,已知:
(1)NH3(g)+HCl(g)===NH4Cl(s) △H1=-176kJ/mol
(2)NH3(g)+H2O(l)===NH3.H2O(aq) △H2=-35.1kJ/mol
(3)HCl(g) +H2O(l)===HCl(aq) △H3=-72.3kJ/mol
(4)NH3(aq)+ HCl(aq)===NH4Cl(aq) △H4=-52.3kJ/mol
(5)NH4Cl(s)+2H2O(l)=== NH4Cl(aq) △H5=?
则第(5)个方程式中的反应热△H是________.
[学生]根据盖斯定律和上述反应方程式得:
(4)+ (3)+ (2)- (1)= (5),即Q= +16.3kJ/mol
【(2)有用吗】
如果用(4)+(3)+(2)-(1),得到NH4Cl(s)+NH3(g)+2H2O(l)=NH4Cl(aq)+NH3.H2O(aq),而非NH4Cl(s)+2H2O(l)=== NH4Cl(aq) 我是何未1年前1
我是何未1年前1 -
 xiong5 共回答了17个问题
xiong5 共回答了17个问题 |采纳率70.6%(2)NH3(g)+H2O(l)===NH3.H2O(aq) △H2=-35.1kJ/mol
(3)HCl(g) +H2O(l)===HCl(aq) △H3=-72.3kJ/mol(方程有问题?)
(2)和(3)都是溶解热的,是必要的1年前查看全部
- 一道盖斯定律的题已知常状态下,H2(g)+1/2O2(G)=H2O(G) H1=-241.8KJ/MOLH2O(G)=H
一道盖斯定律的题
已知常状态下,H2(g)+1/2O2(G)=H2O(G) H1=-241.8KJ/MOL
H2O(G)=H2O(I) H2=-44KL/MOL 试求4.48升氢气和氧气生成液态水所放出的热量 唐小牛牛1年前2
唐小牛牛1年前2 -
 danglin 共回答了18个问题
danglin 共回答了18个问题 |采纳率100%方程一加上方程二得:H2(G)+1/2O2(G)=H2O(L) H=-285.8KJ/MOL
4.48L=0.2MOL带人得Q=57.16KJ1年前查看全部
大家在问
- 1已知a,b均为单位向量,它们的夹角为60度,那么la+3bl=
- 2有一种树需要一种鸟吃种子用粪便帮他繁殖,后来鸟灭绝了,树也将灭绝.他们各是?
- 3关于求最大公约数算法的问题书上是说:1.输入m、n(m为被除数,n为除数)2.m/n得余数r.3.判断r=0?是的话n为
- 4售货员将两件衣服都卖了120元钱,结果一件赚了20%,另一件亏了20%.这位售货员是赚了还是赔了?
- 5河宽420m,船在静水中速度为4m/s,水流速度是3m/s,则船过河的最短时间为( )
- 6哪种矿泉水是最干净的、?
- 7五年级 解方程解方程2.8÷(5减x)=0.7
- 8有一种AB2C2型分子,在该分子中以A为中心原子,下列关于它的分子构型和有关同分异构体的各种说法正确的是( )
- 9he must be helping the old man to water the flowers,
- 10观《小学生安全教育视频》有感 作文
- 11你得等他多久的英文
- 12小强在一本180页的书中夹标本,从第1页数起每隔3页纸夹进一片树叶,这本书共夹进多少片树叶?
- 132013年广州二模理科综合物理部分第13题的A为什么不正确?
- 14感叹句What和Hao的用法举例子个一句
- 15请问一个因式分解的问题请问c^2+ac-b^2-ab=(a+b+c)(c-b)是怎么得出来的
