钙元素是人体必需的常量元素,所有的细胞都需要
 xiaoyu2222022-10-04 11:39:540条回答
xiaoyu2222022-10-04 11:39:540条回答钙元素。正常人体血液中含Ca2+为2.2×10-3~
2.7×10-3 mol·L-1。现抽取某人血样10 mL,稀释后
用草酸铵〔(NH4)2C2O4〕溶液处理,使Ca2+完全
转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得
到的沉淀用稀硫酸溶解,并用2.0 mL 5.0×10-3
mol·L-1 KMnO4溶液与其恰好完全反应。求此人血
液中Ca2+的浓度,并判断其血液中钙含量是否正
常。
(提示:2KMnO4+5H2C2O4+3H2SO4
——
2MnSO4+K2SO4+10CO2↑+8H2O)

已提交,审核后显示!提交回复
共0条回复
相关推荐
- 将3.6gCaCO3 高温煅烧后冷却,测得固体剩余物中钙元素的质量分数为57.6%.求固体剩余物中氧化钙的质量
 Ben_He1年前1
Ben_He1年前1 -
 s578312999 共回答了21个问题
s578312999 共回答了21个问题 |采纳率95.2%3.6克碳酸钙中钙元素质量为3.6克*40/100=1.44克
根据反应前后固体中钙元素质量是不变的,所以反应固体质量为1.44/57.6%=2.5克.,
所以反应后生成二氧化碳质量为3.6-2.5=1.1克
设生成氧化钙质量为X
CaCO3 =高温= CaO + CO2↑
56 44
X 1.1克
X=1.4克
亲,若满意请采纳 ,谢谢.1年前查看全部
- 将3.6克CaCO3高温煅烧一段时间后冷却,测得固体剩余物中钙元素的质量分数为57.6%,求固体剩余物中氧化钙的质量.(
将3.6克CaCO3高温煅烧一段时间后冷却,测得固体剩余物中钙元素的质量分数为57.6%,求固体剩余物中氧化钙的质量.(计算结果保留一位小数)
 飞飞来去1年前1
飞飞来去1年前1 -
 toto46536057 共回答了26个问题
toto46536057 共回答了26个问题 |采纳率92.3%解题思路:高温煅烧石灰石前后质量减少的质量为生成二氧化碳的质量,而反应前后的钙元素质量不变,根据碳酸钙中钙元素的质量和剩余物中钙元素的质量分数可求出剩余固体的总质量,然后根据质量守恒定律求出生成二氧化碳的质量,进而根据方程式求出氧化钙的质量.此反应没有完全煅烧,煅烧后的石灰石并不一定全部变成了氧化钙,所以,计算时只能根据生成的二氧化碳质量来确定氧化钙的量.则剩余固体的总质量=残留的碳酸钙质量+氧化钙质量.
3.6g碳酸钙中钙元素的质量为:3.6g×[40/40+12+16×3]=1.44g
∵固体剩余物中钙元素的质量分数为57.6%,
∴固体剩余物的质量=1.44g÷57.6%=2.5g
∴生成二氧化碳的质量=3.6g-2.5g=1.1g
设生成的氧化钙的质量为x,
CaCO3═CaO+CO2↑
56 44
x 1.1g
[56/44]=[x/1.1g]
x=1.4g
答:固体剩余物中氧化钙的质量为1.4g.点评:
本题考点: 碳酸钠、碳酸氢钠与碳酸钙;质量守恒定律及其应用;根据化学反应方程式的计算.
考点点评: 本题考查元素质量分数和化学方程式的综合计算.1年前查看全部
- 只有氢元素和钙元素,竜组成什么化合物?只有这两种元素
 山铜子1年前1
山铜子1年前1 -
 13671566372 共回答了26个问题
13671566372 共回答了26个问题 |采纳率96.2%氢化钙:CaH2
无色斜方晶系结晶;工业品为灰色,正交晶或粉末.对湿气敏感.在常温下与干燥空气、氮气、氯气均不反应,但在高温可与上述气体发生反应,分别生成氧化钙、碳化钙、氯化钙.遇水分解同时释放出氢气,也可与乙醇反应生成氢气和乙醇钙.对金属氧化物的还原作用比氢化钠或氢化锂更为强烈.
化学反应活性很高,遇潮气、水或酸类发生反应,放出氢气并能引起燃烧.与氧化剂、金属氧化物剧烈反应.遇湿气和水分生成氢氧化物,腐蚀性很强.
燃烧(分解)产物:氧化钙、水.氧化钙再与水产生反应,最终生成氢氧化钙.
化学方程式CaH2+O2==CaO+H2O CaO+H2O==Ca(OH)2
所以 总的化学方程式为 CaH2+O2==Ca(OH)2
另外,氢化钙与水的反应是:
CaH2+2H2O=Ca(OH)2+2H2↑
登山队员常用此反应制取氢气1年前查看全部
- 22g氯化镁、氯化钙和氯化钠组成的混合物中,含有镁元素1.2g,钙元素2g,混合物中钠元素与氯元素的质量比为( )
22g氯化镁、氯化钙和氯化钠组成的混合物中,含有镁元素1.2g,钙元素2g,混合物中钠元素与氯元素的质量比为( )
A. 23﹕35.5
B. 23﹕71
C. 23﹕142
D. 46﹕213 人鱼uusc1年前2
人鱼uusc1年前2 -
 zlei3866 共回答了17个问题
zlei3866 共回答了17个问题 |采纳率88.2%解题思路:根据物质中某元素的质量分数=[该元素的相对原子质量×原子个数/化合物的相对分子质量]×100%.
(1)由镁元素的质量求出氯化镁的质量,进而可求氯化镁中氯元素的质量;同理可求出氯化钙的质量和氯化钙中氯元素的质量;
(2)根据混合物总质量求出氯化钠的质量,然后分别求出氯化钠中氯元素和钠元素的质量;
(3)把三部分的氯元素质量相加就是混合物中氯元素中氯的质量,再和钠元素相比就可求出答案.(1)混合物中氯化镁的质量为x:x×[24/95]×100%=1.2 g 则x=4.75 g
氯化镁中氯元素的质量:4.75g×[71/95]×100%=3.55 g
混合物中氯化钙的质量 y:y×[40/111]×100%=2 g 则y=5.55 g
氯化钙中氯元素的质量为:5.55 g×[71/111]×100%=3.55g
(2)混合物总中氯化钠的质量为:22-4.75-5.55=11.7g,
氯化钠中氯元素的质量为:11.7g×[35.5/58.5]×100%=7.1g
钠元素的质量为:11.7g×[23/58.5]×100%=4.6g
(3)混合物中氯元素中氯的质量为:3.55+3.55+7.1=14.2g
混合物中钠元素与氯元素的质量比为:4.6g:14.2g=23:71
故选B.点评:
本题考点: 元素质量比的计算;物质组成的综合计算.
考点点评: 本题考查学生根据物质中某元素的质量分数进行综合分析解题的能力.1年前查看全部
- 用化学符号填空:2个氮原子 ___ ;2个氧分子 ___ ;2个镁离子 ___ ;+2价的钙元素 ___ .
 7755661年前7
7755661年前7 -
 果子1号 共回答了18个问题
果子1号 共回答了18个问题 |采纳率88.9%解题思路:根据原子的表示方法:用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.进行解答; 根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,进行解答;根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;进行解答;根据元素化合价的表示方法:在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,进行解答.根据原子的表示方法:用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.因此2个氮原子表示为:2N;
根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,因此2个氧分子表示为:2O2;
根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;因此2个镁离子表示为:2Mg2+;
根据元素化合价的表示方法:在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,因此+2价的钙元素表示为:
+2
Ca;
故答案为:2N;2O2;2Mg2+;
+2
Ca.点评:
本题考点: 化学符号及其周围数字的意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础.1年前查看全部
- 31.2g碳酸钙高温煅烧一段时间,冷却,测的剩余固体中含钙元素60%,求剩余固体中氧化钙的质量
 wtnpsdm1年前4
wtnpsdm1年前4 -
 大尾巴狼008 共回答了21个问题
大尾巴狼008 共回答了21个问题 |采纳率100%初中的题目
CaCO3中Ca%=40%
Cao中Ca%=71.4%
设分解的CaCO3的质量为x
CaCO3=CaO +CO2
100 56
x 56/100x
(31,2-x)×40%+ 56/100x ×71.4%=(31.2-x +56/100x)×60%
可以求出56/100x了1年前查看全部
- 某补钙品(有效成分为碳酸钙,其它成分不含钙元素)的说明中标明含钙量为30%.
某补钙品(有效成分为碳酸钙,其它成分不含钙元素)的说明中标明含钙量为30%.
李琳同学为了检验该产品,取l0g补钙品放入100g稀盐酸中,HCI与补钙品的有效成分刚好完全反应(其它成分不与盐酸反应).反应后剩余固体和液体的总质量比反应前减少了2.2g.求:(1)补钙品中实际含钙的质量分数是多少?(2)所用稀盐酸中溶质的质量分数是多少? gxfuq1年前1
gxfuq1年前1 -
 scouts 共回答了22个问题
scouts 共回答了22个问题 |采纳率95.5%反应后剩余固体和液体的总质量比反应前减少了2.2g——放出的二氧化碳的质量.
CaCO3+2HCl=CaCl2+H2O+CO2
100 73 44
X Y 2.2
X=5克;Y=3.65克.
(1)补钙品中实际含钙的质量分数=5*40/(100*10)=20%;
(2)所用稀盐酸中溶质的质量分数=3.65/100=3.65%.1年前查看全部
- 贝壳中含有大量的钙元素,钙元素在贝壳中以碳酸钙的形式存在.小美为了探究贝壳中钙元素的质量分数,称取了6克贝壳,研磨成粉放
贝壳中含有大量的钙元素,钙元素在贝壳中以碳酸钙的形式存在.小美为了探究贝壳中钙元素的质量分数,称取了6克贝壳,研磨成粉放入烧杯中,然后逐滴滴加稀盐酸,并不断搅拌,至刚好完全反应(假设杂质不溶于水,也不与盐酸反应).共用去稀盐酸24克,此时称得杯内物质质量为27.8克(溶于水的二氧化碳忽略不计,计算结果保留至小数点后一位).
⑴不用其他试剂,你如何判断贝壳与稀盐酸刚好完全反应的依据为__________________________________________________________.
⑵反应过程中生成二氧化碳的质量为________________g.
⑶贝壳中钙元素的质量分数是多少?(写出计算过程)(最好一步一步写清楚.) 紫星云儿1年前1
紫星云儿1年前1 -
 jixuchenharbor 共回答了15个问题
jixuchenharbor 共回答了15个问题 |采纳率93.3%1、把溶液分成两份:一份加入贝壳,另一份加入盐酸,均气体产生表明反应完全.
2、根据质量守恒定律,从烧杯中跑出的全是CO2,也只有CO2
所以,m(CO2)=6+24-27.8=2.2g
3、CaCO3+2HCl===CaCl2+H2O+CO2
40 44
x 2.2g
x=40*2.2/44=2g
w(Ca)=2/6*100%=33.3%1年前查看全部
- 海水中的化学 海水中含量最多的金属离子是含量最多的酸根离子是海水中钙元素的质量分数海水盐分中含量最多的非金属元素与质量分
海水中的化学
海水中含量最多的金属离子是
含量最多的酸根离子是
海水中钙元素的质量分数
海水盐分中含量最多的非金属元素与质量分数为百分之3.96的金属元素形成化合物的化学式 取个名字更难1年前1
取个名字更难1年前1 -
 yoyouhu 共回答了10个问题
yoyouhu 共回答了10个问题 |采纳率90%1.钠离子
2.氯离子
3.?
4.?1年前查看全部
- 是不是含有钙元素的物质都可以补钙
 eeee真温暖1年前3
eeee真温暖1年前3 -
 561chengang 共回答了15个问题
561chengang 共回答了15个问题 |采纳率93.3%当然不是
道理上都能提供钙元素
但如果阴离子有毒,还能吃吗?
常用的补钙剂一般是:碳酸钙、乳酸钙、氨基酸螯合钙、葡萄糖酸钙
像硝酸钙什么的,你敢吃吗?1年前查看全部
- 多少克氧化钙中含有的钙元素和9克水中含有的钙元素质量相等?
 今无果来无续1年前1
今无果来无续1年前1 -
 晴旺 共回答了19个问题
晴旺 共回答了19个问题 |采纳率94.7%水中没有钙元素谢谢1年前查看全部
- 钙元素的原子结构示意图的第三电子层上为什么只排8个电子,而不是10个呢?
 1120601年前1
1120601年前1 -
 冰灯娃娃 共回答了14个问题
冰灯娃娃 共回答了14个问题 |采纳率85.7%每一个电子层所能排列的电子最多为2n+2个.且最后一个电子层的电子数不能超过8个,因为8个电子视为稳定结构~(N久没接触化学了,希望没有误人子弟)1年前查看全部
- 高温加热10g碳酸钙,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%.求碳酸钙分解的百分率?
 知足常乐81年前1
知足常乐81年前1 -
 蘼蘼 共回答了15个问题
蘼蘼 共回答了15个问题 |采纳率86.7%原碳酸钙中的钙元素质量为10g×40%=4g
剩余固体质量为 4g÷50%=8g
碳酸钙分解的百分率8g÷10g*100%=80%1年前查看全部
- 高温加热10g碳酸钙,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%.此时反应生成的二氧化碳质量为( )
高温加热10g碳酸钙,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%.此时反应生成的二氧化碳质量为( )
A. 4.4克
B. 2克
C. 2.4克
D. 4克 莂来1年前1
莂来1年前1 -
 dzy_yun 共回答了18个问题
dzy_yun 共回答了18个问题 |采纳率88.9%解题思路:根据化学变化前后元素质量不变,可得反应前后固体物质中钙元素的质量相等,由反应前碳酸钙中所含量钙元素的质量及反应后固体中钙元素的质量分数可计算反应后所得固体的质量,然后使用质量守恒定律,反应前后固体的质量差即为分解过程放出二氧化碳气体的质量.原碳酸钙10g中的钙元素质量为:10g×[40/40+12+16×3]×100%=4g,反应前后钙元素质量不变,则剩余固体中钙元素质量仍为4g,则含钙50%的剩余固体质量=4g÷50%=8g
根据质量守恒定律,反应生成二氧化碳的质量=10g-8g=2g
分析所给的选项可以知道选项B是正确的.
故选:B.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 灵活地运用质量守恒定律,对于解答本题尤为重要,.考查了对质量守恒定律的理解与应用1年前查看全部
- 高温加热10 g碳酸钙,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%.
高温加热10 g碳酸钙,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%.
实际反应生成的二氧化碳是多少克?
不要百度上的答案,不懂. asdf5188181年前1
asdf5188181年前1 -
 紫晶逸梦 共回答了22个问题
紫晶逸梦 共回答了22个问题 |采纳率81.8%10g CaCO3中Ca的质量 = CaCO3质量×钙元素质量分数 = 10g×40% = 4 g
加热后固体质量 = 钙元素的质量÷钙元素的质量分数 = 4 g÷50% = 8 g
根据质量守恒定律,二氧化碳质量=10 g - 8 g=2g1年前查看全部
- 钙元素的质量分数为了测定此严重钙元素的的含量,取10g该盐溶于水中,加入足量盐酸,放出的气体在标准状况下的体积为6.72
钙元素的质量分数
为了测定此严重钙元素的的含量,取10g该盐溶于水中,加入足量盐酸,放出的气体在标准状况下的体积为6.72ml.式计算此加钙食盐中的钙元素的质量分素 xl6271年前1
xl6271年前1 -
 醉里-挑灯-看剑 共回答了19个问题
醉里-挑灯-看剑 共回答了19个问题 |采纳率84.2%根据化学式得知Ca的物质的量和气体的一样,则n=0.00672/22.4
那么m=n*M =40*(0.00672/22.4)
w=m/10=0.12%1年前查看全部
- 关于金属化学性质的问题新买来的铝锅,凡是水浸到的地方都会变黑,说明水中有()A,钾元素,B钠元素,C钙元素,D铁元素,请
关于金属化学性质的问题
新买来的铝锅,凡是水浸到的地方都会变黑,说明水中有()
A,钾元素,B钠元素,C钙元素,D铁元素,请问为什么, zkzpj1年前2
zkzpj1年前2 -
 fionafang0518 共回答了12个问题
fionafang0518 共回答了12个问题 |采纳率91.7%选D
首先根据活动性顺序,铝把铁从其盐溶液中置换出来,单质铁与水蒸汽反应生成黑色的四氧化三铁附着在容器表面,一段时间后就出现上述现象.
说明:通常的水中含较多的钙/镁离子,仅含少量的其他金属离子.1年前查看全部
- 用化学符号表示十2价的钙元素
 希望天晴1年前1
希望天晴1年前1 -
 darbtextile 共回答了16个问题
darbtextile 共回答了16个问题 |采纳率100%在还元素的正上方写+21年前查看全部
- 用符号表示正二价的钙元素关于化学式的
 手机51个1年前4
手机51个1年前4 -
 世纪青蛙 共回答了19个问题
世纪青蛙 共回答了19个问题 |采纳率100%Ca+21年前查看全部
- 氧化钙中正二价的钙元素的符号
 zz青鸟cp1年前4
zz青鸟cp1年前4 -
 sp2020 共回答了20个问题
sp2020 共回答了20个问题 |采纳率90%+2
Ca1年前查看全部
- 初2下.科学题目人体缺钙容易产生骨质疏松症,每天服用某种钙片5片(每片1克)可以补充钙元素0.4克,已知该钙片的有效成分
初2下.科学题目
人体缺钙容易产生骨质疏松症,每天服用某种钙片5片(每片1克)可以补充钙元素0.4克,已知该钙片的有效成分是葡萄糖酸钙其化学式为(C6H11O7)2Ca,回答下面的问题.
(1)每片钙片中含葡萄糖酸钙的质量分数为多少?
请列出标准的计算格式.懂的请回答.
问题(1) 忘记补上了, sd8807251年前1
sd8807251年前1 -
 Anson_su 共回答了18个问题
Anson_su 共回答了18个问题 |采纳率83.3%(C6H11O7)2Ca的相对分子质量为:430
Ca占(C6H11O7)2Ca的百分数为:4/43
五片钙片补0、4g,每片补0、08g,即每片钙片含钙量为0、08g.
那么,每片钙片里含(C6H11O7)2Ca为0、08/(4/43)=0、86g
每片钙片为1g,即含葡萄糖酸钙的质量分数为86%1年前查看全部
- 如图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图.请回答:
如图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图.请回答:
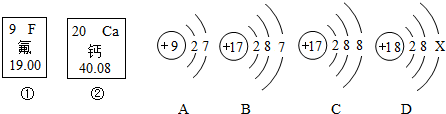
(1)氟元素的相对原子质量为1919,钙元素的原子序数为2020,X=88.
(2)A、B、C、D属于同种元素的粒子是(填序号)BCBC.
(3)若F与Ca元素的化合价分别为-1、+2价,则它们形成化合物的化学式是CaF2CaF2.
(4)元素的化学性质主要由最外层电子数决定,A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似(填序号)BB. westlife2581年前1
westlife2581年前1 -
 hongshen2000 共回答了22个问题
hongshen2000 共回答了22个问题 |采纳率95.5%解题思路:(1)根据氟元素、钙元素在元素周期表中的信息,进行解答;关于x可根据在原子中,原子序数=质子数=核电荷数=核外电子数,进行解答;
(2)根据元素的种类由质子数决定,进行解答;
(3)依据化合物中各元素化合价代数和是零,结合化学式书写的要求书写.
(4)根据元素的化学性质跟它的原子的最外层电子数目有关,最外层电子数相同的元素化学性质相似,进行解答.(1)根据氟元素、钙元素在元素周期表中的信息,可知氟元素的相对原子质量为19.00,钙元素的原子序数为20;根据在原子中,原子序数=质子数=核电荷数=核外电子数,可得18=2+8+x,则x=8;故答案为:19.00;20;8;
(2)根据元素的种类由质子数决定,因为BC的质子数相同,所以BC属于同种元素的粒子;故答案为:BC;
(3)利用化合价以及对化学式书写的注意事项完成化学式的书写.故答案为:CaF2
(4)根据元素的化学性质跟它的原子的最外层电子数目有关,最外层电子数相同的元素化学性质相似,A粒子的化学性质与B粒子化学性质相似.故选B.点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;原子结构示意图与离子结构示意图;元素的概念;化学式的书写及意义.
考点点评: 本题考查学生对元素的种类由质子数决定及在原子中,原子序数=质子数=核电荷数=核外电子数知识在解题中的应用.1年前查看全部
- (6011•杨浦区二模)某省生产的某种钙盐的配料表如下:氯化钠、食用碳酸钙、碘酸钾.为了测定此盐中的钙元素含量,取10g
(6011•杨浦区二模)某省生产的某种钙盐的配料表如下:氯化钠、食用碳酸钙、碘酸钾.为了测定此盐中的钙元素含量,取10g这种盐溶于水,加入足量盐酸,生成0.006mol二氧化碳.请计算:
(1)在盐酸中参加化学反应的H口l的物质的量.
(6)此加钙食盐中钙元素的质量分数. laomaoajia1年前1
laomaoajia1年前1 -
 牙膏13 共回答了24个问题
牙膏13 共回答了24个问题 |采纳率87.5%解题思路:根据碳酸钙与盐酸反应的化学方程式和生成的二氧化碳的摩尔数,即可计算出参与反应的盐酸、碳酸钙的物质的量;然后计算出钙元素的质量,根据“[钙元素的质量/10g]×100%”计算出此加钙食盐中钙元素的质量分数.设参加反应十HCl物质十量为x,食用碳酸钙十物质十量是z.
CaCO1+2HCl→CaCl2+H2O+CO2↑
121
zx0.001mol
(1)则[2/x]=[1/0.001mol]
解得,x=0.00四mol,
(2)[1/z]=[1/0.001mol],
z=0.001mol,
所以,m(CaCO1)=0.001moL×100g/mol=0.1g
m(Ca)=0.1g×[40/100]×100%=0.12g
此加钙食盐中钙元素十质量分数=[0.12g/10g]×100%=1.2%;
答:(1)在盐酸中参加化学反应十HCl十物质十量是0.00四mol.
(2)此加钙食盐中钙元素十质量分数是1.2%.点评:
本题考点: 根据化学反应方程式的计算;化合物中某元素的质量计算.
考点点评: 本题主要考查含杂质物质的化学方程式计算和质量分数的计算,难度较大.解题时要注意计算的步骤规范和计算的准确性.1年前查看全部
- 某石灰石样品中,钙元素的质量分数为25%,求该样品中碳酸钙的质量分数?(杂质中不含
某石灰石样品中,钙元素的质量分数为25%,求该样品中碳酸钙的质量分数?(杂质中不含
杂质中不含钙 两种方法(公式法和比例法) 灵宝宝1年前1
灵宝宝1年前1 -
 坦白男孩 共回答了13个问题
坦白男孩 共回答了13个问题 |采纳率100%1、公式法:
解碳酸钙中钙元素的质量分数为40/(40+12+16*3)=40%
设该样品的质量为m,其中含量碳酸钙的质量m1
w=m1/m=(25%m÷40%)/m=62.5%
2、比例法
解设该样品的质量为m,其中含量碳酸钙的质量分数为b
25%m=m ×b ×40/100
b=62.5%1年前查看全部
- 初三化学方程式计算题150g 碳酸钙高温煅烧一段时间后,测得剩余固体中钙元素的质量分数为46.875%,求碳酸钙的分解率
 烂电吉他1年前1
烂电吉他1年前1 -
 天1涯剑客 共回答了20个问题
天1涯剑客 共回答了20个问题 |采纳率90%设分解的碳酸钙的质量为X
150克碳酸钙中含钙元素的质量=150g*40/100*100%=60g
剩余固体的质量=60g/46.875%=128g
根据质量守恒定律得生成二氧化碳的质量=150g-128g=22g
CaCO3 =高温 =CaO + CO2↑
100 44
X 22g
100:44=X:22g
X=50g
碳酸钙的分解率=50g/150g*100%=33.3%
答:碳酸钙的分解率33.3%1年前查看全部
- 某钙片的标签如图,且知此钙片成分中只有碳酸钙含有钙元素.1.请通过计算说明此标签中的含钙量是错误的
某钙片的标签如图,且知此钙片成分中只有碳酸钙含有钙元素.1.请通过计算说明此标签中的含钙量是错误的

2.为了测定其真实的含钙量,小东每次取10片钙片放入已称量的含足量稀盐酸的烧杯中,充分反应后再称取烧杯和剩余物的总质量,小东做了三次实验数据如下表﹕
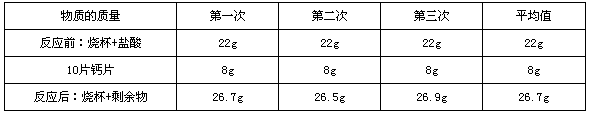
①请计算每片此钙片含碳酸钙的质量?
②请列式计算每片此钙片的含钙量,并建议厂家如何修改标签?
 gdqbzs1年前1
gdqbzs1年前1 -
 bleep 共回答了20个问题
bleep 共回答了20个问题 |采纳率95%1、每瓶50片,重40克,则每片0.8克,而碳酸钙中钙的质量分数为40%,所以每片中钙的含量最多为0.32克,标签中明显错误
2、由实验数据知,溢出的CO2的质量为3.3克
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
100 44
x 3.3
可以算出参加反应的碳酸钙7.5克
则钙片中碳酸钙的含量=7.5/8=93.75%
故每片中含碳酸钙的质量=0.8 X 93.75%=0.75克
则每片中含钙的质量=0.75 X 40%=0.3克1年前查看全部
- Ⅰ.小明在一次作业中出现如下几个错误:①氧化铝(AlO)②钙元素(Cu) ③镁离子(Mg+2)④氧化铁(Fe3
Ⅰ.小明在一次作业中出现如下几个错误:①氧化铝(AlO)②钙元素(Cu) ③镁离子(Mg+2)④氧化铁(Fe3O4),请你任选三个错误帮他订正.
(1)______.
(2)______.
(3)______.
Ⅱ.用H、Cl、C、Na、O五种元素组成符合下列要求的化学式:
(1)食盐的成分______;
(2)天然气的主要成份______;
(3)汽水中一种酸______. 奇克11年前1
奇克11年前1 -
 ender945 共回答了17个问题
ender945 共回答了17个问题 |采纳率100%解题思路:I.①化合物中各元素的化合价代数和为零.
②利用对元素符号的记忆判断书写即可.
③离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后;
II.物质的性质决定物质的用途,根据所学知识判断物质的成分,并根据化合价书写有关的化学式.I.(1)①已知铝元素的化合价为+3价,氧元素的化合价为-2价,标注化合价
+3
Al
−2
O,利用化合价数值交叉法书写化学式为A1203,故AlO改为Al2O3.
②铜与钙的元素符号第一个字母相同,第二个字母小写不同,铜是u,钙是a,故钙元素(Cu)因改为Ca
③离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,故镁离子:Mg+2改为Mg2+;
故答案为:①AlO改为Al2O3;②钙元素(Cu)改为Ca;③Mg+2改为Mg2+;
II.:(1)食盐的成分是氯化钠.(2)天然气的主要成分是甲烷.(3)汽水中的二氧化碳主要是以碳酸的方式存在.
故答案为:NaCl;CH4;H2CO3.点评:
本题考点: 化学符号及其周围数字的意义;化学式的书写及意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号的书写,熟记常见元素的符号及化合价是解题的必要条件.1年前查看全部
- 氢化钙 是怎么回事 氢元素和钙元素的化合价分别是多少
 chenlei21nt1年前4
chenlei21nt1年前4 -
 林林彼岸 共回答了26个问题
林林彼岸 共回答了26个问题 |采纳率96.2%活泼金属可以和H形成金属氢化物,
比如 NaH,KH,BaH2 等等
里面的H 都是 -1价的 ,金属是正价的 ,比如CaH2 中Ca +2 价,H -1价
形成原因是 Ca,Na等元素太容易失去电子了.1年前查看全部
- 100g某大理石样品(杂质中不含钙元素)中不含有80g碳酸钙固体.钙元素在大理石样品中的质量分数是多少?
100g某大理石样品(杂质中不含钙元素)中不含有80g碳酸钙固体.钙元素在大理石样品中的质量分数是多少?
则100g该大理石中含有钙元素多少?
第一问是不是M(Ca)=100×40/125=32?
后天期中考试了 2532970221年前1
2532970221年前1 -
 whoiszippo 共回答了18个问题
whoiszippo 共回答了18个问题 |采纳率94.4%钙元素的质量 = 碳酸钙的质量 × 碳酸钙中Ca的质量分数 = 80 g × 40/100 = 32 g
钙元素在大理石样品中的质量分数 = 32/100 = 32%
即32%1年前查看全部
- 用化学符号表示:四个氖原子______,钙元素______,两个硫原子______,三个氯原子______,一个铝原子_
用化学符号表示:四个氖原子______,钙元素______,两个硫原子______,三个氯原子______,一个铝原子______,碳元素______两个氧离子______,一个钠离子______.
 amoretti1年前2
amoretti1年前2 -
 夜色bj 共回答了19个问题
夜色bj 共回答了19个问题 |采纳率89.5%解题思路:本题主要考查元素符号的意义和书写规则,以及离子符号的写法,要根据书本所学习的书写规定,进行合理分析应用.Ne表示氖元素,也表示一个氖原子,四个氖原子,就要在元素符号左边加4,即4Ne,以此类推可得出:两个硫原子为2S,三个氯原子为3Cl,一个铝原子为Al;
钙元素为Ca,碳元素为C;
氧离子带2个单位负电荷,其符号为O2-,那么两个氧离子为2O2-,钠离子的符号为Na+;
故答案是:4Ne、Ca、2S、3Cl、Al、C、2O2-、Na+.点评:
本题考点: 元素的符号及其意义;化合价与离子表示方法上的异同点.
考点点评: 本题比较简单,但许多学生容易把离子电荷的位置写错,和化合价弄混淆了,要注意辨别,还有的不知离子电荷为多少,一般地金属形成阳离子,非金属形成阴离子,离子电荷与该元素的化合价数值有等量关系,但它们的标写的位置不同,顺序不同,表达的含义不同.1年前查看全部
- 用化学符号表示:(1)钙元素(2)2个氢离孑(3)3个硫原孑(4)3个过氧化氢分孑
 dsfgbdsfgjk1年前0
dsfgbdsfgjk1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知葡萄糖酸钙化学式【Ca(C6H11O7)2】 若一人每天需要0.4克钙元素,则每天需要服用几支葡萄糖酸钙
 恨水_无情1年前2
恨水_无情1年前2 -
 接龙452 共回答了15个问题
接龙452 共回答了15个问题 |采纳率100%三精的葡萄糖酸钙口服液的药物制剂规格为:
10ml一支,每1ml含有葡萄糖酸钙100mg.
那么求出葡萄糖酸钙中的含钙量w%=40/235=17.02%,
则每一支葡萄糖酸钙口服液的含钙量为m=10*100mg*w%=1000*17.02%=170.2mg,
已知人每天需要400mg的钙,那么需要400/170.2=2.35支,那么就是2~3支1年前查看全部
- 如图中的①、②分别是氟元素、钙元素在元素周期表中的信息,A、B、C、D分别是四种粒子的结构示意图.请你回答:
如图中的①、②分别是氟元素、钙元素在元素周期表中的信息,A、B、C、D分别是四种粒子的结构示意图.请你回答:
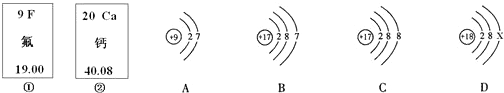
(1)氟原子的核电荷数为______,钙元素的相对原子质量为______,X=______.
(2)A、B、C、D中属于同种元素的粒子是______(填序号). 蒙果果1年前1
蒙果果1年前1 -
 h5xd15k 共回答了16个问题
h5xd15k 共回答了16个问题 |采纳率87.5%解题思路:根据原子中核电荷数=质子数=核外电子数以及依据元素周期表的信息分析获得的信息来完成解答;根据原子中质子数=电子数判断x的值,根据元素的定义来完成元素种类的解答.(1)根据原子中核电荷数=质子数=核外电子数可以知道氟原子的核电荷数为9,依据元素周期表的信息分析可以知道钙元素的相对原子质量为40.08;根据原子中质子数=电子数可以判断:18=x+8+2,所以x=8;
(3)根据元素的定义可以知道元素是指含有相同质子数的一类元素的总称,所以可以判断B和C为同种元素.
故答案为:(1)9;40.08;8;(3)BC.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 了解元素周期表的特点及其应用,掌握元素的概念:具有相同核电荷数(即质子数)的一类原子总称,以及原子的结构特点是解题的关键.1年前查看全部
- 如图是钙元素在元素周期表中的相关信息及钙原子结构示意图,请根据信息回答问题:
如图是钙元素在元素周期表中的相关信息及钙原子结构示意图,请根据信息回答问题:
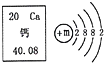
(1)钙元素的相对原子质量是______;
(2)钙原子在化学反应中易______(选填“得”或“失”)电子;
(3)钙原子的结构示意图中,m的数值是______.
(4)与图中化学性质相似的是______.
 寻找远去的家园1年前1
寻找远去的家园1年前1 -
 快乐开心把钱赚 共回答了26个问题
快乐开心把钱赚 共回答了26个问题 |采纳率92.3%解题思路:如图是钙元素在元素周期表中的相关信息及钙原子结构示意图,则可知:钙元素的相对原子质量、得失电子情况、根据“原子序数=核内质子数=核外电子数=核电荷数”,可求m的数值.根据最外层电子数决定元素化学性质来进行分析解答.(1)由钙元素在元素周期表中的相关信息,可知钙元素的相对原子质量是40.08;
(2)由钙元素的原子结构示意图,则可知:最外层电子数为2,钙原子在化学反应中易失电子;
(3)根据“原子序数=核内质子数=核外电子数=核电荷数”,故钙原子的结构示意图中,m的数值是2+8+8+2=20;
(4)钙原子最外层有2个电子,在化学反应中易失去最外层的2个电子而形成阳离子;A只有一个电子层,有2个电子,已经是稳定结构;B最外层是8个电子,已经是稳定结构;C最外层有2个电子,在化学反应中易失去最外层的2个电子而形成阳离子;D最外层是8个电子,已达到稳定结构.故选C.
故答案为:(1)40.08;(2)失;(3)20;(4)C.点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;原子结构示意图与离子结构示意图.
考点点评: 解元素周期表的特点及其应用;核外电子在化学反应中的作用;了解原子结构示意图与离子结构示意图的特点.1年前查看全部
- (2012•湛江)漂白粉的主要成分是Ca(ClO)2和CaCl2,其中钙元素的化合价是+2,氧元素的化合价是-2,则Ca
(2012•湛江)漂白粉的主要成分是Ca(ClO)2和CaCl2,其中钙元素的化合价是+2,氧元素的化合价是-2,则Ca(ClO)2中氯元素的化合价是( )
A.-1
B.+1
C.+5
D.+7 rj45man1年前1
rj45man1年前1 -
 wenrou 共回答了24个问题
wenrou 共回答了24个问题 |采纳率87.5%解题思路:根据化合物中正负化合价的代数和为0进行解答.Ca(ClO)2中Ca元素化合价为+2价,氧元素为-2价,设氯元素化合价为x,根据正负化合价的代数和为0可得:+2+2x-2×2=O,得x=+1.
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零进行计算化合物中指定元素的化合价的能力.1年前查看全部
- 缺钙能导致儿童发育不良或佝偻病.某同学从食物中摄入钙元素不足,每天需要服用1片某种钙片.
缺钙能导致儿童发育不良或佝偻病.某同学从食物中摄入钙元素不足,每天需要服用1片某种钙片.
该钙片标签的部分内容如图1-15(钙片中只有碳酸钙含有钙元素),小明每天从钙片中设摄入钙元素的质量为多少克?----------八年级下科学作业本
...都迟了,科学老师校对了 夜上淡妆1年前1
夜上淡妆1年前1 -
 佯睡的小鱼 共回答了19个问题
佯睡的小鱼 共回答了19个问题 |采纳率89.5%0.3g
各元素的相对原子质量:O-16,C-12,Ca-40
CaCO3的相对分子质量:40*1+12*1+16*3=100
所以Ca的质量:7.5*40/100=0.3
每片钙片中可摄入的钙的质量 = 0.75g * (40/100*100%) = 0.3g
在化学中,因为化学不是用国际单位位,所以中学化学中,每部计算都要带上单位.上面的算式中,40/100*100%表示碳酸钙中含钙的质量分数.1年前查看全部
- 食品安全问题与人类生活息息相关.下列做法不会危害人体健康的是( ) A.牛奶中加入适量乳酸钙补充钙元素 B.香肠中加入
食品安全问题与人类生活息息相关.下列做法不会危害人体健康的是()
A.牛奶中加入适量乳酸钙补充钙元素 B.香肠中加入过量亚硝酸钠防腐 C.用硫酸铜溶液泡粽叶,使粽叶变得鲜绿 D.大量添加面粉增白剂使面粉更白  陌离1年前1
陌离1年前1 -
 网名叫dada 共回答了16个问题
网名叫dada 共回答了16个问题 |采纳率87.5%A
1年前查看全部
- 钙元素跟氧化合生成的物质化学式是?镁原子和氯原子组成的化合物的化学式是?
钙元素跟氧化合生成的物质化学式是?镁原子和氯原子组成的化合物的化学式是?
这种题有什么规律吗? 夏日的梦想1年前4
夏日的梦想1年前4 -
 urmsshine2 共回答了19个问题
urmsshine2 共回答了19个问题 |采纳率84.2%钙元素跟氧化合生成的物质化学式是:CaO
镁原子和氯原子组成的化合物的化学式是:MgCl2
规律:
氧一般-2价
氯一般-1价
钙镁都是+2价
以后做多了就知道了,不必心急1年前查看全部
- 钙元素是人体必需的常量元素,正常人血液中Ca2+的浓度为2.2*10-3—2.7*10-3mol/L.已知2KMnO4+
钙元素是人体必需的常量元素,正常人血液中Ca2+的浓度为2.2*10-3—2.7*10-3mol/L.已知2KMnO4+5H2C2O4+3H2SO4====2MnO4+K2SO4+10CO2↑+8H2O.现抽取某人血样20ml.稀释后用草酸铵【(NH4)2C2O4】溶液处理,使Ca+完全转化为草酸钙(CaC2O4)沉淀;过滤.洗涤.将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4);用溶解到的草酸与2.0ml 5.0*10-3mol/L KMnO4溶液恰好完全反应.根据以上信息,求此人血液中钙离子浓度,并判断其血液含钙量是否正常?
 dearok1年前3
dearok1年前3 -
 zhaxi_15 共回答了17个问题
zhaxi_15 共回答了17个问题 |采纳率94.1%2KMnO4+5H2C2O4+3H2SO4====2MnO4+K2SO4+10CO2↑+8H2O
计算关系式如下:
5Ca2+ 5H2C2O4 2KMnO4
5mol 5mol 2mol
x 2*10^-3*5.0*10-3mol
x=2.5*10-5mol m(Ca2+)=2.5*10-5/0.020=1.25*10-3mol/L 所以此人血液中含钙量不正常1年前查看全部
- 缺钙会导致儿童发育不良.某小孩从食物中摄入钙元素的量不足,每天需要服用2片某种钙片.该钙片标签的部分内容如图所示(假设钙
 缺钙会导致儿童发育不良.某小孩从食物中摄入钙元素的量不足,每天需要服用2片某种钙片.该钙片标签的部分内容如图所示(假设钙片中只有碳酸钙含有钙元素),请计算:
缺钙会导致儿童发育不良.某小孩从食物中摄入钙元素的量不足,每天需要服用2片某种钙片.该钙片标签的部分内容如图所示(假设钙片中只有碳酸钙含有钙元素),请计算:
(1)碳酸钙的相对分子质量______
(2)碳酸钙中Ca、C、O三种元素的质量比为______;
(3)碳酸钙中钙元素的质量分数为______;
(4)如果该小孩改用喝牛奶(每100ml牛奶中含钙0.10g)来补充钙,每天至少需要喝多少毫升牛奶? keobergh1年前1
keobergh1年前1 -
 风之低语 共回答了13个问题
风之低语 共回答了13个问题 |采纳率76.9%解题思路:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和来分析;
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(3)根据化合物中元素的质量分数的计算方法进行分析解答.
(4)根据每天需要喝的牛奶中含钙量=每天所吃的钙片中钙元素的质量来回答.(1)碳酸钙的相对分子质量是40+12+16×3+16=100;故填:100;
(2)碳酸钙中钙、碳、氧元素的质量比为:40:12:(16×3)=40:12:48=10:3:12;故填:10:3:12;
(3)碳酸钙中钙元素的质量分数为
40
40+12+16×3×100%=40%;故填:40%;
(4)根据每天需要喝的牛奶中含钙量=每天所吃的钙片中钙元素的质量,设:每天至少需要喝牛奶的体积为V,则
0.1V
100g=0.25g×2×40%
V=200mL
故答案为:200mL.点评:
本题考点: 标签上标示的物质成分及其含量;相对分子质量的概念及其计算;元素质量比的计算;元素的质量分数计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2010•厦门)钙元素是人必需的常量元素,正常人每升血液含钙88~108mg.现按下列步骤测定某血样的含钙量:
(2010•厦门)钙元素是人必需的常量元素,正常人每升血液含钙88~108mg.现按下列步骤测定某血样的含钙量:
①取血样10mL,将血样中的钙元素全部转化到CaC2O4中;
②用稀硫酸处理CaC2O4,化学方程式为:CaC2O4+H2SO4=CaSO4+H2C2O4;
③测得上一反应所得H2C2O4的质量为2.25mg.
计算并判断(要求写出计算过程):
(1)每10mL该血样可转化生成的CaC2O4质量.
(2)每升该血样中钙元素的质量,并判断该血样含钙量是否正常. zz_pp1年前1
zz_pp1年前1 -
 sunjigao 共回答了19个问题
sunjigao 共回答了19个问题 |采纳率84.2%解题思路:(1)根据H2C2O4的质量利用化学方程式计算CaC2O4质量;
(2)根据质量守恒定律,由CaC2O4质量计算出Ca的质量,与正常血液含钙量比较,得出结论.(1)10mL血液转化成的CaC2O4的质量为x
CaC2O4+H2SO4=CaSO4+H2C2O4
128 90
x 2.25mg
128:x=90:2.25mg
x=3.2mg
(2)3.2mgCaC2O4中Ca质量=3.2mg×
40
128×100%=1.0mg
每升血样中Ca质量=(1000/10)×1.0mg=100mg
∵88mg<100mg<108mg
∴该血样含钙量正常.
答:10mL血液转化生成的CaC2O4质量为3.2mg,每升该血样含钙元素100mg,该血样钙含量正常.点评:
本题考点: 根据化学反应方程式的计算;化合物中某元素的质量计算.
考点点评: 本题考查化学方程式的计算,要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等,结合所学的相关知识和技能,进行认真解答即可.1年前查看全部
- 某品牌补钙药品的部分说明书如图所示.若人体对该药品中钙的平均吸收率为30%,按照说明书服用,每天实际被人体吸收的钙元素质
 某品牌补钙药品的部分说明书如图所示.若人体对该药品中钙的平均吸收率为30%,按照说明书服用,每天实际被人体吸收的钙元素质量为______.
某品牌补钙药品的部分说明书如图所示.若人体对该药品中钙的平均吸收率为30%,按照说明书服用,每天实际被人体吸收的钙元素质量为______.  pushuyp1年前1
pushuyp1年前1 -
 mqzfj 共回答了20个问题
mqzfj 共回答了20个问题 |采纳率90%解题思路:由题意,每片含1.5gCaCO3,每次一片,每天2次,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,若人体对该药品中钙的平均吸收率为30%,据此进行分析解答.由题意,每片含1.5gCaCO3,每次一片,每天2次,则每天服用的碳酸钙的质量为:1.5g×2=3g,其中含钙元素的质量为3g×[40/40+12+16×3]×100%=1.2g;若人体对该药品中钙的平均吸收率为30%,则按照说明书服用,每天实际被人体吸收的钙元素质量是1.2g×30%=0.36g.
故答案为:0.36g.点评:
本题考点: 化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- 某钙片的标签如下,且知此钙片成份中只有碳酸钙含有钙元素.
某钙片的标签如下,且知此钙片成份中只有碳酸钙含有钙元素.
┌———————————————————┐
│ 主要成分:碳酸钙 │
│含钙量:每片含钙0.75g,每瓶50片,重40g│
└———————————————————┘
①请通过计算说明此标签中的含钙量是错误的.
②若经测定该钙片每片含碳酸钙的量为0.75g,请通过计算建议厂家如何改 标签中的含钙量. 溶溶月的似水流年1年前1
溶溶月的似水流年1年前1 -
 todaisl 共回答了13个问题
todaisl 共回答了13个问题 |采纳率76.9%1) 因为0.75乘以50不等于40,所以是错误的.2)因为0.75乘以50=37.5,所以可将标签中的含钙量改为381年前查看全部
- 初三化学提求解拜托了各位 谢谢如图,为某加钙食盐包装袋上的标签.小明通过下列方法检查该食盐中的钙元素的含量;往装有稀硝酸
初三化学提求解拜托了各位 谢谢
如图,为某加钙食盐包装袋上的标签.小明通过下列方法检查该食盐中的钙元素的含量;往装有稀硝酸的小烧杯(总质量为200g)加入30g的该盐样品,充分反应后,无固体剩余,反应后烧杯和溶液的总质量为229.67g. (方程式: CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑) 图: 配料表:氯化钠、食用碳酸钙、碘酸钾 净含量:500g 成分表:氯化钠≥95% 钙(以Ca计)(0.3-1.3)% 碘(以I计)(20-50)mg/kg 问题: (1)反应过程中产生 gCO2? (2)30g该食盐中含碳酸钙的质量为多少? (3)此加钙食盐含量是否符合标签要求? (请给出化学方程式,当然咯,有解说就更好啦.)!
 singlefox1年前1
singlefox1年前1 -
 zirantiankong 共回答了17个问题
zirantiankong 共回答了17个问题 |采纳率88.2%1)根据质量守恒定律mCO2=200.00g+30.00g-229.67g=0.33g 设该食盐中含碳酸钙的质量为xg CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O 100 44 x 0.33g 100/44=x/0.33g 所以x=0.75g 答:30.00g食盐中含碳酸钙质量为0.75g 3)加钙食盐钙元素的质量分数=(0.75X40/100)/30.00g=1.0% 所以此加钙食盐钙含量符合标签要求.1年前查看全部
- 如图是某种加钙食盐(在加碘食盐中掺适量的食用碳酸钙)包装标签上的部分文字.某同学为了测定此盐中的钙元素含量是否符合标签所
 如图是某种加钙食盐(在加碘食盐中掺适量的食用碳酸钙)包装标签上的部分文字.某同学为了测定此盐中的钙元素含量是否符合标签所示,取10g这种盐于烧杯中,加入足量稀盐酸,待完全反应后,烧杯中质量减少了0.132g.请通过计算判断此标签中钙的含量是否属实?
如图是某种加钙食盐(在加碘食盐中掺适量的食用碳酸钙)包装标签上的部分文字.某同学为了测定此盐中的钙元素含量是否符合标签所示,取10g这种盐于烧杯中,加入足量稀盐酸,待完全反应后,烧杯中质量减少了0.132g.请通过计算判断此标签中钙的含量是否属实?  lugm1年前1
lugm1年前1 -
 实话难实说 共回答了17个问题
实话难实说 共回答了17个问题 |采纳率94.1%解题思路:碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据二氧化碳的质量及其反应的化学方程式可以计算碳酸钙的质量、钙元素的质量.根据质量守恒定律可知,反应前后烧杯内质量减少的就是生成的二氧化碳质量,所以二氧化碳的质量为0.132g.
设参加反应碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.132g
[100/x=
44
0.132g]
x=0.3g
10g此加钙食盐中钙元素的质量为:0.3g×[40/100]×100%=0.12g;
所以此加钙食盐中钙元素的质量分数=[0.12g/10g]×100%=1.2%,钙元素的含量在0.5%到1.3%之间,所以此标签中钙的含量属实
答:此标签中钙的含量属实.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用化学方程式进行计算和推断的能力,比较简单,解答时要注意规范性.1年前查看全部
- 如图为某加钙食盐包装袋袋上的标签.小明为了探究该食盐中的钙元素的含量:取30.00g该盐样品,测得期中碳元素0.09g
如图为某加钙食盐包装袋袋上的标签.小明为了探究该食盐中的钙元素的含量:取30.00g该盐样品,测得期中碳元素0.09g

(1)30.00g该食盐中含碳酸钙的质量是多少?
(2)此加钙食盐钙含量是否符合标签要求?
(3)一袋该加钙食盐中至少要加入碘酸钾多少克?
(4)若一个成年人每天摄取5.0g碘盐,则至少能从中获取碘元素多少克?
 skill61年前1
skill61年前1 -
 鱼哇哇 共回答了22个问题
鱼哇哇 共回答了22个问题 |采纳率81.8%(1)设该食盐中含碳酸钙的质量为x
CaCO3------------Ca(NO3)2
100 44
x 0.33g
100/44=x/0.33g -----x=0.75g
30.00g食盐中含碳酸钙的质量是0.75g;
(2)加钙食盐钙元素的质量分数为 =(0.75*40/100)/30×100%=1.0%,
根据标签钙判断 此加钙食盐钙含量符合标签要求.
(3) 一袋500g的加碘食盐中碘酸钾的质量:碘含量(以I计)35mg/kg ,所以500g规格碘含量17.5mg
碘酸钾的质量:214÷127×17.5=29.5mg
(4)一个成人每天摄取5g碘盐,则至少能从中获得碘元素0.175毫克.1年前查看全部
- 某钙片主要成分碳酸钙,其碳酸含量为80%,现需要补充钙元素4g需要吃钙片多少?
 polybear1年前4
polybear1年前4 -
 piaoer5757 共回答了20个问题
piaoer5757 共回答了20个问题 |采纳率95%CaCO3------Ca
100 40
x*80% 4g
100/40=x*80%/4g
x=12.5g1年前查看全部
- (2014•沈河区二模)结合如图含钙元素物质间可以发生的转化关系.下列说法中,正确的是( )
(2014•沈河区二模)结合如图含钙元素物质间可以发生的转化关系.下列说法中,正确的是( )
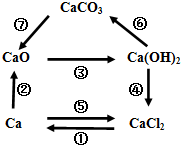
A.图中的五种物质,有三种属于氧化物
B.转化①属于化合反应
C.转化④⑥一定有水生成
D.Ca在Cl2中燃烧可实现转化⑤,该反应说明燃烧不一定需要氧气 fhkrav1年前1
fhkrav1年前1 -
 ato1982 共回答了18个问题
ato1982 共回答了18个问题 |采纳率94.4%解题思路:A、根据氧化物的概念来分析;
B、根据化合反应的概念来分析;
C、根据物质间的转化过程来分析;
D、根据燃烧现象来分析燃烧的条件.A、氧化物是由两种元素组成,并且有一种元素是氧元素的化合物叫做氧化物,因此只有氧化钙属于氧化物,故错误;
B、电解熔融的氯化钙得到钙和氯气,属于分解反应,故错误;
C、④可以通过氢氧化钙与碳酸钠反应实现,生成物是碳酸钙沉淀和氢氧化钠,没有水生成,故错误;
D、钙在氯气中燃烧生成氯化钙,此燃烧过程中没有氧气参与,说明燃烧不一定需要氧气,故正确.
故选D.点评:
本题考点: 碳酸钙、生石灰、熟石灰之间的转化;从组成上识别氧化物;反应类型的判定;燃烧与燃烧的条件.
考点点评: 熟练掌握物质间的转化过程,进一步明确燃烧不一定需要氧气参与.1年前查看全部
- 已知测得50克石灰水样品中含钙元素10克,求石灰水的纯度?
 Jolly1年前3
Jolly1年前3 -
 我爱何剑峰 共回答了14个问题
我爱何剑峰 共回答了14个问题 |采纳率85.7%石灰水的纯度:10*(74/40)/50=0.37=37%1年前查看全部
大家在问
- 1麻烦帮忙翻译:做某事有困难
- 2写出一个可以用3x+4y除七表示结果的实际问题 说出可以用二分之a+b表示结果的实际问题
- 3该油罐车能装10吨柴油,现有80立方米的柴油,一次全部装完,需要几辆这样的车(柴油密度=0.8克每立方厘 米)
- 4棱长是5dm的正方体,若它的棱长增加1dm,则表面积增加多少?
- 5there is always a lot of t( ) at this time of day.you 'd bet
- 6我们可以在报纸上登一则广告.翻译英语
- 7fulfil与fulfill的区别..
- 8解释一下有关电势能的一句话电荷在某点的电势能,等于静电力把它从该点移动到零势能位置时所做的功.为什么不说从零势能移动到该
- 9把14分之9化成小数后,小数点的第一百位是什么
- 10It was the parents not the children that should be blamed be
- 11我要的天空 是有你的地方 是啥意思 = =
- 12几道初一英语填空题求助``let me show it to you on the m____L____ turn gr
- 13IQ 大比拼1.If two swalows are sitting on a twig and you wish to
- 14高中课本上的一句话,once published,his work became famous for the abse
- 1534/85化成最简分数
