求菱铁矿、黄铜矿、辉铜矿的主要成分的化学表达式
 喵基2022-10-04 11:39:542条回答
喵基2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 zhhy07 共回答了17个问题
zhhy07 共回答了17个问题 |采纳率76.5%- 菱铁矿FeCO3、黄铜矿CuFeS2、辉铜矿Cu2S
- 1年前
 LOUIS12 共回答了67个问题
LOUIS12 共回答了67个问题 |采纳率- 菱铁矿FeCO3,黄铜矿CuFeS2,辉铜矿Cu2S
- 1年前
相关推荐
- 下载:某化学兴趣小组有一次活动的内容是:对一包铁矿石粉末的组成进行探究,请你参与并回答有关问题.[教师提醒]它由菱铁矿(
下载:
某化学兴趣小组有一次活动的内容是:对一包铁矿石粉末的组成进行探究,请你参与并回答有关问题.
[教师提醒]它由菱铁矿(FeCO3)、赤铁矿(Fe2O3)、磁铁矿(Fe3O4)三种固体粉末中的一种或两种组成.
[提出猜想]试样粉末主要成分可能有:①只是FeCO3、②只是Fe2O3、③只是Fe3O4、④FeCO3和Fe2O3、⑤FeCO3和Fe3O4、⑥Fe2O3和Fe3O4.
[查阅资料](1)FeCO3受热易分解FeCO3
FeO+CO2↑,常温与可盐酸反应放出CO2:FeCO3+2HCl=FeCl2+CO2↑+H2O,△ .
(2)铁矿石粉末中的杂质不参加反应.
[探究思路]先利用物质的性质不同设计实验探究其成分,然后再选择适当的试剂和方法通过实验测定其含量.(装置内空气中的水蒸气、CO2忽略不计)
[实验探究]
(1)取适量试样粉末装入试管中,加入适量的盐酸,没有气泡产生,从而排除猜想中的______(填猜想中的序号).
(2)为进一步确定试样粉末的组成,称取该粉末10.0g装入硬质玻璃管中,在通风厨按如图进行实验.
开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
[交流讨论]反应前 反应后 a管 玻璃管和试样粉末的总质量为70.0g 玻璃管和固体物质的总质量为67.6g b瓶 洗气瓶和所盛溶液的总质量为200.0g 洗气瓶和瓶中物质的总质量为206.6g
(3)为了防止溶液倒吸,本实验最后停止加热前是否需要先断开装置中a和b的连接处?______(填需要或不需要),理由是______.
(4)b装置中可能会发生多个化学反应,任写出其中1个反应的化学方程式:______.
[反思评价]
(5)本实验的尾气是否需处理?如需处理,请回答如何处理,如不需处理,请说明理由:______.
(6)通过计算确定,该铁矿石试样的主要成分,指出哪个猜想是正确的(已知铁矿石的纯度为80.0%).
解: 琴儿宝贝1年前1
琴儿宝贝1年前1 -
 2550216 共回答了17个问题
2550216 共回答了17个问题 |采纳率94.1%解题思路:(1)根据盐酸会和碳酸亚铁反应放出二氧化碳进行解答;
(3)根据在反应中一直通入CO气体直至冷却,B中溶液不会倒吸到A装置中进行解答;
(4)根据二氧化碳和氢氧化钙溶液或者是氢氧化钠溶液反应进行解答;
(5)根据CO有毒,排放到空气中会污染大气进行解答;
(6)根据a试管中减少的质量为混合物中元素的质量进行解答.(1)盐酸会和碳酸亚铁反应放出二氧化碳,加入适量的盐酸,没有气泡产生,说明一定没有碳酸亚铁,所以①④⑤可以排除;
(3)在反应中一直通入CO气体直至冷却,B中溶液不会倒吸到A装置中,所以不需要先断开装置中a和b的连接;
(4)二氧化碳和氢氧化钙溶液或者是氢氧化钠溶液反应,反应的化学方程式分别为:CO2+Ca(OH)2=CaCO3↓+H2O或2NaOH+CO2=Na2CO3+H2O;
(5)CO有毒,排放到空气中会污染大气,所以需要尾气处理,在b装置后放一燃着的酒精灯将剩余气体烧掉;
(6)a试管中减少的质量为混合物中元素的质量,混合物中氧元素的质量=70.0g-67.6g=2.4g,所以该混合物中氧元素的质量分数为:
2.4g
10.0g×100%=24%.
如果是只是Fe2O3混合物中氧元素的质量分数=80%×
56×2
56×2+16×6×100%=24%,所以正好和该混合物中氧元素的质量分数相同,故猜想②正确.
故答案为:(1)①④⑤;
(3)不需要;因为一直通入CO气体,B中溶液不会倒吸到A装置中;
(4)CO2+Ca(OH)2=CaCO3↓+H2O;
(5)需要;在b装置后放一燃着的酒精灯将剩余气体烧掉;
(6)猜想②正确.点评:
本题考点: 实验探究物质的组成成分以及含量;一氧化碳的化学性质;酸的化学性质;碱的化学性质;根据化学反应方程式的计算.
考点点评: 此类题目主要对炼铁的实验原理、实验现象、操作步骤、尾气处理、装置连接及实验分析与评价等方面进行考查.熟练掌握该实验的反应原理以及实验注意事项是解决此类问题的关键.1年前查看全部
- 下列矿石不能用来炼铁的是 A赤铁矿 B菱铁矿 C铝铁矿 D磁铁矿
 hwrhwrhwry1年前4
hwrhwrhwry1年前4 -
 Roger哥哥 共回答了21个问题
Roger哥哥 共回答了21个问题 |采纳率81%选C 因为 C铝铁矿 的主要成分是AL2O3
A赤铁矿 的主要成分是Fe2O3
B菱铁矿的主要成分是FeCO3
D磁铁矿 的主要成分是Fe3O41年前查看全部
- 菱铁矿是怎么形成的?它在形成过程中怎么没有被氧化?
 4蛋1年前1
4蛋1年前1 -
 林同 共回答了24个问题
林同 共回答了24个问题 |采纳率87.5%缺氧条件下形成,如水流不畅的泻湖湖底,因有大量有机物存在,消耗氧气1年前查看全部
- (2013•珠海)常见的铁矿石有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、菱铁矿(FeCO3)、黄铁矿(FeS2)等.
(2013•珠海)常见的铁矿石有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、菱铁矿(FeCO3)、黄铁矿(FeS2)等.若用______矿炼铁会产生形成酸雨的有害气体;CO在高温时与赤铁矿反应的方程式为3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3,炼得的生铁合金中含2%-4.3%的是______.
2Fe+3CO2高温 . 源静流清1年前1
源静流清1年前1 -
 佳佳头 共回答了15个问题
佳佳头 共回答了15个问题 |采纳率93.3%解题思路:根据炼铁选用的铁矿不仅要选含铁量高的,还要选“有害元素”少的进行解答.黄铁矿(FeS2)含有硫元素,所以矿炼铁会产生形成酸雨的有害气体二氧化硫;CO在高温时与赤铁矿反应生成铁和二氧化碳,反应的方程式为3CO+Fe2O3
高温
.
2Fe+3CO2;炼得的生铁合金中含2%-4.3%的是碳元素.
故答案为:黄铁矿(FeS2);3CO+Fe2O3
高温
.
2Fe+3CO2;C.点评:
本题考点: 金属元素的存在及常见的金属矿物;铁的冶炼;生铁和钢;书写化学方程式、文字表达式、电离方程式.
考点点评: 掌握铁的冶炼方法和注意事项,了解金属元素的存在及常见的金属矿物.1年前查看全部
- 菱铁矿的主要成分是FeCO3.下列说法正确的是( )
菱铁矿的主要成分是FeCO3.下列说法正确的是( )
A. FeCO3中Fe、C、O元素的质量比是1:l:3
B. FeCO3中Fe、C、O的原子个数比是56:12:16
C. FeCO3的相对分子质量是56+12+16
D. FeCO3中Fe元素的质量分数是[56/56+12+16×3]×100% klongei1年前4
klongei1年前4 -
 起名要低调 共回答了13个问题
起名要低调 共回答了13个问题 |采纳率92.3%解题思路:A、根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
B、根据化学式右下角的数字确定物质中个元素的原子个数比
C、相对分子质量;是各元素的相对原子质量的总和
D、根据物质中某元素的质量分数=[该元素的相对原子质量×原子个数/该物质相对分子质量]×100%,进行解答.A、FeCO3中铁、碳、氧元素的质量比为:56:12:(16×3)=14:3:12;故错
B、根据化学式FeCO3Fe、C、O的元素的原子个数比为:1:1:3;故错
C、FeCO3的相对分子质量为:56+12+16×3=116;故错
D、FeCO3中Fe元素的质量分数为:[56/56+12+16×3]×100%.故对
故选D点评:
本题考点: 元素质量比的计算;相对分子质量的概念及其计算;元素的质量分数计算.
考点点评: 本题主要考查学生根据化学式确定物质元素及根据组成物质元素之间的质量关系进行分析解题的能力.1年前查看全部
- 赤铁矿、磁铁矿、菱铁矿的主要成分分别是三氧化二铁、四氧化三铁核碳酸亚铁.这些物质各1t,
赤铁矿、磁铁矿、菱铁矿的主要成分分别是三氧化二铁、四氧化三铁核碳酸亚铁.这些物质各1t,
含铁最多的是( )
A.赤铁矿 B.磁铁矿
C.菱铁矿 D.一样多 hqry1年前1
hqry1年前1 -
 kk幽瞳 共回答了17个问题
kk幽瞳 共回答了17个问题 |采纳率82.4%B 磁铁矿,分子量中铁的比例最多1年前查看全部
- 菱铁矿的主要成分是FeCO3.下列说法正确的是( )
菱铁矿的主要成分是FeCO3.下列说法正确的是( )
A. FeCO3中Fe、C、O元素的质量比是1:l:3
B. FeCO3中Fe、C、O的原子个数比是56:12:16
C. FeCO3的相对分子质量是56+12+16
D. FeCO3中Fe元素的质量分数是[56/56+12+16×3]×100% godwyt1年前1
godwyt1年前1 -
 欧阳欧阳我爱你 共回答了18个问题
欧阳欧阳我爱你 共回答了18个问题 |采纳率88.9%解题思路:A、根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
B、根据化学式右下角的数字确定物质中个元素的原子个数比
C、相对分子质量;是各元素的相对原子质量的总和
D、根据物质中某元素的质量分数=[该元素的相对原子质量×原子个数/该物质相对分子质量]×100%,进行解答.A、FeCO3中铁、碳、氧元素的质量比为:56:12:(16×3)=14:3:12;故错
B、根据化学式FeCO3Fe、C、O的元素的原子个数比为:1:1:3;故错
C、FeCO3的相对分子质量为:56+12+16×3=116;故错
D、FeCO3中Fe元素的质量分数为:[56/56+12+16×3]×100%.故对
故选D点评:
本题考点: 元素质量比的计算;相对分子质量的概念及其计算;元素的质量分数计算.
考点点评: 本题主要考查学生根据化学式确定物质元素及根据组成物质元素之间的质量关系进行分析解题的能力.1年前查看全部
- 现有赤铁矿,黄铁矿,磁铁矿,菱铁矿,那种不适合用来炼铁?说明理由
现有赤铁矿,黄铁矿,磁铁矿,菱铁矿,那种不适合用来炼铁?说明理由
能详细一点吗 顶天立地_oo1年前1
顶天立地_oo1年前1 -
 yuanzi5811 共回答了23个问题
yuanzi5811 共回答了23个问题 |采纳率95.7%黄铁矿
1高温煅烧的过程中生成SO2和Fe2O3,猜想要炼铁的话还要再次还原Fe2O3,增加成本 2在燃烧时会释放二氧化硫有毒气体,污染环境
我们老师这样说的1年前查看全部
- (2013•天桥区二模)碳酸亚铁(FeCO3)是一种重要的工业盐,也是炼铁所用菱铁矿的主要成分,外观为白色固体,难溶于水
(2013•天桥区二模)碳酸亚铁(FeCO3)是一种重要的工业盐,也是炼铁所用菱铁矿的主要成分,外观为白色固体,难溶于水,遇水和氧气会发生反应,化学方程式为4FeCO3+6H2O+O2=4Fe(OH)3+4CO2.
(1)小亮同学提出三种生成碳酸亚铁的情况,其中正确的是(填序号)______
A.+3价铁的盐溶液与可溶性碳酸盐发生复分解反应;B.+2价铁的盐溶液与可溶性碳酸盐作用;C.铁与氧气、水发生复杂的氧化反应
(2)小亮同学取一定量碳酸亚铁固体于烧杯中,加入足量水,将烧杯放置在天平左盘上,向右盘放入砝码至天平平衡.放置较长时间后(不考虑水分蒸发),观察到天平的指针会______(填“偏左”、“偏右”、“不发生偏转”之一);另外,放置过程中还可观察到的一项实验现象为______.
(3)待上述烧杯中物质的质量不发生变化时,向烧杯中加入溶质质量分数为10%的稀盐酸109.5g,恰好完全反应,求反应后所得不饱和溶液中溶质的质量.(计算结果精确到0.01g) tyliuxing1年前1
tyliuxing1年前1 -
 牛儿神话 共回答了15个问题
牛儿神话 共回答了15个问题 |采纳率93.3%解题思路:(1)根据复分解反应前后各元素化合价不变分析;(2)根据碳酸盐铁、水和氧气反应能生成氢氧化铁和二氧化碳分析质量变化,根据生成物叙述实验现象;(3)根据盐酸中氯化氢的质量计算出生成氯化铁的质量.(1)复分解反应前后元素化合价不变,所以+3价铁的盐溶液与可溶性碳酸盐发生复分解反应生成碳酸铁,不是碳酸亚铁,故A错,+2价铁的盐溶液与可溶性碳酸盐作用能生成碳酸亚铁,故B正确;铁与氧气、水发生复杂的氧化反应,是铁生锈生成主要成分是氧化铁的物质,不属于碳酸亚铁,故C错;
(2)烧杯内质量增加了参加反应氧气的质量,反应后减少的质量是生成了二氧化碳,由方程式可知参加反应的氧气的质量小于生成的二氧化碳的质量,所以放置较长时间后,烧杯内质量减少,所以偏向右端;生成的氢氧化铁是红褐色固体,所以现象是白色固体变成红褐色固体;
(3)HCl的质量=109.5g×10%=10.95g
设所得溶液中溶质FeCl3的质量为x
Fe(OH)3+3HCl=FeCl3+3H2O
109.5 162.5
10.95g x
根据:[109.5/162.5=
10.95g
x]解得x=16.25g.
故答案为:(1)B;(2)偏右;白色固体变成红褐色固体(或产生气泡);(3)16.25g.点评:
本题考点: 物质的相互转化和制备;根据化学反应方程式的计算.
考点点评: 本题属于信息探究题,解题的关键是根据题目所给的信息,提取出有用信息,分析出反应进行的情况,从而进行有关的分析与计算.1年前查看全部
- FeS2(黄铁矿);FeCO3(菱铁矿);CH3COOH(醋酸);NH3H2O(氨水);
FeS2(黄铁矿);FeCO3(菱铁矿);CH3COOH(醋酸);NH3H2O(氨水);
CO(NH2)2(尿素);NH4HCO3(碳酸氢铵);基酸(C6H10O5)n(淀粉); C6H12O6(葡萄糖);C12H22O11(蔗糖);C2H5OH(乙醇)
磷酸铵(磷酸二氢铵NH4H2PO4和磷酸氢二铵(NH4)2H2PO4的混合物) sqpaul19811年前4
sqpaul19811年前4 -
 jinshagoa 共回答了23个问题
jinshagoa 共回答了23个问题 |采纳率82.6%C2H5OH(乙醇)
CH3COOH(醋酸)
NH4HCO3(碳酸氢铵)
CO(NH2)2(尿素)
CO(NH2)2(尿素)1年前查看全部
- 利用下图所示装置测定某含菱铁矿的矿石样品中碳酸亚铁的质量分数(杂质不含铁元素且在实验过程中不发生任何变化),实验数据记录
利用下图所示装置测定某含菱铁矿的矿石样品中碳酸亚铁的质量分数(杂质不含铁元素且在实验过程中不发生任何变化),实验数据记录在下表中.
提示:FeCO3
FeO+CO2↑高温 .
(1)该含菱铁矿的矿石样品中碳酸亚铁的质量分数______;实验前 实验后 硬质玻璃管(含样品) 165.6g 159.6g 说明 ①空硬质玻璃管质量为l45.6g
②含铁各物质反应完全
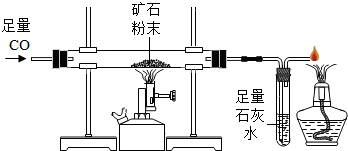
(2)实验结束后盛有澄清石灰水的试管的总质量比反应前的总质量增加______克. 有想法1年前1
有想法1年前1 -
 yujintao8 共回答了16个问题
yujintao8 共回答了16个问题 |采纳率100%解题思路:(1)固体物质的减少主要是因为从碳酸亚铁变成铁,失去了CO3,所以质量的减少为CO3的质量,根据两者的关系求算碳酸亚铁的质量,从而求算出其质量分数.
(2)空硬质玻璃管中减少的质量就是与一氧化碳结合的氧元素的质量,所以要根据与一氧化碳结合的氧元素的质量求算二氧化碳的质量.(1)实验中发生的化学反应有:FeCO3
高温
.
FeO+CO2↑,CO+FeO
高温
.
Fe+CO2↑,CO2+Ca(OH)2═CaCO3↓+H2O.
CO还原菱铁矿最终产物是铁和二氧化碳,实验前后硬质玻璃管(含样品)质量差为165.6g-159.6g=6g,实际上就是FeCO3中失去CO32-的质量,由此可计算出FeCO3的质量为11.6g.实验前硬质玻璃管(含样品)质量为165.6g,空硬质玻璃管质量为145.6g,得出样品质量为20g,故含菱铁矿的矿石样品中碳酸亚铁的质量分数为[11.6g/20g]×100%=58%
所以:因空硬质玻璃管质量是l45.6g,实验前硬质玻璃管(含样品)的质量是165.6g,实验后硬质玻璃管(含样品)的质量是159.6g,参加反应的样品的质量是165.6g-l45.6g=20g,而固体物质的质量减少为165.6g-159.6g=6g,即碳酸根的质量为6g;设碳酸亚铁的质量为x.
FeCO3~CO3
116 60
x6g
[116/60]=[x/6g]
x=11.6g
碳酸亚铁在样品中的质量分数为[11.6g/20.0g]×100%=58%
(2)分析可知碳酸根离子中只有一个氧原子和一氧化碳而生成二氧化碳,而剩余部分直接转化为二氧化碳.设与一氧化碳反应生成的二氧化碳的质量为y,而碳酸亚铁分解所生成的二氧化碳质量为z.
CO3~一氧化碳转化的CO2~碳酸亚铁分解产生的CO2
60 44 44
6g y z
[60/6g]=[44/y]=[44/z]
y=4.4g
z=4.4g
所以二氧化碳总质量为4.4g+4.4g=8.8g.
故答案为:58%;
(2)生成二氧化碳的质量是:8.8g.这些二氧化碳被试管中的澄清石灰水吸收,实验结束后盛有澄清石灰水的试管的总质量比反应前的总质量增加 8.8g.
故答案为:8.8g.点评:
本题考点: 一氧化碳还原氧化铁;根据化学反应方程式的计算.
考点点评: 本题主要考查与化学反应式有关的计算,有一定的难度,需要同学们细心方可做好此题.1年前查看全部
- (2012•广州)菱铁矿的主要成分是FeCO3.下列说法正确的是( )
(2012•广州)菱铁矿的主要成分是FeCO3.下列说法正确的是( )
A.FeCO3中Fe、C、O元素的质量比是1:l:3
B.FeCO3中Fe、C、O的原子个数比是56:12:16
C.FeCO3的相对分子质量是56+12+16
D.FeCO3中Fe元素的质量分数是[56/56+12+16×3]×100% 一个人去旅游1年前1
一个人去旅游1年前1 -
 阿曼塔 共回答了17个问题
阿曼塔 共回答了17个问题 |采纳率88.2%解题思路:A、根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
B、根据化学式右下角的数字确定物质中个元素的原子个数比
C、相对分子质量;是各元素的相对原子质量的总和
D、根据物质中某元素的质量分数=[该元素的相对原子质量×原子个数/该物质相对分子质量]×100%,进行解答.A、FeCO3中铁、碳、氧元素的质量比为:56:12:(16×3)=14:3:12;故错B、根据化学式FeCO3Fe、C、O的元素的原子个数比为:1:1:3;故错C、FeCO3的相对分子质量为:56+12+16×3=116;故错D、FeCO3中Fe元素的质量...
点评:
本题考点: 元素质量比的计算;相对分子质量的概念及其计算;元素的质量分数计算.
考点点评: 本题主要考查学生根据化学式确定物质元素及根据组成物质元素之间的质量关系进行分析解题的能力.1年前查看全部
- 求矿物质的名称及其化学式,越多越好,至少30个,如磷铁矿,菱铁矿…………
 xzneme131年前2
xzneme131年前2 -
 baiwffgwksy 共回答了14个问题
baiwffgwksy 共回答了14个问题 |采纳率100%铬铁矿 (Mg,Fe)Cr2O4,成分比较复杂,
斑铜矿 Cu5FeS4,Cu63.33%,Fe11.12%,S25.55%、
孔雀石 Cu2(OH)2CO3
辉铜矿 Cu2S
橄榄石 是镁橄榄石(Mg2Sio4)和铁橄榄石(Fe2Sio4)系列的中间品
辉石 主要成分为XY(Si,Al)2O6,其中X代表钙、钠、镁和2价铁,也有一些锌、锰和锂等种类的离子.Y代表较小的离子如氯、铝、3价铁、钒、钪等.
石英 化学式为SiO2.
绢云母 K 0.5-1 ( Al,Fe,Mg ) 2 ( SiAl ) 4 O 10 (OH) 2 ? nH 2 O
绿泥石 Y3【Z4O10】(OH)2·Y3(OH)6
白云石 CaMg(CO 3 ) 2
方解石 CaCO3
闪锌矿 ZnS
明矾石 KAl3(SO4)2(OH)6
磁铁矿 Fe3O4,
稀土元素即轻稀土组为镧、铈、镨、钕、钷;中稀土组为钐、铕、钆、铽、镝;重稀土组为钬、铒、铥、镱、镥、钇.
虽然还不到30个,但尽了我最大努力,望采纳.1年前查看全部
- 菱铁矿(主要为碳酸亚铁)为什么长期处于空气(O2)中没有变成三价铁离子?
 sfsdgs1年前1
sfsdgs1年前1 -
 meitanju 共回答了24个问题
meitanju 共回答了24个问题 |采纳率75%纯的碳酸铁在干燥的空气中碳酸铁是稳定的.在有水存在的条件下还是会因为氧化与水解而生成茶色的氢氧化铁(水溶液中不存在碳酸铁).而菱铁矿的情况与纯的碳酸铁情况又不一样,菱铁矿的主要成分是碳酸亚铁,也共生有别的金属矿,共生的其他的组成成分(如硫-还原剂)会影响到碳酸亚铁这一组分的稳定性,所以就像你提问中说的那样了.1年前查看全部
- 菱铁矿的化学式是什么?
 suohuiyuan1年前2
suohuiyuan1年前2 -
 28666578 共回答了15个问题
28666578 共回答了15个问题 |采纳率66.7%菱铁矿是一种分布比较广泛的矿物,它的成分是碳酸亚铁.化学式是FeCO31年前查看全部
- 赤铁矿.褐铁矿.磁铁矿.菱铁矿.的化学式是怎么?它们难易还原程度怎么排列?为什么?
赤铁矿.褐铁矿.磁铁矿.菱铁矿.的化学式是怎么?它们难易还原程度怎么排列?为什么?
绝对正确的告诉我个.难易还原程度怎么排列. 虎皮沙拉1年前2
虎皮沙拉1年前2 -
 lnyj 共回答了23个问题
lnyj 共回答了23个问题 |采纳率100%赤铁矿中主要成分为Fe2O3,即氧化铁;褐铁矿实际上并不是一个矿物种,而是针铁矿、纤铁矿、水针铁矿、水纤铁矿以及含水氧化硅、泥质等的混合物.化学成分变化大,含水量变化也大.磁铁矿:主要成分为Fe3O4,即四氧化三铁;菱铁矿主要成分为FeCO3,即碳酸亚铁.
准确地说它们的难易还原程度无法确切地比较,Fe2O3中Fe为亚铁离子即Fe2+,Fe3O4中可以看成是一个Fe2O3和一个FeO组成,Fe2+既有氧化性又有还原性,Fe3+只有氧化性,所以Fe2+的氧化性不如Fe3+,而Fe3+的还原性不如Fe2+,即含Fe2+的化合物更容易被还原.1年前查看全部
- (2013•长春二模)菱铁矿的主要成分是FeCO3,下列关于FeCO3的说法中正确的是( )
(2013•长春二模)菱铁矿的主要成分是FeCO3,下列关于FeCO3的说法中正确的是( )
A.由原子直接构成
B.碳、氧元素的质量比是1:3
C.铁元素的化合价为+3价
D.Fe元素的质量分数是[56/56+12+16×3]×100% NothingNowhere1年前1
NothingNowhere1年前1 -
 倚马过斜桥 共回答了15个问题
倚马过斜桥 共回答了15个问题 |采纳率86.7%解题思路:A.根据物质的结构来分析;B.根据化合物中元素质量比的计算方法来分析;C.根据化合物中元素化合价的计算方法来分析;D.根据化合物中元素质量分数的计算方法来分析.A.FeCO3是由亚铁离子和碳酸根离子构成的,不是由原子直接构成的,故错误;
B.FeCO3中碳、氧元素的质量比为:12:(16×3)=3:12;故错误;
C.FeCO3中,碳酸根显-2价,根据化合物中各元素正负化合价的代数和为零原则可知,铁元素显+2价,故错误;
D.FeCO3中Fe元素的质量分数为:
56
56+12+16×3×100%=48.3%,故正确.
故选D.点评:
本题考点: 化学式的书写及意义;分子、原子、离子、元素与物质之间的关系;有关元素化合价的计算;元素质量比的计算;元素的质量分数计算.
考点点评: 本题主要考查学生根据化学式确定物质元素及根据组成物质元素之间的质量关系进行分析解题的能力.1年前查看全部
- 菱铁矿炼铁方程式FECO3
 WP28591年前1
WP28591年前1 -
 我要一个结果 共回答了11个问题
我要一个结果 共回答了11个问题 |采纳率81.8%FeCO3=(高温)FeO+CO2↑
FeO+CO=(高温)Fe+CO21年前查看全部
- 注意:以下都用化学式表示!①:最常见的溶剂②:菱铁矿的主要成分:③:赤铁矿的主要成分:④:磁铁矿的主要成分:⑤:铁锈的主
注意:以下都用化学式表示!
①:最常见的溶剂
②:菱铁矿的主要成分:
③:赤铁矿的主要成分:
④:磁铁矿的主要成分:
⑤:铁锈的主要成分: 泪小叶QMM1年前5
泪小叶QMM1年前5 -
 kasnet 共回答了7个问题
kasnet 共回答了7个问题 |采纳率100%①:最常见的溶剂 H2O
②:菱铁矿的主要成分:FeCO3
③:赤铁矿的主要成分:Fe2O3
④:磁铁矿的主要成分:Fe3O4
⑤:铁锈的主要成分 Fe2O31年前查看全部
大家在问
- 1已知x的平方加二x加y的平方减六y加十等于零,求x,y的值
- 21、如图,在矩形ABCD中,角BAD的平分线交BC于E,O为对角线AC、BD的交点,且角CAE=15°:
- 312. Lily didn't come to school, did she?
- 4甲乙丙等7人排一排,分别按下列要求排各需几种排法
- 5描写(不相及)有关成语?越多越好急……先谢谢了!!!!
- 6如图,三角形ABO绕点O旋转得到三角形CDO,在这个旋转过程中:
- 7为什么0度的冰摸起来比0度的水还要冰?
- 8偏铝酸根和碳酸氢根双水解
- 9某商店出售一种商品,有如下三种方案:
- 102011年莱西一中南校暑假作业答案
- 11古文《黄香温席》的解释
- 12英语翻译用英文,忘说了
- 13一个正方形的面积是36平方分米,圆的面积是多少平方分米?一个正方形的面积是50平方分米,圆的面积是多少
- 14逻辑学中的SAP SEP SIP SOP
- 15一个商人骑一头驴要穿越1000公里长的沙漠,去卖3000根胡萝卜.已知驴一次性可驮1000根胡萝卜,但每走1公里又要吃掉
