新型电池Li-I2(数字在右下角),其反应可简写为2Li+I2==2LiI.回答下列问题……(1),电池的负极
 刘科k2022-10-04 11:39:542条回答
刘科k2022-10-04 11:39:542条回答新型电池Li-I2(数字在右下角),其反应可简写为2Li+I2==2LiI.回答下列问题……(1),电池的负极材料为(),电极反应式为()

已提交,审核后显示!提交回复
共2条回复
 charliecom 共回答了22个问题
charliecom 共回答了22个问题 |采纳率95.5%- 发生氧化反应的是负极.Li失电子被氧化,所以负极材料是金属Li
电极反应:Li→Li++e- - 1年前
 vajion322 共回答了3个问题
vajion322 共回答了3个问题 |采纳率- li作正极
i作负极 - 1年前
相关推荐
- 高中化学关于化合价的问题某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料, 该电池可用作深水勘探等无空气环
高中化学关于化合价的问题
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料, 该电池可用作深水勘探等无空气环境电源,其工作原理如下图所 示.下列说法正确的是
A.a极上的电极反应式为:BH4- + 8OH- - 8e- = BO2- + 6H2O
BO2- 的化合价不还是+3吗 没发生氧化还原啊 怎么出来的这个电极反应式? lily126031年前5
lily126031年前5 -
 koko7952082 共回答了20个问题
koko7952082 共回答了20个问题 |采纳率85%BH4-中H为-1价,H2O中为+1价,所以BH4-中H共转移了8个电子;其他元素无化合价变化.有化合价升降,所以发生了氧化还原反应1年前查看全部
- 学完了原电池、比较清楚.电解质中阴离子负极移动,阳离子相反.但是我想问在燃料电池,新型电池中也是这样吗?正负极反应比较复
学完了原电池、比较清楚.电解质中阴离子负极移动,阳离子相反.但是我想问在燃料电池,新型电池中也是这样吗?正负极反应比较复杂.如何保证他们还会这样吸引电解质中离子?
 冰封乐园1年前5
冰封乐园1年前5 -
 我爱深海鱼 共回答了16个问题
我爱深海鱼 共回答了16个问题 |采纳率93.8%这是同样的道理,只不过导电的介质有所不同.有些靠金属导电,有些靠熔融盐导电.
另外:普通原电池中的离子移动主要是为了平衡溶液中正负放电导致的生阴阳离子失衡.1年前查看全部
- 某新型电池,以NaBH 4 (B的化合价为+3价)和H 2 O 2 作原料,该电池可用作深水勘探等无空气环境电源,其工作
某新型电池,以NaBH 4 (B的化合价为+3价)和H 2 O 2 作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( ) A.电池工作时Na + 从b极区移向a极区 B.每消耗3molH 2 0 2 ,转移3mole - C.b极上的电极反应式为:H 2 0 2 +2e - +2H + =2H 2 0 D.a极上的电极反应式为:BH 4 - +80H - -8e=B0 2 - +6H 2 0 
 simon-13471年前1
simon-13471年前1 -
 fas51509 共回答了15个问题
fas51509 共回答了15个问题 |采纳率100%由原电池工作原理示意图可知反应中BH 4 - 被氧化为BO 2 - ,应为原电池的负极反应,电极反应式为BH 4 - +8OH - -8e - =BO 2 - +6H 2 O,正极H 2 O 2 得电子被还原生成OH - ,
A.该装置是原电池,原电池放电时,阳离子向正极移动,所以Na + 从a极区移向b极区,故A错误;
B.每消耗3molH 2 O 2 ,转移的电子为6mol,故B错误;
C.b电极反应式为H 2 O 2 +2e - =2OH - ,故C错误;
D.反应中BH 4 - 被氧化为BO 2 - ,应为原电池的负极反应,电极反应式为BH 4 - +8OH - -8e - =BO 2 - +6H 2 O,故D正确;
故选:D.1年前查看全部
- (2014•安徽一模)草酸亚铁晶体(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产.回答下列
(2014•安徽一模)草酸亚铁晶体(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产.回答下列问题:
I兴趣小组对草酸亚铁晶体的分解产物进行实验和探究.探究分解得到的固体产物中铁元素的存在形式.
(1)提出假设
假设一:______;假设二:全部是FeO;假设三:FeO和Fe混合物.
(2)设计实验方案证明假设三.
限选试剂:稀盐酸、新制的氯水、0.1mol•L-1CuSO4溶液、20% KSCN溶液、蒸馏水.
Ⅱ兴趣小组在文献中查阅到,FeC204•2H20受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC204•2H20晶体受热分解的化学方程式为:实验步骤 现象与结论 步骤1:向试管中加入少量固体产物,再加入足量______,充分振荡 若溶液颜色明显改变,且有______生成,则证明有铁质存在 步骤2:将步骤1中得到浊液过滤,并用蒸馏水洗涤至洗涤液无色 步骤3:取步骤2得到的少量固体于试管中滴加______ ______ FeC2O4.2H2O
FeO+CO↑+CO2↑+2H2O△ .FeC2O4.2H2O
FeO+CO↑+CO2↑+2H2O△ .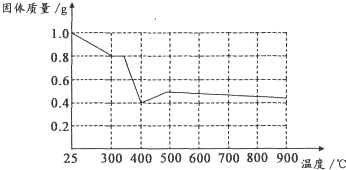
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设二不成立.你是否同意该同学的结论,并简述理由:______. yuyu7yaya1年前1
yuyu7yaya1年前1 -
 秋菊背心的ii 共回答了6个问题
秋菊背心的ii 共回答了6个问题 |采纳率100%解题思路:Ⅰ.(1)依据假设2、3分析假设1的内容;
(2)依据假设3是铁和氧化亚铁的混合物,利用硫酸铜溶液和铁反应生成铜的现象分析证明铁的存在,过滤后用蒸馏水洗涤,取固体用盐酸溶解后加入过氧化氢氧化为铁离子,加入硫氰酸钾溶液若出现血红色现象证明含有氧化亚铁,据此设计实验步骤检验;
Ⅱ.氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
定量实验:根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立不合理,氧化亚铁可以被空气氧化;
Ⅱ.根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立不合理,氧化亚铁可以被空气氧化.解Ⅰ:(1)假设2:FeO; 假设3:FeO和Fe混合物,则假设1为Fe,
故答案为:Fe;
②依据题干所提供的试剂结合假设3的混合物组成为铁和氧化亚铁的性质分析设计实验步骤为,向试管中加入少量固体产物,再加入足量硫酸铜溶液,充分振荡,若溶液颜色明显改变,且有暗红色固体物质生成证明有铁单质存在,将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色,取步骤2得到的少量固体与试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN,若溶液呈血红色证明含有氧化亚铁,
故答案为:
实验步骤现象与结论
步骤1:硫酸铜溶液(暗)红色固体
步骤3:过量HCl,静置,取上层清液,滴加几滴KSCN溶液,再滴加适量新制的氯水,充分振荡 若滴加适量新制的氯水后溶液呈红色,则证明有FeO ;
II.通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,设失去结晶水x,图象分析可知固体质量变化1.0-0.8=0.2g,依据则反应的化学方程式计算为:
FeC2O4•2H2O
△
.
FeC2O4+(2-x)H2O+xH2O△m
180 18x
1.0 0.2
解得:x=2
加热到300°C,晶体全部失去结晶水生成草酸亚铁和水,
继续加热到400°C,固体质量减少0.8g-0.4g=0.4g;此时草酸亚铁分解减少的是气体质量,反应过程中一定存在反应生成氧化亚铁和二氧化碳,铁元素化合价不变时,依据元素化合价变化和电子守恒可知碳元素化合价从+3价变化为+4价,一定有化合价降低生成+2价的一氧化碳,反应的化学方程式为:FeC2O4
△
.
FeO+CO+CO2,分析图象可知;
FeC2O4
△
.
FeO+CO+CO2 △m
144 72
0.8 0.4
计算结果符合图象固体质量变化,所以反应的化学方程式为:FeC2O4.2H2O
△
.
FeO+CO↑+CO2↑+2H2O;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,依据铁元素守恒计算得到若生成氧化亚铁,质量为0.4g,但实验过程中最终残留黑色固体的质量大于0.4g,可能是实验未在密闭容器中进行,氧化亚铁被空气氧化为氧化铁,所以“某同学由此得出结论:假设一不成立”不合理,
故答案为:FeC2O4.2H2O
△
.
FeO+CO↑+CO2↑+2H2O;不同意,实验未在密闭容器中进行,FeO会被空气进一步氧化,生成铁的其它氧化物.点评:
本题考点: 性质实验方案的设计;探究物质的组成或测量物质的含量.
考点点评: 本题考查了探究物质组成、测量物质含量及性质实验方案的设计,题目难度中等,注意掌握物质的性质及检验方法,(II)为易错点,正确分析曲线变化为解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.1年前查看全部
- 铝空气海水为能源的新型电池 负极电极式为什么要加氢氧根
铝空气海水为能源的新型电池 负极电极式为什么要加氢氧根
负极:Al -3e + 3OH- ==Al(OH)3
正极:O2 +4e + 2H2O== 4OH-
总反应:4Al+3O2 +6H2O==4Al(OH)3 负极为什么要加氢氧根 才学原理不太懂求好人讲解 乔叶琳1年前1
乔叶琳1年前1 -
 西门淘书 共回答了16个问题
西门淘书 共回答了16个问题 |采纳率87.5%因为在正极产生了氢氧根,而且氢氧根确实参与了负极反应,况且在溶液中电子传递是通过离子传递进行的,欢迎追问.1年前查看全部
- 科学家利用淡水与海水之间含盐量的差别发明了一种新型电池-水电池.
 科学家利用淡水与海水之间含盐量的差别发明了一种新型电池-水电池.
科学家利用淡水与海水之间含盐量的差别发明了一种新型电池-水电池.
(1)用二氧化锰纳米棒作电池正极可提高发电效率,这是利用纳米材料的______特性,使之能与钠离子充分接触.
(2)水电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,该电池的负极反应式为______.水电池工作时,Na+不断向______极方向移动.
(3)水电池生成1mol Na2Mn5O10转移电子的物质的量为______.
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如图.请据如图分析:
①该温度下,溶度积常数的关系为:KSP[Fe(OH)3]______KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是______. weiye_s1年前1
weiye_s1年前1 -
 淡去的欢颜 共回答了20个问题
淡去的欢颜 共回答了20个问题 |采纳率80%解题思路:(1)纳米材料具有较强的吸附性能,能加大吸附面积;
(2)原电池的负极上发生的是失电子的氧化反应;
(3)根据电子守恒结合电极反应式进行计算;
(4)①根据Ksp的意义以及沉淀的转化知识来判断生成的沉淀是什么;
②根据沉淀溶解平衡移动的影响因素知识来回答判断.(1)纳米材料具有较强的吸附性能,能加大吸附面积,该电池用二氧化锰纳米棒为正极材料可提高发电效率,故答案为:较强吸附能力或较大的表面积;
(2)根据电池的总反应:5MnO2+2Ag+2NaCL=Na2Mn5O10+2AgCl,失电子的是金属银,而原电池的负极上发生的是失电子的氧化反应,所以负极反应是Ag+Cl--e-=AgCl↓,在原电池中,阳离子移向正极,所以钠离子移向正极,故答案为:Ag+Cl--e-=AgCl↓;正;
(3)根据电池反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,化合价升高值=化合价降低值=2=转移电子数,生成1molNa2Mn5O10转移电子的物质的量为2mol,
故答案为:2mol;
(4)①根据图象上的点可以知道,当阳离子铁离子、镁离子浓度相等时,对应的氢离子浓度的大小关系,结合Ksp(氢氧化铁)=c(Fe3+)•c(OH-)3,Ksp(氢氧化镁)=c(Mg2+)•c(OH-)2,所以KSP[Fe(OH)3]<KSP[Mg(OH)2],故答案为:<;
②根据①的分析,KSP[Fe(OH)3]<KSP[Mg(OH)2],氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2⇌Mg2++2OH-,当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,机会生成红褐色沉淀物质,
故答案为:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2⇌Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀.点评:
本题考点: 化学电源新型电池;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题是要综合知识考查题,要求学生具有分析和解决问题的能力,注意原电池的工作原理以及原理的灵活应用是关键,难度较大.1年前查看全部
- 氢氧燃料电池是一种新型电池,其电池总反应为2H2+O2==H2O回答下列问题:
氢氧燃料电池是一种新型电池,其电池总反应为2H2+O2==H2O回答下列问题:
氢氧燃料电池是一种新型电池,其电池总反应为2H2+O2==H2O回答下列问题:
1:若电解质溶液是KOH溶液:
正极反应式是:
负极反应式是:
2:若电解质溶液是H2SO4溶液:
正极反应式是:
负极反应式是:
求详解,最多只有20财富了我全出了! cool198507311年前1
cool198507311年前1 -
 泣血玫瑰┈ 共回答了19个问题
泣血玫瑰┈ 共回答了19个问题 |采纳率94.7%1、
正极反应:O2+2H2O+4e- ==4OH-
负极反应:2H2+4OH- -4e- ==4H2O
2、
正极反应:O2+4H+ +4e- ===2H2O
负极反应:2H2-4e- ===4H+
原则就是碱性介质中不能出现H+,酸性介质中不能出现OH-1年前查看全部
- 科学家利用淡水与海水之间含盐量的差别发明了一种新型电池——水电池。
科学家利用淡水与海水之间含盐量的差别发明了一种新型电池——水电池。
(1)用二氧化锰纳米棒作电池正极可提高发电效率,这是利用纳米材料的 特性,使之能与钠离子充分接触。
(2)水电池总反应可表示为:5MnO 2 +2Ag+2NaCl=Na 2 Mn 5 O 10 +2AgCl,该电池的负极反应式为 。水电池工作时,Na + 不断向 极方向移动。
(3)水电池生成1 mol Na 2 Mn 5 O 10 转移电子的物质的量为 。
(4)某温度下,Fe(OH) 3 (s)、Mg(OH) 2 (s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如右图。请据右图分析:
①该温度下,溶度积常数的关系为:K SP [Fe(OH) 3 ] K SP [Mg(OH) 2 ](填“>”、“=”或“<”);
②如果在新生成的Mg(OH) 2 浊液中滴入足量的FeCl 3 溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是 。 abcdd3221年前1
abcdd3221年前1 -
 zhenlijun 共回答了15个问题
zhenlijun 共回答了15个问题 |采纳率93.3%(1)较强的吸附能力或较大的表面积 (2分)(2)Ag + Cl - -e - =AgCl (3分,2倍计量数、加“↓”不扣分,产物写Ag + 不给分) 正(2分)(3)2 mol(3分,单位错漏扣1分) (4)① < (2分)②Mg(OH) ...1年前查看全部
- (2013•茂名二模)草酸亚铁(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产.已知:CO能
(2013•茂名二模)草酸亚铁(FeC2O4•2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产.已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉.回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究.
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有______.
(2)探究分解得到的固体产物中铁元素的存在形式.
①提出假设
假设1:______;假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3.
限选试剂:1.0mol•L-1盐酸、3% H2O2、0.1mol•L-1CuSO4、20% KSCN、蒸馏水.
Ⅱ:某草酸亚铁样品中含有少量草酸.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++10CO2↑+3Mn2++12H2O实验方案设计为:实验步骤 现象与结论 步骤1:向试管中加入少量固体产物,再加入足量______,充分振荡 若溶液颜色明显改变,且有______生成,则证明有铁单质存在 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 步骤3:取步骤2得到的少量固体与试管中,滴加______
____________
______
①将准确称量的0.20g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红.将滤液过滤至另一个锥形瓶中,继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL
③重复以上实验1~2次
若某小组的一次测定数据记录如下:V1=18.90mL,V2=6.20mL.根据数据计算0.20g 样品中:n(Fe2+)=______; n(C2O42-)=______;FeC2O4 的质量分数为______(精确到0.01%) 武术qq1年前1
武术qq1年前1 -
 m7ax 共回答了13个问题
m7ax 共回答了13个问题 |采纳率76.9%解题思路:Ⅰ、(1)依据CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉,二氧化碳和澄清石灰水变浑浊分析判断;
(2)①依据假设2、3分析假设1的内容;
②依据假设3是铁和氧化亚铁的混合物,利用硫酸铜溶液和铁反应生成铜的现象分析证明铁的存在,过滤后用蒸馏水洗涤,取固体用盐酸溶解后加入过氧化氢氧化为铁离子,加入硫氰酸钾溶液若出现血红色现象证明含有氧化亚铁,据此设计实验步骤检验;
Ⅱ、根据题干数据,计算出亚铁离子、草酸根离子的浓度,再根据亚铁离子、草酸根离子的物质的量计算出草酸铁的质量分数.Ⅰ:(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,说明产物含有二氧化碳气体,B中出现黑色物质生成,CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉,证明含有一氧化碳气体,则上述现象说明气体产物中有二氧化碳和一氧化碳,
故答案为:CO2、CO;
(2)①假设2:FeO; 假设3:FeO和Fe混合物,则假设1为Fe,故答案为:Fe;
②依据题干所提供的试剂结合假设3的混合物组成为铁和氧化亚铁的性质分析设计实验步骤为,向试管中加入少量固体产物,再加入足量硫酸铜溶液,充分振荡,若溶液颜色明显改变,且有暗红色固体物质生成证明有铁单质存在,将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色,取步骤2得到的少量固体与试管中,滴加
过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN,若溶液呈血红色证明含有氧化亚铁,
故答案为:
实验步骤 现象与结论
步骤1:硫酸铜溶液 暗红色固体
步骤3:过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN 若溶液呈血红色,则证明有FeO Ⅱ:样品中亚铁离子、草酸根离子消耗的高锰酸钾溶液的体积为V1ml:高锰酸钾的物质的量为:V1×10-3L×0.02000mol/L=2V1×10-5mol,
亚铁离子消耗的高锰酸钾溶液的体积为V2ml,高锰酸钾的物质的量为:V2×10-3L×0.02000mol/L=2V2×10-5mol,
草酸根离子消耗的高锰酸钾的物质的量为:(2V1×10-5mol-2V2×10-5mol)×0.02000mol/L,V1=18.90mL,V2=6.20mL;
根据化合价升降相等找出关系式:5Fe2+~MnO4-,5C2O42-~2MnO4-,
n(Fe2+)=5×2V2×10-5mol=0.0006200mol
n(C2O42-)=2.5×(2V1×10-5mol-2V2×10-5mol)=0.0006350mol
根据亚铁离子物质的量可知草酸亚铁的物质的量为:0.0006200mol,质量为:0.0006200mol×144g/mol=0.08928g,
草酸铁的质量分数为:[0.08928g/0.20g]×100%=44.64%,
故答案为:0.0006200mol;0.0006350mol;44.64%.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了用滴定法测定该样品中FeC2O4的含量,涉及了实验方案设计、滴定管的使用、质量分数的计算等知识,可以根据所学知识完成,难度中等.1年前查看全部
- (2014•德化县模拟)某新型电池NaBH4(其中B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境
 (2014•德化县模拟)某新型电池NaBH4(其中B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境的电源,其工作原理如图所示.下列说法正确的是( )
(2014•德化县模拟)某新型电池NaBH4(其中B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境的电源,其工作原理如图所示.下列说法正确的是( )
A.电池工作时Na+从b极区移向a极区
B.b极上的电极反应式为:H2O2+2e-+2H+═2H2O
C.每消耗3molH2O2,转移3mol e-
D.a极上的电极反应式为:BH4-+8OH--8e-═BO2-+6H2O 打武松的虎1年前1
打武松的虎1年前1 -
 老驴驴 共回答了15个问题
老驴驴 共回答了15个问题 |采纳率100%解题思路:由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2得电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,原电池工作时,阳离子向正极移动,阴离子向负极移动,以此解答该题.由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2得电子被还原生成OH-,
A.该装置是原电池,原电池放电时,阳离子向正极移动,所以Na+从a极区移向b极区,故A错误;
B.b电极反应式应该为H2O2+2e-=2OH-,故B错误;
C.根据b电极反应式H2O2+2e-=2OH-可判断每消耗3molH2O2,转移的电子为6mol,故C错误;
D.反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故D正确;
故选:D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池的工作原理,题目难度中等,本题注意根据物质化合价的变化判断两极反应为解答该题的关键,注意电极反应式的书写.1年前查看全部
- 草酸亚铁(FeC 2 O 4 •2H 2 O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(
草酸亚铁(FeC 2 O 4 •2H 2 O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl 2 )溶液反应生成黑色的钯粉。回答下列问题:
I.兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质生成,则上述现象说明气体产物中有 。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:________; 假设2:FeO; 假设3:FeO和Fe混合物
②设计实验方案证明假设3。
限选试剂: 1.0 mol•L - 1 盐酸、3% H 2 O 2 、0.1 mol•L - 1 CuSO 4 、20% KSCN、蒸馏水。实验步骤 现象与结论 步骤1 :向试管中加入少量固体产物,再加入足量_________________,充分振荡 若溶液颜色明显改变,且有_______生成,则证明有铁单质存在 步骤2: 将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 步骤3:取步骤2得到的少量固体与试管中, 滴加___________________________________
_______________________________________
__________________________________
___________________________________
II.某草酸亚铁样品中含有少量草酸(为方便于计算,草酸亚铁中草酸根和草酸分子均用C 2 O 4 2 - 代替)。现用滴定法测定该样品中FeC 2 O 4 的含量。滴定反应分别是:5Fe 2+ +MnO 4 - +8H + =5Fe 3+ +Mn 2+ +4H 2 O、5C 2 O 4 2 - +2MnO 4 - +16H + =10CO 2 ↑+2Mn 2+ +8H 2 O。
(3)实验方案设计为:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H 2 SO 4 溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V 1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H 2 SO 4 溶液,煮沸5~8min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记录数据。重复滴定2次。平均消耗V 2 mL。
③若某小组的一次测定数据记录如下: V 1 = 18.90mL,V 2 =6.20mL。根据数据计算0.20g样品中:n(Fe 2+ )= ; n(C 2 O 4 2 - )= ;FeC 2 O 4 的质量分数为 (精确到0.01%,FeC 2 O 4 的式量为144) 深层qq的女人1年前1
深层qq的女人1年前1 -
 俗张大民 共回答了18个问题
俗张大民 共回答了18个问题 |采纳率83.3%(16分)I.(1)CO 2 、CO (2分) (2)① Fe (2分)
②
实验步骤
现象与结论
步骤1:硫酸铜溶液(1分)
暗红色固体(1分)
步骤3:过量HCl,静置,取上层清液,滴加适量H 2 O 2 ,充分振荡后滴加KSCN (2分)
若溶液呈血红色,则证明有FeO (2分)
II.(3)n(Fe 2+ )=0.0006200mol n(C 2 O 4 2 - )=0.0006350mol FeC 2 O 4 的质量分数为44.64%(每空2分,共6分)
1年前查看全部
- 手电筒用的电源是?汽车上照明用的电源是?电子表上用的电源是?还有一些不属于化学电池的新型电池,如--------电池
 jitao9111年前2
jitao9111年前2 -
 4257416 共回答了14个问题
4257416 共回答了14个问题 |采纳率92.9%手电筒用的电源是干电池 汽车上照明用的电源是铅蓄电池 电子表上用的电源是银锌纽扣电池 还有一些不属于化学电池的新型电池,如太阳能电池1年前查看全部
- 干电池、蓄电池是我们常见的电源,为了适应工业、生活以及宁宙航行等新技术的发展需要,人们研制了多种新型电池.请你通过各种途
干电池、蓄电池是我们常见的电源,为了适应工业、生活以及宁宙航行等新技术的发展需要,人们研制了多种新型电池.请你通过各种途径查一查目前新型电池都有哪些种,它们的优点是什么?
 77秋夜雨1年前1
77秋夜雨1年前1 -
 hbjt 共回答了23个问题
hbjt 共回答了23个问题 |采纳率95.7%解题思路:根据对电池的了解分析答题.答:太阳能电池,优点:节能环保;
锂离子电池:体积小,容量大,寿命长.点评:
本题考点: 电源及其能量转化.
考点点评: 根据对电池的了解分析答题,本题是一道开放题,答案并不唯一.1年前查看全部
- 放射性同位素电池是一种新型电池,它是利用放射性同位素衰变放出的高速带电粒子(α射线、β射线)与物质相互作用, 射线的动能
放射性同位素电池是一种新型电池,它是利用放射性同位素衰变放出的高速带电粒子(α射线、β射线)与物质相互作用, 射线的动能被阻止或吸收后转变为热能,再通过换能器转化为电能的一种装置。其构造大致是:最外层是由合金制成的保护层,次外层是防止射线泄漏的辐射***层,第三层是把热能转化成电能的换能器,最里层是放射性同位素。电池使用的三种放射性同位素的半衰期和发出的射线如下表。若选择下述某一种同位素作为放射源,使用相同材料制成的辐射***层,制造用于执行长期航天任务的核电池,则下列论述正确的是 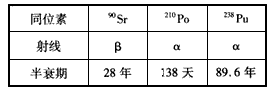 [ ]
[ ]a.放射性同位素在发生衰变时,出现质量亏损,但衰变前后的总质量数不变
b. 238 pu的半衰期最长,使用寿命最长,放出的α射线比β射线的贯穿本领弱,所需的***材料较薄
c. 210 po的半衰期最短,使用寿命最长,放出的α射线比β射线的贯穿本领弱,所需的***材料较薄
d. 90 sr的半衰期较长,使用寿命较长,放出的β射线比α射线的贯穿本领弱,所需的***材料较薄 wellina1年前1
wellina1年前1 -
 wangp0409 共回答了21个问题
wangp0409 共回答了21个问题 |采纳率95.2%AB1年前查看全部
- 氢氧燃料电池是一种新型电池,具有能量转化率高,燃烧产物为水,不污染环境等优点.有关该电池的说法中正确的是( )
氢氧燃料电池是一种新型电池,具有能量转化率高,燃烧产物为水,不污染环境等优点.有关该电池的说法中正确的是( )
A.通入氢气的电极为负极
B.电流从氢电极流向氧电极
C.反应中电子从氧转移给氢
D.反应中电能转化成了化学能 马踏飞燕_ff1年前1
马踏飞燕_ff1年前1 -
 liyanyanyanyana 共回答了14个问题
liyanyanyanyana 共回答了14个问题 |采纳率78.6%解题思路:氢氧燃料电池是将化学能转变为电能的电池,属于原电池,该原电池放电时,燃料失去电子发生氧化反应,投放燃料的电极是负极,则投放氧化剂的电极是正极,电子从负极沿导线流向正极,电流则相反.A、该原电池放电时,氢气失电子发生氧化反应,则投放燃料的电极是负极,故A正确;
B、该原电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,电流从氧电极沿导线流向氢电极,故B错误;
C、反应中电子从氢转移给氧,故C错误;
D、该反应中是将化学能转变为电能,故D错误.
故选A.点评:
本题考点: 常见化学电源的种类及其工作原理.
考点点评: 本题以燃料电池为载体考查了原电池原理,根据燃料电池中得失电子来判断正负极即可,难度不大.1年前查看全部
- 氢氧燃烧电池是一种高效、低污染的新型电池,主要用于航天领域.它的电极材料一般为活性电极.
氢氧燃烧电池是一种高效、低污染的新型电池,主要用于航天领域.它的电极材料一般为活性电极.
具有很强的催化活性,如铂电极、活性炭电极等,该电池__为燃料,__为氧化剂,可用__性电解质,也可用__性电解质,如( ).当用酸性电解质时,电极反应为;负极;___________ 正极;___________总反应式为;__________.当用碱性电解质时,电极反应式为;负极;___________正极;___________ 希望大家帮我把空填一下, 飞翔德剑10011年前2
飞翔德剑10011年前2 -
 绯色春深 共回答了18个问题
绯色春深 共回答了18个问题 |采纳率94.4%氢 氧 酸 碱 氢氧化钾 H2—2e-=H+ O2+(2H+)=H2O
2H2+O2=2H2O H2—(2e-)+2OH-=2H2O O2+2H2O+e-=4OH-1年前查看全部
- BD是错的,为什么某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料, 该电池可用作深水勘探等无空
BD是错的,为什么
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料, 该电池可用作深水勘探等无空气环境电源,其工作原理如下图所 示.下列说法正确的是
A.a极上的电极反应式为:BH4- + 8OH- - 8e- = BO2- + 6H2O
B.b极上的电极反应式为:H2O2 + 2e- + 2H+ = 2H2O
C.每消耗3mol H2O2,转移3mol e-
D.电池工作时Na+从b极区移向a极区
 slxin1年前2
slxin1年前2 -
 大金鸟 共回答了15个问题
大金鸟 共回答了15个问题 |采纳率86.7%分享知识,传递感动,【云水意】团队为您竭诚解答!
所以b极会产生OH-,所以反应物中不可能有氢离子,所以b极反应是过氧化氢得到电子变成两个氢氧根;
D,电池工作时,a极失去电子,正电性升高,b极得到电子,负电性升高,在电场下钠离子会向b极移动.
希望对你有所帮助!
不懂请追问!
望采纳!1年前查看全部
- 氯铝电池是一中新型电池,电解质溶液是KOH溶液,试回答下列问题:
氯铝电池是一中新型电池,电解质溶液是KOH溶液,试回答下列问题:
通入氯气的电极是什么极,电极反应式是什么?
通入铝的电极是哪一极,电极反应式是什么? ll包包1年前1
ll包包1年前1 -
 maohuan000 共回答了14个问题
maohuan000 共回答了14个问题 |采纳率85.7%阴 cl2+2e=2cl-
阳 Al-3e=Al3+1年前查看全部
- (2012•吉林一模)氢氧碱性燃料电池是一种高效、环境友好的新型电池,在航空航天、潜艇和汽车等领域得到了广泛的应用.
(2012•吉林一模)氢氧碱性燃料电池是一种高效、环境友好的新型电池,在航空航天、潜艇和汽车等领域得到了广泛的应用.
(1)写出该电池两极的电极反应式.
负极:______,
正极:______.
(2)用该燃料电池做电源,以石墨为电极电解足量的饱和食盐水,请回答下列问题:
①写出电解饱和食盐水发生反应的化学方程式:2NaCl+2H2O
2NaOH+H2↑+Cl2↑电解 .2NaCl+2H2O.
2NaOH+H2↑+Cl2↑电解 .
②每生成0.1mol阳极产物,燃料电池中消耗氢气的物质的量为______. luokangkang1年前1
luokangkang1年前1 -
 狗狗家乖乖 共回答了24个问题
狗狗家乖乖 共回答了24个问题 |采纳率87.5%解题思路:(1)氢氧燃料碱性电池中,负极上燃料失电子发生氧化反应,正极上氧气得电子发生还原反应;
(2)用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;
根据转移电子守恒计算消耗氢气的物质的量.(1)氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为:2H2+4OH--4e-═4H2O,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-═4OH-,
故答案为:2H2+4OH--4e-═4H2O;O2+2H2O+4e-═4OH-;
(2)①用惰性电极电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中还生成氢氧化钠,所以电池反应式为2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑;
②电解时,阳极上生成氯气,每生成 0.1mol 转移电子的物质的量=0.1mol×(1-0)×2=0.2mol,
燃料电池中消耗氢气的物质的量=
0.2mol
2×(1−0)=0.1mol,
故答案为:0.1mol.点评:
本题考点: 化学电源新型电池;电解原理.
考点点评: 本题考查了原电池和电解池原理,根据原电池中正负极上得失电子及串联电路中转移电子相等来分析解答即可,难度不大,注意氢氧燃料电池在酸性或碱性介质中电极反应式的差别,为易错点.1年前查看全部
- (2013•自贡一模)研究表明:用纳米硅粉和藻朊酸盐制成电池的电极,其容量是一般电池的8倍.在测定一节该新型电池的电动势
(2013•自贡一模)研究表明:用纳米硅粉和藻朊酸盐制成电池的电极,其容量是一般电池的8倍.在测定一节该新型电池的电动势和内阻的实验中,所提供的器材有:
待测该电池一节(电动势约为2V)
电流表G(量程3.0mA,内阻rl=100Ω)
电流表A(量程0.6A,内阻r2=1.0Ω)
定值电阻R1=100Ω
定值电阻R2=900Ω
滑动变电阻器R′( 0-50Ω)
开关、导线若干
(1)为了更准确测出该电池的电动势和内阻,采用图甲所示实验电路图,其中定值电阻R应选用______(选填“R1”或“R2”).请根据你选定的定值电阻完成图乙中的实物连接.
(2)某同学在实验中测出电流表A和电流表G的示数I和Ig根据记录数据作出Ig-I图象如图丙所示,根据图象可求得,被测电池的电动势E=______V,内阻r=______Ω.(计算结果保留两位小数) 醉看残红乱舞1年前1
醉看残红乱舞1年前1 -
 高春宁 共回答了18个问题
高春宁 共回答了18个问题 |采纳率83.3%解题思路:(1)将表头和定值电阻串联,改装成3V的电压表使用,由欧姆定律求出应串联的电阻阻值.即可选择定值电阻R.
(2)由闭合电路欧姆定律可得出表达式,由图象结合表达式可得出电动势和内电阻;(1)待测电池的电动势约为2V,由于题目中没有电压表,所以用电流计和定值电阻串联,改装成量程为3V的
 电压表,所以
电压表,所以
应串联的电阻R=
3
3×10−3-100=900Ω,故选R2;
(2)由原理图连接实物图所示;
(3)表头的示数与定值电阻阻值的乘积可作为路端电压处理,路端电压U=Ig(R2+r1),将原图象转换成路端电压与电流图象如图所示,
由闭合电路欧姆定律可知:I=0,U=E=1.90V
U-I图象的斜率大小等于电源的内阻,由数学知识得r=0.13
故答案为:
①R2
②如图所示
③1.90;2点评:
本题考点: 测定电源的电动势和内阻.
考点点评: 本题为测量电源的电动势和内电阻的实验的变形,注意由于没有电压表,本实验中采用改装的方式将表头改装为电压表,再根据原实验的研究方法进行分析研究.1年前查看全部
- (2012•宿州一模)“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳
 (2012•宿州一模)“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有______特性,使之能与钠离子充分接触.(2)“水”电池总反应可表示为:5MnO2+2Ag+2NaCL=Na2Mn5O10+2AgCL该电池的负极反应式为______.
(2012•宿州一模)“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有______特性,使之能与钠离子充分接触.(2)“水”电池总反应可表示为:5MnO2+2Ag+2NaCL=Na2Mn5O10+2AgCL该电池的负极反应式为______.
(3)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图1,已知两电极的材料分别为石墨和铁.
①若图中的电池为“水”电池,则其与a极相连的电极是由下列物质中的______制成(填编号,下同).
A.MnO2B.AgC.NaClD.Na2Mn5O10 E.AgCl
②a极的电极反应式为______.
③电解液c可以是______.
A.纯水B.NaCl溶液C.H2SO4溶液D.CuCl2溶液
④当生成1mol Fe(OH)2白色沉淀时将消耗MnO2______mol.
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如图2.请据图2分析:①该温度下,溶度积常数的关系为:KSP[Fe(OH)3]______
KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
______. 一遍又一遍1年前1
一遍又一遍1年前1 -
 27274912 共回答了23个问题
27274912 共回答了23个问题 |采纳率87%解题思路:(1)纳米材料具有较强的吸附性能,能加大吸附面积;
(2)原电池的负极上发生的是失电子的氧化反应;
(3)①根据电解池的工作原理来确定电极材料以及电解质溶液;
②电解池中阳极是活泼金属时,则电极本身发生失电子的氧化反应;
③在电解池的阴极上是阳离子发生得电子的还原反应,根据总反应来确定电解质的选择;
④根据电子守恒进行计算;
(4)①根据Ksp的意义以及沉淀的转化知识来判断生成的沉淀是什么;
②根据沉淀溶解平衡移动的影响因素知识来回答判断.(1)纳米材料具有较强的吸附性能,能加大吸附面积,该电池用二氧化锰纳米棒为正极材料可提高发电效率,故答案为:较强吸附能力;
(2)根据电池的总反应:5MnO2+2Ag+2NaCL=Na2Mn5O10+2AgCl,失电子的是金属银,而原电池的负极上发生的是失电子的氧化反应,所以负极反应是Ag+Cl--e-=AgCl↓,故答案为:Ag+Cl--e-=AgCl↓;
(3)①做电极的材料是可以导电的金属单质、非金属单质或是其他固体物质,故NaCl、Na2Mn5O10、AgCl都不可以,金属银作阳极会发生金属银失电子的氧化反应,故不行,故答案为:A;
②电解池中阳极是活泼金属时,则电极本身发生失电子的氧化反应,制取氢氧化亚铁时,金属铁在阳极上反应,即Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
③在电解池的阴极上是阳离子氢离子发生得电子的还原反应,氢氧根浓度增加,所以会出现氢氧化铁,合适的电解质只能是氯化钠溶液,故答案为:B;
④根据电池反应:5MnO2+2Ag+2NaCL=Na2Mn5O10+2AgCl,当生成1molFe(OH)2白色沉淀时将转移2mol电子,所以消耗MnO2的物质的量是5mol,故答案为:5;
(4)①根据图象上的点可以知道,当阳离子铁离子、镁离子浓度相等时,对应的氢离子浓度的大小关系,结合Ksp(氢氧化铁)=c(Fe3+)•c(OH-)3,Ksp(氢氧化镁)=c(Mg2+)•c(OH-)2,所以KSP[Fe(OH)3]<KSP[Mg(OH)2],故答案为:<;
②根据①的分析,KSP[Fe(OH)3]<KSP[Mg(OH)2],氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2⇌Mg2++2OH-,当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,机会生成红褐色沉淀物质,
故答案为:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2⇌Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀.点评:
本题考点: 化学电源新型电池;难溶电解质的溶解平衡及沉淀转化的本质;电解原理.
考点点评: 本题是要综合知识考查题,要求学生具有分析和解决问题的能力,难度较大.1年前查看全部
- 燃料电池是目前正在探索的一种新型电池.它主要是利用燃料在燃烧过程中把化学能直接转化为电能...
燃料电池是目前正在探索的一种新型电池.它主要是利用燃料在燃烧过程中把化学能直接转化为电能...
目前已经使用的氢氧燃料电池的基本反映是:x极:O2(气)+2H2O(液)+4e-==4OH-
y极:H2(气)+2OH-==2H2O(液)+2e-
(1)x是——,发生——反应(氧化、还原)
(2)y是负极,发生——反应,总反应方程式为———————— 我叫阿槐1年前2
我叫阿槐1年前2 -
 在线小说 共回答了24个问题
在线小说 共回答了24个问题 |采纳率87.5%记住一般是氢负氧正,得到电子发生还原反应,失去电子发生氧化反应,因此,X为正极发生还原反应,Y为负极发生氧化反应.总反应H2(气)+O2(气)=2H2O(液)1年前查看全部
- 甲醇和氧气以及强碱做电解质溶液的新型电池 其负极反应式 急
 扬谷的天空1年前1
扬谷的天空1年前1 -
 沪QQ17156504 共回答了15个问题
沪QQ17156504 共回答了15个问题 |采纳率86.7%CH3OH+8OH-_6e- = CO3 2- + 6H2O1年前查看全部
- 老是从新闻上看见科学家发明新型电池,为什么总不见应用?
老是从新闻上看见科学家发明新型电池,为什么总不见应用?
每隔两三月,都有新闻说某个***发明了可以快速充电,或者体积小,储电量大的电池.可是总不见批量生产.好电池也没见普及.到现在还是手机用锂电池,汽车用铅酸电池. 北溟养望1年前1
北溟养望1年前1 -
 liujian-2 共回答了15个问题
liujian-2 共回答了15个问题 |采纳率86.7%成本问题, 虽然研究出来了 ,但是大多是实验室产品.不能进行批量生产.
比如制备氧气,在实验室,我们用高锰酸钾加热,简单快捷.但是如果工业上也这么干,成本就高了.所以,工业方法就是从空气中分离氧气.
你看到的那些发明,都是高锰酸钾加热制氧气.大家还没发现怎么分离空气,所以 都没有开始应用.1年前查看全部
- 研究表明:用纳米硅粉和藻朊酸盐制成电池的电极,其容量是一般电池的8倍.在测定一节该新型电池的电动势和内阻的实验中,所提供
研究表明:用纳米硅粉和藻朊酸盐制成电池的电极,其容量是一般电池的8倍.在测定一节该新型电池的电动势和内阻的实验中,所提供的器材有:
待测该电池一节(电动势约为2V)
电流表 (量程3.0mA,内阻rl=100Ω)
(量程3.0mA,内阻rl=100Ω)
电流表 (量程0.6A,内阻r2=1.0Ω)
(量程0.6A,内阻r2=1.0Ω)
定值电阻R1=100Ω定值电阻R2=900Ω
滑动变电阻器R'( 0-50Ω)开关、导线若干
①为了更准确测出该电池的电动势和内阻,采用图甲所示实验电路图,其中定值电阻R应选用______(选填“R1”或“R2”).请根据你选定的定值电阻完成图乙中的实物连接.
②某同学在实验中测出电流表 和电流表
和电流表 的示数I和Ig根据记录数据作出Ig-I图象如图丙所示,根据图象可求得,被测电池的电动势E=______V,内阻r=______Ω.(计算结果保留两位小数).此测量结果______(填“有”或者“没有”)系统误差.
的示数I和Ig根据记录数据作出Ig-I图象如图丙所示,根据图象可求得,被测电池的电动势E=______V,内阻r=______Ω.(计算结果保留两位小数).此测量结果______(填“有”或者“没有”)系统误差.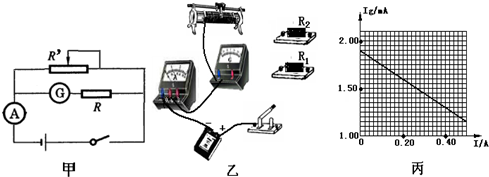
 ucjunlan1年前1
ucjunlan1年前1 -
 saya110 共回答了19个问题
saya110 共回答了19个问题 |采纳率94.7%解题思路:①将表头和定值电阻串联,改装成3V的电压表使用,由欧姆定律求出应串联的电阻阻值.即可选择定值电阻R.根据电路图连接实物电路图.
②由闭合电路欧姆定律可得出表达式,由图象结合表达式可得出电动势和内电阻;根据实验电路分析实验误差.①待测电池的电动势约为2V,由于题目中没有电压表,所以用电流计和定值电阻串联,改装成量程为3V的电压表,所以应串联的电阻R=[3
3×10−3-100=900Ω,故选R2;根据电路图连接实物电路图,实物电路图如图所示:
②表头的示数与定值电阻阻值的乘积可作为路端电压处理,路端电压U=Ig(R2+r1),
将原图象转换成路端电压与电流图象如图所示,
由闭合电路欧姆定律可知:I=0,U=E=1.90V,
由图示图象可知:k=r+RA=
△U/△I]=[1.90−1.15/0.50]=1.5,电源内阻r=k-RA=1.5-1.0=0.50Ω;
由图示电路图与实验数据处理方法可知,测量结果不存在系统误差.
故答案为:①R2;电路图如图所示;②1.90;0.50;没有.点评:
本题考点: 测定电源的电动势和内阻.
考点点评: 本题为测量电源的电动势和内电阻的实验的变形,注意由于没有电压表,本实验中采用改装的方式将表头改装为电压表,再根据原实验的研究方法进行分析研究.1年前查看全部
- 我省某地太阳能的日辐射量为4.5千瓦时每立方米那么一块面积为0.4平方米的新型电池一天产生的电能
我省某地太阳能的日辐射量为4.5千瓦时每立方米那么一块面积为0.4平方米的新型电池一天产生的电能
可供一只功率为20瓦LED灯正常工作几小时?详细解答 龙之天使1年前3
龙之天使1年前3 -
 509807 共回答了15个问题
509807 共回答了15个问题 |采纳率80%你的电池效率是多少啊... 现在比较好的硅基太阳能电池的效率也就是20%左右吧... 另外太阳能辐射量的单位应该是千瓦时每平方米.
但是题目没说,假定电池效率是100%,而且电能可以储存(没有损耗),W = 4.5 kWh/m^2 * 0.4 m^2 = 1.8 kWh; t = W/P = 1.8 kWh / 20W = 1800 Wh / 20W = 90h
所以可工作90个小时.
请拿这道题吐槽你们出题的老师,太不严谨了.1年前查看全部
大家在问
- 12008年5月12日,在我省汶川县发生的8.0级特大地震给灾区带来了巨大的人员伤亡和经济损失.地震时震源的振动以横波和纵
- 2三角形的三个内角的度数分别为x度,y度,y度.写出y与x的函数关系式
- 3有一架飞机沿水平方向向左做匀速直线运动,每隔1s从飞机上投掷一包救灾物资。当有三包救灾物资落下且未落至地面时,若不计空气
- 4《成长是一件怎样的事》的阅读答案
- 5一个长方体的长,宽,高分别是11cm,6cm,14cm,如果搞减少3cm,那么表面积减少()cm,体积减少()cm急
- 6翻译:植物没有水和空气就不能生存.plants ____ live ____air____ ____.
- 7盲人判断不了颜色,然后,老师就将试卷发给每个学生,然后交盲人怎么分辨颜色,用英语怎么翻译这段话
- 8高中地理必修一的地球方面的,计算的要怎么学?
- 9饮湖上初晴后雨和钱塘湖春行写作背景是否不同.
- 10外研版九年级上册英语单词
- 11语文的阅读理解做那种反应了人物当时怎样的心里的题怎么做
- 12若三角形的各边张为互不相等的整数,且周长小于13,则这样的三角形共有几个
- 13已知如图,在△ABC中,AB=AC,AD垂直BC于D,AN是△ABC外角∠CAM的平分线,CE垂直AB于E.
- 14有一个三位数,它的各个数位上的和是12,各个数位上的积是30,这样的三位数有多少?
- 15请教“雕刻时光”用英语翻译 简介点的我做标题
