钡盐、银盐、铜盐、铁盐、亚铁盐、铝盐溶解性
 1952552022-10-04 11:39:541条回答
1952552022-10-04 11:39:541条回答与这些阴离子搭配
亚硫酸根离子、亚硝酸根离子、卤离子

已提交,审核后显示!提交回复
共1条回复
 水舞花影 共回答了18个问题
水舞花影 共回答了18个问题 |采纳率100%- 亚硫酸根:钡盐不溶、银盐不溶不稳、铜盐不溶不稳、铁盐不存在、亚铁盐不溶不稳、铝盐不存在
亚硝酸根离子:钡盐不溶、铜盐不溶、铁盐不存在、亚铁盐不溶、铝盐不存在
氟离子:钡盐不溶、银盐溶、铜盐溶、铁盐易配合、亚铁盐易配合、铝盐不溶
其它卤离子:钡盐溶、银盐不溶、铜盐溶、铁盐溶(FeI3不存在)、亚铁盐溶、铝盐溶 - 1年前
相关推荐
- 求银盐卤素的性质如AgF AgCl AgBr
 alwamldi1年前2
alwamldi1年前2 -
 生活就是一团乱麻 共回答了10个问题
生活就是一团乱麻 共回答了10个问题 |采纳率80%氟化银
,也称作氟化银(I),是银(I)的氟化物,化学式为AgF.在常温下为白色固体或黄棕色固体,熔点435°C,暴露于潮湿空气时变黑.与其他卤化银不同,氟化银极易溶于水,在标况下(25摄氏度,298K,101kPa)溶解度为1800g/L,合约14.17mol/L,也可溶于乙腈,也能溶于硝酸等强酸.
氯化银
,白色粉末.见光变紫并逐渐变黑.25℃时水中溶解度为1.93mg/L,盐酸能增加其在水中溶解度,溶于250份浓盐酸、13份10%氨水.溶于氰化钠、硫代硫酸钠、碳酸铵、浓氯化铵、硝酸汞和硝酸银溶液.不溶于乙醇和稀盐酸.相对密度5.560.熔点455℃.沸点1550℃.折光率2.071.
溴化银,
浅黄色结晶或粉末.无气味.见光色变深.溶于220份饱和氯化钠和35份饱和溴化钾溶液,溶于氰化钾溶 液、浓氨水,微溶于碳酸铵溶液、硫代硫酸钠、硫氰酸钾溶液和稀氨溶液,不溶于水、乙醇和多数酸类.相对密度(d254)6.473.熔点432℃.沸点700℃(分解).折光率2.253.
碘化银
浅黄色无定形粉末或六方、立方结晶.无气味.遇空气与光逐渐变为黑色.能缓慢地与沸的浓酸反应,而不与热的氢氧化碱溶液反应.易溶于氰化碱和碘化碱溶液,溶于浓的氢碘酸、溴化碱、氯化碱、硫氰酸碱、硫代硫酸碱、硝酸汞和硝酸银溶液,几乎不溶于水、氢碘酸以外的酸和碳酸铵溶液,在化学反应中常作为沉淀.相对密度5.67.熔点552℃.沸点1506℃.折光率2.211年前查看全部
- (2014•陕西一模)下表是二种银盐的溶度积常数KSP(25℃).下列说法不正确的是( )
(2014•陕西一模)下表是二种银盐的溶度积常数KSP(25℃).下列说法不正确的是( )
化学式 AgCl AgBr AgI 颜色 白 浅黄 黄 Ksp(25℃) 1.4×10-10 7.7×10-13 8.51×10-16
A.25℃时.二种银盐的饱和溶液中,c(Ag+)最大的是AgCl溶液
B.在AgCl的悬浊液中加入0.1mol•L-1的KI溶液,可能有黄色沉淀产生
C.25℃时.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D.在AgBr的悬浊液中加入0.1mol•L-1的KI溶液.发生反应的离子方程式为I-+Ag+═AgI↓ 黑夜彩虹enigma1年前1
黑夜彩虹enigma1年前1 -
 物事人非事事休 共回答了17个问题
物事人非事事休 共回答了17个问题 |采纳率88.2%解题思路:A.结构相似的难溶性盐,Ksp越大,其溶解度越大;
B.根据沉淀转化原理分析;
C.溶度积只与温度有关;
D.AgBr属于难溶电解质,在离子方程式中写化学式.A.由表中数据可知溶度积最大的是AgCl,其溶解度也最大,所以c(Ag+)最大的是AgCl溶液,故A正确;
B.AgI溶度积小于AgCl,溶解度小的沉淀转化为溶解度更小的容易实现,所以在AgCl的悬浊液中加入0.1mol•L-1的KI溶液,可能有黄色沉淀产生,故B正确;
C.溶度积只与温度有关,所以25℃时.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同,故C正确;
D.AgBr属于难溶电解质,在离子方程式中写为化学式,所以在AgBr的悬浊液中加入0.1mol•L-1的KI溶液,发生反应的离子方程式为AgBr(s)+I-(aq)⇌AgI(s)+Br-(aq),故D错误;
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度不大,本题注意比较表中数据,把握溶解平衡的特征以及影响因素.1年前查看全部
- 一些可溶性的重金属盐(如铜盐、钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性而丧失其生理功能,危及生命。由此
一些可溶性的重金属盐(如铜盐、钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性而丧失其生理功能,危及生命。由此可知,可溶性重金属盐为有毒物质。在医疗上用X射线检查肠胃时,常让病人服用硫酸钡的悬浊液(俗称钡餐,BaSO 4 不溶于水也不溶于酸),但不能服用碳酸钡,其原因是什么?万一因BaCl 2 中毒有人认为应服Na 2 SO 4 ,你认为是否合适?你认为什么方法既简单又科学?  ha80001年前1
ha80001年前1 -
 jiaotongd 共回答了22个问题
jiaotongd 共回答了22个问题 |采纳率86.4%碳酸钡可与胃酸中盐酸反应生成可溶性的钡盐( BaCl 2 ),被人体吸收导致蛋白质变性,引起中毒。万一中毒服用Na 2 SO 4 则会引起体内氯化钠含量增高,所以最好用富含蛋白质的牛奶、豆浆来解毒。1年前查看全部
- 如何用两种不同的方法区别锌盐和铜盐、锌盐和镉盐、银盐和汞盐?
 928471411年前1
928471411年前1 -
 ajeie 共回答了21个问题
ajeie 共回答了21个问题 |采纳率85.7%【1】锌属两性金属,对应的难溶碱即可溶于强酸也可溶于强碱.
所以区别锌盐和铜盐,锌盐和镉盐都可以加入足量的NaOH溶液,先形成白色沉淀后溶解的是锌盐,形成沉淀不溶解的是铜盐和镉盐.
【2】区别银盐和汞盐可用Cl-,形成白色沉淀的是银盐.1年前查看全部
- 银盐与na2s2o3反应方程式
 北风吹向1年前1
北风吹向1年前1 -
 kokofun 共回答了18个问题
kokofun 共回答了18个问题 |采纳率94.4%Ag+ + 2S2O3^2- = Ag(S2O3)2^3-
生成络合物1年前查看全部
- 下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是( )
下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是( )
化学式 AgCl Ag2SO4 Ag2S AgBr AgI 溶度积 1.8×10-10 1.4×10-5 6.3×10-50 5.0×10-13 8.3×10-17
A.五种物质在常温下溶解度最大的是Ag2SO4
B.向AgCl的悬浊液中加入0.1mol/L Na2S溶液,则可以生成黑色的Ag2S沉淀
C.外界条件改变时,沉淀溶解平衡也会发生移动
D.常温下,向AgI的悬浊液中加入0.1mol/L NaCl溶液,黄色沉淀变成白色沉淀 solider9920001年前1
solider9920001年前1 -
 linhaue 共回答了20个问题
linhaue 共回答了20个问题 |采纳率100%解题思路:由表中数据可知溶解度最大的是Ag2SO4,最小的是Ag2S,AgCl、AgBr、AgI的溶解度依次减小.A、由表中数据可知溶解度最大的是Ag2SO4,微溶于水,其它物质难溶,故A正确;
B、Ag2S溶度积远小于AgCl,Ag2S难溶于水,在AgCl的饱和溶液中加入Na2S,则可以生成黑色的Ag2S沉淀,故B正确;
C、化学平衡为动态平衡,当外界条件发生改变时,平衡发生移动,故C正确;
D、AgCl的溶解度大于AgI的溶解度,故AgCl可以转化为AgI,反之则不可以,故D错误.
故选:D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度中等,本题注意比较表中数据,把握溶解平衡的特征以及影响因素.1年前查看全部
- 下表是五种银盐的溶度积常数(25℃).下列说法错误的是( )
下表是五种银盐的溶度积常数(25℃).下列说法错误的是( )
化学式 AgCl Ag2SO4 Ag2S AgBr AgI 溶度积 1.8×10-10 1.4×10-5 6.3×10-50 7.7×10-13 8.51×10-16
A.五种物质在常温下溶解度最小的是Ag2S
B.向AgCl悬浊液中加入Na2S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度依次增大
D.难溶电解质的溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 bill441年前0
bill441年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一些可溶性的重金属盐(如铜盐、钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性而丧失其生理功能,危及生命.由此
一些可溶性的重金属盐(如铜盐、钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性而丧失其生理功能,危及生命.由此可知,可溶性的重金属盐为有毒物质.在医疗上用X射线检查肠胃病时,常让病人服用硫酸钡的悬浊液(俗称钡餐.硫酸钡不溶于水,也不与酸反应),但不能服用碳酸钡,其原因是人体胃液中含有一定的______(填物质的化学式)与碳酸钡反应后,产生了一定量的使人中毒的______离子.若因氯化钡中毒,甲、乙两同学提出了两种不同的解毒方案:甲认为可以饮用硫酸钠溶液来解毒,乙同学认为可以多饮鲜牛奶,你认为谁的方案更好,还有其他方案吗?请你补充一个.
 飞火流1年前1
飞火流1年前1 -
 kai99 共回答了15个问题
kai99 共回答了15个问题 |采纳率100%解题思路:胃酸的成分是盐酸,化学式为:HCl.
重金属盐有毒是因可溶的重金属盐可电离出重金属离子,硫酸钡是难溶于水且难溶于酸的钡盐,因而不能电离出钡离子;而碳酸钡可与胃液中的盐酸反应生成可溶性的氯化钡,能电离出钡离子.
解毒时服用的物质不应对人体有害,或过量时对人体健康有影响.胃酸的成分是盐酸,化学式为:HCl.
由于硫酸钡是难溶于水且难溶于酸的钡盐,因而不能电离出钡离子被人体吸收,不会使人体内的蛋白质变性,而碳酸钡可与胃液中的盐酸反应生成可溶性的氯化钡,能电离出钡离子,易被人体吸收而导致蛋白质变性,引起中毒.
若服用硫酸钠,则会导致人体内钠盐的含量增多,导致疾病发生,富含蛋白质的鲜牛奶、豆浆等是人体需要的营养物质,又含蛋白质,可阻止钡离子破坏人体蛋白质.
故答案为:HCl;Ba2+;乙;吃豆制品.点评:
本题考点: 常见中毒途径及预防方法;酸的化学性质;化学式的书写及意义;亚硝酸钠、甲醛等化学品的性质与人体健康.
考点点评: 理解重金属盐中毒的原理,掌握复分解反应的条件,以及人体营养元素与营养物质的基本知识,是解决问题的关键.1年前查看全部
- 下表是五种银盐的溶度积常数(25℃):下列说法错误的是 [ ] A.五种
下表是五种银盐的溶度积常数(25℃):下列说法错误的是  [ ]
[ ]A.五种物质在常温下溶解度最大的是Ag 2 SO 4
B.将氯化银溶解于水后,向其中加入Na 2 S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 top7771年前1
top7771年前1 -
 上不了岸de潮 共回答了22个问题
上不了岸de潮 共回答了22个问题 |采纳率100%C1年前查看全部
- 溶碱钾钠钡胺,微溶是氢氧化钙.钾钠铵盐都是可溶盐.盐酸盐除银盐.硫酸盐除钡盐微溶钙银盐,碳酸盐除只溶钾钠铵,微溶是镁盐.
溶碱钾钠钡胺,微溶是氢氧化钙.钾钠铵盐都是可溶盐.盐酸盐除银盐.硫酸盐除钡盐微溶钙银盐,碳酸盐除只溶钾钠铵,微溶是镁盐.硝酸盐都是可溶盐.所学算都是可溶酸.这是个化学的口诀 能不能麻烦大家清楚的解释下?
 sail4851年前2
sail4851年前2 -
 江南布衣girl 共回答了18个问题
江南布衣girl 共回答了18个问题 |采纳率88.9%可按照书中图表所给,只需记住不可溶的与微溶的,其他的就是可溶的1年前查看全部
- 碱盐的溶解性解释钾钠铵钡四碱溶,钾钠铵硝盐全溶盐酸盐,除银盐,硫酸盐,除钡盐碳酸盐,唯有钾钠铵可溶
 myc2002611年前3
myc2002611年前3 -
 本叔叔 共回答了21个问题
本叔叔 共回答了21个问题 |采纳率85.7%钾钠铵钡四碱溶:氢氧化钾,氢氧化钠,一水合氨,氢氧化钡可溶于水
钾钠铵硝盐全溶:钾盐,钠盐,铵盐,硝酸盐都溶于水
盐酸盐,除银盐:盐酸盐(氯化某)只有氯化银不溶于水,其他盐酸盐全溶于水
硫酸盐,除钡盐:硫酸盐中只有硫酸钡不溶于水,其他硫酸盐全溶于水(硫酸钙微溶于水)
碳酸盐,唯有钾钠铵可溶:碳酸盐中只有碳酸钾,碳酸钠,碳酸铵溶于水,其他碳酸盐都不溶于水1年前查看全部
- 下表是五种银盐的溶度积常数(25℃):
下表是五种银盐的溶度积常数(25℃):
下列说法错误的是( )化学式 AgCl Ag2SO4 Ag2S AgBr AgI 溶度积 1.8×10-10 1.4×10-5 6.3×10-50 7.7×10-13 8.51×10-16
A. 五种物质在常温下溶解度最大的是Ag2SO4
B. 将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C. 对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D. 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 我好热啊1年前1
我好热啊1年前1 -
 153fish 共回答了13个问题
153fish 共回答了13个问题 |采纳率100%解题思路:A.Ag2SO4的Ksp最大,所以其溶解度最大;
B.硫化银的溶度积比硫酸银小,从沉淀平衡移动的角度分析;
C.结构相似的难溶性盐,溶度积越小,溶解度越小;
D.难溶电解质的溶解平衡是一定条件下的动态平衡.A.由表中数据可知溶度积最大的是Ag2SO4,Ag2SO4微溶于水,其它物质难溶,所以Ag2SO4溶解度最大,故A正确;
B.Ag2S溶度积远小于AgCl,Ag2S难溶于水,在AgCl的饱和溶液中加入Na2S,则可以生成黑色的Ag2S沉淀,故B正确;
C.结构相似的难溶性盐,溶度积越小,溶解度越小,由表格中的数据可知AgCl、AgBr、AgI的溶解度依次减小,所以对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小,故C错误.
D.难溶电解质的溶解平衡是一定条件下的动态平衡,当条件改变,平衡要发生移动,故D正确;
故选:C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度中等,本题注意比较表中数据,把握溶解平衡的特征以及影响因素.1年前查看全部
- 下表是五种银盐的溶度积常数(25℃)。下列说法错误的是 [ ] A.五种
下表是五种银盐的溶度积常数(25℃)。下列说法错误的是  [ ]
[ ]A.五种物质在常温下溶解度最小的是Ag 2 S
B.向AgCl悬浊液中加入Na 2 S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度依次增大
D.难溶电解质的溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 qiuhaihong1年前1
qiuhaihong1年前1 -
 真的很傻 共回答了20个问题
真的很傻 共回答了20个问题 |采纳率90%C1年前查看全部
- 一些可溶性的重金属盐(如钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性而丧失其生理功能,危及生命.由此可知,
一些可溶性的重金属盐(如钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性而丧失其生理功能,危及生命.由此可知,可溶性的重金属盐为有毒物质.在医疗上用X射线检查肠胃病时,常让病人服用BaSO 4 的悬浊液,但不能服用碳酸钡,其原因是胃液与BaCO 3 反应后,产生了一定量的使人中毒的 ______离子.若因BaCl 2 中毒,甲同学认为可以饮用Na 2 SO 4 溶液来解毒,原因是 ______;乙同学认为可以多次饮鲜牛奶,原因是 ______;谁的方案好 ______,我还有的补充方案是 ______.  区欠金白巾水工鸟1年前1
区欠金白巾水工鸟1年前1 -
 最后的温柔一刀 共回答了17个问题
最后的温柔一刀 共回答了17个问题 |采纳率94.1%胃液中含有盐酸,服用碳酸钡后,则发生如下反应BaCO 4 +2HCl=BaCl 2 +H 2 O+CO 2 ↑,氯化钡可溶解于水,能电离出重金属离子钡离子,有毒;硫酸钠和氯化钡反应可生成不溶的硫酸钡和氯化钠,氯化钠摄入过多对人有害,所以甲方案不好;鲜牛奶中富含蛋白质,可防止钡离子破坏人体本身的蛋白质,有解毒作用,且不产生副作用,当然其它富含蛋白质的食物也可以,如饮用豆浆.
故答案为:钡;Na 2 SO 4 与BaCl 2 反应生成不溶性盐BaSO 4 ;钡盐在体液中与牛奶作用,不再与人体蛋白质反应,从而达到解毒效果;乙;多次饮鲜豆浆.1年前查看全部
- 已知一些银盐的颜色和Ksp(25℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
已知一些银盐的颜色和Ksp(25℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
滴定时,你认为该滴定适宜选用的指示剂是
A KBr B KI C K2S D K2CrO4
Ag2CrO4 颜色 红色 Ksp 1.12*10^-12 高智能方程式1年前3
高智能方程式1年前3 -
 bian971 共回答了18个问题
bian971 共回答了18个问题 |采纳率94.4%D K2CrO4
要作为指示剂,它与银离子形成的沉淀的溶解度要稍小于被测物氯离子与银离子形成的沉淀的溶解度.所以只有K2CrO4符合.1年前查看全部
- 一次探究实验课上,老师为同学们准备了三杯溶液,分别是镁盐、铁盐、银盐的溶液中的一种,将三杯溶液标记为l、2、3号,进行下
一次探究实验课上,老师为同学们准备了三杯溶液,分别是镁盐、铁盐、银盐的溶液中的一种,将三杯溶液标记为l、2、3号,进行下列探究活动.
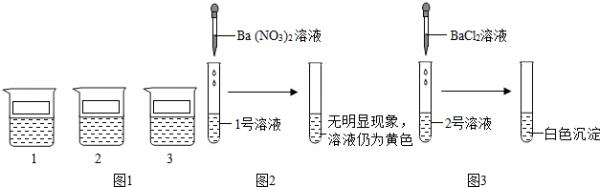
【提出问题】三种溶液中的溶质分别是什么?
探究实验1
【表达与交流】甲同学认为l号溶液中的溶质不是硫酸铁,一定是硝酸铵,你认为他的结论(1)______(填“正确”或“不正确”).
探究实验2
【反思与评价】乙同学认为2号溶液中的溶质一定是硫酸镁,请你对乙同学的结论给与评价(2)______.
探究实验3
根据上述实验,丙同学取少量2号溶液少量分别与l号和3号溶液混合,均立即出现有(3)______生成的现象,由此小组同学确定了三种溶液中分别含有的溶质.(实验中不涉及微溶性物质)
【解释与结论】探究实验3中2号与3号溶液混合发生反应的化学方程式为(4)______,请帮助他们将三种溶液中溶质的化学式填写在烧杯的标签上. coogy1年前1
coogy1年前1 -
 hjj11 共回答了17个问题
hjj11 共回答了17个问题 |采纳率76.5%解题思路:钡离子和硫酸根离子产生硫酸钡沉淀,而1号溶液中加入硝酸钡溶液后没有沉淀产生,说明在1号溶液中不含有硫酸根离子,氯化钡溶液中钡离子容易和硫酸根离子产生硫酸钡沉淀,其中的氯离子也可能和银离子产生氯化银沉淀,所以根据图3中的实验可以判断在2号溶液中,所以可以判断在2号溶液中含有硫酸根离子或是银离子;而探究实验3中,将2号溶液分别与l号和3号溶液混合后应该产生白色沉淀,而题给的三种溶液中没有能够和硫酸根离子结合形成沉淀的,所以可以判断在2号溶液中含有银离子,而没有硫酸根离子,即2号溶液为硝酸银溶液,而1号溶液和3号溶液中都含有氯离子,它们分别为氯化镁和氯化铁溶液;可以据此解答该题.(1)硝酸铵中含有的阳离子为铵根离子,所以溶液不是硫酸镁,更不可能含有硝酸铵,故甲同学的说法不正确;
(2)氯化钡溶液中含有钡离子也含有氯离子,所以当把氯化钡溶液加入到2号溶液时形成的沉淀可能是硫酸钡也可能是氯化银,即不能断定该溶液就是硫酸镁溶液;
(3)钡离子和硫酸根离子产生硫酸钡沉淀,而1号溶液中加入硝酸钡溶液后没有沉淀产生,说明在1号溶液中不含有硫酸根离子,氯化钡溶液中钡离子容易和硫酸根离子产生硫酸钡沉淀,其中的氯离子也可能和银离子产生氯化银沉淀,所以根据图3中的实验可以判断在2号溶液中,所以可以判断在2号溶液中含有硫酸根离子或是银离子;而探究实验3中,将2号溶液分别与l号和3号溶液混合后应该产生白色沉淀,而题给的三种溶液中没有能够和硫酸根离子结合形成沉淀的,所以可以判断在2号溶液中含有银离子,而没有硫酸根离子,即2号溶液为硝酸银溶液,而1号溶液和3号溶液中都含有氯离子,它们分别为氯化镁和氯化铁溶液;
(4)根据(3)的解答可以知道2号溶液为硝酸银溶液,而3号溶液可以是氯化镁溶液,它们反应的化学方程式为:MgCl2+2AgNO3═Mg(NO3)2+2AgCl↓.
故答案为:(1)不正确;
(2)不正确.2号溶液中加入氯化钡溶液出现白色沉淀,溶液中可能含有硫酸镁,因为硫酸镁能与氯化钡反应生成硫酸钡白色沉淀;也可能含有硝酸银,因为硝酸银也能与氯化钡反应生成氯化银白色沉淀,因此乙同学认为2号溶液中的溶质一定是硫酸镁是错误的;
(3)白色沉淀;
(4)MgCl2+2AgNO3═Mg(NO3)2+2AgCl↓.点评:
本题考点: 实验探究物质的组成成分以及含量.
考点点评: 解答这类题目时,首先,赏析问题情景,找到实验探究的反应原理,再根据实验的反应原理,利用所称取的样品进行实验探究,分析推断出该物质的组成成分.1年前查看全部
- 表是五种银盐的溶度积常数(25℃)。下列说法错误的是( )
表是五种银盐的溶度积常数(25℃)。下列说法错误的是( )
A.五种物质在常温下溶解度最大的是Ag 2 SO 4化学式 AgCl Ag 2 SO 4 Ag 2 S AgBr AgI 溶度积 1.8×10 -10 1.4×10 -5 6.3×10 -50 7.7×10 -13 8.5×10 -16
B.将AgCl溶解于水后,向其中加入Na 2 S则可以生成黑色沉淀
C.AgCl 、AgBr、AgI三种物质在常温下的溶解度按氯、溴、碘的顺序减小
D.向100ml0.1mol/LNa 2 SO 4 溶液中加入1mL0.1mol/L AgNO 3 溶液,有沉淀生成 sdgdfshf1年前1
sdgdfshf1年前1 -
 ze174 共回答了24个问题
ze174 共回答了24个问题 |采纳率91.7%D
1年前查看全部
- 根据电对电极电势,如何应用配合物的性质,用fe2+回收银盐中的银
 lelegao1年前1
lelegao1年前1 -
 wy253664501 共回答了16个问题
wy253664501 共回答了16个问题 |采纳率87.5%将Fe2+用CN-配合,使Fe3+/Fe2+电对的标准电极电势变小,从而可以还原Ag+1年前查看全部
- 下表是五种银盐的溶度积常数(25℃) 下列说法错误的是 [ ] A.五种
下表是五种银盐的溶度积常数(25℃) 
下列说法错误的是 [ ]A.五种物质在常温下溶解度最大的是Ag 2 SO 4
B.将氯化银溶解于水后,向其中加入Na 2 S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 心无所向1年前1
心无所向1年前1 -
 simon524199 共回答了14个问题
simon524199 共回答了14个问题 |采纳率78.6%C1年前查看全部
- 银盐、氢氧化银的溶解度(难溶微溶沉淀什么的)
 超级dd者1年前1
超级dd者1年前1 -
 人月两朦胧 共回答了23个问题
人月两朦胧 共回答了23个问题 |采纳率95.7%易溶:硝酸银AgNO3,氟化银AgF,高氯酸银AgClO4 ,其中硝酸银在水中的溶解度 (218g/100g水)
微溶:硫酸银Ag2SO4、亚硝酸银AgNO2、氯酸银AgClO3
其它的难溶.如:Ag2S ,AgI,AgBr,AgCl 等
氢氧化银(AgOH) 极不稳定,常温下已不存在,它会自发分解成氧化银和水.1年前查看全部
- (2014•山东模拟)25℃时,5种银盐的溶度积常数(Ksp)分别是:
(2014•山东模拟)25℃时,5种银盐的溶度积常数(Ksp)分别是:
下列说法正确的是( )AgCl Ag2SO4 Ag2S AgBr AgI 1.8×10-10 1.4×10-5 6.3×10-50 7.7×10-13 8.51×10-16
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C.在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol/L的AgNO3溶液,能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成 萤火虫二代1年前1
萤火虫二代1年前1 -
 jacksun0833 共回答了27个问题
jacksun0833 共回答了27个问题 |采纳率77.8%解题思路:A.结构相似的难溶性盐,溶度积越小,溶解度越小;
B.硫化银的溶度积比硫酸银小,从沉淀平衡移动的角度分析;
C.根据溶度积计算,当离子的浓度幂之积大于Ksp时,能生成沉淀,否则不生成沉淀;
D.当离子的浓度幂之积大于Ksp时,能生成沉淀.A.氯化银、溴化银和碘化银的溶度积依次减少,结构相似,溶度积越小,溶解度越小,故A错误;
B.硫化银的溶度积比硫酸银小,将硫酸银溶解于水后,向其中加入少量硫化钠溶液,可得到黑色沉淀,故B错误;
C.c(Cl-)=1.8×10-5mol/L×[5/5+0.05],c(Ag+)=1.0×10-3mol/L×[0.05/5+0.05],
则c(Cl-)×c(Ag+)=1.8×10-5mol/L×[5/5+0.05]×1.0×10-3mol/L×[0.05/5+0.05]<1.8×10-10(mol/L)2,不能析出沉淀,故C错误;
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,如满足c(Cl-)×c(Ag+)>1.8×10-10,则可生成沉淀,故D正确.
故选D.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度不大,本题注意根据溶度积计算,理解溶度积的意义,比较溶解度与溶度积之间的关系.1年前查看全部
- 铜单质与可溶性银盐反应;铜单质与可溶性铁盐反应.方程式?
铜单质与可溶性银盐反应;铜单质与可溶性铁盐反应.方程式?
应该是离子方程式吧? 榴溜1年前1
榴溜1年前1 -
 虎头蛇尾 共回答了21个问题
虎头蛇尾 共回答了21个问题 |采纳率95.2%Cu+2AgNO3=Cu(NO3)2+2Ag
Cu+2FeCl3=CuCl2+2FeCl2
Cu+2Ag+ =Cu2+ + 2Ag
Cu+2Fe3+ =Cu2+ + 2Fe2+1年前查看全部
- 下表是五种银盐的溶度积常数(25℃):
下表是五种银盐的溶度积常数(25℃):
下列说法错误的是( )化学式 AgCl Ag2SO4 Ag2S AgBr AgI 溶度积 1.8×10-10 1.4×10-5 6.3×10-50 7.7×10-13 8.51×10-16
A. 五种物质在常温下溶解度最大的是Ag2SO4
B. 将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C. 对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D. 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 夏欣欣1年前4
夏欣欣1年前4 -
 ahqy148 共回答了14个问题
ahqy148 共回答了14个问题 |采纳率92.9%解题思路:A.Ag2SO4的Ksp最大,所以其溶解度最大;
B.硫化银的溶度积比硫酸银小,从沉淀平衡移动的角度分析;
C.结构相似的难溶性盐,溶度积越小,溶解度越小;
D.难溶电解质的溶解平衡是一定条件下的动态平衡.A.由表中数据可知溶度积最大的是Ag2SO4,Ag2SO4微溶于水,其它物质难溶,所以Ag2SO4溶解度最大,故A正确;
B.Ag2S溶度积远小于AgCl,Ag2S难溶于水,在AgCl的饱和溶液中加入Na2S,则可以生成黑色的Ag2S沉淀,故B正确;
C.结构相似的难溶性盐,溶度积越小,溶解度越小,由表格中的数据可知AgCl、AgBr、AgI的溶解度依次减小,所以对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小,故C错误.
D.难溶电解质的溶解平衡是一定条件下的动态平衡,当条件改变,平衡要发生移动,故D正确;
故选:C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度中等,本题注意比较表中数据,把握溶解平衡的特征以及影响因素.1年前查看全部
- (2011•太原模拟)下表是五种银盐的溶积常数(25°C)
(2011•太原模拟)下表是五种银盐的溶积常数(25°C)
下列说法不正确的是( )化学式 AgCl Ag2SO4 Ag2S AgBr AgI 溶度积 1.8×10-10 1.4×10-5 6.3×10-50 5.4×10-13 8.3×10-17
A.向Ag2SO4饱和溶液中加入Na2SO4固体后会生成白色沉淀
B.将少量氯化银溶于水后,向其中加入一定量的Na2S,能生成黑色沉淀
C.氯化银、溴化银和碘化银在常温下的溶解度依次增大
D.AgBr饱和溶液中加入一定量的NaCl也可能会生成AgCl沉淀 aeawer1年前1
aeawer1年前1 -
 dahai20035 共回答了20个问题
dahai20035 共回答了20个问题 |采纳率90%解题思路:A.Ag2SO4在溶液中存在沉淀溶解平衡;
B.硫化银的溶度积比氯化银小,从沉淀平衡移动的角度分析;
C.结构相似的难溶性盐,溶度积越小,溶解度越小;
D.当离子的浓度幂之积大于Ksp时,能生成沉淀.A.Ag2SO4在溶液中存在沉淀溶解平衡,加入Na2SO4固体,沉淀平衡逆移,会生成Ag2SO4白色沉淀,故A正确;
B.Ag2S溶度积远小于AgCl,Ag2S难溶于水,在AgCl的饱和溶液中加入Na2S,则可以生成黑色的Ag2S沉淀,故B正确;
C.结构相似的难溶性盐,溶度积越小,溶解度越小,由表格中的数据可知AgCl、AgBr、AgI的溶解度依次减小,所以对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小,故C错误;
D.AgBr饱和溶液中加入一定量的NaCl,如满足c(Cl-)×c(Ag+)>1.8×10-10,则可生成沉淀,故D正确.
故选:C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度不大,本题注意根据溶度积计算,理解溶度积的意义,比较溶解度与溶度积之间的关系.1年前查看全部
- 一些可溶性的重金属盐(如铜盐、钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性而丧失其生理功能,危及生命。由此
一些可溶性的重金属盐(如铜盐、钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性而丧失其生理功能,危及生命。由此可知,可溶性的重金属盐为有毒物质。在医疗上用X射线检查肠胃病时,常让病人服用硫酸钡的悬浊液(俗称钡餐。硫酸钡不溶于水,也不与酸反应),但不能服用碳酸钡,其原因是人体胃液中含有一定的_________(填物质的化学式)与碳酸钡反应后,产生了一定量的使人中毒的_______离子。若因氯化钡中毒,甲、乙两同学提出了两种不同的解毒方案:甲认为可以饮用硫酸钠溶液来解毒,乙同学认为可以多饮鲜牛奶,你认为谁的方案更好,还有其他方案吗?请你补充一个。  yiqisiqu1年前1
yiqisiqu1年前1 -
 vivien8304 共回答了19个问题
vivien8304 共回答了19个问题 |采纳率89.5%HCl;Ba 2+ ;由于硫酸钡是难溶于水且难溶于酸的钡盐,因而不能被人体吸收,不会使人体内的蛋白质变性,而碳酸钡可与胃液中的盐酸反应生成可溶性的钡盐(氯化钡),易被人体吸收而导致蛋白质变性,引起中毒;若服用硫酸钠则会导致人体内氯化钠的含量增多,因此最好用富含蛋白质的鲜牛奶、豆浆等来解毒。1年前查看全部
- 常温下亚铁离子难以将银离子还原为银单质,如何应用配合物性质,用亚铁离子回收银盐溶液中的银?
 chronobra1年前3
chronobra1年前3 -
 cxg_hh 共回答了20个问题
cxg_hh 共回答了20个问题 |采纳率95%用氨水,使银离子转化为银氨离子.而亚铁离子则转化为沉淀,过滤,得到银氨离子的溶液.加硝酸酸化.再用金属置换出银.1年前查看全部
- 一些可溶性的重金属盐(如钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性而丧失其生理功能,危及生命.由此可知,
一些可溶性的重金属盐(如钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性而丧失其生理功能,危及生命.由此可知,可溶性的重金属盐为有毒物质.在医疗上用X射线检查肠胃病时,常让病人服用BaSO4的悬浊液,但不能服用碳酸钡,其原因是胃液与BaCO3反应后,产生了一定量的使人中毒的 ______离子.若因BaCl2中毒,甲同学认为可以饮用Na2SO4溶液来解毒,原因是 ______;乙同学认为可以多次饮鲜牛奶,原因是 ______;谁的方案好 ______,我还有的补充方案是 ______.
 guolihe1年前1
guolihe1年前1 -
 xy单眼皮 共回答了16个问题
xy单眼皮 共回答了16个问题 |采纳率100%解题思路:可溶性的重金属盐,能电离出重金属离子,它能破坏蛋白质的结构,服用含有丰富蛋白质的食品,可防止人体本身的蛋白质被破坏,有解毒作用.胃液中含有盐酸,服用碳酸钡后,则发生如下反应BaCO4+2HCl=BaCl2+H2O+CO2↑,氯化钡可溶解于水,能电离出重金属离子钡离子,有毒;硫酸钠和氯化钡反应可生成不溶的硫酸钡和氯化钠,氯化钠摄入过多对人有害,所以甲方案不好;鲜牛奶中富含蛋白质,可防止钡离子破坏人体本身的蛋白质,有解毒作用,且不产生副作用,当然其它富含蛋白质的食物也可以,如饮用豆浆.
故答案为:钡;Na2SO4与BaCl2反应生成不溶性盐BaSO4;钡盐在体液中与牛奶作用,不再与人体蛋白质反应,从而达到解毒效果;乙;多次饮鲜豆浆.点评:
本题考点: 常见中毒途径及预防方法;鉴别淀粉、葡萄糖的方法与蛋白质的性质.
考点点评: 人民的生命重于泰山,在生产、生活中可能会遇到中毒现象或其它灾难,了解中毒原理、或事故发生原因,才会正确对事故进行处理,保障人的生命安全.1年前查看全部
- 下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是 [ ] A.
下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是  [ ]
[ ]A.五种物质在常温下溶解度最大的是Ag 2 SO 4
B.将AgCl溶解于水后,向其中加入Na 2 S,则可以生成黑色的Ag 2 S沉淀
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
D.常温下,AgCl、AgBr和AgI三种物质的溶解度随着氯、溴、碘的顺序逐渐增大 小晓晓111年前1
小晓晓111年前1 -
 紫色野草莓 共回答了20个问题
紫色野草莓 共回答了20个问题 |采纳率95%D1年前查看全部
- 所有的银盐是不是见光都易分解
 kubasa1年前1
kubasa1年前1 -
 kingofwg 共回答了17个问题
kingofwg 共回答了17个问题 |采纳率88.2%见光分解的物质有:
硝酸,4HNO3=4NO2+O2+2H2O
次氯酸,2HClO=2HCl+O2
所有的银盐,卤化银,2AgBr=2Ag+Br2;硝酸银
过氧化氢,2H2O2=2H2O+O2
以上物质都要避光保存在棕色瓶中.
另外,高锰酸钾的分解,光也有一定的催化作用,所以,也要保存在棕色瓶中.1年前查看全部
- 怎样用两种不同的方法区别锌盐和铜盐、锌盐和镉盐、银盐和汞盐?
 li8213b1年前1
li8213b1年前1 -
 qwe5680300 共回答了21个问题
qwe5680300 共回答了21个问题 |采纳率90.5%【1】锌属两性金属,对应的难溶碱即可溶于强酸也可溶于强碱.
所以区别锌盐和铜盐,锌盐和镉盐都可以加入足量的NaOH溶液,先形成白色沉淀后溶解的是锌盐,形成沉淀不溶解的是铜盐和镉盐.
【2】区别银盐和汞盐可用Cl-,形成白色沉淀的是银盐.1年前查看全部
- 加酸加碱在工业提纯上的作用就像加盐酸可以防止某些盐水解 调节PH值 生成银盐沉淀 等 请高手懂的补充点
 因为有你zx1年前1
因为有你zx1年前1 -
 水洗的天空 共回答了20个问题
水洗的天空 共回答了20个问题 |采纳率100%除去碳酸根和亚硫酸根1年前查看全部
- 所有的银盐是不是见光都易分解
 wangdong0081年前1
wangdong0081年前1 -
 cccc 共回答了18个问题
cccc 共回答了18个问题 |采纳率88.9%见光分解的物质有:
硝酸,4HNO3=4NO2+O2+2H2O
次氯酸,2HClO=2HCl+O2
所有的银盐,卤化银,2AgBr=2Ag+Br2;硝酸银
过氧化氢,2H2O2=2H2O+O2
以上物质都要避光保存在棕色瓶中.
另外,高锰酸钾的分解,光也有一定的催化作用,所以,也要保存在棕色瓶中.1年前查看全部
- 玻璃容器上如果沾有难溶的银盐应如何处理
 asdfx1年前4
asdfx1年前4 -
 冰冰凉2005 共回答了23个问题
冰冰凉2005 共回答了23个问题 |采纳率82.6%用过量氨水,银离子在过量的氨水中会形成络离子,而络离内界很难电离,所以不溶盐的溶解平衡会朝溶解方向移动,而后银离子又会形成络离子1年前查看全部
- 下表是五种银盐的溶度积常数K3p(25°),下列说法不正确的是( )
下表是五种银盐的溶度积常数K3p(25°),下列说法不正确的是( )
化学式 AgCl Ag2SO4 Ag2S AgBr Agl 溶度积 1.4×10-10 1.4×10-5 6.4×10-50 7.7×-13 8.51×10-16
A.25℃时五种银盐的饱和溶液中,c(Ag+)最小的是Ag2S溶液
B.25℃时,将Ag2S固体溶解到浓度为0.001mol•L-1的Na2S溶液中达到饱和,此时c(Ag+)=8.0×10-24mol•L-1
C.25℃时,在等物质的量浓度的NaCl、CaCl2两溶液中加入足量的AgCl固体形成饱和溶液,则两溶液中AgCl的溶度积相同,且两溶液中c(Ag+)也相同
D.AgBr沉淀可以转化成Agl沉淀,而Agl沉淀在一定条件下也可以转化成AgBr沉淀 easylifetobe1年前1
easylifetobe1年前1 -
 咿呀咿呀哦 共回答了18个问题
咿呀咿呀哦 共回答了18个问题 |采纳率88.9%解题思路:由表中数据可知溶度积最大的是Ag2SO4,最小的是Ag2S,AgCl、AgBr、AgI的溶解度依次减小.反应向更难溶的方向进行;沉淀溶解平衡中溶度积是常数.
A、由表中数据可知溶度积最小的是Ag2S,其溶解度也最小,则c(Ag+)最小;
B、根据 Ksp(Ag2S)=c2(Na+)•c(S2-)=6.4×10-50,c(S2-)=0.001mol•L-1,计算c(Ag+)=8.0×10-24mol•L-1;
C、在等物质的量浓度的NaCl、CaCl2两溶液中氯离子的浓度为1:2,根据 Ksp(AgCl)=c(Ag+)•c(Cl-),则两溶液中AgCl的溶度积相同,c(Ag+)不相同;
D、AgI的溶度积小于AgBr的溶度积,AgBr的溶度积小于AgCl的,反应向更难溶的方向进行.A、由表中数据可知溶度积最小的是Ag2S,其溶解度也最小,则c(Ag+)最小,故A正确;
B、根据 Ksp(Ag2S)=c2(Na+)•c(S2-)=6.4×10-50,计算c(Ag+)=8.0×10-24mol•L-1,故B正确;
C、在等物质的量浓度的NaCl、CaCl2两溶液中氯离子的浓度为1:2,根据 Ksp(AgCl)=c(Ag+)•c(Cl-),则两溶液中AgCl的溶度积相同,c(Ag+)不相同,故C错误;
D、AgI的溶度积小于AgBr的溶度积,AgBr的溶度积小于AgCl的,反应向更难溶的方向进行,故可以转化,故D正确;
故选:C.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查难溶电解质的溶解平衡问题,题目难度不大,本题注意根据溶度积计算,理解溶度积的意义,比较溶解度与溶度积之间的关系.1年前查看全部
- 一些可溶性盐的重金属(如铜盐、钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性丧失其生理功能,危及生命.由此可
一些可溶性盐的重金属(如铜盐、钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性丧失其生理功能,危及生命.由此可知,可溶性的重金属盐为有毒物质.在医疗上用X射线检查肠胃病时,常让病人服用硫酸钡的悬浊液(俗称钡餐.硫酸钡不溶于水,也不与酸反应),但不能服用碳酸钡,其原因是人体胃液中含有一定的(填物质的化学式)______,与碳酸钡反应后,产生了一定量的使人中毒的______离子.若因氯化钡中毒,甲、乙同学提出了两种不同的解毒方案:甲认为可以饮用硫酸钠溶液来解毒,乙同学认为可以多饮鲜牛奶,你认为谁的方案更好?原因什么?还有其他方案吗?请你补充一个.______.
 小丫呵1年前1
小丫呵1年前1 -
 9030735 共回答了20个问题
9030735 共回答了20个问题 |采纳率80%解题思路:胃酸的成分是盐酸,化学式为:HCl.
重金属盐有毒是因可溶的重金属盐可电离出重金属离子,硫酸钡是难溶于水且难溶于酸的钡盐,因而不能电离出钡离子;而碳酸钡可与胃液中的盐酸反应生成可溶性的氯化钡,能电离出钡离子.
解毒时服用的物质不应对人体有害,或过量时对人体健康有影响.胃酸的成分是盐酸,化学式为:HCl.
由于硫酸钡是难溶于水且难溶于酸的钡盐,因而不能电离出钡离子被人体吸收,不会使人体内的蛋白质变性,而碳酸钡可与胃液中的盐酸反应生成可溶性的氯化钡,能电离出钡离子,易被人体吸收而导致蛋白质变性,引起中毒.
若服用硫酸钠,则会导致人体内钠盐的含量增多,导致疾病发生,富含蛋白质的鲜牛奶、豆浆等是人体需要的营养物质,又含蛋白质,可阻止钡离子破坏人体蛋白质.
故答案为:HCl; 钡;乙,若服用硫酸钠,则会导致人体内钠盐的含量增多,导致疾病发生,富含蛋白质的鲜牛奶、豆浆等是人体需要的营养物质,又含蛋白质,可阻止钡离子破坏人体蛋白质;多次饮鲜豆浆点评:
本题考点: 证明盐酸和可溶性盐酸盐;常见中毒途径及预防方法.
考点点评: 理解重金属盐中毒的原理,掌握复分解反应的条件,以及人体营养元素与营养物质的基本知识,是解决问题的关键.1年前查看全部
大家在问
- 1关于x的不等式ax-b>0的解集是一到正无穷大的开区间,则关于X的不等式ax-b/x-2>0的解集是
- 2已知各项均不相等的等差数列{a n }的前n项和为S n ,若S 3 =15,且a 3 +1为a 1 +1和a 7 +1
- 3微积分-判断题如果f(x) 在(a,b)是上升的,那么所有x在(a,b)上f'(x)是正数.
- 4(2010•锦州三模)在等比数列{an}中,a1=2,前n项和为Sn,若数列{an+λ}(λ≠0)也是等比数列,则Sn等
- 5英语翻译牧羊人的故事 十六世纪衣索匹亚有个牧羊人,有一天发现自己饲养的羊只忽然在那儿不停的蹦蹦跳跳,他觉得非常不可思议,
- 6在S2-、FE2+、FE3+、MG2+、S、CL-、H+、CL2中 只有氧化性的是?只有还原性的是?既有还原又有氧化性的
- 7游乐场里的摩天轮的半径是10米,小强坐着它在空中大约转过125.6米,这个摩天轮转动几周?要算式要答案.
- 8甲乙两筐苹果共有85千克,从甲筐里取出四分之一的苹果,从乙筐里取出...
- 9力的示意图,知道力的大小 需要把力标出来么?
- 10一些英语的单选题目1.-I hear that an old couple are traveling around C
- 11化学必采纳,500ml,0.1Moll代表什么物质浓度还是什么啊
- 12两道数学题1.已知圆锥的底面半径3,高为4,则圆锥侧面展开图的面积是:A.12∏ B.15∏ C.30∏ D.24∏2.
- 13如图所示,关于该装置的下列叙述中,不正确的是( )
- 14韩英郁是女生改成双重否定句句意不变
- 15如图所示,是一工人师傅用于粉刷楼房外墙壁的升降装置示意图,上端固定在楼顶.若动滑轮质量为2.5kg,工作台质量为7.5k
