六氟化碳的结构如何用轨道来解释我只是高二,希望是简明易懂的解释,硫周围12个电子真心想不明白不好意思,打错了,其实是六氟
 咸盐2022-10-04 11:39:541条回答
咸盐2022-10-04 11:39:541条回答我只是高二,希望是简明易懂的解释,硫周围12个电子真心想不明白
不好意思,打错了,其实是六氟化硫

已提交,审核后显示!提交回复
共1条回复
 heliweng 共回答了22个问题
heliweng 共回答了22个问题 |采纳率81.8%- CF3-CF3?
- 1年前
相关推荐
- OF读作氟化氧还是氧化氟?常规来说应读作氟化氧但也有说氧化物都要读作氧化什么的
 玟比1年前1
玟比1年前1 -
 yeqingxue 共回答了18个问题
yeqingxue 共回答了18个问题 |采纳率94.4%应该是氟化氧.
一方面是氟的氧化性强,另一方面这是一个约定俗成的东西.
因为氧化氟是OF2的别名.当然它的学名是二氟化氧,中文别名有一氧化二氟;一氧化氟;氧化氟.1年前查看全部
- 氟化盐有什么用途
 炫火花1年前1
炫火花1年前1 -
 蓉儿123 共回答了14个问题
蓉儿123 共回答了14个问题 |采纳率78.6%氟化盐
1、冰晶石Na3AlF6
用途
主要用作铝电解的助熔剂;也用作研磨产品的的耐磨添加剂,可以有效提高砂轮耐磨,切,削力,延长砂轮使用寿命和存储时间;铁合金及沸腾钢的熔剂,有色金属熔剂,铸造的脱氧剂,链烯烃聚合催化剂,以及用于玻璃抗反射涂层,搪瓷的乳化剂,玻璃的乳白剂,焊材的助熔剂,陶瓷业的填充剂,农药的杀虫剂等行业企业.
2、氟化铝
用途
在铝电解工业中用以降低电解质的熔化温度和提高导电率,用作非铁金属的熔剂,陶瓷釉和搪瓷釉的助熔剂和釉药的组分,以及精油生产中副发酵作用的抑止剂.酒精生产中用作起副发酵作用的抑制剂.在新能源材料工业中,制备锂电池正极材料--锰酸锂的过程中,添加1%的氟化铝,可以提高锰酸锂电池的高温循环性能.有剧毒,应小心使用.1年前查看全部
- 1mol氢气与1mol氟气生成2mol气态HF,△H=-270kJ/mol。已知1mol气态氟化氢转化为1mol液态氟化
1mol氢气与1mol氟气生成2mol气态HF,△H=-270kJ/mol。已知1mol气态氟化氢转化为1mol液态氟化氢需放热50kJ/mol,求1mol氢气与1mol氟气生成2mol液态HF的反应热
 草莓店主1年前0
草莓店主1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列说法正确的是( )A.原子核外的未成对电子数:氧>氮B.离子晶体的晶格能:氟化钠>氧化镁C.共价键的极性强弱:氟化
下列说法正确的是( )
A.原子核外的未成对电子数:氧>氮
B.离子晶体的晶格能:氟化钠>氧化镁
C.共价键的极性强弱:氟化氢>氯化氢
D.元素的电负性:钠>镁>铍 xiaocan1年前1
xiaocan1年前1 -
 泡泡梦之恋 共回答了14个问题
泡泡梦之恋 共回答了14个问题 |采纳率85.7%解题思路:A.根据轨道表示式判断未成对电子;
B.根据晶格能与离子的半径、电荷有关,电荷越多、离子半径越小,晶格能越大;
C.根据元素的非金属越强,与同种元素形成的共价键的极性越强;
D.根据同周期自左而右电负性增大,同主族自上而下电负性减小,据此解答.A.由轨道表示式可知,氧原子核外的未成对电子数为2,氮原子核外的未成对电子数为3,所以原子核外的未成对电子数:氧<氮,故A错误;
B.氟化钠中阴阳离子所带电荷为1,小于MgO中离子所带电荷,钠离子半径大于镁离子半径,晶格能与离子的半径、电荷有关,电荷越多、离子半径越小,晶格能越大,所以离子晶体的晶格能:氟化钠<氧化镁,故B错误;
C.元素的非金属:氟>氯,所以共价键的极性强弱:氟化氢>氯化氢,故C正确;
D.同周期自左而右电负性增大,同主族自上而下电负性减小,所以元素的电负性:铍>镁>钠,故D错误;
故选:C.点评:
本题考点: 元素周期律的作用;原子结构与元素的性质.
考点点评: 本题主要考查了核外电子排布、晶格能大小比较、共价键的极性强弱、电负性大小等知识,注意规律的掌握,难度不大.1年前查看全部
- 二氟化氧OF2,四氟化氧OF4,六氟化氧OF6通过什么方法可以制的?
 苏北土人1年前1
苏北土人1年前1 -
 爱啃老玉米 共回答了13个问题
爱啃老玉米 共回答了13个问题 |采纳率84.6%制取二氟化氧,可以把氟气(F2)通入2%的NaOH溶液,
2F2 + 2NaOH==2NaF + H2O + OF2↑
至于四氟化氧和六氟化氧还没听过,在二氟化氧中,氧被氧化成正二价已经很不容易了,更何况是正四和正六!1年前查看全部
- 氢键,分子间做用力不是对晶体而言吗,那气体,液体间有氢键吗?还有1摩尔冰,1摩尔氨气,1摩尔氟化青...
氢键,分子间做用力不是对晶体而言吗,那气体,液体间有氢键吗?还有1摩尔冰,1摩尔氨气,1摩尔氟化青...
氢键,分子间做用力不是对晶体而言吗,那气体,液体间有氢键吗?还有1摩尔冰,1摩尔氨气,1摩尔氟化青有几摩尔氢键呢 Lcai20001年前5
Lcai20001年前5 -
 yearjong 共回答了19个问题
yearjong 共回答了19个问题 |采纳率89.5%液体、气体分子之间也可以有氢键,不过一般数量比相应的固体少.
例如HF在沸点或者稍高时的气态就是主要以双聚(HF)2形式存在,就是靠氢键连接在一起的.有一些具有分子内氢键的物质,哪怕温度更高该分子内氢键仍然存在.
0度下1mol冰具有2mol氢键,但同温度下液态水的氢键数量比2少,温度升高后氢键数量会进一步降低.沸点时的水蒸气氢键数量下降到低于0.05.
凝固点以下1mol的固态氨具有3mol比较弱的氢键,液态下这个数量下降到1左右,气态时已经完全没有氢键了.
对HF,1mol 固态或液态HF 一直都有1mol氢键,沸点左右的气体HF氢键数量略高于0.5.1年前查看全部
- 高中化学,难溶电解质转化问题已知25摄氏度氟化镁的溶度积比氢氧化镁的溶度积大问25摄氏度时,在氢氧化镁的悬浊液中加入氟化
高中化学,难溶电解质转化问题
已知25摄氏度氟化镁的溶度积比氢氧化镁的溶度积大
问
25摄氏度时,在氢氧化镁的悬浊液中加入氟化钠溶液后,氢氧化镁能否转化为氟化镁
答案是可以
我比较疑惑,谁能解释一下,谢谢了,最好具体、清晰一些,感激不尽 jianping12341年前1
jianping12341年前1 -
 妖姬一箩筐 共回答了25个问题
妖姬一箩筐 共回答了25个问题 |采纳率96%Mg(OH)2 + 2F- = MgF2 + 2OH-
K=[OH-]²/[F-]²=Ksp[Mg(OH)2]/Ksp(MgF2)
因为不知道具体数值,没法进行准确计算
但是,只要溶液中[F-]/[OH-]>K就可以进行转化
这种方法常用于溶解度差别不大的物质之间的转化,比如:
BaSO4 + CO32- = BaCO3 + SO42-
我记得这个平衡的K是1/24,不算很小,因此只要令溶液中[CO32-]是[SO42-]的24倍以上即可.实际上这也是工业上利用重晶石(主要成分是BaSO4)的方法之一.利用饱和Na2CO3溶液不断地将BaSO4转化为可酸溶的BaCO3进而转变成其它含Ba的产物1年前查看全部
- 学过有种物质 唯一的氧显正价的物质 到底是氧化氟还是氟化氧 有什么性质
 兰星空1年前2
兰星空1年前2 -
 cc百合2005 共回答了20个问题
cc百合2005 共回答了20个问题 |采纳率90%二氟化氧
二氟化氧,分子式为OF2,为无色、几乎无味的剧毒气体,液化后呈淡黄色.主要用于氧化氟化反应、火箭工程液体助燃剂.吸入刺激肺和粘膜,能引起严重头痛、呼吸困难、肺出血和肺水肿症状.氧化性极强,助燃,剧毒,有极其强烈的刺激性和腐蚀性.
外观与性状:二元氟化氧中最稳定的一种.为无色、几乎无味的剧毒气体,液化后呈淡黄色.由于二氟化氧在常温下就能与干燥的空气迅速反应生成二氧化氮和具有霉臭味的无色气体三氟化氮(氟气在常温下与干燥的空气几乎不反应,由此可见二氟化氧的极强氧化性),所以通常见到的二氟化氧为一种棕黄色恶臭气体.1年前查看全部
- 我想请问下 催化剂的氟化和活化是一样的道理吧?活化与再生又有什么区别呢?
我想请问下 催化剂的氟化和活化是一样的道理吧?活化与再生又有什么区别呢?
催化剂再生完好像还要活化? G01211年前1
G01211年前1 -
 98朵玫瑰 共回答了20个问题
98朵玫瑰 共回答了20个问题 |采纳率95%氟化和活化,氟化是指使之带上含氟基团,活化是指使催化剂具有活性,一般催化剂再生后,氧化还原状态和颗粒直径都要发生变化,再生后一般都要活化,使其重新具有催化功能.1年前查看全部
- 氟化盐的主要制作原料是?
 twfbdpw1年前1
twfbdpw1年前1 -
 shd20034 共回答了16个问题
shd20034 共回答了16个问题 |采纳率93.8%在南方,用的是磷肥厂的含氟废气,与纯碱或氢氧化钠反应,成为氟化钠,在北方,使用的是氟化氢或萤石为原料,与硫酸反应生成氟化氢.1年前查看全部
- 四氟化碳和四氟化溴熔沸点比较
 marcy131年前2
marcy131年前2 -
 xyzd1984_10 共回答了16个问题
xyzd1984_10 共回答了16个问题 |采纳率93.8%因为都是分子晶体,所以熔沸点根据相对分子质量比较,相对分子质量大的熔沸点就高.所以应是四氟化溴的的高!1年前查看全部
- 请问付氟化亚锡和氟化锡有什么性质上的区别
 天ss的gg1年前1
天ss的gg1年前1 -
 须相忆 共回答了20个问题
须相忆 共回答了20个问题 |采纳率80%氟化锡:易水解1年前查看全部
- (2011•信阳二模)近年来研制的NF3气体可用作氟化氢-氟化氚高能化学激光器的氟源,也可作为火箭推进剂,NF3可用NH
(2011•信阳二模)近年来研制的NF3气体可用作氟化氢-氟化氚高能化学激光器的氟源,也可作为火箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3+3F2═NF3+3NH4F,下列说法中不正确的是( )
A.NF3的形成过程用电子式可表示为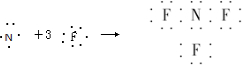
B.NF3的氧化性大于F2
C.NF3分子空间构型为三角锥形
D.NH4F中既有离子键又有极性共价键 secondary-planet1年前1
secondary-planet1年前1 -
 ARCHANC 共回答了15个问题
ARCHANC 共回答了15个问题 |采纳率93.3%解题思路:A、NF3属于共价化合物,N原子和F原子周围有8个电子;
B、根据氧化剂的氧化性大于氧化产物的氧化性判断;
C、根据NH3分子构型判断NF3分子构型;
D、根据NH4Cl化学键类型判断NH4F的化学键类型.A、NF3属于共价化合物,N原子和F原子周围有8个电子,则NF3的形成过程用电子式可表示为
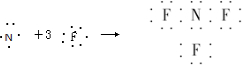 ,故A正确;
,故A正确;
B、4NH3+3F2═NF3+3NH4F,该反应中F2为氧化剂,NF3为氧化产物,则氧化性NF3的氧化性小于F2,故B错误;
C、NF3分子构型与NH3相似,NH3分子构型是三角锥型的,所以NF3分子构型也是三角锥型的,故C正确;
D、NH4Cl与NH4F含的阳离子相同,阴离子是同一主族元素,所以NH4Cl与NH4F具有相同的化学键,所以NH4F中存在的化学键是离子键、极性共价键,故D正确;
故选B.点评:
本题考点: 用电子式表示简单的离子化合物和共价化合物的形成;判断简单分子或离子的构型;极性键和非极性键.
考点点评: 本题考查物质的结构、化学键、物质的分类、氧化还原反应,该反应中元素的化合价的判断是解答的关键,并注意类推方法的应用,题目难度中等.1年前查看全部
- 在N3-(氮) O2-()氧 F-(氟) Na+(钠) Mg2+(镁) Al3+(铝) NH4+(氨根离子) HF(氟化
在N3-(氮) O2-()氧 F-(氟) Na+(钠) Mg2+(镁) Al3+(铝) NH4+(氨根离子) HF(氟化氢)等粒子中,相同的是
A 核电荷数 B 最外层电子数 C 电子总数 D 质子总数 真爱英雄1年前1
真爱英雄1年前1 -
 留在唐朝 共回答了18个问题
留在唐朝 共回答了18个问题 |采纳率77.8%C1年前查看全部
- 6氟化硫和5氯化磷这两个物质里.原子都满足最外层8电子的结构么.
 18030141年前1
18030141年前1 -
 xjwe 共回答了20个问题
xjwe 共回答了20个问题 |采纳率60%都不满足,并且都是阴离子满足,阳离子不满足,硫核外12个,磷是10个.1年前查看全部
- 有无六氟化氧这种化合物?短周期离子半径最大是什么元素,是硫吗?为什么不是硅或磷
有无六氟化氧这种化合物?短周期离子半径最大是什么元素,是硫吗?为什么不是硅或磷
有无六氟化氧这种化合物?
 水仙跳跳1年前1
水仙跳跳1年前1 -
 vivid3000 共回答了13个问题
vivid3000 共回答了13个问题 |采纳率92.3%没有,因为(这理论上也可以证明)O的第二电离能(即氧失去1个电子所需要吸收的能,下面类似)与O的第一电离能的1/2已经几乎等于(略小)F的电子亲和能(即:1molF得到一个电子所放出的能量),所以F将O只能最高氧化到+2价,即类似与OF2的物质,所以没有也不能有OF6这种物质(所以三楼的同志是错的).
短周期离子半径最大是H-(较少存在)(S2-鲍林离子半径为184pm;哥德希密德半径为182pm),H-鲍林所测得的半径为208pm,类似的还有C4-(哥德希密德所测德的半径为198pm),Si4-(其鲍林所测得的半径为271pm等等但因为极少存在,因为所测得的半径不统一这很难确定,但我也认为P3-是短周期中半径最大的的离子(磷我无数据但有离子半径变化规则P3-应该略小于Si4-).1年前查看全部
大家在问
- 1on until his he kept mother came studying连成句
- 2如图,在平面直角坐标系xOy中,抛物线y=x2+bx+c与x轴交于A、B两点,点A在x轴负半轴,点B在x轴正半轴,与y轴
- 3快 6点之前OK
- 4在三角形ABC中,角C=90°,①a=8,b=6,求c的长;②c=34,a:b=8:15,求a,b两边的长;③b=6,c
- 5ABCDE是什么物质已知AD是黑色固体BCE是常见的无色气体,则C的相对分子质量大于B他们的转换关系如图所示回答 A--
- 6读中东地区图(如图),回答下列问题.
- 7生产电脑芯片的材料主要是高纯硅.工业生产硅的原理为:2C+SiO2Si+2CO↑,在反应中SiO2发生了 (填“氧化”或
- 8如果a,b为定值,关于x的方程3分之2kx+a=2+6分之x-bx,无论k为何值,它的根总是1,求a,b的值拜托了各位
- 9做一下这两道题目,谢谢1.下面是一个直角体型.请你画一条线段,把它分成两个形状相同面积相等的四边形.请标明表示线段位置的
- 10taik speak tell say ask 的区别
- 11We have got a general idea of how our new flat will be decor
- 1225除以100又25分之26
- 13(1)如图是电解水的实验装置图.
- 14如图所示,光滑水平面AB=x,其右端B处连接一个半径为R的竖直光滑半圆轨道,C为最高点.质量为m可视为质点的小物块静止在
- 15某商场新进一批服装,进货价每件200元,如果要使利润率不少于15%,那么这种服装售价至少为多少
