摩尔盐的配置比例一定要1:1么?
 Armei2022-10-04 11:39:542条回答
Armei2022-10-04 11:39:542条回答摩尔盐有什么性质么?有何用途?

已提交,审核后显示!提交回复
共2条回复
 kadanlu 共回答了18个问题
kadanlu 共回答了18个问题 |采纳率94.4%- 摩尔盐是十二水合硫酸亚铁氨.化学式为(NH4)2Fe(SO4)*12H2o
显然(NH4)2SO4 FeSO4配置比为1:1
由于摩尔盐较稳定,而一般亚铁试剂极易氧化,所以摩尔盐作为分析化学中重要的还原剂所使用. - 1年前
 我在这里了 共回答了6个问题
我在这里了 共回答了6个问题 |采纳率- 就是的
- 1年前
相关推荐
- 硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]又称摩尔盐.某兴趣小组为了制备硫酸亚铁铵,上网查阅到硫酸铵、硫酸亚
硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]又称摩尔盐.某兴趣小组为了制备硫酸亚铁铵,上网查阅到硫酸铵、硫酸亚铁、硫酸亚铁铵三种盐的溶解度(单位为g/100g水)如表:
1制备晶体.该兴趣小组设计了制取少量摩尔盐的流程如下:温度/℃ 10 20 30 40 50 70 (NH4)2SO4 73.0 75.4 78.0 81.0 84.5 91.9 FeSO4•7H2O 40.0 48.0 60.0 73.3 - - (NH4)2SO4•FeSO4•6H2O 18.1 21.2 24.5 27.9 - - 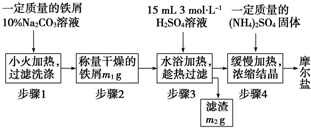
试回答下列问题:
①步骤3中进行“趁热快速过滤”,可采取的措施是______(写出1种),趁热过滤的目的是______;
②步骤4中加热浓缩至______时为止;
③)步骤4中析出的晶体不含(NH4)2SO4、FeSO4的原因是______,理论上制得的摩尔盐的质量为______.
(2)纯度分析.为了测定产品中Fe3+杂质含量,进行下列定量分析:
①配制Fe3+浓度为1.0mg/mL的标准溶液100mL.称取______mg高纯度的硫酸铁铵(NH4)Fe(SO4)2•12H2O,加2.00mL经处理的去离子水,振荡溶解后,加入2mol•L-1 HBr溶液1mL和1mol•L-1 KSCN溶液0.5mL,加水制成100mL溶液.配制过程中必须用到的定量仪器为______(选填编号).
a.精确度为0.001g的电子天平b.精确度为0.1mg的电子天平
c.100mL容量瓶d.酸式滴定管e.10mL量筒
②将上述溶液稀释为浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg/L)的溶液.分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如图.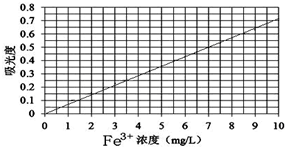
③取该兴趣小组所得的硫酸亚铁铵产品,按步骤①配得产品溶液10mL,稀释至100mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.490、0.510,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为______mg/L. 炼狱猎手1年前1
炼狱猎手1年前1 -
 菜刀门徒 共回答了19个问题
菜刀门徒 共回答了19个问题 |采纳率94.7%解题思路:(1)①FeSO4在低温时溶解度较小,如果不趁热过滤就会有FeSO4•7H2O晶体析出,过滤时会出现漏斗堵塞现象;
②加热浓缩至液体表面出现晶膜,即可停止加热;
③从题中溶解度表中可知:在相同温度下(NH4)2SO4•FeSO4•6H2O的溶解度比(NH4)2SO4、FeSO4都要小,摩尔盐先析出;
根据铁元素质量守恒可得关系式Fe~(NH4)2SO4•FeSO4•6H2O,然后根据铁的质量计算出生成高纯度的硫酸铁铵(NH4)Fe(SO4)2•12H2O的质量;
(2)①根据n=cV、m=nM计算出铁离子的质量,再依据关系式Fe3+~(NH4)Fe(SO4)2•12H2O得m[(NH4)Fe(SO4)2•12H2O];
根据配制一定物质的量浓度的溶液方法进行解答;
③两次测定所得的吸光度分别为0.490、0.510,计算出其取其平均值为0.500,然后结合图象中曲线数据计算出该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度.(1)①因为FeSO4在低温时溶解度较小,应采用趁热过滤,如果不趁热过滤就会有FeSO4•7H2O晶体析出,过滤时会出现漏斗堵塞现象,
故答案为:将漏斗置于沸水中预热后进行快速热过滤;防止FeSO4•7H2O晶体析出;
②加热浓缩至液体表面出现晶膜,停止加热,冷却使晶体析出,故答案为:液体表面出现晶膜;
③从题中溶解度表中得出在相同温度下,(NH4)2SO4•FeSO4•6H2O的溶解度比(NH4)2SO4、FeSO4都要小,摩尔盐先析出;
根据铁元素质量守恒可得关系式Fe~(NH4)2SO4•FeSO4•6H2O,而M[(NH4)2SO4•FeSO4•6H2O]=392g•mol-1,
加入铁屑m1g,剩余的铁屑为m2,则溶解的铁粉的质量为:(m1-m2)g,
得出生成晶体的质量为:m[(NH4)2SO4•FeSO4•6H2O]=
(m1−m2)g
56g/mol×392g/mol=7(m1-m2)g,
故答案为:在相同温度下,(NH4)2SO4•FeSO4•6H2O的溶解度比(NH4)2SO4、FeSO4都要小;7(m1-m2)g;
(2)①在Fe3+浓度为1.0mg/mL的标准溶液100mL中,m(Fe3+)=1.0mg/mL×100mL=100.0mg,
依据关系式Fe3+~(NH4)Fe(SO4)2•12H2O得:m[(NH4)Fe(SO4)2•12H2O]=100.0mg×[482/56]=860.7mg;
称取860.7mg晶体需精确度为0.1mg的电子天平,配制100 mL溶液,需100 mL容量瓶,即选bc,
故答案为:860.7; bc;
③两次测定所得的吸光度分别为0.490、0.510,取其平均值为0.500,从吸光度可以出浓度为7 mg/L,又因配得产品溶液10mL,稀释至100 mL,故原产品硫酸亚铁铵溶液中所含Fe3+浓度为:7mg/L×[100mL/10mL]=70mg/L,
故答案为:70.点评:
本题考点: 制备实验方案的设计;探究物质的组成或测量物质的含量.
考点点评: 本题通过硫酸亚铁铵[(NH4)2SO4•FeSO4•6H2O]的制备,考查了化学实验方案设计的方法,正确分析制备流程和反应原理为解答本题的关键,试题综合性较强、涉及的知识点较多,充分考查了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.1年前查看全部
- 制摩尔盐时用酒精洗涤产品,而在制阿司匹林时用水洗涤产品 right?
 用左手跳舞1年前1
用左手跳舞1年前1 -
 verabaxia 共回答了21个问题
verabaxia 共回答了21个问题 |采纳率90.5%NO
制阿司匹林用NaHCO3洗涤.1年前查看全部
- 制备摩尔盐减压抽滤时为什么FeSO4没被明显氧化成浅黄色
 珠珠糖1年前1
珠珠糖1年前1 -
 jiwaiprofessor 共回答了20个问题
jiwaiprofessor 共回答了20个问题 |采纳率95%减压抽滤的时候 应该滤的不是FeSO4而是(NH4)2Fe(SO4)2·6H2O 了 也就是摩尔盐 这是一种复盐 其中Fe(Ⅱ)的稳定性由于晶格结构与晶格中的NH4+而增加了 不很容易被空气氧化成Fe(Ⅲ)
一般地 在碱性环境中 Fe(Ⅱ)易被氧化成Fe(Ⅲ) 而酸性环境中Fe(Ⅱ)相对于碱性环境要稳定一些 实验室保存FeSO4不就是在其中加入稀酸和铁钉么 莫尔盐就是因此而稳定了 不易被氧化 另一方面 莫尔盐的溶解性比FeSO4和(NH4)2SO4都低 这意味着摩尔盐的晶格较稳定 氧化作用会破坏这种稳定性 所以这种稳定的晶格结构也可以起到一部分的抗氧化的作用1年前查看全部
- 硫酸亚铁铵的化学式为(NH 4 ) 2 Fe(SO 4 ) 2 •6H 2 O,商品名为摩尔盐.硫酸亚铁可与硫酸铵生成硫
硫酸亚铁铵的化学式为(NH 4 ) 2 Fe(SO 4 ) 2 •6H 2 O,商品名为摩尔盐.硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表
实验室欲制备硫酸亚铁铵晶体,设计了如下方案.温度/℃ 10 20 30 40 50 70 (NH 4 ) 2 SO 4 73.0 75.4 78.0 81.0 84.5 91.9 FeSO 4 •7H 2 O 40.0 48.0 60.0 73.3 - - (NH 4 ) 2 Fe(SO 4 ) 2 •6H 2 O 18.1 21.2 24.5 27.9 31.3 38.5
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na 2 CO 3 溶液,小火加热10min以除去______,倒掉溶液,用蒸馏水把铁冲洗干净,干燥,备用;
②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H 2 SO 4 溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为______(填名称,不考虑水解),其物质的量约为______mol;
③加入______g硫酸铵到蒸发皿中,缓缓加热、浓缩至表面出现结晶膜为止、冷却,得硫酸亚铁铵晶体.
(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a______;b______;
②加热、浓缩溶液时,不浓缩至干的理由是______;
③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是______;
④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO 4 酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO 4 酸性溶液装在______(酸式或碱式)滴定管,操作时用______手拿锥形瓶;
Ⅱ) 已知MnO 4 - 被还原为Mn 2+ ,试写出该滴定过程中的离子方程式:______;
Ⅲ) 判断该反应到达滴定终点的现象为______;
Ⅳ) 假设到达滴定终点时,用去V mL KMnO 4 酸性溶液,则该KMnO 4 酸性溶液的浓度为______mol/L. zq78283011年前1
zq78283011年前1 -
 leevana 共回答了17个问题
leevana 共回答了17个问题 |采纳率88.2%(1)①铁屑表面的油污属于酯类,在热碱性溶液中能被水解掉,故答案为:铁屑表面的油污;
②铁和稀硫酸反应的产物是硫酸亚铁,根据反应:Fe+H 2 SO 4 ═FeSO 4 +H 2 ↑,消耗的稀硫酸的量和生成的硫酸亚铁的量相等即n=0.015L×3mol/L=0.045mol,故答案为:硫酸亚铁;0.045;
③根据(NH 4 ) 2 Fe(SO 4 ) 2 •6H 2 O~(NH 4 ) 2 SO 4 ~FeSO 4 ,则硫酸铵的物质的量为0.045mol,质量m=nM=0.045mol×132g/mol=5.94g,故答案为:5.94;
(2)①硫酸亚铁溶液在空气中易被氧化变质,为避开氧气的氧化,要求过滤洗涤操作速度要快并且步骤③要缓缓加热,避免沸腾;故答案为:过滤洗涤操作速度要快;步骤③要缓缓加热,避免沸腾;
②硫酸亚铁铵晶体中的结晶水受热容易失去,蒸干会使晶体分解,故答案为:因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解;
③根据表中所示的在不同温度下的溶解度数据,可以看出相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小,所以将硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,故答案为:因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小;
④Ⅰ)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,所以将KMnO 4 酸性溶液装在酸式滴定管中,滴定时右手拿锥形瓶,左手控制活塞,故答案为:酸式;右;
Ⅱ)高锰酸根具有氧化性,亚铁离子具有还原性,氧化还原反应为:5Fe 2+ +MnO 4 - +8H + =5Fe 3+ +Mn 2+ +4H 2 O,故答案为:5Fe 2+ +MnO 4 - +8H + =5Fe 3+ +Mn 2+ +4H 2 O;
Ⅲ)高锰酸钾本身有颜色,滴定亚铁离子不需要指示剂,当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点,故答案为:当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点;
Ⅳ)1.96g硫酸亚铁铵晶体的物质的量n=
m
M =
1.96g
392g/mol =0.005mol,根据原子守恒则亚铁离子的物质的量为0.005mol,反应5Fe 2+ +MnO 4 - +8H + =5Fe 3+ +Mn 2+ +4H 2 O,则5Fe 2+ ~MnO 4 - ,所以高锰酸钾的物质的量为0.001mol,据c=
n
V =
0.001mol
10 -3 VL =
1
V mol/l,故答案为:
1
V .1年前查看全部
- (2012•寿光市模拟)摩尔盐(硫酸亚铁铵晶体)具有重要用途.下图为制取摩尔盐过程的示意图.
(2012•寿光市模拟)摩尔盐(硫酸亚铁铵晶体)具有重要用途.下图为制取摩尔盐过程的示意图.

请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑,除去废铁屑表面油渍.碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH______7(填“>”、“<”或“=”).
(2)废铁屑的主要成分是铁,同时含少量氧化铁.步骤①中有多个化学反应.请写出其中一个反应的化学方程式:______.
(3)根据步骤③可知,摩尔盐______(填“能”或“不能”)溶解于酒精.
(4)步骤②所得滤液含有未反应的FeSO4、(NH4)2SO4,可采用如下流程回收利用.
溶液N中一定含有的溶质是______,试剂Y是______. abb25h1年前1
abb25h1年前1 -
 凌雨诗 共回答了18个问题
凌雨诗 共回答了18个问题 |采纳率94.4%(1)碱性溶液能溶解油污,故碳酸钠溶液pH大于7;
(2)废铁屑中有铁、氧化铁,铁与稀硫酸反应生成硫酸亚铁和氢气,氧化铁和稀硫酸反应生成硫酸铁和水,铁还能与硫酸铁反应生成硫酸亚铁,方程式为Fe+H2SO4═FeSO4+H2↑; 3H2SO4+Fe2O3═Fe2(SO4)3+3H2O;Fe2(SO4)3+Fe═3FeSO4
(3)根据步骤③可知,用酒精可以洗去摩尔盐表面的水,然后晾干,说明摩尔盐不溶于酒精;
(4)氢氧化铁与Y反应只生成硫酸亚铁,故Y是硫酸,滤液中含有硫酸亚铁,硫酸铵,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠,硫酸铵与氢氧化钠反应生成硫酸钠、氨气和水,溶液N中一定含有硫酸钠.
故答案为:(1)>;(2)Fe+H2SO4═FeSO4+H2↑; 3H2SO4+Fe2O3═Fe2(SO4)3+3H2O;Fe2(SO4)3+Fe═3FeSO4
(3)不能 (4)硫酸钠硫酸1年前查看全部
- 用酒精洗涤摩尔盐的目的是除去表面水,而不是除去杂质离子,
 nanaxueli441年前1
nanaxueli441年前1 -
 xxxxxx啊 共回答了24个问题
xxxxxx啊 共回答了24个问题 |采纳率91.7%不对,有两方面的作用,其一是减少硫酸亚铁铵的溶解,其二是洗去晶体表面的杂质离子1年前查看全部
- 绿矾( FeSO 4 ·7H 2 O )、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
绿矾( FeSO 4 ·7H 2 O )、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH 4 ) 2 SO 4 + FeSO 4 + 6H 2 O =(NH 4 ) 2 SO 4 ·FeSO 4 ·6H 2 O↓。
其流程可表示为:
(1)洗涤中Na 2 CO 3 的主要作用是____________ 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到_____________时,停止加热。
(3)过滤是用图14所示装置进行的,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是____________ 。
(4)用无水乙醇洗涤的目的是____________ 。
(5)产品中Fe 2+ 的定量分析:制得的摩尔盐样品中往往含有极少量的Fe 3+ 。为了测定摩尔盐产品中Fe 2+ 的含量,一般采用在酸性条件下KMnO 4 标准液滴定的方法。称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol/LKMnO 4 溶液滴定,当溶液中Fe 2+ 全部被氧化时,消耗KMnO 4 溶液10.00mL。
①本实验的指示剂是___________ 。(填字母)
A. 酚酞 B.甲基橙C.石蕊D.不需要
②产品中Fe 2+ 的质量分数为______________ 。
 接龙4201年前1
接龙4201年前1 -
 翦翦 共回答了21个问题
翦翦 共回答了21个问题 |采纳率81%(1)利用碳酸钠溶液呈碱性,除去铁表面的油污
(2)加热到溶液表面出现晶膜时
(3)得到较干燥的沉淀
(4)除去水分,减少固体损失
(5)①D ; ②14%1年前查看全部
- (2014•江都市一模)硫酸亚铁铵晶体俗名为摩尔盐,化学式为xFeSO4•y(NH4)2SO4•zH2O,在制药、电镀方
(2014•江都市一模)硫酸亚铁铵晶体俗名为摩尔盐,化学式为xFeSO4•y(NH4)2SO4•zH2O,在制药、电镀方面有广泛的应用.
资料:①硫酸亚铁铵晶体易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
③硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去.温度/℃ FeSO4 (NH4)2SO4 xFeSO4•y(NH4)2SO4•zH2O 10 20.0 73 17.2 20 26.5 75.4 21.6 30 32.9 78 28.1
【探究一】:制备硫酸亚铁铵晶体
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如图1:
(1)在盛有废铁屑的容器中,倒入热水和洗涤剂,充分搅拌.以除去废铁屑表面的油污,这是利用洗涤剂的______作用;
(2)操作①中发生反应的化学方程式为______;
(3)过滤所需的玻璃仪器有烧杯、玻璃棒、______.过滤操作中滤纸有多种折法,为了加快过滤速率,你选择折法是______;
(4)操作①中过滤时,要趁热进行的原因是______,过滤后得到的固体中一定含有的物质是______;
(5)操作②的目的是得到硫酸亚铁铵晶体.操作顺序是b→______→______→d;
a.过滤b.加热浓缩c.冷却结晶d.洗涤干燥
(6)操作②中使用乙醇洗涤,可快速晾干.这样做的优点是______;
A、避免用水洗涤所造成的晶体损耗
B、酒精易挥发,可低温晾干晶体
【探究二】:探究硫酸亚铁铵的组成
【实验步骤】:取2份等质量的硫酸亚铁铵晶体,分别进行实验.向一份中加入过量的NaOH溶液,充分反应后得到0.68gNH3;向另一份中加入过量的BaCl2溶液,充分反应后过滤、洗涤、干燥得到9.32g沉淀.
回答下列问题:
(7)实验中生成的NH3能使湿润的______变蓝;写出(NH4)2SO4与NaOH反应的化学方程式______,属于______反应;
(8)实验中加入过量BaCl2溶液的目的______;
(9)取最后一次洗涤液,加入Na2SO4溶液,______,则说明沉淀已经洗涤干净;
(10)根据实验数据,计算x 和y的比值(2分,写出计算过程;相对分子质量:NH3-17、BaSO4-233)
______;
为进一步确定硫酸亚铁铵晶体的组成,另取7.84g硫酸亚铁铵晶体,并加热使其分解,剩余固体质量与温度的关系如图3所示.则:
(11)根据图示数据,硫酸亚铁铵晶体中,x:y:z=______;
(12)写出A点到B点发生反应的化学方程式FeSO4•(NH4)2SO4•6H2O
FeSO4+(NH4)2SO4•2H2O+4H2O△ .FeSO4•(NH4)2SO4•6H2O.
FeSO4+(NH4)2SO4•2H2O+4H2O△ . chenzheng8881年前1
chenzheng8881年前1 -
 沙汀鱼 共回答了23个问题
沙汀鱼 共回答了23个问题 |采纳率91.3%解题思路:(1)根据乳化作用的概念解答;
(2)根据铁和稀硫酸反应生成硫酸亚铁和氢气书写;
(3)根据过滤要用到的玻璃仪器包括:烧杯、漏斗、玻璃棒解答;
(4)铜不会和硫酸反应,所以可以过滤出来;根据硫酸亚铁的溶解性表格可知;
(5)根据制取硫酸亚铁晶体的基本操作解答;
(6)硫酸亚铁难溶于酒精可知.
(7)根据氨气能和水反应生成氨水,氨水呈碱性能使石蕊变蓝色;(NH4)2SO4与NaOH反应生成硫酸钠、水和氨气和复分解反应的定义解答;
(8)根据硫酸铵和氯化钡反应生成硫酸钡沉淀和氯化铵分析解答;
(9)证明氯化钡过量只要证明钡离子有剩余即可;
(10)根据硫酸铵和氯化钡反应的化学方程式计算出硫酸铵的质量;再硫酸铵和氯化钡反应生成硫酸钡沉淀的质量,然后用9.32g减去求出来的硫酸钡的质量既是硫酸钠和氯化钡反应产生沉淀的质量解答;
(11)图象中的A到B就是xFeSO4•y(NH4)2SO4•zH2O分解得到水蒸气的质量;
(12)A到B时xFeSO4•y(NH4)2SO4•zH2O分解得到的硫酸铵、硫酸亚铁铵晶体和水的过程.(1)倒入热水和洗涤剂,充分搅拌,以除去废铁屑表面的油污,这是利用洗涤剂的乳化作用;故答案:乳化;
(2)铁和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑;故答案:Fe+H2SO4=FeSO4+H2↑;
(3)过滤要用到的玻璃仪器包括:烧杯、漏斗、玻璃棒,故答案:漏斗;A;
(4)加入稀硫酸后,铁可以和硫酸反应生成硫酸亚铁和氢气,但铜不会和硫酸反应,因此铜就被过滤出来;根据硫酸亚铁的溶解表格可知,硫酸亚铁在50℃到80℃时溶解度是比较大的;故答案为:增大硫酸亚铁的溶解度;Cu.
(5)操作②的目的是得到硫酸亚铁铵晶体,基本操作步骤:加热浓缩,然后冷却结晶;再过滤;最后洗涤干燥.
(6)硫酸亚铁溶于水不溶于酒精,用A方法洗涤硫酸亚铁晶体损失较多,可用酒精洗涤,酒精又易挥发,能得到大量的纯净的硫酸亚铁晶体,故答案:AB;
(7)氨气能和水反应生成氨水,氨水呈碱性能使石蕊变蓝色;(NH4)2SO4与NaOH反应生成硫酸钠、水和氨气;该反应生成两种化合物相互交换成分生成另外两种化合物的反应,属复分解反应; 答案:紫色石蕊试纸;(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O;复分解反应;
(8)氯化钡和硫酸亚铁反应生成硫酸钡沉淀和氯化铁,氯化钡过量就是为了将硫酸根离子全部沉淀,故答案:将硫酸根离子全部沉淀;
(9)加入硫酸钠若不产生白色沉淀证明沉淀上已不附着BaCl2,则说明沉淀已经洗涤干净,故答案:若不产生白色沉淀;
(10)设硫酸亚铁铵晶体中硫酸铵的质量为x;
(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O
132 34
y0.68g
[132/34]=[y/0.68g]
y=2.64g
设和硫酸铵反应生成硫酸钡沉淀的质量为y
(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
132233
2.64g y
[132/233]=[2.64g/y]
y=4.66g
所以和硫酸亚铁反应产生硫酸钡沉淀的质量为9.32g-4.66g=4.66g;
设和硫酸亚铁反应生成硫酸钡沉淀的质量为z
FeSO4+BaCl2=BaSO4↓+FeCl2
152233
z4.66g
[152/233]=[z/4.66g]
z=3.04g
硫酸亚铁铵中[3.04g/2.64g]=[152x/132y];[x/y]=[1/1];故答案:1:1;
(11)由A→B固体质量减轻的质量就是生成的水的质量,7.84g硫酸亚铁铵晶体中水的质量为7.84g-5.68g=2.16g,[132y/18z]=[2.64g/2.16g];[y/z]=[1/6]故答案:1:1:6;
(12)加热FeSO4•(NH4)2SO4•6H2O分解得到硫酸亚铁、硫酸铵、和水;故答案:FeSO4•(NH4)2SO4•6H2O
△
.
FeSO4+(NH4)2SO4•2H2O+点评:
本题考点: 物质的相互转化和制备;实验探究物质的组成成分以及含量;过滤的原理、方法及其应用;常见气体的检验与除杂方法;金属的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 通过这个题培养学生观察视图的能力,以及比较分析的能力.本题考查了常见金属的性质以及某些盐的性质,完成此题,可以依据题干提供的内容,从中抽取有用的信息,结合已有的知识进行.本题是一道实验探究题,能较好的考查学生分析和解决问题的能力,考查了常见金属的性质以及某些盐的性质,解答时要依据题干提供信息,结合相关知识细心分析解答.1年前查看全部
- 24.(18分)化学研究性小组利用某铝铁合金测定室温下气体摩尔体积,并制备摩尔盐,设计了如下实验.
24.(18分)化学研究性小组利用某铝铁合金测定室温下气体摩尔体积,并制备摩尔盐,设计了如下实验.
I.气体摩尔体积的测定采用如图的实验装置.主要实验步骤为:
①装好实验装置;
② ;
③将m1 g合金样品放入圆底烧瓶中,并在分液漏斗中加入NaOH溶液;
④装好实验装置,记下量气管读数;
⑤打开分液漏斗旋塞,开始反应;
⑥反应结束后,再次记下量气管读数;
⑦对烧瓶中剩余物质进行过滤、洗涤、烘干,测得质量为m2 g;
⑧测量实验进行的温度.回答下列问题:
(1)实验步骤的第②步是 .
(2)步骤⑤反应的离子方程式是 .
(3)本实验需对量气管进行多次读数,读数时应注意:①将实验装置恢复到室温;② ;③视线与凹液面最低处相平.
(5)分析下列因素对实验结果的影响,填“偏大”、“偏小”或“无影响”(假设其他实验操作均正确).
①未恢复至室温就开始读数 ;②加入NaOH溶液不足量 ;
③拆去导管a .


我只想知道第(5)小题的第三小问,拆去导管a 为什么填偏大? yyjyyjyyj1年前1
yyjyyjyyj1年前1 -
 tyk123 共回答了14个问题
tyk123 共回答了14个问题 |采纳率78.6%因为导管的作用是保证烧瓶与分液漏斗气压平衡,使还没有反应的时候,右边的量气管液面就是稳定的,如果没有导管的话,还没开始反应,烧瓶内就有气压就会使量气管液面上升,在液体滴定的过程中,右边液面上升的体积包括产生气体的体积和空气的体积,所以V是偏大的,故最终结果也是偏大的.1年前查看全部
- 摩尔盐[xFeSO4•y(NH4)2SO4•zH2O]是一种重要化工原料.其组成可通过下列实验测定:
摩尔盐[xFeSO4•y(NH4)2SO4•zH2O]是一种重要化工原料.其组成可通过下列实验测定:
①称取1.568 0g样品,准确配成100mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.466 0g.
③再量取25.00mL溶液A,滴加适量稀硫酸,用0.020 0mol•L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL.
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 mol•L-1,应保持溶液中c(Ba2+ )≥______mol•L-1.
(2)③中发生反应的离子方程式为______,滴定终点的现象是______.
(3)通过计算确定样品的组成(必须写出计算过程). winsun261年前1
winsun261年前1 -
 tommow44 共回答了18个问题
tommow44 共回答了18个问题 |采纳率77.8%解题思路:(1)根据沉淀溶解平衡常数Ksp=c(SO42-)•c(Ba2+ )来计算;
(2)在酸性环境下,高猛酸根离子可以将亚铁离子氧化为三价铁离子;
(3)根据高猛酸根离子和亚铁离子的化学方程式,据高猛酸根离子的量来确定亚铁离子的量,根据元素守恒确定样品的组成情况.(1)沉淀溶解平衡常数Ksp=c(SO42-)•c(Ba2+ ),c(Ba2+ )=
Ksp
c(SO42−),当c(SO42-)≤1.0×10-5 mol•L-1,所以溶液中c(Ba2+ )≥1.1×10-5mol/L,故答案为:1.1×10-5;
(2)在酸性环境下,高猛酸根离子可以将亚铁离子氧化为三价铁离子,即MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;滴入最后一滴KMnO4时,溶液由无色变为浅紫色,且半分钟内不变色;
(3)取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660g.根据硫酸根离子守恒,硫酸根离子的物质的量和硫酸钡的物质的量是相等的,即为:[0.4660/233g/mol]=0.002mol,取25.00mL溶液A,滴加适量稀硫酸,用0.020 0mol•L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL,所以亚铁离子的物质的量为:5×0.02-1×10×10-3=1×10-3mol,铵根离子的物质的量为:2×2.0×10-3-2×1.0×10-3=2×10-3(mol),根据质量守恒,水的物质的量:[1.5680g×[25mL/100mL]-1.0×10-3-3mol×152g/mol-1.0×10-3×132g/mol]×[1/18]=6.0×10-3,所以x:y:z=1:1:6,化学式为:FeSO4•(NH4)2SO4•6H2O.
答:样品的组成为FeSO4•(NH4)2SO4•6H2O.点评:
本题考点: 复杂化学式的确定;难溶电解质的溶解平衡及沉淀转化的本质;中和滴定.
考点点评: 本题涉及中和滴定、沉淀溶解平衡以及守恒法来确定物质的分子式等知识的综合考查题,要求学生具有分析和解决问题的能力,难度大.1年前查看全部
- 摩尔盐的能抗氧化,是因为它是复盐?复盐为什么能抗氧化?
 budaocun1年前2
budaocun1年前2 -
 狂人舅舅 共回答了17个问题
狂人舅舅 共回答了17个问题 |采纳率94.1%硫酸亚铁铵的固体中,原子之间的空隙很小,氧分子不能进入,仅氧化掉表面后反应即停止.类似于钝化.1年前查看全部
- 大学无机化学实验中摩尔盐的制备中的一些问题
大学无机化学实验中摩尔盐的制备中的一些问题
我抽滤得到了淡绿色的晶体,但是有几组抽滤后得到的是绿色的牙膏状的产品,不是一粒粒的晶体. 秋夜思风1年前1
秋夜思风1年前1 -
 疼我包容我 共回答了26个问题
疼我包容我 共回答了26个问题 |采纳率92.3%你做的对.膏状物说明产生了胶体,可能是碱性过强而引起.1年前查看全部
- 什么是摩尔盐?可以用它来鉴别氯化钠个亚硝酸钠吗?
 鱼鱼for眼泪1年前1
鱼鱼for眼泪1年前1 -
 cdpz7520 共回答了15个问题
cdpz7520 共回答了15个问题 |采纳率100%摩尔盐是亚铁盐的复盐(硫酸亚铁铵),一种含结晶水的复盐.易溶于水 分子式为(NH4)2SO4·FeSO4·6H2O 终于你的下一个问题,恕我不知道1年前查看全部
- 硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2•6H2O,商品名为摩尔盐.硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚
硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2•6H2O,商品名为摩尔盐.硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表
实验室欲制备硫酸亚铁铵晶体,设计了如下方案.温度/℃ 10 20 30 40 50 70 (NH4)2SO4 73.0 75.4 78.0 81.0 84.5 91.9 FeSO4•7H2O 40.0 48.0 60.0 73.3 - - (NH4)2Fe(SO4)2•6H2O 18.1 21.2 24.5 27.9 31.3 38.5
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去______,倒掉溶液,用蒸馏水把铁冲洗干净,干燥,备用;
②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为______(填名称,不考虑水解),其物质的量约为______mol;
③加入______g硫酸铵到蒸发皿中,缓缓加热、浓缩至表面出现结晶膜为止、冷却,得硫酸亚铁铵晶体.
(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a______;b______;
②加热、浓缩溶液时,不浓缩至干的理由是______;
③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是______;
④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在______(酸式或碱式)滴定管,操作时用______手拿锥形瓶;
Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:______;
Ⅲ) 判断该反应到达滴定终点的现象为______;
Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为[1/V][1/V]mol/L. 晴天铃1年前1
晴天铃1年前1 -
 jimmysharon 共回答了17个问题
jimmysharon 共回答了17个问题 |采纳率94.1%解题思路:(1)油污属于酯类,在热碱性溶液中能被水解掉,铁和稀硫酸反应的产物是硫酸亚铁,反应中消耗的稀硫酸的量和生成的硫酸亚铁的量相等;(2)亚铁离子具有较强的还原性,能被氧气或高锰酸钾氧化,硫酸亚铁铵晶体中的结晶水受热容易失去;相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小;高锰酸钾具有强氧化性,能腐蚀橡胶,滴定时右手拿锥形瓶,左手控制活塞,高锰酸钾本身有颜色,滴定亚铁离子是不需要指示剂的,根据亚铁离子和高锰酸根反应的实质,可以找到亚铁离子与高锰酸根之间的量的关系,根据原子守恒可以找到亚铁离子和酸亚铁铵之间量的关系,进而进行计算.(1)①铁屑表面的油污属于酯类,在热碱性溶液中能被水解掉,故答案为:铁屑表面的油污;
②铁和稀硫酸反应的产物是硫酸亚铁,根据反应:Fe+H2SO4═FeSO4+H2↑,消耗的稀硫酸的量和生成的硫酸亚铁的量相等即n=0.015L×3mol/L=0.045mol,故答案为:硫酸亚铁;0.045;
③根据(NH4)2Fe(SO4)2•6H2O~(NH4)2SO4~FeSO4,则硫酸铵的物质的量为0.045mol,质量m=nM=0.045mol×132g/mol=5.94g,故答案为:5.94;
(2)①硫酸亚铁溶液在空气中易被氧化变质,为避开氧气的氧化,要求过滤洗涤操作速度要快并且步骤③要缓缓加热,避免沸腾;故答案为:过滤洗涤操作速度要快;步骤③要缓缓加热,避免沸腾;
②硫酸亚铁铵晶体中的结晶水受热容易失去,蒸干会使晶体分解,故答案为:因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解;
③根据表中所示的在不同温度下的溶解度数据,可以看出相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小,所以将硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,故答案为:因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小;
④Ⅰ)高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,所以将KMnO4酸性溶液装在酸式滴定管中,滴定时右手拿锥形瓶,左手控制活塞,故答案为:酸式;右;
Ⅱ)高锰酸根具有氧化性,亚铁离子具有还原性,氧化还原反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
Ⅲ)高锰酸钾本身有颜色,滴定亚铁离子不需要指示剂,当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点,故答案为:当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点;
Ⅳ)1.96g硫酸亚铁铵晶体的物质的量n=[m/M]=[1.96g/392g/mol]=0.005mol,根据原子守恒则亚铁离子的物质的量为0.005mol,反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则5Fe2+~MnO4-,所以高锰酸钾的物质的量为0.001mol,据c=[n/V]=[0.001mol
10−3VL=
1/V]mol/l,故答案为:[1/V].点评:
本题考点: 硫酸亚铁的制备.
考点点评: 本题是一道有关滴定知识的大型实验题目,综合性较强,难度较大.1年前查看全部
- 硫酸亚铁铵是一种重要的化工原料,用途十分广泛.硫酸亚铁铵俗称摩尔盐,下图为制取摩尔盐过程的示意图.
硫酸亚铁铵是一种重要的化工原料,用途十分广泛.硫酸亚铁铵俗称摩尔盐,下图为制取摩尔盐过程的示意图.

请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍.碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH______7(填“>”、“<”或“=”).
(2)步骤②中,过滤操作,需要的玻璃仪器有烧杯、玻璃棒、______能用加热结晶的方法析出说明摩尔盐的溶解度______;
(3)废铁屑的主要成分是铁,同时含有少量氧化铁.请写出①中反应的化学方程式______;______
(4)步骤②所得滤液中一定含有的溶质是______;
(5)能用酒精洗涤的原因______. dannyemailer1年前1
dannyemailer1年前1 -
 wddou 共回答了22个问题
wddou 共回答了22个问题 |采纳率90.9%解题思路:(1)碳酸钠溶液显碱性,能除去油污;
(2)根据过滤的操作分析用到的仪器,根据溶解度随温度的变化情况分析结晶的方法;
(3)根据铁、氧化铁与硫酸的反应写出反应的方程式;
(4)硫酸亚铁铵的溶液中结晶析出硫酸亚铁铵,滤液中一定含有硫酸亚铁铵;
(4)硫酸亚铁铵不溶于酒精.(1)碳酸钠溶液显碱性,pH>7,能除去油污;
(2)过滤操作中,需要的玻璃仪器有烧杯、玻璃棒、漏斗,能用加热结晶的方法析出说明摩尔盐的溶解度随着温度的升高而增大;
(3)废铁屑中有铁、氧化铁,铁与稀硫酸反应生成硫酸亚铁和氢气,氧化铁和稀硫酸反应生成硫酸铁和水,铁还能与硫酸铁反应生成硫酸亚铁,方程式为Fe+H2SO4═FeSO4+H2↑; 3H2SO4+Fe2O3═Fe2(SO4)3+3H2O;Fe2(SO4)3+Fe═3FeSO4;
(4)从硫酸亚铁铵的溶液中结晶析出硫酸亚铁铵,滤液中一定含有硫酸亚铁铵;
(5)由于硫酸亚铁铵不溶于酒精,所以能用酒精洗涤摩尔盐.
故答为:(1)>;(2)漏斗,溶解度随着温度的升高而增大;(3)Fe+H2SO4═FeSO4+H2↑,3H2SO4+Fe2O3═Fe2(SO4)3+3H2O;(4)硫酸亚铁铵;(5)硫酸亚铁铵不溶于酒精.点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题看上去是一道新信息题,但题目考查的知识点全是课本基础知识,熟练掌握酸碱盐的化学性质即可解答本题.1年前查看全部
- (2013•芜湖县模拟)硫酸亚铁铵晶体[(NH4)2Fe(5O4)2•6H2O]俗称“摩尔盐”,是分析化学中的重要试剂.
(2013•芜湖县模拟)硫酸亚铁铵晶体[(NH4)2Fe(5O4)2•6H2O]俗称“摩尔盐”,是分析化学中的重要试剂.
(1)查阅文献:硫酸亚铁铵晶体在500℃时隔绝空气加热完全分解,固体产物可能有FeO和Fe2O3,则气体产物可能有NH3、5O3、H2O、N2和______.
(2)为检验分解产物的成分,设计如图实验装置.隔绝空气加热十中的硫酸亚铁铵至分解完全.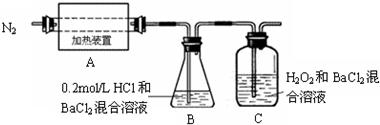
①十中固体充分加热较长时间后,再通入氮气,目的是______.
②装置B的作用是为了检验分解产物中是否有______气体生成;实验中,观察到C中有白色沉淀生成,则C中发生反应的离子方程式为______.
③甲同学设计实验验证十中残留物是否含有FeO,请帮他完成表中内容.
限选试剂:65CN溶液、浓盐酸、稀硫酸、6MnO4溶液、稀硝酸、蒸馏水.仪器和用品自选.
④乙同学认为只需精确称量加热前后固体的质量即可确定残留固体的成分,你是否同意乙同学的看法,并简述理由:______.实验步骤 预期现象和结论 ______ ______  nana12081年前1
nana12081年前1 -
 saullw 共回答了25个问题
saullw 共回答了25个问题 |采纳率84%解题思路:(1)根据硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]的化学式组成及质量守恒定律判断;
(2)①依据实验测定过程分析,通入氮气可以使分解生成的气体全部赶到装置BC中完全吸收;
②三氧化硫和氯化钡溶液反应生成硫酸钡沉淀;装置C中通入二氧化硫和过氧化氢发生氧化还原反应,生成硫酸和氯化钡反应生成硫酸钡沉淀;
③氧化亚铁具有还原性,能够被酸性高锰酸钾溶液氧化从而使高锰酸钾溶液褪色,据此可以判断A中残留物否是否有氧化亚铁;
④氧化亚铁和氧化铁的摩尔质量不同,主要(NH4)2Fe(SO4)2•6H2O的质量固定,则生成的氧化亚铁和氧化铁的质量会不同,据此进行判断.(1)硫酸亚铁铵晶体的化学式为:(N她t)2Fe(Syt)2•d她2y,在500℃时隔绝空气加热完全分解,固体产物可能有Fey和Fe2y1,则气体产物可能有N她1、Sy1、她2y、N2,还可能含有Sy2,
故答案为:Sy2;
(2)①A中固体充分加热较长时间后,通入氮气目的是使分解生成的 气体在她C装置中完全吸收,
故答案为:将分解生成的气体在她C装置中完全吸收;
②装置她中她aC12溶液的作用是为了检验分解产物中是否有Sy1气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊;
装置C中通入二氧化硫和过氧化氢发生氧化还原反应,生成硫酸和氯化钡反应生成硫酸钡沉淀,反应的离子方程式为:Sy2+她2y2+她a2+=她aSyt↓+2她+,
故答案为:Sy1;Sy2+她2y2+她a2+=她aSyt↓+2她+;
③根据亚铁离子的还原性,可以用高锰酸钾溶液检验,方法为:取少量A中残留物与试管中,加入适量稀硫酸,充分振荡使其完全溶解,在所九溶液中滴加高锰酸钾溶液,并振荡,若高锰酸钾溶液褪色,则残留物中含有Fey;若高锰酸钾溶液不褪色,则残留物中不含Fey,
故答案为:
实验步骤预期现象和结论
取少量A中残留物与试管中,加入适量稀硫酸,充分振荡使其完全溶解;
在所九溶液中滴加高锰酸钾溶液,并振荡.若高锰酸钾溶液褪色,则残留物中含有Fey;
若高锰酸钾溶液不褪色,则残留物中不含Fey.④将一定量的(N她t)2Fe(Syt)2•d她2y完全分解后生成Fey或Fe2y1的量是确定的,且二者的质量不相同,所以只需精确称量加热前后固体的质量即可确定残留固体的成分,
故答案为:同意,一定量的(N她t)2Fe(Syt)2•d她2y完全分解后生成Fey或Fe2y1的量是确定的,且各不相同.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题通过探究硫酸亚铁铵晶体的组成成分及检验,考查了性质实验方案的设计方法,题目难度中等,注意掌握常见物质的性质及检验方法,明确性质实验方案的设计与评价原则,试题有利于培养学生的分析、理解能力及化学实验能力.1年前查看全部
- 下列说法不正确的是( )A. 制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品B. 培养明矾晶体时,为得到较大颗粒
下列说法不正确的是( )
A. 制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品
B. 培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却,并静置过夜
C. 铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入氢氧化钠溶液中浸泡5分钟,用水洗净后还需放入稀盐酸中浸泡,再用水洗净
D. 做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗 43554701年前1
43554701年前1 -
 gkcc54572 共回答了13个问题
gkcc54572 共回答了13个问题 |采纳率92.3%解题思路:A.摩尔盐在有机溶剂中的溶解度小,阿司匹林的溶解度随温度的升高而增大;
B.应使饱和溶液缓慢冷却;
C.电镀前应除掉表面的杂质;
D.酸式滴定管需要润洗.A.摩尔盐在有机溶剂中的溶解度小,因此制摩尔盐时用酒精洗涤产品,可以减少晶体的溶解;阿司匹林的溶解度随温度的升高而增大,因此制阿司匹林时用冷水洗涤产品可以减少固体的溶解,故A正确;
B.应使饱和溶液缓慢冷却才能得到较大颗粒的晶体,故B正确;
C.电镀前应放入稀盐酸中浸泡除掉表面的杂质,故C正确;
D.酸式滴定管需要润洗,不润洗相当于稀释了溶液,故D错误.
故选D.点评:
本题考点: 物质的分离、提纯和除杂;化学实验方案的评价.
考点点评: 本题考查物质的分离、提纯和除杂,明确得到较大颗粒的晶体的方法是解题的关键,难度不大.1年前查看全部
- 废铁屑制备摩尔盐固液分离
 超级狂gg1年前1
超级狂gg1年前1 -
 phunter 共回答了17个问题
phunter 共回答了17个问题 |采纳率76.5%答复楼主:
摩尔盐的固液分力分离
我们在分离过程,主要参考盐的溶解度
在试验中通过 加热蒸发、冷却结晶、过滤 这样的步骤取得盐
不知道您描述的过程是不是这样1年前查看全部
- 制摩尔盐时加入少量什么物质可加快铁屑的溶解?加入硫酸后趁热过滤的原因?
 hjj6121年前1
hjj6121年前1 -
 天外飞秒 共回答了14个问题
天外飞秒 共回答了14个问题 |采纳率100%加入少量的CuSO4可以形成原电池加快溶解
趁热过滤是为避免莫尔盐结晶出来被过滤掉了.1年前查看全部
- 将绿矾(FeSO 4 ·7H 2 O)、硫酸铵[(NH 4 ) 2 SO 4 ]以相等物质的量混合可制得摩尔盐[FeSO
将绿矾(FeSO 4 ·7H 2 O)、硫酸铵[(NH 4 ) 2 SO 4 ]以相等物质的量混合可制得摩尔盐[FeSO 4 ·(NH 4 ) 2 SO 4 ·6H 2 O]晶体。 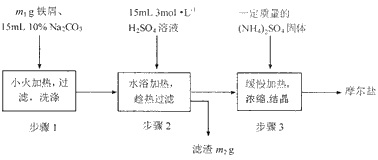
I.根据上图回答:
(1)步骤1的主要作用是__________________________。
(2)步骤3在溶液浓缩时不能蒸发至干,为什么?_______________________________。
(3)制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,理由是___________________________。
Ⅱ.制摩尔盐的原料之一是硫酸铵,评价硫酸铵化肥的主要指标如下:
某研究性学习小组对某硫酸铵化肥样品进行了如下实验探究:
[观察外观] 该硫酸铵化肥无可见机械杂质。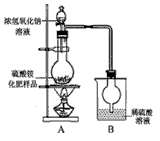
[实验探究] 按图示装置进行实验。
[交流讨论]
(1)甲同学:根据此实验测得的数据,计算的硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:____________________________。
(2)乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是________________________________。
[探究结论] 称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4g。由此可判断该化肥的品质为______________________。(选填“优等品”、“一等品”、“合格品”) 叼蛮小丫1年前1
叼蛮小丫1年前1 -
 目送归鸿 共回答了14个问题
目送归鸿 共回答了14个问题 |采纳率78.6%I.(1)除去铁屑表面的油污
(2)①蒸干时溶液中的杂质离子会被带入晶体中②蒸干时晶体会受热分解或被氧化③得不到含有结晶水的晶体
(3) ①减少晶体在洗涤时的溶解②减少蒸馏水中溶解氧对晶体的氧化
Ⅱ.(1)A、B装置间缺一个干燥装置
(2)使硫酸铵充分反应完全转化为NH 3 ;合格品1年前查看全部
大家在问
- 1英语翻译It was great to hear from you.You sound great fun,and I
- 2第一次真好一文是怎样阐述感悟的?
- 3用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示 (a、b为铜电极).下列说法中不正确的是( )
- 4把1~8这八个数字填入图中的"O"内,是每个正方形的四个角及每个条直线上的四个数之和都等于18
- 5西红柿的生长需要各种无机盐,在它幼苗的根系中,吸收无机盐的主要部位是根尖的______,因此,准备移栽的西红柿幼苗根部总
- 6英语翻译“因为时间不同,机票的价格不同”或者“机票价格随时间变化而变化”求这句话的翻译
- 7对如图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四幅图的描述,正确的是( )
- 8our computer is 这句话是谚语 我找了好久都没找到 请大家给我一个比较精确的答案
- 9作文,我最爱的一种植物,要体现志向的!以现象开头的散文!450字左右!
- 10关于地球引力,根据万有引力,如果我在地球内部中心的话那我是不是处于失重状态了?
- 11小李同学家准备装修一套新房,若甲/乙两家装饰公司合做需6周完成,需支付工资5.2万元;若甲公司单独做4周后,剩下的由乙公
- 12一至九位数横三排竖三排加起都一样,求怎样排
- 13下列关于工业革命的叙述,不正确的是 [ ] A、英国首先发生工业革命的前
- 14怎么算这个数是谁的平方比如:c的平方=1681,c=41.有没有算这种题目的方法
- 15大道之行也 里的 而 是什么意思
