将绿矾(FeSO 4 ·7H 2 O)、硫酸铵[(NH 4 ) 2 SO 4 ]以相等物质的量混合可制得摩尔盐[FeSO
 叼蛮小丫2022-10-04 11:39:541条回答
叼蛮小丫2022-10-04 11:39:541条回答| 将绿矾(FeSO 4 ·7H 2 O)、硫酸铵[(NH 4 ) 2 SO 4 ]以相等物质的量混合可制得摩尔盐[FeSO 4 ·(NH 4 ) 2 SO 4 ·6H 2 O]晶体。 |
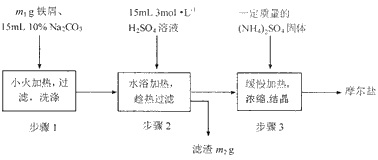 |
| I.根据上图回答: (1)步骤1的主要作用是__________________________。 (2)步骤3在溶液浓缩时不能蒸发至干,为什么?_______________________________。 (3)制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,理由是___________________________。 Ⅱ.制摩尔盐的原料之一是硫酸铵,评价硫酸铵化肥的主要指标如下: |
 |
| 某研究性学习小组对某硫酸铵化肥样品进行了如下实验探究: [观察外观] 该硫酸铵化肥无可见机械杂质。 |
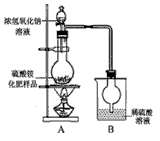 |
| [实验探究] 按图示装置进行实验。 [交流讨论] (1)甲同学:根据此实验测得的数据,计算的硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:____________________________。 (2)乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是________________________________。 [探究结论] 称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4g。由此可判断该化肥的品质为______________________。(选填“优等品”、“一等品”、“合格品”) |

已提交,审核后显示!提交回复
共1条回复
 目送归鸿 共回答了14个问题
目送归鸿 共回答了14个问题 |采纳率78.6%- I.(1)除去铁屑表面的油污
(2)①蒸干时溶液中的杂质离子会被带入晶体中②蒸干时晶体会受热分解或被氧化③得不到含有结晶水的晶体
(3) ①减少晶体在洗涤时的溶解②减少蒸馏水中溶解氧对晶体的氧化
Ⅱ.(1)A、B装置间缺一个干燥装置
(2)使硫酸铵充分反应完全转化为NH 3 ;合格品 - 1年前
相关推荐
- (2013•怀柔区一模)绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等
(2013•怀柔区一模)绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下表:
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为______.25℃时 pH值 饱和H2S溶液 3.9 SnS沉淀完全 1.6 FeS开始沉淀 3.0 FeS沉淀完全 5.5
A.KSCN溶液B.NaOH溶液C.KMnO4溶液D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是______;在溶液中用硫酸酸化至pH=2的目的是______.
(3)操作IV的顺序依次为______、冷却结晶、______.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②______.
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为______(填仪器名称).
②判断此滴定实验达到终点的方法是______.
③计算上述样品中FeSO4•7H2O的质量分数为______. fanxiang7981年前1
fanxiang7981年前1 -
 如果有来世xuan 共回答了18个问题
如果有来世xuan 共回答了18个问题 |采纳率94.4%解题思路:(1)依据三价铁离子的检验方法分析回答,三价铁离子遇硫氰酸钾溶液变血红色;于苯酚呈紫色溶液;
(2)依据流程关系图分析,通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
(3)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,结晶洗涤得到晶体;
(4)操作IV得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用简式滴定管;
②利用高锰酸钾溶液紫红色指示反应终点;
③依据滴定实验的反应终点时发生的反应进行计算.(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价铁离子检验方法分析,三价铁离子遇硫氰酸根离子会反应生成硫氰酸铁血红色,证明铁离子的存在,
A、KSCN溶液和三价铁离子反应生成血红色溶液,可以检验铁离子的检验,故A符合;
B、NaOH溶液和亚铁离子反应生成白色沉淀迅速变化为灰绿色最后变为红褐色,和铁离子反应生成红褐色沉淀,不能检验铁离子的存在,故B不符合;
C、KMnO4溶液不与铁离子反应物现象发生,故C不符合;
D、苯酚溶液和铁离子反应生成紫色溶液,可以检验铁离子的存在,故D符合;
故答案为:AD;
(2)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发、结晶、过滤、洗涤,
故答案为:蒸发浓缩;过滤洗涤;
(4)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,故答案为:降低洗涤过程中FeSO4•7H2O的损耗;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用简式滴定管,用酸式滴定管,故答案为:酸式滴定管;
②滴定实验达到终点时,滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色,故答案为:滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL,则
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×[250/25]=0.01mol;
FeSO4•7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=[2.78g/2.85g]×100%=97.54%,
故答案为:97.54%.点评:
本题考点: 硫酸亚铁的制备.
考点点评: 本题考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.1年前查看全部
- (2013•渭南二模)I.铁是人体必须的微量元素,绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成份.
 (2013•渭南二模)I.铁是人体必须的微量元素,绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成份.
(2013•渭南二模)I.铁是人体必须的微量元素,绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成份.
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是______;实验室在配制FeSO4溶液时常加入______以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化______.
(2)测定绿矾样品含量的实验步骤:
a.称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是______.
②计算上述产品中FeSO4•7H2O的质量分数为______.
II.硫酸亚铁铵(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁.
(3)硫酸亚铁铵不易被氧化的原因______.
(4)为检验分解产物的成份,设计如图实验装置进行实验,加热A中硫酸亚铁铵至分解完全.
①A中固体充分加热较长时间后,通入氮气,目的是______.
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为______.
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为______(用离子方程式表示) 下一步241年前1
下一步241年前1 -
 hnshao 共回答了26个问题
hnshao 共回答了26个问题 |采纳率76.9%解题思路:Ⅰ、(1)硫酸亚铁被空气中的氧气氧化为硫酸铁,依据电荷守恒和原子守恒写出离子方程式,为防止硫酸亚铁被氧化,常加入铁粉,证明硫酸亚铁溶液是否被氧化,可以利用生成的铁离子的特征性质,和硫氰酸钾反应生成血红色溶液设计实验证明;
(2)①依据高锰酸钾溶液的颜色来指示反应终点,滴入最后一滴高锰酸钾溶液变化为紫红色,半分钟不褪色说明达到反应终点;
②依据滴定实验的反应终点时发生的反应进行计算,依据铁元素守恒,结合滴定过程的反应离子方程式计算得到;
Ⅱ、(3)硫酸亚铁铵不易被氧化硫酸亚铁铵溶液中铵根离子水解显酸性,氢离子浓度增大,抑制氧化还原反应的发生;
(4)①依据实验测定过程分析,通入氮气可以使分解生成的气体全部赶到装置BC中完全吸收;
②三氧化硫和氯化钡溶液反应生成硫酸钡沉淀;
③装置C中通入二氧化硫和过氧化氢发生氧化还原反应,生成硫酸和氯化钡反应生成硫酸钡沉淀.Ⅰ、(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+;实验室在配制FeSO4溶液时常加入铁粉防止亚铁离子被氧化,实验证明FeSO4溶液是否被氧化,利用氧化生成的铁离子的特征性质设计实验验证,取少量溶液与试管中,滴加几滴硫氰酸钾溶液,若变红色证明硫酸亚铁已被氧化,若未变红色证明硫酸亚铁未被氧化,
故答案为:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+;铁粉;取少量溶液与试管中,滴加几滴硫氰酸钾溶液,若变红色证明硫酸亚铁已被氧化,若未变红色证明硫酸亚铁未被氧化;
(2)①依据高锰酸钾溶液的颜色来指示反应终点,滴入最后一滴高锰酸钾溶液变化为紫红色,半分钟不褪色说明达到反应终点,
故答案为:当滴入最后一滴高锰酸钾溶液变化为紫红色,半分钟不褪色说明达到反应终点;
②a.称取5.7g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为40.00mL;依据反应方程式进行计算:
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0400L
计算得到;n(Fe2+)=0.002mol;
则250mL溶液中含Fe2+=0.002mol×[250/25]=0.02mol;
FeSO4•7H2O物质的量为0.02mol,质量=0.02mol×278g/mol=5.56g;
质量分数=[5.56g/5.7g]×100%=97.54%,故答案为:97.54%;
Ⅱ、(3)硫酸亚铁铵不易被氧化的原因是因为溶液中铵根离子水解显酸性,氢离子浓度增大,抑制氧化还原反应的发生,
故答案为:溶液中铵根离子水解显酸性,氢离子浓度增大,抑制氧化还原反应的发生;
(4)①A中固体充分加热较长时间后,通入氮气目的是使分解生成的 气体在BC装置中完全吸收,
故答案为:使分解生成的气体在BC装置中完全吸收;
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊,
故答案为;溶液变浑浊;
③装置C中通入二氧化硫和过氧化氢发生氧化还原反应,生成硫酸和氯化钡反应生成硫酸钡沉淀,反应的离子方程式为:SO2+H2O2+Ba2+=BaSO4↓+2H+,
故答案为:SO2+H2O2+Ba2+=BaSO4↓+2H+.点评:
本题考点: 探究物质的组成或测量物质的含量;离子方程式的书写.
考点点评: 本题考查了物质存在和性质的实验探究方法和实验设计判断,氧化还原反应和盐类水解的分析应用是解题关键,题目难度中等.1年前查看全部
- 某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),其实验方案如图:
方案一:
试回答下列问题:
(1)过滤用的器材已有:滤纸、铁架台、铁圈、烧杯和漏斗,还要补充的玻璃仪器是______.
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是______,理由是______.
(3)从滤液E中得到绿矾晶体的实验操作是______.
(4)写出用滤渣F制备胆矾晶体的化学方程式______,______.
方案二:
请回答下列问题:
(5)写出由滤液C到沉淀Ⅱ的离子方程式______.
(6)小组成员经过检测,发现制得的绿矾不纯,试分析原因______,小组成员检测制得的绿矾不纯所用试剂为______.
(7)方案一和方案二,你认为哪种方案相对______更合理,理由是______. ljp9710301年前1
ljp9710301年前1 -
 pp20365 共回答了19个问题
pp20365 共回答了19个问题 |采纳率89.5%解题思路:(1)根据过滤实验用到的仪器来回答;
(2)根据反应所得产物的组成来选择合适的制取方案;
(3)根据溶液来得到晶体来分析实验操作;
(4)根据铜、稀硫酸的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(5)偏铝酸钠可以和少量的盐酸反应生成氢氧化铝;
(6)亚铁离子易被氧化为三价铁离子,硫氰酸钾遇到三价铁离子显示红色;
(7)根据实验中的酸和碱的量的情况来对比回答.(1)过滤实验用到的仪器有:滤纸、铁架台、铁圈、烧杯、玻璃棒和漏斗,故答案为:玻璃棒;
(2)偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,
故答案为:;途径Ⅱ更合理;因为按途径I直接向A加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;
(3)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,将析出的固体洗涤、干燥,即可得到绿矾,故答案为:蒸发浓缩、冷却结晶、洗涤、干燥;
(4)铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,硫酸铜溶液是蓝色的,由于各反应物是混合接触在一起的,这两个反应是同时进行的,所以氧化铜没机会单独的存在,故我们可以认为反应物为氧气、铜和硫酸,而生成物为硫酸铜和水,
故可以写出该反应的化学方程式2Cu+O2+2H2SO4=2CuSO4+2H2O;CuSO4+5H2O=CuSO4•5H2O,
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;CuSO4+5H2O=CuSO4•5H2O;
(5)偏铝酸钠和盐酸反应的实质是:H2O+AlO2-+H+=Al(OH)3↓,故答案为:H2O+AlO2-+H+=Al(OH)3↓;
(6)因为硫酸亚铁中的亚铁离子易被氧化为三价铁离子,会导致绿矾晶体不纯,三价铁的检验用硫氰酸钾溶液,会变红色,故答案为:亚铁离子易被氧化为三价铁离子;KSCN溶液;
(6)在实验方案一中,酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,需要的是适量的酸,这很难控,故答案为:方案一;酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,适量的酸没法控制.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;无机物的推断.
考点点评: 本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.1年前查看全部
- t℃时,在75g水中溶解25g绿矾(FeSO4.7H2O),所得溶液的质量分数为?
 xuhanwen1年前1
xuhanwen1年前1 -
 山水二郎 共回答了17个问题
山水二郎 共回答了17个问题 |采纳率94.1%FeSO4 质量为 25*(56+96)/ (56+96 +7*18)=13.67 g
质量分数==13.67/(75+25)===13.67%1年前查看全部
- 绿矾的化学制法(实验室制法)是什么?
绿矾的化学制法(实验室制法)是什么?
RT. 玄冰烈火1年前2
玄冰烈火1年前2 -
 爱上猫的米老鼠 共回答了22个问题
爱上猫的米老鼠 共回答了22个问题 |采纳率90.9%反应原理:
Fe + H2SO4 = FeSO4 + H2
得到的FeSO4溶液,加热浓缩,至出现少量固体,停止加热,降温,结晶,即得到FeSO4.7H2O绿矾晶体,然后过滤,洗涤,自然干燥,即可.
实验操作注意:
1、用Fe屑与稀硫酸反应,生成FeSO4溶液,要注意Fe要过量,避免生成的FeSO4被氧化.
2、过滤,除去多余的Fe,注意动作要迅速,减少溶液中FeSO4被氧化.
3、加热浓缩FeSO4溶液时注意,出现少量固体,即要停止加热,避免结晶水的失去.
4、过滤、洗涤等操作都要尽量迅速,先用少量水洗涤,再用乙醇洗涤,可除去残留的水分.1年前查看全部
- 要配制10公斤浓度为 2%的FeSO4的水溶液,用绿矾多少?蒸馏水多少 ?铁粉多少?稀硫酸多少?先放什么后放什么?应注意
要配制10公斤浓度为 2%的FeSO4的水溶液,用绿矾多少?蒸馏水多少 ?铁粉多少?稀硫酸多少?先放什么后放什么?应注意什么?
是不是用这些材料?还有什么方法吗? 地狱来客百年幻影1年前1
地狱来客百年幻影1年前1 -
 坏坏BABY 共回答了15个问题
坏坏BABY 共回答了15个问题 |采纳率93.3%要配制10公斤浓度为 2%的FeSO4,需要绿矾质量=10000*0.2%*278/152=36.6(克);需要蒸馏水质量=10000-36.6=9963.4(克)
配制方法:称出需要的绿矾,量出9953毫升水,先溶解在少量水里,加上10克稀盐酸,再把剩余的水加进去,搅拌均匀就好了.(加稀盐酸是为了防止硫酸亚铁水解)1年前查看全部
- (2014•安徽模拟)将绿矾(FeSO4•7H2O)隔绝空气条件下强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产
(2014•安徽模拟)将绿矾(FeSO4•7H2O)隔绝空气条件下强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
实验一:为探究固体产物中Fe元素的价态,该同学将固体产物溶于足量的稀H2SO4得到相应溶液,进行以下猜想和实验
实验二:为进一步探究该反应的产物,进行了如下图所示的实验猜想 实验操作 预期现象 猜想一:Fe元素只显______价; ①向所得溶液中滴入KSCN
溶液;
②向稀酸性KMnO4溶液中滴入所得溶液.KSCN溶液无明显现象
稀酸性KMnO4溶液颜色______;猜想二:Fe元素只显______价; 稀酸性KMnO4溶液颜色______; 猜想三:Fe元素既有+2价又有+3价. KSCN溶液呈______色;
稀酸性KMnO4溶液颜色______.
①实验开始时,点燃B处酒精喷灯之前应先打开A处活塞通CO2,其目的是______;
②装置图中C的作用是______;
③该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,测得D瓶中沉淀的质量为23.3克,根据这些数据,可以得知,绿矾分解的化学方程式为:2FeSO4•7H2O
Fe2O3+SO2+SO3+14H2O△ .2FeSO4•7H2O;
Fe2O3+SO2+SO3+14H2O△ .
④该组同学设计的装置存在着一个明显的缺陷是______. sadflkgjawkRgrst1年前1
sadflkgjawkRgrst1年前1 -
 fixage 共回答了22个问题
fixage 共回答了22个问题 |采纳率90.9%解题思路:实验一、根据Fe元素有+2价、+3价来分析;依据二价铁可以还原高锰酸钾溶液为无色,铁离子和硫氰酸钾溶液反应生成血红色溶液设计实验分析判断;
实验二、①实验开始时,点燃B处酒精喷灯之前应先打开A处活塞通CO2,目的是赶净空气避免影响测定结果;
②装置C是安全瓶起到防倒吸的作用;
③55.6克的绿矾,物质的量是0.2摩尔,其中,A中产生的二氧化碳是不会和氯化钡反应生成沉淀的,二氧化硫也不和氯化钡产生沉淀,二氧化硫也不和氯化钡产生沉淀.所以,产生的沉淀就只能是硫酸钡,也就是说,一定会有三氧化硫产生.根据沉淀的质量是23.3克,所以硫酸钡的物质的量是0.1摩尔,所以产生的三氧化硫是0.1摩尔,根据原子守恒,在绿矾中的硫是0.2摩尔,剩余的0.1摩尔的硫可能有很多的生成形式,可能是单质硫,也可以使其他形态的硫,但是C瓶中并没有单质硫析出;不管是那种形态的硫存在,硫元素化合价一定降低了,所以铁元素化合价一定要升高,根据电子守恒计算分析判断;
④分析装置生成的气体中二氧化硫有毒不能排放到空气中需要尾气吸收;实验一,Fe元素有+2价、+3价,所以产物可能为Fe2(SO4)3、FeSO4或Fe2(SO4)3和FeSO4的混合物,铁元素化合价可能是+2价,+3价,或+2,+3价;①向所得溶液中滴入KSCN溶液;②向稀酸性KMnO4溶液中滴入所得溶液.KSCN溶液无明显现象,稀酸性KMnO4溶液颜色褪去,证明只含有Fe2+;稀酸性KMnO4溶液颜色无变化,证明一定是+3价铁元素;若KSCN溶液出现血红色现象,稀酸性KMnO4溶液颜色褪去,证明Fe元素既有+2价又有+3价;
故答案为:
猜想 实验操作 预期现象
+2 褪成无色
+3 无变化
血红色
褪成无色实验二,①实验开始时,点燃B处酒精喷灯之前应先打开A处活塞通CO2,目的是赶净空气避免影响测定结果;
故答案为:赶走装置中的空气
②装置C是安全瓶起到防倒吸的作用;
故答案为:防倒吸的作用;
③55.6克的绿矾FeSO4•7H2O,物质的量是0.2摩尔,其中,A中产生的二氧化碳是不会和氯化钡反应生成沉淀的,二氧化硫也不和氯化钡产生沉淀,二氧化硫也不和氯化钡产生沉淀;所以,产生的沉淀就只能是硫酸钡,也就是说,一定会有三氧化硫产生,根据沉淀的质量是23.3克,所以硫酸钡的物质的量是0.1摩尔,所以产生的三氧化硫是0.1摩尔,根据原子守恒,在绿矾中的硫是0.2摩尔,剩余的0.1摩尔的硫可能有很多的生成形式,可能是单质硫,也可以使其他形态的硫,但是C瓶中并没有单质硫析出;不管是那种形态的硫存在,硫元素化合价一定降低了,所以铁元素化合价一定要升高,根据电子守恒计算,0.2molFe2+变化为Fe3+;硫元素化合价从+6价变化为x价,0.2×1=0.1×(6-x),x=+4,实验生成的产物中有SO2,依据原子守恒配平书写化学方程式:2FeSO4•7H2O
△
.
Fe2O3+SO2+SO3+14H2O;
故答案为:2FeSO4•7H2O
△
.
Fe2O3+SO2+SO3+14H2O;
④分析装置生成的气体中二氧化硫有毒不能排放到空气中需要尾气吸收;
故答案为:未进行尾气吸收;点评:
本题考点: 探究物质的组成或测量物质的含量;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查了物质性质的实验探究方法和实验分析判断,氧化还原反应电子守恒的计算应用,主要是铁及其化合物性质的应用,掌握基础和实验基本操作是解题关键,题目难度中等.1年前查看全部
- 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用.其实验方案如下:

请回答下列问题:
(1)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是______,理由是:______.
(2)从滤液E中得到绿矾晶体的实验操作是______.
(3)请用一个总反应式表示由滤渣F制备胆矾晶体过程中发生的变化:2Cu+O2+2H2SO4+8H2O
2CuSO4•5H2O△ .2Cu+O2+2H2SO4+8H2O.
2CuSO4•5H2O△ .
(4).有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理______,理由是______. 大雪飘飞1年前1
大雪飘飞1年前1 -
 AINGAING 共回答了14个问题
AINGAING 共回答了14个问题 |采纳率92.9%解题思路:铝、铁、铜的合金中加入足量烧碱溶液,只有铝与其反应而溶解,过滤后得滤渣B的成分为铁和铜,滤液A为偏铝酸钠溶液;滤液A生成氯化铝溶液的途径Ⅰ发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O;而途径Ⅱ通入足量的二氧化碳反应后过滤能得到纯净的氢氧化铝,氢氧化铝与盐酸反应能制得AlCl3溶液;滤渣B中只有铁和稀硫酸反应,反应后经过滤得滤渣为铜,再由铜制取胆矾,滤液为硫酸亚铁溶液,然后由溶液制取晶体.
(1)途径Ⅰ会引入氯化钠杂质;而途径Ⅱ能制得纯净的AlCl3溶液;
(2)由溶液制取晶体,需经过加热浓缩,冷却结晶、过滤洗涤、干燥;
(3)铜和氧气和酸反应生成硫酸铜和水;
(4)将方案中最初溶解合金的烧碱改为盐酸,后者操作步骤多,消耗的试剂量更多,时间长.铝、铁、铜的合金中加入足量烧碱溶液,只有铝与其反应而溶解,过滤后得滤渣B的成分为铁和铜,滤液A为偏铝酸钠溶液;滤液A生成氯化铝溶液的途径Ⅰ发生反应:NaAlO2+4HCl=AlCl3↓+NaCl+2H2O;而途径Ⅱ通入足量的二氧化...
点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题主要考查了从工业废料中制取纯净物,注意从框图转化中找出有用信息,利用有关的化学反应进行解答,难度中等.1年前查看全部
- 工业上为了处理含有Cr 2 O 7 2 - 的酸性工业废水,采用下列的处理方法:是绿矾(FeSO 4 ·7H 2 O),
工业上为了处理含有Cr 2 O 7 2 - 的酸性工业废水,采用下列的处理方法:是绿矾(FeSO 4 ·7H 2 O),把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH) 3 沉淀。其主要的化学方程式如下:
H 2 Cr 2 O 7 +6FeSO 4 +6 H 2 SO 4 =Cr 2 (SO 4 ) 3 +3Fe 2 (SO 4 ) 3 +7H 2 O
现用上述方法处理1×10 4 L含铬(+6价)78mg/L的废水(Cr相对原子质量为52),请回答下列问题:
⑴处理后,沉淀物中除Cr(OH) 3 外,还有 . (用化学式表示)。
⑵需用绿矾的质量 。 mengxiang9991年前0
mengxiang9991年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下述物质不能作混凝剂的是碱式氯化铁 明矾 绿矾 胆矾
 ericony1年前1
ericony1年前1 -
 wllggx 共回答了18个问题
wllggx 共回答了18个问题 |采纳率88.9%凡是具有三价的金属离子都能形成胶体聚沉,如:铝离子(Al3+) 和 铁离子(Fe3+) ...胆矾的化学式是(CuSO4)不含三价铁离子或者铝离子,所以不能用作混凝剂.绿矾是硫酸亚铁,但是亚铁离子能被氧气氧化成三价铁离子,所以也可以用作混凝剂..1年前查看全部
- 急 可否帮我总结一下高中阶段的一些特殊化学俗名或别名的化学成分与名称比如绿矾,黑矾的成分是 FeSO4 -7 H2O 名
急
可否帮我总结一下高中阶段的一些特殊化学俗名或别名的化学成分与名称
比如绿矾,黑矾的成分是 FeSO4 -7 H2O 名称为硫酸亚铁晶体
详备些, 玉伺1年前3
玉伺1年前3 -
 yanshi230202 共回答了18个问题
yanshi230202 共回答了18个问题 |采纳率83.3%下载下来看看吧1年前查看全部
- 为探索工业废料的再利用,某化学兴趣小组设计了如图1实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4•7H
为探索工业废料的再利用,某化学兴趣小组设计了如图1实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体.

请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是______,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有______.
(2)试剂X是______.
(3)步骤Ⅱ中发生反应的离子方程式是:______.
(4)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个______.
(5)溶液D中各离子的浓度由大到小的顺序为:______.
(6)工业上由X和F制得CuSO4,还必须使用的最恰当的试剂可以是______或______.
A.浓H2SO4B.Fe2O3C.HNO3D.O2E.H2O2. fangzhuzi21年前1
fangzhuzi21年前1 -
 大漠孤独子 共回答了16个问题
大漠孤独子 共回答了16个问题 |采纳率93.8%解题思路:铝、铁和铜的合金中只有金属铝可以和氢氧化钠之间反应生成溶液A偏铝酸钠,固体B是金属铁和金属铜,A中通入过量的二氧化碳可以得到氢氧化铝沉淀C和碳酸氢钠溶液D,金属铁可以和硫酸之间发生反应生成硫酸亚铁和氢气,但是金属铜和稀硫酸之间不反应,硫酸亚铁溶液蒸发浓缩、冷却结晶可以获得绿矾晶体,金属铜可以获得胆矾晶体.
(1)固体和液体的分离用过滤法,过滤用到的仪器:烧杯、玻璃棒、漏斗等;
(2)根据步骤Ⅰ加过量的氢氧化钠发生的反应以及金属铁、铜的性质区别进行解答;
(3)过量CO2与偏铝酸钠溶液反应;
(4)制得的CO2气体中混有氯化氢气体,用饱和的碳酸氢钠除去;
(5)是饱和的碳酸氢钠溶液,溶液呈碱性,水解程度大于电离程度;
(6)根据铜、稀硫酸的性质来判断反应的发生,并结合产物一会原子的利用率来回答其优点.铝、铁和铜的合金中只有金属铝可以和氢氧化钠之间反应生成溶液A偏铝酸钠,固体B是金属铁和金属铜,A中通入过量的二氧化碳可以得到氢氧化铝沉淀C和碳酸氢钠溶液D,金属铁可以和硫酸之间发生反应生成硫酸亚铁和氢气,但是金属铜和稀硫酸之间不反应,硫酸亚铁溶液蒸发浓缩、冷却结晶可以获得绿矾晶体,金属铜可以获得胆矾晶体.
(1)步骤Ⅰ加过量的氢氧化钠,金属铝和氢氧化钠反应,金属铝溶解其中生成偏铝酸钠溶液,金属铁和金属铜不与氢氧化钠反应,将它们分离用过滤;步骤Ⅰ过滤得到的滤液成分为偏铝酸钠,步骤Ⅱ中向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,溶液中的溶质为碳酸氢钠,将它们分离用过滤;步骤Ⅲ中金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应而金属铜不反应将它们分离用过滤,过滤用到的玻璃仪器:烧杯、玻璃棒、漏斗等.
故答案为:过滤;漏斗;
(2)步骤Ⅰ加过量的氢氧化钠,因铝与碱反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,金属铁和金属铜不与氢氧化钠反应,所以溶液A中的离子主要有AlO2-、Na+、OH-;本实验的目的是用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体,金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应生成硫酸亚铁而金属铜不反应,可以实现三种金属的分离,所以试剂X是稀硫酸,
故答案为:稀硫酸;
(3)过量CO2与偏铝酸钠溶液反应,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的氯化氢气体,氯化氢在水中溶解了部分沉淀氢氧化铝,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去氯化氢的装置,二氧化碳在饱和碳酸氢钠中不溶,氯化氢和碳酸氢钠反应生成二氧化碳气体,所以可在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶,除去二氧化碳中的氯化氢,
故答案为:盛有饱和碳酸氢钠溶液的洗气瓶;
(5)是饱和的碳酸氢钠溶液,溶液呈碱性,水解程度大于电离程度,所以离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(OH)>c(H+)>c(CO32-),故答案为:c(Na+)>c(HCO3-)>c(OH)>c(H+)>c(CO32-);
(6)铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,即2Cu+O2+2H2SO4=2CuSO4+2H2O,或者加入过氧化氢氧化不产生新的杂质,故答案为:DE.点评:
本题考点: 常见金属元素的单质及其化合物的综合应用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题是对物质的分离和提纯知识点的考查,注意掌握铝、铁和铜及其化合物的性质是解答本题的关键,题目难度不大.1年前查看全部
- (2011•如皋市模拟)绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生
(2011•如皋市模拟)绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:

已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是______.
(2)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是______;通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②______.
(3)操作IV的顺序依次为:______、结晶______.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②______.
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO-4+8H+═5Fe3++Mn2++4H2O).
①计算上述样品中FeSO4•7H2O的质量分数为______.
②若用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有______;______. korla30g1年前1
korla30g1年前1 -
 太湖渔翁1 共回答了24个问题
太湖渔翁1 共回答了24个问题 |采纳率87.5%解题思路:(1)依据三价铁离子的检验方法分析回答,三价铁离子遇硫氰酸钾溶液变血红色;
(2)依据流程关系图分析,在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;
(3)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,结晶洗涤得到晶体;
(4)操作IV得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(5)依据滴定实验的反应终点时发生的反应进行计算,根据实验过程中操作的误差分析方法进行判断.(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价铁离子检验方法分析,三价铁离子遇硫氰酸根离子会反应生成硫氰酸铁血红色,证明铁离子的存在,
故答案为:取少量晶体溶于水,滴加KSCN溶液,若不出现血红色,表明不含有Fe3+;
(2)已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,
故答案为:使Sn2+完全变成SnS沉淀,而Fe2+不沉淀;防止Fe2+的氧化;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发、结晶、过滤、洗涤,故答案为:蒸发、过滤洗涤;
(4)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,
故答案为:降低洗涤过程中FeSO4•7H2O的损耗;
(5)①a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL;依据反应方程式减小计算:
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×[250/25]=0.01mol;
FeSO4•7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=[2.78g/2.85g]×100%=97.54%;
故答案为:97.54%;
②用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因是洗涤不彻底,亚铁离子被空气中的氧气部分氧化,
故答案为:样品中存在少量的杂质(如H2O、H2SO4等);样品部分被氧化.点评:
本题考点: 铁盐和亚铁盐的相互转变;氧化还原反应的计算;制备实验方案的设计.
考点点评: 本题考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.1年前查看全部
- 绿矾在空气中被氧化变质的化学方程试
 怀念草原1年前1
怀念草原1年前1 -
 yzy1117 共回答了28个问题
yzy1117 共回答了28个问题 |采纳率85.7%12FeSO4+6H2O+3O2=4Fe2(SO4)3+4Fe(OH)3↓1年前查看全部
- 谁能告诉我石膏,绿矾,乙醇,和磷酸的化学式?
 夏日番茄1年前3
夏日番茄1年前3 -
 肘过如刀 共回答了18个问题
肘过如刀 共回答了18个问题 |采纳率100%生石膏CaSO4·2H2O,熟石膏2CaSO4·H2O,
FeSO4·7H2O 绿矾
CH3CH2OH 或 C2H60 ,乙醇
磷酸 H3PO41年前查看全部
- 求绿矾的化学式分三步从含有Fe3+,Cu2+,Cl-,NO3-的废液中,把Fe3+转化为绿矾回收,把Cu2+转化为Cu回
求绿矾的化学式
分三步从含有Fe3+,Cu2+,Cl-,NO3-的废液中,把Fe3+转化为绿矾回收,把Cu2+转化为Cu回收,分别加入什么? damowuyan1年前2
damowuyan1年前2 -
 老忘ss名 共回答了22个问题
老忘ss名 共回答了22个问题 |采纳率90.9%FeSO4*7H2O1年前查看全部
- 检验绿矾变质的问题一瓶购置时间较长的绿矾(FeSO4.7H2O),某同学做了简单的检验,得出的结论是:已经开始氧化.该同
检验绿矾变质的问题
一瓶购置时间较长的绿矾(FeSO4.7H2O),某同学做了简单的检验,得出的结论是:已经开始氧化.该同学所用的试剂和判断依据是()
A.氯水,出现黄褐色
B.NaOH溶液,生成红褐色沉淀
C.铁屑,绿色加深
D.KSCN溶液,有较浅的血红色
另:但我觉的其他也不错啊.为什么选D呢? shaka5321年前2
shaka5321年前2 -
 god1983221 共回答了14个问题
god1983221 共回答了14个问题 |采纳率85.7%A的情况不管绿矾有没有被氧化,都会变成黄褐色,因为浅绿色的亚铁离子会被氧化成黄褐色的三价铁,故无法判断,B中加氢氧化钠后溶液生成的氢氧化亚铁极易被空气中的氧气氧化成氢氧化铁,也无法判断;C答案有点问题,理论上讲是成立的,但实际上如果被氧化的量很少时,无论是铁屑的减少量还是溶液颜色的加深都不好观察.只有D最符合实际,硫氰酸跟与三价铁的反应,灵敏度很高,很容易判断.1年前查看全部
- 明矾、胆矾、蓝矾、绿矾、绿铜分别是什么
明矾、胆矾、蓝矾、绿矾、绿铜分别是什么
不是绿铜,是铜绿 www_37abc_com1年前2
www_37abc_com1年前2 -
 HitCracker 共回答了18个问题
HitCracker 共回答了18个问题 |采纳率100%明矾:十二水硫酸铝钾
胆矾、蓝矾:五水硫酸铜
绿矾:硫酸亚铁晶体
铜绿:碱式碳酸铜1年前查看全部
- 胆矾、明矾和绿矾属于盐吗?它们是盐,还是盐的水合物?
 努力相信1年前1
努力相信1年前1 -
 背对影子 共回答了16个问题
背对影子 共回答了16个问题 |采纳率87.5%1、胆矾也就是五水硫酸铜
化学式为CuSO4·5H2O
属于盐
2、明矾学名十二水合硫酸铝钾
分子式K2SO4·Al2(SO4)3·24H2O
是含有结晶水的硫酸钾和硫酸铝的复盐
属于复盐
3、 绿矾分子式FeSO4·7H2O
属于盐1年前查看全部
- 利用质量分数为30%硫酸的废液2吨跟足量的铁屑起反应,可生产出绿矾(FeSO4.7H2O)多少吨?
 airwolf12231年前1
airwolf12231年前1 -
 sz91tg 共回答了18个问题
sz91tg 共回答了18个问题 |采纳率94.4%n(H2SO4)=2000000*0.3/98=6122.45mol,根据硫元素守恒,所以绿矾的物质的量也为6122.45摩尔.所以m=6122.45*278=1.7吨,望采纳1年前查看全部
- 明矾、胆矾、绿矾的化学式分别是?
 300mm1年前4
300mm1年前4 -
 泥丫头 共回答了18个问题
泥丫头 共回答了18个问题 |采纳率77.8%明矾:KAl(SO4)2·12H2O(也可以写成K2SO4·Al2(SO4)3·24H2O)
胆矾:CuSO4·5H2O
绿矾:FeSO4·7H2O1年前查看全部
- 绿矾在空气中怎么变质?
 laozl1年前3
laozl1年前3 -
 3AN3 共回答了17个问题
3AN3 共回答了17个问题 |采纳率82.4%2.绿矾即硫酸亚铁的水合物,在空气中既要脱水(非氧化还原反应),又要被氧气等氧化成3价铁(氧化还原反应)
1.溴水有强氧化性,只发生氧化还原反应
3.电石会与水蒸气反应,生成乙炔和氢氧化钙,是非氧化还原反应
4.漂白粉与二氧化碳反应,是非氧化还原反应1年前查看全部
- 胆矾,明矾,绿矾分别是什么?
 cqx_fa7yk695f1年前1
cqx_fa7yk695f1年前1 -
 98765432104 共回答了22个问题
98765432104 共回答了22个问题 |采纳率100%胆 矾
别名 石矾,兰矾,鸭嘴绿胆矾.
来源 为硫化铜矿氧化分解形成或人工制成的含水硫酸铜.
胆矾:为三斜晶系胆矾的矿石或为人工制成的含水硫酸铜.呈不规则的块状结晶体,大小不一.深蓝或淡蓝色,微带浅绿.晶体具玻璃光泽,半透明至透明,在空气中易风化.质脆易碎,碎块呈棱柱状.硬度2.5,比重2.2.3.无臭,味酸涩.
性味归经 酸,辛,寒;有毒.归肝,胆经.
功效应用
1,涌吐风痰,毒物:用于风痰壅塞,喉痹,癫痫,误食毒物.
2,解毒收湿:用于风眼赤烂口疮牙疳.宜小量外用.
3,蚀疮祛腐:用于肿毒不破,胬肉疼痛.本品外用剂量稍大,有蚀疮祛腐之功.
用量用法 内服0.0.6g,温汤化服.用于催吐,每次极量0.3g,限服1次.外用适量,煅研为末外敷.若洗目,应作千倍之水溶液使用.
使用注意 体虚者忌服.本品有毒,不宜大量及久服.
明矾又称白矾、钾矾、钾铝矾、钾明矾、十二水硫酸铝钾.是含有结晶水的硫酸钾和硫酸铝的复盐.化学式KAl(SO4)2·12H2O,式量474.39,无色立方,单斜或六方晶体,有玻璃光泽,密度1.757g/cm3,熔点92.5℃.64.5℃时失去9分子结晶水,200℃时失去12分子结晶水,溶于水,不溶于乙醇.明矾性味酸涩,寒,有毒.故有抗菌作用、收敛作用等,可用做中药.明矾还可用于制备铝盐、发酵粉、油漆、鞣料、澄清剂、媒染剂、造纸、防水剂等.明矾净水是过去民间经常采用的方法,它的原理是明矾在水中可以电离出两种金属离子:
KAl(SO4)2 = K+ + Al3+ + 2SO42-
而Al3+很容易水解,生成胶状的氢氧化铝Al(OH)3:
Al3+ + 3H2O = Al(OH)3(胶体)+ 3H+
氢氧化铝胶体的吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清.所以,明矾是一种较好的净水剂.
绿矾的成分是硫酸亚铁晶体.
亦名皂矾、青矾.煅红者名绛矾或矾红.
气味 酸、凉、无毒.硫酸亚铁(FESO4*7H2O) 又名绿矾、铁矾,含有7个结晶水分子.为透明、淡绿色的结晶或粉末,无臭,味涩,在干燥空气中易风化.1年前查看全部
- 绿矾,明矾,胆矾分别是什么?
 双股屠刀1年前5
双股屠刀1年前5 -
 货代高手 共回答了19个问题
货代高手 共回答了19个问题 |采纳率94.7%FeSO4.7H20 Al2SO43.12H2O CuSO4.5H201年前查看全部
- 为什么在用铁屑制取绿矾的过程中,蒸发浓缩、冷却结晶后还要过滤洗涤呢?不是已经得到了晶体了吗?是因为冷却结晶后的晶体里面还
为什么在用铁屑制取绿矾的过程中,蒸发浓缩、冷却结晶后还要过滤洗涤呢?不是已经得到了晶体了吗?是因为冷却结晶后的晶体里面还有些没结晶的硫酸亚铁?
 ee12121年前3
ee12121年前3 -
 littlesparrow01 共回答了25个问题
littlesparrow01 共回答了25个问题 |采纳率88%洗涤是把杂质给除去.
这里一般可以用酒精来洗,以减少在洗涤过程中绿矾晶体的溶解,而产率偏低.1年前查看全部
- 由铁红制绿矾的化学方程式
 hhr1431年前1
hhr1431年前1 -
 826200 共回答了21个问题
826200 共回答了21个问题 |采纳率81%首先将铁红(Fe2O3)放到过量稀硫酸里方程式为:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
再向其中加入过量的铁粉,方程式为:Fe+Fe2(SO4)3==3FeSO4,其中过量的铁粉和稀硫酸也会反应:Fe+H2SO4==H2+FeSO4,氢气后面记得打箭头.然后蒸发就好了.得到了绿矾.1年前查看全部
- 如何用绿矾制造硫酸
 xin只有你1年前1
xin只有你1年前1 -
 丰收2号 共回答了19个问题
丰收2号 共回答了19个问题 |采纳率89.5%绿矾不过就是硫酸亚铁晶体吗.
绿矾加强热达到500℃以上就能分解生成氧化铁、二氧化硫、三氧化硫和水;
三氧化硫与水反应就能生成硫酸.
化学方程式:
2FeSO4·7H2O=(高温)Fe2O3+SO2+SO3+14H2O,
SO3+H2O=H2SO41年前查看全部
- 下列制绿矾的方法最适宜的是是铁屑与稀硫酸 不是FeO与稀硫酸 为什么
 正牌绝代香蕉1年前1
正牌绝代香蕉1年前1 -
 cxg1984 共回答了19个问题
cxg1984 共回答了19个问题 |采纳率78.9%因为Fe2+离子容易被氧化成Fe3+离子 因此应该用Fe来防止Fe2+被氧化 反应原理:Fe + H2SO4 = FeSO4 + H2 得到的FeSO4溶液,加热浓缩,至出现少量固体,停止加热,降温,结晶,即得到FeSO4.7H2O绿矾晶体,然后过滤,洗涤,自然干燥,即可.实验操作注意:1、用Fe屑与稀硫酸反应,生成FeSO4溶液,要注意Fe要过量,避免生成的FeSO4被氧化.2、过滤,除去多余的Fe,注意动作要迅速,减少溶液中FeSO4被氧化.3、加热浓缩FeSO4溶液时注意,出现少量固体,即要停止加热,避免结晶水的失去.4、过滤、洗涤等操作都要尽量迅速,先用少量水洗涤,再用乙醇洗涤,可除去残留的水分.其他方法不行的,原因也是易被氧化.1年前查看全部
- 绿矾能制硫酸吗?能的话写出方程式.
 mengzhou1年前1
mengzhou1年前1 -
 雨丝飘零的苦味 共回答了21个问题
雨丝飘零的苦味 共回答了21个问题 |采纳率100%对于出逃尚未风干的密道貌似学盐那里是这样讲的
里边有大量的氢氧化钙,如果将热的硫酸铜溶液或者硫酸亚铁溶液泼在上边
会反映成硫酸钙和氢氧化铁,墙体就变得稀烂了
或者可以
CaCO3+FeSO4==CaSO4+FeCO31年前查看全部
- 工业上常用铁屑跟硫酸反应经除杂、浓缩、结晶、干燥等过程,来制取绿矾晶体,为使绿矾晶体更纯,合理的方法是
工业上常用铁屑跟硫酸反应经除杂、浓缩、结晶、干燥等过程,来制取绿矾晶体,为使绿矾晶体更纯,合理的方法是
使用稀硫酸(为什么呢?) lxg801年前1
lxg801年前1 -
 benbenmao1209 共回答了14个问题
benbenmao1209 共回答了14个问题 |采纳率78.6%绿矾是七水硫酸亚铁,浓硫酸有强氧化性,会把亚铁离子氧化成铁离子,就不纯了1年前查看全部
- 加热绿矾晶体生成SO3 SO20通入BACL2为什么有BASO4沉淀 SO2溢出
 小征哥1年前1
小征哥1年前1 -
 拓荒的疯子 共回答了17个问题
拓荒的疯子 共回答了17个问题 |采纳率88.2%强酸可以制弱酸啊 三氧化硫生成硫酸 二氧化硫生成亚硫酸1年前查看全部
- 绿矾受热分解的化学式
 岂岂笑1年前3
岂岂笑1年前3 -
 去了远方 共回答了22个问题
去了远方 共回答了22个问题 |采纳率95.5%2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O.1年前查看全部
- 用重铬酸钾法测定绿矾中亚铁离子的含量时,滴定前为什么要加入磷酸?加入磷酸后为什么要立即滴定?
 芝麻狂ll1年前1
芝麻狂ll1年前1 -
 henauty 共回答了21个问题
henauty 共回答了21个问题 |采纳率95.2%加磷酸的目的是消除随后产生的Fe3+干扰,加酸可以提高亚铁受空气中氧的氧化干扰,故应该立即滴定.再说,谁做好实验准备了还要先睡一觉再动手?1年前查看全部
- 将50g含铁70%的铁屑和70g50%的硫酸反应,可制的绿矾多少克
 粉耗呆1年前1
粉耗呆1年前1 -
 小可爱小可爱 共回答了19个问题
小可爱小可爱 共回答了19个问题 |采纳率89.5%Fe+H2SO4→FeSO4+H2↑
n(Fe)=50×70%/56=0.625mol
n(H2SO4)=70×50%/98=0.357mol
所以铁过量
S守恒,有H2SO4→FeSO4→FeSO4·7H2O
m(FeSO4·7H2O)=0.357×278=99.29g1年前查看全部
- 典型是几种硫酸盐的名称.如,绿矾FeSO4.7H2O,蓝矾CuSO4.5H2O之类的,越多越好.
 蒸馒头的蒸1年前3
蒸馒头的蒸1年前3 -
 你注册失败啦 共回答了11个问题
你注册失败啦 共回答了11个问题 |采纳率90.9%芒硝 NaSO4.10H2O
绿矾 FeSO4.7H2O
明矾 KAlSO4.12H2O
泻盐 MgSO4.7H2O
皓矾 ZnSO4.7H2O
胆矾 CuSO4.5H2O
生石膏 CaSO4.2H2O
熟石膏 2CaSO4.H2O1年前查看全部
- FeSO4是生产补血剂的重要原料,某学生用绿矾配制FeSO4溶液时发现溶液略偏黄色,且有少量浑浊现象,造成溶液偏黄色的原
FeSO4是生产补血剂的重要原料,某学生用绿矾配制FeSO4溶液时发现溶液略偏黄色,且有少量浑浊现象,造成溶液偏黄色的原因是( ),出现少量浑浊现象的原因是( ),为防止上述现象发生,应在配制FeSO4溶液时,加入少量的( )和( )(填物质名称),防止溶液偏黄色的离子方程式是( ).
 ssVB1年前1
ssVB1年前1 -
 金顺顺 共回答了12个问题
金顺顺 共回答了12个问题 |采纳率91.7%亚铁离子被空气中的氧气氧化成三价铁离子,因为三价铁离子显黄色,所以溶液偏黄色.
浑浊的原因是由于亚铁离子的水解生成了沉淀.
加入少量的硫酸来抑制水解;加入少量的铁粉来防止亚铁离子被氧化.
2Fe3+ + Fe ==== 3Fe2+1年前查看全部
- 下列物质置露于空气中易变质的是 1氯水 2水玻璃 3烧碱 4漂白粉 5绿矾 6亚硫酸钠?
下列物质置露于空气中易变质的是 1氯水 2水玻璃 3烧碱 4漂白粉 5绿矾 6亚硫酸钠?
希望会的指教一下,请说明为什么.
还有硅酸的酸性弱与碳酸酸性的实验(CO2通入可溶性硅酸盐中析出硅酸沉淀),究竟是怎么一回事,请指教, 咪棣1年前1
咪棣1年前1 -
 一棒 共回答了25个问题
一棒 共回答了25个问题 |采纳率92%以上物质置露于空气中都易变质
1氯水中有次氯酸在空气中易分解
2水玻璃易与二氧化碳反应生成硅酸,碳酸钠
3固体烧碱易潮解;烧碱溶液易与二氧化碳反应
4漂白粉中的次氯酸钙再有水的情况下易与二氧化碳反应生成碳酸钠和次氯酸
5绿矾主要成分七水合硫酸铁晶体在空气中易风化失去结晶水
6亚硫酸根易被氧气氧化为硫酸根
由于硅酸的酸性弱于碳酸酸性,根据强酸可以从弱酸盐中制出弱酸的原理,CO2通入可溶性硅酸盐中可以析出硅酸沉淀(其实先生成原硅酸,然后失水生成硅酸且硅酸不溶水)1年前查看全部
- 绿矾(FeSO4•7H2O)、硫酸亚铁铵(FeSO4•(NH4)2SO4•6H2O)是重要的化学化工试剂.工业上常利用机
绿矾(FeSO4•7H2O)、硫酸亚铁铵(FeSO4•(NH4)2SO4•6H2O)是重要的化学化工试剂.工业上常利用机械加工行业产生的废铁屑为原料制备.这种废铁屑中常混有FeS(其它杂质忽略不计),与稀硫酸反应为:FeS+H2SO4=FeSO4+H2S↑,H2S有毒,水溶液名称为氢硫酸.

请回答下列问题:
(1)图Ⅰ用于制备绿矾.锥形瓶中反应产生绿矾,其中盛放的药品或原料是______,发生的反应除前述化学方程式外,还一定有 (写化学方程式):______.
若知集气瓶的作用是作安全瓶,烧杯中发生的反应是:CuSO4+H2S=CuS↓+H2SO4,则烧杯中盛放的试剂是______,其作用为______.
(2)图Ⅱ用于制备硫酸亚铁铵(已知亚铁盐容易被氧化).在0~60℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,所以硫酸亚铁与硫酸铵的混合溶液冷却至室温便析出硫酸亚铁铵.
具体操作:①打开活塞______,关闭活塞______,从______(填仪器名称)中滴下稀H2SO4到250mL规格的锥形瓶中,充分反应.②待锥形瓶中的铁屑快反应完时,关闭活塞______,打开活塞______.③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
实验中氢气的作用是______,
氢氧化钠溶液的作用是______.
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁铵,并对产品质量进行检测.检测结果如下:
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制______过量为最佳.序号 反应物用量(n表示微粒个数) 产品质量 1 n(H2SO4):n(Fe)>1:1 介于1级~Ⅱ级之间 2 n(H2SO4):n(Fe)<1:1 优于1级
(4)处理胶片的废液中含大量AgNO3、Zn(NO3)2和Fe(NO3)2,若随意排放不仅会造成严重的污染,而且造成资源浪费.某同学从上述的废液中回收金属银并得到副产品绿矾(FeSO4•7H2O),其回收流程如下:
操作②是______,固体A中含______,固体B是______,
x是______,y是______,x、y过量的共同作用是______.
(5)硫酸最古老的生产方法是:把绿矾(FeSO4•7H2O)装入反应器中加强热,会流出油状液体,并放出有刺激性气味的气体(SO2),反应器中的固体变为红色.这个变化的过程可用两个化学方式表示.
①2FeSO4•7H2O
Fe2O3+SO2↑+SO3↑+14H2O△ .2FeSO4•7H2O.
Fe2O3+SO2↑+SO3↑+14H2O△ .
②______. silmens1年前1
silmens1年前1 -
 fldsaf 共回答了27个问题
fldsaf 共回答了27个问题 |采纳率92.6%(1)工业制备绿矾常用废铁屑和硫酸反应进行制取,故答案为:废铁屑和稀硫酸;废铁屑中一定含有铁,铁和硫酸反应生成硫酸亚铁和氢气,故答案为:Fe+H2SO4=FeSO4+H2↑;
烧杯中发生的反应是:CuSO4+H2S=CuS↓+H2SO4,废铁屑中含有FeS,可知硫化氢来自锥形瓶中,所以烧杯中应为硫酸铜溶液,故答案为:CuSO4溶液;
H2S有毒,水溶液名称为氢硫酸,故答案为:吸收尾气H2S.
(2)需要先制备硫酸亚铁,就需要通过中间比较长的装置滴加液体,锥形瓶中盛放废铁屑,制取时,先关闭A,不然会将生成的硫酸压入左边的瓶中,打开BC用氢气将装置内的空气排出,因为亚铁盐容易被氧化,制出硫酸亚铁后,就需要打开A,关闭BC,将硫酸亚铁压入左边的瓶中,使之反应,故答案为:BC,A;分液漏斗;BC,A
瓶中的空气需要用气体排出,硫酸亚铁也需要气体将其压入反应容器中,故答案为:①排尽整个装置中的空气,防止FeSO4被氧化 ②将硫酸亚铁溶液压入饱和碳酸铵溶液
因为H2S有毒,水溶液名称为氢硫酸,需要被吸收,故答案为:吸收尾气H2S
(3)硫酸和铁的质量比确定了产品的级别,从Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,可以看出,三价铁的含量越低级别越高,从表中可以看出,只要控制铁过量,产品级别就高,故答案为:铁,
(4)过滤操作是将固体从液体中分离的一种操作,经过②后,分离出液体和固体,故答案为:过滤
溶液D中只有一种盐是硫酸亚铁,可以分析出Y是硫酸,B是银,所以固体A就是铁和银,所以X就是铁,过量的铁是为了将硝酸亚铁中的铁全部置换出来,过量的硫酸是为了将铁全部反应完,故答案为:银、铁,银,铁,稀硫酸,使反应完全
(5)绿矾(FeSO4•7H2O)加热后生成了氧化铁、二氧化硫,还有浓硫酸,故答案为:①2FeSO4•7H2O
△
.
Fe2O3+SO2↑+SO3↑+14H2O;②SO3+H2O═H2SO41年前
41年前查看全部
- 某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),其实验方案如下:

请回答下列问题:
(1)过滤用的玻璃仪器有______.
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:______,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______.
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______.
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案______ (填“更合理”或“不合理”),理由是______. 流连的钟声1年前1
流连的钟声1年前1 -
 撞到猪 共回答了18个问题
撞到猪 共回答了18个问题 |采纳率94.4%解题思路:合金铝、铁、铜加入足量盐酸溶解后过滤,得到滤液A为氯化铝、氯化亚铁,加入足量氢氧化钠溶液过滤得到滤液C为偏铝酸钠溶液,加入适量盐酸过滤得到氢氧化铝沉淀加入盐酸溶解生成氯化铝溶液;沉淀Ⅰ为氢氧化亚铁,加入硫酸生成硫酸亚铁溶液D蒸发结晶得到绿矾晶体;
(1)根据过滤实验用到的仪器来回答;
(2)制得的绿矾不纯,部分亚铁离子被氧化为铁离子,要想由沉淀I最终制得纯度较高的绿矾,需要向D溶液中加入过量铁粉还原铁离子过滤后溶液通过操作得到晶体;
(3)依据反应原理分析即可;根据铜、稀硫酸、双氧水的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(4)根据实验中的酸和碱的量的情况来对比回答.(1)过滤实验用到的仪器有:滤纸、铁架台、铁圈、烧杯、玻璃棒和漏斗,故答案为:烧杯、漏斗、玻璃棒;
(2)发现制得的绿矾不纯,是因为亚铁离子被氧化为铁离子,要想由沉淀I最终制得纯度较高的绿矾,需要向D溶液中加入过量铁粉还原铁离子为亚铁离子,过滤得到溶液蒸发浓缩,冷却结晶,过滤洗涤得到绿矾晶体;
故答案为:反应过程中部分二价铁转化成了三价铁,向溶液D中加入足量铁粉,反应后过滤,取滤液蒸发结晶即可得绿矾;
(3)铜与浓硫酸反应生成有毒有污染的二氧化硫气体,若铜先和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,不会产生污染大气的气体,该过程原料利用率高,所以途径②最佳,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为:Cu+H2SO4+H2O2=CuSO4+2H2O,
故答案为:Cu+H2SO4+H2O2=CuSO4+2H2O;
(4)在实验原方案中,需要的是适量的酸,且步骤繁琐,这很难控制,改用烧碱,首先分离出来铝,然后加入硫酸,分离出铁,最后得铜的化合物,故比较合理,
故答案为:更合理; 原方案操作步骤多、时间长、消耗试剂量过大;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.1年前查看全部
- 强热绿矾晶体,除结晶水蒸发外,还发生如下化学反应:2FeSO4 △ . Fe2O3+SO2
强热绿矾晶体,除结晶水蒸发外,还发生如下化学反应:2FeSO4
Fe2O3+SO2↑+SO3↑.如果将生成的气体通入浓BaCl2溶液中,产生的现象是( )△ .
A. 生成确BaSO4和BaSO3混合沉淀
B. 生成BaSO4沉淀,有SO2气体逸出
C. 生成BaSO4沉淀,有SO3气体逸出
D. 有SO2和SO3两种气体同时逸出 jannia1年前3
jannia1年前3 -
 ghost13 共回答了19个问题
ghost13 共回答了19个问题 |采纳率89.5%解题思路:混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,注意H2SO3酸性小于HCl.混合气体中含有SO3,将生成的气体通入BaCl2溶液中发生:SO3+H2O=H2SO4,则没有SO3逸出;
H2SO4+BaCl2=BaSO4↓+2HCl,则有BaSO4沉淀生成;
由于H2SO3酸性小于HCl和H2SO4,则SO2不能与BaCl2溶液反应而从溶液中逸出,故得不到BaSO3沉淀;
所以产生的现象是生成BaSO4沉淀,有SO2气体逸出.
故选B.点评:
本题考点: 含硫物质的性质及综合应用.
考点点评: 本题考查二氧化硫的性质,题目难度中等,本题注意SO3和SO2性质的区别,注意H2SO3酸性小于HCl和H2SO4,则不能与BaCl2溶液反应,得不到BaSO3沉淀.1年前查看全部
- &:为什么绿矾容易被氧化啊?(易被什么氧化啊?)
 shersand1年前1
shersand1年前1 -
 就爱那只鱼 共回答了19个问题
就爱那只鱼 共回答了19个问题 |采纳率94.7%绿矾叫做 硫酸亚铁的结晶 里面的亚铁离子不稳定 它容易被氧气氧化成硫酸铁1年前查看全部
- 绿矾(FeSO 4 ·7H 2 O)可用于色谱分析剂、净水、照相制版等方面。下面是以铁屑(含少量锡等杂质)生产绿矾的一种
绿矾(FeSO 4 ·7H 2 O)可用于色谱分析剂、净水、照相制版等方面。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法:

己知:在H 2 S饱和溶液中,SnS沉淀完全时的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时溶液的pH为5.5。
(1)操作Ⅱ中用pH试纸测定溶液pH的操作是:
(2)操作Ⅱ中用硫酸酸化至pH=2的目的是
(3)操作Ⅲ中需要的玻璃仪器是烧杯、 。
(4)通入硫化氢至饱和的目的是:①除去操作Ⅰ所得溶液中含有的Sn 2+ 等杂质离子;
②
(5)操作IV的顺序依次为: 、冷却结晶、 。
(6)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。 单独出旅1年前1
单独出旅1年前1 -
 深山妖狐 共回答了20个问题
深山妖狐 共回答了20个问题 |采纳率100%(1)将pH试纸放在干净、干燥的表面皿上,用干净、干燥的玻璃棒蘸取少量待测液滴在pH试纸中间,观察颜色并与比色卡比较
(2)使溶液中的Sn 2+ 完全转化为SnS,而Fe 2+ 不生成FeS沉淀
(3)玻璃棒、漏斗
(4)将溶液中的Fe 3+ 离子转化为Fe2+离子
(5)蒸发浓缩 过滤 (6)降低绿矾的溶解度,减少绿矾的损失
1年前查看全部
- 下列有关物质的俗名正确的是( ) A.Na 2 CO 3 →小苏打 B.CuSO 4 ·5H 2 O →绿矾 C.
下列有关物质的俗名正确的是( )
A.Na 2 CO 3 →小苏打 B.CuSO 4 ·5H 2 O →绿矾 C.NaOH →烧碱 D.Fe(OH) 3 →铁红  zeus_azhe1年前1
zeus_azhe1年前1 -
 禁止冷嘲热讽及 共回答了15个问题
禁止冷嘲热讽及 共回答了15个问题 |采纳率100%C
1年前查看全部
- 请问绿矾溶解后与氢氧化钠会由绿色变为什么颜色,再加入硫酸会变回绿色吗?
 冬阳之1年前1
冬阳之1年前1 -
 dongweiyu 共回答了20个问题
dongweiyu 共回答了20个问题 |采纳率85%绿色溶液-》-》白色沉淀(氢氧化亚铁)-》-》沉淀变成灰绿色-》-》最终沉淀变为红褐色(氢氧化铁).此时加入硫酸不会变回绿色.另外,由于绿矾溶液的绿色并不明显,所以只要发生了氧化,再加入了硫酸,看上去都像是黄黄的···1年前查看全部
- 用含15%硫酸的废液2500kg与足量的铁屑反应,可生成绿矾(FeSO4 · 7H2O)多少千克?
 吃了tt1年前2
吃了tt1年前2 -
 yanbozhang 共回答了23个问题
yanbozhang 共回答了23个问题 |采纳率87%m(H2SO4)=2500kg*15%=375kg
m(SO4^2-)=375kg*96/98=18000/49 kg
由题意可知,硫酸与足量铁反应,即硫酸中的硫酸根离子全部变成绿钒中的硫酸根离子,于是有
m(FeSO4·7H2O)=18000/49 kg*278/96=52125/49≈1063.78kg
这道题要掌握的就是硫酸根的守恒 因为我们知道绿钒中的硫酸根全部都是由硫酸而来的 这样楼主还有什么疑问可以追加( # ▽ # )祝学习进步1年前查看全部
- 绿矾会溶于水吗?放在水中加热会不会反应生成什么、
 忧郁艳艳1年前3
忧郁艳艳1年前3 -
 芷蓝若冰 共回答了21个问题
芷蓝若冰 共回答了21个问题 |采纳率95.2%绿矾是FeSO4*7H2O晶体,水溶液加热的话会水解,Fe2+ + H2O == Fe(OH)2 + 2H+,这里的二价铁还可能被氧化成三价铁,生成Fe(OH)3,视反应情况而定,另外,如果将溶液蒸干会生成硫酸铁(Fe2(SO4)3)1年前查看全部
- 绿矾晶体(FeSO4•7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4•7H2O)样品(杂质不
 绿矾晶体(FeSO4•7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4•7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.
绿矾晶体(FeSO4•7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4•7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.
(1)观察样品时,发现表面上有一点黄色物质,估计是什么物质______(填化学式)
(2)实验时用到的主要仪器除滴定管、滴定管夹、铁架台、烧杯外,还有______.
(3)滴定时,反应的离子方程式______.
(4)上述实验中的KMnO4溶液需要酸化,用于酸化的酸是______.
a.稀硝酸b.稀硫酸c.稀盐酸d.浓硫酸
(5)KMnO4溶液 应装在______式滴定管中.到达滴定到终点时标志是______.
(6)下列说法正确的是______.
A.选用规格为25.00ml的滴定管装 KMnO4溶液,滴定 时用去20.00ml溶液,剩余溶液为5.00ml.
B.滴定时边滴边摇动锥形瓶,眼睛应观察滴定管内液面的变化.
C.配制标准液KMnO4时,定容俯视,会使测定结果偏高.
D.记录滴定体积时,滴定前读数仰视,滴定后读数俯视会使测定结果偏低.
Ⅱ、氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ•mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ•mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______.
(2)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为______.阴极的电极反应式______. 阿杰9991年前1
阿杰9991年前1 -
 119_yao 共回答了16个问题
119_yao 共回答了16个问题 |采纳率81.3%解题思路:(1)FeSO4能氧化生成Fe2(SO4)3,Fe2(SO4)3呈黄色;
(2)根据滴定操作需要的仪器有:滴定管、滴定管夹、铁架台、烧杯外、锥形瓶;
(3)根据Fe2+氧化生成Fe3+,MnO4-被还原成Mn2+,结合氧化还原反应电子得失和质量守恒进行配平.
(4)KMnO4溶液需要酸化,用于酸化的酸不能具有强氧化性,否则氧化Fe2+,不能具有强还原性,否则被高锰酸钾氧化;
(5)根据KMnO4溶液具有强氧化性,能氧化橡皮管,所以只能放在酸式滴定管中;KMnO4溶液为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,且半分钟不褪色为终点.
(6)A、根据滴定管的结构来分析;
B、根据滴定操作的要求;
C、根据关系式c(待测)×V(待测)=c(标准)×V(标准)来分析;
D、根据关系式c(待测)×V(待测)=c(标准)×V(标准)来分析;
Ⅱ、(1)利用盖斯定律来并书写热化学反应方程式;
(2)由阳极排出液中含有大量的碳酸盐成份,则尿素在阳极参与反应,N元素的化合价升高,以此来书写阳极电极反应;由图可知,阴极生成氢气以此来书写阴极电极反应;(1)FeSO4能氧化生成Fe2(SO4)3,Fe2(SO4)3呈黄色,故答案为:Fe2(SO4)3;
(2)根据滴定操作需要的仪器有:滴定管、滴定管夹、铁架台、烧杯外、锥形瓶,故答案为:锥形瓶;
(3)Fe2+氧化生成Fe3+,MnO4-被还原成Mn2+,KMnO4溶液滴定FeSO4发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(4)稀硝酸、浓硝酸具有强氧化性,含有氧化Fe2+,高锰酸钾可以氧化HCl为氯气,故选硫酸酸化,故选:b;
(5)根据KMnO4溶液具有强氧化性,能氧化橡皮管,所以只能放在酸式滴定管中;KMnO4溶液为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,
故答案为:酸;加入的最后一滴KMnO4溶液不反应,溶液的颜色为紫色,且半分钟不褪色;
(6)A、根据规滴定管的下端有一部分没有刻度,滴定时用去20.00ml溶液,剩余溶液的体积应大于5.00ml,故A错误;
B、滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中溶液颜色的变化;故B错误;
C、配制标准液KMnO4时,定容俯视,标准液的浓度偏大,滴定时,造成V(标)偏小,根据c(待测)×V(待测)=c(标准)×V(标准)可知c(待测)偏小,故C错误;
D、记录滴定体积时,滴定前读数仰视,滴定后读数俯,造成V(标)偏大,根据c(待测)×V(待测)=c(标准)×V(标准)可知c(待测)偏大,故D正确;
故选:D.
Ⅱ、(1)①CH4(g)+H2O(g)═CO (g)+3H2(g)△H=+206.2kJ•mol-1,
②CH4(g)+CO2(g)═2CO (g)+2H2(g)△H=+247.4kJ•mol-1,
由盖斯定律可知,①×2-②可得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ•mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ•mol-1;
(2)由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,则阳极反应式为:CO(NH2)2+8OH-+6e-═CO32-+N2↑+6H2O,由图可知,阴极生成氢气,则阴极反应为:6H2O-6e-═3H2↑+6OH-,
故答案为:CO(NH2)2+8OH-+6e-═CO32-+N2↑+6H2O;6H2O-6e-═3H2↑+6OH-;点评:
本题考点: 中和滴定;热化学方程式;电解原理.
考点点评: 本题主要考查了中和滴定、盖斯定律、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,难度不大,注意对高考热点的训练.1年前查看全部
- 制取绿矾时为什么要加过量的铁?据说是防止绿矾被氧气氧化,为什么这样说呢?
 冰雪中的女孩1年前4
冰雪中的女孩1年前4 -
 zhwsghh 共回答了21个问题
zhwsghh 共回答了21个问题 |采纳率81%亚铁离子有较强的还原性,易与空气中的氧气反应生成铁离子,加足量的铁则可使氧化生成的铁离子再转化为亚铁的.1年前查看全部
大家在问
- 1求小学六年级的课内奥数题
- 2英语翻译在无数蓝色的眼睛和红色的眼睛之中,我有一双宝石般的黑色的眼睛,我骄傲,我是中国人!在无数白色的皮肤和黑色的皮肤之
- 3若三点A,B,C不在同一点上,点P满足PA=PB=PC,则平面内满足条件的点P有
- 4一个关于字母a,b的多项式,除常数项外,其余各项的次数都是3,则这个多项式有5项
- 5化学与生活密切相关.(1)下列食物中,能提供大量蛋白质的是______(填字母).A.苹果 B.纯牛奶
- 6只能用向上排空气法,“只能”为什么能说明溶解性
- 7铝表面常有一层致密而坚固的氧化物薄膜 当用汞盐 如硝酸汞磨擦表面时 在空气中会长出白色毛刷状固体物质 这种白色毛刷状物质
- 81 fx与gx分别是一个奇函数 一个偶函数 若fx-gx=(1/2)^x 则f(1) g(0) g(-2)从大到小顺序是
- 9雪梨的滋味阅读答案,求求你了
- 10请帮我翻译一下文字。谢谢望子成龙,望女成凤,这是天下父母的共同的愿望。但事与愿违,有些父母不懂得表达他们的爱,不知道怎么
- 11英语翻译诗歌被誉为一个民族文化的结晶和最高体现,同时诗歌也是时代、历史文化沉淀的结果.中西方诗歌迥然不同,分别体现了中西
- 12已知函数F(x)=(a*2-3a+2)x*(a*2-5a+5) (a为常数)
- 13菜刀在生活中有重要应用.下列情况中,菜刀腐蚀由快到慢的是
- 14Au100g Au50g Au9995 Au9999 Pt9995 Ag(T+D) AuT+D Au(T+N1) Au(
- 15氯化铵与碱混合共热生成一种有刺激性气味的气体,该气体是
