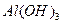中通外直的外什么意思急用
 哈罗摩托2022-10-04 11:39:541条回答
哈罗摩托2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 没毛牙刷 共回答了17个问题
没毛牙刷 共回答了17个问题 |采纳率88.2%- 这个外,意思是外面.
- 1年前
相关推荐
- FeCl3中通H2S气体H2S+2FeCl3=2FeCl2+S↓+2HCl这个反应有没有违背弱酸不能制强酸
 九尾雪狐1年前5
九尾雪狐1年前5 -
 wlyllk 共回答了17个问题
wlyllk 共回答了17个问题 |采纳率100%弱酸制强酸有两种情形:
1)非氧化还原反应的复分解反应
酸性较强的酸能够制取酸性较弱的酸,是因为较强酸在水溶液中的电离程度大于较弱酸,电离产生的氢离子可以跟较弱酸的酸根根离子结合,形成较难电离的较弱酸分子从体系中“游离”出去,从而导致化学平衡向着生成较弱酸的方向移动.
事实上,弱酸能制取强酸的道理是相同的,也是使整个反应向总的离子浓度减小的方向进行,只不过是由于生成的盐的溶解度实在是很小.
如:CuSO4 + H2S == CuS(沉淀)+ H2SO4等等.
2)氧化还原反应
这纯粹是与反应物和产物的氧化还原性大小有关.氧化还原反应发生的规律:氧化性强的氧化剂 + 还原性强的还原剂 == 氧化性弱的氧化产物 + 还原性弱的还原产物.
如:Cl2 + H2S == S(沉淀)+ 2HCl
H2SO3 + Cl2 + H2O == H2SO4 + 2HCl等等1年前查看全部
- 向饱和Na2CO3溶液中通入足量CO2有晶体析出,对晶体析出的原因分析不正确的是?
向饱和Na2CO3溶液中通入足量CO2有晶体析出,对晶体析出的原因分析不正确的是?
A.相同温度下,Na2CO3溶解度大于NaHCO3,B.溶液中溶剂减少了 C.溶质质量增加了 D.反应过程放热.. cyrusyummy1年前3
cyrusyummy1年前3 -
 xiaobo20 共回答了12个问题
xiaobo20 共回答了12个问题 |采纳率75%首先是反应CO2 + Na2CO3 + H2O = 2 NaHCO3,可见溶剂减少了、溶质增加了,BC正确
并且溶解度NaHCO3<Na2CO3,可见A正确
·
D不正确.反应放热应该有利于物质溶解,不是有利于物质沉淀
题目选择不正确的,应该选择D1年前查看全部
- 为什么在饱和碳酸钠溶液中通入二氧化碳会有晶体析出?
为什么在饱和碳酸钠溶液中通入二氧化碳会有晶体析出?
溶液中的碳酸钠饱和,为什么不能再溶碳酸氢钠? ponypony1年前1
ponypony1年前1 -
 狂猎人 共回答了16个问题
狂猎人 共回答了16个问题 |采纳率93.8%不是不能再溶碳酸氢钠
而是碳酸钠与水、二氧化碳反应生成碳酸氢钠,相同温度时碳酸氢钠比碳酸钠的溶解度要小,所以会有晶体析出1年前查看全部
- 关于电动机中通电线圈转动.磁感线与线圈平面垂直时是平衡位置,线圈不动.书里说线圈不动是因为线圈受到的力与线圈在同一平面上
关于电动机中通电线圈转动.
磁感线与线圈平面垂直时是平衡位置,线圈不动.书里说线圈不动是因为线圈受到的力与线圈在同一平面上.这里面“线圈受到的力”指的是磁力吗,如果是,线圈平面与磁感线垂直,为什么不动呢?

 8234ed1年前1
8234ed1年前1 -
 fanchao0901 共回答了20个问题
fanchao0901 共回答了20个问题 |采纳率80%正因为线圈平面与磁感线垂直,所以线圈的速度与磁感线平行,没有力的作用.1年前查看全部
- 硫代硫酸钠溶液中通入氯气,有淡黄色沉淀产生的离子方程式
 爱尔兰-1年前2
爱尔兰-1年前2 -
 分手后再看海 共回答了18个问题
分手后再看海 共回答了18个问题 |采纳率88.9%4 Na2S2O3 + Cl2 = 5 S ↓ + 3 Na2SO4 + 2 NaCl
4 S2O32- + Cl2 = 5 S ↓+ 3 SO42- + 2 Cl-1年前查看全部
- 【急】向硫酸铝溶液中通入氨气反应离子式
 我爱迪士尼1年前1
我爱迪士尼1年前1 -
 renmiss 共回答了19个问题
renmiss 共回答了19个问题 |采纳率94.7%Al3+ +3 NH3+ 3H2O=Al(OH)3+ 3NH4+1年前查看全部
- 化学氧化还原反应计算题在100ml含等物质的量的HBr和H2SO3的混合溶液中通入0.1molCl2,有一半Br-变为B
化学氧化还原反应计算题
在100ml含等物质的量的HBr和H2SO3的混合溶液中通入0.1molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)原溶液中的HBr和H2SO3的浓度等于
0.08mol/L怎么算的谢谢啊 victorbaggio1年前1
victorbaggio1年前1 -
 加乐仔 共回答了16个问题
加乐仔 共回答了16个问题 |采纳率100%因为有一半Br-变为Br2
所以H2SO3肯定全被氧化了~
所以令n(H2SO3)=n(HBr)=2x
所以根据电子守恒可知:
得电子:0.1*2=0.2mol
失电子:x*1+2*2x=5x mol
所以0.2=5x
所以x=0.04mol
所以n(H2SO3)=n(HBr)=0.08mol
所以浓度c=0.08mol/0.1L=0.8mol/l1年前查看全部
- 高等数学中通解和特解分别是什么?
 geren841年前3
geren841年前3 -
 qggy 共回答了14个问题
qggy 共回答了14个问题 |采纳率85.7%通解是解中含有任意常数,且任意常数的个数与微分方程的阶数相同.
特解是解中不含有任意常数.一般是给出一组初始条件,先求出通解,再求出满足该初始条件的特解.1年前查看全部
- 往0.1mol/L的氨水中通入HCl气体至c(NH4+)=c(Cl-),则溶液中离子浓度关系为
往0.1mol/L的氨水中通入HCl气体至c(NH4+)=c(Cl-),则溶液中离子浓度关系为
往0.1mol/L的氨水中通入HCl气体至c(NH₄+)=c(Cl-),则溶液中离子浓度关系为:
c(NH₄+)=c(Cl-)>c(OH-)=c(H+)
不知这样的解释行不行?如下:
反应至中性说明c(H+)=c(OH-),由电荷守恒得,c(NH₄+)=c(Cl-)………………*
反应至中性还可得出:氨水过量,故此时溶液为NH₃·H₂O和NH₄Cl的混合溶液
易知,溶液中相当于仅存在:NH₄ClNH₄+ + Cl-
--------------------------------------------------------------------------
由于物料守恒,0.1=c(NH₃·H₂O)+ c(NH₄+)
又上述可知c(NH₃·H₂O) longwen1231年前1
longwen1231年前1 -
 蔷薇和夏天 共回答了20个问题
蔷薇和夏天 共回答了20个问题 |采纳率85%感觉你是简单问题复杂化了.
铵根离子的水解程度是非常有限的,可以近视看成溶液 中c(NH₄+)=c(Cl-)=0.1mol/L就行了,很容易得出c(NH₄+)=c(Cl-)>c(OH-)=c(H+).1年前查看全部
- 向次氯酸钙溶液中通入二氧化碳或二氧化硫,方程式和离子方程式,
向次氯酸钙溶液中通入二氧化碳或二氧化硫,方程式和离子方程式,
这个和二氧化碳或二氧化硫的浓度有关吗?如果有,那是什么? mzlzhangyue1年前1
mzlzhangyue1年前1 -
 8inch 共回答了22个问题
8inch 共回答了22个问题 |采纳率95.5%Ca(ClO)2 + CO2 + H2O -----> CaCO3 + 2HClO
Ca2+ + 2ClO- + CO2 + H2O -----> CaCO3 + 2HClO
Ca(ClO)2 + 2CO2 + 2H2O -----> Ca(HCO3)2 + 2HClO
ClO- + CO2 + H2O -----> HCO3- + HClO
Ca(ClO)2 + SO2 + H2O -----> CaSO4 + HClO + HCl
Ca2+ + 2ClO- + SO2 + H2O -----> CaSO4 + H+ + Cl- + HClO
Ca(ClO)2 + 2SO2 + 2H2O -----> CaSO4 + H2SO4 + 2HCl
Ca2+ + 2ClO- + 2SO2 + 2H2O -----> CaSO3 + 4H+ + 2ClO- + SO42-1年前查看全部
- 一定条件下,在10L密闭容器中通入1molA和3molB.发生如下反应:
一定条件下,在10L密闭容器中通入1molA和3molB.发生如下反应:
A(g)+xB(g)==(可逆)==2C(g),8分钟够反应达到平衡,测得此时混合气体共3.4mol,生成物C有0.4mol,则下列计算结果错误的是:
A.A的转换率为百分之二十
B.x的值为4
C.用B的浓度改变表示的反应速率为0.01mol/(L.min)
D.平衡时A、B、C的物质的量浓度之比为1:4:3 langdeyouhuo3301年前4
langdeyouhuo3301年前4 -
 大桃仙 共回答了25个问题
大桃仙 共回答了25个问题 |采纳率80%有C 0.4mol,所以反应了A0.2mol所以A对
平衡时A0.8,C0.4,所以B2.2,所以B反应了0.8,1:x=0.2:0.8=1:4,所以x=4
v(B)=(0.8/10)/8=0.01
平衡时A:B:C=0.8:2.2:0.4=4:11:2
选择D1年前查看全部
- 向含少量水蒸汽的容器中通入SO2和H2S共1.00摩尔且知H2S过量充分反应后,所得的氧化产物比还原产物多8.00g则通
向含少量水蒸汽的容器中通入SO2和H2S共1.00摩尔且知H2S过量充分反应后,所得的氧化产物比还原产物多8.00g则通入的SO2和H2S的物质量之比是多少?
 看见的失去了1年前1
看见的失去了1年前1 -
 fgly12345 共回答了16个问题
fgly12345 共回答了16个问题 |采纳率100%2H2S+SO2==2H20+2S(氧化产物)+1S(还原产物)
所以共生成S 24g,0.75mol
根据题意,SO2反应完全,所以SO2为0.25mol,而和它反应的H2S为0.5mol (这样共生成0.75mol S)
总量1mol,所以剩余0.25mol H2S
也就是SO2和H2S的物质量之比是 1:31年前查看全部
- 有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和
有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=_________;若平衡时,甲、乙两容器中A的物质的量不相等,则x=_________.
(2)平衡时甲、乙两容器中A、B的物质的量之比是否相等____________(填“相等”或“不相等”),平衡时甲中A的体积分数为____________.
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为_____________. 长啸剑1年前1
长啸剑1年前1 -
 gilsa0870 共回答了15个问题
gilsa0870 共回答了15个问题 |采纳率86.7%(1)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,甲、乙为等效平衡,
若平衡时,甲、乙两容器中A的物质的量相等,则为完全等效平衡,将乙按化学计量数转化到左边满足n(A)=6mol、n(B)=2mol,则1.5+9/x=6,0.5+3/x=2,解得x=2;
若平衡时,甲、乙两容器中A的物质的量不相等,则压强不影响平衡移动,反应前后气体体积不变,则x=3+1=4,
故答案为:2;4;
(2)A与B的起始物质的量之比等于化学计量数之比,则平衡后A、B的物质的量之比为定值3:1;A、B的体积分数之和为1-0.2=0.8,故A的体积分数=0.8×0.75=0.6,
故答案为:相等;0.6;
(3)若平衡时两容器中的压强不相等,则压强不影响平衡移动,反应前后气体体积不变,则x=4,甲、乙混合气体的总的物质的量不变,压强之比等于物质的量之比,故甲、乙两容器内压强之比为(6+2)mol:(1.5+0.5+3)mol=8:5,
故答案为:P(甲):P(乙)=8:5.1年前查看全部
- 向某溶液中通入cl2,再滴加淀粉碘化钾溶液.变蓝色,则原溶液中有一定有I-,为什么不对
 珍韶华_ff1年前1
珍韶华_ff1年前1 -
 走走走123 共回答了22个问题
走走走123 共回答了22个问题 |采纳率86.4%溶液变蓝色,说明有碘单质存在,是氯气把碘离子氧化成碘单质的,原溶液中可能没有碘离子,因为加进来碘化钾有碘离子了.1年前查看全部
- 在NaOH溶液中通入少量CO2时,发生反应2NaOH+CO2=Na2CO3+H2O
在NaOH溶液中通入少量CO2时,发生反应2NaOH+CO2=Na2CO3+H2O
在NaOH溶液中通入过量CO2时,发生反应NaOH+CO2=NaHCO3
现在用1L 1.0mol/L 的NaOH溶液吸收0.8molCO2,则所得溶液中Na2CO3和NaHCO3的物质的量的比是多少?) lke11111年前3
lke11111年前3 -
 英语班三十六号 共回答了12个问题
英语班三十六号 共回答了12个问题 |采纳率91.7%这个如果用方程式计算有点麻烦
不如你看一下我们用元素守恒计算(反正你到高二高三的时候都要这门用的)
NaOH的物质的量是1mol,CO2的物质的量是0.8mol
设生成Na2CO3 xmol,NaHCO3 ymol
即根据Na守恒知道了2x+y=1
根据C守恒知道了x+y=0.8
根据两式知道了x=0.2,y=0.6
所以生成Na2CO3是0.2mol,NaHCO3是0.6mol
比例是1:31年前查看全部
- 世界上没有十全十美的选择,我们在选择中通往不同的路。我们应该 [ ] A
世界上没有十全十美的选择,我们在选择中通往不同的路。我们应该 [ ]A.选择升学
B.选择就业
C.随遇而安
D.学会选择,学会承担 天生牙1年前1
天生牙1年前1 -
 taylor卡卡 共回答了9个问题
taylor卡卡 共回答了9个问题 |采纳率66.7%D1年前查看全部
- 求一些正确的离子方程式‘① 铝与氢氧化钠溶液反映②向碳酸氢钠溶液中加入少量的澄清石灰水③电解氯化镁溶液④向苯酚钠溶液中通
求一些正确的离子方程式‘
① 铝与氢氧化钠溶液反映
②向碳酸氢钠溶液中加入少量的澄清石灰水
③电解氯化镁溶液
④向苯酚钠溶液中通入少量二氧化碳
⑤向溴化亚铁溶液中通入氯气
⑥将氯气通入水中
⑦氧化铁溶于足量氢碘酸中
⑧碳酸钠溶液呈碱性
⑨硫酸与氢氧化钡溶液混合
⑩向稀氨水中通入少量二氧化碳 隆回深圳人1年前1
隆回深圳人1年前1 -
 yagamishen 共回答了14个问题
yagamishen 共回答了14个问题 |采纳率100%al+4oh-=2h2o+alo2-
ca2++2oh-+2hco3-=caco3+2h2o+co32-
2h2o+2cl-=cl2+h2+2oh-
苯o+co3+h2o=hco3-+苯oh
2fe2++4br++3cl2=6cl-+fe3++2br2
cl2+h2o=h++cl-+hclo
fe2o3+6hi=3h2o+2fei3
co32-+h2o=hco3-+oh-
ba2++2oh-+2h++so42-=baso4+2h2o
2nh3h2o+co32-=(nh4)2co3+2oh-1年前查看全部
- (1/2)由铁的氧化物组成的样品中加入一定量的盐酸,该样品恰好与盐酸完全反应而溶解.再往溶液中通入标...
(1/2)由铁的氧化物组成的样品中加入一定量的盐酸,该样品恰好与盐酸完全反应而溶解.再往溶液中通入标...
(1/2)由铁的氧化物组成的样品中加入一定量的盐酸,该样品恰好与盐酸完全反应而溶解.再往溶液中通入标准状况下的氯气1.12L,氯气完全转化为Cl
答案为1:2 liuxianwei1年前1
liuxianwei1年前1 -
 萧小的我 共回答了23个问题
萧小的我 共回答了23个问题 |采纳率91.3%回答在(2/2)里了如果正确,就给分吧
答案是1:2啊...那就是你题目没说明白了,那0.8mol就是加入氯气前溶液中的氯离子的物质的量了.
那2价铁算法不变还是0.1mol,3j价铁为(0.8-0.1*2)/3=0.2mol,所以最终是1:21年前查看全部
- 为什么向饱和石灰水中通入过量二氧化碳生成沉淀后又溶解?请写出化学方程式.
 全球英语8911年前5
全球英语8911年前5 -
 快乐妖声 共回答了20个问题
快乐妖声 共回答了20个问题 |采纳率95%Ca(OH)2+CO2=CaCO3↓+H2O
CaCO3+CO2+H2O=Ca(HCO3)21年前查看全部
- 下列反应的离子方程式书写正确的是 A.明矾溶液中加入过量的氨水: B.次氯酸钙溶液中通人过量二氧化碳: C.用石墨作电极
下列反应的离子方程式书写正确的是
A.明矾溶液中加入过量的氨水: 
B.次氯酸钙溶液中通人过量二氧化碳: 
C.用石墨作电极电解饱和食盐水: 


D.澄清的石灰水中加人少量的  溶液:
溶液:
 空中雪花1年前1
空中雪花1年前1 -
 hslc311 共回答了24个问题
hslc311 共回答了24个问题 |采纳率91.7%1年前查看全部
- 氯水中通入so2反应式
 梦里花落不知道1年前3
梦里花落不知道1年前3 -
 开始北漂 共回答了31个问题
开始北漂 共回答了31个问题 |采纳率93.5%氧化还原反应:cl2+2H2O+SO2=2HCL+H2SO4,如有不懂可以继续问的,亲1年前查看全部
- (a)一块表面有氧化膜的铝在氢氧化钠溶液中溶解的离子方程式_______________.(b)偏铝酸钠溶液中通入
(a)一块表面有氧化膜的铝在氢氧化钠溶液中溶解的离子方程式_______________.(b)偏铝酸钠溶液中通入
(a)一块表面有氧化膜的铝在氢氧化钠溶液中溶解的离子方程式________,_______.
(b)偏铝酸钠溶液中通入少量二氧化碳,现象________________,离子方程式 . 一腔热精洒何处1年前1
一腔热精洒何处1年前1 -
 caisan4250 共回答了19个问题
caisan4250 共回答了19个问题 |采纳率84.2%(a)Al2O3+2OH-=2AlO2-+2H2O,Al+4OH-=AlO2-+2H2O
(b)产生白色沉淀 AlO2-+CO2+2H2O=Al(OH)3+HCO3-1年前查看全部
- 将22gNaCl和NaBr的混合粉末溶于水,配成100mL溶液,向溶液中通入足量的Cl2后,将溶液蒸干,得到干燥固体的质
将22gNaCl和NaBr的混合粉末溶于水,配成100mL溶液,向溶液中通入足量的Cl2后,将溶液蒸干,得到干燥固体的质量为17.55g,求:
(1)原混合物中NaCl的物质的量的浓度
(2)参加反应中的Cl2在标准状况下的体积. 活力瓶1521年前0
活力瓶1521年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 氢氧化钠中通入二氧化碳后,如何鉴别已生成碳酸钠?
氢氧化钠中通入二氧化碳后,如何鉴别已生成碳酸钠?
要两种方法
 云里有片天1年前1
云里有片天1年前1 -
 醉看夕阳 共回答了19个问题
醉看夕阳 共回答了19个问题 |采纳率94.7%加氯化钙,生成沉淀.
加盐酸,出现气体.1年前查看全部
- 已知2Fe2++Br2=2Fe3++2Br-.向100 mL的FeBr2溶液中通入标准状况下Cl22.24L,充分反应后
已知2Fe2++Br2=2Fe3++2Br-.向100 mL的FeBr2溶液中通入标准状况下Cl22.24L,充分反应后,溶液中有1/3的Br-被氧化成溴单质.求原FeBr2溶液的物质的量浓度
 天悯631年前1
天悯631年前1 -
 既然留念 共回答了16个问题
既然留念 共回答了16个问题 |采纳率100%通过氯气2.24L,即为0.1mol的氯气
由于二价铁离子(Fe2+)的还原性比Br-的要强,所以,Cl2先氧化Fe(2+)
设,该溴化亚铁溶液的量浓度为c mol/L,则亚铁离子的量为0.1c mol.
2Fe(2+)+Cl2=2Fe(3+)+2Cl(-),氧化全部的亚铁离子需要0.05c mol的氯气
而,溴离子的量为0.2c mol,1/3的Br(-)被氧化,就是0.2c/3 molBr(-)被氧化
2Br(-)+Cl2=2Cl(-)+Br2
所以,消耗0.1c/3 mol的氯气.
0.05c+0.1c/3=0.1
解得c=1.2 mol/L1年前查看全部
- 下列离子方程式正确的是( )A.水玻璃中通入二氧化碳:Na2SiO3+CO2+H2O=H2SiO3+CO32-+2Na
下列离子方程式正确的是( )
A.水玻璃中通入二氧化碳:Na2SiO3+CO2+H2O=H2SiO3+CO32-+2Na+
B.向氯化亚铁溶液中通入少量氯气:Fe2++Cl2=Fe3++2Cl-
C.硫酸厂的废气SO2用强碱溶液吸收:SO2+2OH-═SO42-+H2O
D.SiO2溶于NaOH溶液:SiO2+2OH-=SiO32-+H2O gyc2261年前1
gyc2261年前1 -
 小胖陈 共回答了20个问题
小胖陈 共回答了20个问题 |采纳率100%解题思路:A.硅酸为难溶物,需要写出沉淀符号;
B.根据电荷守恒判断,该离子方程式电荷不守恒;
C.二氧化硫与氢氧化钠溶液反应生成的是亚硫酸根离子,不是硫酸根离子;
D.二氧化硅与氢氧化钠溶液反应生成硅酸钠和水.A.硅酸钠为强电解质,不能保留化学式,正确的离子方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-,故A错误;
B.该离子方程式电荷不守恒,正确的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故B错误;
C.反应产物错误,应该为亚硫酸根离子,正确的离子方程式为:SO2+2OH-═SO32-+H2O,故C错误;
D.氢氧化钠与二氧化硅反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,故D正确;
故选D.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子方程式的正误判断,浓度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.1年前查看全部
- 向氢氧化钠中通入二氧化碳,量多量少为什么不一样
向氢氧化钠中通入二氧化碳,量多量少为什么不一样
少量生成碳酸钠,过量生成碳酸氢钠, ampm19841年前1
ampm19841年前1 -
 天竺教父 共回答了16个问题
天竺教父 共回答了16个问题 |采纳率87.5%实质是氢氧化钠先和二氧化碳反应:2NaOH+CO2===Na2CO3+H2O
生成的碳酸钠再和过量的二氧化碳反应:
Na2CO3+CO2+H2O===2NaHCO31年前查看全部
- 向KI与稀硫酸的混合溶液中通入氧气
向KI与稀硫酸的混合溶液中通入氧气
离子方程式 4I-+O2+4H+=2H2O+2I2 的化学方程式怎么写
谢谢楼下2位的热情回答!请问为什么要先在碘化钾溶液里加入淀粉之后再加入稀硫酸呢,淀粉起什么作用呢? ico00720031年前2
ico00720031年前2 -
 yohogame 共回答了20个问题
yohogame 共回答了20个问题 |采纳率80%4KI + O2+ 2 H2SO4 = 2H2O+ 2I2 + 2K2SO4 该小写的地方你会小写吧?!I2 的二是下脚标,跟硫酸根的那个一样,是小的,1年前查看全部
- 苯酚钠溶液中通入CO2生成苯酚和碳酸氢钠,这反应属于取代反应吗?为什么?
苯酚钠溶液中通入CO2生成苯酚和碳酸氢钠,这反应属于取代反应吗?为什么?
不要抄袭 夏夜的烟1年前4
夏夜的烟1年前4 -
 13_II13 共回答了20个问题
13_II13 共回答了20个问题 |采纳率85%这个反应方程是这样的:
C6H5-ONa + CO2 + H2O C6H5OH + Na-HCO3
当然实际上,NaHCO3是通过离子键结合的,以上这个表示的方式只是让它显得更直观而已.
也就是说,有机分子中(C6H5-ONa)的一个原子(Na)被其他原子(H)所代替的反应,符合取代反应的定义.
不过,一家之言,我是这么认为的而已..1年前查看全部
- 在标准状况下,往 100 mL 的氢气和氮气的混合气体中通入100 mL 氧气并点燃,反应完成后让气体恢复到起始状态,测
在标准状况下,往 100 mL 的氢气和氮气的混合气体中通入100 mL 氧气并点燃,反应完成后让气体恢复到起始状态,测得体积为 125 mL ,其中氧气占60%,则原有氢气和氮气的混合气体中,氮气所占的体积应为( )
A.60 mL B.50 mL C.30 mL D.25 mL  流泪的鱼1191年前0
流泪的鱼1191年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知:①向KClO 3 晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验
已知:①向KClO 3 晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是( ) A.实验③说明KI被氧化 B.实验②中氧化剂与还原剂的物质的量之比为2:1 C.实验①证明Cl - 具有还原性 D.上述实验证明氧化性:ClO 3 - <Cl 2 <I 2  花殇之魇1年前1
花殇之魇1年前1 -
 silentsoun 共回答了14个问题
silentsoun 共回答了14个问题 |采纳率92.9%①向KClO 3 晶体中滴加浓盐酸,产生黄绿色气体,反应的化学方程式为:KClO 3 +6HCl=KCl+3Cl 2 ↑+3H 2 O,说明Cl - 具有还原性,氧化剂KClO 3 的氧化性大于氧化产物Cl 2 ;
②向NaI溶液中通入少量实验①产生的气体,反应的化学方程式为:Cl 2 +2NaI=2NaCl+I 2 ;氧化剂Cl 2 和还原剂NaI物质的量之比为1:2;氧化剂Cl 2 的氧化性大于氧化产物I 2 ;
③取实验②生成的溶液中含有碘单质,滴在淀粉KI试纸上,碘单质遇淀粉试纸变蓝色,说明溶液中含有碘单质;所以:
A、说明实验②生成的溶液中含有碘单质,不是试纸上的碘化钾被氧化,故A错误;
B、实验②中氧化剂与还原剂的物质的量之比为1:2,故B错误;
C、实验①反应可知能证明Cl - 具有还原性,故C正确;
D、上述实验证明氧化性:ClO 3 - >Cl 2 >I 2 ,故D错误;
故选C.1年前查看全部
- 将40g烧碱溶于水得溶液甲,再向甲中通入1molHCl得溶液乙,则在相同温度下甲和乙的导电能力一样.为什么?
 Phonixsong1年前1
Phonixsong1年前1 -
 兜兜多多 共回答了18个问题
兜兜多多 共回答了18个问题 |采纳率94.4%如果不考虑溶液体积变化,那麼甲有1molNaOH,乙有1molNaCl,大家阴阳离子的总量以及带电都是一样的,那麼导电能力当然相同.1年前查看全部
- 如图1,线圈A中通有电流i,i随时间t变化的图线如图2(以电流从M端流入、N端流出为正).A右端固定放置一个金属环C.则
 如图1,线圈A中通有电流i,i随时间t变化的图线如图2(以电流从M端流入、N端流出为正).A右端固定放置一个金属环C.则在0~T时间内,关于C环中感应电流i的方向和C环受到的安培力F方向的说法中正确的是( )
如图1,线圈A中通有电流i,i随时间t变化的图线如图2(以电流从M端流入、N端流出为正).A右端固定放置一个金属环C.则在0~T时间内,关于C环中感应电流i的方向和C环受到的安培力F方向的说法中正确的是( )
A.i和F方向都将改变
B.i和F的方向都不改变
C.i的方向不变,F的方向改变
D.i的方向改变,F的方向不变 redpillow1年前1
redpillow1年前1 -
 nfbkbs 共回答了14个问题
nfbkbs 共回答了14个问题 |采纳率92.9%由题意可知,在前半个周期内,电流从N端流入、M端流出,且大小在减小,则由右手螺旋定则与楞次定律可知,C环的感应电流的方向:顺时针(从左向右看);
在后半个周期内,电流从M端流入、N端流出,且大小在增大,则由右手螺旋定则与楞次定律可知,C环的感应电流的方向:顺时针(从左向右看),因此i的方向不变;
在前后半个周期内,通过C环的感应电流的方向相同,但所处的磁场方向相反,则根据左手定则可知,F的方向改变,故C正确,ABD错误;
故选:C.1年前查看全部
- 帮忙写下化学反应离子方程式1.氯化铁溶液中通入硫化氢气体.2.向次氯酸钙溶液中通入二氧化硫.3.硫酸铁的酸性溶液中通入足
帮忙写下化学反应离子方程式
1.氯化铁溶液中通入硫化氢气体.
2.向次氯酸钙溶液中通入二氧化硫.
3.硫酸铁的酸性溶液中通入足量硫化氢.
4.氯化铝溶液中加入过量氨水.
5.碳酸钠溶液中加入过量苯酚.
6.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液. wdy442791年前1
wdy442791年前1 -
 lina138 共回答了21个问题
lina138 共回答了21个问题 |采纳率66.7%晕,不会打小加号和小数字,怎么办
算了,应该看得明白吧.
2Fe3+ + H2S ==2H+ + S↓+ 2Fe
2ClO- + Ca2+ +2H2O+2SO2==2Cl- +CaSO4↓+4H+ + SO4 2-
Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4
Al3+ +3NH3.H2O=Al(OH)3↓+3NH4+
AlCl3+3NH4.H2O==3NH4Cl+Al(OH)3 ↓
Ca2+ +HCO3- +OH-==CaCO3↓+H2O
打到手累1年前查看全部
- (1)常温下向20l真空容器中通入amol硫化氢和bmol二氧化硫(a,b都是正整数,且a
 潮汐乘风1年前2
潮汐乘风1年前2 -
 朴原1 共回答了22个问题
朴原1 共回答了22个问题 |采纳率90.9%(1)容器中发生的反应为:2H2S+SO2=3S↓+2H2O,
欲使容器内气的密度(ρ=m÷V,容器的体积一定)最大,则要让容器中的气体质量最大(质量与物质的量成正比,即物质的量最大).
两种气体反应,最后剩余的气体为过量的气体,所以只要让剩余的气体的质量(物质的量)最大,容器内气体的密度最大.要让剩余气体的物质的量最大,则让硫化氢气体和二氧化硫气体的物质的量差值最大即可;
所以欲使容器中气体密度最大,则b取最大值5,a取最大值1即可;
此时硫化氢完全反应,剩余的SO2的物质的量为5-0.5=4.5mol(通过方程式计算可知);
所以容器中气体的质量为m=n×M=4.5mol×64g/mol=288g;
所以此时容器中的气体的密度为:ρ=m÷V=288g÷20L=14.4g/L;
综上所述,容器内气体可能达到的最大密度约是14.4g/mol.
(楼上错误的原因是a取了0,0不是正整数)
(2)根据气体状态方程PV=nRT可知:同问同体积时,压强和物质的量成正比,即P1/P2=n1/n2;所以反应前后容器中气体的总物质的量之比为P1/P2=2:1;
根据反应方程式可知若恰好完全反应则无气体剩余,所以剩余的气体为过量的气体;
设反应前H2S的物质的量为x,SO2的物质的量为y.
①若H2S过量;则有:
(x-2y)/(x+y)=1/2,所以x:y=5:1;
②若SO2过量,则有:
(y-0.5x)/(x+y)=1/2,所以x:y=1:2;
综上所述:反应前H2S和SO2的体积比是5:1或1:2.1年前查看全部
- 学奕中通国之善弈也中通的意思,为是其智弗若与中的意思
学奕中通国之善弈也中通的意思,为是其智弗若与中的意思
急. 金猪颜颜1年前1
金猪颜颜1年前1 -
 lishkui 共回答了19个问题
lishkui 共回答了19个问题 |采纳率100%弈秋是全国最会下棋的人.(有人)让弈秋教两个人学习下棋,其中一个人学下棋时专心致志,只听弈秋的教导;而另一个人虽然在听着弈秋的教导,可是他心里一直认为天鹅会从头顶飞过,想拿弓箭去射它.虽然他和他同学在一起学习,学习的成果却不如他同学.这能说他的聪明才智不如他同学吗?说:不是这样的.1年前查看全部
- (2014•宿迁二模)低频电涡流传感器可用来测量自动化生产线上金属板的厚度.如图,在线圈L1中通以低频交流电,它周围会产
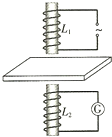 (2014•宿迁二模)低频电涡流传感器可用来测量自动化生产线上金属板的厚度.如图,在线圈L1中通以低频交流电,它周围会产生交变磁场,其正下方有一个与电表连接的线圈L2,金属板置于L1、L2之间.当线圈L1产生的变化磁场透过金属板,L2中会产生感应电流.由于金属板厚度不同,吸收电磁能量强弱不同,导致L2中感应电流的强弱不同,则( )
(2014•宿迁二模)低频电涡流传感器可用来测量自动化生产线上金属板的厚度.如图,在线圈L1中通以低频交流电,它周围会产生交变磁场,其正下方有一个与电表连接的线圈L2,金属板置于L1、L2之间.当线圈L1产生的变化磁场透过金属板,L2中会产生感应电流.由于金属板厚度不同,吸收电磁能量强弱不同,导致L2中感应电流的强弱不同,则( )
A.金属板吸收电磁能量,是由于穿过金属板的磁场发生变化,板中产生涡流
B.金属板越厚,涡流越弱
C.L2中产生的是直流电
D.L2中产生的是与L1中同频率的交流电 完美结局20021年前1
完美结局20021年前1 -
 47322 共回答了8个问题
47322 共回答了8个问题 |采纳率62.5%解题思路:根据变化的电流产生变化磁场,导致金属板有变化的电场,从而出现涡流,使电磁能量转化内能,板越厚,产生内能越多,由电磁感应可知,L2中产生是同频率的交流电,从而即可求解.A、当L1中通过有交流电时,根据右手螺旋定则可知,穿过金属板的磁场发生变化,从而出现变化的电场,导致金属板产生涡流,进而吸收电磁能量,转化成板的内能,故A正确;
B、当金属板越厚,在变化的电场作用下,产生涡流越强,故B错误;
C、根据电磁感应原理,L2中产生的是与L1中同频率的交流电,故C错误,D正确;
故选:AD.点评:
本题考点: * 涡流现象及其应用.
考点点评: 考查电磁感应现象的原理,掌握产生涡流的原理,注意板的厚度与涡流的大小关系,结合变压器与电磁炉,更能便于解题.1年前查看全部
- NaAlO2溶液中通入少量CO2、足量CO2的化学方程式
 可可西里1111年前2
可可西里1111年前2 -
 huanglinkang 共回答了11个问题
huanglinkang 共回答了11个问题 |采纳率90.9%NaAlO2+CO2+H2O=NaHCO3+Al(OH)3↓ (CO2过量)
2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓ (CO2少量)1年前查看全部
- 卤素化学计算题在含有50克溴化钠的溶液中通入一些氯气后,将溶液蒸干,得到残渣45.55克 求多少克溴生成?
 七天一醉1年前2
七天一醉1年前2 -
 lidongjian 共回答了22个问题
lidongjian 共回答了22个问题 |采纳率95.5%反应是
Cl2+2NaBr=Br2+2NaCl
----206------160----117 质量差=206-117=89
--------- x--------- 50-45.55=4.45
所以
x*89=160*4.45
x=81年前查看全部
- 变压器是由于原线圈中通交流电,激发感应磁场,然后激发的磁场在副线圈中激发感应电流
变压器是由于原线圈中通交流电,激发感应磁场,然后激发的磁场在副线圈中激发感应电流
根据I2/I1=n1/n2,原线圈中的电流和匝数成反比,电流小了不是应该激发的磁场也小了吗,那为什么原线圈中匝数多,而副线圈中的感应电流就大了. tl1112221年前2
tl1112221年前2 -
 qizhaoyang007 共回答了19个问题
qizhaoyang007 共回答了19个问题 |采纳率100%这和杠杆原理差不多,力臂越长,作用力越小.动力臂和阻力臂之比越大,阻力和动力之比也就越大.变压器也如此,原线圈和副线圈匝数比悬殊越大,原线圈和副线圈的电流之比也就越大.
另类解题法,换个角度看物理!1年前查看全部
- 下列离子方程式正确的是( ) A.在稀氨水中通入少量CO 2 :NH 3 •H 2 O+CO 2 ═NH 4 + +H
下列离子方程式正确的是( ) A.在稀氨水中通入少量CO 2 :NH 3 •H 2 O+CO 2 ═NH 4 + +HCO 3 - B.向次氯酸钙溶液通入SO 2 :Ca 2+ +2ClO - +SO 2 +H 2 O=CaSO 3 ↓+2HClO C.过量的NaHSO 4 与Ba(OH) 2 溶液反应:Ba 2+ +OH - +H + +SO 4 2- =BaSO 4 ↓+2H 2 O D.在氯化亚铁溶液中加入稀硝酸:3Fe 2+ +4H + +NO 3 - =3Fe 3+ +NO↑+2H 2 O  ljljlrr801年前1
ljljlrr801年前1 -
 u_Doria 共回答了19个问题
u_Doria 共回答了19个问题 |采纳率94.7%A.在稀氨水中通入少量CO 2 生成CO 3 2- ,反应的离子方程式为2NH 3 •H 2 O+CO 2 ═2NH 4 + +CO 3 2- +H 2 O,故A错误;
B.SO 2 具有还原性,向次氯酸钙溶液通入SO 2 生成CaSO 4 和Cl - ,发生氧化还原反应,故B错误;
C.过量的NaHSO 4 与Ba(OH) 2 溶液反应,参加反应Ba 2+ 、OH - 的比值为1:2,反应的离子方程式为Ba 2+ +2OH - +2H + +SO 4 2- =BaSO 4 ↓+2H 2 O,故C错误;
D.在氯化亚铁溶液中加入稀硝酸,Fe 2+ 与稀硝酸之间发生氧化还原反应,反应的离子方程式为3Fe 2+ +4H + +NO 3 - =3Fe 3+ +NO↑+2H 2 O,故D正确.
故选D.1年前查看全部
- 将一充满NO的试管倒扣于水槽中,然后向试管中通入一定量的O2试管中恰好充满水,则通入的O2与原NO气体的体积比为( )
将一充满NO的试管倒扣于水槽中,然后向试管中通入一定量的O2试管中恰好充满水,则通入的O2与原NO气体的体积比为( )
A.4:3
B.3:4
C.4:1
D.1:4 csh2181年前1
csh2181年前1 -
 diaodiao110 共回答了16个问题
diaodiao110 共回答了16个问题 |采纳率93.8%解题思路:依据一氧化氮和氧气在水中全部反应生成硝酸的反应就计算分析判断.将一充满NO的试管倒扣于水槽中,然后向试管中通入一定量的O2试管中恰好充满水,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,反应为4NO+3O2+2H2O=4HNO3,则通入的O2与原NO气体的体积比为3:4,
故选B.点评:
本题考点: 氮的氧化物的性质及其对环境的影响;化学方程式的有关计算.
考点点评: 本题考查了一氧化氮和氧气反应后溶于水生成硝酸的反应特征分析判断,题目较简单.1年前查看全部
- 为什么自来水中通入硝酸银溶液可以产生白色沉淀而蒸馏水不可以?
 wll45801年前1
wll45801年前1 -
 iamfys 共回答了16个问题
iamfys 共回答了16个问题 |采纳率93.8%自来水中通入硝酸银溶液可以产生白色沉淀,
是因为自来水中含有氯离子与硝酸银反应生成白色的氯化银沉淀,
蒸馏水中不含有氯离子.1年前查看全部
- 小芳家夏天常用的“电热驱蚊器”是利用电流的______效应工作的,发热元件是一个阻值为1000Ω的电阻,接在照明电路中通
小芳家夏天常用的“电热驱蚊器”是利用电流的______效应工作的,发热元件是一个阻值为1000Ω的电阻,接在照明电路中通电5min产生的热量为______J.她家电能表铭牌上标有“220V10(40)A 50HZ 2000r/kW•h”,则她家最多可同时接入总功率为______W的用电器正常工作;她用1kW的电磁炉(其它用电器都断开)6min烧开一壶水的过程中,电能表的转盘转______圈.
 leafivan1年前1
leafivan1年前1 -
 分别会见公 共回答了15个问题
分别会见公 共回答了15个问题 |采纳率93.3%解题思路:(1)电流通过导体时向外放出热量的现象叫做电流的热效应;(2)家庭电路的电压为220V,根据Q=W=U2Rt求出通电5min产生的热量;(3)“10(40)A”指标定电流10A(瞬时最大电流40A),根据P=UI求出她家最多可同时接入总功率;(4)根据W=Pt求出电磁炉消耗的电能,根据表盘上的转盘转数和消耗电能之间的关系求出转盘转动的圈数.(1)“电热驱蚊器”是利用电流的热效应来工作的;
(2)通电5min产生的热量:
Q=W=
U2
Rt=
(220V)2
1000Ω×5×60s=14520J;
(3)她家最多可同时接入总功率:
P总=UI=220V×10A=2200W;
(4)1kW的电磁炉(其它用电器都断开)6min消耗的电能:
W=Pt=1kW×[6/60]h=0.1kW•h,
电能表的转盘转转动的圈数:
n=0.1kW•h×2000r/kW•h=200r.
故答案为:热;14520;2200;200.点评:
本题考点: 焦耳定律的计算公式及其应用;电能表参数的理解与电能的求法.
考点点评: 本题考查了学生对电流做功的实质、焦耳定律、电功率公式、电能计算公式的理解和掌握,明白电能表参数的含义是关键.1年前查看全部
- 一根导线中通以正弦电流,周围的磁场怎么变?是没有相移的和导线中电流变化相同,还是有90度的相移?
 lvruub1年前0
lvruub1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 高二物理安培力问题如图所示,用两条一样的弹簧秤吊着一根铜棒,铜棒所在的虚线框范围内有垂直纸面的匀强磁场,棒中通入自左向右
高二物理安培力问题
如图所示,用两条一样的弹簧秤吊着一根铜棒,铜棒所在的虚线框范围内有垂直纸面的匀强磁场,棒中通入自左向右的电流.当棒静止时,弹簧秤示数为F1;若将棒中电流反向,当棒静止时,弹簧秤的示数为F2,且F2>F1,根据上面所给的信息,可以确定 ( )
A磁场的方向 B磁感应强度的大小
C安培力的大小 D铜棒的重力如图
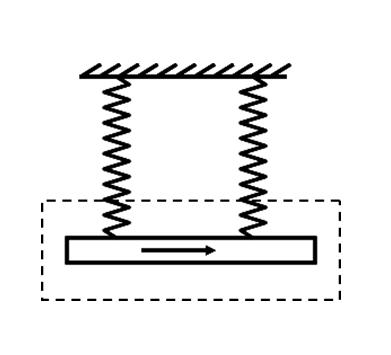
 lywapp1年前1
lywapp1年前1 -
 痛苦seu 共回答了21个问题
痛苦seu 共回答了21个问题 |采纳率90.5%图呢1年前查看全部
- 已知氧化性Cl2>Br2>I2,向NaI和NaBr的混合溶液中通入足量的氯气,充分反应后将溶液蒸干,并灼烧残留物,最后得
已知氧化性Cl2>Br2>I2,向NaI和NaBr的混合溶液中通入足量的氯气,充分反应后将溶液蒸干,并灼烧残留物,最后得到的物质是(提示:溴单质易挥发、碘单质易华)( )
A. NaCl、I2
B. NaCl、NaBr
C. NaBr、I2
D. NaCl caicc1年前2
caicc1年前2 -
 喵呜呜呜呜呜 共回答了24个问题
喵呜呜呜呜呜 共回答了24个问题 |采纳率95.8%解题思路:因氧化性Cl2>Br2>I2,则在Br-、I-中,还原性由弱到强为Br-<I-,向含有NaBr和NaI的混合溶液中通入足量氯气发生:2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,结合Br2和I2的性质分析.在Br-、I-中,还原性由弱到强为Br-<I-,向含有NaBr和NaI的混合溶液中通入足量氯气发生:2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,将溶液蒸干并充分灼烧,溴易挥发,碘易升华,得到固体剩余物质的组成只有氯化钠,
故选D.点评:
本题考点: 卤素原子结构及其性质的比较.
考点点评: 本题考查卤素知识,为高频考点,注意把握物质的性质的异同,结合还原性强弱解答该题,题目难度不大,注意相关基础知识的积累.1年前查看全部
- 1.硝酸钾和氢氧化钠在水溶液中混合 离子方程式 2.向澄清石灰水中通入co2气体 离子方程式
1.硝酸钾和氢氧化钠在水溶液中混合 离子方程式 2.向澄清石灰水中通入co2气体 离子方程式
3.硝酸银溶液和氯化钡溶液 离子方程式
4.稀醋酸和石灰石 离子方程式
5.用铁粉和稀硫酸反应制取氢气 离子方程式 9di61年前4
9di61年前4 -
 潜水高手927 共回答了17个问题
潜水高手927 共回答了17个问题 |采纳率100%1.不反应
2.(1)Ca2+ + 2OH- + CO2 = CaCO3↓+ H2O,
如果二氧化碳过量就会发生
(2)CaCO3+ H2O+CO2==Ca2+ + 2HCO3-
总反应:OH- + CO2==HCO3 -
3.Ag+ + Cl- = AgCl↓
4.2CH3COOH + CaCO3 = Ca2+ + H2O +2CH3COO- +CO2↑
5.Fe + 2H+ = Fe2+ + H2↑1年前查看全部
- 为什么碳酸钠溶液中通足量二氧化碳会生成碳酸氢钠
 窝火了1年前1
窝火了1年前1 -
 侯金利 共回答了11个问题
侯金利 共回答了11个问题 |采纳率100%碳酸根是弱酸根,结合氢离子的能力很强.而通入多量二氧化碳后,生成碳酸,氢离子逐渐增多,逐渐被碳酸根离子结合,成为碳酸氢根.即:生成碳酸氢钠1年前查看全部
大家在问
- 1两道二重积分的小题!如图所示!
- 2帮我算一道积分具体点哈谢谢答案是 x-2ln(√(1+e^X)+1)+C
- 3一道积分运算!对exp{1/x}在定区间(1,2)上做积分.
- 4用绳量井深,三折量里井底差1米,二折超过井深1/4,求井深
- 51MPA等于多少斤有的麻烦告诉下
- 6按规律填数字 如题18()12()()6 3 1 1()3 5 () 130 2 2 5 4 ()()11 8
- 7第一题写出比利时,第二题写清过程
- 8第二小题跪求 积分多多的有
- 9一道积分小题题在这里:
- 103枝铅笔和5枝钢笔共69元,5枝铅笔和3枝钢笔共51元.1枝铅笔和1枝钢笔共多少元
- 11甲乙丙丁站在一排照相,已知甲乙只能站在两边,共有几种不同的站法?
- 12已知x^2+4x+y^2-8y+20=0,求xy的值
- 13辰加偏旁组成2个同音字再组词
- 14在[36/41]、[72/83]、[24/29]、[12/13]四个分数中,第二大的是______.
- 15方程组{●x+●y=26,① ●x+5y=18,②是一个被墨迹污染的方程组,小陈回忆后说:“