用平衡移动原理解释在烧开水时,为什么水未开时会发出响声
 月明亦清2022-10-04 11:39:541条回答
月明亦清2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 ilovea3 共回答了16个问题
ilovea3 共回答了16个问题 |采纳率100%- 根据勒下特烈原理,水到达100摄氏度时,应该朝着抵消这种温度上升方向进行反应,而水蒸发时会吸热,而吸热蒸发是会发出响声.
- 1年前
相关推荐
- 这个怎么用平衡移动原理解释氨水越稀越电离,OH-浓度增大,PH为什么还更小
 炎炎炎1年前1
炎炎炎1年前1 -
 manoo9 共回答了19个问题
manoo9 共回答了19个问题 |采纳率78.9%NH3·H2O ←→ NH4+ + OH-
开始的浓度 C 0 0
结束的浓度 C-x x x
查电离平衡常数表得到 Kb=1.8×10^-5
根据离子积 Kb=[NH4+][OH-]/[NH3]=1.8×10^-5
其中[NH4+]=[OH-]= x mol/L x^2/(C-x)=1.8×10^-5
由于C>>x, 近似计算时C-x=C
x^2=1.8×10^-5*C
将C1=0.1,代入求出x=OH-=1.34*10^-3; 电离度=x/C*100%=1.34%
将C2=0.01代入求出x=OH-=4.24*10^-4 电离度=x/C*100%=4.24%
[H+]=Kw/[OH-]
pH=-lg[H+]
代数据入上两个式子后,就得出你给出题目上数据了.
氨水越稀,平衡向右移动,电离程度越大,是电离度增大,而不是OH-浓度增大,
因OH-浓度低了,PH的值就更小了.1年前查看全部
- 化学高中用平衡移动原理解释为什么可用饱和食盐水除去氯气中的氯化氢,用排饱和食盐水发法收集氯气
 泪无言1年前1
泪无言1年前1 -
 撒旦大人 共回答了12个问题
撒旦大人 共回答了12个问题 |采纳率83.3%Cl2 +H2O ==H+ +Cl- +HClO (可逆反应)饱和食盐水中c(Cl-)浓度大,氯气几乎不溶于水,平衡向逆反应移动.因此,可以用饱和食盐水吸收HCl,而不吸收氯气.1年前查看全部
- 下列事实中,不能用平衡移动原理来解释的是( ) A.工业上由氢气和氮气合成氨是在较高温度下进行的 B.加压后二氧化碳在
下列事实中,不能用平衡移动原理来解释的是( ) A.工业上由氢气和氮气合成氨是在较高温度下进行的 B.加压后二氧化碳在水中的溶解度增大 C.盛有二氧化氮气体的烧瓶,浸入热水浴后颜色变深 D.打开冰镇啤酒的瓶盖时,有大量泡沫溢出  hfevh1年前1
hfevh1年前1 -
 变坏 共回答了16个问题
变坏 共回答了16个问题 |采纳率87.5%A、工业合成氨是放热反应,温度升高,平衡向逆反应移动,不利用氨气的生成,生成中在较高温度下进行,注意考虑反应速率与催化剂的活性,不能用平衡移动原理来解释,故A符合;
B、存在平衡H 2 CO 3 ?H 2 O+CO 2 ,增大压强有利于平衡向左移动,增大二氧化碳的溶解度,可以用平衡移动原理来解释,故B不符合;
C、存在平衡2NO 2 ?N 2 O 4 ,且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故C不符合;
D、存在平衡H 2 CO 3 ?H 2 O+CO 2 ,打开瓶盖时,压强减小,平衡向右移动,二氧化碳气体溶解度减小,逸出二氧化碳,可以用平衡移动原理来解释,故D不符合;
故选A.1年前查看全部
- 试利用平衡移动原理解释下列事实:
试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中
(3)分别用等体积的蒸馏水和0.010mol/L硫酸洗涤
BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量 razars1年前2
razars1年前2 -
 泡淡了的茶叶 共回答了18个问题
泡淡了的茶叶 共回答了18个问题 |采纳率94.4%好久以前学的了,就把我记忆中的东西说说吧
1.水显中性,而稀盐酸呈酸性具有氧化性
2.如果与稀硫酸反映,则生成的硫酸钙,依旧是固态,所以基本上不进行置换作用,而醋酸具有弱酸性,且反映以后生成的醋酸钙是盐,呈液态,容易反映.
3.水洗涤是稀释,而硫酸洗涤还能把部分沉淀的BaSO4溶解.因为BaSO4沉淀本来就是看它在溶液中的比重来算的,而硫酸钡的溶液事实上就是游历的SO4根和H离子组成的 所以多了写溶液沉淀自然会减少.1年前查看全部
- 实验室中常用排饱和食盐水的方法收集氮气能不能用平衡移动原理解释
 xywh1231年前1
xywh1231年前1 -
 蕃薯 共回答了22个问题
蕃薯 共回答了22个问题 |采纳率90.9%饱和食盐水会起到干燥水分的作用1年前查看全部
- 下列事实不能用平衡移动原理解释的是( )
下列事实不能用平衡移动原理解释的是( )
A.实验室中常用排饱和食盐水的方法收集氯气
B.配制FeC13溶液时加入少量的盐酸
C.实验室利用双氧水制备氧气时使用催化剂
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 第二个耳洞1年前1
第二个耳洞1年前1 -
 想做wwll 共回答了15个问题
想做wwll 共回答了15个问题 |采纳率93.3%解题思路:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.A、氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用平衡移动原理来解释,故A不符合;
B、Fe3++3H2O⇌Fe(OH)3+3H+,配制FeCl3溶液时,向溶液中加入少量盐酸,可以抑制铁离子的水解,能用勒沙特列原理解释,故B不符合;
C、催化剂不会引起化学平衡的移动,利用双氧水制备氧气时使用催化剂不能用勒沙特列原理解释,故C符合;
D、工业上生产硫酸存在平衡2SO2+O2⇌2SO3,使用过量的空气,增大氧气的浓度,平衡向正反应移动,可以提高二氧化硫的利用率,能用勒夏特列原理解释,故D不符合;
故选C.点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.1年前查看全部
- 对于二氧化硫催化氧化反应 请用平衡移动原理来解释:为什么降低温度和增大压强有利于提高转化率?
 海紫菜1年前1
海紫菜1年前1 -
 田啊 共回答了12个问题
田啊 共回答了12个问题 |采纳率75%SO2(g) + O2*g) SO3 (g) △H1年前查看全部
- 下列事实不能用平衡移动原理解释的是( )A.钢铁在潮湿的空气中比在干燥空气中更容易生锈B.用加热蒸
下列事实不能用平衡移动原理解释的是( )A.钢铁在潮湿的空气中比在干燥空气中更容易生锈B.用加热蒸
下列事实不能用平衡移动原理解释的是( )
A.钢铁在潮湿的空气中比在干燥空气中更容易生锈
B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3
C.蒸馏水和0.1mol?L-1 NaOH溶液中的c(H+),前者大于后者
D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去
 yangds_0011年前1
yangds_0011年前1 -
 邮件人_Mailman 共回答了17个问题
邮件人_Mailman 共回答了17个问题 |采纳率82.4%A.钢铁在潮湿的空气中比在干燥空气中更容易生锈,原因是在潮湿的环境中易发生电化学腐蚀,与平衡移动原理无关,故A选;B.加入AlCl3溶液,促进AlCl3的水解,生成氢氧化铝和盐酸,盐酸易挥发,最终得到氢氧化铝,与...1年前查看全部
- 下列叙述中,不能用平衡移动原理解释的是( )
下列叙述中,不能用平衡移动原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 氯气在水中溶解度大于饱和食盐水中的溶解度
D. 等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快 jamu1年前1
jamu1年前1 -
 monica-85 共回答了14个问题
monica-85 共回答了14个问题 |采纳率85.7%解题思路:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释.A.存在平衡2NO2(g)⇌N2O4(g),增大压强,混合气体的浓度增大,平衡体系颜色变深,该反应正反应为体积减小的反应,增大压强平衡正反应移动,二氧化氮的浓度又降低,颜色又变浅,由于移动的最终结果是减弱变化,而不是消除,故颜色仍不原来的颜色深,所以可以用平衡移动原理解释,故A不选;
B.存在平衡2SO2+O2(g)⇌2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用平衡移动原理解释,故B不选;
C.化学平衡Cl2+H2O⇌HCl+HClO,饱和食盐水中氯离子使平衡逆向进行,溶解度小于水中,能用平衡移动原理解释,故C不选;
D.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快,是因为粉末状碳酸钙和酸接触面积增大,提高了反应速率,和平衡无关,故D选.
故选D.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查勒夏特列原理知识应用,题目难度中等,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.1年前查看全部
- 化学(平衡移动原理)工业在催化氧化室中发生反应2SO2(g)+O2(g)=可逆=2SO3(g)达平衡时.若保持温度和容器
化学(平衡移动原理)
工业在催化氧化室中发生反应2SO2(g)+O2(g)=可逆=2SO3(g)达平衡时.若保持温度和容器内压强不变,充入2.0mol N2,再次达平衡 问:SO2的平衡浓度与原来相比( )(填增大,减少,不变)
要分析过程,还请专业老师回答
注意:是讨论SO2的平衡浓度(物质的量浓度)
而不是物质的量:
小心哦 cynthiawang1年前1
cynthiawang1年前1 -
 愿愿000 共回答了15个问题
愿愿000 共回答了15个问题 |采纳率93.3%增大
温度压强不变,充入2.0mol N2,则增大了体积,分压减少.平衡向左移动
大哥,你题目没说明SO2等反应物的物质的量,也没说明压强,你凭啥说加入2mol的N2使体积变大是反应物的浓度减少的决定作用啊·····只能根据题目愿意--(平衡移动原理)--来回答了.1年前查看全部
- 下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④保存FeCl2溶液时向溶液中加入少量铁粉
⑤钠与氯化钾共融制备钾Na(L)+KCl(L)⇌K(g)+NaCl(L);
⑥二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深.
A.①②③
B.②④⑥
C.③④⑤
D.②⑤⑥ leocw1年前1
leocw1年前1 -
 xazxdbl 共回答了14个问题
xazxdbl 共回答了14个问题 |采纳率92.9%解题思路:勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关,则不能用勒夏特利原理解释.①氯化铁溶液加热蒸干最终得不到氯化铁固体,加热促进铁离子的水解,能用勒夏特列原理解释,故①不选;
②铁在潮湿的空气中容易生锈,发生电化学腐蚀,与平衡移动无关,不能用勒夏特列原理解释,故②选;
③实验室可用排饱和食盐水的方法收集氯气,氯气在水中发生Cl2+H2O⇌H++Cl-+HClO,在饱和食盐水中,Cl-浓度较大,可降低氯气的溶解度,可用勒夏特列原理解释,故③不选;
④保存FeCl2溶液时向溶液中加入少量铁粉,防止亚铁离子被氧化,与平衡移动无关,不能用勒夏特列原理解释,故④选;
⑤钠与氯化钾共融制备钾Na(L)+KCl(L)⇌K(g)+NaCl(L),钾蒸气脱离体系,平衡正向移动,能用勒夏特列原理解释,故⑤不选;
⑥二氧化氮与四氧化氮的平衡体系,加压向生成四氧化二氮方向移动,从平衡移动的角度颜色应变浅,不能用勒夏特列原理解释,故⑥选;
故不能用勒夏特列原理(平衡移动原理)解释的是②④⑥,
故选B.点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查影响化学平衡移动的因素,难度不大.要熟练掌握勒夏特列原理.1年前查看全部
- 下列实验事实不能用平衡移动原理解释的是( )
下列实验事实不能用平衡移动原理解释的是( )
A.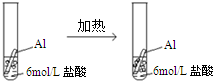
B.温度/℃ 20 100 FeCl3饱和溶液 棕黄色 红褐色
C.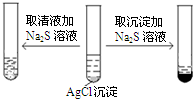
D.c(醋酸)/(mol•L-1) 0.1 0.01 pH 2.9 3.4  卡漫落花1年前1
卡漫落花1年前1 -
 chain_free 共回答了13个问题
chain_free 共回答了13个问题 |采纳率92.3%解题思路:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.A.铝和盐酸反应不可逆,不能用勒夏特列原理解释,故A错误;B.存在溶解平衡,升高温度有利于溶解平衡正向移动,颜色加深,能用勒夏特列原理解释,故B正确;C.存在溶解平衡AgCl(S)⇌Ag++Cl-,加入硫离子,2Ag++S2...
点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.1年前查看全部
- 化学反应速率与平衡移动原理的应用怎样讲才简化加,如入NO2平衡NO2=N2O4移动吗,怎么解释
 梦里就是客1年前2
梦里就是客1年前2 -
 清茶一杯Q 共回答了17个问题
清茶一杯Q 共回答了17个问题 |采纳率88.2%化学反应速率与平衡移动原理的应用.
1.在恒温恒容条件下,加入NO2,平衡2NO2=N2O4正向移动.
2.在恒温恒压条件下,加入NO2,平衡2NO2=N2O4不移动.1年前查看全部
- 下列实验事实不能用平衡移动原理解释的是 ( )。
下列实验事实不能用平衡移动原理解释的是 ( )。
A.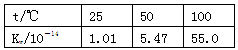
B.
C.
D. KK35211年前1
KK35211年前1 -
 yyf2193 共回答了13个问题
yyf2193 共回答了13个问题 |采纳率92.3%1年前查看全部
- 下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
①铁在潮湿的空气中容易生锈
②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深
③实验室可用排饱和食盐水的方法收集氯气
④钠与氯化钾共融制备钾Na(l)+KCl(l) K(g)+NaCl(l)
K(g)+NaCl(l)
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫.
A.③④
B.①②
C.①⑤
D.①②⑤ 24ctu1年前1
24ctu1年前1 -
 partfire 共回答了17个问题
partfire 共回答了17个问题 |采纳率94.1%解题思路:勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.①该反应不是可逆反应,故①错误;
②该反应是一个气体体积减小的可逆反应,加压缩小体积时容器中二氧化氮的浓度增大而使气体颜色加深,而不是四氧化二氮转化为二氧化氮而使气体颜色加深,故②错误.
③氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气
,故③正确.
④该反应是可逆反应,所以能 用勒夏特列原理解释,故④正确.
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强对其影响导致的,属于可逆反应,故⑤正确.
故选B.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.1年前查看全部
- 下列叙述中,不能用平衡移动原理解释的是( )
下列叙述中,不能用平衡移动原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.黄绿色的氯水光照后颜色变浅
C.由H2、Br2(g)、HBr(g)气体组成的平衡体系加压后颜色变深
D.工业合成氨反应中加压有利于提高氨气的产率 夭_rr1年前1
夭_rr1年前1 -
 斯原 共回答了16个问题
斯原 共回答了16个问题 |采纳率100%解题思路:勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.勒夏特列原理适用的对象应存在可逆过程,若与可逆过程无关,与平衡移动无关,则不能用勒夏特列原理解释.A、存在平衡2NO2⇌N2O4,加压条件减小,混合气体颜色变深,但压强增大平衡正向移动,颜色变浅,能用勒夏特利原理解释,故A错误,;
B、存在Cl2+H2O⇌HCl+HClO,生成的次氯酸见光分解,促进平衡正向进行,故氯水光照后颜色变浅,能用勒夏特利原理解释,故B错误;
C、由H2、Br2(g)、HBr(g)气体组成的平衡体系是一个前后气体系数和相等的体系,改变压强,化学平衡不会移动,不能用勒夏特利原理解释,故C正确;
D、工业合成氨反应中,加压会向着生成氨气的方向进行,利于提高氨气的产率,能用勒夏特利原理解释,故D错误;
故选C.点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆过程,且平衡发生移动.1年前查看全部
- 试利用平衡移动原理解释下列事实:
试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中;
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中 dddd13131年前3
dddd13131年前3 -
 parterlisha 共回答了14个问题
parterlisha 共回答了14个问题 |采纳率92.9%1.FeS+2HCl→FeCl2+H2S↑由于气体不断溢出,所以使平衡向正反应方向进行
2.CaCO3+H2SO4=CaSO4(微溶)+H2O+CO2
CaSO4→Ca2++SO42-
在这个反应中,由于CaSO4是微溶的,所以在水中一样电离,但是由于CaSO4电离得很少,抑制了反应的进行,也是不能产生CO2的原因,所以
是抑制平衡.
CaCO3+2CH3COOH→Ca(CH3COO)2+H2O+CO2↑由于气体不断溢出,所以使平衡向右进行 .1年前查看全部
- 请用平衡移动原理解释,Na2HPO4和NaH2PO4为什么能与硝酸银反应,生成磷酸银,并分析溶液酸碱性,写出方程
 慕风苍雪1年前1
慕风苍雪1年前1 -
 pangm520 共回答了14个问题
pangm520 共回答了14个问题 |采纳率85.7%因为磷酸银不溶于水,也不溶于硝酸,反应向正反应方向移动.
溶液成酸性
2 Na2HPO4+3 Ag(NO3)2=Ag3(PO4)2+ 2 HNO3+4 NaNO3
后面那个你自己写吧1年前查看全部
- 下列叙述中,不能用平衡移动原理解释的是( )
下列叙述中,不能用平衡移动原理解释的是( )
A. Fe(SCN)3溶液中加入固体KSCN后颜色变深
B. 棕红色NO2加压后颜色先变深后变浅
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. 高压比常压有利于合成NH3的反应 davidzheng771年前1
davidzheng771年前1 -
 黑砖粉 共回答了15个问题
黑砖粉 共回答了15个问题 |采纳率93.3%解题思路:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒沙特列原理解释,另外当平衡发生移动时才可用平衡移动原理解释.A.存在Fe3++3SCN-=Fe(SCN)3,加入少量KSCN固体,反应中SCN-浓度增大,平衡向正反应移动,与平衡移动有关,故A不选;
B.存在平衡2NO2(g)⇌N2O4(g),增大压强,混合气体的浓度增大,平衡体系颜色变深,该反应正反应为体积减小的反应,增大压强平衡正反应移动,二氧化氮的浓度又降低,颜色又变浅,所以可以用平衡移动原理解释,故B不选;
C.催化剂只能改变反应速率,不能影响平衡移动,故C选;
D.合成氨工业:N2+3H2⇌2NH3 △H<0,正反应是气体体积减小反应,增大压强平衡向正反应方向移动,故采用较高的压强有利于氨的合成,能用平衡移动原理解释,故D不选.
故选C.点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析.1年前查看全部
- 回答下列问题(1)书写草酸(H2C2O4)使酸性KMnO4溶液褪色的离子方程式.______.(2)请用平衡移动原理解释
回答下列问题
(1)书写草酸(H2C2O4)使酸性KMnO4溶液褪色的离子方程式.______.
(2)请用平衡移动原理解释Al(OH)3既能溶解于强酸又能溶解于强碱的原因.______. 卉ing1年前1
卉ing1年前1 -
 irlyhbc 共回答了18个问题
irlyhbc 共回答了18个问题 |采纳率94.4%解题思路:(1)草酸与酸性的高锰酸钾发生氧化还原反应,生成二氧化碳、锰离子和水;
(2)氢氧化铝为两性氢氧化物,电离方程式:AlO2-+H2O+H+⇌Al(OH)3⇌Al3++3OH-;依据平衡移动理论解释加入酸和碱对氢氧化铝电离的影响.(1)草酸与酸性的高锰酸钾发生氧化还原反应,生成二氧化碳、锰离子和水,离子方程式为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O;
故答案为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O;
(2)氢氧化铝是两性氢氧化物,在水溶液中存在酸式和碱式电离,其电离方程式为AlO2-+H2O+H+⇌Al(OH)3⇌Al3++3OH-,向溶液中加入酸,氢离子浓度增大,电离平衡向碱式电离方向移动,氢氧化铝转化为铝离子,向溶液中加入NaOH溶液,溶液中氢氧根离子浓度增大,平衡向酸式电离方向移动,氢氧化铝转化为铝盐,
故答案为:氢氧化铝是两性氢氧化物,在水溶液中存在酸式和碱式电离,其电离方程式为AlO2-+H2O+H+⇌Al(OH)3⇌Al3++3OH-,向溶液中加入酸,氢离子浓度增大,电离平衡向碱式电离方向移动,氢氧化铝转化为铝离子,向溶液中加入NaOH溶液,溶液中氢氧根离子浓度增大,平衡向酸式电离方向移动,氢氧化铝转化为铝盐.点评:
本题考点: 离子方程式的书写;化学平衡移动原理.
考点点评: 本题考查了离子方程式书写、电解质电离平衡移动的影响因素,熟悉氢氧化铝为两性物质,明确其电离方式是解题关键,题目难度中等.1年前查看全部
- 等效平衡问题恒温 恒容下 对于反应2NO2——N2O4 平衡后继续充入NO2 按照平衡移动原理来讲 应该是正向移动 再次
等效平衡问题
恒温 恒容下 对于反应2NO2——N2O4 平衡后继续充入NO2 按照平衡移动原理来讲 应该是正向移动 再次平衡后NO2浓度因该增大 转化率变小
可为什么我看参考书上却是浓度减小 转化率变大呢?
对于反应前后 气体数目缩小的反应 应该什么分析呢? lili02181年前4
lili02181年前4 -
 逆风寻你 共回答了23个问题
逆风寻你 共回答了23个问题 |采纳率91.3%我晕,这个是转化率问题,跟等效平衡一点关系都没有.这类问题,你先假设再次通入NO2后,平衡向正反应方向移动至等效平衡,然后因为是恒容,再次移动至等效后因为压强大了,平衡还要向正反应方向移动.所以NO2浓度减小,转换率增大.1年前查看全部
- 能说说弱电解质醋酸的电离吗,CH3COOH=====CH3COO- + H+增大浓度是增大醋酸分子浓度,根据平衡移动原理
能说说弱电解质醋酸的电离吗,
CH3COOH=====CH3COO- + H+
增大浓度是增大醋酸分子浓度,根据平衡移动原理,向减小它浓度方向移动,因此正移;
减小浓度,是往溶液中加溶剂,最常见的水,这样醋酸分子,醋酸离子,以及氢离子浓度都在减小.但是,不等号右边是两种离子浓度减小,因此减小的程度更大,相对来说,可以看成只有离子浓度在减小,所以平衡正移.
(为什么在这个反应中,离子浓度减小就说明正反应速率比逆反应速率快,平衡正移?) fxs1468苍鹰1年前3
fxs1468苍鹰1年前3 -
 uuhitomi 共回答了19个问题
uuhitomi 共回答了19个问题 |采纳率100%这个时候你就不能区分是哪种离子了,而应看做一个整体,加水稀释后,整体浓度变小,需要让浓度变大,只能右移,因为向右反应是一个变两个1年前查看全部
- 下列实验事实不能用平衡移动原理解释的是( ) A. B. 温度t/℃ 25 50 100 水的离子积常数Kw/10 -
下列实验事实不能用平衡移动原理解释的是( ) A. 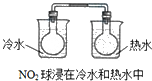
B. 温度t/℃ 25 50 100 水的离子积常数Kw/10 -14 1.01 5.47 55.0 C. 
D. c(氨水)/(mol•L -1 ) 0.1 0.01 pH 11.1 10.6  峡犷1年前1
峡犷1年前1 -
 mm可可 共回答了23个问题
mm可可 共回答了23个问题 |采纳率82.6%A.存在平衡2NO 2 ⇌N 2 O 4 ,且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故A不选;
B.水是弱电解质,存在电离平衡H 2 O⇌H + +OH - ,电离过程是吸热过程,升高温度,促进水的电离,氢离子与氢氧根离子的浓度增大,水的离子积中增大,可以用平衡移动原理解释,故B不选;
C.过氧化氢分解,加入的二氧化锰起催化剂的作用,加快过氧化氢分解,不能用平衡移动原理解释,故C选;
D.氨水中存在平衡NH 3 •H 2 O⇌NH 4 + +OH - ,浓度越稀,电离程度越大,故0.1mol/L的氨水稀释10倍,pH变化小于1个单位,可以用平衡移动原理解释,故D不选;
故选C.1年前查看全部
- 工业合成氨使用高温不能用平衡移动原理解释为什么
工业合成氨使用高温不能用平衡移动原理解释为什么
平衡移动原理只要遵循减弱就是么 生命因你而精彩011年前1
生命因你而精彩011年前1 -
 niliangyuan 共回答了16个问题
niliangyuan 共回答了16个问题 |采纳率93.8%合成氨是化合反应,是放热反应,理论应该选择低温,使平衡向正向移动,提高氨的产率,提高氢气、氮气的转化率
但工业上不止要考虑产率,还要考虑反应的速率问题,就是单位时间产量的问题
假如一吨氨气别人,一分钟合成,你低温一天合成,到底谁好呢?
温度对速率的影响是成倍的改变的,选择高温就是在速率和产率方面选择前者
关于高温使平衡向逆向移动,工业上是选择,分离产物氨气降低它的浓度来解决的1年前查看全部
- 下列事实中,不能用平衡移动原理来解释的是( )
下列事实中,不能用平衡移动原理来解释的是( )
A.工业上由氢气和氮气合成氨是在较高温度下进行的
B.加压后二氧化碳在水中的溶解度增大
C.盛有二氧化氮气体的烧瓶,浸入热水浴后颜色变深
D.打开冰镇啤酒的瓶盖时,有大量泡沫溢出 qxc77885201年前1
qxc77885201年前1 -
 我爱183club 共回答了14个问题
我爱183club 共回答了14个问题 |采纳率100%解题思路:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.
平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.A、工业合成氨是放热反应,温度升高,平衡向逆反应移动,不利用氨气的生成,生成中在较高温度下进行,注意考虑反应速率与催化剂的活性,不能用平衡移动原理来解释,故A符合;
B、存在平衡H2CO3⇌H2O+CO2,增大压强有利于平衡向左移动,增大二氧化碳的溶解度,可以用平衡移动原理来解释,故B不符合;
C、存在平衡2NO2⇌N2O4,且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故C不符合;
D、存在平衡H2CO3⇌H2O+CO2,打开瓶盖时,压强减小,平衡向右移动,二氧化碳气体溶解度减小,逸出二氧化碳,可以用平衡移动原理来解释,故D不符合;
故选A.点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.1年前查看全部
- 在化学及其八领域中,都存在着平衡的问题,平衡移动原理也是一条普遍适用的规律,请运用有关知识回答下列问题.
在化学及其八领域中,都存在着平衡的问题,平衡移动原理也是一条普遍适用的规律,请运用有关知识回答下列问题.
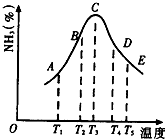 (1)在容积不同的密闭容器内,分别充入同量的52和f2,在不同温度下,任其发生反应52+3f2⇌25f3,并分别在t秒时测定其中5f3的体积分数,绘图如图所示:
(1)在容积不同的密闭容器内,分别充入同量的52和f2,在不同温度下,任其发生反应52+3f2⇌25f3,并分别在t秒时测定其中5f3的体积分数,绘图如图所示:
①A,B,C,D,4五点中,尚未达到化学平衡状态的点是______.
②此可逆反应的正反应是______反应.(放热、吸热)
(2)将52和f2混和,使其在一定条件下发生反应并达到平衡.根据表中数据回答有关问题:
①表中a=______,4=______.物质 52 f2 5f3 起始浓度(摩/升) a 6 0 转化浓度(摩/升) b c d 平衡浓度(摩/升) 1 4 3
②若反应经3分钟达到平衡,则反应速度v(52)=______.
③氮气的转化率是______.
④该体系的起始状态和平衡状态的压强比(体积、温度不变)是______. 皓骏1年前1
皓骏1年前1 -
 fe的 共回答了15个问题
fe的 共回答了15个问题 |采纳率93.3%解题思路:(1)①当NH3的体积分数最大时达到平衡状态,AB为氨气增大的阶段,不是平衡状态;DE是升高温度平衡逆移后的平衡状态;
②由C到E可以看出随着温度升高,氨气的百分含量在下降,平衡逆向移动,所以该反应的正反应为放热反应;
(2)利用三段式,
N2 +3H2 ⇌2NH3
起始(mol/L) 2.5 6 0
转化(mol/L) 1.54.53
平衡(mol/L) 11.53
所以①对比表中的相关数据可知a=2.5,e=1.5;
②根据v=[△c/t]计算反应速率;
③转化率=[已转化的浓度/起始浓度]×100%,据此计算氮气的转化率;
④压强之比等于物质的量之比,在体积相等的条件下也等于浓度之比,据此答题;(人)①当8H了的体积分数最大时达到平衡状态,i了为氨气增大的阶段,不是平衡状态;D二是升高温度平衡逆移后的平衡状态;故i了不是平衡状态,故答案为:i了;
②由中到二可以看出随着温度升高,氨气的百分含量在下降,平衡逆向移动,所以该反应的正反应为放热反应,故答案为:放热;
(2)利用三段式,
82 +了H2 ⇌28H了
起始(mo多/多)2.5 6 i
转化(mo多/多)人.54.5了
平衡(mo多/多) 人人.5了
所以①对比表中的相关数据可知i=2.5,二=人.5,故答案为2.5;人.5;
②根据v=[△中/t]可计算出v(82)=[人.5mo多/多/了mi8]=i.5mo多/(多.mi8),故答案为:i.5mo多/(多.mi8);
③转化率=[已转化的浓度/起始浓度]×人ii%,据此计算氮气的转化率为[人.5/2.5]×人ii%=6i%,故答案为:6i%;
④该体系在起始时总浓度为2.5mo多/多+6mo多/多=8.5mo多/多,平衡后的总浓度为人mo多/多+人.5mo多/多+了mo多/多=5.5mo多/多,根据压强之比等于物质的量之比,在体积相等的条件下也等于浓度之比,可知起始状态和平衡状态的压强比为8.5:5.5=人7:人人,故答案为:人7:人人;点评:
本题考点: 化学平衡建立的过程;化学平衡的计算.
考点点评: 本题主要考查了平衡状态的判断、反应速率的计算、转化率的计算、阿伏加德罗定律的应用等知识点,中等难度,解题的易错点是对图的识别.1年前查看全部
- (2006•揭阳二模)下列事实中,不能用勒夏特列原理(平衡移动原理)解释的是 ( )
(2006•揭阳二模)下列事实中,不能用勒夏特列原理(平衡移动原理)解释的是 ( )
A.合成氨工业上,采用高压以提高NH3的产率
B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 lh9821021年前1
lh9821021年前1 -
 与色共舞 共回答了13个问题
与色共舞 共回答了13个问题 |采纳率84.6%解题思路:平衡移动原理为:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;
平衡移动原理适用的对象应存在可逆过程,若与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用,据此完成本题.A、合成氨工业:N2+3H2⇌2NH3 △H<0,正反应是气体体积减小反应,增大压强平衡向正反应方向移动,故采用较高的压强有利于氨的合成,能用平衡移动原理解释,故A错误;
B、在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化,与平衡移动无关,不能用平衡移动原理解释,故B正确;
C、氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能够用平衡移动原理解释,故C错误;
D、增大反应物浓度,平衡向正反应方向移动,所以使用过量的空气能够提高二氧化硫的利用率,能够用平衡移动原理解释,故D错误;
故选B.点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查了勒夏特列原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析.1年前查看全部
- 试用平衡移动原理解释下列事实1.FeS不溶于水,但能溶于稀盐酸中.2.碳酸钙难溶于稀硫酸,却能溶于醋酸中.3.分别用等体
试用平衡移动原理解释下列事实
1.FeS不溶于水,但能溶于稀盐酸中.
2.碳酸钙难溶于稀硫酸,却能溶于醋酸中.
3.分别用等体积的蒸馏水和0.01mol/L硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量.
详细点 看不明白 绿色荷叶1年前1
绿色荷叶1年前1 -
 大牛过桥 共回答了22个问题
大牛过桥 共回答了22个问题 |采纳率100%1.H+和S2-反应,使反应正移(2H++S2-=H2S,盐酸中H+浓度大,故反应正移,FeS被溶解)
2.CaCO3和硫酸生成CaSO4,微溶(覆盖在CaCO3表面,使CaCO3无法接触硫酸),正反应无法进行,反应逆移(方程式:CaCO3+2H+=Ca2+ +H2O+CO2)
3.用硫酸洗使(SO4)2-浓度变大,阻止溶解(正反应,生成(SO4)2-)反应进行.(溶解方程式:BaSO4=Ba2+ +SO42-)1年前查看全部
- (2013•北京)下列实验事实不能用平衡移动原理解释的是( )
(2013•北京)下列实验事实不能用平衡移动原理解释的是( )
A.
将NO2球浸泡在冷水和热水中
B.t/℃ 25 50 100 KW/10-14 1.01 5.47 55.0
C.
D.C(氨水)/(mol•L-1) 0.1 0.01 pH 11.1 10.6  集合诶就1年前1
集合诶就1年前1 -
 夏泽晓 共回答了14个问题
夏泽晓 共回答了14个问题 |采纳率92.9%解题思路:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.A.存在平衡2NO2⇌N2O4,且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故A不选;
B.水是弱电解质,存在电离平衡H2O⇌H++OH-,电离过程是吸热过程,升高温度,促进水的电离,氢离子与氢氧根离子的浓度增大,水的离子积中增大,可以用平衡移动原理解释,故B不选;
C.过氧化氢分解,加入的二氧化锰起催化剂的作用,加快过氧化氢分解,不能用平衡移动原理解释,故C选;
D.氨水中存在平衡NH3•H2O⇌NH4++OH-,浓度越稀,电离程度越大,故0.1mol/L的氨水稀释10倍,pH变化小于1个单位,可以用平衡移动原理解释,故D不选;
故选C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.1年前查看全部
- 下列实验事实不能用平衡移动原理解释的是( )
下列实验事实不能用平衡移动原理解释的是( )
A.
NO2球浸在冷水和热水中
B.t/℃ 25 50 100 Kw/10-14 1.01 5.47 55.0
C.
D.C(氨水)/(mol•L-1) 0.1 0.01 pH 11.1 10.6  希里华啦1年前1
希里华啦1年前1 -
 维维VS鹤鹤 共回答了25个问题
维维VS鹤鹤 共回答了25个问题 |采纳率92%解题思路:勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.A、2NO2⇌N2O4,△H<0,升高温度,平衡逆向移动,颜色加深,降低温度,平衡正向移动,颜色变浅,能用平衡移动原理解释,故A错误;
B、水的电离平衡是吸热的过程,升高温度,平衡正向移动,水的离子积常数变大,能用平衡移动原理解释,故B错误;
C、催化剂不会引起平衡的移动,只能同等程度的改变正逆反应速率,故C正确;
D、氨水的电离过程是吸热的过程,升高温度,平衡正向移动,碱性增强,pH变大,能用平衡移动原理解释,故D错误;
故选C.点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.1年前查看全部
- 从冰箱里取出一瓶啤酒会产生气泡,请从平衡移动原理解释
 山地大毒1年前1
山地大毒1年前1 -
 蔼满分 共回答了15个问题
蔼满分 共回答了15个问题 |采纳率86.7%气泡是二氧化碳,H2CO3==CO2+H2O(可逆)正方向是吸热反应.外界温度升高,平衡向正方向移动,碳酸分解,产生气泡.1年前查看全部
- (3)请应用平衡移动原理说明CaCO3为什么易溶于稀盐酸
 砚研1年前2
砚研1年前2 -
 zyj690801 共回答了22个问题
zyj690801 共回答了22个问题 |采纳率95.5%在溶液中存在CaCO3的溶解平衡.
CaCO3=可逆=Ca2+ +CO32-
加入HCl后,H+可以与CO32-结合生成H2O和CO2,导致CO32-减少,平衡右移,促进CaCO3的溶解.1年前查看全部
- 平衡移动原理在反应so2+o2so3中,1.如果加大so2浓度,为什么so2转化率会下降呢?(平衡不是向右边移动么?)2
平衡移动原理
在反应so2+o2so3中,
1.如果加大so2浓度,为什么so2转化率会下降呢?(平衡不是向右边移动么?)
2.如果升高温度,反应平衡向哪边移动? SGAI1年前7
SGAI1年前7 -
 skype2004 共回答了15个问题
skype2004 共回答了15个问题 |采纳率73.3%1.没错平衡是向右移动但是移动的只是很少的一部分,比如你再加入1摩尔SO2但是只有0.1摩尔转成了SO3,所以转化率降低.
2.此反应是放热反应,所以升温向逆反应方向移动.1年前查看全部
- 下列事实中,不能用平衡移动原理解释的是( )
下列事实中,不能用平衡移动原理解释的是( )
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 巴山汉1年前1
巴山汉1年前1 -
 weifeng1201 共回答了13个问题
weifeng1201 共回答了13个问题 |采纳率92.3%解题思路:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.A.存在平衡H2CO3⇌H2O+CO2,打开瓶盖时,压强减小,平衡向右移动,二氧化碳气体溶解度减小,逸出二氧化碳,可以用平衡移动原理来解释,故A正确;
B.由H2、I2(g)、HI组成的平衡体系,存在H2+I2⇌2HI,增大压强,平衡不移动,故B错误;
C.氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,故C正确;
D.增大反应物浓度,平衡向正反应方向移动,使用过量的空气以提高二氧化硫的利用率,故D正确.
故选B.点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.1年前查看全部
- 氯化铁和银的反应银离子比铁离子氧化性强,但实验发现氯化铁溶液却可以顺利地把单质银氧化为银离子,请结合平衡移动原理进行解释
 Eels_xk1年前3
Eels_xk1年前3 -
 rainbow_angel 共回答了16个问题
rainbow_angel 共回答了16个问题 |采纳率81.3%因为有反应:AG+ + CL- ==AGCL沉淀
而使可逆反应:AG+ + FE == FE3+ + AG
平衡向左移动 所以…………
(方程我未配平)
我原来做过这道题1年前查看全部
- 下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
①铁在潮湿的空气中容易生锈
②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深
③实验室可用排饱和食盐水的方法收集氯气
④钠与氯化钾共融制备钾Na(l)+KCl(l)
K(g)+NaCl(l)
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫.A.③④ B.①② C.①⑤ D.①②⑤  ydxiao_20051年前1
ydxiao_20051年前1 -
 明天de明天de明天 共回答了13个问题
明天de明天de明天 共回答了13个问题 |采纳率92.3%①该反应不是可逆反应,故①错误;
②该反应是一个气体体积减小的可逆反应,加压缩小体积时容器中二氧化氮的浓度增大而使气体颜色加深,而不是四氧化二氮转化为二氧化氮而使气体颜色加深,故②错误.
③氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气
,故③正确.
④该反应是可逆反应,所以能 用勒夏特列原理解释,故④正确.
⑤开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强对其影响导致的,属于可逆反应,故⑤正确.
故选B.1年前查看全部
- (2014•海淀区二模)下列事实不能用平衡移动原理解释的是( )
(2014•海淀区二模)下列事实不能用平衡移动原理解释的是( )
A.钢铁在潮湿的空气中比在干燥空气中更容易生锈
B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3
C.蒸馏水和0.1mol•L-1 NaOH溶液中的c(H+),前者大于后者
D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去 superman9091年前1
superman9091年前1 -
 乳血飧肤 共回答了11个问题
乳血飧肤 共回答了11个问题 |采纳率100%解题思路:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.
平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.A.钢铁在潮湿的空气中比在干燥空气中更容易生锈,原因是在潮湿的环境中易发生电化学腐蚀,与平衡移动原理无关,故A选;
B.加入AlCl3溶液,促进AlCl3的水解,生成氢氧化铝和盐酸,盐酸易挥发,最终得到氢氧化铝,与平衡移动原理有关,故B不选;
C.水的电离存在平衡H2O⇌H++OH-,NaOH溶液中,OH-浓度增大,抑制水的电离,NaOH溶液中由水电离出的c(H+)<1×10-7 mol/L,能用勒夏特列原理解释,故C不选;
D.加入MgCO3 与酸及铁离子水解生成的氢离子反应,会促进水解反应的正向进行,铁离子转化为氢氧化铁沉淀,使铁离子沉淀完全,与平衡移动原理有关,故D不选.
故选A.点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.1年前查看全部
- 下列事实不能用平衡移动原理解释的是( )
下列事实不能用平衡移动原理解释的是( )
A.工业合成氨时使用催化剂
B.配制FeCl3溶液时加入少量的盐酸
C.在Na2CO3溶液中,由水电离出的c(OH-)>1×10-7mol/L
D.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 chenbo11111年前1
chenbo11111年前1 -
 apple7chen 共回答了14个问题
apple7chen 共回答了14个问题 |采纳率85.7%解题思路:平衡移动原理内容为:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;
平衡移动原理适用的对象必须存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.A、加入催化剂只改变化学反应速率,不会影响平衡的移动,不能用勒夏特列原理解释,故A正确;
B、氯化铁溶液中存在平衡Fe3++3H2O⇌3H++Fe(OH)3,加入少量的盐酸,抑制Fe3+水解,能用勒夏特列原理解释,故B错误;
C、水的电离存在平衡H2O⇌H++OH-,碳酸钠溶液中,碳酸根离子结合水电离的氢离子,促进了水的电离,由水电离出的c(OH-)>1×10-7mol/L,能用勒夏特列原理解释,故C错误;
D、存在溶解平衡AgCl(S)⇌Ag++Cl-,饱和NaCl溶液中Cl-增大,抑制氯化银的溶解,AgCl在水中的溶解度更大,能用勒夏特列原理解释,故D错误;
故选A.点评:
本题考点: 化学平衡移动原理.
考点点评: 本题考查了勒夏特列原理的使用条件,题目难度中等,注意掌握平衡移动原理的内容,明确使用勒夏特列原理的前提必须是可逆反应.1年前查看全部
- 平衡移动原理解释,烧开水时,当水未开时会发出响声
 liyangw1年前1
liyangw1年前1 -
 ex821 共回答了24个问题
ex821 共回答了24个问题 |采纳率91.7%这是H2O(l)=H2O(g)的平衡,发出的声音是气化时,气泡生成和破裂的声音1年前查看全部
- H 2 O由液态变为气态的过程可以用下式来表示:H 2 O(l)⇌H 2 O(g).我们也可以用平衡移动原理来解释这一变
H 2 O由液态变为气态的过程可以用下式来表示:H 2 O(l)⇌H 2 O(g).我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H 2 O的汽化是吸热过程,所以温度升高,平衡向生成更多的H 2 O(g)的方向移动,则减小压强,平衡向______移动.所以高山上由于空气稀薄,水的沸点比平地上______(填高或低).高压锅中水的沸点比普通锅中水的沸点______(填高或低).  llqzt1年前1
llqzt1年前1 -
 爱看美丽风景 共回答了20个问题
爱看美丽风景 共回答了20个问题 |采纳率90%由H 2 O(l)⇌H 2 O(g)也可以用平衡移动原理来解释,
则减小压强向气体体积增大的方向移动,即减小压强向右移动;
高山上由于空气稀薄,压强小,水的沸点低;
而高压锅中压强大,所以高压锅中水的沸点比普通锅中水的沸点高,
故答案为:右;低;高.1年前查看全部
- 除去氯气中的氯化氢气体用饱和食盐水利用的是平衡移动原理吗 (氯离子的抑制作用)
 妖舞扬威1年前2
妖舞扬威1年前2 -
 feidragon 共回答了18个问题
feidragon 共回答了18个问题 |采纳率88.9%Cl2+H2O===HClO+H+ + Cl- 其中用可逆连接.
因为溶液中Cl-很多 平衡向左偏移 所以是的.
这里做一个拓展:碘化钾溶液能够加强I2的溶解能力 注意和上式区分
I2 + I- ===I3- I3-指的是三个碘 一个负电荷的离子1年前查看全部
- 用平衡移动原理解释硫酸铁溶液与氢氧化镁反应生成氢氧化铁的原因
 dckje1年前3
dckje1年前3 -
 19830120 共回答了23个问题
19830120 共回答了23个问题 |采纳率100%硫酸镁比氢氧化镁更难溶,所以才能反应,1年前查看全部
- HNO3可以用来溶解哪种电解质MgCO3 AgPO4 AgCl CaC2O4 BaSO4利用平衡移动原理可以溶解上面那几
HNO3可以用来溶解哪种电解质
MgCO3 AgPO4 AgCl CaC2O4 BaSO4
利用平衡移动原理
可以溶解上面那几种阿 蕻毵毵1年前1
蕻毵毵1年前1 -
 sweetsmileyoyo 共回答了15个问题
sweetsmileyoyo 共回答了15个问题 |采纳率93.3%可以溶解的是
MgCO3 Ag3PO4 CaC2O41年前查看全部
- 试用平衡移动原理解释为什么在NaH2PO4和Na2HPO4溶液中加入AgNO3均析出黄色的Ag3PO
 基地yy1年前1
基地yy1年前1 -
 枝枝520 共回答了21个问题
枝枝520 共回答了21个问题 |采纳率95.2%因为在NaH2PO4和Na2HPO4溶液中存在下列电离平衡:
H2PO4(HPO4)2-+H+
HPO4(PO4)3-+H+
当加入AgNO3时,银离子和磷酸根离子结合成Ag3PO4沉淀,使溶液中磷酸根离子浓度下降,上述平衡向正反应方向移动,从而不断析出黄色的Ag3PO4沉淀.1年前查看全部
- 下列事实不能用平衡移动原理解释的是( )
下列事实不能用平衡移动原理解释的是( )
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.温度过高对合成氨不利
D.热的纯碱溶液易去油污 大守财奴1年前1
大守财奴1年前1 -
 笑香兰0 共回答了18个问题
笑香兰0 共回答了18个问题 |采纳率100%解题思路:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.A.氯化铁溶液中水解生成氢氧化铁和氯化氢,加热促进水解,氯化氢挥发得到水解产物氢氧化铁,加热蒸干最终得不到氯化铁固体,可以用平衡移动原理来解释,故A不符合;
B、钢铁在潮湿的空气中容易生锈,是铁的吸氧腐蚀,原电池反应,不能用平衡移动原理来解释,故B符合;
C、工业上合成氨的反应是放热反应,高温是为了加快反应速率,不利于提高产物氨气的产率,能用平衡移动原理来解释,故C不符合;
D、热的纯碱溶液易去油污,是因为碳酸钠溶液中碳酸根离子水解显碱性,反应过程是吸热反应,升温促进水解,碱性增强,可以用平衡移动原理来解释,故D不符合;
故选B.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.1年前查看全部
- 向少量Mg(OH)2固体中加饱和氯化铵或醋酸铵溶液,固体完全溶解,用平衡移动原理解释
 shang1112221年前3
shang1112221年前3 -
 lalala_j 共回答了11个问题
lalala_j 共回答了11个问题 |采纳率90.9%答:Mg(OH)2 ↔Mg2++2OH¯
加入饱和NH4Cl后,NH4+结合OH¯,使OH¯浓度减小,平衡右移,所以Mg(OH)2溶解.
加入NH4Ac后,NH4+结合OH¯,使OH¯浓度减小,平衡右移,所以Mg(OH)2溶解.1年前查看全部
大家在问
- 1篮框内共有108个球,其中有4个红球,104个蓝球,一次倒出其中的53个球,问,53个球中出现1个红球概率是多少
- 2帮我想T..S..R..Q..P..O..这些字母开头的英语情话.
- 3压力的作用效果和哪些因素有关?
- 4一辆小汽车5小时行驶225千米,照这样的速度,行驶135千米需要多少小时?
- 5沉默的父爱 作文
- 6sure.hereyou are是什么意思?
- 7具有电学特性的化学物质,材料,有哪些?
- 81.there will be __English party tomorrow night.
- 9离散型随机变量的方差1:已知某运动员投篮的命中率p=0.6(1)求一次投篮时,命中次数ξ的期望与方差;(2)求重复5次投
- 10如图所示,半径为R,内径很小的光滑半圆管竖直放置在水平地面上,两个质量均为m的小球a、b以不同的速度进入管内,a通过最高
- 11作文 难忘的回忆
- 12这条多项选择题我不懂.Q:马克思主义哲学的科学性主要在于它是?A.人类优秀文化成果的总汇 B.以实践为基础的唯物主义的历
- 13关于审美意识的创造的例子
- 14假如你是李明,你校组织以“I want to be a volunteer of protecting animals”
- 15简单英语!do you know a boy _ted health?yes,he is sitting over th

