(2008•清城区模拟)如图所示是两列相干波的干涉图样,实线表示波峰,虚线表示波谷,两列波的振幅都为10cm,波速和波长
 樱夏2022-10-04 11:39:541条回答
樱夏2022-10-04 11:39:541条回答 (2008•清城区模拟)如图所示是两列相干波的干涉图样,实线表示波峰,虚线表示波谷,两列波的振幅都为10cm,波速和波长分别为1m/s和0.2m,C点为AB连线的中点,则图所示五点中振动加强的点是______,振动减弱的点是______,C点此时的振动方向______(选填“向上”或“向下”),从图示时刻再经过0.65s时,C点的位移为______cm,通过的路程______cm.
(2008•清城区模拟)如图所示是两列相干波的干涉图样,实线表示波峰,虚线表示波谷,两列波的振幅都为10cm,波速和波长分别为1m/s和0.2m,C点为AB连线的中点,则图所示五点中振动加强的点是______,振动减弱的点是______,C点此时的振动方向______(选填“向上”或“向下”),从图示时刻再经过0.65s时,C点的位移为______cm,通过的路程______cm. 
已提交,审核后显示!提交回复
共1条回复
 lzwei65 共回答了19个问题
lzwei65 共回答了19个问题 |采纳率94.7%- 解题思路:波峰与波峰相遇,波谷与波谷相遇,为振动加强点,波峰与波谷相遇,为振动减弱点.根据波的传播方向确定C的振动方向.通过波长和波速求出周期,从而确定C点的位移,根据一个周期内经过的路程等于4A求出总路程,注意振幅等于两列波的振幅之和.
A、B两点分别为波峰与波峰相遇,波谷与波谷相遇,是振动加强点,C是AB连线上的点,也是振动加强点.D、E为波峰和波谷相遇,为振动减弱点.
从图可知,波从B向A传播,B处于波谷,知C在平衡位置向下振动.
周期T=[λ/v=0.2s,从图示时刻再经过0.65s时,即经过3
1
4]个周期,C运动到波谷位置,此时的位移x=-2A=-20cm,通过的路程s=3
1
4×4×20cm=260cm.
故答案为:A、B、C;D、E;向下;-20;260点评:
本题考点: 波的干涉和衍射现象.
考点点评: 解决本题的关键知道什么情况下振动加强,什么情况下振动减弱.以及知道波速、波长和周期的关系. - 1年前
相关推荐
- (2008•清城区模拟)在“探究恒力做功与动能改变的关系”实验中,某实验小组采用如图甲所示的装置.实验步骤如下:
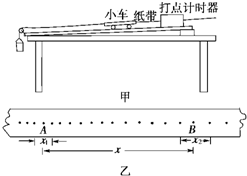 (2008•清城区模拟)在“探究恒力做功与动能改变的关系”实验中,某实验小组采用如图甲所示的装置.实验步骤如下:
(2008•清城区模拟)在“探究恒力做功与动能改变的关系”实验中,某实验小组采用如图甲所示的装置.实验步骤如下:
①把纸带的一端固定在小车的后面,另一端穿过打点计时器
②改变木板的倾角,以重力的一个分力平衡小车及纸带受到的摩擦力
③用细线将木板上的小车通过一个定滑轮与悬吊的砂桶相连
④接通电源,放开小车,让小车拖着纸带运动,打点计时器就在纸带上打下一系列的点,测出x、x1、x2(如图乙所示),查得打点周期为T.
判断重力的一个分力是否已与小车及纸带受到的摩擦力平衡的直接证据是______;实验还需直接测量的物理量是:______.(并用相应的符号表示)探究结果的表达式是mgx=[1/2]M(
)2-[1/2]M(x2 2T
)2x1 2T mgx=[1/2]M(.(用相应的符号表示)
)2-[1/2]M(x2 2T
)2x1 2T  hushuo0001年前1
hushuo0001年前1 -
 dawood2000 共回答了14个问题
dawood2000 共回答了14个问题 |采纳率100%解题思路:平衡摩擦力是用重力的下滑分量来平衡小车受到的摩擦力,故最简洁的方法是调节木板倾角,使小车恰能匀速下滑;本题“探究恒力做功与动能改变的关系”,则要知道恒力的大小,和小车的动能,所以要测量小车的质量M、砂及砂桶的质量m;要探究的结论是合外力做的功等于小车动能的变化量.如果已经平衡好摩擦力,则此时小车做匀速运动,纸带上点迹间距应该相等.
本题“探究恒力做功与动能改变的关系”,则要知道恒力的大小,和小车的动能,所以要测量小车的质量M、砂及砂桶的质量m
合外力对小车做的功为W=mgx
小车从A运动到B动能的变化量△EK=
1
2MvB2−
1
2MvA2=[1/2]M(
x2
2T)2-[1/2]M(
x1
2T)2
所以探究结果的表达式是mgx=[1/2]M(
x2
2T)2-[1/2]M(
x1
2T)2
故答案为:纸带上点迹间距相等;小车的质量M、砂及砂桶的质量m;mgx=[1/2]M(
x2
2T)2-[1/2]M(
x1
2T)2点评:
本题考点: 探究功与速度变化的关系.
考点点评: “探究恒力做功与动能改变的关系”与“探究加速度与力、质量的关系”有很多类似之处,在平时学习中要善于总结、比较,提高对实验的理解能力.1年前查看全部
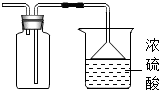
- (2013•清城区模拟)下列实验基本操作正确的是( )
(2013•清城区模拟)下列实验基本操作正确的是( )
A.
取用固体
B.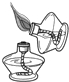
点燃酒精灯
C.
溶解固体
D.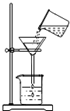
过滤 江湖wang1年前1
江湖wang1年前1 -
 很舒服吧 共回答了17个问题
很舒服吧 共回答了17个问题 |采纳率88.2%解题思路:在取用固体药品时应用镊子或药匙.在点燃烧酒精灯时,可用火柴点燃,不能用燃着的酒精灯去引燃另一只酒精灯.过滤时必须用玻璃棒引流.A、在取用固体药品时,用手拿药品错误.
B、用燃着的酒精灯去引燃另一只酒精灯,易引起火灾错误.
C、符合溶解时的操作方法,故正确.
D、在过滤时,没有用玻璃棒引流,且漏斗的颈没有紧靠在烧杯壁上.
故选C点评:
本题考点: 实验操作注意事项的探究.
考点点评: 玻璃棒在多处实验中都会用到,但在不同的实验中作用不同.如在配制溶液中玻璃棒用来加速溶解.在过滤中玻璃棒用来引流.1年前查看全部
- (2013•清城区模拟)选择一种试剂(适量)除去下列括号中的杂质(填化学式)
(2013•清城区模拟)选择一种试剂(适量)除去下列括号中的杂质(填化学式)
(1)氯化钠(碳酸钠)______;
(2)铜(氧化铜)______. 宝贝儿萧萧1年前1
宝贝儿萧萧1年前1 -
 忧郁玫瑰cai 共回答了14个问题
忧郁玫瑰cai 共回答了14个问题 |采纳率78.6%解题思路:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.(1)要除去氯化钠中的碳酸钠,实质就是除去碳酸根离子,可利用碳酸钠溶液与稀盐酸(或氯化钙溶液)反应生成碳氯化钠、水和二氧化碳(或碳酸钙和氯化钠),能除去杂质且没有引入新的杂质,符合除杂原则.(2)氧化铜...
点评:
本题考点: 物质除杂或净化的探究.
考点点评: 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.1年前查看全部
- (2008•清城区模拟)近几年来,人们对火星表现出空前热情,2003年一年之间先后有四颗探测器朝着火星绝尘而去.如图所示
 (2008•清城区模拟)近几年来,人们对火星表现出空前热情,2003年一年之间先后有四颗探测器朝着火星绝尘而去.如图所示,假设地球的质量为M,某探测器的质量为m,地球的半径为R0,地球表面附近的重力加速度g,已知重力势能Ep=-G
(2008•清城区模拟)近几年来,人们对火星表现出空前热情,2003年一年之间先后有四颗探测器朝着火星绝尘而去.如图所示,假设地球的质量为M,某探测器的质量为m,地球的半径为R0,地球表面附近的重力加速度g,已知重力势能Ep=-G
,其中r为探测器到地球球心的距离.若不考虑地球、火星的自转和一切空气阻力的影响.Mm r
(1)试证明:从地面将该探测器发射至半径为r的运行轨道,发射速度v=
.gR0(2−
)R0 r
(2)取R0=6.4×106m,地球表面附近的重力加速度g=9.8m/s2,试以上式求出发射速度的最小值和最大值.
(3)假设该探测器在火星上软着陆时第一次弹起的最大高度为h,水平速度为v1,第二次着陆时速度为v2.求火星表面的重力加速度g火. 醒来时忘记1年前0
醒来时忘记1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2011•清城区一模)短周期元素A、B、C、D位于同周期且原子序数依次增大.已知A、C、D三种元素原子的最外层共有10
(2011•清城区一模)短周期元素A、B、C、D位于同周期且原子序数依次增大.已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水.请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是:______>______>______(填写离子符号)
(2)指出元素D在元素周期表中的位置:第______周期第______族
(3)元素B的氧化物属于______化合物(填“离子”或“共价”),其电子式为______.
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为______.
(5)含有C阳离子的盐常用来净化水,其原因为______.(用离子方程式表示和适当的文字说明) 孤独卖剑1年前1
孤独卖剑1年前1 -
 雾锁残阳_雾中人 共回答了21个问题
雾锁残阳_雾中人 共回答了21个问题 |采纳率76.2%解题思路:短周期元素A、B、C、D位于同周期且原子序数依次增大.A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水,为氢氧化铝与强碱、强酸的反应,故A为Na、C为Al,B为为Mg元素,D原子最外层电子数为10-1-3=6,则D为硫元素,
(1)Na+、Mg2+、Al3+电子层结构相同,核电荷数越大离子半径越小;
(2)主族元素周期数=电子层数、主族族序数=最外层电子数;
(3)氧化镁属于离子化合物,由镁离子越氧离子构成;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水;
(5)Al3+水解产生的氢氧化铝胶体具有很强的吸附能力.短周期元素A、B、C、D位于同周期且原子序数依次增大.A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水,为氢氧化铝与强碱、强酸的反应,故A为Na、C为Al,D原子最外层电子数为10-1-3=6,则D为硫元素,
(1)Na+、Mg2+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径Na+>Mg2+>Al3+,
故答案为:Na+、Mg2+、Al3+;
(2)D为硫元素,原子有3个电子层,最外层电子数为6,处于周期表第三周期第ⅥA族,
故答案为:三、ⅥA;
(3)MgO属于离子化合物,电子式为 ,
,
故答案为:离子; ;
;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:OH-+Al(OH)3=AlO2-+H2O,
故答案为:OH-+Al(OH)3=AlO2-+H2O;
(5)Al3+水解Al3++3H2O⇌Al(OH)3+3H+,产生的氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的,
故答案为:Al3+水解Al3++3H2O⇌Al(OH)3+3H+,产生的氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查结构性质位置关系、常用化学用语、盐类水解应用等,难度不大,注意基础知识的理解掌握,推断元素是解题的关键.1年前查看全部
- (2008•清城区模拟)如图所示,一质量为m的带电液滴以竖直向下的初速度v0进入某电场中.由于电场力和重力的作用,液滴沿
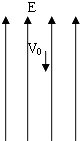 (2008•清城区模拟)如图所示,一质量为m的带电液滴以竖直向下的初速度v0进入某电场中.由于电场力和重力的作用,液滴沿竖直方向下落一段距离h后,速度为0.以下判断正确的是( )
(2008•清城区模拟)如图所示,一质量为m的带电液滴以竖直向下的初速度v0进入某电场中.由于电场力和重力的作用,液滴沿竖直方向下落一段距离h后,速度为0.以下判断正确的是( )
A.电场力对液滴做的功为[1/2m
mv 20]
B.液滴克服电场力做的功为[1/2
mv 20]+mgh
C.液滴的机械能减少mgh
D.液滴的机械能减少量为[1/2v 20]+mgh赞
朱希ww没商量 幼苗
共回答了17个问题采纳率:94.1% 举报
解题思路:带电液滴在电场力和重力的作用,以竖直向下的初速度沿竖直方向下落,根据功能关系可得出电场力做的功;根据除重力以外的力做功,导致机械能变化,即可求解.A、带电液滴下落h高度,由功能关系:W电=-mgh-[1/2]m
v20,所以电场力做负功,其值为[1/2]m
v20+mgh,故A错误;
B、带电液滴下落h高度,由功能关系:W电=-mgh-[1/2m
v20],所以电场力做负功,液滴克服电场力做的功为[1/2]m
v20+mgh,故B正确;
C、根据除重力以外的力做功,导致机械能变化,可知:电场力做负功,其值为[1/2]m
v20+mgh,所以液滴的机械能减小,减小为[1/2]m
v20+mgh,故C错误;
D、根据除重力以外的力做功,导致机械能变化,可知:电场力做负功,其值为[1/2]m
v20+mgh,所以液滴的机械能减小,减小为[1/2]m
v20+mgh,故D正确;
故选:BD点评:
本题考点: 电势能;动能定理的应用.
考点点评: 考查功能关系与机械能是否守恒,并知道除重力以外力做功,导致机械能变化:若此力做正功,则机械能增加;若做负功,则机械能减小.1年前
2可能相似的问题-
1年前1个回答
你能帮帮他们吗
精彩回答
-
1年前
-
1年前
-
1年前
-
1年前
-
1年前
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.089 s. - webmaster@yulucn.com 背上有点痒1年前1
背上有点痒1年前1 -
 朱希ww没商量 共回答了17个问题
朱希ww没商量 共回答了17个问题 |采纳率94.1%解题思路:带电液滴在电场力和重力的作用,以竖直向下的初速度沿竖直方向下落,根据功能关系可得出电场力做的功;根据除重力以外的力做功,导致机械能变化,即可求解.A、带电液滴下落h高度,由功能关系:W电=-mgh-[1/2]m
v20,所以电场力做负功,其值为[1/2]m
v20+mgh,故A错误;
B、带电液滴下落h高度,由功能关系:W电=-mgh-[1/2m
v20],所以电场力做负功,液滴克服电场力做的功为[1/2]m
v20+mgh,故B正确;
C、根据除重力以外的力做功,导致机械能变化,可知:电场力做负功,其值为[1/2]m
v20+mgh,所以液滴的机械能减小,减小为[1/2]m
v20+mgh,故C错误;
D、根据除重力以外的力做功,导致机械能变化,可知:电场力做负功,其值为[1/2]m
v20+mgh,所以液滴的机械能减小,减小为[1/2]m
v20+mgh,故D正确;
故选:BD点评:
本题考点: 电势能;动能定理的应用.
考点点评: 考查功能关系与机械能是否守恒,并知道除重力以外力做功,导致机械能变化:若此力做正功,则机械能增加;若做负功,则机械能减小.1年前查看全部
- (2008•清城区模拟)如图所示,充电后的平行板电容器竖直放置,板间一带正电的绝缘球用绝缘细线悬挂于A板上端,若将小球和
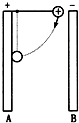 (2008•清城区模拟)如图所示,充电后的平行板电容器竖直放置,板间一带正电的绝缘球用绝缘细线悬挂于A板上端,若将小球和细线拉至水平位置,由静止释放后小球将向下摆动直至与A板发生碰撞,此过程细线始终处于伸直状态,则此过程中( )
(2008•清城区模拟)如图所示,充电后的平行板电容器竖直放置,板间一带正电的绝缘球用绝缘细线悬挂于A板上端,若将小球和细线拉至水平位置,由静止释放后小球将向下摆动直至与A板发生碰撞,此过程细线始终处于伸直状态,则此过程中( )
A.小球电势能一直增加
B.小球的动能一直增大
C.小球受细线的拉力一直在增大
D.小球运动的向心加速度先增大后减小 ywwl1年前1
ywwl1年前1 -
 可口可乐FLY 共回答了22个问题
可口可乐FLY 共回答了22个问题 |采纳率90.9%解题思路:带电小球在复合场中的摆动类似于单摆,它的受力与运动都可以使用单摆的模型说明,由于小球与A板相碰,则说明速度最大不在偏角45°处,而是大于
45°,从而可以确定动能如何变化,向心加速度的变化,及拉力的变化,再根据电场力做功来确定电势能的变化.A:由题意可知,小球在运动过程中,电场力做负功,导致电势能增加.故A正确;
B:根据单摆的对称性可得,小球速度先增加后减小.故B错误;
C:根据牛顿第二定律可得,小球在速度最大时,拉力最大,因此拉力先增加后减小.故C错误;
D:根据an=
v2n
R,可知,当速度变化时,向心加速也变化,因此向心加速度先增大后减小.故D正确.
故选:AD点评:
本题考点: 带电粒子在匀强电场中的运动.
考点点评: 对研究对象进行受力分析,并结合单摆的模型来分析,从而算出结果,并掌握电势能、动能、向心加速度、拉力的变化判定的方法.1年前查看全部
- (七011•清城区一模)下列关于化学观或化学研究方法的叙述中,错误的是( )
(七011•清城区一模)下列关于化学观或化学研究方法的叙述中,错误的是( )
A.在化工生产中应遵循“绿色化学”的思想
B.在过渡元素中寻找优良的催化剂
C.在元素周期表的金属和非金属分界线附近寻找半导体材料
D.根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 mzh19831年前1
mzh19831年前1 -
 破碎的镜子 共回答了19个问题
破碎的镜子 共回答了19个问题 |采纳率94.7%解题思路:A.化工生产主要考虑原料的利用率和减少污染性物质的排放;
B.制取催化剂的元素大都属于过渡金属元素;
C.在元素周期表的金属和非金属分界线附近的元素金属性也非金属性都不强,常用于制备半导体材料;
D.F无正价.A.化工生产主要考虑原料的利用率和减少污染性物质的排放,遵循“绿色化学”的思想,故A正确;
B.制取催化剂的元素位于周期表第ⅢB至ⅡB族之间,属于过渡金属元素,故B正确;
C.在元素周期表的金属和非金属分界线附近的元素金属性也非金属性都不强,常用于制备半导体材料,故C正确;
D.F无正价,不能形成含氧酸,故D错误.
故选D.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期律和元素周期表的综合应用,题目难度不大,注意把握元素周期表中元素的分布和应用的关系.1年前查看全部
- (2011•清城区一模)已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4.三氧化二铁和氧化亚铜都是红色粉末
(2011•清城区一模)已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某化学兴趣小组通过实验来探究某红色粉末是Fe2O3或Cu2O或两者的混合物.(实验所需试剂只能从下列中选择:稀硫酸、KSCN溶液、稀硝酸、双氧水、铁粉、碱式碳酸铜)
探究方案:将红色粉末溶于足量的稀硫酸中;实验现象:反应后有红色固体存在;
(1)结论:红色粉末是______.
(2)如果红色粉末是Cu2O和少量Fe2O3的混合物,请设计实验证明之.
实验操作:______
实验现象:______
(3)兴趣小组欲利用Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4•5H2O).经查阅资料得知:在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
实验小组设计如下实验方案:物质 Cu(OH)2 Fe(OH)2 Fe(OH)3 开始沉淀的pH 6.4 9.7 1.9 沉淀完全的pH 9.6 12.7 3.7 
试回答:
①试剂1为______,试剂2为______(填名称);
加入试剂1后发生反应的离子方程式为______,______.
②固体X的化学式为______;
③操作1为______. 抬山1年前1
抬山1年前1 -
 hbxtdzb 共回答了20个问题
hbxtdzb 共回答了20个问题 |采纳率95%解题思路:(1)将红色粉末溶于足量的稀硫酸中;实验现象:反应后有红色固体存在,三氧化二铁和氧化亚铜都是红色粉末,红色粉末可能是Cu2O或Fe2O3和Cu2O的混合物;
(2)若固体粉末完全溶解,滴加KSCN溶液时溶液不变红色,则一定存在Fe2O3和Cu2O;
(3)根据表格可知,Fe(OH)3完全沉淀时,pH最小,故应将Fe2+先转化为Fe3+,在利用增大pH的方法除去溶液中的Fe3+,但是所加物质不能增加新的杂质.(1)将红色粉末溶于足量的稀硫酸中;实验现象:反应后有红色固体存在,三氧化二铁和氧化亚铜都是红色粉末,红色粉末可能是Cu2O或Fe2O3和Cu2O的混合物,故答案为:Cu2O或Fe2O3和Cu2O的混合物;(2)如果红色粉末是Cu...
点评:
本题考点: 性质实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查实验的设计及评价,以及物质的组成及含量的测定,本题难度较大,做题时注意把握题给信息.1年前查看全部
- (2008•清城区模拟)伽利略的斜面理想实验的意义是( )
(2008•清城区模拟)伽利略的斜面理想实验的意义是( )
A.证明了力不是维持物体运动的原因
B.证明了力是维持物体运动的原因
C.证明小球总能滚到另一斜面上同一高度
D.证明小球总能在水平面上作匀速直线运动 ppice1年前1
ppice1年前1 -
 goudongdong 共回答了20个问题
goudongdong 共回答了20个问题 |采纳率95%解题思路:理想斜面实验:在轨道的一边释放一颗钢珠,如果忽略摩擦力带来的影响,我们发现钢珠从左边滚下后,再从右边的斜面滚上,钢珠将上升到与左边释放高度相同的点;若将右边的倾斜角减小,钢珠还是上升到原来的高度,但通过的路程比原来更长;假设右边的轨道为水平,钢珠想要达到原来的高度,但是钢珠无法达到原来的高度,钢珠将永远运动下去.A、伽利略的理想斜面实验证明力不是维持物体运动的原因,没有力作用的物体能保持原来的运动状态.故A正确,B错误
C、伽利略的理想斜面实验证明了运动的物体具有惯性,故CD错误
故选A.点评:
本题考点: 物理学史.
考点点评: 伽利略斜面实验的卓越之处不是实验本身,而是实验所使用的独特的方法:在实验的基础上,进行理想化推理(也称作理想化实验),它标志着物理学的真正开端.1年前查看全部
- (2013•清城区模拟)下列说法正确的是( )
(2013•清城区模拟)下列说法正确的是( )
A.用过氧化氢溶液制氧气,若不加入二氧化锰,则反应不能发生
B.某物质在空气中燃烧生成二氧化碳和水,则该物质一定含碳、氢、氧三种元素
C.测得某溶液的pH约为6,则该溶液呈碱性
D.NH4NO3溶于水会使溶液温度降低,则NH4NO3溶于水的过程表现为吸热 橘子郡1年前1
橘子郡1年前1 -
 aswe102 共回答了16个问题
aswe102 共回答了16个问题 |采纳率87.5%解题思路:根据已有的知识进行分析,实验室制取氧气可以使用过氧化氢和二氧化锰的混合物,加入的二氧化锰能改变过氧化氢的分解速率,根据质量守恒定律,化学反应前后元素的种类不变,碱性溶液的pH大于7,硝酸铵溶于水会使溶液的温度降低.A、用过氧化氢制取氧气,不适用二氧化锰反应也能够进行,故A错误;
B、某物质在空气中燃烧生成二氧化碳和水,实际上是与空气中的氧气反应,氧气含有氧元素,则该物质一定含有碳元素和氢元素,可能含有氧元素,故B错误;
C、测得某溶液的pH约为6,则该溶液呈酸性,故C错误;
D、NH4NO3溶于水会使溶液温度降低,则NH4NO3溶于水的过程表现为吸热,故D正确;
故选D.点评:
本题考点: 实验室制取氧气的反应原理;溶解时的吸热或放热现象;溶液的酸碱性与pH值的关系;质量守恒定律及其应用.
考点点评: 本题考查了实验室制取氧气的反应原理以及溶液的酸碱性的知识,完成此题,可以依据已有的知识进行.1年前查看全部
- (2011•清城区一模)一包白色粉末中一定含有碳酸钠,可能还含有硫酸钠、氯化钠中的一种或两种,为进一步确认白色粉末的成份
(2011•清城区一模)一包白色粉末中一定含有碳酸钠,可能还含有硫酸钠、氯化钠中的一种或两种,为进一步确认白色粉末的成份,某兴趣小组对白色粉末样品进行了探究.
可选用的仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹
可选用的药品:1.0mol•L-1H2SO4、1.0mol•L-1HNO3、1.0mol•L-1HCl、NaOH稀溶液、0.1mol•L-1AgNO3、0.1mol•L-1BaCl2、0.1mol•L-1Ba(NO3)2、蒸馏水.
以下是实验探究过程:
1)提出假设:
假设1白色粉末为______的混合物;
假设2白色粉末为______的混合物;
假设3白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
请回答:
(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1mol•L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4.你认为他的结论是______(填“对的”或“错的”),原因是:______.
(2)基于假设3,请根据实验方案,将实验操作和预期的现象及结论填入下表中:
编号 实验操作 预期现象和结论 ① 有气体产生,说明样品中含有Na2CO3. ② 向试管中加入0.1mol•L-1的Ba(NO3)2 溶液至过量. ③ 取②操作中的上层清液于另一试管中,加入几滴0.1mol•L-1AgNO3溶液.  农田1年前1
农田1年前1 -
 美妙的雪花 共回答了26个问题
美妙的雪花 共回答了26个问题 |采纳率96.2%解题思路:1)根据假设3来确定假设1和假设2的内容;
3)(1)碳酸根、硫酸根均可以和钡离子反应生成白色沉淀;
(2)①碳酸钠可以和酸反应生成二氧化碳气体;
②白色且不溶于硝酸的沉淀有硫酸钡和氯化银两种;
③能和硝酸酸化的硝酸银反应生成白色沉淀的是含有氯离子的化合物.1)根据假设3来确定假设1为碳酸钠、氯化钠;假设2为碳酸钠、硫酸钠,故答案为:碳酸钠、氯化钠;碳酸钠、硫酸钠;
(1)碳酸根、硫酸根均可以和钡离子反应生成白色沉淀,向试管中滴入0.1mol•L-1的BaCl2溶液,有白色沉淀产生,样品中含有碳酸钠或者是Na2SO4,
故答案为:错的;溶液中含有CO32-,可与BaCl2溶液产生BaCO3沉淀,因此无法确定该沉淀是BaSO4;
(2))①只有碳酸钠可以和酸反应生成二氧化碳气体,可以用硝酸检验是否生成二氧化碳气体来检验碳酸钠的存在;
②向酸化后的试管中加入0.1mol•L-1的Ba(NO3)2 溶液至过量,生成的白色且不溶于硝酸的沉淀是硫酸钡,证明含有硫酸钠;
③能和硝酸酸化的硝酸银反应生成的白色沉淀一定是氯化银,证明含有氯化钠,故答案为:
编号 实验操作 预期现象和结论
① 取少许样品于试管中,加蒸馏水溶解.向试管中加足量的1.0 mol•L-1HNO3.(或加入1.0 mol•L-1HNO3至溶液中不再有气体放为止.)
② 若有沉淀产生,则含Na2SO4,若没有沉淀产生,则不含Na2SO4.
③ 有沉淀产生,则含NaCl,若无沉淀,则不含NaCl.点评:
本题考点: 几组未知物的检验;常见阴离子的检验.
考点点评: 本题属于文字叙述型推断题,给出物质范围和实验现象,要求考生推出混合物中一定存在、一定不存在和可能存在的是什么物质.解答时以文字信息为序,寻找并抓住“题眼”,逐步分析“筛选”.这就要求考生熟悉这类题目的常见“题眼”,也就是解题的“突破口”.1年前查看全部
- (2008•清远)清城区的龙塘镇和石角镇是我市的工业重镇,金属回收利用是其支柱产业之一.金属回收过程中常常产生对环境产生
(2008•清远)清城区的龙塘镇和石角镇是我市的工业重镇,金属回收利用是其支柱产业之一.金属回收过程中常常产生对环境产生污染的废液,要进行处理.下列是对金属回收过程中产生的某种废液(主要含AgNO3、Zn(NO3)2、Cu(NO3)2)进行的处理方法.
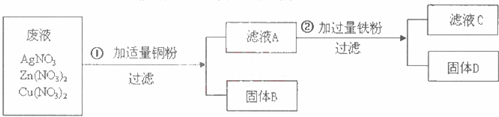
(1)写出下列物质的化学式:固体B是______,固体D是______,滤液C的溶质是______.
(2)写出①、②两个主要反应的化学方程式:①______,②______. 多谢kk1年前1
多谢kk1年前1 -
 ff秦皇岛 共回答了15个问题
ff秦皇岛 共回答了15个问题 |采纳率86.7%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,锌>铁>铜>银,铜能与硝酸银反应生成银,铁能与硝酸铜反应生成铜.(1)在硝酸银、硝酸铜和硝酸锌的混合溶液中,加入铜粉,铜只能与硝酸银反应生成银和硝酸铜,所以固体B是银,滤液A中含有硝酸铜和硝酸锌,加入过量的铁粉,铁能与硝酸铜反应生成硝酸亚铁和铜,铜有剩余,所以固体D是铜和铁的混合物,滤液C中含有硝酸亚铁和硝酸锌,所以本题答案为:Ag,Cu、Fe,Zn(NO3)2、Fe(NO3)2;
(2)铜能与硝酸银反应生成硝酸铜和银,铁能与硝酸铜反应生成硝酸亚铁和铜,所以本题答案为:Cu+2AgNO3═Cu(NO3)2+2Ag,Fe+Cu(NO3)2═Fe(NO3)2+Cu.点评:
本题考点: 金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行,需要注意铁参加的置换反应生成亚铁盐.1年前查看全部
- (2013•清城区模拟)“毒胶囊”泛指利用由工业皮革废料为原料生产的含重金属铬(Cr)超标的胶囊,其中含有可能引起人体肾
(2013•清城区模拟)“毒胶囊”泛指利用由工业皮革废料为原料生产的含重金属铬(Cr)超标的胶囊,其中含有可能引起人体肾伤害的+6价的铬.下列铬的化合物中铬呈+6价的是( )
A.K2CrO4
B.Cr2(SO4)3
C.CrCl2
D.Cr2O3 hwenber1年前1
hwenber1年前1 -
 梧桐西道 共回答了26个问题
梧桐西道 共回答了26个问题 |采纳率92.3%解题思路:根据在化合物中正负化合价代数和为零,结合各选项中的化学式进行解答本题.A、钾元素显+1价,氧元素显-2价,设K2CrO4中铬元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价.
B、硫酸根显-2价,设Cr2(SO4)3中氯元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:2y+(-2)×3=0,则y=+3价.
C、氯元素显-1价,设CrCl2中铬元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:z+(-1)×2=0,则z=+1价.
D、氧元素显-2价,设Cr2O3中氯元素的化合价是w,根据在化合物中正负化合价代数和为零,可得:2w+(-2)×3=0,则w=+3价.
故铬的化合物中铬呈+6价的是K2CrO4.
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答本题.1年前查看全部
- (2008•清城区模拟)往一杯清水中滴入一滴红墨水,一段时间后,整杯水都变成了红色.这一现象在物理学中称为______现
(2008•清城区模拟)往一杯清水中滴入一滴红墨水,一段时间后,整杯水都变成了红色.这一现象在物理学中称为______现象,是由于分子的______而产生的.这一过程是沿着分子热运动的______(填“无序性”、或“有序性”)的方向进行的.
 飞蛾021年前1
飞蛾021年前1 -
 风无情君无语 共回答了24个问题
风无情君无语 共回答了24个问题 |采纳率91.7%解题思路:不同物质彼此进入对方的现象,我们称为扩散现象,是由分子的无规则运动产生的,这一过程是向着热运动的无序性方向进行的.不同物质彼此进入对方的现象,我们称为扩散现象,是由分子的无规则运动产生的,这一过程是有热运动的无序性向有序性进行的;因此往一杯清水中滴入一滴红墨水,一段时间后,整杯水都变成了红色.这一现象在物理学中称为 扩散现象,是由于分子的无规则运动而产生的.这一过程是沿着分子热运动的无序性的方向进行的.
故答案为:扩散;无规则运动;无序性.点评:
本题考点: 扩散.
考点点评: 本题考查了扩散现象,是一道基础题,熟练掌握基础知识即可正确解题.1年前查看全部
- (2013•清城区模拟)如图是初中化学常见物质间的转化关系,(反应条件和部分产物已略去),其中C为既不溶于水也不溶于酸的
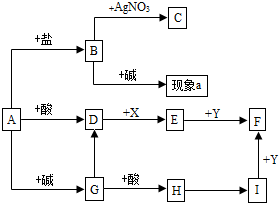 (2013•清城区模拟)如图是初中化学常见物质间的转化关系,(反应条件和部分产物已略去),其中C为既不溶于水也不溶于酸的白色沉淀,D、E、I均为气体,X为黑色固体,Y为红色固体,请回答下列问题:
(2013•清城区模拟)如图是初中化学常见物质间的转化关系,(反应条件和部分产物已略去),其中C为既不溶于水也不溶于酸的白色沉淀,D、E、I均为气体,X为黑色固体,Y为红色固体,请回答下列问题:
(1)写出下列物质的化学式:C:______D:______ E:______.
(2)若现象a无明显变化,则A的化学式可能为______.若现象a为“产生能使湿润的红色石蕊试纸变蓝色的有刺激性气味的气体”,则A的化学式可能为______(以上填一种).
(3)写出物质E的一种用途______.
(4)写出上述物质转化过程中属于复分解反应的一个化学方程式______. 梦回千里路1年前1
梦回千里路1年前1 -
 ydh_ydh 共回答了19个问题
ydh_ydh 共回答了19个问题 |采纳率100%解题思路:根据题干叙述可以知道,B和硝酸银反应生成C,C为既不溶于水也不溶于酸的白色沉淀,则C是氯化银,B中含有氯离子,A能与酸反应生成气体,且能与盐和碱反应,则A可能是碳酸盐,B与碱混合若能产生能使湿润的红色石蕊试纸变蓝色的有刺激性气味的气体,则B是铵态氮肥,可以是氯化铵,故A可能是碳酸铵,若无明显的现象,则A中不含有铵根离子,A可能是碳酸钠,生成的D是二氧化碳,二氧化碳能和碳反应生成一氧化碳,则X是碳,E是一氧化碳,一氧化碳能与红色固体氧化铁反应生成铁和二氧化碳,则F是铁,I能与氧化铁反应生成铁,且I是气体,则I是氢气,H能生成氢气,则H可能是水,碳酸钠与碱反应生成的G是碳酸钙,碳酸钙能与酸反应生成水.(1)B和硝酸银反应生成C,C为既不溶于水也不溶于酸的白色沉淀,则C是氯化银,化学式是AgCl,B中含有氯离子,A能与酸反应生成气体,且能与盐和碱反应,则A可能是碳酸盐,碳酸盐与酸反应生成的气体D是二氧化碳,化学式是CO2;二氧化碳能和碳反应生成一氧化碳,且X是黑色固体,则X是碳,所以E是一氧化碳,化学式是CO;
(2)B与碱混合若若无明显的现象,则A中不含有铵根离子,A可能是碳酸钠,化学式是Na2CO3;B与碱混合若能产生能使湿润的红色石蕊试纸变蓝色的有刺激性气味的气体,这种气体显碱性,是氨气,则B是铵态氮肥,可以是氯化铵,故A可能是碳酸铵,化学式是(NH4)2CO3;
(3)E是一氧化碳,具有还原性,在工业上可以用于冶炼金属,一氧化碳具有可燃性,可以做燃料;
(4)复分解反应是两种化合物相互交换成分,生成两种新的化合物的反应类型,碳酸钠与盐酸的反应属于复分解反应,该反应生成的是氯化钠,水和二氧化碳,用观察法配平,故填:Na2CO3+2HCl═2NaCl+CO2↑+H2O.
故答案为:(1)AgCl;CO2;CO;(2)Na2CO3;(NH4)2CO3;(3)冶炼金属(或做燃料);(4)Na2CO3+2HCl═2NaCl+CO2↑+H2O.点评:
本题考点: 物质的鉴别、推断.
考点点评: 本题为框图式物质推断题,完成此题,关键是找准解题突破口,直接得出有关物质的化学式,然后根据框图结合物质的性质,推断得出其他物质的化学式1年前查看全部
- (2011•清城区二模)设集合A={x|y=ln(1-x)},集合B={y|y=x2},则A∩B=( )
(2011•清城区二模)设集合A={x|y=ln(1-x)},集合B={y|y=x2},则A∩B=( )
A.[0,1]
B.[0,1)
C.(-∞,1]
D.(-∞,1) bryant0061年前1
bryant0061年前1 -
 fjswh 共回答了26个问题
fjswh 共回答了26个问题 |采纳率88.5%解题思路:由集合A={x|y=ln(1-x)},表示函数y=ln(1-x)的定义域,集合B={y|y=x2},表示y=x2的值域,我们不难求出集合A,B,再根据集合交集的定义,不难得到答案.∵A={x|y=ln(1-x)}={x|x<1},
B={y|y=x2}={y|y≥0},
∴A∩B=[0,1).
故选B点评:
本题考点: 交集及其运算;对数函数的定义域.
考点点评: 遇到两个连续数集的运算,其步骤一般是:①求出M和N;②借助数轴分析集合运算结果,方法是:并集求覆盖的最大范围,交集求覆盖的公共范围.1年前查看全部
- (2011•清城区二模)某中学一位高三班主任对本班50名学生学习积极性和对待班级工作的态度进行长期的调查,得到的统计数据
(2011•清城区二模)某中学一位高三班主任对本班50名学生学习积极性和对待班级工作的态度进行长期的调查,得到的统计数据如下表所示:
(1)如果随机调查这个班的一名学生,那么抽到积极参加班级工作的学生的概率是多少?抽到不太积极参加班级工作且学习积极性一般的学生的概率是多少?积极参加班级工作 不太主动参加班级工作 合计 学习积极性高 18 7 25 学习积极性一般 6 19 25 合计 24 26 50
(2)学生的积极性与对待班级工作的态度是否有关系?说明理由. sanasuki1年前1
sanasuki1年前1 -
 scbx 共回答了21个问题
scbx 共回答了21个问题 |采纳率95.2%解题思路:(1)本题是一个等可能事件的概率,试验发生包含的事件数50,满足条件的事件数分别是24,19,根据概率公式得到结果.
(2)根据列联表所给的数据,代入求观测值的公式,求出观测值,把观测值同临界值进行比较,得到有99.9%的把握认为“学生的学习积极性与对待班级工作的态度”有关系.(1)由题意知本题是一个等可能事件的概率,
试验发生包含的事件数50,
满足条件的事件数分别是24,19,
∴P1=
24
50=
12
25
P2=
19
50
(2)根据k2=
50(18×19−6×7)2
24×26×25×25=11.538>10.828
∴我们有99.9%的把握认为“学生的学习积极性与对待班级工作的态度”有关系.点评:
本题考点: 独立性检验的应用.
考点点评: 本题考查独立性检验的应用和等可能事件的概率,本题解题的关键是正确利用观测值公式求出观测值,正确理解临界值对应的概率的意义.1年前查看全部
- (2011•清城区一模)铋(Bi)被称为“绿色”金属,在医药方面有重要应用.下列关于20983Bi和21083Bi的说法
(2011•清城区一模)铋(Bi)被称为“绿色”金属,在医药方面有重要应用.下列关于20983Bi和21083Bi的说法正确的是( )
A.20983Bi和21083Bi是同一种核素
B.20983Bi和21083Bi都含有83个中子
C.20983Bi和21083Bi的核外电子数相同,中子数不同
D.20983Bi和21083Bi分别含有126和127个质子 楚倾城1年前1
楚倾城1年前1 -
 k_065 共回答了24个问题
k_065 共回答了24个问题 |采纳率83.3%解题思路:A、同一元素的不同原子互称同位素,是元素的不同核素;
B、元素符号的左下角表示质子数,左上角表示质量数,中子数=质量数-质子数;
C、原子中核外电子数=核内质子数;
D、元素符号的左下角表示质子数.A、同一元素的不同原子互称同位素,83209Bi和83210Bi都是Bi元素的不同原子,所以互称同位素,是Bi元素的不同核素,故A错误;
B、83209Bi中质子数为83,质量数为209,中子数=质量数-质子数=209-83=126;83210Bi中质子数为83,质量数为210,中子数=质量数-质子数=210-83=127,故B错误;
C、原子中核外电子数=核内质子数,83209Bi和83210Bi的质子数都是83,所以其核外电子数都是83,质量数不同,所以中子数不同,故C正确;
D、83209Bi和83210Bi都含有83个质子,故D错误.
故选C.点评:
本题考点: 核素;同位素及其应用.
考点点评: 本题考查了质子数、中子数、质量数、核外电子数之间的关系,难度不大,明确这几个物理量之间的关系.1年前查看全部
- (2011•清城区一模)做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其
(2011•清城区一模)做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+H2C2O4+H+→CO2↑+Mn2++□,关于此反应的叙述正确的是( )
A.该反应的氧化剂是H2C2O4
B.该反应右边方框内的产物是OH-
C.配平该反应后,H+的系数是6
D.配平后该反应电子转移总数是5e- lyx_197911201年前1
lyx_197911201年前1 -
 yoyo33shan 共回答了15个问题
yoyo33shan 共回答了15个问题 |采纳率100%解题思路:MnO4-+H2C2O4+H+→CO2↑+Mn2++□,Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,由电子守恒可知,2MnO4-+5H2C2O4+H+→10CO2↑+2Mn2++□,再由电荷守恒可知,2MnO4-+5H2C2O4+6H+→10CO2↑+2Mn2++□,由原子守恒可知,该反应为2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O,以此来解答.MnO4-+H2C2O4+H+→CO2↑+Mn2++□,Mn元素的化合价由+7价降低为+2价,C元素的化合价由+3价升高为+4价,由电子守恒可知,2MnO4-+5H2C2O4+H+→10CO2↑+2Mn2++□,再由电荷守恒可知,2MnO4-+5H2C2O4+6H+→10CO2↑+2Mn2++□,由原子守恒可知,该反应为2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O,
A.C元素的化合价升高,则H2C2O4为还原剂,故A错误;
B.该反应右边方框内的产物是H2O,故B错误;
C.配平该反应后,H+的系数是6,故C正确;
D.配平后该反应电子转移总数是10e-,故D错误;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考常见题型,侧重氧化还原反应中基本概念的考查,把握元素的化合价变化即可解答,注意守恒法的应用为解答的关键,题目难度中等.1年前查看全部
- (2008•清城区模拟)如图所示,在研究平抛运动时,小球A沿轨道滑下,离开轨道末端(末端水平)时撞开轻质接触式开关S,被
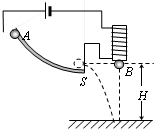 (2008•清城区模拟)如图所示,在研究平抛运动时,小球A沿轨道滑下,离开轨道末端(末端水平)时撞开轻质接触式开关S,被电磁铁吸住的小球B同时自由下落.改变整个装置的高度H重复同样的实验.
(2008•清城区模拟)如图所示,在研究平抛运动时,小球A沿轨道滑下,离开轨道末端(末端水平)时撞开轻质接触式开关S,被电磁铁吸住的小球B同时自由下落.改变整个装置的高度H重复同样的实验.
①实验所观察的现象是______,
②该实验现象说明了A球在离开轨道后______
A、水平方向的分运动是匀速直线运动
B、水平方向的分运动是匀加速直线运动
C、竖直方向的分运动是自由落体运动
D、竖直方向的分运动是匀速直线运动. 蔡达建1年前1
蔡达建1年前1 -
 jyt02 共回答了21个问题
jyt02 共回答了21个问题 |采纳率90.5%解题思路:球A与球B同时释放,同时落地,由于B球做自由落体运动,A球做平抛运动,说明A球的竖直分运动与B球相同.观察到的现象是两球同时落地,知小球A在竖直方向上的运动规律与B球运动规律相同,知A球在竖直方向上做自由落体运动.
故答案为:(1)①AB两球同时落地 ②C点评:
本题考点: 研究平抛物体的运动.
考点点评: 虽然我们知道A球在水平方向做匀速直线运动,但本题中在水平方向没有可以参照的物体,故无法判定其在水平方向的运动情况.这种方法一定要掌握.1年前查看全部
- (2013•清城区模拟)(1)下表为某品牌营养素饮料标签的部分内容,请根据表中信息回答问题.
 (2013•清城区模拟)(1)下表为某品牌营养素饮料标签的部分内容,请根据表中信息回答问题.
(2013•清城区模拟)(1)下表为某品牌营养素饮料标签的部分内容,请根据表中信息回答问题.
该饮料含有六大营养素中的______种;该饮料pH为3.5,此饮料呈______性.营养成分 糖类 钠 钙 锌 维生素C 维生素B6 含量/500mL 22.5g 16mg 16mg 3.0mg 100mg 0.56mg
(2)如图为电解水的实验装置,正极产生的气体是______,它的密度比空气______;(“大”/“小”),实验室检验该气体的方法是:______. 濯濯之水1年前1
濯濯之水1年前1 -
 hunan890 共回答了20个问题
hunan890 共回答了20个问题 |采纳率90%解题思路:人类需要的营养物质有糖类、油脂、蛋白质、维生素、水和无机盐;pH小于7的溶液显酸性;氧气能使带火星的木条复燃.(1)由表中信息可知,该饮料含有糖类、维生素、水和无机盐等四种,该饮料pH为3.5,说明显酸性.
故填:四;酸.
(2)电解水的实验中,正极产生的气体是氧气,负极产生的气体是氢气,氧气的密度比空气大,可以用带火星的木条检验某种气体是否为氧气.
故填:氧气;大;把带火星的木条伸入气体中,如果带火星的木条复燃,说明是氧气.点评:
本题考点: 生命活动与六大营养素;电解水实验.
考点点评: 本题是信息给予题,解答时要充分理解表中或图中提供的信息,并进行综合判断.1年前查看全部
- (2013•清城区模拟)某化工厂为综合利用FeSO4,设计了以下工艺流程:
(2013•清城区模拟)某化工厂为综合利用FeSO4,设计了以下工艺流程:
(1)煤粉、H2既是重要的化工原料又是重要的能源,氢氧燃料电池可以将______能转化为电能,煤燃烧主要将化学能转化为______能.
(2)煅烧炉1中还会发生FeO和CO反应,其方程式为FeO+CO
Fe+CO2高温 .FeO+CO,X气体的化学式是______;循环利用X的优点是______.
Fe+CO2高温 .
(3)下列金属能从FeSO4溶液中置换出Fe的是______(填字母)
a、Al b、Cu c、Ag
(4)实验室模拟操作a 的过程是蒸发浓缩、______、过滤干燥.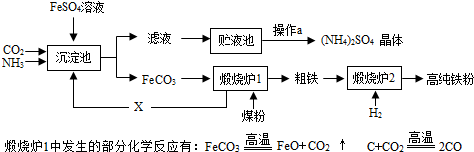
 digitgirl1年前1
digitgirl1年前1 -
 whduchang 共回答了12个问题
whduchang 共回答了12个问题 |采纳率100%解题思路:(1)能量之间可以相互转化,但是总能量保持不变;
(2)根据反应物、生成物、反应条件及其质量守恒定律可以书写化学方程式;
(3)排在金属活动性顺序前面的金属,能够把排在后面的金属从它的盐溶液中置换出来;
(4)蒸发硫酸亚铁溶液可以得到硫酸亚铁晶体.(1)氢氧燃料电池可以将化学能转化为电能,煤燃烧主要将化学能转化为热能.
故填:化学;热.
(2)氧化亚铁和一氧化碳在高温条件下反应能生成铁和二氧化碳,反应的化学方程式为:FeO+CO
高温
.
Fe+CO2,X气体是二氧化碳,化学式是CO2,循环利用二氧化碳的优点是:节约原料,减缓温室效应.
故填:FeO+CO
高温
.
Fe+CO2;CO2;节约原料,减缓温室效应.
(3)金属活动性顺序中,铝排在铁的前面,能够把硫酸亚铁中的铁置换出来.
故填:a.
(4)实验室模拟操作a 的过程是蒸发浓缩、结晶、过滤干燥.
故填:结晶.点评:
本题考点: 物质的相互转化和制备;混合物的分离方法;金属的化学性质;物质发生化学变化时的能量变化.
考点点评: 二氧化碳、甲烷、氨气等属于温室气体,减少这些物质的排放,有利于减缓温室效应,保护环境.1年前查看全部
- (b003•清城区模拟)下列如个力学实验u体现出的共同的物理思想方法是( )
(b003•清城区模拟)下列如个力学实验u体现出的共同的物理思想方法是( )
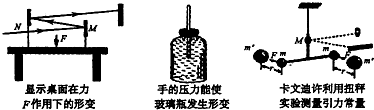
A.极限法
B.放大法
C.控制变量法
D.等效替代法 niki03271年前1
niki03271年前1 -
 777_xy 共回答了25个问题
777_xy 共回答了25个问题 |采纳率92%解题思路:图1和图3实验利用:入射光线不变时,当入射角改变α时,反射角改变2α,采用放大法.图2中,用手压琉璃瓶,通过细管将瓶子的形变显示出来,采用的也是放大法.图1和图e实验都利用入射光线不变时,当入射角改变α时,反射角改变wα的原理,图1中将桌面在力F作用下发生的形变通过反射光线在屏上光斑移动显示出来,采用放个法.图w中,用手压琉璃瓶,琉璃瓶发生微小的变形,体积减小,由于管子很细,管中水位上升明显,即通过细管将瓶子的形变显示出来,采用的也是放个法.
故选1.点评:
本题考点: 物理学史.
考点点评: 对于物理实验常用的科学研究方法要理解并记忆.放大法是将微小的量放大,变得直观,是常用的研究方法.1年前查看全部
- (2013•清城区模拟)如图1所示,请根据下列装置,回答问题:
(2013•清城区模拟)如图1所示,请根据下列装置,回答问题:
(1)写出标号①、②的仪器名称:①______,②______.
(2)实验室制取CO2的反应方程式为:______;检验二氧化碳气体的反应原理是______(用化学方程式表示).
(3)实验中为了回收二氧化锰固体.正确操作的先后顺序是______(填写选项序号).
A.烘干B.溶解C.过滤D.洗涤
(4)在实验室制取CO2的实验装置中,F装置相对于B装置具有的优点是______.
(5)实验室通过加热固体氯化铵和固体氢氧化钙的混合物反应可以得到NH3(极易溶于水,密度比空气小),你将选择图2中的______作为实验室收集NH3的装置.
(6)图3是收集NH3并对尾气进行处理的装置(浓硫酸可与NH3反应生成硫酸铵),请根据图示把装置画完整.
(7)图3中倒扣漏斗倒放的作用是______.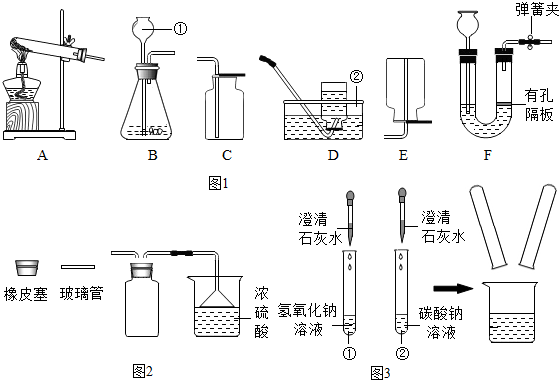
 weiyixcf1年前1
weiyixcf1年前1 -
 影子ee125 共回答了13个问题
影子ee125 共回答了13个问题 |采纳率100%解题思路:(1)熟练掌握常见的化学仪器名称和用途;
(2)实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,写出反应的方程式;检验二氧化碳用石灰水,看是否变浑浊;
(3)根据分离不溶性固体与可溶固体的方法分析;
(4)比较FB两种装置,通过观察可知F装置中有弹簧夹,分析弹簧夹的优点;
(5)根据NH3极易溶于水,密度比空气小的特点选择收集装置;
(6)以及尾气的处理方法(1)①是长颈漏斗;②是水槽;
(2)实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;检验二氧化碳用石灰水,因为二氧化碳可以使石灰水变浑浊,反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(3)由于二氧化锰不溶于水,可以采取先溶解后再过滤最后洗涤烘干的方式即可得到较为纯净的二氧化锰.所以顺序为 BCDA;
(4)比较FB两种装置的使用过程,可发现F装置可以通过弹簧夹的开关来控制反应的发生和停止,但B装置不能;
(5)因NH3极易溶于水,密度比空气小,只能采用向下排空气法收集,收集是只能用E;
(6)完整的装置图如下:
(7)其中漏斗的作用:防止倒吸.
故答案为:(1)长颈漏斗;水槽;
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;CO2+Ca(OH)2=CaCO3↓+H2O;
(3)BCDA;
(4)可以控制反应的随时发生或停止;
(5)E;
(6) 装置图如右图:
装置图如右图:
(7)防止倒吸.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;混合物的分离方法.
考点点评: 本题考查了气体的制取装置、收集方法等的选择,并在此基础上进行拓展,关键是明确发生装置、收集方法选择的依据结合题目提供的信息完成解答.1年前查看全部
- (2011•清城区一模)短周期元素A、B、C、D位于同周期且原子序数依次增大.已知A、C、D三种元素原子的最外层共有10
(2011•清城区一模)短周期元素A、B、C、D位于同周期且原子序数依次增大.已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水.请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是:Na+Na+>Mg2+Mg2+>Al3+Al3+(填写离子符号)
(2)指出元素D在元素周期表中的位置:第三三周期第ⅥAⅥA族
(3)元素B的氧化物属于离子离子化合物(填“离子”或“共价”),其电子式为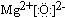
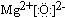 .
.
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为OH-+Al(OH)3=AlO2-+H2OOH-+Al(OH)3=AlO2-+H2O.
(5)含有C阳离子的盐常用来净化水,其原因为Al3+水解Al3++3H2O⇌Al(OH)3+3H+,产生的氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的Al3+水解Al3++3H2O⇌Al(OH)3+3H+,产生的氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的.(用离子方程式表示和适当的文字说明) 江南春光无限好1年前1
江南春光无限好1年前1 -
 wwrwwr 共回答了21个问题
wwrwwr 共回答了21个问题 |采纳率90.5%短周期元素A、B、C、D位于同周期且原子序数依次增大.A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水,为氢氧化铝与强碱、强酸的反应,故A为Na、C为Al,D原子最外层电子数为10-1-3=6,则D为硫元素,
(1)Na+、Mg2+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径Na+>Mg2+>Al3+,
故答案为:Na+、Mg2+、Al3+;
(2)D为硫元素,原子有3个电子层,最外层电子数为6,处于周期表第三周期第ⅥA族,
故答案为:三、ⅥA;
(3)MgO属于离子化合物,电子式为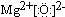 ,
,
故答案为:离子;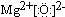 ;
;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:OH-+Al(OH)3=AlO2-+H2O,
故答案为:OH-+Al(OH)3=AlO2-+H2O;
(5)Al3+水解Al3++3H2O⇌Al(OH)3+3H+,产生的氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的,
故答案为:Al3+水解Al3++3H2O⇌Al(OH)3+3H+,产生的氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的.1年前查看全部
- (2011•清城区二模)等比数列{an}中,公比q=2,S3=34685,则a2=______.
 kmds1年前1
kmds1年前1 -
 jingtiancn 共回答了16个问题
jingtiancn 共回答了16个问题 |采纳率93.8%解题思路:由题设条件:等比数列{an}中,公比q=2,S3=34685,先求出a1,再由公式a2=a1q求出a2.∵等比数列{an}中,公比q=2,S3=34685,
∴a1+2a1+4a1=34685,
∴a1=4955,
∴a2=a1q=4955×2=9910.
故答案为:9910.点评:
本题考点: 等比数列的前n项和.
考点点评: 本题考查等比数列的通项公式和前n项和公式,解题时要认真审题,注意公式的灵活运用.1年前查看全部
大家在问
- 1分数化小数.500/137 1又5/2 8/7 1又3分之2 百分数化成小数.300% 130%
- 2冬游迪斯尼 作文
- 3铭牌上标有“220V 40W”的日光灯,正常工作时的电流为
- 4AD是直角三角形ABC斜边BC上的高,若AB=3,BD=X,BC=Y.【急!答得好我要加分的!】
- 5正方形中心在M(-1,0),一条边所在的直线方程为x+3y-5=0,求其他三边所在直线的方程.
- 6秋天到了,树叶变黄了。Autumn comes.The leaves __ __ yellow .求划线处答案
- 7某钢铁厂冶炼4000t含杂质4%的生铁,需要含四氧化三铁质量分数为80%的磁铁矿石多少t?(结果保留整数)求过程
- 8已知根号下x +23=5,(y-1)的三次方=-0.125,求根号x-根号2xy-三次根号下2y-
- 9平行四边形ABCD的高CG等于BE的两倍,平行四边形ABCD的面积是360平方厘米,AE=9厘米,AB=15厘米.
- 10设函数f(x)的导数为f′(x),且f(x)=f′(π2)sinx+cosx,则f′(π4)= ___ .
- 11写一句描写初夏时农忙景象的诗句
- 12已知定点G(-3,0),S是圆C:(x-3)2+y2=72(C为圆心)上的动点,SG的垂直平分线与SC交于点E.设点E的
- 13唱好自己的那首歌 求好的开头 急
- 14|-2|-√1/16+(-2)负二次方-(√3-2)零次方
- 15在三角形内部到三边距离相等的点有______个,而在三角形的外部到三条边所在直线距离相等的点共有______个.



