白云石+硅铁制取金属镁的化学方程式? 白云石(CaCO3.MgCO3)经高温煅烧后生成氧化物(CaO.MgO),该氧化物
 西扯扯东扯扯__2022-10-04 11:39:541条回答
西扯扯东扯扯__2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 非洲雏菊 共回答了14个问题
非洲雏菊 共回答了14个问题 |采纳率85.7%- Si+MgO=SiO+Mg
- 1年前
相关推荐
- 玻璃棉保温材料玻璃棉板玻璃棉毡玻璃棉保温材料属于玻璃纤维中的一个类别.是一种人造无机纤维.采用石英砂、石灰石、白云石等天
玻璃棉保温材料玻璃棉板玻璃棉毡
玻璃棉保温材料属于玻璃纤维中的一个类别.是一种人造无机纤维.采用石英砂、石灰石、白云石等天然矿石为主要原料,配合一些纯碱、硼砂等化工原料熔成玻璃.在融化状态下,借助外力.吹制式甩成絮状细纤维,纤维和纤维之间为立体交叉.互相缠绕在一起,呈现出许多细小的间隙.这种间隙可看作孔隙.因此,玻璃棉可视为多孔材料,具有良好的绝热,吸声性能.
玻璃棉保温材料是将处于熔融状态的玻璃用离心喷吹法工艺进行纤维化喷涂热固性树脂制成的丝状材料,再经过热固化深加工处理,可制成具有多种用途的系列产品.玻璃棉保温材料具有阻燃、无毒、耐腐蚀、容重小、导热系数低、化学稳定性强、吸湿率低、憎水性好等优点,是目前公认的性能最优越的保温、隔热、吸音防噪材料,它具有十分广泛的用途.用玻璃棉保温材料制成的玻璃棉板、玻璃棉毡、玻璃棉管已大量用于建筑、化工、电子、电力、冶金、能源、交通等领域的保温隔热、吸声降噪,效果十分显著.
由于玻璃棉保温材料质地柔软、纤维微细,施工中不会刺激皮肤,无论在高温或低温环境中均能保持良好的保温隔热性能,因而深受施工单位欢迎,成为保温隔热的首选产品,具有广阔的发展前景.
淄博起瑞保温材料有限公司供应优质玻璃棉保温材料,联系人:胡经理 欢迎来电来函洽谈. zhangyan671年前1
zhangyan671年前1 -
 等着月亮来载我 共回答了16个问题
等着月亮来载我 共回答了16个问题 |采纳率81.3%我知道地址:潘成五金709号起瑞保温材料有限公司1年前查看全部
- 白云石成分含量碳酸钙30.26%碳酸镁20.52%碳酸铁0.048%这种含量的白云石有什么用途和价格
 lionhou1年前2
lionhou1年前2 -
 我爱梦里花 共回答了19个问题
我爱梦里花 共回答了19个问题 |采纳率89.5%没什么用...
提炼镁含量又低..铁的就不说了
碳酸钙地上一大堆1年前查看全部
- 把稀盐酸加入白云石样本中会出现什么现象?
把稀盐酸加入白云石样本中会出现什么现象?
就是稀盐酸、碳酸钙、碳酸镁之间会出现的反应?
它们之间会有反应吗?如果有,
请写出反应现象与反应化学方程式. 小狐狸晒太阳1年前1
小狐狸晒太阳1年前1 -
 韦广安 共回答了12个问题
韦广安 共回答了12个问题 |采纳率91.7%会啊!
HCl+CaCO3=H2O+CO2↑+CaCl2
HCl+MgCO3=H2O+CO2↑+MgCl2
现象都是产生气泡1年前查看全部
- 自然界存在着一种白云石的矿石,其化学式是xCaCO3•yMgCO3.(其中x、y为最小正整数比).以它为原料,可制取耐火
自然界存在着一种白云石的矿石,其化学式是xCaCO3•yMgCO3.(其中x、y为最小正整数比).以它为原料,可制取耐火材料等.
(1)称取2.76g白云石,加热到质量不再变化,冷却到室温,再称量固体质量为1.44g.试通过计算写出白云石的化学式.
(2)若再称取2.76g白云石,研碎后与过量炭粉混合,放在特定仪器中隔绝空气强热一段时间后,测得白云石分解率为a(设白云石CaCO3、MgCO3同比分解),生成V L一氧化碳(密度为:1.25g/L).(已知CaO+3C
CaC2+CO;2MgO+5C高温
Mg2C3+2CO)高温
①试计算V为多少L?(用a代数式表示).
②请在右图中画出V和a的关系图. ccc19881年前4
ccc19881年前4 -
 didi1919 共回答了17个问题
didi1919 共回答了17个问题 |采纳率94.1%解题思路:(1)碳酸钙、碳酸镁在高温下可分解生成氧化钙、氧化镁和二氧化碳,根据题意可推断出白云石加热时分解生成氧化钙、氧化镁和气体二氧化碳,利用反应前后的固体的质量差来计算二氧化碳的质量,写出反应的化学方程式并利用反应中白云石与二氧化碳的质量关系,推算出化学式中x、y的比,然后取最小整数比写出白云石的化学式;
(2)根据在隔绝空气时加强热,白云石分解出的二氧化碳能与过量的炭粉发生反应,反应生成一氧化碳来利用化学反应方程式来解答.(1)根据题意,白云石受热分解的化学方程式为:
xCaCO3•yMgCO3
高温
.
xCaO+yMgO+(x+y)CO2↑
100x+84y 44(x+y)
2.76g (2.76g-1.44g)
[100x+84y/2.76g=
44(x+y)
(2.76g−1.44g)],
解得 x:y=1:1,
因此白云石的化学式为CaCO3•MgCO3,
答:白云石的化学式为CaCO3•MgCO3;
(2)①由CaCO3•MgCO3
高温
.
CaO+MgO+2CO2↑,
CaO+3C
高温
CaC2+CO,
2MgO+5C
高温
Mg2C3+2CO,
CO2+C
高温
.
2CO,则可知
CaO~COMgO~COCO2~2CO
即存在CaCO3•MgCO3~6CO
184 6×28
2.76g×a V×1.25g/L
[184/6×28=
2.76g×a
V×1.25g/L],
解得V=2.02aL,
答:V为2.02aL;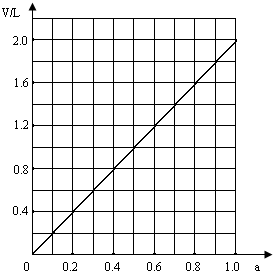
②由V=2.02aL可知,
V和a的关系在坐标图上为斜率为2.02的正比例图象,
答:V和a的关系图为点评:
本题考点: 有关化学式的计算和推断;根据化学反应方程式的计算.
考点点评: 本题较难,考查学生利用化学反应方程式的计算,二氧化碳的质量是解答的关键,然后利用二氧化碳的质量代入计算即可,然后利用几个化学反应得出关系式,利用关系式法来计算生成一氧化碳的关系,注重了解题方法的应用来解答本题.1年前查看全部
- .用酸分解石灰石或白云石试样时应注意什么 实验中怎样判断试样已分解完全
.用酸分解石灰石或白云石试样时应注意什么 实验中怎样判断试样已分解完全
急 五芳斋_米粽1年前1
五芳斋_米粽1年前1 -
 forjolly 共回答了15个问题
forjolly 共回答了15个问题 |采纳率93.3%石灰石的主要成分是CaCO3,而白云石的主要成分是CaMg(CO 3 ) 2
用酸分解是最好使用稀盐酸.
酸解时石灰石分解速度快,而白云石分解速度较慢.
判断分解完全的方法就是看是否还有气泡产生啊.1年前查看全部
- 白云石和方解石区别
 winterls1年前1
winterls1年前1 -
 灵儿1231 共回答了17个问题
灵儿1231 共回答了17个问题 |采纳率82.4%内蒙白云鄂博铁铌稀土矿床以其矿种多、规模大、成因复杂而闻名于世.铁矿以沉积为主后经热液改造而成;稀土矿属富稀土的碳酸岩岩浆热液成因.铁矿和稀土矿的围岩是白云岩,脉石矿物是白云石和方解石.白云石的差热曲线吸热峰峰顶温度为747~798℃、798~835℃,与标准的830℃相差较大;方解石的差热曲线吸热峰峰顶温度为842~907℃,与标准的960℃差距较大.白云石和方解石化学成分中多种微量元素置换总量愈高,其热分解温度降低得愈多;白云石经受的热液交代变质作用愈强,其热分解温度降低得愈多;方解石热变质作用愈强,其热分解温度降低的愈多.1年前查看全部
- 白云石和萤石的区别 白云石主要是增加渣中MgO含量保护炉衬,而萤石是助熔剂加速石灰熔化,与白云石作用相反.
 marnisn11年前2
marnisn11年前2 -
 今天开始变歪嘴控 共回答了18个问题
今天开始变歪嘴控 共回答了18个问题 |采纳率94.4%白云石:(Mg,Ca)CO3
荧石:CaF2
白云石分解成碱性氧化物(MgO,CaO),可以与酸性氧化物作用而造渣.
CaF2无法造渣,只起助熔作用,即降低熔点的作用.1年前查看全部
- 为什么白云石在煅烧过程中比菱镁石易粘接、结坨
 那么复杂1年前1
那么复杂1年前1 -
 唯一的神 共回答了20个问题
唯一的神 共回答了20个问题 |采纳率95%白云石里面含有CaMgCO3,而菱镁石里面主要为MgCO3,Ca很低很低.
在烧结过程中,白云石的Ca会在灼烧以后变为CaO,而CaO和MgO在一起会交联,会更容易结块.
而菱镁石在在灼烧后,CO2跑出会使得材料变得很蓬松,而不容易结块1年前查看全部
- 金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法.该方法是以白云石
金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法.该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁(硅铁含硅量达95%--99%)还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁.反应工艺流程如下图:

(1)写出还原炉中硅铁还原氧化镁发生置换反应的化学方程式2MgO+Si
2Mg↑+SiO2高温 .2MgO+Si
2Mg↑+SiO2高温 .
(2)在冶炼过程中反应温度对生成金属镁的影响如图,从图中分析,该还原反应属于______(填“吸热”“放热”)反应,理由是______.
(3)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
真空条件对制备金属镁来讲,可以达到的目的是:①______②______剩余压强mmHg 760 10 1 0.1 平衡时的温度℃ 2370 1700 1430 1235
(4)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2•6H2O),其中
KCl•MgCl2•6H2O属于______.
A.盐 B.混合物
(5)写出煅烧白云石的反应化学方程式CaCO3•MgCO3
CaO•MgO+2CO2↑高温 .CaCO3•MgCO3.
CaO•MgO+2CO2↑高温 . 222768921年前1
222768921年前1 -
 cdcdkey 共回答了20个问题
cdcdkey 共回答了20个问题 |采纳率90%解题思路:(1)根据化学方程式的书写方法考虑本题;(2)根据图象中热量的变化考虑;(3)根据镁易与空气中氧气反应,真空可以降低反应的温度考虑;(4)根据混合物是由不同物质组成的物质考虑;(5)根据化学方程式的书写方法考虑.(1)反应物是氧化镁和硅,生成物是镁和二氧化硅,反应条件是高温,镁属于镁蒸汽,标上上升符号,所以方程式是:2MgO+Si
高温
.
2Mg↑+SiO2
(2)吸热,因为升高温度Mg的产率增大,说明反应是吸热反应;
(3)①由于镁与氧气能反应生成氧化镁,真空条件防止高温下Mg被空气氧化;②真空条件可以降低反应所需温度,节约能源;
(4)混合物是由不同物质组成的物质,KCl•MgCl2•6H2O是由一种物质组成,属于纯净物,且属于盐;
(5)难溶性的碳酸盐碳酸钙和碳酸镁在高温下分解为氧化物和二氧化碳,即CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑.
故答案为:(1)2MgO+Si
高温
.
2Mg↑+SiO2;(2)吸热;升高温度Mg的产率增大,说明反应是吸热反应;(3)①防止高温下Mg被空气氧化;②降低反应所需温度,节约能源;(4)A;(5)CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑.点评:
本题考点: 物质的相互转化和制备;常见的氧化物、酸、碱和盐的判别;物质发生化学变化时的能量变化;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查学生镁的化合物的有关知识,可以根据所学知识进行回答,难度不大,需要学会从题干中提取有用信息.1年前查看全部
- 金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法.该方法是以白云石
金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法.该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁.反应工艺流程如图1:
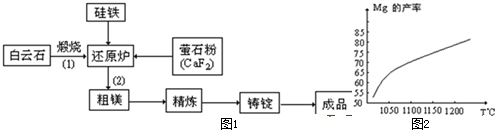
(1)在冶炼过程中反应温度对生成金属镁的影响如图2,从图中分析,还原反应的反应热△H______0(填“<”“>”“=”)理由是______.
(2)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
真空条件对制备金属镁来讲,可以达到的目的是:①______②______剩余压强mmHg 760 10 1 0.1 平衡时的温度℃ 2370 1700 1430 1235
(3)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2•6H2O),其中KCl•MgCl2•6H2O属于______.
A.复盐 B.混合物C.配合物
(4)写出煅烧白云石的反应化学方程式CaCO3•MgCO
CaO•MgO+2CO2↑高温 .CaCO3•MgCO.
CaO•MgO+2CO2↑高温 . X黄氏1年前1
X黄氏1年前1 -
 想飞只狗 共回答了16个问题
想飞只狗 共回答了16个问题 |采纳率87.5%解题思路:(1)根据图象中Mg的产率随温度的变化考虑;
(2)根据镁易与空气中氧气反应,真空可以降低反应的温度考虑;
(3)根据混合物是由不同物质组成的物质考虑;
(4)根据化学方程式的书写方法考虑.(1)由图象可知,温度越高,Mg的产率增大,说明升高温度平衡正移,所以正方向为吸热方向,即△H>0,
故答案为:>;升高温度Mg的产率增大,平衡向正反应方向移动,说明正反应为吸热反应;
(2)①由于镁与氧气能反应生成氧化镁,真空条件防止高温下Mg被空气氧化;②真空条件可以降低反应所需温度,节约能源,
故答案为:①降低反应所需温度,节约能源②防止Mg被空气氧化;
(3)混合物是由不同物质组成的物质,KCl•MgCl2•6H2O是由一种物质组成,属于纯净物,且属于盐;故答案为:A;
(4)难溶性的碳酸钙和碳酸镁在高温下分解为氧化物和二氧化碳,即CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑,
故答案为:CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑.点评:
本题考点: 金属冶炼的一般原理;镁的化学性质.
考点点评: 本题考查学生镁的化合物的有关知识,涉及了平衡图象的分析,方程式的书写等,难度中等,需要学会从题干中提取有用信息.1年前查看全部
- (2009•金华模拟)马格尼特法冶炼镁的工艺流程如图.炉料中除有煅烧白云石和硅铁外,还加入煅烧过的铝土矿,加Al2O3的
(2009•金华模拟)马格尼特法冶炼镁的工艺流程如图.炉料中除有煅烧白云石和硅铁外,还加入煅烧过的铝土矿,加Al2O3的主要目的是降低渣的熔点,便于液态排渣.已知白云石的成分为CaCO3•MgCO3,硅铁是指含有55%硅左右的合金,作还原剂,最后得到低品位的硅铁含硅量少的合金,简易流程图如下:

试回答下列问题
(1)反应①白云石煅烧得CaO•MgO的化学方程式为:CaCO3•MgCO3
CaO•MgO+2CO2↑高温 .CaCO3•MgCO3
CaO•MgO+2CO2↑高温 .
(2)反应②还原炉中发生反应生成镁和炉渣的化学方程式为:2(CaO•MgO)+Si+0.3Al2O3
2Mg+2CaO•SiO2•0.3Al2O3高温 .2(CaO•MgO)+Si+0.3Al2O3
2Mg+2CaO•SiO2•0.3Al2O3高温 .
(3)沪渣是一种工业生产的重要原料,可作为生产______的原料.
(4)马格尼特法冶炼镁,一台4500千瓦的炉子可日产约7.2吨镁,一天至少约消耗含硅60%的硅铁______吨(假设硅全部反应) suipi1年前1
suipi1年前1 -
 c7f6kz 共回答了19个问题
c7f6kz 共回答了19个问题 |采纳率94.7%解题思路:(1)难溶性的碳酸盐高温下分解为氧化物和二氧化碳;
(2)根据还原炉中的炉渣来书写化学方程式;
(3)炉渣2CaO•SiO2•0.3Al2O3是生产水泥的原料;
(4)根据化学方程式进行计算.(1)难溶性的碳酸盐碳酸钙和碳酸镁在高温下分解为氧化物和二氧化碳,即CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑,
故答案为:CaCO3•MgCO3
高温
.
CaO•MgO+2CO2↑;
(2)根据还原炉中的炉渣为2CaO•SiO2•0.3Al2O3,结合原子守恒,可以得出化学方程式为:2(CaO•MgO)+Si+0.3Al2O3
高温
.
2Mg+2CaO•SiO2•0.3Al2O3,故答案为:2(CaO•MgO)+Si+0.3Al2O3
高温
.
2Mg+2CaO•SiO2•0.3Al2O3;
(3)沪渣2CaO•SiO2•0.3Al2O3可作为生水泥的原料,故答案为:水泥;
(4)根据化学方程式:2(CaO•MgO)+Si+0.3Al2O3
高温
.
2Mg+2CaO•SiO2•0.3Al2O3,当生成7.2吨镁消耗硅的质量为:[28×7.2/48]=4.2g,所需含硅60%的硅铁质量为:[4.2/60%]=7.0(t),故答案为:7.0.点评:
本题考点: 镁、铝的重要化合物;化学反应的基本原理;硅酸盐工业.
考点点评: 本题考查学生镁和铝的化合物的有关知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 以白云石(化学式表示为MgCO3•CaCO3)为原料制备氢氧化镁的工艺流程如下:⑴根据流程图判断白云石“轻烧
以白云石(化学式表示为MgCO3•CaCO3)为原料制备氢氧化镁的工艺流程如下:⑴根据流程图判断白云石“轻烧”后固体产物的主要成分——.则“轻烧”温度应不超过——⑵流程图中“加热反应”的化学方程式为——⑶沉淀过程溶液的PH=9.5,此时溶液中c(Mg2+)=——(已知Ksp〔Mg(OH)2〕=5.61×10^-12)⑷该工艺中可以循环使用的物质是——、—— ⑸传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法,其优点是——、——

 流浪小兔1年前1
流浪小兔1年前1 -
 yyyy1969 共回答了18个问题
yyyy1969 共回答了18个问题 |采纳率94.4%1年前查看全部
- 白云石的主要成分和用途是什么?
 swindler5201年前1
swindler5201年前1 -
 qq知已 共回答了23个问题
qq知已 共回答了23个问题 |采纳率95.7%白云石的分子式为x0dCaCO 3 MgCO 3x0d.理论成分:CaO 30.4x0d%、MgO 21.9%、CO 2 47.7x0d%.常含有硅、铝、铁、钛等杂质.x0d主要用途:配入胎釉中作为助熔剂.北方的一些古窑场,如定窑等常在胎釉中加入白云石,景德镇的某些色釉中亦加入白云石.白云石化学成分为CaMg[CO3]2x0d,晶体属三方晶系的碳酸盐矿物.白云石的晶体结构与方解石类似,晶形为菱面体,晶面常弯曲成马鞍状,聚片双晶常见,多呈块状、粒状集合体.纯白云石为白色,因含其他元素和杂质有时呈灰绿、灰黄、粉红等色,玻璃光泽.三组菱面体解理完全,性脆.摩氏硬度x0d3.5-4x0d,比重x0d2.8-2.9x0d.矿物粉末在冷稀盐酸中反应缓慢.x0d鉴定特征:以硬度稍大,在冷稀盐酸中反应缓慢等特征,可与相似的方解石相区别.x0d白云岩是一种碳酸盐岩,主要由白云石组成,含少量的方解石、粘土矿物、燧石、菱镁矿,有时含有石膏、硬石膏,天青石,重晶石、黄铁矿和有机质等,白云岩的颜色随地质环境、沉积条件有很大差异,一般为灰白色,在外貌上与石灰岩相似.在石灰岩与白云岩之间按方解石,白云石的比例不同的可以划分出一些过渡类型岩石,如:含灰云岩等.一般称为白云岩的是指方解石含量在5%以下的轻纯白云岩,其中质量合乎工业要求者称为白云石矿..x0d大理石的称谓很多:因石出自苍山而名“点苍石”x0d,因有“凉生肘腑间”质感而被诗客称为“醒酒石”x0d,因有“凤凰玉女点石”的传说而被山民叫做“凤凰石”x0d,官家征石时贡故名“贡石”x0d,民间用于柱础故称“础石”x0d,因大理古称榆城而名“榆石”x0d,大理古有“天竺妙香国”之称而名“天竺石”x0d,最终趋向于称“大理石”1年前查看全部
- 有谁知道 长石,白云石,石灰石,纯碱,芒硝,碳粉的密度啊?
 赵汗青1年前1
赵汗青1年前1 -
 amway安利 共回答了17个问题
amway安利 共回答了17个问题 |采纳率94.1%单位:g/(cm^3)
钠长石2.60-2.63
中长石2.66-2.68
正长石2.55-2.63
钙钠斜长石2.69-2.72
钙斜长石2.74-2.76
白云石2.85
铁白云石2.97
石灰石2.71-2.95
芒硝2.66
碳3.521年前查看全部
- 1、白云石的主要成分为CaCO3·MgCO3,还含有少量Fe、Si的化合物.实验室以白云石为原料制备Mg(OH)2及Ca
1、白云石的主要成分为CaCO3·MgCO3,还含有少量Fe、Si的化合物.实验室以白云石为原料制备Mg(OH)2及CaCO3.
实验过程中需要的数据见下表:
氢氧化物开始沉淀时的pH
氢氧化物沉淀完全时的pH
Fe3+
1.9
3.2
Fe2+
7.0
9.0
Mg2+
9.5
11.0
请回答下列问题:
(1)溶液A中含有Ca2+、Mg2+、Fe2+、Fe3+,则试剂①可选择_________(填字母,下同);试剂②可选择_________;试剂③可选择_________.
(A)KMnO4(B)Cl2(C)MgO(D)CaO
1、(1)B(1分),CD(2分),D(1分)
第二、三个空 why?
tu

 zeeg1年前2
zeeg1年前2 -
 三亚旅游26 共回答了14个问题
三亚旅游26 共回答了14个问题 |采纳率100%在反应1中加了CL2,使溶液呈酸性,且让FE2+完全变为FE3+.
第二步中加的两种物质都能和水剧烈反应,生成OH-
但PH不用调很大,使FE3+完全沉淀就行.加MGO是为了提高产量
第三步中加过量CAO,可以调节PH使MG2+也沉淀完全.
我就觉得是这样拉1年前查看全部
- (2010•南京三模)白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.
 (2010•南京三模)白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.
(2010•南京三模)白云石(主要成分为CaCO3,MgCO3)可用作碱性耐火材料和高炉炼铁的溶制等.
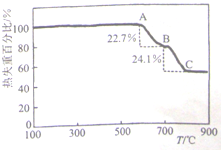
(1)甲同学利用加热法测定白云石中MgCO3的含量,实验曲线如图(MgCO3的分解温度比CaCO3低)
①700℃(即B点)对剩余固体的主要成分为______(填化学式).
②该白云石中MgCO3的质量分数为______(保留3位有效数字).
(2)乙同学利用滴定法测定白云石中MgCO3的含量.已知:①滴定时,EDTA分别有Ca2+或Mg2+以物质的量之比1:1进行反应,可用K-B指示剂作为该滴定反应的指示剂;②实验条件下.Mg2+开始沉淀时的pH为10,沉淀完全时的pH为11.2,Ca2+开始沉淀时的pH为12.
步骤1:准确称取白云石试样m g,在烧杯中用适量稀盐酸完全溶解;
步骤2:冷却后全部转移到250mL容量瓶中定容,
步骤3:从容量瓶中移取试液25.00mL,用NaOH溶液调节溶液pH约为9.5;
步骤4:加入2滴K-B指示剂,以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V1mL;
步骤5:再从容量瓶中移取试液25.00mL,______;
步骤6:加入2滴K-B指示剂,继续以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V2mL.
①根据上述分析数据,测得该白云石试样中MgCO3的质量分数为
%84c(V1−V2) m (用含字母的代数式表示).
%84c(V1−V2) m
②配制100mL c mol/L EDTA标准溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒,______. 带劲妞1年前1
带劲妞1年前1 -
 irenelyl1 共回答了22个问题
irenelyl1 共回答了22个问题 |采纳率90.9%解题思路:(1)①根据信息,碳酸镁分解温度比碳酸钙的低,白云石中先分解的是碳酸镁,分析图象曲线变化特征,图象中A到B过程是碳酸镁分解,BC段是碳酸钙分解;
②设混合物为100g,热失重比22.7%,则碳酸镁分解失重22.7g为碳酸镁分解生成的二氧化碳,依据化学方程式计算出碳酸镁恰好分解时的质量,得到碳酸镁的含量;
(2)①从容量瓶中移取试液25.00mL,用NaOH溶液调节溶液pH约为9.5;镁离子和钙离子全部和c mol/L的EDTA标准溶液反应消耗EDTA溶液V2mL,再从容量瓶中移取试液25.00mL,用NaOH溶液调节pH至11.2~12之间,镁离子全部沉淀,加入2滴K-B指示剂,继续以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V2mL,是钙离子和c mol/L的EDTA标准溶液反应消耗的溶液体积,依据两次滴定数据可以计算镁离子和c mol/L的EDTA标准溶液反应的体积为(V1-V2)ml,依据滴定时,EDTA分别有Ca2+或Mg2+以物质的量之比1:1进行反应计算碳酸镁质量分数;
②依据溶液配制过程和操作选择所需玻璃仪器.(1)①根据信息,碳酸镁分解温度比碳酸钙的低,白云石中先分解的是碳酸镁,分析图象曲线变化特征,图象中A到B过程是碳酸镁分解,MgCO3
△
.
MgO+CO2↑,BC段是碳酸钙分解,所以B点得到固体为MgO和CaCO3,故答案为:MgO和CaCO3;
②B点是碳酸镁恰好分解时的质量变化,设混合物为100g,热失重比22.7%,则碳酸镁分解失重22.7g为碳酸镁分解生成的二氧化碳,
MgCO3
△
.
MgO+CO2↑,
84 44
m 22.7g
m=43.3g
则碳酸镁质量分数为43.3%或0.433,
故答案为:43.3%或0.433;
(2)从容量瓶中移取试液25.00mL,用NaOH溶液调节溶液pH约为9.5;镁离子和钙离子全部和c mol/L的EDTA标准溶液反应消耗EDTA溶液V2mL,再从容量瓶中移取试液25.00mL,用NaOH溶液调节pH至11.2~12之间,镁离子全部沉淀,加入2滴K-B指示剂,继续以c mol/L的EDTA标准溶液滴定至终点,消耗EDTA溶液V2mL,是钙离子和c mol/L的EDTA标准溶液反应消耗的溶液体积,依据两次滴定数据可以计算镁离子和c mol/L的EDTA标准溶液反应的体积为(V1-V2)ml,依据滴定时,EDTA分别有Ca2+或Mg2+以物质的量之比1:1进行反应计算碳酸镁质量分数,
故答案为:用NaOH溶液调节pH至11.2~12之间;
①250ml溶液中碳酸镁的质量分数=
(V1−V2)×10−3L×cmol/L×84g/mol
mg×10×100%=
84c(V1−V2)
m%,故答案为:
84c(V1−V2)
m%;
②依据配制溶液的步骤是计算、量取用量筒,溶解用烧杯和玻璃棒,转移玻璃棒,洗涤一并转移到100ml的容量瓶,最后用胶头滴管定容,配制100mL c mol/L EDTA标准溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了实验探究物质组成实验过程和计算分析应用,滴定实验的原理应用,图象理解判断是解题关键,题目难度较大.1年前查看全部
- 白云石元素含量的测定用分析化学方法来做,究竟用什么方案啊
白云石元素含量的测定用分析化学方法来做,究竟用什么方案啊
白云石中的钙镁铁铝都怎末滴定啊?如何计算啊 斗斗星1年前1
斗斗星1年前1 -
 梦醒天亮 共回答了17个问题
梦醒天亮 共回答了17个问题 |采纳率100%一、实验目的
1.学习酸溶法的溶样方法.
2.掌握配位滴定法测定石灰石中钙、镁含量的方法和原理.
3.学习采用掩蔽剂消除共存离子的干扰.
二、实验原理
石灰石、白云石的主要成分是caco3 和mgco3 以及少量fe、al、si等杂质,采用掩蔽剂即可消除共存离子的干扰,故通常不需分离直接滴定.试样用hcl溶解后,钙镁等以ca2+、mg2+离子进入溶液,试样中含有少量铁铝等干扰杂质,滴定前在酸性条件下加入三乙醇胺掩蔽.
调节试液ph=10,用铬黑t作指示剂,用edta标准溶液滴定试液中ca、mg总量;于另一份试液中,调节ph≥12,mg2+生成mg(oh)2 沉淀,用钙指示剂作指示剂,用edta标准溶液单独滴定ca2+.
三、仪器、药品
edta标准溶液、1:1hcl溶液、nh3—nh4cl缓冲溶液、10%naoh
1:1 三乙醇胺、钙指示剂、铬黑t指示剂;fa/ja1004型电子天平.
四、实验步骤
1、试液的制备:准确称取0.35~0.45g 试样于烧杯中,加水数滴润湿,盖以表面皿,从烧杯嘴慢慢加入1:1hcl 5ml,加热使之溶解.反应停止后用1:1hcl检验试样溶解是否完全.将试样全溶后,冷却、定量转移入250ml容量瓶中,用纯水稀至刻度后摇匀.
2、钙含量的测定:用移液管吸取试液25.00ml于锥形瓶中,加1:1 三乙醇胺3ml,加水25ml,加10%naoh 4ml调节试液ph≥12,加米粒大小(0.01g)钙指示剂.摇匀后用edta标准溶液滴定,溶液由红色变为纯蓝色即为终点.平行测定三次.
3、钙、镁总量测定:另外吸取25.00ml试样溶液于锥形瓶中,加1:1 三乙醇胺5ml,水25ml稀释,摇匀后加入nh3—nh4cl缓冲溶液5ml调节试液ph为10,加入米粒大小(0.01g)的铬黑t,用edta 标准溶液滴定,溶液由紫红色转变为纯蓝色即为终点.平行测定三次.1年前查看全部
- 氧气顶吹炼钢时如何快速计算出加入石灰和白云石等造渣剂的量
氧气顶吹炼钢时如何快速计算出加入石灰和白云石等造渣剂的量
假如知道了铁水中Si和P的量是多少,如何计算!给个详细的工式,如果Si是90,P是60,废钢是钢管头,那么石灰和白云石各应该是多少呀!再次谢谢师傅们了!小弟我刚学炼钢呀! ruidancin1年前1
ruidancin1年前1 -
 goingwithme 共回答了15个问题
goingwithme 共回答了15个问题 |采纳率100%1、石灰加入量主要根据铁水中Si、P含量和炉渣碱度来确定
(1)、炉渣碱度的确定.碱度高低主要根据铁水成份而定,一般来说,铁水含P、S量低,炉渣碱度控制在2.8-3.2;中等P、S含量的铁水,炉渣碱度控制在3.2-3.5;P、S含量较高的铁水,炉渣碱度控制在3.5-4.0.
(2)、石灰加入量的计算
铁水含P小于0.3%:石灰加入量(Kg/t)=2.14【%Si】*碱度*1000/%CaO有效
式中:%CaO有效指石灰中有效CaO含量,%CaO有效=%CaO石灰-碱度%SiO2石灰,一般值都在90%左右
2.14指SiO2与Si的分子量之比.
铁水含P大于0.3%:石灰加入量(Kg/t)=2.2(【%Si】+【%P】)*碱度*1000/%CaO有效
式中2.2指1/2{(SiO2/Si)+(P2O5/P)},即分子量之比的平均值
2、白云石加入量的确定 白云石加入量根据炉渣中所要求的MgO含量来确定,一般炉渣中MgO含量控制在6-8%.炉渣中的MgO含量由石灰、白云石和炉衬侵蚀的MgO带入,故在确定白云石加入量时要考虑他们的相互影响.
(1)白云石应加入量(Kg/t)=渣量%(%MgO)*1000/白云石中MgO含量
(2)白云石时间加入量=应加入量-石灰中MgO折算的白云石量-炉衬侵蚀带入MgO折算的白云石量1年前查看全部
- 石灰岩和白云岩(方解石和白云石)的鉴定特征是什么,尽量完整,
石灰岩和白云岩(方解石和白云石)的鉴定特征是什么,尽量完整,
尽量完整阿 能想到几条回答几条吧 羽落无痕1年前1
羽落无痕1年前1 -
 爱拖鞋的女孩 共回答了24个问题
爱拖鞋的女孩 共回答了24个问题 |采纳率87.5%石灰岩鉴定特征:菱面体完全解理,硬度不大,加稀盐酸剧烈起泡.
石灰岩是分布最广的矿物之一,是组成石灰岩和大理岩的主要成分.在石灰岩地区,溶解在溶液中的重碳酸钙在适宜的条件下沉淀出方解石,形成千姿百态的钟乳石、石笋、石幔、石柱等自然景观.
白云岩白云岩,是一种沉积碳酸盐岩,形成于海洋环境.主要由白云石组成,常混入石英、长石、方解石和粘土矿物.外貌与石灰岩很相似.
鉴定特征:
①呈灰白色,性脆,硬度小,用铁器易划出擦痕.
②遇稀盐酸缓慢起泡或不起泡,并慢慢溶解.而方解石和碳酸盐上滴盐酸后反应剧烈,大量冒泡.
参考资料:岩石与矿物(自然珍藏图鉴丛书)1年前查看全部
- 以白云石(化学式为MgCO3•CaCO3)为原料制备氢氧化镁的工艺流程如图甲所示:
以白云石(化学式为MgCO3•CaCO3)为原料制备氢氧化镁的工艺流程如图甲所示:
白云石在不同温度下受热失重的情况如图乙所示.
(1)根据流程图甲判断白云石“轻烧”后固体产物的主要成份______.则“轻烧”温度应不超过______.
(2)流程图甲中“沉淀”过程的离子方程式为:Mg2++2NH3•H2O
Mg(OH)2↓+2NH4+△ .Mg2++2NH3•H2O.
Mg(OH)2↓+2NH4+△ .
(3)该工艺中可以循环使用的物质是:______、______(填化学式).
(4)传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法,其优点是______、______.
 ly8023kame1年前1
ly8023kame1年前1 -
 闲来无事练打字 共回答了19个问题
闲来无事练打字 共回答了19个问题 |采纳率78.9%解题思路:流程分析白云石主要成分为MgCO3•CaCO3轻烧,从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁,研磨加入水和硫酸铵加热,硫酸铵和氧化镁反应生成氨气、硫酸镁和水,过滤加入氨水生成氢氧化镁沉淀,过滤得到氢氧化镁固体,
(1)从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁;从表中可以看出,温度低于540℃时,物质不分解,高于840℃时,碳酸钙和碳酸镁都分解,因此该温度不超过700℃;
(2)硫酸镁溶液中加入氨水生成氢氧化镁沉淀;
(3)该工艺中可以循环使用的物质是参加反应过程,反应后又生成的物质可以循环使用,流程图分析判断(NH4)2SO4 、NH3或NH3•H2O可以循环使用;
(4)减少能源消耗、便于CaCO3分离.流程分析白云石主要成分为MgCO3•CaCO3轻烧,从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁,研磨加入水和硫酸铵加热,硫酸铵和氧化镁反应生成氨气、硫酸镁和水,过滤加入氨水生成氢氧化镁沉淀,过滤得到氢氧化镁固体;
(1)从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁,分解生成氧化镁,白云石“轻烧”后固体产物的主要成份CaCO3、MgO;从表中可以看出,温度低于540℃时,物质不分解,高于840℃时,碳酸钙和碳酸镁都分解,因此该温度不超过700℃;
故答案为:CaCO3、MgO;700℃;
(2)硫酸镁溶液中加入氨水生成氢氧化镁沉淀,即Mg2++2NH3•H2O
△
.
Mg(OH)2↓+2NH4+,故答案为:Mg2++2NH3•H2O
△
.
Mg(OH)2↓+2NH4+;
(3)该工艺中可以循环使用的物质是参加反应过程,反应后又生成的物质可以循环使用,流程图分析判断(NH4)2SO4 、NH3或NH3•H2O可以循环使用.
故答案为:(NH4)2SO4、NH3或NH3•H2O;
(4)分析流程可知,传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法可以减少能源消耗、便于CaCO3分离;
故答案为:减少能源消耗、便于CaCO3分离.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质分离方法和流程理解应用,主要是混合物分离试剂的作用,产物的分析判断,掌握基础是关键,题目难度中等.1年前查看全部
- 皮江法炼镁工艺原理皮江法生产金属镁是以煅烧白云石为原料、硅铁为还原剂、萤石为催化剂,进行计量配料.粉磨后压制成球,称为球
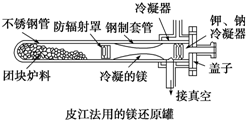 皮江法炼镁工艺原理
皮江法炼镁工艺原理
皮江法生产金属镁是以煅烧白云石为原料、硅铁为还原剂、萤石为催化剂,进行计量配料.粉磨后压制成球,称为球团.将球团装入还原罐中,加热到1200℃,内部抽真空至13.3Pa或更高,则产生镁蒸气.镁蒸气在还原罐前端的冷凝器中形成结晶镁,亦称粗镁.再经熔剂精炼,产生商品镁锭,即精镁.
皮江法炼镁生产工序
(1)白云石煅烧:将白云石在回转窑或竖窑中加热至1100~1200℃,烧成煅白(MgO•CaO).
(2)配料制球:以煅白、硅铁粉和萤石粉计量配料、粉磨,然后压制成球.
(3)还原:将料球在还原罐中加热至1200±10℃,在13.3Pa或更高真空条件下,保持8~10小时,氧化镁还原成镁蒸气,冷凝后成为粗镁.
(4)精炼铸锭:将粗镁加热熔化,在约710℃高温下,用溶剂精炼后,铸成镁锭,亦称精镁.
(5)酸洗:将镁锭用硫酸或硝酸清洗表面,除去表面夹杂,使表面美观.
(注:白云石:CaMg(CO3)2 萤石:CaF)
(1)白云石在回转窑或竖窑中煅烧产生的______是侯德榜制碱法中的原料之一.
(2)在还原罐中发生反应的化学方程式为2MgO+Si
2Mg↑+SiO2高温 .2MgO+Si.
2Mg↑+SiO2高温 .
(3)还原罐抽成真空的目的是______.
(4)从环保角度考虑,精镁酸洗用______(填硫酸或硝酸)洗更好,原因是______.
(5)取经酸洗干燥过的镁4.8克,与足量的盐酸反应完全后,得氢气0.402克,则镁中的杂质可能是______(填元素符号)
A.Zn B.Fe C.Al
若镁仅含上述一种金属杂质,则镁中杂质的质量分数为______.
(6)皮江法炼镁尽管比融盐电解法有优点,但是它也有一定的缺点,试举出皮江法炼镁一个缺点______. Afonso1年前1
Afonso1年前1 -
 yy_snake 共回答了16个问题
yy_snake 共回答了16个问题 |采纳率87.5%解题思路:(1)根据的白云石:CaMg(CO3)2组成、煅烧产物MgO•CaO及侯德榜制碱法的原料进行分析;
(2)还原罐中硅与氧化镁反应生成镁蒸气和二氧化硅;
(3)在空气中镁能够被空气中的氧气氧化,据此进行解答;
(4)根据硫酸、硝酸的化学性质及反应产物进行解答;
(5)根据平均摩尔质量法计算出二价金属的平均摩尔质量,然后进行判断;根据氢气的质量、金属的质量列式计算;
(6)根据消耗能源情况、环境污染方面进行分析.(1)白云石化学式为:CaMg(CO3)2,煅烧得到MgO•CaO,所以反应产物中有二氧化碳生成,二氧化碳为侯氏制碱法的原料,
故答案为:二氧化碳;
(2)在还原罐中氧化镁与硅反应,发生反应的化学方程式为:2MgO+Si
高温
.
2Mg↑+SiO2,
故答案为:2MgO+Si
高温
.
2Mg↑+SiO2;
(3)为了防止已还原的Mg在高温条件下再次被氧化,还原罐需要抽成真空,
故答案为:防止已还原的Mg在高温条件下再次被氧化;
(4)由于硝酸反应产物中有氮的氧化物产物,会造成大气污染,所以应该选用硫酸,
故答案为:硫酸;因为HNO3会产生氮氧化物,污染大气;
(5)4.8克若全部为金属镁,镁的物质的量为0.2mol,完全反应生成氢气0.2mol,质量为0.4g,显然实际生成的氢气偏大,说明相同质量时杂质放出的氢气比镁多,选项中只有Al放出的氢气比镁多;设镁的物质的量为x,铝的物质的量为y,根据混合物总质量可得:24x+27y=4.8,根据氢气的质量可得:2x+3y=0.402,解得:x=0.197mol,所以装置铝的质量分数为:1-[0.197mol×24g/mol/4.8]×100%=1.5%,
故答案为:C;1.5%;
(6)根据反应原理可知,皮江法炼镁消耗的能量较高,环境污染较大,
故答案为:环境污染大,能耗高.点评:
本题考点: 金属冶炼的一般原理;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了金属的冶炼原理、物质的分离与提纯,题目难度较大,试题涉及的知识点较多,题量较大,充分考查了学生对所学知识的掌握情况.1年前查看全部
- 寻求磷酸和白云石改写成氧化物的形式
寻求磷酸和白云石改写成氧化物的形式
磷酸:H3PO4
白云石:KH2Al3Si3O12 网上逛逛1年前1
网上逛逛1年前1 -
 道义放两旁04 共回答了20个问题
道义放两旁04 共回答了20个问题 |采纳率95%磷酸:P2O5·3H2O
白云石:K2O·3Al2O3·6SiO2·2H2O1年前查看全部
- 以白云石(化学式表示为MgCO3•CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示.
以白云石(化学式表示为MgCO3•CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示.
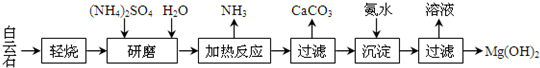
(1)研磨的作用是______.
(2)该工艺中可循环使用的物质是______、______(写化学式).
(3)白云石轻烧的主要产物是MgO•CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是______.
(4)加热反应的离子方程式为______.
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在如图画出373k的曲线.
②由图可知,随着温度升高:______. smtequipment1年前1
smtequipment1年前1 -
 西域散人 共回答了21个问题
西域散人 共回答了21个问题 |采纳率90.5%解题思路:(1)依据影响化学反应速率的因素分析,研磨增大接触面积增大反应速率;(2)依据流程图分析物质在反应过程中又生成的物质可以循环利用;(3)依据节能减排分析流程中 轻烧的目的;(4)轻烧得到MgO•CaCO3,加入硫酸铵和水反应生成氨气是利用铵根离子水解显酸性溶解氧化镁;(5)①温度升高氨气浓度减小,达到平衡所需要的时间缩短,据此画出曲线;②图象分析温度升高速率增大缩短达到平衡的时间,铵根离子浓度减小.(1)研磨增大物质的接触面积,反应速率增大,增大原料的利用率,故答案为:增大固体的表面积,加快反应速率,增大原料利用率;
(2)依据流程分析可知氨气和氯化铵在反应流程中参加反应,反应过程中有生成,可以循环利用,故答案为:NH3、(NH4)2SO4;
(3)轻烧减少能耗和二氧化碳气体的排放,符合节能减排的目的,故答案为:减少能耗、减少CO2的排放等;
(4)轻烧得到MgO•CaCO3,加入硫酸铵和水反应生成氨气是利用铵根离子水解显酸性溶解氧化镁反应的两种方程式为:MgO+2NH4+=Mg2++2NH3↑+H2O,
故答案为:MgO+2NH4+=Mg2++2NH3↑+H2O;
(5)①温度升高氨气浓度减小,达到平衡所需要的时间缩短,据此画出曲线;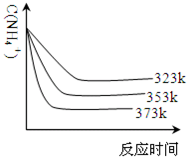 ,
,
故答案为: ;
;
②图象分析可知温度越高,反应速率增大,达到平衡所需要的时间缩短,铵根 两种的浓度减少,故答案为:反应的时间缩短、平衡时c(NH4+)减小.点评:
本题考点: 制备实验方案的设计;镁、铝的重要化合物.
考点点评: 本题考查了物质制备和物质性质的分析应用,制备物质的流程关系是解题关键,题目难度中等.1年前查看全部
- 硅石和白云石分别在炼铁中起到什么的作用
 爱婕Sharon1年前3
爱婕Sharon1年前3 -
 从良小偷 共回答了19个问题
从良小偷 共回答了19个问题 |采纳率100%炼铁就是用一氧化碳或是焦炭还原铁的氧化物,再高温下变成铁水.但铁矿石往往会带有杂质,所以就需要一种类似于吸附剂的东西来清除这些杂质,反应产生凝结物会浮在铁水表面.只要从高炉的底部放出铁水就可以分离出较为纯净的铁水了.1年前查看全部
- 煅烧白云石(CaCO3-MgCO3)后的产物(CaO-MgO)在高温下与硅反应的化学方程式
 langziping1年前3
langziping1年前3 -
 goodwoodcafe 共回答了19个问题
goodwoodcafe 共回答了19个问题 |采纳率94.7%都不和硅反应
CaO+SiO2=高温(1010度)=CaSiO31年前查看全部
- 自然界存在着一种白云石的矿石,其化学式是xCaCO3·yMgCO3.(其中x、y为最小正整数比).
自然界存在着一种白云石的矿石,其化学式是xCaCO3·yMgCO3.(其中x、y为最小正整数比).
称取2.76g白云石,加热到质量不再变化,冷却到室温,再称量固体质量为1.44 g.试通过计算写出白云石的化学式. pcrtt881年前1
pcrtt881年前1 -
 rutyleilei 共回答了25个问题
rutyleilei 共回答了25个问题 |采纳率76%100x+88y=2.76 56x+40y=1.44 x=0.01759 y=0.01138 再用两数值比下1年前查看全部
- 白云石主要成分是 碳酸钙和碳酸镁的 混合物 白云石遇酸遇碱分别有什么反应?
白云石主要成分是 碳酸钙和碳酸镁的 混合物 白云石遇酸遇碱分别有什么反应?
白云石为三方晶系,化学成份为CaMg(CO3)2,主要是由碳酸钙与碳酸镁所组成的矿物(CaCO3与MgCO3的比例大 白云石胶结物致为1:1)白云石遇酸 遇碱分别有什么反应? xiaozhzh1年前1
xiaozhzh1年前1 -
 楼兰女巫 共回答了21个问题
楼兰女巫 共回答了21个问题 |采纳率95.2%和酸反应:CaMg(CO3)2+4HCl=CaCl2+MgCl2+2CO2↑+2H2O 遇碱不反应,固体物质不能和碱反应1年前查看全部
- 以白云石(化学式表示为 MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下
以白云石(化学式表示为 MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下
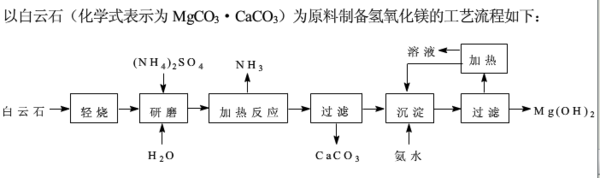
题目中给出轻烧后是mgo和caco3,我想问的是 过滤的时候把caco3除掉 ,那么mgo又是在哪一步溶解呢? mgo不溶于水,如果是(NH4)2SO4酸性溶解的话,那为什么酸性环境不是优先溶解CACO3而是MGO? 小笼生煎10151年前1
小笼生煎10151年前1 -
 dzhdhz 共回答了13个问题
dzhdhz 共回答了13个问题 |采纳率84.6%你理解错了.在这里,硫酸铵和白云灰(白云石煅烧产物)与水反应过程首先反应生成氢氧化镁和氢氧化钙,这是一个水合反应过程.然后继续反应,得到溶解度小的硫酸钙和溶解度大的硫酸镁(硫酸铵对氢氧化镁有助溶作用),同时蒸发出氨.另外,过滤得到的是硫酸钙和硫酸镁的混合溶液,不是碳酸钙.1年前查看全部
- 方解石与白云石在显微镜下怎样区别
 杳窅1年前2
杳窅1年前2 -
 三要三不要 共回答了16个问题
三要三不要 共回答了16个问题 |采纳率87.5%一、白云石常呈菱形自形状,自形程度高于方解石
二、方解石双晶平行于菱形长对角线,白云石双晶平行于菱形短对角线1年前查看全部
- 白云石中镁含量
 adw4e21年前3
adw4e21年前3 -
 大浪淘沙118 共回答了17个问题
大浪淘沙118 共回答了17个问题 |采纳率88.2%料白云石是碳酸钙和碳酸镁的复盐,分子式为CaCO3·MgCO3,六方晶系,比重2.80~2.99,莫氏硬度3.4.5,理论组成为CaO30.41%、MgO21.87%、CO247.72%,CaO/MgO比为1.39.
镁的含量为21.87%.1年前查看全部
- 白云石CaMg(CO3)2 里面Mg的质量百分数是多少 摩尔百分数是多少 怎么算的呀
 爱朋的兰1年前1
爱朋的兰1年前1 -
 孤行千里 共回答了16个问题
孤行千里 共回答了16个问题 |采纳率93.8%没听说过摩尔百分数.
镁的质量百分数为24/184*100%=13.0%1年前查看全部
- 冶炼金属镁对原料白云石成分含量的要求,
 shang_34341年前1
shang_34341年前1 -
 watshs 共回答了22个问题
watshs 共回答了22个问题 |采纳率81.8%综合鹿泉白云石性能分析可知:化学成分分析,物相组成分析,热性能分析 鹿泉白云石碳酸钙和碳酸镁的含量为87.45%,92...和成分分析 获得活性氧化镁的滤液285ml再和白云石反应 后,得到的滤液经烘干后的质量是11.6g 滤液成份含量CaCl21年前查看全部
- CaMg[CO3]2怎么读我知道是叫白云石,但是化学式怎么读啊还有磷灰石Ca5[PO4]3(F,OH) 怎么读,
 真情永不变steven1年前2
真情永不变steven1年前2 -
 其实俺不想拍2 共回答了17个问题
其实俺不想拍2 共回答了17个问题 |采纳率94.1%钙镁碳酸盐
磷酸盐矿物1年前查看全部
- 姐姐哥哥请问,白云石,石灰石,芒硝,纯碱的密度多少啊
 2753608421年前1
2753608421年前1 -
 flyet008 共回答了22个问题
flyet008 共回答了22个问题 |采纳率86.4%白云石: 2.86g/cm 3 ~ 3.20g/cm 3
石灰石:密度为2.7g/cm3.
芒硝:1.48g/cm3
纯碱:2.532g/cm31年前查看全部
- 白云石元素含量的测定用分析化学方法来做,究竟用什么方案啊如题
白云石元素含量的测定用分析化学方法来做,究竟用什么方案啊如题
白云石中的钙镁铁铝都怎末滴定啊?如何计算啊 樱粟1年前1
樱粟1年前1 -
 剑舞清影 共回答了21个问题
剑舞清影 共回答了21个问题 |采纳率81%一、实验目的 1.学习酸溶法的溶样方法.2.掌握配位滴定法测定石灰石中钙、镁含量的方法和原理.3.学习采用掩蔽剂消除共存离子的干扰.二、实验原理 石灰石、白云石的主要成分是caco3 和mgco3 以及少量fe、al、si等杂质,采用掩蔽剂即可消除共存离子的干扰,故通常不需分离直接滴定.试样用hcl溶解后,钙镁等以ca2+、mg2+离子进入溶液,试样中含有少量铁铝等干扰杂质,滴定前在酸性条件下加入三乙醇胺掩蔽.调节试液ph=10,用铬黑t作指示剂,用edta标准溶液滴定试液中ca、mg总量;于另一份试液中,调节ph≥12,mg2+生成mg(oh)2 沉淀,用钙指示剂作指示剂,用edta标准溶液单独滴定ca2+.三、仪器、药品 edta标准溶液、1:1hcl溶液、nh3—nh4cl缓冲溶液、10%naoh 1:1 三乙醇胺、钙指示剂、铬黑t指示剂;fa/ja1004型电子天平.四、实验步骤 1、试液的制备:准确称取0.35~0.45g 试样于烧杯中,加水数滴润湿,盖以表面皿,从烧杯嘴慢慢加入1:1hcl 5ml,加热使之溶解.反应停止后用1:1hcl检验试样溶解是否完全.将试样全溶后,冷却、定量转移入250ml容量瓶中,用纯水稀至刻度后摇匀.2、钙含量的测定:用移液管吸取试液25.00ml于锥形瓶中,加1:1 三乙醇胺3ml,加水25ml,加10%naoh 4ml调节试液ph≥12,加米粒大小(0.01g)钙指示剂.摇匀后用edta标准溶液滴定,溶液由红色变为纯蓝色即为终点.平行测定三次.3、钙、镁总量测定:另外吸取25.00ml试样溶液于锥形瓶中,加1:1 三乙醇胺5ml,水25ml稀释,摇匀后加入nh3—nh4cl缓冲溶液5ml调节试液ph为10,加入米粒大小(0.01g)的铬黑t,用edta 标准溶液滴定,溶液由紫红色转变为纯蓝色即为终点.平行测定三次.1年前查看全部
- 白云石 是哪一类的岩石 变质岩 沉积岩 还是 岩浆岩
 主要有三点1年前1
主要有三点1年前1 -
 lk8168194 共回答了14个问题
lk8168194 共回答了14个问题 |采纳率100%白云石无法简单归类,它是一种分布很广的造岩矿物,即属于碳酸盐类沉积岩,又是一种超基性碱性岩浆岩.1年前查看全部
大家在问
- 1若定义:双曲线的对称轴与双曲线交点即为双曲线的顶点,则双曲线(x-1)(y-1)=4的实轴长为__
- 2存储单位"K,M(兆),G,T,E"汉语里如何读?
- 3硫酸氢钠与氢氧化钡反应方程式怎么写?
- 4在△ABC中,角A、B、C的对边分别为a、b、c,已知向量m=(a+c,b-a)n=(a-c,b),且m⊥n.
- 5给祖国母亲的一封信 作文
- 6求《诗经·无衣》一文及解释
- 72x的平方-4xy-二分之一y的平方-2x的平方-1+二分之一y的平方,y=负四分之一,x=2
- 8(2011•嘉定区三模)设n∈N*,(2x+1)n展开式各项系数之和为an,(3x+1)n展开式各项系数之和为bn,则l
- 9一种像狒狒的动物读音是 山QIAO,第二个字不会读,脸上是红鼻子白脸蓝额头的家伙.那个字怎么打还有这种动物的基本介绍
- 109.8*5.6-46*0.98.(25-0.2)/(1/0.25)简便运算
- 11English is spoken worldwide,这句话中WORLDWIDE是副词来表达前面的意思?
- 12数列收敛 数列有极限 数列有界的区别的联系
- 13“嫦娥三号”探测器携带“玉兔号”月球车于2013年12月14日成功落月。回答下列各题。
- 14“废墟”的“墟”是什么意思
- 15not until的事态用法He didn't leave his office until he ____(finis

