氯化氨有离子键么
 今年夏天的事情2022-10-04 11:39:541条回答
今年夏天的事情2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 albatross5424 共回答了17个问题
albatross5424 共回答了17个问题 |采纳率100%- 氯离子与氨跟离子直接是离子键
- 1年前
相关推荐
- 氯化氨、氯化钙不同浓度水溶液的冰点是多少?有知道的朋友吗?
氯化氨、氯化钙不同浓度水溶液的冰点是多少?有知道的朋友吗?
还有冬季用它们的水溶液洗玻璃之后,会不会在玻璃上残留白色结晶物?
例如:氯化氨和氯化钙水溶液浓度分别为5%、10%、15%、20%时,其相应的冰点是多少?最好是实测温度。 fengqingjian1年前1
fengqingjian1年前1 -
 弥勒未生 共回答了21个问题
弥勒未生 共回答了21个问题 |采纳率76.2%稀溶液有依数性:稀溶液的依数性是说溶液的某些性质与溶质的粒子数的多少有关,与溶质本性无关.依数性分别用拉乌尔定律、沸点升高、凝固点降低和渗透压公式定量描述.
由于稀溶液有依数性,所以会造成融业的凝固点降低(拉乌尔定律)
稀溶液当冷却到凝固点时析出的可能是纯溶剂,也可能是溶剂和溶质一起析出.当只析出纯溶剂时,即与固态纯溶剂成平衡的稀溶液的凝固点Tf比相同压力下纯溶剂的凝固点T*f低,实验结果表明,凝固点降低的数值与稀溶液中所含溶质的数量成正比,比例系数kf叫凝固点下降系数它与溶剂性质有关而与溶质性质无关.
有公式可以算出来:
不同浓度的溶液的凝固点t=原来的凝固点+凝固点降低常数×质量摩尔浓度
冬季用他们的水溶液洗过玻璃,氯化钙应该会留下白色结晶物
那个我没有实际测过,所以我也不太清楚,不好意思1年前查看全部
- (大学分析化学)用银量法测定下列试样(1)氯化钡 (2)氯化钾 (3)氯化氨(4)KSCN
(大学分析化学)用银量法测定下列试样(1)氯化钡 (2)氯化钾 (3)氯化氨(4)KSCN
还有(5)碳酸钠+氯化钠(6)NaBr
各 应选择何种方法确定终点 为什么 顶yy1年前1
顶yy1年前1 -
 兄弟有烟不 共回答了17个问题
兄弟有烟不 共回答了17个问题 |采纳率76.5%莫尔法钡离子和碳酸根有干扰,富哈弗的发用铁铁铵矾做指示剂,1.氯化钡只能用法扬司法2.绿化钾,3.绿化铵和6溴化钠三种任选,4用佛哈弗德返定法,5先用福哈弗的测氯化钠后过滤再1年前查看全部
- 下列物质的化学式和名称都正确的是( ) A.胆矾CuSO 4 B.氯化氨NH 4 Cl C.氦气He 2 D.碳酸氢钙
下列物质的化学式和名称都正确的是( ) A.胆矾CuSO 4 B.氯化氨NH 4 Cl C.氦气He 2 D.碳酸氢钙Ca(HCO 3 ) 2  红色水星1年前1
红色水星1年前1 -
 花的嫁纱janey 共回答了20个问题
花的嫁纱janey 共回答了20个问题 |采纳率85%A、胆矾 蓝矾,铜矾,五水硫酸铜,CuSO 4 .5H 2 O,故A化学式和名称不符合;
B、氯化铵化学式为:NH 4 Cl;故B化学式和名称不符合;
C、稀有气体元素组成的单质是单原子分子,所以氦气的化学式就是表示氖元素的元素符号及He;故C化学式和名称不符合;
D、碳酸氢钙 化学式为 Ca(HCO 3 ) 2 ,故D化学式和名称都正确
故选D.1年前查看全部
- (1/2)臭氧是一种强氧化剂、常用于消毒和废水的处理.1.用臭氧处理氯化氨的废水时生成的两种无污染单质...
(1/2)臭氧是一种强氧化剂、常用于消毒和废水的处理.1.用臭氧处理氯化氨的废水时生成的两种无污染单质...
(1/2)臭氧是一种强氧化剂、常用于消毒和废水的处理.1.用臭氧处理氯化氨的废水时生成的两种无污染单质是()和(),反应后溶液中的溶质是()<填 翡冷翠女子1年前4
翡冷翠女子1年前4 -
 279124007 共回答了18个问题
279124007 共回答了18个问题 |采纳率94.4%臭氧是一种强氧化剂、常用于消毒和废水的处理.1.用臭氧处理氯化氨的废水时生成的两种无污染单质是 N2 和 O2,反应后溶液中的溶质是 HCl1年前查看全部
- 化学平衡问题,高中请问醋酸钠溶液,如果升温的话,醋酸分子浓度如何变化? 如果加入氯化氨的话,它的ph如何变化?有劳大家啦
化学平衡问题,高中
请问醋酸钠溶液,如果升温的话,醋酸分子浓度如何变化? 如果加入氯化氨的话,它的ph如何变化?有劳大家啦!谢谢! 甜蜜十一月1年前4
甜蜜十一月1年前4 -
 易声 共回答了14个问题
易声 共回答了14个问题 |采纳率92.9%二楼第一句纯粹误人子弟,不要信,很简单,放热还是吸热就和能量有关系,化学键断裂就要吸收能量就要吸热,相反的,形成化学键就要放出能量,就要放热,溶解是一个化学键断裂的过程,所以溶解吸热,与之相对,水解就是形成化学键的过程,也就会放热,升高温度,反应平衡向吸热方向移动.醋酸分子溶解,所以,醋酸分子浓度减小.
第二个,PH值其实就是反应溶液中氢离子浓度的数值,就看看氢离子浓度怎么变化就行了.这里先说明一下相同浓度的醋酸和氨水溶液中相应的氢离子和氢氧根离子浓度相差很小,也就是说,醋酸铵溶液的PH接近于7.再来看这道题哈,向醋酸钠溶液中加入氯化铵,这里醋酸钠和氯化铵肯定要发生双水解反应的,那我们就不妨假设醋酸钠溶液过量(氯化铵过量就不用解释了,溶液PH肯定小于7了,小学生都知道增大还是减小),既然醋酸钠溶液过量,我们就先拿出来一部分醋酸钠恰好和这部分氯化铵反应完全,现在反应完全的这部分溶液中就是氯化钠和醋酸铵,然后醋酸铵再分解,前面都说了,醋酸铵溶液PH接近于7,所以,现在反应完全的这部分溶液PH也就接近于7,现在再把这部分溶液加回到原来的醋酸钠溶液当中,其实就是和加水没什么两样,也就是说醋酸钠溶液相当于被稀释了,醋酸钠的浓度减小了,然后就简单了,醋酸钠的浓度减小,PH肯定就是降低了.
像这种双水解啊还有其他的一些双重变化的题,就是想办法把这两种变化分开,逐一讨论,就简单多了,不然根本看不出来,就比如这道题,乍一看加完氯化铵,肯定双水解,醋酸分子也多了,然后还填了氨分子,到底增大还是减小,乍一看谁也看不出来,分开以后看就简单多了1年前查看全部
- 我是做水质简分析的,请问一下做总硬时,加氯化氨缓冲液后有一点沉淀颜色开始是绿色,慢慢变绿黄色,加了铬黑T变成酒红色后没有
我是做水质简分析的,
请问一下做总硬时,加氯化氨缓冲液后有一点沉淀颜色开始是绿色,慢慢变绿黄色,加了铬黑T变成酒红色后没有沉淀,请问水中是不是含有铁离子?这个颜色不是太好辩认,加了四滴盐酸羟胺颜色也没有变,能用其他遮蔽剂吗? 天xin崖1年前2
天xin崖1年前2 -
 woshibaijiazi 共回答了16个问题
woshibaijiazi 共回答了16个问题 |采纳率100%加氯化铵缓冲溶液,只是调节水样的pH值,跟硬度无关,加铬黑T后呈酒红色说明水样中有硬度,也可能是有铜铁离子干扰,也可加两毫升硫化钠掩蔽剂,以消除干扰.一定要先加掩蔽剂,后加缓冲溶液,最后再加硬度指示剂.若还显现酒红色,就用EDTA滴定至蓝紫色,就为它的硬度终点.1年前查看全部
- 将氯化氨稀溶液滴入氢氧化钠固体为什么不能制取氨气
 琼海男孩恋之爱1年前1
琼海男孩恋之爱1年前1 -
 ppfish999 共回答了21个问题
ppfish999 共回答了21个问题 |采纳率95.2%稀溶液中铵根离子与氢氧根离子结合生成一水合氨,氯化铵稀溶液中滴加少量氢氧化钠稀溶液,反应的离子方程式为NH4++OH-═NH3•H2O1年前查看全部
- 氯化氨加热后酸性怎么变?加热冷却后PH和加热前的一样吗?
 紫色的魔鬼1年前2
紫色的魔鬼1年前2 -
 130443426 共回答了19个问题
130443426 共回答了19个问题 |采纳率89.5%加热
NH4Cl====NH3+HCl
生成HCl变为酸性,PH降低1年前查看全部
- 氯化氨与锌反应化学方程式反应的化学方程式是什么?
 邪雨飞花1年前4
邪雨飞花1年前4 -
 busibird 共回答了19个问题
busibird 共回答了19个问题 |采纳率89.5%化合反应
1、镁在空气中燃烧:2Mg + O2 点燃 2MgO
2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
4、氢气在空气中燃烧:2H2 + O2 点燃 2H2O
5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
6、硫粉在空气中燃烧: S + O2 点燃 SO2
7、碳在氧气中充分燃烧:C + O2 点燃 CO2
8、碳在氧气中不充分燃烧:2C + O2 点燃 2CO
9、二氧化碳通过灼热碳层: C + CO2 高温 2CO
10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3
12、生石灰溶于水:CaO + H2O === Ca(OH)2
13、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O
14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl
分解反应
15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑
16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17、水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
18、碳酸不稳定而分H2CO3 === H2O + CO2↑
19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2↑
置换反应
20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑
22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑
23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
24、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO
27、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
其他
28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4
29、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
32、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O
35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
一. 物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
二.几个分解反应:
13. 水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑
15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑
16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17. 碳酸不稳定而分H2CO3 === H2O + CO2↑
18. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑
三.几个氧化还原反应:
19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑
23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
24. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑
31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑
32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑
33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑
(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg
(3)碱性氧化物 +酸 -------- 盐 + 水
37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水
43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O
(5)酸 + 碱 -------- 盐 + 水
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O
51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O
57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
(6)酸 + 盐 -------- 另一种酸 + 另一种盐
59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl
(7)碱 + 盐 -------- 另一种碱 + 另一种盐
65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4
66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl
67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl
68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl
69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH
(8)盐 + 盐 ----- 两种新盐
70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3
71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
五.其它反应:
72.二氧化碳溶解于水:CO2 + H2O === H2CO3
73.生石灰溶于水:CaO + H2O === Ca(OH)2
74.氧化钠溶于水:Na2O + H2O ==== 2NaOH
75.三氧化硫溶于水:SO3 + H2O ==== H2SO4
76.硫酸铜晶体受热分CuSO4·5H2O 加热 CuSO4 + 5H2O
77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2
化学方程式 反应现象 应用
2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟 白色信号弹
2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体 拉瓦锡实验
2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体
4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体
3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3
C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊
S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰
2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 高能燃料
4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量
CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 甲烷和天然气的燃烧
2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 氧炔焰、焊接切割金属
2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体 实验室制备氧气
2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体 实验室制备氧气
2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体 拉瓦锡实验
2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气 电解水
Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体 铜绿加热
NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体 碳酸氢铵长期暴露空气中会消失
Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解 实验室制备氢气
Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解
2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性
Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性
WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性
MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性
2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、
H2+Cl2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验
2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因
2C O+O2点燃2CO2 蓝色火焰 煤气燃烧
C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属
2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属
Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属
C + CO2 高温2CO
CO2 + H2O = H2CO3 碳酸使石蕊变红 证明碳酸的酸性
H2CO3 ΔCO2↑+ H2O 石蕊红色褪去
Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁
CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化
Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.钟乳石的形成
2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头
CaCO3 高温 CaO+ CO2↑ 工业制备二氧化碳和生石灰
CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理
Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理
MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体
CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体 冶炼金属
Fe2O3+3CO高温 2Fe+3CO2 冶炼金属原理
Fe3O4+4CO高温 3Fe+4CO2 冶炼金属原理
WO3+3CO高温 W+3CO2 冶炼金属原理
CH3COOH+NaOH=CH3COONa+H2O
2CH3OH+3O2点燃2CO2+4H2O
C2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热 酒精的燃烧
Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质 湿法炼铜、镀铜
Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色 Cu+Hg(NO3)2=Hg+ Cu (NO3)2
Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质 镀银
Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质 镀铜
Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色 铁器除锈
Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解
Na2O+2HCl=2NaCl+H2O 白色固体溶解
CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色
ZnO+2HCl=ZnCl2+ H2O 白色固体溶解
MgO+2HCl=MgCl2+ H2O 白色固体溶解
CaO+2HCl=CaCl2+ H2O 白色固体溶解
NaOH+HCl=NaCl+ H2O 白色固体溶解
Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解
Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解
Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解 胃舒平治疗胃酸过多
Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色
Ca(OH)2+2HCl=CaCl2+2H2O
HCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸 检验Cl—的原理
Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色 铁器除锈
Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解
CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色
ZnO+H2SO4=ZnSO4+H2O 白色固体溶解
MgO+H2SO4=MgSO4+H2O 白色固体溶解
2NaOH+H2SO4=Na2SO4+2H2O
Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解
Ca(OH)2+H2SO4=CaSO4+2H2O
Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解
2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解
2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色
Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
Na2O+2HNO3=2NaNO3+H2O 白色固体溶解
CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色
ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解
MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解
CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解
NaOH+HNO3=NaNO3+ H2O
Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解
Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解
Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解
Ca(OH)2+2HNO3=Ca(NO3)2+2H2O
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色
3NaOH + H3PO4=3H2O + Na3PO4
3NH3+H3PO4=(NH4)3PO4
2NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、
2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)
FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成
AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成
MgCl2+2NaOH = Mg(OH)2↓+2NaCl
CuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成
CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、 生石灰制备石灰浆
Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成 初中一般不用
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成 工业制烧碱、实验室制少量烧碱
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成
Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成
CuSO4+5H2O= CuSO4·H2O 蓝色晶体变为白色粉末
CuSO4·H2OΔ CuSO4+5H2O 白色粉末变为蓝色 检验物质中是否含有水
AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应) 应用于检验溶液中的氯离子
BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应) 应用于检验硫酸根离子
CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成
MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
MgCO3+2HCl= MgCl2+H2O+ CO2 ↑
NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体 应用于检验溶液中的铵根离子
NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体1年前查看全部
- 通常情况下,氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,形成的溶液是氨水.实验室用加热氯化氨
通常情况下,氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,形成的溶液是氨水.实验室用加热氯化氨和消石灰的固体混合物制取氨气如图是实验室常用的装置.请回答:
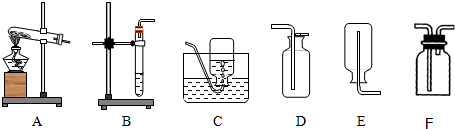
(1)实验室制取氨气的发生装置,可选用______(填装置编号);该装置还可用于在实验室制取______.
(2)收集氨气,应采用的装置为______(填装置编号);且集气瓶必须______.
(3)若用F装置收集氨气,则氨气应从______端进入.
(4)实验室制取氨气时,为防止多余的氨气逸散到空气中,可用______吸收.
(5)把收集满氨气的集气瓶倒扣入盛有足量水的水槽中,可观察到的现象是______. 仓位1年前1
仓位1年前1 -
 bobozq 共回答了13个问题
bobozq 共回答了13个问题 |采纳率69.2%解题思路:(1)实验室制取氨气时需要加热,应该用A装置作为发生装置,实验室可以利用加热高锰酸钾或氯酸钾的方法制取氧气;
(2)根据氨气的性质可以选择收集的方法;
(3)根据装置的特点可以选择气体的导入端;
(4)因为氨气极易溶于水,可以用水吸收氨气;
(5)根据氨气的性质可以判断出现的实验现象.(1)实验室制取氨气时需要加热,应该用A装置作为发生装置,该装置还可用于在实验室制取氧气.
故填:A;氧气.
(2)氨气极易溶于水,不能用排水法收集,密度比空气小,可以用向下排空气法收集,即用E装置收集,因为氨气极易溶于水,所以集气瓶必须是干燥的.
故填:E;干燥.
(3)若用F装置收集氨气,由于氨气的密度比空气小,则氨气应从短导管端进入.
故填:短导管.
(4)实验室制取氨气时,为防止多余的氨气逸散到空气中,可用水吸收.
故填:水.
(5)把收集满氨气的集气瓶倒扣入盛有足量水的水槽中,氨气会全部溶于水,导致液体进入集气瓶,可观察到的现象是液体充满集气瓶.
故填:液体充满集气瓶.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法.
考点点评: 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.1年前查看全部
- 3cl2+8Nh3=6Nh4cl+N2 当有106.5克氯化氨产生时,被氧化的氨气在标况下体积是多少?
 shenholmes1年前1
shenholmes1年前1 -
 youngsjun 共回答了18个问题
youngsjun 共回答了18个问题 |采纳率94.4%3C2+ 8NH3 = 6NH4Cl +N2
从中可以看出:只有2molNH3被氧化
8NH3------2NH3 -------6NH4Cl
2*22,4 6* 53.5
V(NH3) 106.5 V(NH3)= 14.9(L) 答:略1年前查看全部
- 加热时分解,恢复室温又生成此物质,则该物质是氯化氨还是碳酸氨,为什么?
 shouhang123451年前3
shouhang123451年前3 -
 丑人多作怪啊 共回答了18个问题
丑人多作怪啊 共回答了18个问题 |采纳率94.4%氯化铵受热分解生成氯化氢和氨气,恢复室温即可又生成氯化铵;
而碳酸铵受热分解生成二氧化碳、水和氨气,即使氨气溶于水中,二氧化碳也不易与其反应.1年前查看全部
- 氯化氨和氢氧化钙固体生成什么?
 7Small1年前1
7Small1年前1 -
 dajtwmd 共回答了17个问题
dajtwmd 共回答了17个问题 |采纳率100%生成氯化钙,水和氨气1年前查看全部
- 氯化氨与氢氧化钙的反应方程式
 超级小甜心1年前1
超级小甜心1年前1 -
 冰之灵520 共回答了17个问题
冰之灵520 共回答了17个问题 |采纳率100%2 NH4Cl + Ca(OH)2 = CaCl2 + 2 NH3↑+ 2 H2O1年前查看全部
- 请问氯化氨和碳酸钙能发生反映吗?等用,谢.
请问氯化氨和碳酸钙能发生反映吗?等用,谢.
含有氯化氨的液体中能否加入碳酸钙类物质,谢谢. 一也11年前1
一也11年前1 -
 tianyaxongdi 共回答了14个问题
tianyaxongdi 共回答了14个问题 |采纳率85.7%可以啊.产生氨气、二氧化碳和氯化钙.1年前查看全部
- 氯气能与氨气反应生成氯化氨,能与一甲胺反应吗?生成什么?
 szniu_2081年前2
szniu_2081年前2 -
 短信故乡 共回答了16个问题
短信故乡 共回答了16个问题 |采纳率93.8%能反应,生成类似铵盐的物质.
CH3NH2+HCl=CH3NH3Cl
胺的盐通常为无色固体,易溶于水,而不溶于非极性的有机溶剂;当其与强碱(如NaOH或KOH)溶液作用时,则可使胺重新游离出来,利用这一性质,可以区别和分离不溶于水的胺和不溶于水的有机物.1年前查看全部
- 稀释氯化氨溶液,水的电离程度变大?好像不对,
 老人与快乐1年前3
老人与快乐1年前3 -
 hmiyfp 共回答了12个问题
hmiyfp 共回答了12个问题 |采纳率83.3%确实不对,在稀释的过程中,氢离子的浓度减小.氢离子都是水电离出来的,就说明水的电离程度减小.1年前查看全部
- 氯化氨的化学式是什么?氯化铵的化学式是什么?
氯化氨的化学式是什么?氯化铵的化学式是什么?
分别说 东弟1年前5
东弟1年前5 -
 dknight 共回答了12个问题
dknight 共回答了12个问题 |采纳率83.3%只有氯化铵 氯化铵的化学式是NH4Cl1年前查看全部
- 硝酸氨 硝酸钠 氯化氨 用化学方法鉴别出来
 howardlam1年前1
howardlam1年前1 -
 happyddd 共回答了18个问题
happyddd 共回答了18个问题 |采纳率100%用AgNO3检验出NH4Cl
再用NaOH检验出NH4NO31年前查看全部
- 氯化氨与稀硫酸反应生成什么?
 hsan211年前1
hsan211年前1 -
 与狼共舞love 共回答了18个问题
与狼共舞love 共回答了18个问题 |采纳率83.3%产生(NH4)SO4+2HCL1年前查看全部
- 在氨水中,分别加入适量盐酸,氢氧化钠溶液,和氯化氨铵溶液,对氨水的电离平衡各有什么影响?
 屉屉丫头1年前4
屉屉丫头1年前4 -
 sir_wzm 共回答了18个问题
sir_wzm 共回答了18个问题 |采纳率94.4%促进,(酸碱中和促进电离)
抑制,(碱性溶液抑制电离)
抑制,(同离子效应抑制电离)1年前查看全部
- 氯化氨和熟石灰(溶液)反应生成什么物质?
 dswen1年前1
dswen1年前1 -
 上海之小男人 共回答了18个问题
上海之小男人 共回答了18个问题 |采纳率94.4%2NH4Cl+Ca(OH)2=CaCl2+2NH3+2H2O1年前查看全部
- 氯化氨和草木灰反应生成什么生成什么气体?
 紫色茶1年前1
紫色茶1年前1 -
 文武汉 共回答了14个问题
文武汉 共回答了14个问题 |采纳率92.9%草木灰的主要成份是K2CO3
2NH4Cl+ K2CO3=2KCl+2NH3↑+CO2↑+H2O
因此生成的气体为氨气和二氧化碳(当然还有部分水汽)1年前查看全部
- 氯化氨,醋酸氨,硫酸氨,硫酸氢氨,氨水五种溶液中NH4浓度由大到小的顺序是
 kingpuxp1年前1
kingpuxp1年前1 -
 冰冰不到25 共回答了20个问题
冰冰不到25 共回答了20个问题 |采纳率90%这个,你要看是强酸盐还是弱酸盐.越是弱,那个弱根就会结合h2o中电离的 h+,于是NH4也相对多.依次为硫酸氨,氯酸氨,硫酸氢氨,氨水,醋酸氨.1年前查看全部
- 为什么氯化氨和硝酸钠反应不会生成硝酸氨?
 天兵下北荒1年前1
天兵下北荒1年前1 -
 海岛战神 共回答了19个问题
海岛战神 共回答了19个问题 |采纳率84.2%氯化氨为弱酸性,硝酸钠加入首先会产生硝酸,具有强氧化性,会氧化氯化氨,所以不会生成硝酸氨1年前查看全部
- 能用氢氧化钠和氯化氨反应制氨气吗?
能用氢氧化钠和氯化氨反应制氨气吗?
是不是因为氢氧化钠会吸收氨气? menyin1年前1
menyin1年前1 -
 zht_lww1314 共回答了26个问题
zht_lww1314 共回答了26个问题 |采纳率88.5%可以吧 加热一下 再除去水蒸气就解决了1年前查看全部
- 氯化氨和亚硫酸钠反应的化学方程式
氯化氨和亚硫酸钠反应的化学方程式
还有氯化氨和NaNO2反应的方程式 polly221年前2
polly221年前2 -
 葡葡紫哎哩 共回答了22个问题
葡葡紫哎哩 共回答了22个问题 |采纳率95.5%2NH4Cl+Na2SO3=(NH4)2SO3+2NaCl
NH4Cl+NaNO2=NH4NO2+NaCl
其实,根据复分解反应发生的条件,应该是不能反应的.1年前查看全部
- 在氨水中加入氯化氨,氨水的解离度,解离常数分别怎么变化
 aha68501年前1
aha68501年前1 -
 maladuo 共回答了15个问题
maladuo 共回答了15个问题 |采纳率93.3%电离度减小
电离常数不变1年前查看全部
- 氯化氨加氢氧化钙反应的 方程式
 apollo19761年前5
apollo19761年前5 -
 喜欢高个子美美 共回答了10个问题
喜欢高个子美美 共回答了10个问题 |采纳率100%2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O1年前查看全部
- 氯化氨显酸性还是碱性?
 hhsddjg1年前1
hhsddjg1年前1 -
 z98293flkasdjdlk 共回答了21个问题
z98293flkasdjdlk 共回答了21个问题 |采纳率90.5%因为水解而显酸性1年前查看全部
- 只能使用一种试剂就能将氯化氨,硫酸氨,氯化钠,硫酸钠分开,这种试剂是什么
 charles6671年前3
charles6671年前3 -
 smallsnow200 共回答了15个问题
smallsnow200 共回答了15个问题 |采纳率93.3%氢氧化钡
第一个有气体
第二个既有气体,又有沉淀
第三个没现象
最后一个只有沉淀1年前查看全部
- 用加热氯化氨和消石灰制取氨气的方程式
 wanmsq1年前1
wanmsq1年前1 -
 z19800110 共回答了22个问题
z19800110 共回答了22个问题 |采纳率86.4%2nh4cl+ca(oh)2==加热cacl2+2nh3↑+2h2o1年前查看全部
- 固态氯化氨加热会分解成氨气吗?固态氯化氨与氢氧化钙混合加热有氨气生成吗?
 彬567891年前1
彬567891年前1 -
 c36114 共回答了10个问题
c36114 共回答了10个问题 |采纳率80%这是实验室制氨气的一种,也是最常用的一种方法!1年前查看全部
- 氯化氨(固态)溶于水是吸热还有放热
 aa93741年前1
aa93741年前1 -
 hnxymahui 共回答了28个问题
hnxymahui 共回答了28个问题 |采纳率92.9%氯化铵溶于水,电离生成铵根和氯离子,电离是吸热过程.1年前查看全部
- 有七样固体,加以鉴别:三氧化二铁,碳酸氢氨,硫化铅,氯化氨,硫酸亚铁,氧化亚铜,氧化铜
 mechenkai1年前2
mechenkai1年前2 -
 xyz550 共回答了16个问题
xyz550 共回答了16个问题 |采纳率81.3%红色:Fe2O3,Cu2O,溶于硫酸,得到蓝色溶液的就是Cu2O,黄色溶液 的就是Fe2O3
黑色:PbS,CuO,溶于盐酸得到.蓝色溶液的就是CuO,另一个就是PbS
淡绿色:FeSO4
白色:NH4HCO3,NH4Cl,加热分解有水蒸气产生就是NH4HCO3,另一个就是NH4Cl1年前查看全部
- 15.35g氯化氨与碳酸钠的固体混合物与足量的氢氧化钠反应生成0.1摩尔气体,求固体
 大海无量君1年前4
大海无量君1年前4 -
 lijian1982425 共回答了20个问题
lijian1982425 共回答了20个问题 |采纳率75%NH4CL+NaOH==NaCl+H20+NH3
1mol 1mol
n 0.1mol
n=0.1mol
m(NH4CL)=n*M(NH4CL)=5.25g
剩下的自己算吧1年前查看全部
- 氯化氨能否同硫酸钠生成氯化纳结晶?如何操作?
 sy_yunfeng1年前1
sy_yunfeng1年前1 -
 replay0810 共回答了15个问题
replay0810 共回答了15个问题 |采纳率100%加氯化钡把硫酸根沉淀,然后加热把氨气赶走,剩下蒸发掉水 就只剩氯化钠晶体了1年前查看全部
- 氯化氨水解离子方程式Kuai!
 夺命五花肉1年前1
夺命五花肉1年前1 -
 laziofootball 共回答了13个问题
laziofootball 共回答了13个问题 |采纳率100%NH4+ +H2O+=NH3.H2O + OH-1年前查看全部
- 下列说法错在哪了1.苯酚沾在手上,应立即用HaOH溶液清洗2.用升华法分离碘和氯化氨的混合物3.试管壁上上的银镜可用稀硫
下列说法错在哪了
1.苯酚沾在手上,应立即用HaOH溶液清洗
2.用升华法分离碘和氯化氨的混合物
3.试管壁上上的银镜可用稀硫酸洗涤
并麻烦给出各项原因说明. hmilyhdyy1年前3
hmilyhdyy1年前3 -
 输入您常的 共回答了22个问题
输入您常的 共回答了22个问题 |采纳率86.4%1.苯酚沾在手上,应立即用NaOH溶液清洗
用氢氧化钠这样的强碱洗手……OH MY GOD= =
2.用升华法分离碘和氯化氨的混合物
升华法要加热,但氯化氨一加热就分解成氨气和氯化氢了……
3.试管壁上上的银镜可用稀硫酸洗涤
银和稀硫酸不反应……最好用硝酸1年前查看全部
- 下列各组物质能在pH=1的无色溶液中大量共存的是A硝酸钾、硝酸铜、氯化钠B碳酸钠、硝酸钾、氯化氨C硫酸...
下列各组物质能在pH=1的无色溶液中大量共存的是A硝酸钾、硝酸铜、氯化钠B碳酸钠、硝酸钾、氯化氨C硫酸...
下列各组物质能在pH=1的无色溶液中大量共存的是A硝酸钾、硝酸铜、氯化钠B碳酸钠、硝酸钾、氯化氨C硫酸镁、硝酸钠、氯化钾.为什么这么做? 01cjj1年前3
01cjj1年前3 -
 chibaol 共回答了13个问题
chibaol 共回答了13个问题 |采纳率84.6%选C,pH=1含有大量的H+,无色溶液要求不能含有有色离子,大量共存要求不能反应.
A.不可能,Cu(NO3)2是蓝色的.
B.不可能,2H+ +CO32-=H2O+CO2↑
C.可以共存,没有有色离子.1年前查看全部
- 将100克质量分数为40%的氯化氨溶液,从某温度降至40摄氏度(40摄氏度时氯化氨的溶解度为45克),能析出多少克氯化氨
将100克质量分数为40%的氯化氨溶液,从某温度降至40摄氏度(40摄氏度时氯化氨的溶解度为45克),能析出多少克氯化氨晶体?
 天天09091年前1
天天09091年前1 -
 久泉酒美 共回答了14个问题
久泉酒美 共回答了14个问题 |采纳率92.9%你好,
100克溶液中含有40克氯化铵和60克水
根据 S/100 = 溶质/溶剂
45/100 = x/60
x = 27
40 - 27 = 13克
所以析出13克氯化铵
希望我的回答能帮到你,如果满意望采纳1年前查看全部
- 盐和什么能合成氯化氨
 ErnestoChGuevara1年前3
ErnestoChGuevara1年前3 -
 yinghuochong608 共回答了20个问题
yinghuochong608 共回答了20个问题 |采纳率100%NaCl+NH4HCO3=NH4Cl+NaHCO3
用饱和NH4HCO3溶液加入NaCl
由于NaHCO3溶解度小于NH4HCO3所以会析出NaHCO31年前查看全部
- 为什么偏铝酸钠和氯化氨反应会生成氢氧化铝,一水合氨和氯化钠?
 AINIYANHUAN1年前2
AINIYANHUAN1年前2 -
 moyagene 共回答了24个问题
moyagene 共回答了24个问题 |采纳率91.7%相互促进的水解!
AlO2- +2 H2O =可逆号= Al(OH)3 + OH-
NH4+ + H2O =可逆号= NH3·H2O + H+
偏铝酸钠和氯化氨相遇时上述反应相互促进!1年前查看全部
- 铝片投入氯化氨溶液,铝片上产生大量气泡,这是怎么回事,氯化氨能与铝反应,为啥
 yuanyibing1年前1
yuanyibing1年前1 -
 xhlhaa 共回答了27个问题
xhlhaa 共回答了27个问题 |采纳率100%氯化铵显酸性,因为氯化铵水解有H+存在,在反应后同时有氢氧化铝沉淀1年前查看全部
- Mg(OH)2在同浓度的氨水和氯化氨溶液中的溶解度哪个大?为什么?
 Redchuanbo1年前4
Redchuanbo1年前4 -
 phxswpu 共回答了23个问题
phxswpu 共回答了23个问题 |采纳率87%NH4Cl中比较大···氯化铵是酸性滴···有助于氢氧化镁溶解平衡正方向移动滴···氨水碱性滴···对它的溶解起副作用滴···1年前查看全部
- 氨水是什么性?氯化氨呢?
 raincome1年前2
raincome1年前2 -
 快乐生活20062006 共回答了24个问题
快乐生活20062006 共回答了24个问题 |采纳率87.5%氨水是碱性的,氯化铵溶液是酸性的1年前查看全部
- 常温下饱和碘化铅溶液和饱和氯化氨溶液的浓度各是多少?
 lrongx1年前1
lrongx1年前1 -
 dd公贼 共回答了14个问题
dd公贼 共回答了14个问题 |采纳率92.9%室温时,碘化铅的容度积(Ksp)为1.7×10的负9次方mol/L负3次,溶液浓度1.19×10^(-3)mol/L.
氯化铵在水中溶解度列表:
0℃:29.4g
10℃:33.3g
20℃:37.2g
30℃:41.4g
40℃:45.8g
50℃:50.4g
60℃:55.2g
70℃:60.2g
80℃:65.6g
90℃:71.3g
100℃:77.3g
常温按20℃,溶解度s=37.2g,饱和溶液中氯化铵的质量分数为27.1%,没有密度不好计算物质的量浓度.1年前查看全部
- 向氯化氨溶液中加水,水的电离是促进还是抑制?为什么?
向氯化氨溶液中加水,水的电离是促进还是抑制?为什么?
其他方法有什么 kofer20031年前1
kofer20031年前1 -
 xmkj521 共回答了16个问题
xmkj521 共回答了16个问题 |采纳率100%最简单的方法是极限法去考虑,无限稀释时,就相当于纯水的电离.
而氯化铵溶液水解显酸性,促进了水的电离,也就大于纯水.
所以水的电离被抑制~
也可以用别的方法想,但都没有这个简单~
纯手打~希望能帮到您~有不懂的欢迎追问~望采纳^_^1年前查看全部
大家在问
- 1把两块条形磁铁各方在两根铅笔上,磁极相互靠近时会发生什么现象
- 2在下列各小题的横线上,写出相应的诗文名句。(12分)
- 3针对画蛇添足 这个成语故事 写辩论文 观点是画画者观察入微 有错么
- 4某容器中所盛的空气里含有氧气10L,则此容器中所盛的空气的体积约是( )
- 5测一个铭牌缺失的滑动变阻器最大阻值的试验,图中乙滑动变阻器完好,标有“20Ω 1A”,甲滑动变阻器铭牌缺失,滑片功能失效
- 6The shop is _____(登广告)in the newspaper to look for saleswoma
- 7在一次考试中,共20道题,答对一个得5分,答错或不答扣3分,小青考了60分,她答对多少题?
- 8英语翻译(例句)He didn't ask me to tell her the truth (他没有要求我跟她说实话)
- 9(2004•安徽)已知直线l:x-y-1=0,l1:2x-y-2=0.若直线l2与l1关于l对称,则l2的方程是( )
- 10根号9减绝对值2加小括号3分之1负一的次方加负一的2013次方
- 11△ABC中,D、E、F分别是三边的中点,△DEF面积为4cm²,求△ABC的面积
- 12生物DNA复制错误、影响.虽然DNA复制通过碱基互补配对在很大程度上保证了复制的准确性,但是,DNA复制仍有约10-9的
- 13“敬伟灯饰“翻译成英文是什么?谢谢
- 14请给我列举一下hand 不同意思的短语列举,像hired hand 农场工人 green hand 菜鸟,
- 15下列变形中,正确的是( )A.由3x-1<2x-2,得x<-1B.由2x+1>3x-1,得x>-2C.由-2x+1>x
