用50ml0.50mol/L的盐酸和50ml0.55mol/L的氢氧化钠反应测定中和热,反应前溶液温度均为25.43摄氏
 lgw6686682022-10-04 11:39:541条回答
lgw6686682022-10-04 11:39:541条回答顺便附上计算过程

已提交,审核后显示!提交回复
共1条回复
 sir2 共回答了19个问题
sir2 共回答了19个问题 |采纳率94.7%- 溶液总体积为:100ml(100g),所以反应放出的热量为4.18*100*(28.85-25.43)=1429.56 J=1.42956kJ,因为生成0.5*50/1000=0.025mol水 所以1mol放热为:1.42956/0.025=57.1824kJ
所以热化学方程式为:
HCl+NaOH=NaCl+H2O;△H=-57.1824kJ/mol - 1年前
相关推荐
- 中和反应的反应热实验实验中常用0.50mol/L的盐酸和0.55mol/L的氢氧化钠溶液各50ml.NaOH的浓度大于H
中和反应的反应热实验
实验中常用0.50mol/L的盐酸和0.55mol/L的氢氧化钠溶液各50ml.NaOH的浓度大于HCL的浓度的作用是什么?当室温低于10摄氏度时进行,对实验结果会造成较大误差的原因是什么? 冲浪儿1年前1
冲浪儿1年前1 -
 艺潞同学 共回答了13个问题
艺潞同学 共回答了13个问题 |采纳率100%NaOH的浓度大于HCL的浓度的作用是:氢氧化钠过量,可以使盐酸反应的更彻底.
由于温度比较低,造成热量散失较多.1年前查看全部
- 高二的关于中和热的一道题,实验室用50ml 0.50mol/L的盐酸、50ml 0.55mol/L的NaOH溶液,T2-
高二的关于中和热的一道题,
实验室用50ml 0.50mol/L的盐酸、50ml 0.55mol/L的NaOH溶液,T2-T1=3.4℃
求中和热 ,书上的答案是△H=-[0.1*4.18KJ*3.4℃]/0.025
我不明白这个0.025是怎么得到的?其他的地方都懂,请帮我讲讲这里吧 检星星1年前1
检星星1年前1 -
 冬天里的狼 共回答了19个问题
冬天里的狼 共回答了19个问题 |采纳率84.2%50ml 0.50mol/L的盐酸中H离子物质的量是0.5*0.05=0.025mol
盐酸与稍过量的NaOH溶液生成的水也是0.025mol1年前查看全部
- 0.50mol/L的某金属氯化物(McLn)溶液10.00ml,与0.40mol/L的NaOH溶液25.00ml恰好完
0.50mol/L的某金属氯化物(McLn)溶液10.00ml,与0.40mol/L的NaOH溶液25.00ml恰好完
全反应,生成沉淀M(OH)n,则n等于 些着急1年前1
些着急1年前1 -
 孤独踏上 共回答了16个问题
孤独踏上 共回答了16个问题 |采纳率87.5%0.40mol/L的NaOH溶液25.00ml、物质的量为0.4×0.025 = 0.01mol
0.50mol/L的某金属氯化物(McLn)溶液10.00ml中,含有MCln物质的量为 0.005mol
反应如下:
MCln + nNaOH ==== M(OH)n + nNaCl
1 n
0.005 0.01
===> n = 2
所以,生成的沉淀为M(OH)2、n=21年前查看全部
- 现有硫酸、硫酸铜、硫酸铁混合溶液0.10L,已知溶液的物质的量溶液相等,经测定溶液中c(H )=0.50mol/L.求此
现有硫酸、硫酸铜、硫酸铁混合溶液0.10L,已知溶液的物质的量溶液相等,经测定溶液中c(H )=0.50mol/L.求此溶液理论上可溶解铁粉的质量.
 lhm6669991年前3
lhm6669991年前3 -
 luxiaolu 共回答了28个问题
luxiaolu 共回答了28个问题 |采纳率100%硫酸有0.5*0.1/2=0.025mol
物质的量相等,则硫酸铜、硫酸铁物质的量也为0.025mol
则溶液中一共有硫酸根为 0.025 + 0.025 + 0.025*3 = 0.125mol
现有的溶液中有Fe3+ 为0.025*2=0.05mol
溶解铁粉后,溶液都将成为硫酸亚铁溶液
因此可溶解铁粉量为 0.125-0.05=0.075mol,质量为 0.075 * 56 = 4.2 g1年前查看全部
- 一道沉淀的题目!某溶液中含S2-为0.50mol/l,若向此溶液中加入过量的CdCO3,能否有Cds沉淀产生?计算反应平
一道沉淀的题目!
某溶液中含S2-为0.50mol/l,若向此溶液中加入过量的CdCO3,能否有Cds沉淀产生?计算反应平衡后,溶液中S2-的浓度 已知ksp,cds=8*10-27 ksp,cdco3=5.2*10-12
那主要是平衡后S2-浓度应该怎么算呢?相减得结果吗? 在千1年前1
在千1年前1 -
 狂走 共回答了15个问题
狂走 共回答了15个问题 |采纳率93.3%由cdco3=5.2*10-12算cd,又由ksp,cds=8*10-27看沉淀否1年前查看全部
- 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.50mol/L的NaOH溶液在如图
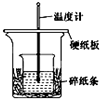 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.50mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.50mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟60 mL 0.50 mol/L的NaOH溶液进行反应,所放出热量相等 yk_ky1年前1
yk_ky1年前1 -
 icman 共回答了18个问题
icman 共回答了18个问题 |采纳率83.3%解题思路:A.根据实验过程的保温情况确定保温效果;
B.根据量热计的构造来判断该装置的缺少仪器;
C.中和热测定实验成败的关键是保温工作,烧杯间填满碎纸条的作用是保温;
D.反应放出的热量与酸碱的用量成正比例关系.A.该装置的保温效果并不如量热计那样好,大小烧杯之间要填满纸片,装置存在热量的散失,故A错误;
B.根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故B正确;
C.中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故C错误;
D.60mL0.50mol/L盐酸跟60mL0.50mol/L的NaOH溶液进行反应反应所放出热量比50mL的放出的热量高,故D错误;
故选B.点评:
本题考点: 中和热的测定.
考点点评: 本题考查中和热的测定,题目难度不大,注意理解中和热的概念是解题的关键.1年前查看全部
- 把1.00mol/L的氢氧化钠溶液加入到40.0mL 0.50mol/L的硫酸中至完全中和,生成硫酸钠的浓度是...
 jessy8191年前2
jessy8191年前2 -
 如意肉眼 共回答了14个问题
如意肉眼 共回答了14个问题 |采纳率64.3%40.0mL 0.50mol/L的硫酸 H+为 0.040*0.5*2
则 NaOH 体积为 0.040*0.5*2 /1==0.04 L
则中和后体积为 40+40==80 ml 0.08 L
Na2SO4 物质的量等于H2SO4的物质的量=== 0.04*0.5==0.02
浓度为 0.02/0.08==0.25 mol/L1年前查看全部
- (2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0m
 (2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌并使其溶解后,回答下列问题:
(2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌并使其溶解后,回答下列问题:
(1)烧杯A中温度______ (填“升高”、“降低”或“不变”);
(2)已知:2NO2(g)⇌N2O4(g)△H<0,从上面实验可知,D烧瓶内混合气体颜色将______(填“变浅”、“变深”或“不变”);
(3)若实验测得B烧杯中酸碱中和反应放热1.4325kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为______;
(4)若起始时在D烧瓶中充入m g N2O4,此时测得烧瓶中压强为1.01×105Pa,当可逆反应:N2O4(g)⇌2NO2(g)达到化学平衡状态时压强变为1.515×105Pa(保持温度不变),则平衡时,N2O4的转化率α=______. 4529259161年前1
4529259161年前1 -
 流水悠悠似侬情 共回答了14个问题
流水悠悠似侬情 共回答了14个问题 |采纳率92.9%解题思路:(1)硝酸铵溶解时吸收热量;
(2)酸碱中和时放出热量,导致溶液的温度升高,升高温度平衡向吸热方向移动;
(3)据HCl和NaOH的物质的量,计算生成1mol水时放热多少,再书写热化学方程式;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,求算反应掉的N2O4物质的量,再求算转化率.(1)硝酸铵溶解时吸收热量导致溶液温度降低,故答案为:降低;
(2)加入氢氧化钠会和盐酸之间发生中和反应时放出热量,导致溶液的温度升高,反应2NO2(g)⇌N2O4(g)是放热反应,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,故答案为:变深;
(3)n(HCl)=0.50mol/L×0.05L=0.025mol,n(NaOH)=[2g/40g/mol]=0.05mol,0.025molHCl与0.05molNaOH反应,生成0.025mol水时放热1.4325KJ,则生成1mol水时放热57.3KJ,所以热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(2)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O△H=-57.3kJ/mol;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,设反应后的四氧化二氮有nmol,则生成的二氧化氮又2nmol,有
mg
92g/mol
nmol+2nmol=
1.01×105Pa
1.515×105Pa,
解得n=[m/184]mol,所以α(N2O4)=
m
184mol
m
96mol×100%=50%,
故答案为:50%.点评:
本题考点: 化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了平衡移动、热化学方程式书写、转化率的求算,题目难度中等.1年前查看全部
- 同学利用50ml0.50mol/l盐酸与50ML氢氧化钠溶液在如图所示的装置中进行中和热测定
 不明是非1年前1
不明是非1年前1 -
 reila 共回答了15个问题
reila 共回答了15个问题 |采纳率93.3%(1)从实验装置上看,图中尚缺少的一种玻璃用品是 环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是 减少实验过程中的热量损失.
(3)大烧杯上如不盖硬纸板,求得的中和热数值 偏小.(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 不相等(填“相等、不相等”),所求中和热 相等(填“相等、不相等”).
简述理由 因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关.1年前查看全部
- (1)用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过
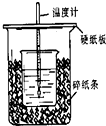 (1)用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______.
(2)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等、不相等”),所求中和热______(填“相等、不相等”),简述理由______.
(3)已知在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,则上述反应的热化学方程式为______. 感恩永远1年前1
感恩永远1年前1 -
 米酥 共回答了20个问题
米酥 共回答了20个问题 |采纳率90%解题思路:(1)根据量热计的构造来判断该装置的缺少仪器;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(3)依据酸碱中和反应的定义要点和热化学方程式的书写原则.(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,
故答案为:环形玻璃搅拌器;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并若60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1 molH2O放出的热量,与酸碱的用量无关;
(3)在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,该反应的热化学方程式可为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol.点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 中和反应反应热的测定50ml0.50mol/L盐酸的质量为什么是50g,还有50mL0.55mol/L的NaOH溶液质量
中和反应反应热的测定50ml0.50mol/L盐酸的质量为什么是50g,还有50mL0.55mol/L的NaOH溶液质量为什么也是?
 mitchboy1年前1
mitchboy1年前1 -
 xuejun1970 共回答了12个问题
xuejun1970 共回答了12个问题 |采纳率91.7%因为这个是溶液,溶液中大部分还是水,所以是按照水的密度来算溶液的质量的其中溶质对水密度产生的影响可以忽略不计1年前查看全部
- 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出来的热量可计算中和热.回答下列问题:
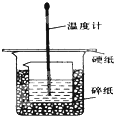
(1)从实验装置上看,图中缺少的一种玻璃用品是______.
(2)烧杯间填满碎纸条的作用是______.
(3)大烧杯上如不盖硬纸板,求得的中和热数值______(填“偏大”、“偏小”或“无影响”)
(4)实验中改用60mL0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量______,(填“相等”或“不相等”).
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______;用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会______.(均填“偏大”、“偏小”或“无影响”) zhangpei1024251年前3
zhangpei1024251年前3 -
 herryddr 共回答了17个问题
herryddr 共回答了17个问题 |采纳率100%解题思路:(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析;根据中和热的概念分析.(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:防止热量损失,
故答案为:减少实验过程中的热量损失;
(3))大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol•L-1H2SO4溶液跟50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,故答案为:不相等;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ;中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值无响应,故答案为:偏小;无影响.点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生有关中和热的测定知识,注意中和热与酸、碱的物质的量无关,可难度不大.1年前查看全部
- 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出来的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出来的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃用品是______.
(2)烧杯间填满碎纸条的作用是______.
(3)大烧杯上如不盖硬纸板,求得的中和热数值______(填“偏大”、“偏小”或“无影响”)
(4)实验中改用60mL0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量______,(填“相等”或“不相等”).
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______;用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会______.(均填“偏大”、“偏小”或“无影响”) pprzqb1年前1
pprzqb1年前1 -
 aze138 共回答了15个问题
aze138 共回答了15个问题 |采纳率80%解题思路:(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析;根据中和热的概念分析.(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:防止热量损失,
故答案为:减少实验过程中的热量损失;
(3))大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol•L-1H2SO4溶液跟50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,故答案为:不相等;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ;中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值无响应,故答案为:偏小;无影响.点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生有关中和热的测定知识,注意中和热与酸、碱的物质的量无关,可难度不大.1年前查看全部
- 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.本制0.50mol/L N
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.本制0.50mol/L NaOH溶液 (1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g
为什么是5.0g不是4.9g? 君子之行1年前2
君子之行1年前2 -
 离开了水的鱼 共回答了20个问题
离开了水的鱼 共回答了20个问题 |采纳率80%因为容量瓶的规格中只有250ml,没有245ml的,所以若实验中大约要使用245mL NaOH溶液,要配制250mol的NaOH溶液
需要NaOH的质量=0.50mol/L*0.25L*40g/L=5g1年前查看全部
- (16分)50mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液在右图所示的装置中进行中和反应,
(16分)50mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液在右图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热。
(1)烧杯间填满泡沫塑料的作用是 ;
(2)大烧杯上若不盖硬纸板,求得的中和热数值 (填“偏大”、 “偏小”、“无影响”)
(3)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H -57.3KJ/mol(填“>”、“<”或“=”);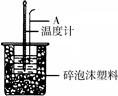
(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、“不相等”),
所求中和热 (填“相等、“不相等”) 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(均填“偏大”、“偏小”、“无影响”)
(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ; 张驴儿1年前1
张驴儿1年前1 -
 nxefry 共回答了24个问题
nxefry 共回答了24个问题 |采纳率87.5%(1)保温防止热量损失。 (2)偏小(3)环形玻璃棒;△H>-57.3KJ/mol
(4)不相等、相等(5)偏小
(6)1/2H 2 SO 4 (aq)+NaOH(aq)=1/2Na 2 SO 4 (aq)+H 2 O(l);△H=-57.3KJ/mol
(1)在实验中应该尽可能的减少热量的损失,所以烧杯间填满泡沫塑料的作用是保温防止热量损失。
(2)大烧杯上若不盖硬纸板,则会造成热量的损失,测定结果偏低。
(3)根据仪器的结构可知,应该是是环形玻璃棒。由于酸能和氢氧化钠反应放出热量,所以造成氢氧化钠溶液的起始温度高,因此导致最终放出的热量偏少,则△H>-57.3KJ/mol。
(4)改变酸和碱的用量,反应中放出的热量会变化,但反应热是不变的,因为中和热是指酸跟碱发生中和反应生成1摩尔H 2 O时所放出的热量,与酸碱的用量无关。
(5)氨水是弱电解质,存在电离平衡,电离吸热,所以测得的中和热的数值偏小。
(6)根据中和热的概念可知,热化学方程式为1/2H 2 SO 4 (aq)+NaOH(aq)=1/2Na 2 SO 4 (aq)+H 2 O(l);△H=-57.3KJ/mol。1年前查看全部
- 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装
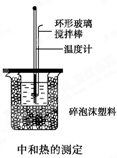 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是______
(2)大烧杯上如不盖硬纸板,求得的中和热数值______(填“偏大”“偏小”“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸进行反应,与上述实验相比,所放出的热量______(填“相等”、“不相等”),所求中和热______(填“相等”、“不相等”),简述理由______.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______(填“偏大”、“偏小”“无影响”). jimingxing1年前1
jimingxing1年前1 -
 lin8974 共回答了17个问题
lin8974 共回答了17个问题 |采纳率88.2%解题思路:(1)中和热测定实验成败的关键是保温工作;
(2)不盖硬纸板,会有一部分热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)根据弱电解质电离吸热分析.(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:减少实验过程中的热量损失,故答案为:减小热量散失;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol•L-1H2SO4溶液跟50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用50mL0.50mol•L-1醋酸代替H2SO4溶液进行上述实验,测得中和热数值相等,故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小.点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应
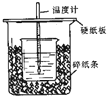 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______;由图可知该装置有不妥之处,应如何改正?______.
(2)烧杯间填满碎塑料泡沫的作用是______.
(3)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求得的中和热数值______(填“相等、不相等”)
(4)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______(填“偏大”、“偏小”、“无影响”). monica01011年前1
monica01011年前1 -
 芝麻L16 共回答了15个问题
芝麻L16 共回答了15个问题 |采纳率93.3%解题思路:(1)根据量热计的构造来判断该装置的缺少仪器、装置的错误;
(2)中和热测定实验成败的关键是保温工作;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
(4)根据弱电解质电离吸热分析.(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,装置的错误是:小烧杯口与大烧杯口不相平,且未填满碎塑料泡沫(或碎纸条),
故答案为:环形玻璃搅拌器;在大小烧杯间填满碎塑料泡沫(或碎纸条)使小烧杯口与大烧杯口相平;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:保温、隔热,减少实验过程中的热最损失,
故答案为:保温、隔热,减少实验过程中的热最损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,
故答案为:相等;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小.点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装
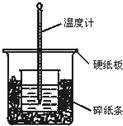 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______;
(2)烧杯间填满碎纸条的作用是______;
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”“不相等”),所求中和热______(填“相等”“不相等”);
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______;用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会______.(均填“偏大”“偏小”“无影响”) 落日昏鸦1年前1
落日昏鸦1年前1 -
 清寻 共回答了19个问题
清寻 共回答了19个问题 |采纳率84.2%解题思路:(1)根据量热计的构造来判断该装置的缺少仪器;(2)中和热测定实验成败的关键是保温工作;(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;(4)根据弱电解质电离吸热分析;要保证一种物质完全反应,需另一种物质过量;(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,
故答案为:环形玻璃搅拌器;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
故答案为:不相等;相等;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ;用50mL 0.50mol/L NaOH与50mL 0.50mol/L盐酸反应,则二者不能完全反应,放出的热量比理论值要小,故答案为:偏小;偏小.点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生有关中和热的测定知识,可以根据中和热概念分析,注意弱电解质电离吸热,难度不大.1年前查看全部
- 在100ml 0.50mol/L H₂SO₄溶液中投入锌粒,锌完全反应后,还须40ml 0.50
在100ml 0.50mol/L H₂SO₄溶液中投入锌粒,锌完全反应后,还须40ml 0.50mol/L NaOH 溶液才能完全中和,求锌的质量.
 grass-蕾1年前1
grass-蕾1年前1 -
 怀念牛 共回答了15个问题
怀念牛 共回答了15个问题 |采纳率80%Zn+H?SO?=ZnSO?+H?
2NaOH+H?SO?=Na?SO?+2H?O
0.5*0.04
由第二个反应式可知H?SO?还剩余0.5*0.04/2=0.01mol
可以算出第一个反应中消耗了0.1*0.5-0.01=0.04molZn
m(Zn)=M(Zn)*n(Zn)=65*0.04=2.6g 即锌的质量为2.6克.1年前查看全部
- 用18.4mol/L的浓H2SO4配制100mL 0.50mol/L的稀H2SO4,请按要求填空
用18.4mol/L的浓H2SO4配制100mL 0.50mol/L的稀H2SO4,请按要求填空
(1)用量筒量取所需浓H2SO4的体积为______mL;
(2)如果实验室有10mL、20mL、50mL量筒,应选用______mL量筒,实验中还需要用到的仪器有______、______、______、烧杯、玻璃棒.
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即进行定容______
②定容时俯视刻度线______
③容量瓶洗净后未干燥______;
④摇匀后发现液面低于刻度线后加水至溶液的凹液面与刻度线相平______;
⑤用量筒量取浓H2SO4时仰视刻度线:______.
(4)若定容时液面高于刻度线应采取的措施是______. yulinangel1年前1
yulinangel1年前1 -
 lulu爱老鼠 共回答了22个问题
lulu爱老鼠 共回答了22个问题 |采纳率81.8%解题思路:(1)根据溶液稀释定律C浓V浓=C稀V稀来计算;
(2)根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)根据c=[m/M]并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)配制过程中的操作失误,能补救就补救,不能补救就需重新配制.(1)设需要浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×VmL=100mL×0.50mol/L
解得V=2.7mL,故答案为:2.7;
(2)根据“大而近”的原则,根据需要量取的浓硫酸的体积为2.7mL,故应选择10mL的量筒;操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管.故答案为:10;100mL容量瓶、胶头滴管;
(3)①浓硫酸溶解后未冷至室温即进行定容,则冷却后溶液体积偏小,则浓度偏高,故答案为:偏高;
②定容时俯视刻度线,则溶液体积偏小,浓度偏高,故答案为:偏高;
③若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故答案为:无影响;
④摇匀后发现液面低于刻度线是正常的,后加水至溶液的凹液面与刻度线相平则导致溶液浓度偏低,故答案为:偏低;
⑤用量筒量取浓H2SO4时仰视刻度线,会导致所取的溶液体积偏大,则所配稀硫酸的浓度偏高,故答案为:偏高;
(4)若定容时液面高于刻度线,无法补救,故需重新配制,故答案为:重新配制.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.1年前查看全部
- (2011•防城港一模)下列溶液经反应后,溶液内含有0.50mol NaHCO3和0.50mol N
(2011•防城港一模)下列溶液经反应后,溶液内含有0.50mol NaHCO3和0.50mol Na2CO3的是( )
A.0.50L 1.00 mol•L-1 NaHCO3加0.50L 0.50 mol•L-1 NaOH
B.0.50L 0.75 mol•L-1 Na2CO3加0.50L 0.50 mol•L-1 HCl
C.0.50L 1.00 mol•L-1 NaHCO3 加0.50L 0.25 mol•L-1 NaOH
D.1.00L 1.00 mol•L-1 Na2CO3 加1.00L 0.50 mol•L-1 HCl 欣然怡怡1年前1
欣然怡怡1年前1 -
 huojizai 共回答了15个问题
huojizai 共回答了15个问题 |采纳率73.3%解题思路:根据方程式:NaHCO3+NaOH═Na2CO3+H2O,Na2CO3+HCl═NaHCO3+NaCl,结合题目中的物质的量计算.A、0.50L 1.00 mol•L-1NaHCO3中n(NaHCO3)=0.50mol,加入0.50L 0.50 mol•L-1NaOH,发生NaHCO3+NaOH═Na2CO3+H2O,则生成n(Na2CO3)=0.25mol,不符合题意,故A不选;
B、0.50L 0.75 mol•L-1 Na2CO3中n(Na2CO3)=0.375mol,加0.50L 0.50 mol•L-1 HCl,发生Na2CO3+HCl═NaHCO3+NaCl,则生成n(NaHCO3)=0.25mol,不符合题意,故B不选;
C、0.50L 1.00 mol•L-1 NaHCO3 中n(NaHCO3)=0.5mol,加0.50L 0.25 mol•L-1 NaOH,发生NaHCO3+NaOH═Na2CO3+H2O,则生成n(Na2CO3)=0.125mol,不符合题意,故C不选;
D、1.00L 1.00 mol•L-1 Na2CO3 n(Na2CO3)=1.00mol,加1.00L 0.50 mol•L-1 HCl,发生Na2CO3+HCl═=NaHCO3+NaCl,则n(HCl)=0.50mol,所以生成n(NaHCO3)=0.50mol,剩余的n(Na2CO3)=0.50mol,故符合题意,故D选;
故选:D.点评:
本题考点: 钠的重要化合物;化学方程式的有关计算.
考点点评: 本题考查了碳酸钠与碳酸氢钠的转化,以及有关物质的量的计算,题目比较简单.1年前查看全部
- .物质的量浓度为0.50mol/L的MCln的溶液10.00mL,与物质的量浓度为0.40mol/L的NaOH溶液25.
.物质的量浓度为0.50mol/L的MCln的溶液10.00mL,与物质的量浓度为0.40mol/L的NaOH溶液25.00mL完全反应生成
为什么我算的是n=根下2 rudy8951年前2
rudy8951年前2 -
 ii798 共回答了18个问题
ii798 共回答了18个问题 |采纳率100%MCLn+nNAOH==nNACL+M(OH)n
1 n
0.5*10 0.4*25
计算0.5*10*n=0.4*25
n=21年前查看全部
- 在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓 为0.50mol
在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓 为0.50mol
在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓
为0.50mol/L的HCl溶液中和,则该生成物的成分是什么?各为多少克?计算题 lein78781年前1
lein78781年前1 -
 giovanni2047 共回答了12个问题
giovanni2047 共回答了12个问题 |采纳率75%根据所得氢氧化钠溶液恰好盐酸溶液中和,说明n(OH-)=n(H+),
即n(NaOH)=n(HCl)=0.50mol/L*0.08L=0.04mol
假设钠与氧气反应的生成物全部是Na2O,
则n(Na2O)=1/2n(NaOH)=0.02mol
氧化钠的质量=0.2mol*62g/mol=1.24g1.5g
说明钠反应的生成物为氧化钠和过氧化钠的混合物,
设混合物中含氧化钠、过氧化钠的物质的量分别为X、Y
62X+78Y=1.5g
2X+2Y=0.04mol
X=0.00375mol
Y=0.01625mol
所以氧化钠的质量=0.00375mol*62g/mol=0.2325g
过氧化钠的质量=0.01625mol*78g/mol=1.2675g
答:该生成物的成分是为氧化钠和过氧化钠,各为0.2325克、1.2675克.1年前查看全部
- 用浓度分别为0.50mol/L,体积各为50mL盐酸、氢氧化钠溶液测定中和热.错在哪
 laoheizi1年前1
laoheizi1年前1 -
 atz1313 共回答了22个问题
atz1313 共回答了22个问题 |采纳率95.5%这是错误的,盐酸和氢氧化钠中,有且只有一个浓度要大于0.50mol/L,书上的是0.55,这是为了是反应完全,减少误差1年前查看全部
- 将10mL 0.50mol/L的一元酸HA溶液和等体积0.10 mol/L的KOH溶液混合后,稀释至100mL,它的pH
将10mL 0.50mol/L的一元酸HA溶液和等体积0.10 mol/L的KOH溶液混合后,稀释至100mL,它的pH=3.
(1)通过计算说明HA是弱酸还是强酸?
(2)如果是弱酸,它的电离平衡常数是多少? maggielq1年前1
maggielq1年前1 -
 zbeong 共回答了13个问题
zbeong 共回答了13个问题 |采纳率84.6%解题思路:(1)n(HA)=0.5mol/L×0.01L=0.005mol,n(KOH)=0.10mol/L×0.01L=0.001mol,根据酸碱反应知,混合溶液中还剩余n(HA)=0.005mol-0.001mol=0.004mol,稀释至100mL,混合溶液中c(HA)=[0.004mol/0.1L]=0.04mol/L,根据混合溶液氢离子浓度和酸浓度的相对大小确定HA是强酸还是弱酸;
(2)根据缓冲溶液中PH=Pka+log[(c(KA)/C(HA)]进行计算.(1)n(HA)=0.5mol/L×0.01L=0.005mol,n(KOH)=0.10mol/L×0.01L=0.001mol,根据酸碱反应知,混合溶液中还剩余n(HA)=0.005mol-0.001mol=0.004mol,稀释至100mL,混合溶液中c(HA)=[0.004mol/0.1L]=0.04mol/L,混合溶液中氢离子浓度为0.001mol/L<0.04mol/L,所以HA是弱酸,
答:HA是弱酸;
(2)混合溶液中c(HA)=0.04mol/L,c(KA)=0.01mol/L,pH=Pka+log[(c(KA)/C(HA)]=Pka+log0.25,Pka =3.00-log0.25=3.00-(-0.6)=3.6,ka =2.5×10-4,
答:HA的电离平衡常数为2.5×10-4.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱电解质的电离,根据混合溶液中酸浓度和氢离子浓度相对大小确定酸的强弱,再结合缓冲溶液公式计算酸的电离平衡常数,为学习难点.1年前查看全部
- 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应
假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃).为了计算中和热,某学生实验记录数据如下:
实验序号 起始温度t1℃ 终止温度t2℃
盐酸 氢氧化钠 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
依据该学生的实验数据计算,该实验测得的中和热△H=________________;(结果保留一位小数) 她是我姐1年前1
她是我姐1年前1 -
 lql_mz 共回答了17个问题
lql_mz 共回答了17个问题 |采纳率82.4%Q=cm△t=4.18*(40+40)*3.1=1036.64J=1.037KJ
现在生成的H2O只有0.02mol,中和热要生成1mol水.
所以生成1mol水的时候,放出热量=Q/0.02=51.9KJ1年前查看全部
- 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程
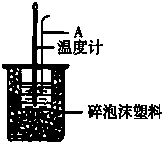 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/molNaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如图所示,仪器A的名称是______;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H______(填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容
c=4.18J/(g•℃).为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=______;(结果保留一位小数)实验序号 起始温度t1℃ 终止温度t2℃ 盐酸 氢氧化钠 混合溶液 1 20.0 20.1 23.2 2 20.2 20.4 23.4 3 20.5 20.6 23.6
(4)______(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是______. sister71年前1
sister71年前1 -
 0820rachel 共回答了20个问题
0820rachel 共回答了20个问题 |采纳率90%解题思路:(1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)根据仪器的结构可知,仪器A是环形玻璃搅拌棒;测量HCl溶液的温度计用水洗净再测氢氧化钠,酸和碱之间因为中和反应而导致的热量损失;
(3)先根据表中测定数据计算出混合液反应前后的平均温度差,再根据Q=cm△T计算出反应放出的热量,最后计算出中和热;
(4)氢氧化钡与硫酸反应生成了硫酸钡沉淀,生成沉淀的过程中会有热量变化,影响测定结果;(1)稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液分别是强酸、强碱,则反应的热化学方程式为:NaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,
故答案为:NaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)仪器A是环形玻璃搅拌棒;测量HCl溶液的温度计用水洗净再测氢氧化钠,酸和碱之间因为中和反应而导致的热量损失,求得的中和热数值将会减小,但反应热△H>-57.3KJ/mol;
故答案为:环形玻璃棒;偏大;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为23.2℃,反应前后温度差为3.15℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为23.4℃,反应前后温度差为:3.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应后温度为23.6℃,反应前后温度差为:3.05℃;
40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠的质量和为m=80mL×1g/cm3=80g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g•℃)×80g×[3.15℃+3.1℃+3.05℃/3]=1.036kJ,即生成0.02mol的水放出热量为1.036kJ,所以生成1mol的水放出热量为:1.036kJ×[1mol/0.02mol]=-51.8kJ/mol,即该实验测得的中和热△H=-51.8kJ/mol,
故答案为:-51.8kJ/mol;
(4)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热.
故答案为:不能;因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热;点评:
本题考点: 中和热的测定.
考点点评: 本题考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热测定原理以及测定反应热的误差等问题,试题有利于培养学生灵活应用所学知识的能力.1年前查看全部
- (2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0m
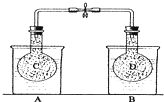 (2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌并使其溶解后,回答下列问题:
(2013•庐江县模拟)如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0gNaOH固体搅拌并使其溶解后,回答下列问题:
(1)烧杯A中温度降低降低 (填“升高”、“降低”或“不变”);
(2)已知:2NO2(g)⇌N2O4(g)△H<0,从上面实验可知,D烧瓶内混合气体颜色将变深变深(填“变浅”、“变深”或“不变”);
(3)若实验测得B烧杯中酸碱中和反应放热1.4325kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O△H=-57.3kJ/molNaOH(aq)+HCl(aq)=NaCl(aq)+H2O△H=-57.3kJ/mol;
(4)若起始时在D烧瓶中充入m g N2O4,此时测得烧瓶中压强为1.01×105Pa,当可逆反应:N2O4(g)⇌2NO2(g)达到化学平衡状态时压强变为1.515×105Pa(保持温度不变),则平衡时,N2O4的转化率α=50%50%. 玉面达魔1年前1
玉面达魔1年前1 -
 仁者无敌之飞歌 共回答了17个问题
仁者无敌之飞歌 共回答了17个问题 |采纳率94.1%(1)硝酸铵溶解时吸收热量导致溶液温度降低,故答案为:降低;
(2)加入氢氧化钠会和盐酸之间发生中和反应时放出热量,导致溶液的温度升高,反应2NO2(g)⇌N2O4(g)是放热反应,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,故答案为:变深;
(3)n(HCl)=0.50mol/L×0.05L=0.025mol,n(NaOH)=
2g
40g/mol=0.05mol,0.025molHCl与0.05molNaOH反应,生成0.025mol水时放热1.4325KJ,则生成1mol水时放热57.3KJ,所以热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(2)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O△H=-57.3kJ/mol;
(4)体积不变的容器中,气体的压强之比等于物质的量之比,设反应后的四氧化二氮有nmol,则生成的二氧化氮又2nmol,有
mg
92g/mol
nmol+2nmol=
1.01×105Pa
1.515×105Pa,
解得n=
m
184mol,所以α(N2O4)=
m
184mol
m
96mol×100%=50%,
故答案为:50%.1年前查看全部
- 浓度为0.50mol/L的某+n价的金属阳离子M的溶液10ml与0.4mol/L的NAOH溶液12.5ml完全反应,生成
浓度为0.50mol/L的某+n价的金属阳离子M的溶液10ml与0.4mol/L的NAOH溶液12.5ml完全反应,生成沉淀,则n等于?
急 aili10001年前1
aili10001年前1 -
 nokla12 共回答了29个问题
nokla12 共回答了29个问题 |采纳率96.6%氢氧根的量:(12.5/1000)*0.4=0.005mol
阳离子的量:(10/1000)*0.5=0.005mol
比例为1/1,所以n=11年前查看全部
- 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出来的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中缺少的一种玻璃用品是______.
(2)烧杯间填满碎纸条的作用是______.
(3)大烧杯上如不盖硬纸板,求得的中和热数值______(填“偏大”、“偏小”或“无影响”)
(4)实验中改用60mL0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量______,(填“相等”或“不相等”).
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______;用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会______.(均填“偏大”、“偏小”或“无影响”) 林零四1年前2
林零四1年前2 -
 蓝天绿草2008 共回答了23个问题
蓝天绿草2008 共回答了23个问题 |采纳率91.3%解题思路:(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析;根据中和热的概念分析.(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌棒;(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:防止热量损失,故答案为:减少实验过程中的热...
点评:
本题考点: 中和热的测定.
考点点评: 本题考查学生有关中和热的测定知识,注意中和热与酸、碱的物质的量无关,可难度不大.1年前查看全部
- (1)50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所
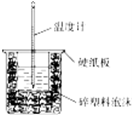 (1)50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是______.
②大烧杯上如不盖硬纸板,求得的中和热数值将______ (填“偏大”“偏小”或“无影响”).
(2)酸碱中和滴定是中学化学常见实验.
某学校化学课外小组用0.2000mol•L-1盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题.
①滴定过程中,眼睛应注视______.
②在铁架台上垫一张白纸,其目的是______.
③根据下表数据,计算被测烧碱溶液的物质的量浓度是______mol•L-1.(保留四位有效数字)
④下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?滴定次数 待测溶液体积(mL) 标准酸体积 滴定前的刻度(mL) 滴定后的刻度(mL) 第一次 10.00 0.40 20.50 第二次 10.00 4.10 24.00
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果______.
b.若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果______. 忧郁KU蓝1年前1
忧郁KU蓝1年前1 -
 th5411145 共回答了18个问题
th5411145 共回答了18个问题 |采纳率94.4%解题思路:(1)根据量热计的构造来判断该装置的缺少仪器;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失;
(3)①滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化;
②在盛放待测溶液的锥形瓶下方放一张白纸的作用是观察锥形瓶中溶液颜色的变化明显,减少实验误差;
③先分析所耗盐酸标准液的体积的有效性,然后求出所耗盐酸标准液的体积平均值,然后根据c(待测)=
计算;c(标准)×V(标准) V(待测)
④根据C(待测)═
分析误差.C(标准)×V(标准) V(待测) (1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌器;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(3)①滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化,故答案为:锥形瓶内溶液颜色的变化;
②为了便于观察锥形瓶中溶液颜色的变化,减少实验误差,在盛放待测溶液的锥形瓶下方放一张白纸,
故答案为:便于观察锥形瓶内液体颜色的变化,减小滴定误差;
③所耗盐酸标准液的体积分别为:20.1mL,19.9mL两组数据均有效,盐酸标准液的平均体积为20.00mL;c(待测)=
c(标准)×V(标准)
V(待测)=[0.2000mol•L−1×20.00mL/10.00mL]=0.4000 mol•L-1,
故答案为:0.4000 mol•L-1;
④a.观察酸式滴定管液面时,开始俯视,滴定终点平视,造成V(标准)偏大,根据C(待测)═
C(标准)×V(标准)
V(待测)分析,可知C(待测)偏高,故答案为:偏高;
b.若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,待测液的物质的量偏大,造成V(标准)偏大,根据C(待测)═
C(标准)×V(标准)
V(待测)分析,可知C(待测)偏高,
故答案为:偏高.点评:
本题考点: 中和热的测定;中和滴定.
考点点评: 本题主要考查了酸碱中和滴定的操作以及有关的化学计算,难度中等,掌握中和滴定的原理是解题的关键.1年前查看全部
- 分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的
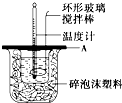 分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(1)理论上稀强酸、稀强碱反应生成1mol 水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/molNaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是______;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)______.
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=______.实验
序号起始温度t1/℃ 终止温度t2/℃ 盐酸 氢氧化钠 混合溶液 1 20.0 20.1 23.2 2 20.2 20.4 23.4 3 20.5 20.6 23.6  怀孕的珞二爷1年前1
怀孕的珞二爷1年前1 -
 szjeffly 共回答了27个问题
szjeffly 共回答了27个问题 |采纳率92.6%解题思路:(1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)根据测定中和热过程中必须尽量减少热量的散失分析;
(3)根据中和热计算公式Q=cm△T中涉及的未知数据进行判断;
(4)先根据表中测定数据计算出混合液反应前后的平均温度差,再根据Q=cm△T计算出反应放出的热量,最后计算出中和热.(1)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:NaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol,
故答案为:NaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,若两个小孔开得过大,会导致散失较多的热量,影响测定结果,
故答案为:减少热量散失;
(3)由Q=cm△T可知,测定中和热需要测定的数据为:A.反应前盐酸溶液的温度、B.反应前盐酸溶液的质量和E.反应后混合溶液的最高温度,
故选ACE;
(4)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,反应前后温度差为:3.15℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应前后温度差为:3.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应前后温度差为:3.05℃;
40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液的质量和为m=80mL×1g/cm3=80g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g•℃)×80g×[3.15℃+3.1℃+3.05/3]=1.036kJ,即生成0.02mol的水放出热量为:1.036kJ,所以生成1mol的水放出热量为:1.036kJ×[1mol/0.02mol]=-51.8kJ/mol,即该实验测得的中和热△H=-51.8kJ/mol,
故答案为:-51.8kJ/mol.点评:
本题考点: 中和热的测定.
考点点评: 本题考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热测定原理以及测定反应热的误差等问题,试题有利于培养学生灵活应用所学知识的能力.1年前查看全部
- 等效平衡,达平衡后移走1.0mol PC13和0.50mol C12,重新到达的平衡,可
等效平衡,达平衡后移走1.0mol PC13和0.50mol C12,重新到达的平衡,可
等效平衡,达平衡后移走1.0mol PC13和0.50mol C12,重新到达的平衡,可以等效为开始加入1.0mol PC13和0.50mol C12到达的平衡,为什么可以这么等效?

 fox8209031年前1
fox8209031年前1 -
 xuming8151023 共回答了16个问题
xuming8151023 共回答了16个问题 |采纳率93.8%选择C
移走前,开始情况2molPCl3与1molCl2, 转化为0.4mol PCl5
移走后,开始情况:1molPCl3与0.5molCl2,
两者的比为2:1,若压强不变,移走后转化为0.2molPCl5.实际上体积不变,相当于移走后1molPCl3与0.5molCl2的压强降低,转化会低于0.2mol.1年前查看全部
- 0.50mol的硫酸钠中含有6.02×10的23次方个离子
0.50mol的硫酸钠中含有6.02×10的23次方个离子
为什么错 娃哈哈6t1年前1
娃哈哈6t1年前1 -
 波光潋滟晴方好 共回答了18个问题
波光潋滟晴方好 共回答了18个问题 |采纳率100%0.5mol的Na2SO4,有1.5mol个离子1年前查看全部
- 分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算
 分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/molNaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是______;反应需要测量温度,每次测量温度后都必须采取的操作是______.
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃),为了计算中和热,实验时还需测量的数据有______(填序号);
A.反应前盐酸溶液的温度B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=______;实验序号 起始温度t1/℃ 终止温度t2/℃ 盐酸 氢氧化钠 混合溶液 1 20.0 20.1 23.2 2 20.2 20.4 23.4 3 20.5 20.6 23.6
(5)假定该学生的操作完全同上,实验中改用100mL 0.5mol/L盐酸跟100mL 0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热______(填“相等”或“不相等”). 跳猫猫1年前1
跳猫猫1年前1 -
 小妖精yz 共回答了22个问题
小妖精yz 共回答了22个问题 |采纳率86.4%解题思路:(1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)根据测定中和热过程中必须尽量减少热量的散失分析;中和反应是放热反应;
(3)根据中和热计算公式Q=cm△T中涉及的未知数据进行判断;
(4)先根据表中测定数据计算出混合液反应前后的平均温度差,再根据Q=cm△T计算出反应放出的热量,最后计算出中和热;
(5)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.(1)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:NaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol,
故答案为:NaOH(aq)+[1/2]H2SO4(aq)═[1/2]Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,若两个小孔开得过大,会导致散失较多的热量,影响测定结果;
中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,温度差偏低,但使测得的中和热偏高,所以每次测量后用水将温度计上的液体冲掉,并擦干温度计;
故答案为:减少热量散失;用水将温度计上的液体冲掉,并擦干温度计;
(3)由Q=cm△T可知,测定中和热需要测定的数据为:A.反应前盐酸溶液的温度、B.反应前盐酸溶液的质量和E.反应后混合溶液的最高温度,
故选ACE;
(4)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,反应前后温度差为:3.15℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应前后温度差为:3.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应前后温度差为:3.05℃;
40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液的质量和为m=80mL×1g/cm3=80g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g•℃)×80g×[3.15℃+3.1℃+3.05℃/3]=1.036kJ,即生成0.02mol的水放出热量为:1.036kJ,所以生成1mol的水放出热量为:1.036kJ×[1mol/0.02mol]=-51.8kJ/mol,即该实验测得的中和热△H=-51.8kJ/mol,
故答案为:-51.8kJ/mol;
(5)反应放出的热量和所用酸以及碱的量的多少有关,若用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增加,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成nmol水时放出的热,与酸碱的用量无关,所以用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行上述实验,测得中和热数值相等;
故答案为:不相等;相等.点评:
本题考点: 中和热的测定.
考点点评: 本题考查了中和热的测定的原理和操作,题目难度中等,在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.注意理解中和热测定原理以及测定反应热的误差等问题,试题有利于培养学生灵活应用所学知识的能力.1年前查看全部
- 在量热计中将100ml 0.55mol/L的CH3COOH溶液与100ml 0.50mol/L的NaOH溶液混合,温度从
在量热计中将100ml 0.55mol/L的CH3COOH溶液与100ml 0.50mol/L的NaOH溶液混合,温度从298.0K升高到300.7K.已知量热计的热熔常数是150.5J/K,溶液密度为1克/毫升,生成溶液的比热容C=4.184J/(gK)
求CH3COOH的中和热?
答案为-53.3kJ/mol.
Q = cmΔt + 150.5Δt = 2665.71 J
为什么要+150.5Δt . impulsion1年前2
impulsion1年前2 -
 断刀流水1132 共回答了17个问题
断刀流水1132 共回答了17个问题 |采纳率94.1%150.5Δt是表示量热计在这个反应过程中吸收的热量,也包含在整个中和反应释放的热量中,所以要加上这部分.1年前查看全部
- 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g.
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有______、______.
Ⅱ.测定中和热的实验装置如图所示.
(3)大小烧杯之间填满碎泡沫塑料的作用是______,从实验装置上看,图中缺少的一种玻璃仪器______.
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如表.
①请填写下表中的空白:实验
次数起始温度t1/℃
终止温度
t2/℃温度差平均值(t2-t1)/℃
H2SO4 NaOH 平均值 1 26.2 26.0 26.1 29.5
______℃2 27.0 27.4 27.2 33.3 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8
②通过计算可得中和热△H=______(精确到小数点后一位)
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是______.(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol•L-1H2SO4溶液跟50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量______ (填“相等”、“不相等”),所求中和热______(填“相等”、“不相等”);,若用50mL0.50mol•L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会______(填“偏大”、“偏小”、“不受影响”). 拖驳1年前1
拖驳1年前1 -
 清清快乐 共回答了16个问题
清清快乐 共回答了16个问题 |采纳率93.8%解题思路:Ⅰ.(1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;(2)需要用到的玻璃仪器有烧杯、容量瓶、胶头滴管和玻璃棒;Ⅱ.(3)中和热测定实验成败的关键是保温工作;根据量热计的构造来判断该装置的缺少仪器;(4)①先判断温度差的有效性,然后求出温度差平均值;②根据公式Q=△H=△Tcm来计算反应的焓变;③a.装置保温、隔热效果差,测得的热量偏小;b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高;(5)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.Ⅰ.(1)容量瓶没有245mL规格的,只能用250mL规格的,需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g,故答案为:5.0;
(2)配制0.50mol/L NaOH溶液需要用到的玻璃仪器有烧杯、250mL容量瓶、胶头滴管和玻璃棒,故答案为:250mL容量瓶;胶头滴管;
Ⅱ.(3)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失;由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:减少实验过程中的热量损失;环形玻璃搅拌棒;
(4)①4次温度差分别为:3.4℃,6.1℃,3.3℃,3.5℃,第二组数据舍去,三次温度差平均值=[3.4℃+3.3℃+3.5℃/3]=3.4℃,故答案为:3.4;
②Q=△H=-△Tcm=-3.4°C×4.18J/(g•℃)×100g═1421.2J=1.42KJ/mol,△H=-[Q/N](H2O)=-56.8KJ/mol,故答案为:-56.8kJ•mol-1;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
b.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;
b.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确,
故答案为:acd;
(5)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol•L-1H2SO4溶液跟50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;又醋酸是弱酸,电离过程吸热,所以用50mL0.50mol•L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会减小,
故答案为:不相等;相等;偏小.点评:
本题考点: 中和热的测定.
考点点评: 本题考查热中和热概念、测定原理及反应热的计算,题目难度大,注意理解中和热的概念以及测定反应热的误差等问题.1年前查看全部
- 溶液混合计算的化学问题欲将0.10mol/L放入NaOH溶液和0.50mol/L的NaOH混合成0.20mol/L的Na
溶液混合计算的化学问题
欲将0.10mol/L放入NaOH溶液和0.50mol/L的NaOH混合成0.20mol/L的NaOH溶液.求两溶液的体积比(忽略混合时体积变化)
欲将0.10mol/L的NaOH溶液 san6100421年前4
san6100421年前4 -
 因为_爱_而qq 共回答了15个问题
因为_爱_而qq 共回答了15个问题 |采纳率93.3%设体积分别是X、Y
那么有:
(0.1X+0.5Y)/(X+Y)=0.2
X:Y=3:11年前查看全部
- (12分)实验室用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液进行反应,通过测定反应过程中
(12分)实验室用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液进行反应,通过测定反应过程中的放热来计算中和热。试回答下列问题:
(1)在本实验中除了用到大烧杯、小烧杯、温度计、量筒等仪器外,还须的一种玻璃仪器名为 。
(2)两只烧杯间要填满碎纸条,其目的是 ;
(3)大烧杯上必须盖上硬纸板,否则,求得的中和热数值将 (填“偏大”、“偏小”、“无影响”)。
(4)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm 3 ,生成溶液的比热容C=4.18J/(g·℃),实验起始温度为t 1 ℃,终止温度为t 2 ℃。试推断中和热的计算式:△H= 。
(5)实验中改用52mL 0.50mol/L的盐酸与50mL 0.55mol/L的烧碱溶液反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”)简述理由
(6)用相同浓度和体积的氨水代替烧碱溶液进行上述实验,测得的中和热的数值会 ;若改用50mL 0.50mol/L烧碱溶液进行上述实验,测得的中和热的数值会 。(填“偏大”、“偏小”、“无影响”) PPTC1年前1
PPTC1年前1 -
 pigflowers 共回答了18个问题
pigflowers 共回答了18个问题 |采纳率83.3%(1)环形玻璃拌棒(1分)
(2)保温隔热,或少热量损失(2分)
(3)偏小(1分)
(4)=—16.72(t 2 —t 1 )kJ/mol(2分)
(5)不相等(1分)相等(1分)中和热量指稀溶液中酸与碱反应生成1mol水放出的热量与酸碱用量无关。(2分)
(6)偏小(1分)偏小(1分)
略1年前查看全部
- 实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图
 实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
试回答下列问题:实验次数 起始温度t1/℃ 终止温度t2/℃ 盐酸 NaOH溶液 1 20.2 20.3 23.7 2 20.3 20.5 23.8 3 21.5 21.6 24.9
(1)实验时用环形玻璃棒搅拌溶液的方法是______,不能用铜丝搅拌棒代替环形玻璃棒的理由是______.
(2)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=______[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混,合溶液的比热容(c)按4.18J/(g•℃)计算].
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1,则△H1与△H的关系为:△H1______△H(填“<”、“>”或“=”),理由是______. hcty371年前1
hcty371年前1 -
 wang3232 共回答了16个问题
wang3232 共回答了16个问题 |采纳率100%解题思路:(1)环形玻璃搅拌棒上下搅动使溶液充分反应;金属导热快,热量损失多;
(2)根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出反应热;
(3)根据弱电解质电离吸热分析.(1)环形玻璃搅拌棒上下搅动使溶液充分反应;不能将环形玻璃搅拌棒改为铜丝搅拌棒,因为铜丝搅拌棒是热的良导体,
故答案为:上下搅动;铜传热快,防止热量损失;
(2)50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH的质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),t2-t1=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为[1.4212KJ×1mol/0.025mol]=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
(3)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于56.8kJ,所以△H1>△H,
故答案为:>;NH3•H2O电离吸热.点评:
本题考点: 中和热的测定.
考点点评: 本题考查中和热的测定,题目难度不大,注意热量计算公式的应用中c=4.18J/(g•℃),要注意热量单位的换算.1年前查看全部
- 实验中改用60ml0.50mol*L-1的盐酸与60mL0.50mol*L-1NaOH溶液进行反应
实验中改用60ml0.50mol*L-1的盐酸与60mL0.50mol*L-1NaOH溶液进行反应
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
实验中该用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”).
求放热不相等而中和热相等的原因 prack1年前1
prack1年前1 -
 famouswolf 共回答了10个问题
famouswolf 共回答了10个问题 |采纳率100%由于生成水的质量不同,所以放出的热量不同.中和热都是生成1摩尔水所放出的热量,所以换算成1摩尔水时,放出热量的数值就是相等的,即中和热是相等的.1年前查看全部
- 碘在科研与生活中有重要应用。某兴趣小组用0.50mol/LKI、0.2%淀粉溶液、0.20mol/L
碘在科研与生活中有重要应用。某兴趣小组用0.50mol/LKI、0.2%淀粉溶液、0.20mol/L
K 2 S 2 O 8 、0.10mol/LNa 2 S 2 O 3 等试剂,探究反应条件对化学反应速率的影响。已知:
(1)向KI、Na 2 S 2 O 3 与淀粉的混合溶液中加入一定量的K 2 S 2 O 8 溶液,当溶液中的__________耗尽后,溶液颜色将由无色变成为蓝色。为确保能观察到蓝色,S 2 O 3 2- 与S 2 O 8 2- 初始的物质的量需满足的关系为:n(S 2 O 3 2- ):n(S 2 O 8 2- )_______。
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表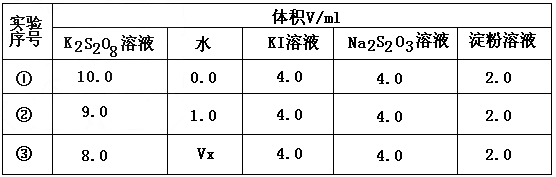
表中Vx=____mL,理由是___________________。
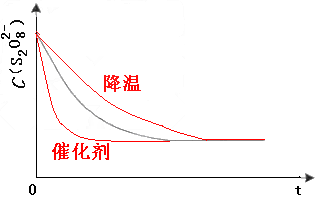
(3) 已知某条件下,浓度c(S 2 O 8 2- )~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S 2 O 8 2- )~t的变化曲线示意图(进行相应的标注)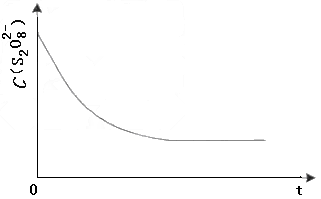
(4) 碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I 2 (s)=2LiI(s)△H
已知:4Li(s)+O 2 (g)=2Li 2 O(s)△H1
4LiI(s)+O 2 (g)=2I 2 (s)+2Li 2 O(s)△H2
则电池反应的△H=_______________;碘电极作为该电池的___________极。 klerman1年前1
klerman1年前1 -
 nnfmx 共回答了20个问题
nnfmx 共回答了20个问题 |采纳率90%1年前查看全部
- 在100ml,0.50mol/L H2SO4溶液中投入锌粒,锌完全反应后,还须用40ml,0.50mol/LNaOH溶液
在100ml,0.50mol/L H2SO4溶液中投入锌粒,锌完全反应后,还须用40ml,0.50mol/LNaOH溶液才能完全中和,求锌粒的质量.
 jonyzhang1年前1
jonyzhang1年前1 -
 zf1234 共回答了20个问题
zf1234 共回答了20个问题 |采纳率80%H2SO4+Zn=ZnSO4+H2
2NaOH+H2SO4 = Na2SO4+2H2O
被Zn用掉的量是总量减去NaOH中和的量
(100/1000)L * 0.5MOL/L-(40/1000)*0.5/2=0.04MOL
所以锌的量为 0.04*65=2.6g1年前查看全部
- 高一化学关于摩尔的几个小题1 含有6.02乘以10的23次方个O的H2SO4的物质的量是A 1mol B 0.50mol
高一化学关于摩尔的几个小题
1 含有6.02乘以10的23次方个O的H2SO4的物质的量是
A 1mol B 0.50mol C 0.25mol D0.125mol
2 含有3.01乘以10的24次方个 硫酸根离子 的 Al2(SO4)3与_____g NA2SO4中的 硫酸根离子 的数目相等
3 NH4Cl KCl K2SO4在溶液中能完全产生阳离子和阴离子.在无土栽培中,需配置一定量的含50mol 氨根离子、66mol 氯离子、24mol硫酸根离子、64mol钾离子的营养液 若用NH4Cl KCl K2SO4配置 则三种物质的物质的量依次为____mol ___mol ____mol
4 等质量的下列物质中 含分子数最少的是 A H2O B CO2 C NH3 D HCL
5同温同压下 1mol O2 和1mol N2 具有
A相同的质量 相同的体积
B相同的体积 相同的分子数
C不同的体积 相同的分子数
D相同的体积 相同的分子数 相同的质量
5 5g 含Mg Zn Fe 三种金属的的混合物跟足量稀盐酸反应 生成2、8L氢气(标准状况) 则这三种金属的总物质的量是
A 0.5 mol B 0.25mol C 0.125 mol D 0.1 mol
麻烦各位 帮忙写一下解题过程 我在这谢谢了…………
 dd九宇1年前1
dd九宇1年前1 -
 混不上一贴 共回答了21个问题
混不上一贴 共回答了21个问题 |采纳率95.2%1.6.02乘以10的23次方个O为1molO,n(H2SO4):n(O)=1:4.所以选C.
2.含有3.01乘以10的24次方个 硫酸根离子,即5molSO4,m( NA2SO4)=5/3*(46+96)=236.7
3.50 16 24
4.D
5.C(Zn):(H2)=2:1 (Mg):(H2)=2:1 (Fe):(H2)=2:11年前查看全部
- 50ml 0.50mol/l盐酸的质量是多少?要计算过程.
50ml 0.50mol/l盐酸的质量是多少?要计算过程.
求的盐酸的质量是纯净物吗? 刀下1年前3
刀下1年前3 -
 suki520001 共回答了25个问题
suki520001 共回答了25个问题 |采纳率96%50ml=0.05L
盐酸mol质量为Hcl=1+35.5=36.5g/mol
盐酸质量=0.05L*0.5mol/L*36.5g/mol
结果自己算1年前查看全部
- 在一定条件下,钠与O2反应生成1.5g固体,若将相同质量的钠与80ml0.50mol/L的盐酸反应钠恰好转化生成NACl
在一定条件下,钠与O2反应生成1.5g固体,若将相同质量的钠与80ml0.50mol/L的盐酸反应钠恰好转化生成NACl,则
1.5g固体的成份是 啊睿1年前2
啊睿1年前2 -
 xianboni 共回答了26个问题
xianboni 共回答了26个问题 |采纳率88.5%2Na+2HCl=2NaCl+H2↑
n(Na)=n(HCl)=0.08×0.5=0.04mol
m(NA)=0.04×23=0.92g
因为钠与氧气只有两种反应
2Na+O2=Na2O2
4Na+O2=2Na2O
由钠的质量代入得
Na2O2为1.34g
Na2O为1.56g
所以是Na2O1年前查看全部
- 某100ml溶液中含有硫酸0.50mol,加入什么物质溶液导电性增强
 czy091年前1
czy091年前1 -
 lousn 共回答了24个问题
lousn 共回答了24个问题 |采纳率87.5%加入固体硫酸钠等不与硫酸反应的物质或者浓硫酸1年前查看全部
- 求计算0.20mol/LNa2CO3溶液和0.50mol/LNaHCO3溶液的pH值的过程
 郑州帅哥1年前1
郑州帅哥1年前1 -
 wangyuxuan2006 共回答了14个问题
wangyuxuan2006 共回答了14个问题 |采纳率100%1、0.20mol/LNa2CO3溶液的pH值:按一元弱碱计算:
pOH=1/2(pKb1-log0.20)=1/2(3.75+0.70)=2.23,pH=11.77
2、0.50mol/LNaHCO3溶液的pH:两性物质计算:
pH=1/2(pKa1+pKa2)=1/2(6.38﹢10.25)=8.315=8.321年前查看全部
- 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、______以及等质量的两片滤纸.
(2)计算.配制该溶液需取NaCl晶体______g.
(3)称量.
①称量过程中NaCl晶体应放于天平的______(填“左盘”或“右盘”).
②称量完毕,将药品倒入烧杯中.
(4)溶解、冷却.
(5)转移、洗涤.需要洗涤烧杯2~3次是为了______.
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度.
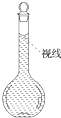
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“偏高”、“偏低”或“无影响”). lllds371年前1
lllds371年前1 -
 Hungry123 共回答了14个问题
Hungry123 共回答了14个问题 |采纳率100%解题思路:(1)依据配制一定物质的量浓度溶液的一般步骤选择合适的仪器;
(2)要配制480mL溶液应选择500ml容量瓶,依据m=CVM计算需要氯化钠的质量;
(3)用托盘天平称量物质时遵循“左物右码”原则;
(5)依据配制溶液的原理,将称取的溶质全部转移到容量瓶;
(8)根据c=[n/V]分析错误操作对溶质的物质的量和溶液的体积的影响.(1)配制一定物质的量浓度溶液的一般步骤,用到的仪器有:托盘天平(精确到0.1g)、药匙、等质量的两片滤纸、烧杯、玻璃棒、500ml容量瓶、胶头滴管;
故答案为:500ml容量瓶、胶头滴管;
(2)要配制0.50mol/L NaCl溶液500mL,需要氢氧化钠的质量m=0.5L×0.50mol/L×40g/mol=10.0g;
故答案为:10.0;
(3)用托盘天平称量物质时遵循“左物右码”原则,氯化钠应放在左盘;
故答案为:左;
(5)依据配制溶液的原理,将称取的溶质全部转移到容量瓶,而烧杯和玻璃棒上沾有溶质,所以应进行洗涤操作;
故答案为:保证溶质全部转移入容量瓶中;
(8)在配制过程中,仰视观察定容时液面,导致溶液的体积偏大,溶液的浓度偏低,
故答案为:偏低.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了配制一定物质的量浓度的溶液的方法,题目难度不大,试题基础性强,注意掌握配制一定物质的量难度的溶液方法.1年前查看全部
大家在问
- 1三原子的化合物的杂化类型如何判断,例如次氯酸和氯酸钾,有没有简单的判断方法,就像双原子的化合物ABm那
- 2Hetold me how to go to Beijing how后面的to是不是固定的 go后面的to是不是因为go
- 3ansys中通过体粘结生成的整体和直接生成的体有什么区别吗
- 4多么辽阔无垠的西北高原啊!(改为陈述句)
- 5语文难题...快来人啊!反复品读,用地一人称"我"来写石灰,把这首诗改写成一段现代文.
- 6西班牙语Me importas mucho的语法问题
- 7帮我写一篇自我介绍的英语作文…爱好打球,唱歌,跳舞,爬山…理想是当一名优秀的模具设计师
- 8英语翻译University of Konstanz,Department of Economics,Box D 145
- 9带牛的四字词语
- 10西班牙语no necesitonadal翻译成中文是什么意思,
- 11BF平行于正方形ADCD的对角线AC,点E在BF上,且AE=AC,CF‖AE,求∠BCF.
- 12设平面区域D是由直线x=0,y=0,x+y=1,x+y=2围成,比较∫∫(x+y)^5dσ与,∫∫(x+y)^6dσ的大
- 13黑名单【1/1】 用英文表达,谢
- 14与OH阴离子含有相同电子数及质子数的单核微粒的电子式是?
- 15在四边形ABCD中,∠B=∠D=90°,且AB=CD,四边形ABCD是矩形吗?为什么?